Clinica e diagnostica del carcinoma midollare
Simona Censi
UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
CLINICA
La sintomatologia dovuta a ipersecrezione ormonale è eminentemente rappresentata da:
- diarrea (ipersecretoria e/o da aumentata motilità gastro-enterica), solitamente presente nei pazienti con livelli molto elevati di calcitonina (CT), malattia avanzata, e/o con metastasi epatiche; può essere particolarmente debilitante sia per la qualità della vita, sia per le alterazioni nutrizionali;
- flushing: si può manifestare in pazienti con malattia avanzata;
- sindrome di Cushing (condizione che peggiora la prognosi): il carcinoma midollare (MTC) rappresenta il 2-6% dei casi di sindrome di Cushing ectopico (1) e i pazienti con la sindrome in genere hanno metastasi epatiche massive.
Un interessamento del compartimento linfonodale centrale e latero-cervicale è presente, rispettivamente, nel 14% e 11% dei pazienti con tumori T1 (≤ 2 cm di dimensione maggiore e limitati alla tiroide) e nell’86% e 93% dei tumori T4 (T4a: tumore di qualsiasi dimensione, che si estenda oltre la capsula a invadere tessuto sottocutaneo, laringe, trachea, esofago e nervo laringeo ricorrente; T4b: tumore che invada la fascia pre-vertebrale, carotide o vasi mediastinici) (10-11). Il 70% dei pazienti con MTC diagnosticato per nodo palpabile presenta metastasi cervicali e il 10% metastasi a distanza (12). All’analisi univariata i fattori prognostici negativi risultano l’età, il sesso maschile, la presenza di interessamento linfonodale e le metastasi a distanza, ma all’analisi multivariata solo l’età e lo stadio alla diagnosi risultano fattori prognostici indipendenti.
La tabella 1 riporta la classificazione prognostica secondo la 8° Edizione della stadiazione AJCC.
| Classificazione prognostica AJCC del carcinoma midollare della tiroide | |
| Stadio | Parametri TNM |
| I | T1, N0, M0 |
| II | T2, N0, M0 T3, N0, M0 |
| III | T1, N1a, M0 T2, N1a, M0 T3, N1a, M0 |
| IV | T4, qualunque N, M0 T1-3, N1b, M0 qualunque T, N1a, M1 qualunque T, N1b, M1 |
La sopravvivenza a dieci anni per i pazienti in stadio I-II-III-IV risulta, rispettivamente, del 100%, 93%, 71% e 21% (5).
Rispetto ai criteri prognostici classici bisogna specificare che, in linea con altri tumori di origine neuro-endocrina, nel 2002 la WHO ha introdotto nella classificazione diagnostica e prognostica dell’MTC anche il grading dell’International Medullary Thyroid Carcinoma Grading System (IMTCGS), che prevede la suddivisione in due categorie: basso e alto grado. L’IMTCGS considera ad alto grado quegli MTC che presentino almeno una delle seguenti caratteristiche: necrosi tumorale, conta mitotica ≥ 5 per 2 mm2 e/o indice di proliferazione Ki67 ≥ 5% (6). È stato dimostrato come il grading sia associato indipendentemente all’esito, sia come sopravvivenza libera da malattia che come sopravvivenza malattia-specifica.
Nelle forme familiari sono presenti metastasi linfonodali nel 20-30% dei pazienti con MTC tra 1 e 4 cm; se la lesione è palpabile, la metastatizzazione alla catena linfonodale latero-cervicale contro-laterale raggiunge il 40%.
Anche nelle MEN 2 la maggiore mortalità è legata alle forme con metastasi a distanza, pertanto sono essenziali diagnosi precoce e trattamento chirurgico adeguato: nelle casistiche più vecchie relative a MEN 2A, nelle quali il MTC veniva diagnosticato già in fase clinica, la mortalità raggiungeva il 15-20%, mentre la possibilità attuale di identificare i portatori di mutazione germinale RET, con conseguente terapia chirurgica profilattica, o comunque precoce, ha ridotto la mortalità MTC-correlata a un valore < 5%.
Nelle MEN 2 il MTC è solitamente la prima manifestazione clinica, quindi tutti i pazienti con MTC devono essere valutati, oltre che per la stadiazione pre-operatoria della neoplasia tiroidea (calcitonina, CEA, diagnostica per immagini), anche con la determinazione di metanefrine frazionate plasmatiche e/o catecolamine e metanefrine su urine delle 24 ore (per lo screening del feocromocitoma), di calcio, fosforo e PTH (per lo screening dell’iperparatiroidismo). In caso di diagnosi positiva per feocromocitoma, il trattamento chirurgico del feocromocitoma deve precedere quello del MTC.
Tutti i pazienti con diagnosi di MTC devono essere sottoposti a screening per mutazione del proto-oncogene RET, anche in assenza di dati clinici e/o anamnestici di MEN-2: ciò permette di individuare forme familiari nel 4-8% dei tumori apparentemente sporadici.
DIAGNOSI
La diagnosi tempestiva rimane l’arma più preziosa per garantire la radicalità chirurgica e la guarigione. Molto spesso l’MTC sfugge all’identificazione ecografica, essendo non di rado privo di caratteristiche di sospetto secondo i più comuni schemi di classificazione ecografica del rischio. Anche la diagnosi citologica è spesso complessa e solo circa un MTC su due viene individuato in corso di esame citologico da agoaspirato tiroideo (7-9).
La calcitonina: punti di forza e limiti
La CT è un ormone polipeptidico secreto dalle cellule C della tiroide e rappresenta un marcatore molto sensibile di MTC. Vari studi hanno dimostrato come l’introduzione della misura routinaria della CT plasmatica abbia permesso di ottenere uno spostamento verso stadi più bassi nelle diagnosi di MTC, con conseguente miglioramento della prognosi (10). È stata comprovata la costo-efficacia della misurazione della CT nei pazienti con noduli della tiroide, ritenuta quasi paragonabile a quella dello screening mammografico per il carcinoma della mammella (11). Ciononostante, le attuali linee guida (LG) non prevedono la misurazione della CT plasmatica come screening dell’MTC in presenza di un nodo tiroideo. Le LG europee, così come quelle americane e le AACE/ACE/AME, non si pongono né pro né contro, e ne ritengono sicuramente opportuna la misura limitatamente a situazioni particolari (12-14). Secondo le ultime LG europee (14), la misurazione della CT nell’ambito della patologia nodulare tiroidea risulta sicuramente opportuna nel caso di:
- pazienti candidati alla chirurgia o a procedure minimamente invasive;
- nodo con citologia indeterminata o con caratteri ecografici di sospetto;
- pazienti con familiarità per MTC o MEN 2.
Questa posizione trova spiegazione nella combinazione tra la bassa prevalenza di MTC nel nodo tiroideo e l’assenza di cut-off di CT condivisi per la diagnosi di MTC, fattori che combinati alla bassa specificità della CT rendono solo del 7.7% il valore predittivo positivo (VPP) di un valore di CT > 10 pg/mL. Secondo una revisione sistematica Cochrane (15), considerando una prevalenza media dell’MTC di circa 0.23%, in una popolazione di 100mila noduli tiroidei, 23 soggetti saranno portatori di MTC. Usando un cut-off pari a 10 pg/mL, nessuno di questi sfuggirà alla diagnosi, ma ben 280 soggetti risulteranno falsi positivi. Questo accade perché l’aumento della CT non è dovuto solo all’MTC, ma anche a farmaci, fumo, alcolici e altre patologie tiroidee o extra-tiroidee (tabella 2).
| Tabella 2 Cause di incremento della CT |
||
| Patologie delle cellule C della tiroide | MTC o iperplasia a cellule C della tiroide, in presenza di mutazione germinale dell’oncogene RET | |
| In assenza di patologia a cellule C della tiroide | Condizioni fisiologiche | Sesso, età |
| Farmaci* | Inibitori di pompa protonica, glucocorticoidi, ß-bloccanti, glucagone | |
| Patologie non tiroidee | Ipercalcemia*, insufficienza renale**, Tumori neuroendocrini***, ipergastrinemia acuta (cronica?)* | |
| Patologie tiroidee | Carcinomi tiroidei (FTC, PTC), tiroiditi autoimmuni (?)* | |
| Interferenze | Anticorpi eterofili, macro-calcitonina | |
| Altro | Fumo di sigaretta, ingestione acuta di alcool* | |
| *da iperplasia delle cellule C non RET-legata **da accumulo ***da produzione paraneoplastica ectopica |
||
La CT presenta, inoltre, alcuni limiti analitici: sebbene i più recenti metodi di laboratorio (two site, two-steps) siano più specifici (mentre i precedenti interagivano anche con i precursori), i metodi impiegati risentono ancora di interferenze di laboratorio, specialmente da anticorpi eterofili e, come recentemente descritto, da macro-calcitonina. Inoltre, la CT ha un’emivita concentrazione-dipendente ed è rapidamente degradata a temperatura ambiente (dopo il prelievo, infatti, deve essere conservata in ghiaccio). Infine, in commercio esistono numerosi kit diversi, ognuno impiegante un diverso tipo di anticorpo e con un diverso cut-off di normalità, rendendo difficile un confronto tra CT rilevate in diversi laboratori. È raccomandabile, quindi, eseguire il follow-up biochimico di un paziente sempre in un unico laboratorio.
Ipercalcitoninemia: cosa fare
È raccomandabile innanzitutto escludere cause secondarie e interferenze di laboratorio. Anche i livelli stessi di CT basale forniscono importanti informazioni sul grado di sospetto di MTC: valori > 100 pg/mL sono altamente suggestivi di MTC, mentre valori moderatamente elevati hanno basso VPP e richiedono ulteriori accertamenti con un test di stimolo con calcio gluconato (7). Un recente studio multicentrico italiano (16) ha calcolato l’accuratezza della CT basale e stimolata in 135 pazienti con patologia nodulare tiroidea e diagnosi istologica (47 MTC sporadici): il miglior cut-off di CT basale era > 30 pg/mL nelle femmine (sensibilità 75.9%, specificità 93.7%) e > 34 pg/mL nei maschi (sensibilità 88.9%, specificità 95%). Nello stesso studio veniva analizzata anche la performance della CT stimolata con calcio gluconato, riscontrando un cut-off > 79 pg/mL nelle femmine (sensibilità 100%, specificità 50%) e > 466 pg/mL nei maschi (sensibilità 94.4%, specificità 80%). Complessivamente, tutti i pazienti con MTC e CT basale > cut-off avevano CT stimolata > cut-off, a dimostrazione dell’alta accuratezza della CT basale. Tuttavia, non tutti gli MTC sarebbero stati individuati senza lo stimolo, per quanto i pazienti con CT basale < cut-off identificati fossero tutti in stadio T1N0, quindi con piccoli MTC intra-tiroidei. Combinando la CT basale con quella stimolata, tutti gli MTC venivano correttamente identificati, sia tra le femmine che tra i maschi. Tuttavia, i dati in letteratura sui cut-off di CT basale e stimolata non sono omogenei, probabilmente per una certa eterogeneità nelle caratteristiche delle casistiche considerate, in particolare nella prevalenza di MTC.
Alternative al test di stimolo per una corretta individuazione dell’MTC
Un’alternativa può essere rappresentata dalla misura della CT da eluato di nodo tiroideo, eventualmente con l’aggiunta di una colorazione immuno-istochimica per individuare CT, cromogranina A, CEA e l’assenza di tireoglobulina. La misura della CT da eluato può essere particolarmente utile specie se ci troviamo di fronte a un nodo singolo e ben raggiungibile. Nonostante sia una metodica con performance nella diagnosi dell’MTC sicuramente migliore rispetto al citologico, è gravata dalla mancanza di una standardizzazione nelle procedure di trattamento del campione e nei cut-off considerati diagnostici di MTC. Esiste, infatti, un’associazione tra livelli di CT plasmatica e misurabilità della stessa sull’eluato: si può riscontrare una CT misurabile da eluato anche in nodi non-MTC, specie in presenza di CT plasmatica misurabile.
Infine, alcuni autori, nei casi di ipercalcitoninemia moderata suggeriscono anche la strategia “wait-and-see” basata sull’assunto che la stragrande maggioranza degli MTC con livelli di CT pre-operatori < 100 pg/mL guariscono a seguito della chirurgia. Quindi questa strategia potrebbe essere perseguita specie per quei pazienti che abbiano CT basale < cut-off sesso-specifici individuati (es 30/34 pg/mL F/M). Tuttavia, è necessario ricordare anche che micro-metastasi linfonodali possono essere presenti fin nel 43% degli MTC ≤ 10 mm, con impatto considerevole sulle probabilità di guarigione. La strategia wait-and-see andrebbe quindi riservata a una ristretta cerchia di pazienti, quando vi sia oltretutto certezza della loro aderenza al follow-up.
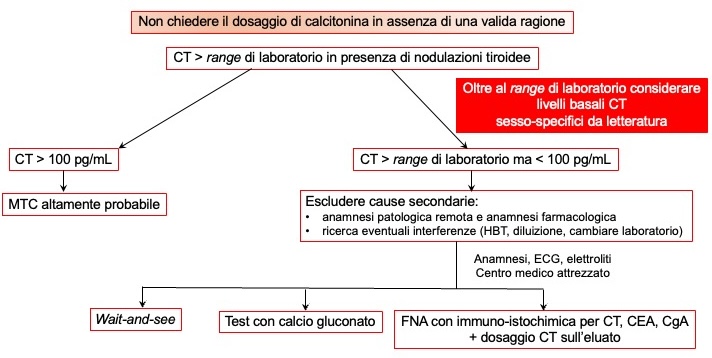
Figura 1
Proposta di flow-chart per la gestione dell’ipercalcitoninemia
(HBT: heterophilic blocking tube; IHC: immunoistochimica)
Il CEA
È una glicoproteina di adesione espressa dalle cellule neuro-endocrine nel tratto gastro-intestinale durante la crescita fetale, mentre solo piccole quantità si possono trovare in circolo durante la vita adulta. Un CEA < 2.5 ng/mL è generalmente considerato normale, livelli tra 2.5-5 ng/mL lievemente elevati, mentre livelli > 5 ng/mL sono considerati francamente elevati.
Il CEA si riscontra elevato nel 60-70% degli MTC alla diagnosi, ma può aumentare anche per effetto di altre condizioni patologiche (altri tipo di cancro) o come conseguenza di condizioni non tumorali (fumo di sigaretta, patologie infiammatorie del tratto gastro-intestinale, patologie polmonari benigne, ecc). Il CEA non è quindi un marcatore specifico di MTC ed è quindi scarsamente utile per la diagnosi.
Tuttavia, il valore pre-operatorio di CEA può avere una valenza prognostica: è stata dimostrata un’associazione tra maggiori livelli pre-operatori di CEA e diametro del tumore primitivo maggiore, presenza di metastasi linfonodali e coinvolgimento metastatico a distanza. I livelli di CEA sono più frequentemente normali nei microMTC. Inoltre, livelli pre-operatori elevati di CEA si associano a minori tassi di remissione post-operatoria: quando i eccedono i 30 ng/mL, la guarigione chirurgica è poco probabile (17).
Procalcitonina (proCT)
È un precursore della CT, recentemente proposto come marcatore alternativo di MTC, perchè presenta diversi vantaggi analitici: lunga emivita (20-24 ore), stabilità a temperatura ambiente, possibilità di confronto tra diversi laboratori (gli immuno-dosaggi presenti in commercio sfruttano lo stesso kit di rilevamento).
La proCT ha dimostrato una buona correlazione col carico di malattia iniziale. I livelli di proCT pre-chirurgici hanno inoltre mostrato un’associazione con i tassi di guarigione in corso di follow-up, mostrando quindi anche un valore in senso prognostico (17).
Una recente metanalisi basata su 11 studi clinicamente omogenei (18) per un totale di 5817 pazienti (355 MTC, prevalenza 0.16-60%) ha analizzato i lavori pubblicati fino a maggio 2021 che hanno analizzato l’accuratezza della proCT nella diagnosi e nel follow-up dell’MTC. Considerando un cut-off di proCT compreso tra 0.06 e 0.5 ng/mL, la sensibilità e la specificità diagnostica della proCT risultavano globalmente del 90% (IC 95% 71-97%) e del 100% (IC 95% 85-100%), rispettivamente. La metanalisi concludeva quindi attribuendo alla proCT una performance comparabile a quella della CT nella diagnosi dell’MTC, con il vantaggio di non mostrare significative variazioni di sensibilità e specificità al variare del kit di laboratorio impiegato, con cut-off che non risentivano di differenze di genere.
Un recente studio multicentrico italiano ha valutato una serie di 151 pazienti (63 con MTC, 88 con patologia nodulare tiroidea non a cellule-C) per cercare di individuare il miglior cut-off di proCT utile alla diagnosi di MTC. Il miglior cut-off diagnostico corrispondeva al valore di proCT > 0.07 ng/mL, con sensibilità 85.7%, specificità 98.9%, VPP 98.2% e VPN 90.6% (19). Lo studio documentava soprattutto un’ottima specificità nella diagnosi di MTC: è stato riportato un solo caso di proCT superiore al cut-off proposto in assenza di MTC, in un paziente con CT negativa. D’altra parte, la sensibilità della proCT era particolarmente deludente nei micro-MTC, essendo in grado di identificare tutti i MTC > 10 mm (tranne un caso) e fallendo invece nel 34.8% degli MTC < 10 mm. In generale, tutti questi studi sono gravati da un importante bias, rappresentato dalla prevalenza del MTC nelle casistiche considerate, molto più elevata della reale prevalenza nella popolazione generale (l’MTC è una malattia rara), con conseguente influenza sui valori di VPP e VPN. Inoltre, è importante tenere a mente che la proCT viene prodotta in quantità sostanziali in risposta alla sepsi batterica, ma è stato documentato un suo incremento anche in corso di risposta infiammatoria sistemica, infezioni batteriche localizzate, malattie autoimmuni, traumi gravi, chirurgie, shock termico e cardiogeno, infezioni fungine e parassitarie (20). Quindi, diversi fattori possono portare a incremento dei livelli di proCT, e in presenza di tali condizioni la proCT non è utilizzabile come marcatore di MTC.
Diagnostica strumentale
Ecografia: nella maggior parte dei casi l’MTC appare ecograficamente come un nodulo solido e ipoecogeno. Tuttavia, non sempre l’MTC presenta caratteri ecografici sospetti. Le varie classificazioni ecografiche di rischio di malignità (es. EU-TIRADS o K-TIRADS) formulate per guidare la richiesta di agoaspirato ed evitare over-diagnosi e mancato riconoscimento di noduli maligni, sono infatti state tarate sulla patologia nodulare maligna tiroidea più frequente, cioè il PTC. Molto spesso l’MTC non presenta margini irregolari (presenti con percentuali variabili tra il 30-60%), spesso mancano anche le micro-calcificazioni/spot iperecogeni (presenti nel 20-45% dei casi) e la morfologia taller-than-wide è riportata nel 10% circa dei casi. Applicando le moderne classificazioni di rischio ecografico, circa il 50% degli MTC rischia di non rientrare nelle categorie a rischio più elevato (21). Sulla base di questi dati e dell’importanza della tempestività diagnostica sull’esito, assume quindi un’importanza ancora maggiore la diagnosi biochimica, anche se lo screening della CT nei pazienti con nodo tiroideo è ancora dibattuto, come sopra esplicato.
Stadiazione pre-operatoria. Nei casi di malattia avanzata a livello locale, dobbiamo studiare i pazienti con TC multistrato di collo, mediastino e torace, tracheoscopia ed esofagogramma per una valutazione corretta dell’estensione locale della malattia e la programmazione dell’intervento chirurgico più adeguato. La RM presenta maggiore sensibilità per il rilievo di infiltrazione della cartilagine tracheale, del nervo laringeo ricorrente e dell’esofago.
È anche importante valutare l’eventuale metastatizzazione epatica mediante TC trifasica con mezzo di contrasto, o RM con mezzo di contrasto. Nel sospetto di malattia con metastasi a distanza, oltre a TC o RM mediastino, TC torace, RM addome, va considerata anche l'esecuzione di RM rachide e bacino, che può rilevare secondarismi prima dell’evidenza alla scintigrafia ossea, con maggiore sensibilità e accuratezza (rispettivamente, 100% vs 72.7% e 96.6% vs 76.7%). Questi ulteriori esami andrebbero presi in considerazione nei pazienti con estesa malattia al collo o segni/sintomi di metastasi regionale o a distanza nonché nei pazienti con livelli di CT > 500 pg/mL.
Attualmente, le LG non raccomandano l’esecuzione di FDG-PET/TC o di F-DOPA-PET/TC in fase diagnostica per rilevare l’eventuale presenza di metastasi a distanza (9).
BIBLIOGRAFIA
- Ilias I, Torpy DJ, Pacak K, et al. Cushing’s syndrome due to ectopic corticotropin secretion: twenty years’ experience at the National Institutes of Health. J Clin Endocrinol Metab 2005, 90: 4955-62.
- Leboulleux S, Baudin E, Travagli J, et al. Medullary thyroid carcinoma. Clin Endocrinol (Oxf) 2004, 61: 299-31.
- Machens A, Hinze R, Thomusch O, Dralle H. Pattern of nodal metastasis for primary and reoperative thyroid cancer. World J Surg 2002, 26: 22–8.
- Moley JF. Medullary thyroid carcinoma: management of lymph node metastases. J Natl Compr Canc Netw 2010, 8: 549-56.
- Modigliani E, Cohen R, Campos JM, et al. Prognostic factors for survival and for biochemical cure in medullary thyroid carcinoma: results in 899 patients. Clin Endocrinol (Oxf) 1998, 48: 265-73.
- Xu B, Fuchs TL, Ahmadi S, et al. International medullary thyroid carcinoma grading system: a validated grading system for medullary thyroid carcinoma. J Clin Oncol 2022, 40: 96–104.
- Hazard JB, Hawk WA, Crile G. Medullary (solid) carcinoma of the thyroid; a clinicopathologic entity. J Clin Endocrinol Metab 1959, 19: 152–61.
- Williams ED. Histogenesis of medullary carcinoma of the thyroid. J Clin Pathol 1966, 19: 114-8.
- Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Elisei R, Bottici V, Luchetti F, et al. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab 2004, 89: 163–8.
- Cheung K, Roman SA, Wang TS, et al. Calcitonin measurement in the evaluation of thyroid nodules in the United States: a cost-effectiveness and decision analysis. J Clin Endocrinol Metab 2008, 93: 2173–80.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Gharib H, Papini E, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules–2016 update appendix. Endocr Pract 2016, 22: 622-39.
- Durante C, Hegedüs L, Czarniecka A. 2023 European Thyroid Association clinical practice guidelines for thyroid nodule management. Eur Thyroid J 2023, 12: e230067.
- Verbeek HH, Groot JWB, Sluiter WJ, et al. Calcitonin testing for detection of medullary thyroid cancer in patients with thyroid nodules. Cochrane Database Syst Rev 2020, 3: CD010159.
- Fugazzola L, Stefano M Di, Censi S, et al. Basal and stimulated calcitonin for the diagnosis of medullary thyroid cancer: updated thresholds and safety assessment. J Endocrinol Invest 2021, 44: 587-97.
- Censi S, Manso J, Mian C. Other markers of medullary thyroid cancer, not only calcitonin. Eur J Endocrinol 2023, 188: R1-13.
- Giovanella L, Garo ML, Ceriani L, et al. Procalcitonin as an alternative tumor marker of medullary thyroid carcinoma. J Clin Endocrinol Metab 2021, 106: 3634–43.
- Censi S, Di Stefano M, Repaci A, et al. Basal and calcium-stimulated procalcitonin for the diagnosis of medullary thyroid cancers: lights and shadows. Front Endocrinol (Lausanne) 2021, 12: 754565.
- Schneider HG, Lam QT. Procalcitonin for the clinical laboratory: a review. Pathology 2007, 39: 383–90.
- Matrone A, Gambale C, Biagini M. Ultrasound features and risk stratification systems to identify medullary thyroid carcinoma. Eur J Endocrinol 2021, 185: 193-200.
Terapia chirurgica del carcinoma midollare
Francesca Torresan1, Maurizio Iacobone1, Simona Censi2
1UOC di Endocrino-chirurgia, Dipartimento di Scienze Chirurgiche, Oncologiche e Gastroenterologiche (DiSCOG)
2UOC di Endocrinologia, Dipartimento di Medicina (DIMED)
Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
(gli autori ringraziano per le immagini chirurgiche l'autore della precedente versione, Corrado Pedroni, Reggio Emilia)
Il carcinoma midollare della tiroide (MTC) è un tumore raro e la sua scarsa prevalenza ha compromesso sia l’acquisizione di un’ampia esperienza clinica, sia la possibilità di realizzare studi clinici randomizzati adeguati e definitivi. Sappiamo, comunque, che è un tumore aggressivo, che tende a metastatizzare frequentemente e precocemente ai linfonodi cervicali e mediastinici superiori (1-3) e che può presentare metastasi a distanza al momento della diagnosi in circa il 20% dei pazienti (4).
VALUTAZIONE PRE-OPERATORIA
La valutazione pre-operatoria di un paziente con MTC sospetto o accertato, evidenziato dalla FNA o dallo screening routinario della calcitonina (CT) basale, può prevedere, oltre al dosaggio della CT sierica basale e dopo stimolo con calcio gluconato, quello del CEA. Inoltre, stante la possibilità che l’MTC faccia parte di un quadro di neoplasia endocrina multipla di tipo 2 (MEN 2), è opportuno eseguire la misurazione della calcemia totale e ionizzata, per escludere l’iperparatiroidismo primario (IPT), e delle metanefrine e normetanefrine plasmatiche e urinarie, per escludere il feocromocitoma (PHEO). Naturalmente, per escludere o confermare la possibilità di una forma familiare (MEN 2) viene inoltre raccomandata già nella fase pre-operatoria l’analisi genetica per la ricerca di mutazioni a carico del proto-oncogene RET, anche se nella pratica clinica è difficile disporre dei risultati di tale analisi prima dell’intervento chirurgico (5-7).
Sebbene lo screening routinario della CT basale nei pazienti portatori di noduli tiroidei sia risultato vantaggioso all’analisi costo/beneficio, l’indicazione all’esecuzione è ancora oggetto di ampio dibattito. Le linee guida (LG) europee, così come quelle americane e le AACE/ACE/AME, non si pongono né pro né contro, o ne ritengono sicuramente opportuna la misura in situazioni particolari (8-10). Secondo le ultime LG europee (10), la misurazione della CT nel quadro di nodi tiroidei risulta sicuramente opportuna in:
- pazienti candidati alla chirurgia o a procedure minimamente invasive;
- caso di nodo con citologia indeterminata o con caratteri ecografici di sospetto;
- pazienti con familiarità per MTC o MEN 2.
In tutti i casi di MTC sospetto o accertato, l’imaging pre-operatorio deve comprendere l’ecografia del collo, con mappaggio linfonodale dei diversi livelli cervicali. Nei pazienti con metastasi linfonodali o con CT sierica > 500 pg/mL, è indicato un work-up diagnostico più approfondito per escludere la presenza di metastasi a distanza (5,11), che comprenda la TC del collo e del torace, che è risultata l’indagine più sensibile per evidenziare metastasi polmonari o ai linfonodi mediastinici, la RM del fegato con mdc, che è l’indagine più sensibile per le metastasi epatiche, e la RM assiale o la scintigrafia ossea per evidenziare metastasi ossee (12). Nello screening metastatico iniziale, è utile eseguire anche lo studio PET con 18F-DOPA o 18F-FDG o con analoghi marcati della somatostatina (5).
CHIRURGIA
Obiettivi del trattamento
La chirurgia è il solo trattamento curativo di questo tumore e, pertanto, è importante cercare di perseguire la massima radicalità chirurgica possibile nel primo intervento, dal momento che, come risulta da studi clinici retrospettivi (1-4, 12-21), i tassi di recidiva locale e di sopravvivenza dipendono dall’adeguatezza del trattamento chirurgico iniziale, mentre la radioterapia esterna e la chemioterapia sono risultate scarsamente efficaci.
Quale tiroidectomia?
C’è generale accordo che il trattamento chirurgico minimo del MTC clinicamente evidente, indipendentemente dalla forma (sporadica o familiare) e dallo stadio (anche nei T1N0), debba essere rappresentato dalla tiroidectomia totale con associata linfadenectomia del compartimento centrale del collo (21-27), mentre è ancora dibattuta e controversa l’indicazione alla linfadenectomia di principio del compartimento laterale del collo. L’indicazione sistematica alla tiroidectomia totale è giustificata dalle seguenti considerazioni:
- il MTC è bilaterale nel 20-30% dei casi delle forme sporadiche ed è potenzialmente multifocale e bilaterale nella totalità delle forme ereditarie;
- il background ereditario è spesso sconosciuto al momento dell’intervento primario;
- il trattamento con radioiodio è inefficace per sterilizzare eventuali residui neoplastici (33,34).
Quale intervento per i linfonodi?
Nelle più recenti LG dell’American Thyroid Association (ATA) (5), basate su una vasta revisione della letteratura secondo i criteri dell’evidence based medicine (EBM) e sull’esperienza di un autorevole panel di esperti, c’è ancora generale accordo sul fatto che nel MTC, in assenza di metastasi linfonodali all’esame clinico e all’ecografia del collo e di metastasi a distanza, alla tiroidectomia totale si debba associare lo svuotamento linfatico precauzionale del compartimento centrale del collo. L’indicazione sistematica alla linfadenectomia del compartimento centrale del collo è giustificata da:
- elevata incidenza di metastasi linfonodali che, nel compartimento centrale, non sono in molti casi evidenziabili all’ecografia pre-operatoria, in quanto mascherate dalla presenza della tiroide, e non sono inoltre agevolmente rilevabili all’esplorazione intra-operatoria;
- un reintervento nel compartimento centrale del collo è associato a maggior tasso di complicanze rispetto all’intervento primario (in particolare paralisi ricorrenziale e ipoparatiroidismo permanente);
- la progressione di malattia metastatica in questa sede può comportare l’infiltrazione del nervo ricorrente e/o della trachea e richiedere un successivo trattamento chirurgico più demolitivo.
La dissezione linfonodale del compartimento centrale del collo deve essere realizzata in modo meticoloso, asportando tutto il tessuto cellulo-adiposo e linfonodale compreso tra un asse carotideo e l’altro, dall’osso ioide, superiormente, sino ai vasi anonimi, inferiormente (fig 1). Nella dissezione saranno così compresi i linfonodi peri-tiroidei e pre-laringei e le catene linfatiche pre-tracheale e para-tracheali.


Figura 1 a (in alto) e 1 b (in basso). Dissezione del compartimento centrale. Sono evidenti le strutture anatomiche che delimitano l'area: l'osso ioide (limite craniale), i vasi anonimi (limite caudale), gli assi carotidei (limiti laterali)
L’intervento richiede la completa dissezione e preservazione dei nervi laringei ricorrenti, iniziando dallo stretto toracico superiore, in modo da rimuovere l’intera catena linfatica para-tracheale en-bloc con il lobo tiroideo corrispondente. L’estensione della dissezione al mediastino antero-superiore è condizionata dall’habitus costituzionale del paziente. Nella dissezione linfonodale del compartimento centrale del collo bisogna cercare di preservare le paratiroidi superiori, con il loro ramo arterioso, mentre è spesso difficile identificare e preservare le paratiroidi inferiori, quasi sempre difficilmente dissociabili dai linfonodi para-tracheali. Se queste vengono identificate ma risultano devascolarizzate a causa dell’accurata dissezione linfonodale, dovranno essere re-impiantate in piccoli frammenti nel ventre del muscolo sterno-cleido-mastoideo (SCM), eventualmente previa conferma istologica estemporanea per evitare l’innesto di un linfonodo metastatico (fig 2).



Figura 2: La paratiroide inferiore, una volta escissa (pannello intermedio), viene suddivisa in 5 frammenti (pannello inferiore), confermati all'istologico intra-operatorio e destinati ad essere auto-trapiantati nel muscolo sterno-cleido-mastoideo.
È ancora oggetto di dibattito invece lo svuotamento linfatico di principio del compartimento laterale del collo, alla luce dell’alta percentuale di pazienti N0 sottoposti a chirurgia estensiva che non ottengono la normalizzazione post-operatoria della CT per la presenza di metastasi a distanza occulte. Anche in presenza di linfadenopatia sospetta del compartimento centrale del collo (VI livello), senza evidenza ecografica di linfonodi sospetti nel compartimento laterale, l’indicazione delle LG dell’ATA è ancora quella della tiroidectomia totale con svuotamento linfatico del solo compartimento centrale del collo. Solo una minoranza dei componenti della Task Force ATA è favorevole a uno svuotamento precauzionale del compartimento laterale del collo in presenza di metastasi linfatiche al VI livello. Come si è detto, tale atteggiamento conservativo è giustificato dal fatto che la maggior parte dei pazienti con metastasi linfonodali loco-regionali non risulterà guarita in modo definitivo da una chirurgia aggressiva che includa lo svuotamento linfatico latero-cervicale bilaterale. In alcuni studi (6,28,29) risulta che lo stadio di malattia è un fattore predittivo indipendente di sopravvivenza, mentre il tipo di chirurgia non lo è. In ogni caso, lo svuotamento linfatico del compartimento centrale del collo è sempre indicato, anche precauzionalmente, perché riduce il rischio di recidiva locale e può prevenire future complicanze come l’infiltrazione del nervo ricorrente o della trachea. Naturalmente, in presenza di linfonodi metastatici o ecograficamente sospetti nel compartimento laterale del collo, alla tiroidectomia totale va associato anche lo svuotamento linfatico comprensivo dei compartimenti centrale e laterale del collo.
Per concludere, secondo le LG ATA (5), l’estensione del trattamento chirurgico nel MTC clinicamente evidente deve prevedere, oltre alla tiroidectomia totale, lo svuotamento linfonodale precauzionale del compartimento centrale del collo. La linfadenectomia latero-cervicale viene invece considerata solitamente a scopo terapeutico e quindi riservata ai casi in cui vi sia la presenza dimostrata di linfonodi metastatici latero-cervicali.
Recentemente (30) è stato proposto di utilizzare i livelli di CT sierica basale per predire l’estensione della malattia e programmare il relativo trattamento chirurgico. Lo studio retrospettivo di 300 pazienti consecutivi con MTC sottoposti a linfadenectomia di 4 compartimenti conclude che la misurazione dei livelli pre-operatori di CT sierica basale è più indicativa di estensione della malattia linfonodale rispetto all’ecografia cervicale, caratterizzata da falsi negativi in più di 1/3 dei pazienti con MTC. Nello studio, livelli pre-operatori di CT basale:
- > 20 pg/mL corrispondono alla presenza di metastasi linfonodali nei compartimenti centrale e/o laterale ipsi-laterale;
- > 50 pg/mL alla presenza di metastasi linfonodali nel compartimento centrale contro-laterale;
- > 200 pg/mL a metastasi linfonodali nel compartimento laterale contro-laterale;
- > 500 pg/mL a metastasi nel mediastino superiore.
Pertanto, sulla base di questi riscontri, è stato proposto che nei pazienti con livelli pre-operatori di CT basale:
- ≥ 20 pg/mL sia indicata (oltre alla linfadenectomia del comparto centrale) anche quella del comparto latero-cervicale omolaterale;
- ≥ 200 pg/mL sarebbe indicata l’associazione con lo svuotamento linfatico latero-cervicale bilaterale.
Peraltro, la linfadenectomia latero-cervicale non è scevra da complicanze, ed è eseguibile anche in un secondo momento, in caso di mancata guarigione dopo tiroidectomia totale e linfadenectomia centrale, senza incremento di morbilità.
Il trattamento chirurgico del compartimento laterale del collo nel MTC è generalmente rappresentato dallo svuotamento radicale modificato (MRND), che comporta l’asportazione di tutto il tessuto cellulo-adiposo e linfonodale compreso tra il muscolo digastrico in alto, la clavicola in basso, l’asse carotideo medialmente e il muscolo trapezio lateralmente, con la conservazione della vena giugulare interna, del nervo accessorio spinale e del muscolo SCM. In questo modo vengono asportati tutti i linfonodi latero-cervicali, dal II al V livello (fig 3).


Figura 3. Svuotamento funzionale (o radicale modiificato) del compartimento laterale del collo; i linfonodi localizzati nei livelli II-V vengono asportati, con preservazione delle strutture vascolari, nervose e del muscolo SCM.
Il I livello non viene comunemente interessato nella dissezione linfonodale, a meno che siano evidenti linfonodi sospetti in quella sede. D’altra parte, anche nello studio di Ellenhorn et al (31), sul trattamento chirurgico dei linfonodi regionali nel MTC, il I livello non risultava mai coinvolto da metastasi linfonodali.
La dissezione radicale classica del collo (RND) non porta a miglioramento della prognosi, anche in presenza di metastasi linfonodali clinicamente evidenti. Può però essere necessaria in presenza di una metastatizzazione linfonodale estesa con coinvolgimento massivo del muscolo SCM e della vena giugulare interna (24) (fig 4). Dovrebbe comunque essere fatto ogni tentativo per preservare il nervo accessorio spinale, soprattutto se non risulta invaso dalla neoplasia.

Figura 4. In caso di coinvolgimento delle strutture vascolari o del muscolo SCM da parte della neoplasia può rendersi necessario lo svuotamento radicale del collo con sacrificio della vena giugulare interna e del muscolo SCM
Quasi tutti gli autori (2,32) concordano sul fatto che la dissezione linfonodale del mediastino superiore debba essere realizzata solo se è coinvolto il compartimento centrale, e generalmente praticata attraverso la normale incisione cervicale, riservando la sternotomia mediana solo ai casi di evidenza radiologica di metastasi mediastiniche (fig 5).

Figura 5. Dissezione linfonodale del compartimento centrale e del mediastino superiore; l'accesso allo spazio mediastinico richiede la sternotomia
Quale intervento nelle forme ereditarie?
Nel MTC ereditario, identificato con l’analisi della mutazione del proto-oncogene RET, senza evidenza clinica di malattia, è indicata la tiroidectomia totale profilattica. Questo termine indicherebbe la rimozione della tiroide prima che si sviluppi il MTC. In realtà al momento della tiroidectomia è già molto spesso presente un’iperplasia delle cellule C o un MTC, molto spesso microMTC. Quindi, in questo contesto, il termine “tiroidectomia profilattica” va a indicare la rimozione della tiroide prima che si sviluppi il MTC o quando esso sia clinicamente non evidente o confinato alla ghiandola tiroidea. L’obiettivo della tiroidectomia profilattica è intervenire prima che si sviluppino metastasi, perché, altrimenti, sarà difficile riuscire a guarire il paziente. Inoltre, la tiroidectomia profilattica eseguita in età precoce, prima che si sviluppino metastasi, evita la necessità dello svuotamento del compartimento centrale del collo, che è associato a maggiore incidenza di ipoparatiroidismo e di paralisi ricorrenziale. Tuttavia, l’intervento chirurgico eseguito in età precoce risulta più complesso e gravato da più alto rischio di complicanze, in particolare di ipoparatiroidismo iatrogeno.
Il timing della tiroidectomia un tempo era guidato squisitamente dalla presenza e categoria di rischio della mutazione di RET. Si è poi notato come per lo stesso tipo di mutazione germinale di RET, ma anche all’interno della stessa famiglia, vi sia una grande eterogeneità dell’età d’esordio e dell’aggressività del MTC. Attualmente, quindi, il timing della tiroidectomia è guidato, oltre che dallo stato mutazionale RET, anche dai valori basali e stimolati di CT. Data la mancanza di cut-off di CT condivisi nel guidare la tiroidectomia profilattica, ogni centro dovrebbe elaborare una sua esperienza per guidare il timing, anche in base alla metodica di laboratorio adottata. Esistono comunque due diversi approcci alla gestione chirurgica per i pazienti MEN 2.
MEN 2A: i periodici controlli di CT, basale e stimolata, ed ecografia del collo dovrebbero iniziare (5):
- nei portatori di mutazione RET ATA-H (C634) a partire dai 3 anni di vita, data la maggiore aggressività del MTC che può svilupparsi nei primissimi anni di vita;
- per i portatori di mutazioni RET ATA-MOD, anche dall’età di 5 anni.
La tiroidectomia è indicata sempre se la CT è già elevata al momento dello screening genetico (es, in caso di parenti del probando). Secondo la strategia basata sulle categorie di rischio genetiche (correlazione genotipo – fenotipo), la tiroidectomia totale con intento profilattico dovrebbe essere comunque eseguita (5):
- nei portatori di mutazioni classificabili nella classe di rischio ATA-H entro i 5 anni di età (o anche prima in caso di positivizzazione della CT), associando la linfadenectomia in caso di CT ≥ 40 pg/mL. Peraltro, anche in caso di portatori di mutazione ad alto rischio (ATA-H, C634) con CT basale negativa, è stata evidenziata la possibilità di guarigione del paziente anche posticipando la tiroidectomia al momento in cui la CT stimolata diventi positiva, rendendo pertanto l’intervento chirurgico gravato da minori tassi di complicanze (33);
- nei portatori di mutazioni ATA-MOD, potrebbe essere posticipata ad età anche maggiori, prolungando il follow-up anche per anni.
In ogni caso, un recente studio retrospettivo (34) ha comunque confermato un esito a lungo termine migliore nei pazienti operati in età precoce, con CT sierica ancora nel range di normalità e quindi con maggiore probabilità di riscontro istologico di sola iperplasia delle cellule C, con tassi di complicanza accettabili purché eseguiti in centri esperti in chirurgia tiroidea.
MEN 2B: la mutazione M918T comporta lo sviluppo di MTC anche con interessamento linfonodale molto precoce, talvolta presente già alla nascita e comunque nel primo anno di vita. Per tale motivo, i portatori di tale mutazione dovrebbero essere sottoposti a tiroidectomia totale (e possibilmente linfadenectomia) nel primo anno di vita. Il timing preciso dovrebbe essere stabilito in accordo tra il pediatra, il chirurgo e i genitori. Esistono alcune complicanze legate al timing così precoce della tiroidectomia. Prima di tutto, i valori di CT non possono essere utilizzati per guidare l’estensione della chirurgia, in quanto sono naturalmente elevati nel neonato. In secondo luogo, nei primi mesi di vita può essere estremamente difficile identificare e isolare le paratiroidi durante la tiroidectomia, aumentando il rischio di ipoparatiroidismo. In assenza di linfadenopatia sospetta, la scelta se estendere o meno la tiroidectomia a una linfadenectomia profilattica del comparto centrale può essere stabilita in base alla possibilità di identificare e preservare le paratiroidi (in situ o con auto-trapianto). Dobbiamo tuttavia ricordare che nel 75% dei casi la mutazione M918T compare de novo, in assenza quindi di una storia familiare di MEN 2. Normalmente tali bambini vengono diagnosticati in seguito alla diagnosi di un nodo tiroideo. In uno studio con 21 pazienti con mutazione del codone M918T, l’età media alla diagnosi era di 14 anni, con elevati livelli di CT basale (media attorno a 26 000) (35). Nonostante ciò, nel post-operatorio il 18% aveva livelli di CT negativi. Nonostante l’aggressività del MTC nella MEN 2B, la guarigione chirurgica è possibile (36). È cruciale per il clinico essere consapevole delle manifestazioni fenotipiche della MEN 2B, spesso evidenti molto prima del nodo tiroideo o del feocromocitoma. I pazienti sospettati di MEN 2B in base alle caratteristiche fenotipiche (manifestazioni scheletriche, ganglioneuromatosi, sintomi orali o oculari, ecc) sono mediamente più giovani, con minori livelli di CT pre-operatoria e maggiori tassi di guarigione chirurgica rispetto a coloro in cui la MEN 2B viene diagnosticata in seguito al riscontro di MTC/feocromocitoma (37). Nei pazienti con MEN 2B portatori di mutazione del codone A883F, l’MTC appare meno aggressivo rispetto ai portatori di mutazione del codone M918T. Tuttavia, è difficile suggerire come gestire al meglio questi pazienti, a causa della scarsità di dati in letteratura.
GESTIONE DEL FEOCROMOCITOMA NEI PAZIENTI CON MEN 2A E MEN 2B
Il feocromocitoma si sviluppa generalmente tra la III e la IV decade di vita. Un feocromocitoma misconosciuto può comportare un’importante morbilità e mortalità peri-operatoria al momento della tiroidectomia. Perciò, il feocromocitoma va sempre escluso prima della tiroidectomia. Nel MTC ancora non classificato come ereditario o sporadico, si possono dosare le metanefrine e normetanefrine urinarie delle 24 ore, il cui risultato è disponibile più velocemente rispetto all’analisi delle mutazioni germinali RET. Per la localizzazione del feocromocitoma possono essere impiegate la TC o la RM addome. Il feocromocitoma andrebbe sempre escluso nelle pazienti MEN 2 che desiderano una gravidanza. In caso di feocromocitoma diagnosticato in gravidanza, la surrenectomia andrebbe eseguita possibilmente prima del III trimestre. La surrenectomia bilaterale comporta lo sviluppo di insufficienza surrenalica; per tale ragione è da preferire la surrenectomia unilaterale per il feocromocitoma isolato, pur sapendo che il rischio di sviluppo di un feocromocitoma nel surrene controlaterale è elevato entro i successivi 10 anni. In alcuni casi può essere considerata anche la surrenectomia subtotale, allo scopo di preservare la funzione corticale. Nei pazienti MEN lo screening per il feocromocitoma dovrebbe iniziare a 11 anni per le categorie di rischio ATA-HST e ATA-H e a 16 anni per gli ATA-MOD (5).
GESTIONE DELL’IPERPARATIROIDISMO PRIMITIVO NEI PAZIENTI CON MEN 2A
La sorveglianza dell’iperparatiroidismo primario nei pazienti MEN 2 comprende la misurazione della calcemia e del PTH a partire dagli 11 anni di età nella categoria ATA-H e dai 16 anni nella categoria ATA-MOD. L’IPT si sviluppa più frequentemente nei portatori di mutazioni dell’esone 11 (più frequentemente codone 634) e, meno frequentemente in pazienti con mutazioni dell’esone 10. Molto spesso l’IPT nella MEN 2 è lieve e asintomatico, più lieve di quello intercorrente nella MEN 1.
Il trattamento chirurgico dell’IPT MEN-2 correlato è la paratiroidectomia selettiva, ovvero l’asportazione delle sole paratiroidi patologiche (una o più), con dosaggio del PTH intra-operatorio. Nel caso in cui tutte e 4 le paratiroidi risultino patologiche, può essere indicata la paratiroidectomia subtotale.
La gestione nei casi pediatrici è sovrapponibile. Nel caso di pazienti già sottoposti a tiroidectomia, la localizzazione intra-operatoria delle paratiroidi può essere più complessa e sono spesso necessarie più indagini di localizzazione (oltre alla scintigrafia con sesta-MIBI ed ecografia, anche TC collo/torace o 18F-colina PET/TC). Se viene identificata una paratiroide ingrandita e vi è la documentazione istologica della pregressa rimozione di 3 paratiroidi, una porzione della ghiandola ingrandita viene lasciata in situ o reimpiantata in un altro sito (5).
VALUTAZIONE POST-OPERATORIA
L’adeguatezza della resezione chirurgica nel MTC è valutata dalla determinazione post-operatoria dei livelli di CT basale e dopo test di stimolo con calcio gluconato. La persistenza di livelli elevati di CT è indicativa di presenza di malattia persistente o recidivante. Dopo il trattamento chirurgico primario, più del 50% dei pazienti avrà persistente elevazione dei livelli di CT, anche nei casi N0, quando il livello pre-operatorio di CT sierica basale era > 300 pg/mL o quando le dimensioni del tumore primitivo erano > 1 cm (4). Recenti studi hanno dimostrato che il tempo di raddoppiamento del CEA ha un valore predittivo di malattia persistente o recidivante maggiore del tempo di raddoppiamento della CT, suggerendo che sia essenziale la misurazione di entrambi i marcatori tumorali per un’appropriata stratificazione del rischio (38).
Vedi capitolo Follow-up del carcinoma midollare.
BIBLIOGRAFIA
- Machens A, Hinze R, Thomusch O, Dralle H. Pattern of nodal metastasis for primary and reoperative thyroid cancer. World J Surg 2002, 26: 22–8.
- Moley JF, DeBenedetti MK. Patterns of nodal metastases in palpable medullary thyroid carcinoma. Recommendations for extent of node dissection. Ann Surg 1999, 229: 880-7.
- Scollo C, Baudin E, Travagli JP, et al. Rationale for central and bilateral lymph node dissection in sporadic and hereditary medullary thyroid cancer. J Clin Endocrinol Metab 2003, 88: 2070-5.
- Machens A, Schneyer U, Holzhausen HJ, Dralle H. Prospects of remission in medullary thyroid carcinoma according to basal calcitonin level. J Clin Endocrinol Metab 2005, 90: 2029-34.
- Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Hyer SL, Vini L, A’Hern R, Harmer C. Medullary thyroid cancer: multivariate analysis of prognostic factors influencing survival. Eur J Surg Oncol 2000, 26: 686-90.
- Moo-Young TA, Traugott AL, Moley JF. Sporadic and familial medullary thyroid carcinoma: state of the art. Surg Clin North Am 2009, 89: 1193–204.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Gharib H, Papini E, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules–2016 update appendix. Endocr Pract 2016, 22: 622-39.
- Durante C, Hegedüs L, Czarniecka A. 2023 European Thyroid Association clinical practice guidelines for thyroid nodule management. Eur Thyroid J 2023, 12: e230067.
- Pacini F, Basolo F, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Brierley J, Tsang R, Simpson WJ, et al. Medullary thyroid cancer: analyses of survival and prognostic factors and the role of radiation therapy in local control. Thyroid 1996, 6: 305–10.
- Dralle H, Damm I, Scheumann GFW, et al. Compartment-oriented microdissection of regional lymph nodes in medullary thyroid carcinoma. Surg Today 1994, 24: 112–21.
- Dralle H, Machens A. Surgical approaches in thyroid cancer and lymph-node metastases. Best Pract Res Clin Endocrinol Metab 2008, 22: 971-87.
- Gimm O, Ukkat J, Dralle H. Determinative factors of biochemical cure after primary and reoperative surgery for sporadic medullary thyroid carcinoma. World J Surg 1998, 22: 562-7; discussion 567-8.
- Marzano LA, Porcelli A, Biondi B, et al. Surgical management and follow-up of medullary thyroid carcinoma. J Surg Oncol 1995, 59: 162-8.
- Moley JF. Medullary thyroid carcinoma: management of lymph node metastases. J Natl Compr Canc Netw 2010, 8: 549-56.
- Fuchshuber PR, Loree TR, Hicks WL, et al. Medullary carcinoma of the thyroid: prognostic factors and treatment recommendations. Ann Surg Oncol 1998, 5: 81–6.
- Gharib H, McConahey WM, Tiegs RD, et al. Medullary thyroid carcinoma: clinicopathologic features and long-term follow-up of 65 patients treated during 1946 through 1970. Mayo Clin Proc 1992, 67: 934-40.
- Simpson WJ, Palmer JA, Rosen IB, Mustard RA. Management of medullary carcinoma of the thyroid. Am J Surg 1982,144: 420–2.
- Heerden JA Van, Grant CS, Gharib H, et al. Long-term course of patients with persistent hypercalcitoninemia after apparent curative primary surgery for medullary thyroid carcinoma. Ann Surg 1990, 212: 395–401.
- Kebebew E, Clark OH. Medullary thyroid cancer. Curr Treat Options Oncol 2000, 1: 359–67.
- Randolph GW, Maniar D. Medullary carcinoma of the thyroid. Cancer Control 2000, 7: 253–61.
- Shaha AR. Management of the neck in thyroid cancer. Otolaryngol Clin North Am 1998, 31: 823–31.
- Duh QY, Sancho JJ, Greenspan FS, et al. Medullary thyroid carcinoma. The need for early diagnosis and total thyroidectomy. Arch Surg (Chicago) 1989, 124: 1206–10.
- Franz MG. Medullary thyroid cancer: Etiology, diagnosis, treatment options, and testing for medullary thyroid cancer are reviewed. Cancer Control 1997, 4: 25–9.
- Lairmore TC, Wells SA. Medullary carcinoma of the thyroid: current diagnosis and management. Semin Surg Oncol 1991, 7: 92–9.
- Franc S, Niccoli-Sire P, Cohen R, et al. Complete surgical lymph node resection does not prevent authentic recurrences of medullary thyroid carcinoma. Clin Endocrinol 2001, 55: 403–9.
- Torresan F, Cavedon E, Mian C, et al. Long-term outcome after surgery for medullary thyroid carcinoma: a single-center experience. World J Surg 2018, 42: 367–75.
- Machens A, Dralle H. Biomarker-based risk stratification for previously untreated medullary thyroid cancer. J Clin Endocrinol Metab 2010, 95: 2655–63.
- Ellenhorn JD, Shah JP, Brennan MF. Impact of therapeutic regional lymph node dissection for medullary carcinoma of the thyroid gland. Surgery 1993, 114: 1078-81.
- Fleming JB, Lee JE, Bouvet M, et al. Surgical strategy for the treatment of medullary thyroid carcinoma. Ann Surg 1999, 230: 697–707.
- Elisei R, Romei C, Renzini G, et al. The timing of total thyroidectomy in RET gene mutation carriers could be personalized and safely planned on the basis of serum calcitonin: 18 years experience at one single center. J Clin Endocrinol Metab 2012, 97: 426–35.
- Torresan F, Censi S, Pennelli G, et al. Prophylactic and early thyroidectomy in RET germline mutation carriers in pediatric and adult population: long-term outcomes of a series of 63 patients. Cancers (Basel) 2022,14: 6226.
- Waguespack SG, Rich TA. Multiple endocrine neoplasia syndrome type 2B in early childhood. Long-term benefit of prophylactic thyroidectomy. Cancer 2010, 116: 2284.
- Brauckhoff M, Machens A, Lorenz K, et al. Surgical curability of medullary thyroid cancer in multiple endocrine neoplasia 2B. A changing perspective. Ann Surg 2014, 259: 800–6.
- Brauckhoff M, Gimm O, Weiss CL, et al. Multiple endocrine neoplasia 2B syndrome due to codon 918 mutation: clinical manifestation and course in early and late onset disease. World J Surg 2004, 28: 1305–11.
- Meijer JAA, le Cessie S, van den Hout WB, et al. Calcitonin and carcinoembryonic antigen doubling times as prognostic factors in medullary thyroid carcinoma: a structured meta-analysis. Clin Endocrinol 2010, 72: 534–42.
Gestione del carcinoma midollare recidivante
Sara Watutantrige Fernando1, Stefania Zovato1, Simona Censi2
1Unità Tumori Ereditari, Istituto Oncologico Veneto IRCCS, Padova;
2UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Università di Padova
(aggiornato a novembre 2024)
Gestione della malattia recidivante loco-regionale
Chirurgia loco-regionale. Pazienti con malattia recidivante o persistente al collo, in assenza di metastasi a distanza, sono candidati al trattamento chirurgico loco-regionale dei linfonodi/lesioni positive all’imaging, alla biopsia o alla misurazione della calcitonina da eluato.
Radioterapia esterna. La valutazione dell’efficacia dell’EBRT (external beam radiotherapy) adiuvante post-tiroidectomia è difficile per la mancanza di RCT. Il ricorso alla procedura per il controllo locale di malattia va attentamente ponderato, perchè re-intervenire chirurgicamente su un collo sottoposto a ERBT può essere molto difficoltoso. In genere, la procedura è riservata a pazienti selezionati con alta probabilità di recidiva tumorale dopo tiroidectomia, su decisione congiunta del chirurgo e del radioterapista o del team multi-disciplinare. Sembra comunque più efficace per il raggiungimento di un controllo di malattia loco-regionale che per migliorare la sopravvivenza (1).
Tipicamente si usano dosaggi di 60-66 Gy nel letto tiroideo, erogati nell’arco di circa 6 settimane.
La procedura è generalmente ben tollerata, sebbene sia gravata da una serie di potenziali tossicità acute (eritema cutaneo, mucositi, edema laringeo, odinofagia, con possibile ricorso alla PEG per la nutrizione durante la terapia) e croniche (iperpigmentazione cutanea, xerostomia, teleangectasia, trisma, danno ai grandi vasi e nervi del collo, raramente stenosi esofagea e tracheale).
Gestione della malattia metastatica a distanza
Metastasi a distanza sono presenti alla diagnosi nel 10% dei pazienti con MTC o compaiono nel corso del tempo nel 19-38% dei casi (2). Le attuali terapie sistemiche disponibili per la gestione dell’MTC non hanno comprovata efficacia sull’overall survival (OS). È fortemente raccomandata la gestione di questi pazienti all’interno di team multi-disciplinari.
Una terapia attiva (loco-regionale o sistemica) è in genere indicata per pazienti con malattia metastatica sintomatica, in caso di lesioni adiacenti a strutture vitali, in caso di massa tumorale molto estesa o progressione di malattia secondo i criteri RECIST v1.1 (3). A partire dal 2012 sono stati approvati farmaci inibitori di tirosin-kinasi, dapprima vandetanib e successivamente cabozantinib. L’approvazione di FDA ed EMA si è basata sulla capacità di incrementare la sopravvivenza libera da malattia (PFS, Progresson Free Survival). Questi due farmaci sono in grado di inibire RET, in qualche misura, ma la loro attività anti-tumorale si basa principalmente sull’inibizione multi-chinasica di fattori angiogenetici chiave, primo tra tutti il Vascular Endothelial Growth Factor Receptor Type 2 (VEGFR2).
Per quanto riguarda vandetanib, lo studio registrativo ZETA (4) ha confrontato il vandetanib (300 mg/die) al placebo (2:1) in 331 pazienti con MTC sintomatico e asintomatico, localmente avanzato o metastatico, non resecabile chirurgicamente. Nel braccio vandetanib, erano significativamente migliori la PFS (30.5 mesi vs 19.3 mesi) e l’ORR (Overall Response Rate) (45% vs 13%). La risposta radiologica era accompagnata anche da una risposta biochimica (con riduzione di CT del 69% e di CEA del 52%).
Vandetanib ha dimostrato efficacia indipendentemente dallo stato mutazionale somatico di RET, da pregressi trattamenti, dal sito metastatico e dall’entità della massa tumorale. Alla prima pubblicazione dei dati del trial ZETA non era stato dimostrato alcun vantaggio in termini di sopravvivenza e nessun aggiornamento è stato pubblicato successivamente. Per quanto riguarda i pazienti pediatrici, nei trial di fase I/II il vandetanib ha mostrato una risposta parziale nel 47% dei casi, con un profilo di effetti collaterali sovrapponibile a quello dell’adulto.
Una successiva rianalisi dei pazienti precedentemente definiti RET non mutati coinvolti nello studio EXAM e lo studio OBS14778 hanno dimostrato un'attività insufficiente di vandetanib in pazienti senza mutazioni RET identificate.
Vandetanib attualmente può essere utilizzato in prima linea solo nella malattia avanzata con mutazione RET somatica.
Per quanto riguarda cabozantinib, lo studio registrativo EXAM (5) ha confrontato cabozantinib (140 mg/die) con placebo (2:1) in 330 pazienti con MTC non operabile localmente avanzato o metastatico e in progressione radiografica entro 14 mesi prima dell’arruolamento (era permesso l’arruolamento di pazienti già trattati precedentemente con inibitori multi-chinasici, MKI). Cabozantinib ha dimostrato una PFS più lunga (11.2 vs 4.0 mesi) e un ORR maggiore (28% vs 0%), per una mediana di durata di risposta di 14.6 mesi. L’efficacia era dimostrata in tutti i sottogruppi, indipendentemente da età, localizzazione del tumore, massa tumorale, velocità di progressione, pregresso trattamento con MKI e stato mutazionale somatico di RET/RAS. I tassi di OS erano simili nei due bracci (26.6 vs 21.1 mesi). Nel sottogruppo con mutazione somatica di RET M918T l’uso di cabozantinib, rispetto al placebo, si associava a migliore OS (44.3 vs 18.9 mesi, P = 0.03) (6). Cabozantinib è oggi utilizzabile in prima linea nei pazienti con neoplasia avanzata che esprima o meno mutazione RET somatica.
Anche se entrambi i trial (ZETA ed EXAM) prendevano in considerazione pazienti con MTC metastatico localmente avanzato e/o in progressione, il disegno era differente. La PFS nel gruppo placebo di ZETA (19.3 mesi) rispetto al gruppo placebo di EXAM (4 mesi) suggerisce importanti differenze nei criteri di arruolamento. Infatti, a differenza dei pazienti arruolati per ZETA, i pazienti arruolati per EXAM dovevano rispettare i criteri RECIST per la progressione di malattia, suggerendo che il MTC fosse in stadio più avanzato. I risultati dei due studi non sono quindi comparabili e non vi sono evidenze a supporto dell'uso dell’uno o dell’altro farmaco in prima linea. Entrambi sono efficaci in prima o seconda linea (cioè in pazienti precedentemente trattati con altri MKI o no), hanno PFS comparabili ed efficacia indipendente dallo stato mutazionale RET/RAS. La scelta dell’uno o dell’altro potrebbe basarsi sulle comorbilità e sui possibili effetti collaterali. Ad ogni modo, cabozantinib ha mostrato una certa efficacia su PFS e OS nel sottogruppo di pazienti RET M918T-mutati o RAS-mutati. Inoltre, alcuni lavori in real-world suggeriscono per il vandetanib un’efficacia inferiore rispetto a quella dimostrata negli RCT in popolazioni selezionate (6).
Una decade dopo l’introduzione dei TKI si sono affermati gli inibitori selettivi di RET. L’ottima possibilità di impiego di questi farmaci anche nelle forme sporadiche, deriva dalla presenza di mutazioni somatiche di RET nel 60% di MTC e in oltre l’80% degli MTC metastatici.
Selpercatinib nello studio registrativo LIBRETTO-531 (7) ha migliorato in modo significativo la PFS e l’ORR rispetto a un MKI standard (cabozantinib o vandetanib) nei pazienti con MTC avanzato naïve ai MKI e portatori di mutazioni del gene RET. A un follow-up mediano di 12 mesi, la mediana di PFS non è stata raggiunta nel braccio trattato con selpercatinib (IC al 95% non stimabile), mentre è risultata di 16.8 mesi (IC 95% 12.2-25.1) nel braccio di controllo, trattato con il MKI; OR era 69.4% vs 38.8%. Selpercatinib è risultato inoltre meglio tollerato: si è registrata una riduzione di dose nel 38.8% dei trattati con selpercatinib vs 77.3% del gruppo di controllo. Selpercatinib è oggi utilizzabile in Italia solamente in seconda linea, nei pazienti RET mutati che abbiano già seguito una prima linea con cabozantinib o vandetanib.
Pralsetinib (inibitore selettivo di RET, VEGFR2, FGRF PDGFR) non è per ora utilizzabile in Italia.
Le linee guida NCCN (National Comprehensive Cancer Network) (11) ben chiariscono il contesto dell’utilizzo dei farmaci tirosin-kinasici e a bersaglio molecolare, sia nel contesto di malattia non resecabile che metastatica, sintomatica e asintomatica (tabella).
| Proposta di trattamento secondo le linee guida NCCN (adattato da 8) | ||||
| Malattia loco-regionale | La resezione chirurgica è la modalità di trattamento di scelta | |||
| L’EBRT dovrebbe essere preso in considerazione solo nel caso di malattia non resecabile non candidabile a terapia sistemica a bersaglio molecolare oppure, meno comunemente, dopo resezione chirurgica | ||||
| Considerare la terapia sistemica per malattia non resecabile sintomatica o in progressione secondo i criteri RECIST | Prima scelta | Vandetanib (livello di evidenza 1) | ||
| Cabozantinib (livello di evidenza 1) | ||||
| Selpercatinib (RET positivi) (livello di evidenza 1) | ||||
| Pralsetinib (RET positivi) (livello di evidenza 2B) | ||||
| Utili in determinate condizioni | Pembrolizumab (elevato carico mutazionale - TMB-H ≥ 10 mut/Mb o in caso di pazienti con tumori mutati in MSI-H o dMMR in progressione dopo trattamento pregresso in assenza di alternative soddisfacenti) | |||
| Monitoraggio di malattia | ||||
| Malattia recidivante o persistente, metastasi a distanza | Asintomatica | Monitoraggio di malattia | ||
| Prendere in considerazione resezione (se possibile), ablazione (radio-frequenza, embolizzazione, altre terapie regionali) | ||||
| Terapia sistemica se non resecabile o in progressione secondo i criteri RECIST | Prima scelta | Vandetanib (livello di evidenza 1) | ||
| Cabozantinib (livello di evidenza 1) | ||||
| Selpercatinib (RET positivi) (livello di evidenza 1); | ||||
| Pralsetinib (RET positivi) (livello di evidenza 2B) | ||||
| Utili in determinate condizioni | Pembrolizumab (TMB-H ≥ 10 mut/Mb o in caso di pazienti con tumori mutati in MSI-H o dMMR in progressione dopo trattamento pregresso in assenza di alternative soddisfacenti) | |||
| Sintomatica o in progressione | Terapia sistemica o trial clinico | Prima scelta | Vandetanib (livello di evidenza 1) | |
| Cabozantinib (livello di evidenza 1) | ||||
| Selpercatinib (RET positivi) (livello di evidenza 1) | ||||
| Pralsetinib (RET positivi) (livello di evidenza 2B) | ||||
| Altre scelte raccomandate | Altre piccole molecole inibitorie delle chinasi | |||
| Chemioterapia a base di dacarbazina | ||||
| Utili in determinate condizioni | Pembrolizumab (TMB-H ≥ 10 mut/Mb o in caso di pazienti con tumori mutati in MSI-H o dMMR in progressione dopo trattamento pregresso in assenza di alternative soddisfacenti) | |||
| EBRT per la palliazione di sintomi locali | ||||
| Valutare bisfosfonati ev o denosumab per le metastasi ossee | ||||
| Considerare terapie palliative chirurgiche, ablative (radio-frequenza, embolizzazione, altre terapie regionali) o altri trattamenti regionali | ||||
| Ottimizzare le terapie di supporto | ||||
Bibliografia
- Wells SA, Asa SL, Dralle Het al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Hadoux J, Schlumberger M. Chemotherapy and tyrosine-kinase inhibitors for medullary thyroid cancer. Best Pract Res Clin Endocrinol Metab 2017, 31: 335–47.
- Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009, 45: 228–47.
- Kreissl MC, Bastholt L, Elisei R, et al. Efficacy and safety of vandetanib in progressive and symptomatic medullary thyroid cancer: post hoc analysis from the ZETA trial. J Clin Oncol 2020, 38: 2773–81.
- Schlumberger M, Elisei R, Müller S, et al. Overall survival analysis of EXAM, a phase III trial of cabozantinib in patients with radiographically progressive medullary thyroid carcinoma. Ann Oncol 2017, 28: 2813–9.
- Trimboli P, Castellana M, Virili C, et al. Efficacy of vandetanib in treating locally advanced or metastatic medullary thyroid carcinoma according to RECIST criteria: a systematic review and meta-analysis. Front Endocrinol (Lausanne) 2018, 9: 224.
- Hadoux J, Elisei R, Brose MS, et al. Phase 3 trial of selpercatinib in advanced RET -mutant medullary thyroid cancer. N Engl J Med 2023, 389: 1851–61.
- Haddad RI, Bischoff L, Ball D, et al. Thyroid Carcinoma, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2022, 20: 925–51.
Follow-up del carcinoma midollare
Simona Censi
UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
Il follow-up si basa sulla valutazione biochimica e su quella strumentale, in primis l’ecografia, in seconda linea TC o RM collo e mediastino, TC torace, RM addome, RM rachide e pelvi, eventualmente scintigrafia scheletro; anche la PET, con diversi traccianti, sta assumendo un ruolo importante.
Nel post-operatorio va iniziata la terapia con L-tiroxina, che deve essere di tipo sostitutivo e non TSH–soppressivo, in quanto le cellule C para-follicolari non sono controllate dal TSH.
Monitoraggio della calcitonina
Dopo l’intervento chirurgico la CT si riduce gradualmente, in modo variabile e in alcuni pazienti il nadir di CT non viene raggiunto sino a oltre la 8°-12° settimana. Pertanto, l’indicazione è di effettuare il controllo post-operatorio non prima di 2-3 mesi (1). In presenza di CT basale indosabile/< 10 pg/mL e di ecografia del collo negativa, oggi si tende sempre più a non effettuare test di stimolo, non solo per la maggiore sensibilità dei metodi disponibili per il dosaggio di CT, ma anche perché in presenza di CT basale non dosabile, un rialzo dopo stimolo equivale a un volume molto piccolo di malattia residua, in pratica non individuabile con le varie metodiche di imaging, e quindi senza ricaduta utile ai fini terapeutici (1). Quindi, i livelli di CT e CEA andrebbero misurati a 3 mesi dall’intervento con tre possibili risultati:
- Livelli indosabili o entro i limiti di norma del laboratorio di riferimento: andrebbero valutati ogni 6 mesi per un anno e quindi annualmente.
- Livelli dosabili ≤ 150 pg/mL: generalmente sono espressione di malattia residua loco-regionale, raramente di presenza di metastasi a distanza, e in tal caso comunque di dimensioni e numero molto limitati, difficilmente rilevabili. La ricerca di malattia dovrebbe iniziare con un’ecografia del collo. In presenza di malattia residua e/o adenopatie sospette per metastasi, va eseguito FNA con dosaggio di CT sul liquido di lavaggio. Altre indagini utili a rilevare malattia residua/recidiva possono includere TC multistrato con mezzo di contrasto di collo, mediastino e torace, TC tri-fasica con mezzo di contrasto o RM con mezzo di contrasto epatiche, ecografia epatica (maggiore sensibilità se effettuata con mezzo di contrasto), scintigrafia scheletro, RM rachide lombare e bacino, 18F-DOPA-PET, 18F-FDG-PET. La sensibilità di queste procedure per la localizzazione di malattia metastatica varia dal 50% all’80%, anche a seconda dei livelli di CT, essendo inferiore nei casi di CT solo moderatamente elevata. In assenza di evidenza di malattia loco-regionale e con valori di CT < 150 pg/mL, le linee guida (LG) ATA (1) indicano come opzionale l’esecuzione di altre indagini di imaging oltre all’ecografia. In alternativa, procrastinare tali indagini in base all’incremento dei livelli di CT, considerato che per tali livelli di CT difficilmente si ha evidenza di malattia a distanza (raccomandazione grado C). I pazienti andranno comunque seguiti con controlli semestrali, comprendenti un’ecografia del collo e misurazione di CT e CEA. Per quanto riguarda i livelli di CT considerati negativi, seguendo le ultime LG ATA 2015 vi era ancora disaccordo in letteratura. Alcuni autori considerano la chirurgia curativa per livelli di CT basale o stimolata indosabili. Altri invece considerano curativa la chirurgia tiroidea anche quando i valori di CT basale o stimolata non superino 10 pg/mL. Successive pubblicazioni hanno testimoniato come l’esito di malattia sia migliore nei pazienti con CT indosabile rispetto a quelli con CT dosabile anche se entro i limiti del range del laboratorio.
- CT post-operatoria > 150 pg/mL richiede una valutazione diagnostica più approfondita. TC, RM, scintigrafia scheletrica sono tecniche diagnostiche consolidate in clinica, mentre è più recente l’introduzione della PET nello studio del MTC non guarito. Secondo alcuni studi, la 18F-DOPA-PET/TC e la 18F-FDG-PET/TC sarebbero superiori all’imaging convenzionale nel rilevare la presenza di metastasi a distanza (2-5).
CEA
Anche se i valori di CEA possono essere normali anche nei pazienti con malattia residua, il CEA ha comunque un ruolo importante come marcatore nel follow-up di MTC. Infatti, un incremento isolato del CEA, in presenza di livelli di CT stabili o in riduzione, può rivelare una progressione di malattia. Questo particolare comportamento è considerato caratteristico di una de-differenziazione dell’MTC. MTC in progressione con CT e CEA entrambi negativi sono aneddotici (6).
Tempo di raddoppiamento
Nel follow-up di un paziente con MTC residuo, a ogni controllo non bisogna considerare solo il valore assoluto di CT e CEA, ma anche il tempo di raddoppiamento di tali marcatori (DT, doubling time). Questo è espressione della progressione della neoplasia e rappresenta un elemento fondamentale per stabilire la tempistica dei controlli, le indagini da effettuare e il trattamento. Una stima affidabile del DT si può ottenere avendo a disposizione almeno 4 valori in un periodo di almeno due anni; tuttavia, DT < 6 mesi si possono stimare anche entro i 12 mesi dall’intervento (7). Il sito dell’ATA fornisce un calcolatore per i DT di CT e CEA: https://www.thyroid.org/professionals/calculators/thyroid-cancer-carcinoma/.
In uno studio retrospettivo su 65 pazienti trattati con tiroidectomia totale e dissezione linfonodale latero-cervicale bilaterale, con un tempo di follow-up post-chirurgico fino a 29.5 anni, la sopravvivenza a 5 e 10 anni risultava del 25% e dell’8% per DT della CT < 6 mesi, contro il 92% e il 37% dei pazienti con DT compresi tra 6 e 24 mesi (7). Tutti i pazienti con DT della CT > 24 mesi erano vivi al termine del follow-up. Il DT della CT si rivelava un fattore prognostico indipendente di sopravvivenza, indipendentemente dallo stadio di malattia. Inoltre, il DT della CT era un predittore migliore di sopravvivenza rispetto al DT del CEA (7).
Dalla meta-analisi di Meijer et al (8) emerge che DT < 12 mesi riflette un maggiore rischio di decesso (HR 21.52 per CT e infinito per CEA) e di recidiva di malattia (HR 5.3 per CT e 6.89 per CEA). Il DT di entrambi i marcatori è un indicatore prognostico molto forte di recidiva e decesso MTC-correlato, con valore predittivo più elevato per il CEA.
I pazienti con CT dosabile ma senza evidenza di lesioni devono effettuare ogni 6 mesi il dosaggio di CT e CEA per stabilire il DT: i controlli successivi (biochimici e clinici) dovrebbero essere effettuati a cadenza pari ad ¼ del DT o con frequenza annuale (9). Tutte le misurazioni dovrebbero essere eseguite nello stesso laboratorio, utilizzando lo stesso kit per la misurazione della CT (10).
Indagini strumentali
La 18F-DOPA-PET/TC sembrerebbe avere maggiore sensibilità rispetto alla 18F-FDG-PET/TC, che però correlerebbe meglio con l’aggressività di malattia e l’esito negativo. La sopravvivenza è infatti significativamente inferiore nei pazienti 18F-FDG-PET/TC positivi rispetto ai pazienti 18F-FDG-PET/TC negativi. Si può quindi concludere come le due metodiche possano essere considerati complementari, essendo l’una più sensibile nel rilevare malattia a distanza (18F-DOPA-PET/TC) e l’altra più abile a indentificare la malattia in progressione (18F-FDG-PET/TC).
La 68Ga-DOTATOC o DOTANOC PET/TC, analogamente alla scintigrafia con 111In-pentetreotide, è poco sensibile nel follow-up e nello staging dell’MTC e non sembra aggiungere informazioni diagnostiche rispetto alla PET con gli altri due traccianti (5). Può essere utile per valutare l’espressione dei recettori della somatostatina ed esplorare la possibilità di un eventuale trattamento radiorecettoriale con 90Y-DOTATOC o 177Lu-DOTATATE (10).
Valutazione del rischio di recidiva/persistenza di malattia
Il TNM fornisce una valida indicazione del rischio di decesso malattia-correlato, senza fornire indicazioni sul rischio di recidiva/persistenza di malattia. Ciò ha portato alcuni autori a proporre una stratificazione del rischio per l’MTC basata sulla risposta alla terapia iniziale, sul modello di quella utilizzata per il carcinoma differenziato. Questo sistema di classificazione del rischio avrebbe anche il vantaggio di permettere, oltre che una stima della mortalità malattia-associata, anche una stima del rischio di recidiva/persistenza di malattia (11). In base ai valori di CT e CEA misurati entro il primo anno dalla chirurgia (la tempistica ottimale è da definire, ma compresa tra i 2-3 e i 6-12 mesi dall’intervento) e in base ai riscontri radiologici, i pazienti possono essere suddivisi nelle seguenti categorie:
- risposta eccellente (ER): è definita in presenza di CT indosabile, con CEA nel range di norma e in assenza di evidenza strutturale di malattia;
- risposta biochimica incompleta (BiR): è definita in presenza di CT dosabile o CEA al di sopra del range, in assenza di evidenza strutturale di malattia;
- risposta strutturale incompleta (SiR): è definita in presenza di evidenza strutturale di malattia, indipendentemente dai livelli di CT e CEA.
Mentre in caso di ER si stima un rischio di recidiva strutturale < 8.5% (11), vari studi attribuiscono un rischio molto più consistente in caso di BiR, attorno al 25-44% (12,13). Risulta quindi evidente come il livello di CT, in assenza di lesioni compatibili con persistenza di malattia strutturale, possa modificare la prospettiva del rischio di recidiva ed essere da guida per il clinico nel programmare i successivi monitoraggi. Nel contesto della malattia BiR, i fattori di rischio che influenzano la maggior probabilità di malattia strutturale nel corso del follow-up risultano: il sesso maschile, la presenza di minima estensione extra-tiroidea, le maggiori dimensioni del tumore primitivo, la presenza di interessamento linfonodale (N1a+N1b, il solo N1a non risulta un fattore di rischio), lo status di T4, lo stadio IV, maggiori livelli di CT e il tempo di raddoppio della CT ≤ 24 mesi (questi ultimi tre come fattori di rischio indipendente) (7).
Terapia farmacologica del carcinoma midollare
BIBLIOGRAFIA
- Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Beheshti M, Pöcher S, Vali R, et al. The value of 18F-DOPA PET-CT in patients with medullary thyroid carcinoma: comparison with 18F-FDG PET-CT. Eur Radiol 2009, 19: 1425–34.
- Luster M, Karges W, Zeich K, et al. Clinical value of 18-fluorine-fluorodihydroxyphenylalanine positron emission tomography/computed tomography in the follow-up of medullary thyroid carcinoma. Thyroid 2010, 20: 527-33.
- Kauhanen S, Schalin-Jäntti C, Seppänen M, et al. Complementary roles of 18F-DOPA PET/CT and 18F-FDG PET/CT in medullary thyroid cancer. J Nucl Med 2011, 52: 1855-63.
- Treglia G, Castaldi P, Villani MF, et al. Comparison of 18F-DOPA, 18F-FDG and 68Ga-somatostatin analogue PET/CT in patients with recurrent medullary thyroid carcinoma. Eur J Nucl Med Mol Imaging 2012, 39: 569-80.
- Censi S, Manso J, Mian C. Other markers of medullary thyroid cancer, not only calcitonin. Eur J Endocrinol 2023, 188: R1-13.
- Barbet J, Campion L, Kraeber-Bodéré F, et al. Prognostic impact of serum calcitonin and carcinoembryonic antigen doubling-times in patients with medullary thyroid carcinoma. J Clin Endocrinol Metab 2005, 90: 6077-84.
- Meijer JAA, Le Cessie S, Van Den Hout WB, et al. Calcitonin and carcinoembryonic antigen doubling times as prognostic factors in medullary thyroid carcinoma: a structured meta-analysis. Clin Endocrinol (Oxf) 2010, 72: 534–42.
- Elisei R, Pinchera A. Advances in the follow-up of differentiated or medullary thyroid cancer. Nat Rev Endocrinol 2012, 8: 466–75.
- Filetti S, Durante C, Hartl D, et al. Thyroid cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019, 30: 1856–83.
- Lindsey SC, Ganly I, Palmer F, et al. Response to initial therapy predicts clinical outcomes in medullary thyroid cancer. Thyroid 2015, 25: 242-9.
- Fanget F, Demarchi MS, Maillard L. Medullary thyroid cancer outcomes in patients with undetectable versus normalized postoperative calcitonin levels. Br J Surg 2021, 108: 1064-71.
- Prete A, Gambale C, Torregrossa L. Clinical evolution of sporadic medullary thyroid carcinoma with biochemical incomplete response after initial treatment. J Clin Endocrinol Metab 2023, 108: e613-22.
Clinica e diagnosi del carcinoma tiroideo anaplastico
Daniele Barbaro
Sezione Endocrinologia, ASL 6, Livorno
(aggiornato al 29 gennaio 2019)
Il carcinoma tiroideo anaplastico (CA) costituisce una delle più aggressive e letali neoplasie solide. Rappresenta attualmente circa l'1-2% dei carcinomi tiroidei e vi è un trend di diminuzione relativa, probabilmente legato all'incremento di incidenza delle forme differenziate (1). Nonostante questo, il carcinoma anaplastico è responsabile del 50% della mortalità annua per carcinoma tiroideo.
È un tumore tipico dell'età avanzata, con picco nella 7° decade, ma sono riportati, e anche l'esperienza del nostro centro lo conferma, casi in età < 50 anni. L'incidenza è lievemente maggiore nelle femmine, con un rapporto femmine:maschi che, a secondo delle casistiche, varia fra 3:1 a 1.2 :1.
La modalità di presentazione classica è un nodulo o una massa dura in rapida espansione, talora su un vecchio gozzo nodulare pre-esistente. Solitamente il paziente riferisce una crescita nell'arco di giorni/settimane, talora rapidamente associata ad altri sintomi infiltrativi, quali raucedine e disfagia. La neoplasia è metastatica alla diagnosi in circa il 50% dei casi, più frequentemente al polmone, seguita da ossa e cervello (1).
Costituiscono elementi prognostici sfavorevoli (2):
- presenza di sintomi acuti;
- dimensioni del tumore > 5 cm;
- metastasi a distanza;
- leucocitosi > 10.000/µL.
Nelle varie casistiche le mediana di sopravvivenza è 3-4 mesi, la sopravvivenza a un anno è < 10% e i casi riportati di lunghe sopravvivenze (> 10 anni) sono eccezionali, con il dubbio dell'attendibilità della diagnosi di partenza.
Fattori di rischio e aspetti patogenetici
Non sono noti fattori di rischio particolari. Come già detto, la maggioranza dei carcinomi anaplastici insorge su un gozzo pre-esistente e il tumore è più frequente nelle aree a basso apporto iodico. In uno studio recente è stato dimostrato che la supplementazione iodica ha diminuito l'incidenza di tale tumore (3). Almeno una parte dei carcinomi anaplastici insorge su precedenti carcinomi tiroidei differenziati (follicolare o papillare), anche se il motivo e la frequenza di questa conversione sono sconosciuti. Nei carcinomi tiroidei differenziati possono essere presenti varie mutazioni puntiformi di proto-oncogeni implicati nella cascata MAP-kinasi e P13K-AKT. Fra queste nei casi in cui il tumore insorge per sdifferenziazione di un carcinoma papillare e follicolare si può trovare una mutazione del proto-oncogene BRAF e RAS (in percentuali rispettivamente del 26% e 22%, dati medi della letteratura). La mutazione del gene TERT (recentemente individuata nelle forme differenziate più aggressive) è presente nel carcinoma anaplastico in percentuali fino al 70%. Mutazioni più specifiche sono quella del gene onco-soppressore p53 e di alcuni oncogeni coinvolti nel sistema di segnale Wnt e nell'adesione intercellulare (ß1-catenina) e nel gene dell'Axina 1. Non è noto quali di queste mutazioni (da sola o combinata) contribuisca all'eccezionale aggressività del tumore (4).
Clinica e diagnosi
Il reperto palpatorio è di un nodulo o di una massa dura e talora possono presentarsi quadri pseudo-infiammatori con dolore locale.
L'ecografia mette chiaramente in evidenza i caratteri tipici del nodulo maligno, quali soprattutto l'ipoecogenicità marcata con margini indistinti.
Seppur la diagnosi si basi ovviamente sul reperto del FNA (talora corroborata da una large needle biopsy con un tru-cut), l’anamnesi di crescita rapida (nell'arco di giorni/settimane) con un reperto ecografico del tipo sopra descritto deve far porre un fortissimo sospetto di carcinoma anaplastico e dunque andranno accelerate le procedure diagnostiche, quali appunto l'FNA e una TAC del collo che potrà essere di aiuto al chirurgo.
Anche se la TAC del torace e la diagnostica per immagini in generale potranno darci informazioni circa la diffusione della malattia e certo dovranno far parte della stadiazione, tali procedure diagnostiche non dovrebbero ritardare la pianificazione generale della strategia e in particolare l'intervento chirurgico, che, ove possibile, può rappresentare la prima tappa terapeutica.
In alcuni casi potrà essere pianificato un iniziale trattamento chemio-radioterapico e dunque la diagnosi dovrà essere citologica ed ovviamente certa. La conferma bioptica potrà essere fatta qualora si programmi l'esecuzione di stomia con l'inserimento di cannula tracheale, altrimenti potrà convenire iniziare subito il trattamento se vi è una ragionevole certezza.
I preparati citologici di un carcinoma anaplastico della tiroide sono, a piccolo ingrandimento, riccamente cellulati e necrotici. Le cellule sono organizzate in piccoli clusters o se non coese, presenti come elementi singoli. Ad alto ingrandimento le cellule sono grandi, con aspetto squamoide e fusato o possono presentarsi come cellule giganti multi-nucleate. Spesso si osserva una commistione di tali caratteristiche. I nuclei sono marcatamente pleomorfi, con cromatina addensata e macro-nucleoli. Talora si possono apprezzare inclusioni citoplasmatiche intra-nucleari e abbondanti mitosi atipiche. Occasionalmente, la necrosi e l’infiammazione possono nascondere gli elementi neoplastici; tuttavia, la presenza della necrosi deve sempre far nascere il dubbio che possa trattarsi di un carcinoma indifferenziato (5,6).

Carcinoma anaplastico (ingrandimento 40 X, colorazione Papanicolau). Organizzazione prevalentemente a cellule singole giganti, di aspetto fusato e squamoide. Cortesia del Dr. Roberto Incesati U.O. Anatomia Patologica Livorno
In un numero rilevante di preparati citologici, si possono osservare elementi neoplastici con le caratteristiche del carcinoma papillare o follicolare, confermando la derivazione della neoplasia da pre-esistenti carcinomi ben differenziati. Vale la pena di considerare che qualunque carcinoma differenziato con aree di CA deve essere considerato CA.
La diagnosi differenziale per il carcinoma anaplastico comprende il carcinoma midollare, la patologia metastatica, i linfomi e i sarcomi.
Il carcinoma midollare può avere aspetti citologici comuni al carcinoma anaplastico, come l’ipercellularità, l’organizzazione a cellule singole e la morfologia fuso-cellulare. Nel dubbio il dosaggio della calcitonina plasmatica e sul lavaggio del FNA potrà dirimere facilmente il quesito.
Anche i tumori metastatici devono essere sempre considerati nella diagnosi. Le neoplasie che più frequentemente metastatizzano alla tiroide sono renali, coliche, polmonari, mammarie, melanoma, linfoma e carcinomi squamo-cellulari di testa-collo. Le metastasi tiroidee si possono presentare come grosse masse che sovvertono completamente la ghiandola, noduli multipli o singoli. Oltre agli aspetti morfologici che rimandano al tumore primitivo, la storia clinica e la presenza di elementi neoplastici tiroidei ben differenziati possono essere utili per considerare o escludere una metastasi. In questi casi, l’ausilio delle colorazioni immuno-citochimiche (citocheratine, TTF-1, tireoglobulina) può essere essenziale per formulare la corretta diagnosi, sebbene in alcuni carcinomi anaplastici l’espressione immunocitochimica di tali molecole possa essere persa. Tali colorazioni sono fondamentali anche nella diagnosi differenziale con il linfoma a grandi cellule, la cui morfologia simula, insieme alla presenza di ricca necrosi, il carcinoma tiroideo indifferenziato. Nelle cellule di derivazione linfoide saranno comunque presenti marcatori immuno-citochimici peculiari, quali CD20 e Bcl2.
In caso di concreto dubbio diagnostico, dopo l’FNA possono essere proposte tecniche con “large needle” ed in particolare con l’ago Tru-Cut. Peraltro, l’ampia eterogeneità cellulare del carcinoma anaplastico e l'ampia necrosi, fa sì che non necessariamente un singolo prelievo anche con Tru-Cut, campioni risultati che diano certezza assoluta. Considerata dunque anche la discreta invasività della metodica, si ritiene che essa debba essere riservata qualora multipli FNA non consentano un sufficiente orientamento diagnostico.
Qualunque carcinoma differenziato con aree anaplastiche deve essere considerato carcinoma anaplastico e tutti i carcinomi anaplastici sono considerati fin dall'inizio come stadio IV dall'American Joint Committee on Cancer TNM staging. In particolare nell’8° edizione del 2016 si distinguono stadi:
- IVa per i casi apparentemente intra-tiroidei;
- IVb per quelli con diffusione linfonodale;
- IVc quelli con metastasi a distanza.
La stadiazione della malattia sarà fatta con i metodi classici di diagnostica per immagini e se possibile potrà essere eseguita una PET/TC, che nei casi a evoluzione più favorevole potrà essere anche di ausilio nel follow-up (7).
Bibliografia
- Nagaiah G, Hossain A, Mooney CJ, et al. Anaplastic thyroid cancer: a review of epidemiology, pathogenesis and treatment. J Oncol 2011, 2011: 542358.
- Sugitani I, Kasai N, Fujimoto Y, et al. Prognostic factors and therapeutic strategy for anaplastic carcinoma of the thyroid. World J Surg 2001, 25: 617–22.
- Besic N, Hocevar M, Zgajnar J. Lower incidence of anaplastic carcinoma after higher iodination of salt in Slovenia. Thyroid 2010, 20: 623–6.
- Smallridge RC, Marlow LA, Copland JA. Anaplastic thyroid cancer: molecular pathogenesis and emerging therapies. Endocr Relat Cancer 2009, 16: 17–44.
- Giuffrida D, Gharbi H. Anaplastic thyroid carcinoma: current diagnosis and treatment. Ann Oncol 2000, 11: 1083–9.
- Lo C, Lam K, Wan K. Anaplastic carcinoma of the thyroid. Am J Surg 1999, 177: 337–9.
- Poisson T, Deandreis D, Leboulleux S, et al. 18F-Fluorodeoxyglucose positron emission tomography and computed tomography in anaplastic thyroid cancer. Eur J Nucl Med Mol Imaging 2010, 37: 2277–85.
Terapia del carcinoma tiroideo anaplastico
Daniele Barbaro
Sezione Endocrinologia, ASL 6, Livorno
(aggiornato al 29 gennaio 2019)
Il trattamento del carcinoma anaplastico è frustrante, non solo per la pessima prognosi in termini di sopravvivenza, ma anche perchè può accadere che durante le tempistiche richieste per la programmazione della strategia terapeutica il tumore mostri una tale progressione da compromettere le possibilità di trattamento che ci eravamo prefissati. Un trattamento multimodale aggressivo, se possibile, rappresenta l'unica strategia, ma attualmente non esiste alcuna linea guida o alcun trattamento che possa essere considerato di riferimento, così come non vi è alcun consenso circa la sequenzialità dei vari trattamenti.
La chirurgia, ove possibile, rappresenta senz'altro un punto fondamentale della terapia loco-regionale che, indipendentemente dal fatto che la malattia sia metastatica, gioca un ruolo decisivo, visto che l'ostruzione delle vie aeree superiori può essere una della cause di morte. La chirurgia può avere ruoli diversi. Nei casi di stadio IVa può avere un’apparente radicalità, mentre negli stadi successivi lo scopo della chirurgia potrà essere solo di riduzione della massa; in alcuni casi sarà invece possibile poco più di una biopsia, che permetterà comunque una verifica istologica e il successivo posizionamento di una cannula tracheale. Vi sono studi in cui l'intervento chirurgico è stato eseguito dopo radio-chemoterapia, che in alcuni casi ha permesso migliori possibilità chirurgiche. In uno studio in 22 pazienti consecutivi la scelta fu di postporre la chirurgia in tutti i pazienti dopo radioterapia iperfrazionata (1.6 Gy x 2 volte al dì, per una dose totale di 46 Gy) e doxorubicina (20 mg/m2 settimanali) fino alla chirurgia eseguita dopo 3 settimane. In quello studio nei 17 pazienti che poterono eseguire l'intervento chirurgico non vi fu alcuna recidiva loco-regionale (1). Appare comunque ragionevole suggerire che la chirurgia debba essere il primo passo se vi è una possibilità di rimozione totale o comunque di importante riduzione della massa.
Fino ad alcuni anni fa le terapie successive all’intervento erano radioterapia e chemioterapia. Gli studi riguardanti l'utilizzo della radioterapia da sola non sembrano mostrare alcun beneficio, pertanto tale opzione è da prendere in considerazione nei casi di pazienti anziani in cui non si intravedano altre forme di trattamento. Pochi studi sembrerebbero mostrare un beneficio della sola radioterapia eseguita a dose piena; in uno di questi non è stata notata differenza di efficacia e tossicità fra il trattamento standard tridimensionale e la radioterapia a intensità modulata (IMRT) (2). Nella maggioranza degli studi, comunque, la radioterapia suggerita è iperfrazionata, vista l'alta velocità di proliferazione della neoplasia.
Il trattamento radio-chemioterapico ha mostrato in vari studi una maggiore evidenza di beneficio. Dalla fine degli anni '80 ad oggi vi sono poco più di 30 studi principali riguardanti varie strategie radio-chemioterapiche (3), ma purtroppo i più sono retrospettivi e con numerosità limitata. Uno dei farmaci più usati e fra i primi storicamente utilizzati è la doxorubicina, per cui già una revisione pubblicata nel 1987 aveva evidenziato una risposta (remissione parziale o stabilizzazione di malattia) nel 22% dei casi, peraltro di breve durata (4). Vari studi anche recenti ne confermano il possibile utilizzo in associazione al cisplatino, in trattamenti multimodali con radioterapia iperfrazionata. Fra questi vi è lo storico “IGR protocol” utilizzato all'Istituto Gustave Roussy di Parigi: doxorubicina (sia in schemi settimanali che trisettimanali) e cisplatino (120 mg/m2 ogni tre settimane), due cicli prima della radioterapia iperfrazionata (1.25 Gy per due volte al dì per 5 gg /settimana fino ad una dose totale di 40 Gy), seguita poi da altri 4 cicli di chemioterapia (5,6). Uno studio prospettico su 30 soggetti con questo schema ha mostrato una sopravvivenza ad un anno del 46% e a 3 anni del 27% (7). Peraltro, in un altro studio prospettico i risultati non sono stati altrettanto buoni (8). Uno studio retrospettivo multimodale su 44 pazienti con doxorubicina (60 mg/m2) più cisplatino (100 mg/m2) ogni tre settimane ha confermato un buon risultato in termini di risposta completa (31.8%) e di risposta parziale (18.2%), con una sopravvivenza mediana dei responders di 28.4 mesi contro i 5.1 mesi dei non responders (9). I tempi di sopravvivenza più lunghi si avevano nei soggetti in cui era stata possibile un’apparente radicalità. Un lavoro retrospettivo sulla banca dati del Memorial Sloan Kettering Cancer Center in 37 pazienti trattati con doxorubicina a bassa dose (10 mg/m2 settimana) e radioterapia iperfrazionata (dose mediana 57.6 Gy) ha evidenziato una sopravvivenza ad un anno solo del 28% (10).
Altri farmaci utilizzati in vari studi sono i taxani. Già nel 2000 una segnalazione riguardava il possibile utilizzo del paclitaxel (11). Il farmaco somministrato in 20 pazienti, già trattati chirurgicamente e con radioterapia, aveva ottenuto il 53% di risposte obiettive, con sopravvivenza mediana però di soli 6 mesi. Uno studio retrospettivo (12), su soli 6 pazienti, ha confermato l’efficacia dopo chirurgia decompressiva di radioterapia (2 Gy/die fino a 60 Gy) e docetaxel (iniziato entro 7 giorni dalla radioterapia, alla dose di 100 mg ogni 3 settimane per 6 cicli).
Un altro farmaco, che sembrava aver mostrato efficacia in fase 1, è la fosbretabulina, ma lo studio di fase 2 ha mostrato una sopravvivenza mediana di soli 4.7 mesi (13).
Allo stato attuale delle cose è difficile consigliare un trattamento piuttosto che un altro e probabilmente per il carcinoma anaplastico è opportuna una strategia multimodale personalizzata, che deve vedere lavorare in equipe l'endocrinologo, il chirurgo, l'oncologo e il radioterapista (14).
Terapie emergenti
Consultando il sito ClinicalTrials.Gov si trovano 33 trial registrati in varie fasi. Molti di essi riguardano gli inibitori multi-kinasici (principalmente lenvatinib e sorafenib, ma anche sunitinib, pazopanib, gefinitib e PLX108-01) ma alcuni riguardano l’utilizzo di farmaci immuno-oncologici (15). Sono inoltre riportate strategie multimodali con chemioterapici classici più radioterapia e trattamenti con meccanismi di azione diversi. Si rimanda al sito per maggiori informazioni, ma bisognerà aspettare ancora per capire se vi potrà essere un possibile utilizzo di queste nuove strategie. Segnalazioni in letteratura abbastanza consistenti sembrerebbero mostrare comunque un’efficacia del lenvatinib (16,17) e l’esperienza personale su due casi in trattamento conferma una possibile efficacia di tale farmaco:
- in un paziente trapiantato renale e immuno-depresso, stadio IVa, trattato chirurgicamente con modesto residuo di malattia, la malattia ha avuto remissione loco-regionale ma dopo 8 mesi è comparsa una metastasi cerebrale e l’exitus è avvenuto per complicanza bronco-polmonare post-intervento;
- in un altro caso, stadio IVc, la terapia ha arrestato il decorso tumultuoso e, sottoposta a tiroidectomia totale, la paziente è in remissione parziale dopo ben 13 mesi.



Metastasi polmonare pre-terapia (in alto), dopo 3 mesi (al centro) e dopo 6 mesi (in basso)
Per il sorafenib vi è un’evidenza di efficacia in uno studio in fase 2 (18).
Alcuni studi in vitro e in vivo nell'animale hanno mostrato possibili sviluppi della terapia genica, con trasferimento di geni onco-soppressori, inibizione di oncogeni, geni suicidio o geni stimolanti la risposta immune. Riguardo alla terapia genica, l'unico lavoro pubblicato sull'uomo risale al 2005: l'inoculazione locale di un retro-virus trasportatore del gene umano IL-2 più un gene suicidio (gene timidin-kinasi dell'Herpes 1), seguito da trattamento con ganciclovir aveva mostrato necrosi del tessuto tumorale (19). Peraltro, il successivo decesso dei pazienti per problematiche cardio-vascolari aveva indotto uno stop del proseguio delle sperimentazioni.
Alcune conclusioni pratiche
La prognosi del carcinoma anaplastico continua ad essere severa e tuttora la risposta ai vari trattamenti, globalmente considerati, è di poco > 20%, dunque certamente vi è urgente bisogno di nuove strategie.
Per il carcinoma anaplastico una diagnosi quanto più precoce possibile è l'unica possibilità per evitare una mortalità pressochè certa. Vista la straordinaria velocità di crescita e la rarità di questo tumore, purtroppo è impossibile un'ipotesi praticabile di screening. Vi sono però alcune considerazioni pratiche. Come detto, il carcinoma anaplastico insorge spesso su un gozzo multinodulare di lunga durata e inoltre in molti casi rappresenta una sdifferenziazione di un carcinoma tiroideo differenziato. Nella metà dei casi giunti alla nostra osservazione, incredibilmente i pazienti erano portatori di gozzo in cui non era mai stato eseguito un agoaspirato. In un caso giunto alla nostra osservazione per gozzo, un FNA su uno dei noduli aveva mostrato una citologia micro-follicolare con sporadici grooves e atipie. Dopo circa due anni la paziente, che non aveva seguito l’indicazione chirurgica, si è ripresentata per la rapida crescita, nell'arco di settimane, del nodulo. In un fortunatissimo caso invece l'FNA ha permesso una diagnosi di sospetto e l'istologia post-chirurgica ha confermato la diagnosi di carcinoma anaplastico di 0.9 mm per verosimile sdifferenziazione di un papillare. Il paziente è vivo a 8 anni senza segni di ripresa e senza avere eseguito alcuna terapia radio-chemioterapica.
Dunque un consiglio pratico può essere quello di seguire con giusta attenzione i pazienti con gozzo nodulare e sforzarsi di eseguire e/o ripetere un FNA in caso di noduli ecograficamente sospetti o che mostrino crescita e modifica delle caratteristiche ecografiche.
In caso di diagnosi di carcinoma anaplastico siamo sostanzialmente di fronte a uno dei pochi tumori solidi che rappresentano un’emergenza oncologica e l'approccio multimodale sovra-descritto ma con sequenzialità individualizzata dovrà essere il più rapido possibile. La terapia con farmaci inibitori multi-kinasici è da considerare per le forme non suscettibili di intervento chirurgico o con ripresa di malattia.
Ringraziamento: si ringraziano per la parte citopatologica la Dott.ssa Elisa Proietti e il Prof F. Basolo, dell'U.O. Anatomia Patologica di Pisa
Bibliografia
- Wallin G, Lundell G, Tennvall J. Anaplastic giant cell thyroid carcinoma. Scand J Surg 2004, 93: 272–7.
- Bhatia A, Rao A, Ang KK, et al. Anaplastic thyroid cancer: clinical outcomes with conformal radiotherapy. Head Neck 2010, 32: 829–36.
- Nagaiah G, Hossain A, Mooney CJ, et al. Anaplastic thyroid cancer: a review of epidemiology, pathogenesis and treatment. J Oncol 2011, 2011: 542358.
- Ahuja S, Ernst H. Chemotherapy of thyroid carcinoma. J Endocrinol Invest 1987, 10: 303-10.
- De Crevoisier R, Baudin E, Bachelot A, et al. Combined treatment of anaplastic thyroid carcinoma with surgery, chemotherapy, and hyperfractionated accelerated external radiotherapy. Int J Radiat Oncol Biol Phys 2004, 60: 1137–43.
- Vrbic S, Pejcic I, Vrbic M, et al. Therapy of stage IV B anaplastic thyroid carcinoma: single institution experience. J BUON 2009, 14: 41–4.
- Tennvall J, Lundell G, Wahlberg P, et al. Anaplastic thyroid carcinoma: three protocols combining doxorubicin, hyperfractionated radiotherapy and surgery. Br J Cancer 2002, 86: 1848–53.
- Swaak–Kragten AT, de Wilt JH, Schmitz PI, et al. Multimodality treatment for anaplastic thyroid carcinoma – Treatment outcome in 75 patients. Radiother Oncol 2009, 92: 100-4.
- Derbel O, Limem S, Ségura-Ferlay C, et al. Results of combined treatment of anaplastic thyroid carcinoma (ATC). BMC Cancer 2011, 11: 469.
- Sherman EJ, Lim SH, Ho AL, et al. Concurrent doxorubicin and radiotherapy for anaplastic thyroid cancer: a critical re-evaluation including uniform pathologic review. Radiother Oncol 2011, 101: 425–30.
- Ain KB, Egorin JM, DeSimone PA. Treatment of anaplastic thyroid carcinoma with paclitaxel: phase 2 trial using ninety-six-hour infusion. Collaborative Anaplastic Thyroid Cancer Health Intervention Trials (CATCHIT) Group. Thyroid 2000, 10: 587–94.
- Troch M, Koperek O, Scheuba C, et al. High efficacy of concomitant treatment of undifferentiated (anaplastic) thyroid cancer with radiation and docetaxel. J Clin Endocrinol Metab 2010, 95: E54–7.
- Mooney CJ, Nagaiah G, Wasman JK, et al. A phase II trial of fosbretabulin in advanced anaplastic thyroid carcinoma and correlation of baseline serum – soluble intracellular adhesion molecule – 1 with outcome. Thyroid 2009, 19: 233–4.
- Chen J, Tward JD, Shrieve DC, et al. Surgery and radiotherapy improves survival in patients with anaplastic thyroid carcinoma: analysis of the surveillance, epidemiology, and end results 1983 – 2002. Am J Clin Oncol 2008, 31: 460–4.
- Valerio L, Pieruzzi L, Giani C, et al. Targeted therapy in thyroid cancer: state of the art. Clin Oncol (R Coll Radiol) 2017, 29: 316-24.
- Iñiguez-Ariza NM, Ryder MM, Hilger CR, Bible KC. Salvage lenvatinib therapy in metastatic anaplastic thyroid cancer. Thyroid 2017, 27: 923-7.
- Tahara M, Kiyota N, Yamazaki T, et al. Lenvatinib for anaplastic thyroid cancer. Front Oncol 2017, 7: 25.
- Savvides P, Nagaiah G, Lavertu P, et al. Phase II trial of sorafenib in patients with advanced anaplastic carcinoma of the thyroid. Thyroid 2013, 23: 600-4.
- Barzon L, Pacenti M, Taccaliti A, et al. A pilot study of combined suicide/cytokine gene therapy in two patients with end – stage anaplastic thyroid carcinoma. J Clin Endocrinol Metab 2005, 90: 2831–4.
Linfoma tiroideo
Franco Angelini & Filomena Graziano
UOC di Oncologia e Ematologia & UOC di Endocrinologia e Malattie Metaboliche, Ospedale Regina Apostolorum, Albano Laziale, Roma
Il linfoma primitivo della tiroide, anche se raro, deve essere preso in considerazione nella diagnosi differenziale dei pazienti affetti da gozzo e neoformazioni tiroidee in accrescimento progressivo, soprattutto se associato ad un quadro clinico ed ecografico di tiroidite.
Solo il 2% dei linfomi extra-nodali colpisce la tiroide e il linfoma rappresenta meno dell'1% dei tumori maligni della tiroide. Insorge con frequenza maggiore nel sesso femminile (F:M = 3-4:1) e il suo picco di incidenza si manifesta in età relativamente avanzata, tra i 65 e i 75 anni (1,2).
Eziologia
Il solo fattore di rischio conosciuto per il linfoma è rappresentato da una pre-esistente tiroidite cronica autoimmune, in circa la metà dei pazienti. I pazienti con tiroidite hanno un rischio di ammalarsi di linfoma tiroideo 40-80 volte superiore rispetto alla popolazione generale, con una latenza media di circa 30 anni rispetto alla diagnosi della malattia tiroidea. L'evoluzione della tiroidite di Hashimoto verso il linfoma, tipicamente MALT (“mucosa-associated limphoid tissue”), può verificarsi fino allo 0.5% dei casi ed è generalmente caratterizzata da un decorso insidioso.
La presenza nella tiroidite cronica di una ricca popolazione linfocitaria può fornire il substrato in cui un clone maligno si può sviluppare a seguito di una non meglio definita condizione di stimolazione antigenica cronica (1,3,4). A conferma di tale ipotesi sono il riscontro di aree di transizione fra un'iperplasia linfoide reattiva e aree di ben definito linfoma e la presenza di un riarrangiamento clonale dei geni delle immunoglobuline nei linfociti di alcuni pazienti con tiroidite di Hashimoto (Atlas of Endocrine Pathology).
Rimangono senza conferma le segnalazioni presenti in letteratura circa il ruolo promuovente svolto dalla supplementazione di iodio ad alte dosi (5). Controversa rimane l'associazione tra l'esposizione a radiazioni e i linfomi (6).
Tra le alterazioni molecolari descritte nel MALT linfoma vi è un ridotta espressione di bcl-2 e un'aumentata attivazione di p53 (7,8).
Classificazione
I linfomi tiroidei sono quasi sempre di tipo non-Hodgkin, mentre eccezionalmente rari sono i linfomi di Hodgkin e le localizzazioni tiroidee del plasmocitoma. Si tratta di linfomi a derivazione dalle cellule B mature; solo occasionalmente sono stati riportati casi di linfomi a cellule T.
I linfomi diffusi a grandi cellule B (DLBCL) rappresentano il sottogruppo più frequente (50-70%), con decorso più aggressivo; meno comuni sono il linfoma follicolare e quello a piccoli linfociti.
Il sottotipo generalmente associato alla tiroidite di Hashimoto è il linfoma della zona marginale extra-nodale (MALT), caratterizzato da basso grado di malignità, crescita relativamente lenta e tendenza a recidivare (o a coinvolgere in modo contemporaneo) altre sedi ricche di tessuto linfoide, quali l'apparato gastroenterico, l'apparato respiratorio, il timo e le ghiandole salivari (9).
Clinica
Nel 90% dei pazienti il sintomo di esordio è l’aumento progressivo di volume (in genere nel corso di settimane o mesi) di un pre-esistente gozzo. Durante il suo avanzamento, la malattia si associa a disfagia, dispnea, disfonia, dolore cervicale ed edema facciale, per la compressione di trachea, esofago e grossi vasi del collo.
Meno frequentemente il linfoma può insorgere su un nodulo singolo o può presentare una crescita lenta e insidiosa nel corso di molti mesi (1,14,15).
Obiettivamente la tiroide appare ingrandita, di consistenza dura, non dolente o scarsamente dolorabile, fissa ai piani sottostanti ed immobile con la deglutizione. In molti casi può essere apprezzata una massa dominante, ma sempre nel contesto di un aumento di volume diffuso della ghiandola.
Circa la metà dei pazienti presenta linfonodi latero-cervicali e sovra-claveari aumentati di volume e di consistenza parenchimatoso-dura. Sintomi sistemici di malattia linfoproliferativa, quali febbre, sudorazione notturna e calo ponderale, sono presenti in circa il 10% dei pazienti.
La maggior parte dei pazienti è eutiroidea. In alcuni casi può essere presente ipotiroidismo, di solito dovuto ad una pre-esistente tiroidite di Hashimoto o, più raramente, a diffusa infiltrazione e distruzione del parenchima da parte del linfoma (1,2,10).
Solo occasionalmente è stata descritta associazione con ipertiroidismo, dovuta a rilascio ormonale secondario a distruzione dei follicoli tiroidei da parte del tumore o a un pre-esistente morbo di Graves (16,17).
Diagnosi
In generale, la sola altra neoplasia tiroidea che presenta una massa a rapido accrescimento è il carcinoma anaplastico, condizione che tende a presentarsi nella stessa fascia di età del linfoma. Non ci sono dati clinici o di laboratorio patognomonici per la diagnosi di linfoma tiroideo. I pazienti presentano in genere un quadro di laboratorio caratterizzato da eu o ipotiroidismo, presenza di anticorpi anti-tireoglobulina e anti-tireoperossidasi e, se ricercati, elevati valori di LDH e ß2-microglobulina (2).
L'ecografia del collo documenta la presenza di una ghiandola disomogeneamente ingrandita, con una o più formazioni nodulari marcatamente ipoecogene, spesso con aspetto di aree mal delimitate e a distribuzione asimmetrica, che richiedono una diagnosi differenziale rispetto alla tiroidite subacuta o cronica (18)(figura 3). Coesiste frequentemente adenopatia cervicale con caratteri ecografici di sospetto.
L’esame scintigrafico della tiroide mostra la presenza di una area ipocaptante (“fredda”), dovuta alla presenza di infiltrato linfomatoso.
L'agoaspirato per esame citologico può, nel caso dei linfomi della tiroide, non consentire una diagnosi precisa per la frequente coesistenza di tiroidite di Hashimoto. I linfomi a piccole cellule sono estremamente difficili da diagnosticare citologicamente ed è necessaria la colorazione immuno-istochimica o la citometria a flusso per stabilire l'origine monoclonale dei linfociti e caratterizzare i marcatori di superficie. La diagnosi citologica di linfoma maligno a grandi cellule offre minori difficoltà diagnostiche per la presenza di una popolazione cellulare monotona di cellule atipiche con grandi nuclei vescicolosi, nucleoli prominenti e detriti necrotici di fondo (Atlas of Endocrine Pathology).
Nella pratica clinica, in caso di sospetto diagnostico di linfoma della tiroide è opportuno eseguire una biopsia con ago tranciante (20-21 G) sotto guida ecografica. Questa procedura, scarsamente invasiva, permette di ottenere nella maggior parte dei casi campioni sufficienti per un'adeguata caratterizzazione senza necessità di ricorrere a una biopsia chirurgica. Elementi caratteristici sono la sostituzione della architettura tiroidea, l’infiltrato linfomatoso permeante i follicoli non neoplastici, l’assenza di centri germinativi (Atlas of Endocrine Pathology).
La TC (Figura 1-2) e la RMN non sono utili per la diagnosi differenziale dei linfomi rispetto ai carcinomi tiroidei, ma sono indispensabili per la stadiazione iniziale. Esse consentono di definire l'estensione extra-tiroidea di malattia in sede cervicale, valutare il coinvolgimento dei linfonodi mediastinici e addominali e documentare l'interessamento tracheale al fine di pianificare la terapia e monitorare la risposta al trattamento.
La PET/TC può avere difficoltà nel distinguere la tiroidite di Hashimoto dal linfoma, in quanto entrambe le condizioni possono causare una captazione diffusa a tutta la ghiandola. I linfomi MALT ed i linfomi follicolari, inoltre, possono produrre immagini falsamente negative (1,9).
Stadiazione
La classificazione di Ann Arbor (tabella1) è quella più frequentemente utilizzata per i linfomi primitivi della tiroide. Secondo tale classificazione, il 50% dei pazienti presenta malattia localizzata alla tiroide (IE); il 45% ha una malattia localizzata alla tiroide e ai linfonodi locoregionali (IIE); solo il 5% ha un coinvolgimento dei linfonodi sia sovra- che sotto-diaframmatici (IIIE) o il coinvolgimento diffuso di altri organi (IV).
I siti extra-nodali più frequentemente coinvolti sono il midollo osseo, il tratto gastrointestinale, il polmone, il fegato, il pancreas, il rene. In considerazione del potenziale coinvolgimento di tali organi, gli esami per la stadiazione iniziale dei linfomi tiroidei devono essere gli stessi utilizzati per tutti i linfomi: TC-PET e biopsia osteo-midollare, con esame del liquor ove indicato (1,2,9,10).
| Tabella 1 Classificazione di Ann Arbor per il linfoma Hodgkin e non-Hodgkin |
|
| Stadio I | Il tumore invade un'unica sede linfatica (I) o solo un organo extra-linfatico (stadio IE)* |
| Stadio II | Il tumore invade due o anche più regioni linfatiche riguardanti lo stesso lato del diaframma (II) Possono essere interessate altre sedi linfonodali Se è interessato un organo extra-linfatico, si definisce stadio (IIE) |
| Stadio III |
Il tumore si estende sia sopra che sotto il diaframma. Tale stadio viene suddiviso in:
|
| Stadio IV | Tumore diffuso al midollo osseo, al fegato o a più di due organi extra-linfatici |
Tutti gli stadi sono sottoclassificati per indicare l'assenza (A) o presenza (B) dei sintomi sistemici ("B"): febbre (> 38°C), sudorazione notturna, perdita di peso inspiegabile o > 10% del peso corporeo nei sei mesi precedenti alla diagnosi.
* "E" si riferisce generalmente a estensione extra-nodale
Prognosi
La sopravvivenza dei pazienti affetti da linfoma tiroideo è correlata alle caratteristiche cliniche e al sottotipo istologico. Sono considerati fattori prognostici sfavorevoli: età > 65 anni, dimensione del tumore > 10 cm, stadiazione > IE, presenza di sintomatologia compressiva locale, coinvolgimento mediastinico, crescita tumorale rapida, recidiva di malattia, istotipo a grandi cellule.
La sopravvivenza complessiva a 5 anni è (10):
- stadio IE: 80%
- stadio IIE: 50%
- stadi IIIE e IVE: < 36%.
Terapia
Un'accurata stadiazione iniziale è indispensabile perchè il tipo e l'efficacia del trattamento dei linfomi tiroidei dipende dall'istotipo e dall'estensione di malattia. Per pianificare la gestione clinica, è necessario l’apporto di uno specialista onco-ematologo.
Stadio IE. Il trattamento di elezione è rappresentato dalla tiroidectomia seguita da radioterapia esterna. Nelle forme circoscritte l’intervento chirurgico è utile nel valutare il superamento della capsula tiroidea da parte del tumore e quindi contribuisce ad una più puntuale stadiazione. Sono da evitare interventi con finalità radicali che provochino danni al ricorrente, alle vie aeree o digestive, o causino ipoparatiroidismo, in quanto non migliorano l'outcome clinico.
La radioterapia esterna è utilizzata per gli stadi IE e IIE da sola o combinata con altre modalità terapeutiche. Nel linfoma MALT stadio IE la sola radioterapia ha dimostrato un’efficacia simile alla chirurgia (11). I risultati migliori sono ottenuti con dosi > 30 Gy somministrate in un periodo di 4-5 settimane.
Stadi IIE o IIIE. Non vi sono evidenze sull'utilità della terapia chirurgica. In questi pazienti l'esecuzione di una biopsia tiroidea percutanea sotto guida ecografica consente di porre la diagnosi sul frammento di tessuto prelevato e consente nella maggior parte dei casi di evitare l'intervento di tiroidectomia o la biopsia chirurgica.
Il 25% dei pazienti con linfoma tiroideo può presentare all'esordio una severa compromissione delle vie aeree, dovuta alla rapida crescita di una variante aggressiva. E' opportuno considerare l'esecuzione di una tracheotomia in elezione in tutti i pazienti ad alto rischio di ostruzione delle vie aeree, per evitare il precipitare di una condizione di asfissia. Tuttavia, nelle situazioni meno gravi (assenza di stridore respiratorio e normali referti emogasanalitici) il pronto inizio di una chemioterapia di combinazione consente nel giro di alcune ore la messa in sicurezza delle vie aeree, grazie alla riduzione clinicamente significativa della massa neoplastica (soprattutto per il rapido effetto della componente corticosteroidea).
Nei pazienti con linfoma diffuso a grandi cellule B con malattia in stadio avanzato (III e IV) o localmente rapidamente evolutivo e in quelli che sviluppano recidive a distanza dopo un’iniziale terapia chirurgica o radiante, il trattamento di elezione è la chemioterapia. Lo schema più utilizzato consiste in 3-6 cicli di CHOP (ciclofosfamide, doxorubicina, vincristina e prednisone), associato a rituximab, un anticorpo monoclonale rivolto verso l'antigene di superficie delle cellule B denominato CD20.
Nei casi avanzati deve essere valutata l'opportunità di una terapia multimodale combinata (radio e chemioterapia), al fine di migliorare il controllo della malattia e la sopravvivenza (1,9,10, 12,13).
| Tabella 2 Rituximab, ciclofosfamide, doxorubicina, vincristina e prednisone nel trattamento del linfoma non Hodgkin |
||
| Farmaco | Dose | Modalità |
| Rituximab | 375 mg/m2 ev | Diluito in soluzione fisiologica (SF) per una concentrazione finale da 1 a 4 mg/mL. infusione iniziale: iniziare a 50 mg/h; aumentare di 50 mg/h ogni 30 min, fino ad un massimo di 400 mg/h, se tollerato Per le infusioni successive somministrare il 20% della dose totale nei primi 30 min e il restante 80% nei successivi 60 min |
| Ciclofosfamide | 750 mg/m2 ev | Diluire in SF 250 mL e somministrare in 30 minuti |
| Doxorubicina | 50 mg/m2 ev | Diluire in SF 50 mL e somministrare in 3-5 minuti |
| Vincristina | 1.4 mg/m2 ev (dose max = 2 mg) | Diluire in SF 50 mL e somministrare in 15-20 minuti |
| Prednisone | 100 mg per os | Somministrare in 30 minuti prima della chemioterapia nel giorno 1, ogni 24 h dal giorno 2 al 5. |

Figura 1. Biopsia eco-assistita di sospetta massa linfoproliferativa del lobo destro tiroide (scansione sagittale): la freccia indica la posizione dell’ago tranciante (18 G) utilizzato per il prelievo istologico

Figura 2. TC del collo (sezione assiale senza mdc): grossolana iperplasia di entrambi i lobi tiroidei e della regione istmica con fenomeni compressivi sulla trachea che, al di sotto della laringe, presenta calibro nettamente ridotto con diametro trasverso minimo pari a circa 4 mm. Tale espanso occupa lo spazio retro-faringeo, retro-laringeo e retro-tracheale, estendendosi caudalmente al di sotto della carena. Filiforme il lume dell'esofago adiacente.

Figura 3. TC del collo (ricostruzione sagittale) senza mdc: processo espansivo tiroideo destro, che disloca posteriormente e infiltra la trachea con gettoni neoplastici.
Bibliografia
- Green LD, Mack LM, Pasiek JL. A Anaplastic thyroid cancer and primary thyroid lynphoma: a review of these rare thyroid malignancies. J Surg Oncol 2006 Dec 15;94(8):725-36.
- Pederson RK, Pederson NT. Primary non Hodgkin's linphoma of the thyroid gland: A population based study. Hystopatology 1996, 28: 25.
- Holm LE, Blomgren H, Lowhagen T. Cancer risks in patients with chronic limphocitic thyroiditis. N Engl J Med 1985, 312: 601.
- Hyjek E, Isaacson PG. Primary B cell lymphoma of the thyroid and its relationship to Hashimoto's thyroiditis. Hum Pathol 1988, 19: 1315.
- Harach HR, William ED. Thyroid cancer and thyroiditis in the goitrous region of Saita, Argentina, before and after iodine prophylaxis. Clin Endocrinol (Oxf) 1995, 43: 701.
- Calandra DB, Shah KH, Lawrence AM, et al. Total thyroidectomy in irradiated patients. A twenty-year experience in 206 patients. Ann Surg 1985, 17: 341.
- Ashton-Key M, Biddolph SC, Stein H, et al. Heterogeneity of bcl-2 expression in MALT limphoma. Hystopatology 1995, 26: 75.
- Du M, Peng H, Singh N, et al. The accumulation of p53 abnormalities is associated wyth progression of mucosa-associated lymphoid tissue lymphoma. Blood 1995, 86: 4587.
- Onal C, Li YX, Miller RC, et al. Treatment results and prognostics factors in primary thyroid lymphoma patients: a rare cancer network study. Ann Oncol 2010, 29: 1.
- Tupchong L, Hughes F, Harmer CL. Primary lymphoma of the thyroid: clinical features, prognostic factors, and results of treatment. Int J Radiat Oncol Biol Phys 1986, 9: 81.
- Widder S, Pasieka JL. Primary thyroid lymphoma. Curr Treat Option Oncol 2004, 5: 37.
- Di Biase SJ, Grigsby PW, Guo C, et al Outcome analysis for stage IE and IIE thyroid lymphoma. Am J Clin Oncol 2004, 27: 178.
- Harrinngton KJ, Michalaki VJ, Vini L, et al. Management of non-Hodgkin's lymphoma of the thyroid: the Royal Marsden Hospital experience. Br J Radiol 2005, 78: 405.
- Junior EJ, Paul J, Reed NS. Primary non-Hodgkin's lymphoma of the thyroid. Eur J Surg Oncol 1992, 18: 313.
- Logue JP, Hale RJ, Stewart AL, et al. Primary malignant lymphoma of the thyroid: a clinicopathological analysis. Int J Radiat Oncol Biol Phys 1992, 22: 929.
- Jennings AS, Saberi M. Thyroid lymphoma in a patient with hyperthyroidism. Am J Med 1984, 76: 551.
- Zeki K, Eto S, Fujihira T, et al. Primary malignant lymphoma of the thyroid in a patient with long-standing Graves' disease. Endocrinol Jpn 1985, 32: 435.
- Matsuzuka F, Miyauchi A, Katayama S, et al. Clinical aspects of primary thyroid lymphoma: diagnosis and treatment based on our experience of 119 cases. Thyroid 1993, 3: 93.
Sarcoma tiroideo
Sara Bianchetti e Filomena Graziano
UOC di Oncologia ed Ematologia, UOC di Endocrinologia e Malattie Metaboliche, Ospedale Regina Apostolorum, Albano Laziale, Roma
(2 Marzo 2012)
I sarcomi sono tumori maligni che originano dal tessuto mesenchimale. La localizzazione tiroidea è estremamente rara e spesso aneddotica; la maggior parte della letteratura è infatti rappresentata da case report e case series.
L'eziologia dei sarcomi tiroidei non è nota. Tuttavia è stato ipotizzato come fattore di rischio il gozzo endemico, in quanto lo stimolo proliferativo indotto dal TSH potrebbe promuovere la trasformazione neoplastica dello struma tiroideo. Controversa è la correlazione con i trattamenti radianti.
Il numero esiguo di casi descritti in letteratura non consente di indicare una prevalenza di sesso né l'età maggiormente colpita.
Le cellule che costituiscono il tessuto mesenchimale possono conservare le caratteristiche di pluripotenzialità e dare quindi origine, nel processo di trasformazione neoplastica, anche a tessuti che fisiologicamente non sono presenti nella ghiandola tiroidea. Sono stati pertanto descritti casi di fibrosarcoma (l’istotipo più rappresentato), liposarcoma, leiomiosarcoma, osteosarcoma, condrosarcoma, angiosarcoma, sarcoma sinoviale, carcinosarcoma localizzati alla ghiandola tiroide (1,2). L’esame istologico pone non poche difficoltà di diagnosi differenziale, soprattutto con il carcinoma anaplastico della tiroide, per la presenza di popolazioni cellulari miste fusate, tonde, pleomorfe. Tuttavia, tale discriminazione ha principalmente carattere speculativo, in quanto la storia naturale, la prognosi e il trattamento di queste due neoplasie non differiscono significativamente. L’unica eccezione è rappresentata dall'angiosarcoma, che origina dalle cellule endoteliali e ha una prognosi migliore.
Clinica
Clinicamente i sarcomi della tiroide hanno un comportamento simile al carcinoma anaplastico per la velocità di crescita, l’aggressività biologica, la capacità di metastatizzare precocemente e l’atteggiamento infiltrativo.
Il sintomo di presentazione più comune è rappresentato da una tumefazione del collo a rapida crescita o dall'incremento di volume di un nodulo tiroideo pre-esistente.
Obiettivamente si presenta solitamente come una voluminosa massa di consistenza duro-elastica, poco mobile sui piani superficiali e/o su quelli profondi. Talora sono presenti linfonodi latero-cervicali aumentati di volume. Precocemente compaiono sintomi da compressione locale, quali disfagia, dispnea, emoftoe, tosse, dolore locale ascrivibile all’effetto massa o al coinvolgimento delle strutture nervose. Ulteriori sintomi e segni possono manifestarsi in relazione alle sedi coinvolte da metastasi, rappresentate principalmente da polmoni e ossa (3).
Diagnosi
Il laboratorio non ha alcuna utilità nella diagnostica dei sarcomi tiroidei (4-6).
La diagnostica per immagini risulta fondamentale sia nelle fasi iniziali di diagnosi che nel follow-up.
L'esame ecografico permette di misurare le dimensioni della massa, i margini, ne evidenzia i rapporti con la capsula tiroidea e il suo eventuale superamento, ne definisce l'ecostruttura, rileva il coinvolgimento delle strutture circostanti, l’entità della vascolarizzazione.
L'agoaspirato con ago sottile della lesione non consente spesso una definizione diagnostica, per cui viene spesso integrato dalla biopsia con ago tranciante sotto controllo ecografico, che fornisce materiale sufficiente nella maggioranza dei casi.
La tomografia computerizzata, senza e con mezzo di contrasto (meglio se spirale con tecnica multifasica) e la RMN consentono di ottenere informazioni aggiuntive riguardanti l'invasione locale della neoplasia e il coinvolgimento delle strutture vitali del collo, quali i vasi, l'esofago, le vie aeree (fig 1). Permettono inoltre di evidenziare la presenza di metastasi polmonari ed epatiche.
 .
.
Figura 1. TC (sezione assiale con mdc): voluminoso espanso solido del lobo sinistro con enhancement disomogeneo (freccia), dislocazione laterale dell’asse vascolare e controlaterale dell’asse tracheale, con fenomeni infiltrativi dell’esofago.
La scintigrafia ossea può essere utile nel dimostrare la presenza di metastasi a carico di vari segmenti scheletrici, mentre la fibrolaringoscopia e l'esofagoscopia documentano il grado di invasione delle vie aeree e digestive.
Terapia
Il trattamento di elezione nei sarcomi della tiroide è essenzialmente chirurgico e consiste nella tiroidectomia totale con asportazione completa della massa tumorale (fig 2).
 .
.
Figura 2. Paziente di anni 78, sottoposta ad intervento di tiroidectomia totale per angiosarcoma tiroideo. Tiroide in gran parte occupata da neoformazione a superficie irregolare, di colorito bianco-giallastro con aree brune, a margini mal definiti, di consistenza friabile
Per la pianificazione dell’intervento è indispensabile la stadiazione pre-operatoria condotta con TAC/RM del collo e mediastino ed esame endoscopico delle vie aeree e dell’esofago.Il precoce coinvolgimento di strutture vitali del collo rende frequentemente impossibile un intervento radicale, per cui spesso ci si limita ad interventi palliativi volti al salvataggio delle vie aeree e digestive.
La radioterapia nei sarcomi tiroidei svolge un ruolo complementare alla chirurgia e può essere utilizzata in fase pre-operatoria per rendere più facilmente aggredibile la massa neoplastica (terapia primaria o neoadiuvante) oppure in fase post-operatoria per cercare di ridurre il rischio di recidiva locale o a distanza. La bassa radiosensibilità dei sarcomi richiede la somministrazione di alte dosi, spesso frazionate nel tentativo di ridurre gli effetti collaterali. La radioterapia può rappresentare un trattamento esclusivo solo in pazienti le cui gravi condizioni generali controindichino l'approccio chirurgico ed assume una funzione funzione palliativa.
La chemioterapia è il trattamento di elezione nelle forme avanzate non operabili, nella malattia metastatica, nella recidiva di malattia già sottoposta a terapia chirurgica e radioterapica. Una precisa definizione dell'attivita della chemioterapia sui sarcomi tiroidei é purtroppo resa complessa dalla rarità della patologia, per la differente sensibilità dei diversi istotipi agli anti-blastici. I farmaci più attivi sono fondamentalmente gli stessi utilizzati nei sarcomi dei tessuti molli, ovvero le antracicline e l’ifosfamide, tuttavia le risposte obiettive hanno una percentuale bassa e sono di breve durata (4-6).
Prognosi
La sopravvivenza dei pazienti con sarcoma è correlata alle dimensioni del tumore e all’invasività locale, alla radicalità dell'intervento chirurgico, alla presenza di metastasi a distanza alla diagnosi.
La prognosi, nei pochi casi descritti in letteratura, è stata infausta.
Bibliografia
- Arons I. Sarcoma of the Thyroid gland. Ann Surg 1930, 91: 44-56.
- Muro-Cacho CA, Ku NN. Tumors of the thyroid gland: histologic and cytologic features –part 2. Cancer Control 2000, 7: 377-85.
- Mitra A, et al. Liposarcoma of the thyroid. Sarcoma 2004, 8: 91-6.
- Wartofsky L, Van Nostrand D. Thyroid Cancer. Ediz. Humana Press, 2006: 562-3
- Ryu CH, et al. Synovial sarcoma of the thyroid gland. Clin Experiment Otorhinolaryngol 2011, 4: 204-6.
- Jang KS, et al. Primary Synovial sarcoma of the thyroid gland. J Corean Med Sci 2007, 22 Suppl: S 154-8.
Metastasi alla tiroide
Franco Angelini1, Filomena Graziano2
1UOC di Oncologia ed Ematologia, 2UOC di Endocrinologia e Malattie del Metabolismo, Ospedale Regina Apostolorum, Albano Laziale (RM)
Introduzione
Le metastasi clinicamente evidenti della tiroide sono una condizione non comune, riscontrandosi solo nello 0.5% dei casi in studi autoptici non selezionati. Un coinvolgimento istologico della tiroide clinicamente non significativo è riscontrabile con frequenza più elevata nei pazienti deceduti per malattia metastatica diffusa (fino al 24% dei casi in alcune casistiche) (1,2, 4-8).
Il coinvolgimento della tiroide può avvenire per contiguità da neoplasie primitive, per lo più a cellule squamose, che colpiscono organi vicini, quali laringe, faringe, trachea ed esofago o, più frequentemente, per diffusione ematogena da sedi primitive lontane (le più frequenti sono rene, mammella, polmone e tratto gastrointestinale) (1,2,4,7).
La relativa rarità di metastasi tiroidee clinicamente evidenti, a dispetto dell'abbondante vascolarizzazione della ghiandola, potrebbe essere ricondotta alla velocità del flusso arterioso, che ostacolerebbe l'adesione delle cellule neoplastiche (come nella malattia di Graves), o agli effetti inibitori sulla proliferazione di cellule neoplastiche esercitati dall'elevata saturazione d'ossigeno e dall'elevato contenuto di iodio (3).
Estremamente rare appaiono le metastasi insorte su un tumore primitivo tiroideo, mentre relativamente più frequente (probabilmente per bias di selezione) sembra il loro riscontro in tiroidi patologiche (tiroiditi croniche) (9).
Le metastasi alla tiroide sono singole nel 40% circa dei casi.
Non è possibile dedurre dai dati della letteratura una prevalenza per sesso o individuare un'età media di incidenza. Il tempo che intercorre tra la diagnosi del tumore primitivo e l'insorgenza della metastasi tiroidea è spesso lungo (carcinoma renale), ma gli intervalli di tempo sono più brevi nelle neoplasie aggressive (tumori del polmone e melanomi).
Nei pazienti con un nuovo nodulo della tiroide, soprattutto se ad accrescimento progressivo, che abbiano anamnesi positiva per neoplasia maligna, anche se non recente, vanno sempre prese in considerazione le metastasi alla tiroide nella diagnosi differenziale.
Quadro clinico
Nei pazienti con malattia metastatica diffusa l'interessamento tiroideo è in genere clinicamente irrilevante. Solo raramente il riscontro di un nodulo della tiroide rappresenta il segno iniziale di un tumore primitivo in altra sede o la prima presentazione di recidiva di una malattia neoplastica curata anni prima. E’ comunque sempre necessario ricordare che la tiroide può essere coinvolta dall'estensione locale di tumori della regione del collo.
Un tumore metastatico alla tiroide può manifestarsi come un nodulo singolo o nell'ambito di un gozzo nodulare ad accrescimento progressivo. Sempre più frequentemente viene diagnosticata una lesione metastatica in seguito al riscontro occasionale (“incidentaloma”) di un nodulo tiroideo con l'esame ecografico, la PET o l'octreoscan eseguiti per varie patologie neoplastiche (3).
L'esame obiettivo documenta una tumefazione di consistenza aumentata, talora poco mobile con la deglutizione e gli atti del respiro. Solo in caso di neoplasie aggressive, possono comparire in breve tempo sintomi da compressione locale, quali disfagia, dispnea, tosse, dolore locale ascrivibile all'effetto massa o all'invasione locale (3). Nella maggioranza dei casi questi sintomi si associano a quelli dovuti al tumore primitivo e alla presenza di metastasi in altri organi.
Raramente le metastasi alla tiroide possono indurre una condizione di ipertiroidismo, a seguito della distruzione del tessuto tiroideo e al conseguente incremento di iodotironine in circolo (2,6).
Diagnosi
L'ecografia mette in evidenza una lesione tiroidea, spesso a carattere ipoecogeno e ben vascolarizzato, ma priva in genere di caratteri che consentano un preciso orientamento diagnostico. L’esame ecografico permette, inoltre, anche se in modo aspecifico, di evidenziare le dimensioni della massa, i margini, i rapporti con la capsula tiroidea, il suo eventuale superamento e il coinvolgimento delle strutture circostanti

Metastasi tiroidea da carcinoma renale a cellule chiare in paziente di anni 70
Ecografia del collo (scansione trasversa): lobo tiroideo destro completamente occupato da formazione nodulare solida ipoecogena a margini polilobulati ad ecostruttura disomogenea
L'agoaspirato della formazione nodulare è l'esame cardine per la diagnosi. La cellularità è in genere abbondante e in alcuni casi la morfologia delle cellule può già chiaramente orientare verso il tumore primitivo (presenza di cellule pigmentate in alcuni, ma non tutti, i casi di melanoma). Tuttavia, non sempre la sola citologia consente una diagnosi corretta (come nel caso di una possibile diagnosi citologica di lesione follicolare nelle metastasi da carcinoma renale a cellule chiare) (13). Orientano in genere verso una lesione secondaria la presenza di cellule fortemente atipiche, con nucleoli prominenti e marcato rapporto nucleo-citoplasmatico e la coesistenza di eventuale necrosi.
In caso di dubbio di metastasi tiroidea all’esame morfologico, è necessario eseguire l'immunoistochimica per tireoglobulina e calcitonina per confermare la genesi non tiroidea delle cellule in esame. La negatività per la tireoglobulina, tuttavia, non esclude un tumore primitivo della tiroide, quando la diagnosi differenziale comprende il carcinoma anaplastico tiroideo, che può essere tireoglobulina negativo (9,12-14).
L'esame citologico deve essere completato con le specifiche colorazioni immunocitochimiche per i tumori primitivi sospettati (tabella).
| Colorazioni immunocitochimiche specifiche | |
| Tumore | Marcatore |
| Carcinoma renale | CD-10 |
| Carcinoma mammario | recettori per estrogeni, progesterone e CGDFP 15 |
| Carcinoma prostatico | PSA |
| Carcinoma polmonare | surfactante (non sempre positivo). Il TTF 1 è positivo nelle cellule tiroidee e non è dirimente |
| Melanoma | HMB-45 |
| Carcinoma ovarico | CA-125 |
| Carcinoma intestinale | CDX-2, citocheratina-20 |
| Carcinoma gastrico | citocheratina-20 |
| Tumori neuroendocrini | cromogranina-A, CD-56, sinaptofisina |
| Linfoma | CD-3, CD-20, CD 45 |
Dopo la diagnosi di metastasi tiroidea da tumore primitivo ad altra sede di origine, deve essere sempre condotta, prima della tiroidectomia, una stadiazione completa, che comprenda tomografia computerizzata (o RMN) e PET-TC finalizzate ad evidenziare la presenza di metastasi in altri organi e l’estensione ed operabilità del tumore primitivo.
Informazioni aggiuntive riguardanti l'invasione locale della neoplasia e il coinvolgimento delle strutture del collo (vasi, esofago, vie aeree) sono ricavate dall’esecuzione di esami endoscopici dedicati.
Terapia
Le metastasi alla ghiandola tiroide sono spesso associate a malattia avanzata e prognosi infausta (2). Il tempo di sopravvivenza non è significativamente diverso nei pazienti oncologici con metastasi alla tiroide rispetto a quelli senza la loro evidenza clinica e il decorso è correlabile allo stadio e al tipo di tumore primitivo piuttosto che alla presenza di impegno tiroideo (7).
In presenza di metastasi multiple extra-tiroidee e in assenza di sintomi di invasione locale, non è appropriato rimuovere la tiroide e la terapia resta quella della neoplasia primitiva. Al contrario, se un paziente con pregressa neoplasia maligna già trattata con intento curativo presenta un nodulo tiroideo metastatico e le indagini diagnostiche escludono ripetizioni in altri organi, l'approccio chirurgico consente la conferma diagnostica e un efficace provvedimento terapeutico (5,7).
Per i pazienti con linfoma si rimanda alla trattazione specifica.
L'estensione della chirurgia è dettata dalle circostanze locali e dallo stato generale del paziente. Comunemente viene raccomandata la lobectomia per le metastasi solitarie e la tiroidectomia per le metastasi bilaterali (9, 10, 11).
È comunque necessario pesare il ruolo del trattamento chirurgico e della sua estensione sulla base della prognosi del tumore primitivo e del reale beneficio atteso attraverso un consulto multidisciplinare con gli specialisti di area.
Bibliografia
- Lam KY, Lo CY. Metastatic tumors of the thyroid gland: a study of 79 cases in Chinese patients. Arch Pathol Lab Med 1998, 122: 37.
- Nakhjavani MK, Gharib H, Goellner JR, et al. Metastasis to the thyroid gland. A report of 43 cases. Cancer 1997, 79: 574–8.
- Chung AY, Tran TB, Brumund KT, et al. Metastases to the thyroid: A Review of the Literature from the Last Decade. Thyroid 2012, 22: 258-68.
- Calzolari F, Sartori PV, Talarico C, et al. Surgical treatment of intrathyroid metastases: preliminary results of a multicentric study. Anticancer Res 2008, 28: 2885–8.
- Cichon S, Anielski R, Konturek A, et al. Metastases to the thyroid gland: seventeen cases operated on in a single clinical center. Langenbecks Arch Surg 2006, 391: 581–7.
- Mirallie E, Rigaud J, Mathonnet M, et al. Management and prognosis of metastases to the thyroid gland. J Am Coll Surg 2005, 200: 203–7.
- Papi G, Fadda G, Corsello SM, et al. Metastases to the thyroid gland: prevalence, clinicopathological aspects and prognosis: a 10-year experience. Clin Endocrinol (Oxf) 2007, 66: 565–71.
- Wood K, Vini L, Harmer C. Metastases to the thyroid gland: the Royal Marsden experience. Eur J Surg Oncol 2004, 30: 583–8.
- Stevens TM, Richards AT, Bewtra C et al. Tumors metastatic to thyroid neoplasm: a case report and review of the literature. Pathol Res Int 2011 Mar 31;2011:238693.
- Cheung AY, Donner L, Capen C. Metastatic adenocarcinoma of the uterine cervix to the thyroid gland. Clin Oncol (R Coll Radiol) 2000, 12: 60–6.
- Heffess CS, Wenig BM, Thompson LD. Metastatic renal cell carcinoma to the thyroid gland: a clinicopathologic study of 36 cases. Cancer 2002, 95: 1869–78.
- Rosai J, Carcangiu ML, De Lellis R. Tumors of the thyroid gland 3rd series fascicle 5, Armed Forces Institute of Pathology, Washington, DC, USA, 1992.
- Wartofsky L, Van Nostrand D. Thyroid Cancer, Humana Press, 2006: 562-3.
- Kim TY, Kim WB, Gong G, et al. Metastasis to the thyroid diagnosed by fine-needle aspiration biopsy. Clin Endocrinol (Oxf) 2005, 62: 583.
Utilità della genetica nella gestione delle neoplasie tiroidee
Nadia Cremonini (1) & Giovanni Tallini (2)
(1) Ambulatorio di Endocrinologia, Clinica Privata Villalba, Bologna
(2) Anatomia Patologica, Ospedale Bellaria, Azienda USL di Bologna
(aggiornato al 20 maggio 2018) questo capitolo è in attesa di aggiornamento
In ambito tiroideo le indagini genetiche sono di supporto alla diagnostica sia per la ricerca di alterazioni della linea germinale, correlate alla sindrome MEN-2 per il carcinoma midollare della tiroide (MTC), sia per l’individuazione di alterazioni tissutali indicative di trasformazione neoplastica maligna.
CARCINOMA MIDOLLARE
Nei pazienti con MTC la ricerca di mutazioni germinali del proto-oncogene RET è fondamentale, e deve essere effettuata anche in assenza di anamnesi familiare positiva per la patologia (circa il 7% dei pazienti con MTC apparentemente sporadico, risulta portatore di mutazione genetica RET). Anche la recente revisione delle linee guida dell’American Thyroid Association (ATA) (1) raccomanda di proporre il test genetico, previo counseling a:
- tutti i pazienti con presunto MTC sporadico;
- parenti di primo grado di pazienti con MTC ereditario;
- genitori di bimbi con fenotipo classico MEN-2B;
- pazienti con lichen cutaneo amiloidosico del dorso;
- bambini con malattia di Hirschprung.
Il test RET deve includere gli esoni 10 e 11 (da effettuarsi per primi, per maggiore frequenza di mutazione dei codoni in questi esoni) e, se negativi, gli esoni 8, 13, 14, 15 e 16.
Per i pazienti con fenotipo MEN-2B, deve essere ricercata la mutazione del codone M918T (esone 16) e, se negativa, la mutazione del codone A883F (esone 15).
Se viene rilevata una mutazione germinale nel paziente, l’analisi genetica deve essere proposta ai familiari di primo grado, al fine di individuare i portatori della mutazione stessa, possibilmente prima dell’età raccomandata per la tiroidectomia profilattica.
I familiari non portatori di mutazione devono essere rassicurati e non devono essere sottoposti a screening biochimico per MTC, feocromocitoma o iperparatiroidismo.
In assenza di mutazioni RET, ma in presenza di sospetto elevato di MTC familiare, si deve verificare che sia stato effettuato uno screening genetico completo, prendere in considerazione la ricerca di nuove mutazioni e lo screening biochimico dei familiari a rischio dall’età di 5 anni.
Da anni è nota la stretta correlazione tra specifiche mutazioni germinali di RET, età di esordio e aggressività di MTC (2), e la correlazione genotipo-fenotipo nelle MEN-2A: l’identificazione di una specifica mutazione indica anche la tempistica per lo screening di feocromocitoma e iperparatiroidismo, poiché la loro incidenza ed età di esordio differisce in base alla mutazione (nei pazienti con mutazione RET C634 il feocromocitoma ha una incidenza del 50% nella V° decade di vita e del 90% nella VIII°, l’iperparatiroidismo è presente in circa il 30% dei pazienti, mentre è nettamente inferiore nei pazienti con altre mutazioni).
Le ultime linee guida ATA (1) hanno indicato di modificare la classificazione dei 4 livelli di rischio per MTC aggressivo (A,B,C,D, in ordine crescente di rischio) delle precedenti Linee Guida ATA (2009) (3), considerando 3 livelli di rischio:
- categoria “rischio più alto” (ex livello D): include pazienti con MEN-2B e mutazione RET M918T; per questi bambini il test RET, l'ecografia (US) tiroidea, il dosaggio di calcitonina (CT) e la tiroidectomia profilattica devono essere effettuati il prima possibile, preferibilmente entro il primo anno di vita;
- categoria “rischio alto” (ex livello C): include pazienti con mutazioni del codone C634 (MEN-2A) o mutazione del codone A883F (MEN-2B); il rischio di MTC aggressivo è inferiore, ma sempre elevato. La tiroidectomia profilattica è suggerita prima dei 5 anni o anticipata in caso di rilievo di livelli elevati di CT, con dissezione del comparto linfonodale centrale se CT > 40 pg/mL, o se evidenza di linfonodi metastatici;
- categoria “rischio moderato” (ex livelli B e A): include pazienti con MTC ereditario e mutazioni diverse da M918T, C634 e A883F, che hanno un rischio inferiore rispetto alle altre due categorie; i bambini dovrebbero essere valutati clinicamente, con US del collo e dosaggio di CT a partire dai 5 anni; il timing della tiroidectomia andrebbe determinato in base a valori elevati di CT, o prima se il monitoraggio a lungo termine risulta impossibile.
Per i pazienti con mutazioni RET di categorie ATA di rischio alto e moderato è importante considerare i livelli basali e stimolati di calcitonina, al fine di proporre una maggiore personalizzazione del timing per la tiroidectomia nei portatori di mutazione: per tali categorie, si è dimostrato sicuro pianificare l’intervento nel momento in cui la CT stimolata diventa positiva, senza variazioni della percentuale di guarigione rispetto alla tiroidectomia profilattica classica (4,5). Requisito essenziale per questo approccio è la compliance del paziente e/o dei familiari.
Ricaduta clinica dello screening genetico per RET
- Individua le forme ereditarie di MTC.
- Guida il clinico nella strategia di follow-up dei pazienti.
- Indica la tempistica di effettuazione di screening genetico nei familiari, con conseguente precoce identificazione dei soggetti portatori della mutazione di
- Indica la tempistica della tiroidectomia totale profilattica nei portatori di mutazione
Ogni qualvolta si deve proporre un test genetico, si raccomandano incontri pre- e post-test tra clinico, genetista (ove possibile) e paziente e/o familiari da sottoporre al test stesso, per illustrare in modo semplice e comprensibile le motivazioni del test e le decisioni cliniche conseguenti al risultato.
NEOPLASIE DI ORIGINE FOLLICOLARE
Le problematiche maggiori in citologia tiroidea derivano da categorie a diagnosi “indeterminata”, che corrispondono a diagnosi di “atipia/non diagnostica, possibile neoplasia-Thy3a” e “neoplasia follicolare/sospetta neoplasia follicolare-Thy3f” secondo la classificazione Royal College of Pathologist (UK) (7), o a diagnosi di “lesione indeterminata a basso rischio – Tir3A” e “lesione indeterminata ad alto rischio - Tir3B” secondo la classificazione Italiana SIAPEC-IAP (8), che complessivamente interessano il 5-20% dei casi e non ci permettono di distinguere se il nodo è benigno o maligno, e in minor misura da quelle che corrispondono a una diagnosi di “sospetta neoplasia maligna - Tir4”.
Circa il 20% dei noduli a citologia indeterminata risulterà maligno all’istologia e pertanto molti di questi pazienti vengono sottoposti a chirurgia diagnostica.
La necessità di migliorare la performance diagnostica della citologia per le lesioni indeterminate ha portato all’introduzione di test molecolari su materiale citologico, atti a rilevare mutazioni o riarrangiamenti genetici somatici, per migliorare la sensibilità diagnostica della citologia nel differenziare i noduli benigni dai maligni, e quindi selezionare in modo più accurato i pazienti che devono essere sottoposti a terapia chirurgica terapeutica (permettendo l’indicazione a tiroidectomia totale in un tempo unico), e non diagnostica (emitiroidectomia, con radicalizzazione chirurgica in un secondo tempo se l’istologia è diagnostica per lesione maligna).
Per una diagnosi pre-operatoria di malignità, il test “Rule in” più sensibile e specifico è costituito da un pannello di mutazioni geniche multiple (BRAF, RAS, RET/PTC, PAX8/PPARgamma) (8-10). Mentre nelle varie casistiche viene riportata uniformemente elevata specificità (86-100%) e alto valore prognostico negativo (85-100%) del pannello mutazionale nelle categorie citologiche “atipie/lesioni follicolari ad incerto significato”, “neoplasia follicolare/sospetta neoplasia follicolare”, “indeterminata” (9-12), la sensibilità e il valore prognostico positivo risultano molto più variabili, rispettivamente 18-100% e 19-100%, per i bassi valori rilevati da Eszlinger et al (12) nella categoria citologica indeterminata di associazione di malignità per RAS (12%) e PAX8/ PPARgamma (50%), rispetto ad altri autori (9-11).

Schema della tumorigenesi nei carcinomi tiroidei ad eziologia follicolare (modificato da 6)
Mutazione BRAF-V600E. È il marcatore molecolare più studiato, presente nel 45-50% dei carcinomi papillari della tiroide (PTC), con percentuale variabile nei diversi istotipi: > 90% nella variante a cellule alte, 5-10% nella variante follicolare. Pertanto, nella variante follicolare del PTC, quella che pone i maggiori problemi alla citologia, la ricerca di BRAF riveste un limitato valore diagnostico. I dati della letteratura attestano che la positività della mutazione di BRAF su un campione citologico indeterminato (Tir3) o sospetto (Tir4) ha un valore predittivo positivo del 100% per la diagnosi di PTC.
Il ruolo prognostico della mutazione BRAF-V600E è invece controverso: l’associazione con un esito peggiore rilevata da alcuni studi (13-15) non è stata confermata da altri (16,17).
La revisione delle linee guida ATA inserisce i micro-carcinomi papillari intra-tiroidei, mono- o pluri-focali, nella categoria di basso rischio anche se BRAF-mutati, nella categoria di rischio intermedio se multi-focali con estensione extra-tiroidea e BRAF-mutati, e nella stessa categoria i PTC < 4 cm intra-tiroidei se BRAF-mutati (18).
La mutazione BRAF è un bersaglio terapeutico per inibitori chinasi-specifici, quali dabrafenib e vemurafenib, molecole che hanno indotto risposta clinica in pazienti con PTC avanzato iodio-refrattario esprimenti la mutazione, anche se la risposta è risultata inferiore rispetto a quella ottenuta in altri tumori.
Riarrangiamenti del gene RET (RET/PTC). Si rilevano nel 20-40% dei PTC. Le forme più frequenti sono RET/PTC1 e RET/PTC3, che rappresentano più del 90% dei casi. Tali riarrangiamenti sono associati a esposizione a radiazioni ionizzanti sia accidentali (come nel caso dei PTC post-Chernobyl), sia a scopo terapeutico, con prevalenza del 50-80% nei PTC insorti dopo esposizione alle radiazioni; si può rilevare anche nei PTC dei bambini e dei giovani adulti. È importante considerare che RET/PTC può essere presente a bassi livelli in lesioni non-neoplastiche (es. tiroidite di Hashimoto) o in alcuni noduli tiroidei non maligni.
Mutazioni di H-, K- ed N-RAS. Sono presenti nelle lesioni tiroidee a pattern follicolare: adenoma follicolare, carcinoma follicolare (FTC), variante follicolare del PTC e NIFTP (neoplasia follicolare non invasiva con caratteri nucleari papillari) (19) e la loro prevalenza è maggiore nelle aree con carenza iodica. Pur non essendo mutazioni specifiche per il FTC, data la presenza anche negli adenomi follicolari, la mutazione RAS su citologia è stata associata a diagnosi istologica di carcinoma nel 76% dei casi, con rischio maggiore di malignità per H-RAS rispetto ad N-RAS e K-RAS (20). Mutazioni di RAS sono state associate a un comportamento clinico più aggressivo nei carcinomi differenziati della tiroide, e sono di frequente riscontro nei carcinomi scarsamente differenziati.
Riarrangiamento PAX8/PPARγ. È presente nel 20-50% degli FTC e in circa il 10% degli adenomi follicolari. Nei FTC PAX8/PPARγ è stato associato a fenomeni di invasione vascolare e a pazienti più giovani, ma non a prognosi sfavorevole. Il riaarrangiamento è raramente presente nelle forme a scarsa differenziazione.
Altri biomarcatori
Lo studio del profilo di espressione genica (cDNA microarray) e di fattori regolatori dell’espressione genica (micro-RNA) è più recente; l’espressione di alcuni microRNA (miR-146b, miR-155, miR-221) su campione citologico risulta utile nel distinguere i noduli benigni dai PTC, ma presenta bassa sensibilità e specificità nei noduli con citologia indeterminata (21). È stata segnalata una diversa espressione di alcuni miRNA (miR-146b, miR-222, miR-34b, miR-130b) nelle forme aggressive di PTC rispetto alle forme meno aggressive, e una maggiore espressione di miR-146b nei PTC BRAF-positivi e più aggressivi (22), e in una metanalisi (23) i livelli di espressione di alcuni miRNA (21, 34b, 130b, 135b, 146b, 151, 181b, 199b-5p, 221, 222, 451, 623, 1271, 2861) è risultata correlata ad almeno un carattere aggressivo (grandi dimensioni tumorali, multi-focalità, estensione extra-tiroidea, invasione linfo-vascolare, metastasi linfonodali, metastasi a distanza, stadio avanzato).
Mutazione di TERT (promotore di telomerasi). La prevalenza è del 20-50% nei carcinomi scarsamente differenziati della tiroide e del 30-70% nei carcinomi anaplastici, mentre si riduce drasticamente nei PTC (circa 11%) e nei FTC (circa 17%). Promuove la progressione tumorale dei carcinomi tiroidei differenziati a tumore scarsamente differenziato e a carcinoma anaplastico. La presenza della mutazione nelle forme differenziate ne aumenta aggressività clinico-patologica, recidiva e mortalità, ulteriormente potenziate dalla coesistenza di mutazioni BRAF o RAS, in particolare nei pazienti con carcinomi differenziati della tiroide ad alto rischio ATA e secondo il sistema TNM (24-26). Va ricordato che la presenza di mutazione TERT (± BRAF) secondo le linee guida ATA 2015 (18) fa rientrare i PTC > 1 cm nella categoria ad alto rischio di recidiva strutturale (in assenza di evidenza di malattia strutturale dopo il trattamento iniziale).
GEC – Gene Expression Classifier. Utilizzando come test “rule-out” l’analisi di un profilo di espressione genica (valutazione di 167 geni) per identificare i noduli a basso rischio di malignità nonostante una citologia indeterminata, uno studio multicentrico condotto su 3789 pazienti e 4812 FNA di noduli tiroidei > 1 cm, ha rilevato che nei 265 casi di diagnosi citologica indeterminata, con riscontro istologico, è stato ottenuto un valore prognostico negativo rispettivamente del 95%, 94%, e 85% per le categorie citologiche “atipia di significato clinico indeterminato”, “neoplasia follicolare/sospetta neoplasia follicolare”, “sospetta neoplasia maligna” (27). Tali dati fecero indicare agli autori che in presenza di GEC test negativo si poteva tenere un approccio un approccio di tipo conservativo nella maggior parte dei pazienti con diagnosi citologica di “atipia di significato clinico indeterminato” e “neoplasia follicolare/sospetta neoplasia follicolare” (27). Infatti, la negatività del test genetico, pur in presenza di diagnosi citologica di “atipia di significato clinico indeterminato - Tir3a” o “neoplasia follicolare/sospetta neoplasia follicolare - Tir3f”, comporterebbe un rischio di malignità simile a quello di un nodulo con diagnosi citologica di lesione benigna. I rischi insiti in questo approccio sono rappresentati dalla probabilità di malignità nei noduli con diagnosi citologica Tir3a e Tir3f, compresa tra il 5 e il 10% anche se classificati come benigni con il GEC test, e dal rischio di malignità > 15% per i noduli con citologia sospetta per carcinoma (Tir4), pure in presenza di un test di espressione genica negativo. Poiché in questo e in successivi lavori il follow-up dei pazienti con citologia indeterminata, GEC-test negativo e non operati era < 1 anno, il GEC test non può essere ancora raccomandato nella routine clinica al fine di escludere la malignità in sostituzione della chirurgia o della stretta sorveglianza (28).
La biologia molecolare su citologia tiroidea ci aiuta nella decisione peri-operatoria?
La presenza di mutazioni con valore predittivo di malignità > 95% (BRAF-V600E, RET/PTC) può ridurre il numero di tiroidectomie in due tempi, mentre per mutazioni associate a un minore rischio di malignità (es RAS-N-H-K) non abbiamo ancora evidenze sufficienti per potere scegliere la tiroidectomia totale anziché la lobectomia (28). Va precisato che la performance di ogni test diagnostico (valore prognostico positivo e negativo) è fortemente influenzata dalla prevalenza di malignità per ogni specifica categoria citologica, prevalenza che varia nei diversi Centri. Pertanto, è necessario che i clinici conoscano la prevalenza di malignità per le categorie indeterminate della citologia tiroidea nei propri Centri.
CONSIDERAZIONI PRATICHE
L'analisi genetica per la ricerca di mutazioni germinali di RET è da anni parte integrante della gestione dei pazienti affetti da MTC.
Nei pazienti con neoplasie dell'epitelio follicolare, la ricerca di mutazioni somatiche (BRAF, RET-PTC, RAS) su citologia va presa in considerazione:
- per completare la valutazione citologica nelle lesioni “indeterminate”,
- se si ritiene che il suo risultato modifichi la gestione clinica,
mentre non va utilizzata nei noduli con caratteri citologici francamente benigni o maligni (29).
La ricerca di TERT va effettuata se si sospetta una forma poco differenziata in base a caratteri clinici, ultrasonografici e citologici.
COSTI
Dal nomenclatore SIAPEC (Nomenclatore 2006-Prestazioni di assistenza specialistica ambulatoriale) il costo per un'analisi mutazionale corrisponde a:
- estrazione del DNA: € 45.45;
- analisi del DNA: € 155.97 (riferito a ogni singola analisi di sequenza).
BIBLIOGRAFIA
- Wells SA Jr, Asa SA, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. The American Thyroid Association guidelines task force on medullary thyroid carcinoma. Thyroid 2015, 25: 567-610.
- Machens A, Niccoli-Sire P, Hoegel J, et al. Early malignant progression of hereditary medullary thyroid cancer. N Engl J Med 2003, 349: 1517-25.
- Kloos RC, Eng C, Evans DB, et al. Medullary thyroid cancer: management guidelines of the American Thyroid Association. The American Thyroid Association Task Force. Thyroid 2009, 19: 565-612.
- Rohmer V, Vidal-Trecan G, Bourdelot A, et al. Prognostic factors of disease-free survival after thyroidectomy in 170 young patients with a RET germline mutation: a multicenter study of the Groupe Francais d’Etude des Tumeurs Endocrines. J Clin Endocrinol Metab 2011, 96: E509-18.
- Elisei R, Romei C, Renzini G, et al. The timing of total thyroidectomy in RET gene mutation carriers could be personalized and safely planned on the basis of serum calcitonin: 18 years experience at one single center. J Clin Endocrinol Metab 2012, 97: 426-35.
- Acquaviva G, Visani M, Repaci A. et al. Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathol 2018, 72: 6-31.
- Lobo C, McQueen A, Beale T, Kocjan G. The UK Royal College of Pathologists thyroid fine-needle aspiration diagnostic classification is a robust tool for the clinical management of abnormal thyroid nodules. Acta Cytol 2011, 55: 499–506.
- Nardi F, Basolo F, Crescenzi A, et al. Italian consensus for the classification and reporting of thyroid cytology. J Endocrinol Invest 2014, 37: 593–9.
- Nikiforov YE, Steward DL, Robinson-Smith TM, et al. Molecular testing for mutations in improving the fine-needle aspiration diagnosis of thyroid nodules. J Clin Endocrinol Metab 2009, 94: 2092-8.
- Yip L, Nikiforova MN, Carty SE, et al. Optimizing surgical treatment of papillary thyroid carcinoma associated with BRAF mutation. Surgery 2009, 146: 1213-23.
- Nikiforov YE, Ohori NP, Hodak SP, et al. Impact of mutational testing on the diagnosis and management of patients with citologically inderminate thyroid nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab 2011, 96: 3390-7.
- Eszlinger M, Krogdahl A, Munz S, et al. Impact of molecular screening for point mutations and rearrangements in routine air dried fine-needle aspiration samples of thyroid nodules. Thyroid 2014, 24: 305-13.
- Xing M, Westra WH, Tufano RP, et al. BRAF mutation predicts a poorer clinical prognosis for papillary thyroid cancer. J Clin Endocrinol Metab 2005, 90: 6373-9.
- Elisei R, Ugolini C, Viola D, et al. BRAFV600E mutation and outcome of patients with papillary thyroid carcinoma: a 15-year median follow-up study. J Clin Endocrinol Metab 2008, 93: 3943–9.
- Elisei R, Viola D, Torregrossa I, et al. The BRAFV600E mutation is an independent, poor prognostic factor for the outcome of patients with low-risk intrathyroid papillary thyroid carcinoma: single-institute results from a large cohort study. J Clin Endocrinol Metab 2012, 97: 4390-8.
- Trovisco V, Soares P, Preto A, et al. Type and prevalence of BRAF mutations are closely associated with papillary thyroid carcinoma histotype and patients’ age but not with tumour aggressiveness. Virchows Arch 2005, 446: 589-95.
- Ito Y, Yoshida H, Maruo R, et al. BRAF mutation in papillary thyroid carcinoma in a Japanese population: its lack correlation with high-risk clinicopathological features and disease-free survival of patients. Endocr J 2009, 56: 89-97.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. The American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Nikiforov YE, Seethala RR, Tallini G, et al. Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: a paradigm shift to reduce overtreatment of indolent tumors. JAMA Oncol 2016, 2: 1023–9.
- Patel SG, Carty SE, McCoy KL, et al. Preoperative detection of RAS mutation may guide extent of thyroidectomy. Surgery 2017, 161: 168-75.
- Agretti P, Ferrarini E, Rago T, et al. MicroRNA expression profile helps to distinguish benign nodules from papillary thyroid carcinomas starting from cells of fine needle aspiration. Eur J Endocrinol 2012, 167: 393-400.
- Yip L, Kelly L, Shuai Y, et al. MicroRNA signature distinguishes the degree of aggressiveness of papillary thyroid carcinoma. Ann Surg Oncol 2011, 18: 2035-41.
- Aragon HP, Weng CH, Khawaja HT, et al. MicroRNA expression and association with clinicopathologic features in papillary thyroid cancer: a systemic review. Thyroid 2015, 25: 1322-9.
- Song YS, Lim JA, Choi H, et al. Prognostic effects of TERT promoter mutations are enhanced by coexistence with BRAF or RAS mutations and strengthen the risk prediction by the ATA or TNM staging system in differentiated thyroid cancer patients. Cancer 2016, 122: 1370-9.
- Melo M, Gapar da Rocha A, Batista R, et al. TERT, BRAF, and NRAS in primary thyroid cancer and metastatic disease. J Clin Endocrinol Metab 2017, 102: 1898-907.
- Moon S, Song YS, Kim YA, et al. Effects of coexistent BRAFV600E and TERT promoter mutations on poor clinical outcomes in papillary thyroid cancer: a meta-analysis. Thyroid 2017, 27: 651-60.
- Alexander EK, Kennedy GC, Baloch ZW, et al. Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. N Engl J Med 2012, 367: 705-15.
- Paschke R, Cantara S, Crescenzi A, et al. European Thyroid Association guidelines regarding thyroid nodule molecular fine-needle aspiration cytology diagnostics. Eur Thyroid J 2017, 6: 115-29.
- Gharib O, Papini E, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules – 2016 Update. Endocr Pract 2016, 22: 622-39.
Gestione dei tumori tiroidei avanzati e delle recidive locali
Tecniche mini-invasive guidate da immagini
Chirurgia radio- o eco-guidata delle recidive locali
Trattamento delle metastasi ossee
Stadiazione dei tumori tiroidei avanzati e delle recidive locali
Mario Cappagli1 & Virginia Cappagli2
1Ex SSD Endocrinologia, Ospedale S. Andrea, La Spezia
2Endocrinologia e malattie del metabolismo, Università di Pisa
(aggiornato al 4 gennaio 2022)
La maggior parte dei tumori tiroidei di origine dall’epitelio follicolare ha prognosi eccellente e va incontro a remissione di malattia dopo il trattamento iniziale (chirurgia ± terapia radiometabolica con 131I). Tuttavia, è presente un rischio di recidiva di malattia a distanza di anni dalla remissione, seppur minimo, a seconda dalla coorte studiata 0.2-1.4%.
La recidiva è prevalentemente localizzata a livello del letto tiroideo e dei linfonodi loco-regionali o dei tessuti molli del collo. Inoltre, il 5-10% dei tumori tiroidei svilupperà metastasi a distanza nel corso del follow-up, prevalentemente localizzate a livello polmonare e osseo; di queste circa il 60% circa diventerà iodio-refrattario, con conseguente riduzione della sopravvivenza media a 3-5 anni.
Il monitoraggio dei pazienti nel tempo ha quindi lo scopo di identificare il più precocemente possibile l’eventuale recidiva e/o localizzazione a distanza di malattia, al fine di pianificare il trattamento più adeguato. La stadiazione di recidiva di malattia e di malattia avanzata si basa sia sulla valutazione dei marcatori tumorali che su metodiche di diagnostica per immagini.
VALUTAZIONE DEI MARCATORI TUMORALI
Il dosaggio della tireoglobulina (Tg) sierica circolante è uno strumento fondamentale per il monitoraggio dei pazienti con malattia residua o recidiva di malattia, specialmente se basato su metodiche ultra-sensibili e valutato longitudinalmente nello stesso laboratorio. Nei pazienti con tireopatia autoimmune, il dosaggio degli anticorpi anti-Tg viene utilizzato come marcatore surrogato di persistenza/recidiva di malattia.
Secondo le nuove linee guida (LG) internazionali ATA, il monitoraggio dei valori sierici di Tg circolante, in terapia con L-tiroxina, e degli anticorpi anti-Tg deve essere eseguito:
- nei pazienti a rischio basso o intermedio, che ottengono una risposta eccellente dopo il primo trattamento iniziale, ogni 12-24 mesi;
- nei pazienti ad alto rischio, indipendentemente dalla risposta al trattamento iniziale, e in tutti i pazienti con risposta biochimica o strutturale incompleta, ogni 6-12 mesi.
La valutazione longitudinale nel tempo di entrambi i marcatori permette sia di identificare precocemente una possibile recidiva di malattia, a volte molto prima delle metodiche di diagnostica per immagini, sia di valutare la rapidità di progressione di malattia nei pazienti con recidiva e/o malattia avanzata, orientando quindi il clinico sulla tempistica del follow-up e sulla necessità di eseguire ulteriori esami di imaging.
DIAGNOSTICA PER IMMAGINI
Ecografia del collo
Dal 2006 è raccomandata dalle LG ATA come metodica principale, più sensibile, insieme al dosaggio della Tg, per l’identificazione delle recidive loco-regionali di malattia, sostituendo il ruolo fino a quel momento avuto dalla scintigrafia totale corporea. La metodica è infatti in grado di identificare lesioni millimetriche (anche di 2-3 mm), sia nella loggia tiroidea che nei linfonodi cervicali, sedi più frequenti di persistenza/recidiva di malattia. Rispetto alla scintigrafia totale corporea, è inoltre in grado di identificare localizzazioni di malattia indipendentemente dalla loro iodio-avidità o iodio-refrattarietà.
Alcuni studi hanno dimostrato come i marcatori ecografici predittivi di malignità linfonodale con più elevata sensibilità/specificità siano, oltre all’assenza di visualizzazione dell’ilo, soprattutto l’aspetto cistico della lesione, le micro-calcificazioni e la vascolarizzazione peri-lesionale.
Limite dell’ecografia è la mancata esplorabilità delle sedi extra-cervicali, quali il mediastino superiore, o delle strutture cervicali a localizzazione profonda, in sede retro e/o para-faringea. Inoltre, è una metodica operatore-dipendente a volte poco specifica, che evidenzia in alcuni casi lesioni di aspetto indeterminato.
Tempistica: secondo le LG ATA, l’ecografia del collo è raccomandata a 6-12 mesi di distanza dal trattamento iniziale e poi periodicamente sulla base sia del rischio stimato di recidiva che dei valori e del trend della Tg.
TC e RM con mezzo di contrasto
La TC con mezzo di contrasto iodato consente una precisa localizzazione anatomica delle sedi di malattia, definendone non solo le esatte dimensioni ma anche i rapporti con le strutture adiacenti. Secondo le nuove LG ATA, l’esecuzione di TC e/o RM è indicata:
- per lo studio di collo e torace in caso di pazienti:
- con evidenza ecografica di estesa recidiva loco-regionale;
- con ecografia negativa ma valori dosabili e incremento di Tg;
- nei casi in cui sia necessario valutare pervietà e integrità delle vie aeree e digestive;
- per lo studio di altri distretti nei pazienti ad alto rischio con elevati valori di Tg circolante (> 10 ng/mL) e nessuna evidenza di metastasi polmonari e/o linfonodali mediastiniche.
La tempistica di ripetizione della metodica nel tempo non è standardizzata: nella maggior parte dei casi si attesta tra i 6-12 mesi, ma dipende essenzialmente dal “carico” tumorale e dal trend di crescita del marcatore tumorale.
La TC è al momento l’unica metodica riconosciuta dalle LG per definire la progressione o stabilità di malattia, sia prima di avviare un’eventuale terapia sistemica sia in corso di terapia per valutarne l’efficacia. L’applicazione dei criteri RECIST consente di definire la variazione tra due valutazioni (ognuna basata sulla somma dei diametri massimi delle lesioni bersaglio parenchimali — > 1 cm — e dei diametri minimi delle lesioni bersaglio linfonodali — > 1.5 cm), come:
- progressione di malattia: incremento > 20%;
- risposta parziale: diminuzione di almeno il 30%;
- stabilità di malattia: riduzione/aumento insufficiente per rientrare nelle altre categorie.
Recentemente alcuni autori hanno suggerito come il cambiamento di volume della lesione bersaglio possa essere un marcatore più affidabile rispetto alla valutazione mono-dimensionale dei criteri RECIST.
Il limite della TC è il rischio di tossicità da mezzo di contrasto iodato e/o il rischio di esposizione alle radiazioni.
La RM è la metodica per eccellenza per l’identificazione e lo studio delle metastasi ossee, soprattutto per definirne l’eventuale estensione ai tessuti molli circostanti, e per la caratterizzazione delle metastasi cerebrali e/o epatiche.
Scintigrafia totale corporea diagnostica con 131I
Sfruttando la capacità delle cellule tiroidee, anche tumorali, di captare lo iodio, la scintigrafia diagnostica totale corporea con 131I, mediante l’acquisizione di immagini planari o tridimensionali (SPECT/CT RAI), consente di identificare la persistenza/recidiva di malattia e anche di metastasi a distanza, con elevata specificità (91-100%), ma minor sensibilità (27-55%). In accordo con le LG ATA, tale procedura non è però ormai più routinariamente raccomandata per i pazienti a rischio basso-intermedio, ma solo per quelli a rischio intermedio-alto, preferendo l’acquisizione di immagini tridimensionali rispetto a quelle planari, o nei pazienti con positività degli anticorpi anti-Tg.
Tomografia ad emissione di positroni (PET)
Negli ultimi anni questa metodica ha trovato sempre più largo uso in campo oncologico, a scopo sia diagnostico che prognostico. Il tracciante più utilizzato è il 18F-FDG, analogo marcato del glucosio, che sfrutta l’elevato metabolismo glucidico delle cellule tumorali rispetto a quelle normali, secondario alla minor efficienza energetica della glicolisi anaerobia rispetto alla fosforilazione ossidativa.
Negli ultimi anni, l’utilizzo della metodica ibrida PET/TC ha notevolmente migliorato la localizzazione anatomica delle lesioni. Tuttavia, alcuni studi hanno dimostrato come la sua capacità diagnostica nell’identificare recidive locali o metastasi polmonari, soprattutto < 1 cm, sia inferiore rispetto a quella dell’ecografia del collo e della TC.
Le LG ATA raccomandano di utilizzare la PET/TC con 18F-FDG nei pazienti ad alto rischio con scintigrafia totale corporea con 131I negativa e valori elevati di Tg circolante, sia basale che stimolata (generalmente > 10 ng/mL). In tale categoria di pazienti la metodica raggiunge sensibilità delll’83% e specificità dell’84%. Inoltre, potrebbe essere utile anche come metodica di stadiazione iniziale nelle forme poco differenziate (scarsamente differenziate, variante a cellule alte o a cellule di Hürthle). Al momento, non c’è evidenza che la preparazione mediante stimolazione con rhTSH aumenti il valore prognostico della metodica e pertanto non è raccomandata nelle nuove LG ATA.
Sebbene la metodica abbia al momento prevalentemente un ruolo prognostico, alcuni autori ne hanno proposto l’utilizzo anche nella valutazione della risposta alle terapie sistemiche nei pazienti con malattia avanzata, mediante l’utilizzo dei criteri PERCIST basati su modificazioni dell’attività metabolica.
BIBLIOGRAFIA
- Schlumberger M, et al. Outcome after ablation in patients with low-risk thyroid cancer (ESTIMABL1): 5-year follow-up results of a randomised, phase 3, equivalence trial. Lancet Diabetes Endocrinol 2018, 6: P618-26.
- Durante C, Montesano T, Torlontano M, et al. Papillary thyroid cancer: time course of recurrences during postsurgery surveillance. J Clin Endocrinol Metab 2013, 98: 636–42.
- Tuttle RM, Tala H, Shah J, et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new ATA staging system. Thyroid 2010, 12: 1341-9.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1–133.
- Fugazzola L, Elisei R, Fuhrer D, et al. 2019 European Thyroid Association guidelines for the treatment and follow-up of advanced radioiodine-refractory thyroid cancer. Eur Thyroid J 2019, 8: 227-45.
- Lamartina L, Deandreis D, Durante C, Filetti S. Imaging in the follow-up of differentiated thyroid cancer: current evidence and future perspectives for a risk-adapted approach. Eur J Endocrinol 2016, 175: R185-202.
Overview sulle tecniche mini-invasive guidate da immagini per la patologia neoplastica tiroidea
Claudio Maurizio Pacella & Enrico Papini
Ospedale Regina Apostolorum, Albano Laziale (RM)
(29/02/2012) questo capitolo è in attesa di aggiornamento
Questo capitolo è dedicato ad una trattazione generale dei principi e metodi delle tecniche ablative percutanee. Per il loro impiego clinico nelle lesioni focali tiroidee e nelle secondarietà linfonodali, epatiche o scheletriche delle neoplasie endocrine vedi i rispettivi capitoli.
*nel testo le tecniche sono menzionate con l’acronimo inglese; le terapie combinate non sono trattate estesamente in questo contesto perchè richiedono un capitolo a sé stante
INTRODUZIONE E CLASSIFICAZIONE
Le terapie mini-invasive guidate da imaging per la distruzione locale dei tumori (“ablazione”) possono essere suddivise in termiche e non-termiche.
- Le termiche inducono un danno irreversibile delle cellule tumorali innalzando o abbassando la temperatura nell’area bersaglio. Sono:
- ipertermiche quando generano calore mediante ultrasuoni o energia elettromagnetica (radiofrequenza, laser, microonde)*
- ipotermiche quando producono basse temperature mediante la rapida espansione di gas (crioterapia)*.
- Le non-termiche per indurre la morte delle cellule tumorali usano agenti fisici (con danno irreversibile della permeabilità delle membrane cellulari)* o agenti chimici (alcol o acido acetico)* (1).
Negli ultimi 25 anni le terapie loco-regionali sono state impiegate nel trattamento di tumori primitivi e metastatici del fegato, del rene, del polmone, dell’osso, della prostata e del cervello (2-21). Gli insuccessi, dovuti in alcuni casi al tipo, al grading e/o alle dimensioni del tumore, hanno portato all’impiego di strategie combinate associando alle terapie loco-regionali chemioterapia, radioterapia, terapia radiometabolica o trattamenti percutanei trans-arteriosi (22-28).
Il temine “image-guided (US, CT or MR) tumor ablation” sottolinea il ruolo dell’imaging nella pratica clinica. Queste terapie, talora eseguite in laparoscopia o laparotomia a cielo aperto, sono poste in atto con approccio percutaneo grazie alla guida ecografica, tomografica o con risonanza magnetica. L’imaging visualizza il tumore nella fase del centraggio e posizionamento degli aghi o elettrodi (targeting), durante il trattamento (controlling) e, infine, nella verifica dei risultati subito dopo la procedura o durante il follow-up (assessment). Le terapie percutanee mini-invasive inducono una distruzione completa (in situ) o una cito-riduzione della massa tumorale in tempi brevi, in maniera selettiva (distruzione del solo tumore o della lesione focale e di 0.5-1.0 cm di tessuto apparentemente sano circostante), con scarsa perdita di sangue, minore trauma dell’organo sede della lesione e assenza della morbilità peri- e post-operatoria.
Le tecniche mini-invasive sono poste in atto in sedazione cosciente, con minimo impatto della anestesia e minore stress psico-fisico del paziente. Sono pertanto eseguibili in regime di day-hospital anche in pazienti ad alto rischio chirurgico e, data la ripetibilità delle manovre percutanee nel tempo, possono essere trattati anche pazienti con lesioni chirurgicamente non resecabili.
TERAPIE NON TERMICHE
Ablazione con agenti chimici
Percutaneous Ethanol Injection (PEI). Questa metodica, interessante per il basso costo e la semplicità, consiste nella somministrazione di un agente chimico, usualmente l’etanolo e più raramente l’acido acetico, nell’area bersaglio attraverso aghi sottili con calibro inferiore al mm (21 G). L’etanolo induce disidratazione del citoplasma delle cellule e denaturazione delle proteine, con secondaria necrosi coagulativa del tessuto tumorale. L’alcool, inoltre, entrando nel circolo vascolare del tumore, induce necrosi endoteliale e trombosi seguite da necrosi tissutale ischemica.
La PEI è stata usata nel trattamento degli epatocarcinomi in pazienti cirrotici con buoni risultati (29, 30). L’acido acetico è stato proposto in alternativa all’alcol per la sua maggiore capacità di penetrazione e diffusione nella componente fibrosa del tessuto tumorale. La distribuzione non uniforme nelle lesioni sottoposte a trattamento, soprattutto in tessuti a contenuto fibroso o disomogenei come le metastasi, ha indotto ad abbandonare tale metodica.
Per l’uso di tale metodica in ambito endocrinologico si rimanda al capitolo sulla PEI nel trattamento delle lesioni cistiche benigne della tiroide e nel trattamento percutaneo delle metastasi linfonodali da carcinoma tiroideo papillifero (PTC) non responsive al trattamento con radioiodio.
Ablazione con agenti fisici
Irreversible Electroporation (IRE). Questa recente metodica non-termica provoca la morte delle cellule tumorali per apoptosi. Si basa sulla cessione di impulsi elettrici ad alta frequenza (micro- milli-secondi) che, generando campi elettrici focalizzati di varia intensità (fino a 3kV/cm), provocano un danno irreversibile della permeabilità delle membrane cellulari del tessuto tumorale (31). Poichè non c’è cessione di energia termica (32), l’IRE danneggia le cellule del parenchima, ma lascia integre le vie biliari, i vasi, il tessuto collagene e i nervi (33-35). Questi dati fanno intravedere un'applicazione di questa metodica a particolari tessuti ed organi, come prostata, mammella, rene o tumori cutanei(36, 37). La tecnica può usare aghi sottili, di solito multipli, con varia configurazione spaziale e con punte attive di diversa lunghezza. Sono in corso studi in vivo su animali per capire le variabili che determinano l’area di ablazione per sessione (33, 38).
Per quanto attiene la patologia tiroidea, studi in vitro dimostrerebbero che l'IRE produce un incremento della captazione del radioiodio in cellule tumorali tiroidee in coltura scarsamente recettive al radioiodio (39). Non ci sono valutazioni in vivo che confermino l’incremento dell’azione tumoricida del radioiodio nei carcinomi scarsamente differenziati pretrattati con questa tecnica.
TERAPIE TERMICHE
Ablazione Ipertermica. Quando le temperature che si generano intorno alla punta di un ago-elettrodo inserito in una lesione focale oscillano tra i 60° e i 100°C avviene una rapida denaturazione delle proteine (“necrosi coagulativa”), con danno irreversibile dell’apparato enzimatico mitocondriale cellulare e del DNA nucleare. Il danno causa la distruzione delle cellule entro alcuni giorni, ma non tutte le cellule comprese nella zona di coagulazione sono morte irreversibilmente. E’ questa la ragione per cui si preferisce chiamare l’area necrotica zona di coagulazione (coagulation zone).
Le temperature ottimali per l’ablazione sono comprese fra 50°C e 100°C, ma l’esatta temperatura a cui la cellula muore dipende da molti fattori ed è legata al tipo di tessuto sottoposto alla procedura termica e ai tempi di azione dell’insulto termico. La massima temperatura alla periferia della zona di ablazione, conosciuta come temperatura critica, varia da 30° a 77°C in un tessuto normale e da 41° a 64°c in vari tipi di tumore(40, 41). Questo significa che la dose richiesta per indurre la morte cellulare varia in maniera significativa da tessuto a tessuto(32). Per temperature al di sopra di 105-110°C si verifica vaporizzazione e carbonizzazione, che limitano la diffusione dell’energia termica nel tessuto, soprattutto quando si usa la radiofrequenza (RF) o la luce laser (LA), al contrario delle microonde (MW) in cui le alte temperature non interferiscono con la deposizione di energia.
Radiofrequency Ablation (RFA). Nel sistema di termoablazione con antenne a radiofrequenza il paziente è inserito in un circuito costituito dal generatore, l’elettrodo inserito all’interno del paziente nell’area bersaglio e una seconda larga antenna di riferimento applicata su una superficie esterna del paziente. In questo circuito il tessuto bersaglio è l’elemento di resistenza al passaggio del flusso di corrente alternata tra le due antenne. La discrepanza dimensionale tra la piccola superficie dell’antenna posizionata nel tessuto bersaglio e la larga antenna di riferimento (antenna di terra) esterna fa sì che il calore che si genera viene focalizzato e concentrato verso l’elettrodo più piccolo. Poiché il tessuto è un cattivo conduttore di elettricità (impedenza), il flusso di corrente tra le due antenne provoca agitazione degli ioni tissutali e quindi calore per effetto Joule. Calore si sviluppa rapidamente nelle aree ad alta densità di corrente e quindi nei tessuti più vicini agli elettrodi, per poi propagarsi ai tessuti più lontani per conduzione (42). Il processo di ablazione provoca disidratazione e vaporizzazione del tessuto, con conseguente incremento della resistenza del tessuto stesso al flusso di corrente (impedenza). Per controllare l’incremento di impedenza che inibisce il flusso di corrente dal generatore, si può espandere la superficie dell’elettrodo più piccolo, usare una corrente pulsata o iniettare soluzioni saline vicino all’elettrodo. Sulla base di questi dati sperimentali, si sono sviluppati diversi tipi di elettrodi, da quelli con più antenne sottili espandibili perfuse con soluzioni saline e non, con morfologia ad uncino, ad ombrello, ad albero di natale, a quelle senza antenne espandibili e perfuse con soluzioni saline raffreddate (1). Tale metodica attualmente è la più diffusa e la più testata, ma non sono ancora disponibili studi controllati che ne dimostrino la superiorità rispetto alle altre metodiche ipertermiche, anche se sono in corso RCT tra la RFA e la LA (7, 43).
Circa l’uso della RFA nella patologia benigna vedi il paragrafo relativo.
Laser Ablation (interstitial laser coagulation, interstitial laser therapy, interstitial laser phototherapy, laser-induced thermal therapy (LITT) o photothermal therapy). La luce laser è trasmessa al tessuto tumorale mediante fibre ottiche di quarzo flessibili, usualmente di calibro molto sottile (300-600 µm) direttamente inserite nel contesto dell’area bersaglio. Laser è l’acronimo di “light amplification by stimulated emission of radiation” e sta a significare la spontanea emissione di fotoni dagli atomi eccitati. La luce laser è coerente monocromatica e può essere collimata e focalizzata (il fascio di luce è composto da onde elettromagnetiche che hanno la stessa frequenza, la stessa fase e la stessa lunghezza d’onda). Per queste caratteristiche è possibile trasferire grandi quantità di energia a distanza senza significative perdite di energia (in caso di controlling della procedura con RM le fibre possono essere lunghe 10 metri).
La maggior parte dei laser in uso sono al Nd:YAG (ad onda continua di 1064 nm) o a diodo (con lunghezza d’onda di 800-980 nm), offrono maggiore penetrazione e assorbimento nei tessuti e operano con potenze comprese tra i 2 e i 40 W. Due sistemi sono in uso in clinica. Uno consiste nell’uso di aghi sottili (21G) e fibre a punta piatta di 300 µm (44), mentre l’altro usa diffusori cilindrici raffreddati, con calibro pari a 400-600 µm, in grado di depositare nel tessuto più di 30 W mediante una superficie emittente più larga in grado di ridurre il surriscaldamento e quindi la vaporizzazione e la carbonizzazione (45-47). Quest’ultima tecnica può essere controllata in tempo reale con la RM durante il trattamento, rendendo agevole la verifica dell’effettiva distruzione del tumore. In entrambi i cas,i i tempi della procedura sono brevissimi, variando da 3 a 6 minuti. La tecnica è diffusa in Germania, Italia e Regno Unito e recentemente è in studio clinico in USA (47).
Per le applicazioni in campo tiroideo vedi il capitolo relativo.
Microwave Ablation (MW). La tecnica a micro-onde usa frequenze molto elevate uguali o superiori a 900 MHz. Quando si cede energia elettromagnetica ad un tessuto, parte di questa energia viene spesa per modificare la polarità delle molecole del tessuto, come quelle dell’acqua. Il passaggio delle micro-onde all’interno delle cellule provoca una rapida ed improvvisa rotazione delle molecole di acqua contenute nel tessuto e parte di questa energia viene dissipata in calore (isteresi termica). Il processo si arresta quando si arresta la cessione di energia (48). Le micro-onde, al contrario dell'energia a radiofrequenza, penetrano rapidamente in tutti i tessuti biologici, anche in quelli a bassa conduttività, come il polmone, l’osso o i tessuti disidratati, raggiungendo temperature molto elevate (> 150°C) con maggiore efficacia ablativa. Non necessita di una seconda antenna di terra come la radiofrequenza, perché non necessità di un circuito chiuso e quindi, al pari della energia laser, è possibile applicare più sorgenti simultaneamente per amplificare l’area di coagulazione (49). E' tuttavia difficile controllare la distribuzione dell’energia nel tessuto irradiato e i dispositivi non sono maneggevoli come per le altre metodiche (50). Inoltre, l’eccessiva potenza usata consente all’operatore di ottenere aree ablative più larghe, ma può condurre a danni in zone non selezionate per l’ablazione, come per esempio la cute. Sono in corso studi con sistemi di raffreddamento delle antenne, che tendono ad eliminarne il riscaldamento (51). La tecnica è molto diffusa in Cina e Giappone e attualmente non ci sono studi in campo tiroideo.
Ultrasound Ablation-High-intensity focused ultrasound (HIFU). È possibile elevare la temperatura in una determinata area di tessuto mediante la cessione interstiziale mirata di energia ultrasonora. L’HIFU è una tecnica ablativa ipertermica non invasiva, basata sulla generazione di onde ultrasonore extra-corporee focalizzate su un'area bersaglio. L’energia si propaga attraverso la cute senza danneggiarla, fino a raggiungere un punto focale, dove la temperatura aumenta per frizione molecolare. Il fascio di ultrasuoni è focalizzato geometricamente o elettronicamente, in modo da ottenere un'alta concentrazione di energia che coagula in maniera precisa solo un’area di pochi millimetri senza danneggiare i tessuti contigui (52). L’area ablata è molto piccola (da uno a pochi mm3) e quindi sono necessari molti impulsi in sequenza continua per ottenere un volume di ablazione di rilievo clinico. Il tutto e’ controllato da un computer, avviene in anestesia generale e richiede alcune ore per ottenere un volume di ablazione significativo. Sono disponibili dati su lesioni renali, epatiche, prostatiche, pancreatiche e fibromi uterini.
In campo endocrino, dopo studi di fattibilità in vivo (53), sono stati riportati uno studio di fattibilità in noduli benigni di piccolo volume (54) e in pazienti con iperparatiroidismo primario (55). E’ una tecnica promettente, ma allo stato attuale risulta troppo complessa e costosa per la pratica clinica.
Cryoblation. L’argon è un gas che quando si espande si raffredda, mentre l’elio si scalda. I sistemi di cryoblation sfruttano l’effetto Joule-Thomson di questi gas per creare cicli di congelamento e di scongelamento e danneggiare in tal modo la membrana delle cellule. Con questa metodica, le dimensioni della zona di ablazione correlano con le dimensioni dei dispositivi usati per raggiungere le aree di trattamento. Una criosonda da 13-gauge (2.4 mm di diametro) produce un'area di ablazione di 2.5 cm di diametro massimo (56). La tecnica è stata testata su lesioni di diversi organi (polmone, reni, fegato, prostata)(20), ma non in campo tiroideo per ovvi motivi legati al critico e ristretto spazio del collo. Le sonde sono grandi e spesso è necessario l’uso di più sonde per ottenere significative aree di ablazione. I tempi di trattamento si aggirano intorno ai 45 min (per tumori esofitici di 2-3 cm del rene) e l’intera sessione, in anestesia profonda, può richiedere molti cicli di congelamento e scongelamento della durata di due o tre ore, con costi estremamente elevati rispetto alle altre metodiche.
Bibliografia
- Ahmed M, Brace CL, Lee FT Jr, et al. Principles of and advances in percutaneous ablation. Radiology 2011, 258: 351-69.
- Vogl TJ, Straub R, Eichler K, et al. Malignant liver tumors treated with MR imaging-guided laser-induced thermotherapy: experience with complications in 899 patients (2,520 lesions). Radiology 2002, 225: 367-77.
- Sorensen SM, Mortensen FV, Nielsen DT. Radiofrequency ablation of colorectal liver metastases: long-term survival. Acta Radiol 2007, 48: 253-8.
- Gillams AR, Lees WR. Five-year survival in 309 patients with colorectal liver metastases treated with radiofrequency ablation. Eur Radiol 2009, 19:1206-13.
- Pacella CM, Valle D, Bizzarri G, et al. Percutaneous laser ablation in patients with isolated unresectable liver metastases from colorectal cancer: Results of a phase II study. Acta Oncol 2006, 45: 77-83.
- Pacella CM, Stasi R, Bizzarri G, et al. Percutaneous laser ablation of unresectable primary and metastatic adrenocortical carcinoma. Eur J Radiol 2008, 66: 88-94.
- Gough-Palmer AL, Gedroyc WM. Laser ablation of hepatocellular carcinoma--a review. World J Gastroenterol 2008, 14: 7170-4.
- Wong SL, Mangu PB, Choti MA, et al. American Society of Clinical Oncology 2009 clinical evidence review on radiofrequency ablation of hepatic metastases from colorectal cancer. J Clin Oncol 2010, 28: 493-508.
- Gillams A, Cassoni A, Conway G, et al. Radiofrequency ablation of neuroendocrine liver metastases: the Middlesex experience. Abdom Imag 2005, 30: 435-41.
- Vogl TJ LT, Eichler K, Proschek D, et al. Adrenal Masses: CT-Guided and MR-Thermometry-Controlled Laser-Induced Interstitial Thermotherapy. Eur Radiol 2007, 17: 2020-7.
- Pacella CM, Francica G, Di Lascio FM, et al. Long-term outcome of cirrhotic patients with early hepatocellular carcinoma treated with ultrasound-guided percutaneous laser ablation: a retrospective analysis. J Clin Oncol 2009, 27: 2615-21.
- Shiina S, Tateishi R, Arano T, et al. Radiofrequency Ablation for Hepatocellular Carcinoma: 10-Year Outcome and Prognostic Factors. Amer J Gastroenterol 2011, 107: 569-77.
- Rossi S, Ravetta V, Rosa L, et al. Repeated radiofrequency ablation for management of patients with cirrhosis with small hepatocellular carcinomas: a long-term cohort study. Hepatology 2011, 53: 136-47.
- Gervais DA, McGovern FJ, Arellano RS, et al. Renal cell carcinoma: clinical experience and technical success with radio-frequency ablation of 42 tumors. Radiology 2003, 226: 417-24.
- Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass: a meta-analysis. Cancer 2008, 113: 2671-80.
- Carrafiello G, Lagana D, Mangini M, et al. Microwave tumors ablation: principles, clinical applications and review of preliminary experiences. Int J Surg 2008, 6 Suppl 1: S65-9.
- Dupuy DE. Image-guided thermal ablation of lung malignancies. Radiology 2011, 260: 633-55.
- Abbas G, Pennathur A, Landreneau RJ, et al. Radiofrequency and microwave ablation of lung tumors. J Surg Oncol 2009, 100: 645-50.
- Callstrom MR, Atwell TD, Charboneau JW, et al. Painful metastases involving bone: percutaneous image-guided cryoablation--prospective trial interim analysis. Radiology 2006, 241: 572-80.
- Finley DS, Pouliot F, Miller DC, et al. Primary and salvage cryotherapy for prostate cancer. Urol Clin North Amer 2010, 37: 67-82.
- Carpentier A, McNichols RJ, Stafford RJ, et al. Real-time magnetic resonance-guided laser thermal therapy for focal metastatic brain tumors. Neurosurgery 2008, 63:ONS21-28; discussion ONS28-29.
- Pacella CM, Bizzarri G, Cecconi P, et al. Hepatocellular carcinoma: long-term results of combined treatment with laser thermal ablation and transcatheter arterial chemoembolization. Radiology 2001, 219: 669-78.
- Goldberg SN, Kamel IR, Kruskal JB, et al. Radiofrequency ablation of hepatic tumors: increased tumor destruction with adjuvant liposomal doxorubicin therapy. AJR 2002, 179: 93-101.
- Jain SK, Dupuy DE, Cardarelli GA, et al. Percutaneous radiofrequency ablation of pulmonary malignancies: combined treatment with brachytherapy. AJR 2003, 181: 711-5.
- Zangos S, Eichler K, Balzer JO, et al. Large-sized hepatocellular carcinoma (HCC): a neoadjuvant treatment protocol with repetitive transarterial chemoembolization (TACE) before percutaneous MR-guided laser-induced thermotherapy (LITT). Eur Radiol 2007, 17: 553-63.
- Takaki H, Yamakado K, Nakatsuka A, et al. Radiofrequency ablation combined with chemoembolization for the treatment of hepatocellular carcinomas 5 cm or smaller: risk factors for local tumor progression. J Vasc Interv Radiol 2007, 18: 856-61.
- Dupuy DE, DiPetrillo T, Gandhi S, et al. Radiofrequency ablation followed by conventional radiotherapy for medically inoperable stage I non-small cell lung cancer. Chest 2006, 129: 738-45.
- Yamakado K, Nakatsuka A, Takaki H, et al. Early-stage hepatocellular carcinoma: radiofrequency ablation combined with chemoembolization versus hepatectomy. Radiology 2008, 247: 260-6.
- Livraghi T, Giorgio A, Marin G, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995, 197: 101-8.
- Ebara M, Okabe S, Kita K, et al. Percutaneous ethanol injection for small hepatocellular carcinoma: therapeutic efficacy based on 20-year observation. J Hepatol 2005, 43: 458-64.
- Davalos RV, Mir IL, Rubinsky B. Tissue ablation with irreversible electroporation. Ann Biomed Engin 2005, 33: 223-31.
- Mertyna P, Goldberg W, Yang W, et al. Thermal ablation: a comparison of thermal dose required for radiofrequency-, microwave-, and laser-induced coagulation in an ex vivo bovine liver model. Acad Radiol 2009, 16: 1539-48.
- Lee EW, Chen C, Prieto VE, et al. Advanced hepatic ablation technique for creating complete cell death: irreversible electroporation. Radiology 2010, 255: 426-33.
- Maor E, Ivorra A, Leor J, et al. The effect of irreversible electroporation on blood vessels. Technol Cancer Res Treat 2007, 6: 307-12.
- Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality--clinical implications. Technol Cancer Res Treat 2007, 6: 37-48.
- Onik G, Mikus P, Rubinsky B. Irreversible electroporation: implications for prostate ablation. Technol Cancer Res Treat 2007, 6: 295-300.
- Neal RE 2nd, Davalos RV. The feasibility of irreversible electroporation for the treatment of breast cancer and other heterogeneous systems. Ann Biomed Engin 2009, 37: 2615-25.
- Ben-David E, Appelbaum L, Sosna J, et al. Characterization of irreversible electroporation ablation in in vivo porcine liver. AJR 2012, 198: W62-8.
- Gopal R, Narkar AA, Mishra KP, et al. Electroporation: a novel approach to enhance the radioiodine uptake in a human thyroid cancer cell line. Appl Radiat Isot 2003, 59: 305-10.
- Mertyna P, Dewhirst MW, Halpern E, et al. Radiofrequency ablation: the effect of distance and baseline temperature on thermal dose required for coagulation. Int J Hyperthermia 2008, 24: 550-9.
- Mertyna P, Hines-Peralta A, Liu ZJ, et al. Radiofrequency ablation: variability in heat sensitivity in tumors and tissues. J Vasc Interv Radiol 2007, 18: 647-54.
- McGahan JP, Dodd GDI. Radiofrequency Ablation of the Liver: Current Status. AJR 2001, 176: 3-16.
- Di Costanzo GG, Tortora R, D’Adamo G, et al. Radiofrequency Ablation versus Laser Ablation for The Treatment of Small Hepatocellular Carcinoma: A Randomized Controlled Trial. In Hong Kong: International Liver Cancer Association 2011 (abstract).
- Pacella CM, Bizzarri G, Francica G, et al. Percutaneous laser ablation in the treatment of hepatocellular carcinoma with small tumors: analysis of factors affecting the achievement of tumor necrosis. J Vasc Interv Radiol 2005, 16: 1447-57.
- Ahrar K, Gowda A, Javadi S, et al. Preclinical assessment of a 980-nm diode laser ablation system in a large animal tumor model. J Vasc Interv Radiol 2010, 21: 555-61.
- Vogl TJ, Eichler K, Straub R, et al. Laser-induced thermotherapy of malignant liver tumors: general principles, equipment(s), procedure(s)--side effects, complications and results. Eur J Ultrasound 2001, 13: 117-27.
- Stafford RJ, Fuentes D, Elliott AA, et al. Laser-induced thermal therapy for tumor ablation. Crit Rev Biomed Eng 2010, 38: 79-100.
- Simon CJ, Dupuy DE, Mayo-Smith WW. Microwave ablation: principles and applications. Radiographics 2005, 25 Suppl 1: S69-83.
- Brace CL, Sampson LA, Hinshaw JL, et al. Radiofrequency ablation: simultaneous application of multiple electrodes via switching creates larger, more confluent ablations than sequential application in a large animal model. J Vasc Interv Radiol 2009, 20: 118-24.
- Brace CL, Laeseke PF, Sampson LA, et al. Microwave ablation with a single small-gauge triaxial antenna: in vivo porcine liver model. Radiology 2007, 242: 435-40.
- Wang Y, Sun Y, Feng L, et al. Internally cooled antenna for microwave ablation: results in ex vivo and in vivo porcine livers. Eur J Radiol 2008, 67: 357-61.
- Rabkin BA, Zderic V, Crum LA, et al. Biological and physical mechanisms of HIFU-induced hyperecho in ultrasound images. Ultras Med Biol 2006, 32: 1721-9.
- Esnault O, Franc B, Monteil JP, et al. High-intensity focused ultrasound for localized thyroid-tissue ablation: preliminary experimental animal study. Thyroid 2004, 14: 1072-6.
- Esnault O, Franc B, Menegaux F, et al. High-intensity focused ultrasound ablation of thyroid nodules: first human feasibility study. Thyroid 2011, 21: 965-73.
- Kovatcheva RD, Vlahov JD, Shinkov AD, et al. High-intensity focused ultrasound to treat primary hyperparathyroidism: a feasibility study in four patients. AJR 2010, 195: 830-5.
- Permpongkosol S, Nicol TL, Link RE, et al. Differences in ablation size in porcine kidney, liver, and lung after cryoablation using the same ablation protocol. AJR 2007, 188: 1028-32.
Chirurgia radio/ecoguidata delle recidive locali
Andrea Liverani, Tatiana Di Cesare, Francesco Cilurso, Carmelo Morano
UOC di Chirurgia Generale, Ospedale Regina Apostolorum, Albano Laziale
INTRODUZIONE
Nel 5-20% circa dei pazienti con carcinoma differenziato della tiroide (DTC), dopo il trattamento iniziale si manifesta persistenza di malattia o recidiva loco-regionale. Nel 70-80% di questi casi la ripresa di malattia si localizza nei linfonodi. I due terzi dei casi si presentano nella prima decade di follow-up (1,2).
La recidiva locale, palpabile o visualizzabile con US, TC, RMN, trova nella exeresi chirurgica il trattamento elettivo e preferibile.
Per le recidive locali o linfonodali captanti, il solo trattamento radio-metabolico con 131I è efficace solo nelle lesioni di piccole dimensioni. Le recidive locali e linfonodali non captanti, così come le recidive non palpabili già trattate con 131I e visualizzabili con US o altra metodica ma non responsive al trattamento, devono essere trattate chirurgicamente.
Il re-intervento è un importante fattore di rischio per complicanze specifiche:
- alterazione dei normali piani anatomici;
- difficile dissociazione delle strutture anatomiche, spesso inglobate in cicatrice;
- dimensioni della recidiva con ampie dissezioni.
L’aumento delle complicanze è di 3–5 volte.
Obiettivi primari delle metodiche chirurgiche assistite sono:
- identificare la sede della recidiva neoplastica;
- guidare l’asportazione radicale della recidiva;
- confermare l’avvenuta asportazione;
- limitare la dissezione dei tessuti al fine di una riduzione delle complicanze;
- utilizzare accessi chirurgici anatomicamente vergini.
CHIRURGIA ECO-GUIDATA (IOUS)
La metodica identifica le recidive non palpabili, può suggerire variazioni dell’intervento, verifica la completa asportazione dei tessuti patologici (3,4).
Problemi e limiti della metodica sono (5,6):
- l’eccessiva impedenza acustica dei tessuti cicatriziali, della fibrosi, delle calcificazioni, dei punti non riassorbiti, crea zone cieche e notevoli problemi d’interpretazione dell’immagine ecografica;
- la metodica è operatore-sensibile e può aumentare i tempi operatori;
- difficoltà operative in campo operatorio aperto;
- bassa sensibilità e specificità nell’esplorazione del VI compartimento.
La chirurgia eco-guidata con repere metallico (fig 1) è una possibile variazione della metodica che comporta (7):
- minimo rischio di lesione ricorrenziale;
- buoni risultati;
- discomfort del paziente;
- possibile dislocazione del repere specie per lesioni superficiali o durante la dissezione tessutale;
- difficoltà in presenza di cicatrici dense (tessuto cicatriziale);
- rischioso posizionamento in prossimità dei grossi vasi;
- supporto ecografico intra-operatorio per conferma radicalità.

Figura 1
Posizionamento sotto guida ecografica di repere metallico per successiva resezione
EXERESI CROMO-GUIDATA
Tale metodica consiste nell’iniezione eco-guidata all’interno della lesione di colorante vitale; ciò consente buona visualizzazione intra-operatoria (fig 2) e riduzione della dissezione tessutale, ma necessita di assoluta precisione dell’inoculo, può provocare reazione allergica al colorante e tossicità locale (necrosi cutanea, neurotossicità)(8). La verifica della radicalità è esclusivamente visiva o ecografica.

Figura 2
Iniezione di colorante vitale sotto guida ecografica (a sinistra) per facilitare il riconoscimento intra-operatorio della lesione (a destra)
CHIRURGIA RADIO-GUIDATA
Il principio su cui si basa è l’accumulo di uno specifico tracciante radioattivo all’interno di un tessuto bersaglio. Il tessuto così marcato viene identificato attraverso l’uso di una gamma-sonda intra-operatoria.
Recidive iodocaptanti
Il primo radio-farmaco utilizzato per la chirurgia della tiroide è stato ovviamente lo iodio-131 (9-10). In una casistica di 31 pazienti, il 41% di 184 foci metastatici asportati erano stati visti solo dalla scintigrafia intra-operatoria (11).
Vantaggi della metodica sono:
- localizzazione della recidiva con elevata specificità e sensibilità;
- localizzazione della recidiva anche in tessuto cicatriziale o in sedi anatomiche “sfavorevoli” (retro-vascolari o mediastiniche);
- rilevazione di foci non visualizzati alla scintigrafia pre-operatoria;
- conferma dell’asportazione radicale della lesione.
I problemi sono:
- esposizione del paziente e degli operatori ad alte dosi di radiazioni;
- protocollo di lunga durata (8 giorni). È stato però proposto l’uso di 123I alla dose di 2 mCi, la cui breve emivita (13 ore) consente l’intervento lo stesso giorno o il giorno successivo (12).
Recidive non iodio-captanti
Solo una parte dei DTC recidivi captano iodio (50-60% dei PTC e 64-67% dei FTC). In quelli che non lo captano viene utilizzato come radiofarmaco il 99mTc-MIBI ev, che ha dimostrato alta sensibilità nell’individuare recidive cervicali e mediastiniche di DTC (il 60-70% dei casi capta il tracciante)(13,14). Iniettando alcuni minuti prima dell’intervento il tracciante (da 1 a 20 mCi) diluito in soluzione salina, si è ottenuta l’asportazione del 16% di 147 foci metastatici non rilevati dalle metodiche di localizzazione pre-operatoria (15,16).
Questo tipo di procedura è stato adottato anche nel carcinoma midollare (MTC): combinando 111Indio-pentetreotide e 99mTc-DMSA è stata riportata una sensibilità del tumore del 97% (17,18).
È recente la comparsa in letteratura (19) dell’uso di sonda PET intra-operatoria con l’utilizzo di 18F-FDG come radio-farmaco per le recidive non captanti di DTC in 12 pazienti: attenzione ai falsi positivi nel II livello (per l’alta captazione fisiologica delle ghiandole sotto-mandibolari).
ROLL (localizzazione radioguidata di lesioni non palpabili)
La tecnica è nata per l’asportazione di neoplasie mammarie non palpabili e consiste nell’iniezione eco-guidata intra-tumorale (nel tumore individuato in precedenza con metodica d’immagine) il giorno prima o lo stesso giorno dell’intervento di un radio-farmaco a base di 99mTc coniugato (a colloide di albumina umana, nano-colloide, macro-aggregato di albumina, destrano), con l’utilizzo di una gamma-sonda intra-operatoria per la ricerca e rimozione della lesione inoculata senza danno al tessuto circostante. Esistono alcune segnalazioni sull’uso della tecnica nelle recidive di DTC (20-23).
Nella nostra esperienza dal 2010 abbiamo trattato 38 pazienti (età media 47 anni, con range 18-85 anni, 26 donne e 12 uomini), con recidiva di carcinoma tiroideo (3 MTC, 34 PTC, 1 FTC+PTC), precedente tiroidectomia totale e linfoadenectomia compartimentale, conferma della recidiva (linfonodale in 32 e parenchimale in 6) con esame citologico su FNA-US. Da 1 a 2 ore prima dell’intervento sono stati sottoposti a inoculazione eco-guidata nella/e recidive con ago sottile 21G di 0.1 mL di nano-colloide marcato con 10 MBq di 99mTc. I pazienti sono poi stati divisi in 2 gruppi: gruppo 1 (n = 19, F14-M5) sottoposto a trattamento chirurgico tradizionale (eco-guidato o dissezione anatomica), gruppo 2 (n = 19, F12-M7) a chirurgia radio-guidata.
La durata dell’intervento è risultata pari a 100±45 min nel gruppo 1 vs 113±37 min nel gruppo 2 (p = 0.9). Nessuna complicanza si è verificata nei 2 gruppi. Il numero di linfonodi asportati è stato pari a 171 nel gruppo 1 vs 153 nel gruppo 2, ma nel gruppo 1 l'istologia ha confermato una positività di 38 linfonodi (22% circa), mentre nel gruppo 2 la positività istologica si è avuta per 54 linfonodi (circa il 35%). Nel gruppo 2 il chirurgo ha modificato l'accesso chirurgico in 2 casi.
In conclusione la metodica
- è di facile riproducibilità;
- consente la precisa localizzazione intra-operatoria della recidiva, limitando il rimaneggiamento tissutale;
- non necessita di professionalità specifica nell’uso dello strumento di rilevazione;
- consente di mantenere gli stessi tempi operatori;
- è di guida per l’utilizzo di piani di dissezione non convenzionali;
- dà la certezza dell’asportazione di tutto il tessuto inoculato;
- il tempo di apprendimento è rapido (2-3 casi);
- consente il risparmio in termini di utilizzo di sala operatoria e degenza post-operatoria (dimissione in 2° giornata post-op).
Nella nostra esperienza la metodica è sempre consigliabile e potrebbe essere ritenuta obbligatoria in caso di pluri-recidiva, collo fisicamente/anatomicamente “difficile”, sede retro-vascolare, IV e VI compartimento.
BIBLIOGRAFIA
- Mazzaferri EL, Kloos RT. Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab 2001, 86: 1447-63.
- Club delle UEC-Associazione delle Unità di Endocrinochirurgia Italiane, Rosato L, Pinchera A, Bellastella A, et al. Diagnostic, therapeutic and healtcare management protocols in thyroid surgery. I consensus conference (UEC club). Chir Ital 2006, 58: 141-50.
- Karwowski JK, Jeffrey RB, McDougall IR, et al. Intraoperative ultrasonography improves identification of recurrent thyroid cancer. Surgery 2002, 132: 924–9.
- Solorzano CC, Carneiro DM, Ramirez M, et al. Surgeon-performed ultrasound in the management of thyroid malignancy. Am Surg 2004, 70: 576-80.
- Mc Coy KL, et al. Same-day ultrasound guidance in reoperation for locally recurrent papillary thyroid cancer. Surgery 2007, 142: 965-72.
- Ahn JE, et al. Diagnostic accuracy of CT and ultrasonography for evaluating metastatic cervical lymph nodes in patients with thyroid cancer. World J Surg 2008, 32: 1552-8.
- Triponez F, et al. Hook needle-guided excision of recurrent differentiated thyroid cancer in previously operated neck compartments: a safe technique for small, nonpalpable recurrent disease. J Clin Endocrinol Metab 2006, 91: 4943-7.
- Sippel RS, et al. Localization of recurrent thyroid cancer using intraoperative ultrasound-guided dye injection. World J Surg 2009, 33: 434-9.
- Travagli JP, et al. Combination of radioiodine (131I) and probe-guided surgery for persistent or recurrent thyroid carcinoma. J Clin Endocrinol Metab 1998, 83: 2675-80.
- Salvatori M, et al. Radio-guided surgery for lymph node recurrences of differentiated thyroid cancer. World J Surg 2003, 27: 770-5.
- Rubello D, et al. Iodine-131 radio-guided surgery in differentiated thyroid cancer: outcome on 31 patients and review of the literature. Biomed Pharmacother 2007, 61: 477-81.
- Gallowitsch H, et al. Gamma probe-guided resection of a lymph node metastasis with I-123 in papillary thyroid carcinoma. Clin Nucl Med 1997, 22: 591-2.
- Pelizzo MR, et al. Contribution of SLN investigation with 99mTc-nanocolloid in clinical staging of thyroid cancer: technical feasibility. Eur J Nucl Med Mol Imaging 2007, 34: 934-8.
- Boz A, etal. Gamma probe-guided resection and scanning with TC-99m MIBI of a local recurrence of follicular thyroid carcinoma. Clin Nucl Med 2001, 26: 820-2.
- Rubello D, et al. 99mTc-MIBI radio-guided surgery for recurrent thyroid carcinoma: technical feasibility and procedure, and preliminary clinical results. Eur J Nucl Med Mol Imaging 2002, 29: 1201-5.
- Rubello D, et al. 99mTc-sestamibi radio-guided surgery of loco-regional 131Iodine-negative recurrent thyroid cancer. Eur J Surg Oncol 2007, 33: 902-6.
- Adams S, et al. Radioisotope-guided surgery in patients with pheochromocytoma and recurrent medullary thyroid carcinoma: a comparison of preoperative and intraoperative tumor localization with histopathologic findings.Cancer 2001, 92: 263-70.
- De Labriolle-Vaylet C, et al. Successful surgical removal of occult metastases of medullary thyroid carcinoma recurrences with the help of immunoscintigraphy and radioimmunoguided surgery. Clin Cancer Res 2000, 6: 363-71.
- Kim WW, et al. Radioguided surgery using an intraoperative PET probe for tumor localization and verification of complete resection in differentiated thyroid cancer: a pilot study. Surgery 2011, 149: 416-24.
- Tukenmez M, et al. Radio-guided nonpalpable metastatic lymph node localization in patients with recurrent thyroid cancer. J Surg Oncol 2007, 96: 534-8.
- Erbil Y, et al. Radio-guided excision of metastatic lymph nodes in thyroid carcinoma: a safe technique for previously operated neck compartments. World J Surg 2010, 34: 2581-8.
- Martino A, et al. A new radioguided procedure for localization and surgical treatment of neck node metastasis of papillary thyroid cancer. J Endocrinol Invest 2010, 33: 339-42.
- Terzioglu T, et al. Excision efficiency of radioguided occult lesion localization in reoperative thyroid and parathyroid surgery. Thyroid 2010, 20: 1271-8.
Salvataggio delle vie aeree e delle vie digestive superiori
Marco Boniardi
SC di Chirurgia Generale Oncologica e Mininvasiva, Ospedale Niguarda Ca’ Granda, Milano
Le vie aeree possono essere interessate, per contiguità, dall’infiltrazione di un carcinoma tiroideo. Questa eventualità è piuttosto frequente nei carcinomi anaplastici, in più del 25% dei casi, mentre più raro è il loro coinvolgimento da parte dei carcinomi ben differenziati (6-8% dei casi). Ancora più raro, solo nel 3% dei casi, è l’interessamento delle vie digestive superiori (faringe-esofago), quasi sempre in associazione ad un’infiltrazione delle vie aeree (1-3).
Si tratta più spesso di malati anziani, nei quali il carcinoma della tiroide presenta un andamento più aggressivo.
L’interessamento delle vie aeree da parte del tumore tiroideo comporta un significativo peggioramento della prognosi, con aumento della morbilità e della mortalità, soprattutto quando lo sviluppo del tumore coinvolge tutta la parete del viscere con estensione intra-luminale. Sono infatti possibili, in questi casi, episodi di soffocamento, per stenosi del lume o per paralisi ricorrenziale bilaterale, o di asfissia per imponenti emorragie all’interno dell’albero respiratorio.
Diagnosi
La diagnosi di infiltrazione delle vie aeree/digestive da parte del tumore tiroideo viene posta sulla base di segni clinici e con l’ausilio di indagini strumentali.
La consistenza lignea del tumore e la sua fissità sui piani profondi costituiscono segni indiretti di interessamento delle strutture viscerali del collo; così pure la comparsa di disfonia può indurre al sospetto di una paralisi ricorrenziale per coinvolgimento diretto del nervo ricorrente o per infiltrazione dei muscoli laringei. L’interessamento della trachea può però presentarsi anche in assenza di paralisi ricorrenziale.
L’emoftoe è invece sempre il riflesso di uno sviluppo intraluminale del tumore.
La laringoscopia indiretta o la fibroscopia laringea possono evidenziare una paralisi delle corde vocali o, nelle forme più avanzate, consentono di rilevare focolai emorragici nelle aree infiltrate.
La TC e la RM rappresentano al momento le indagini più accurate per il riconoscimento di un coinvolgimento delle vie aeree e digestive da parte del tumore: esse consentono inoltre di valutare l’estensione della malattia e di pianificare una corretta strategia di trattamento.
Di scarso rilievo, ai fini diagnostici, sono l’ecotomografia, più indicata per lo studio delle lesioni focali tiroidee o delle linfoadenopatie satelliti, e la PET, utile nell’evidenziare la presenza di tessuto neoplastico, ma priva di definizione anatomica.
Trattamento
Nei carcinomi anaplastici il coinvolgimento delle vie aeree è nella maggior parte dei casi già presente all’esordio della malattia: spesso risulta interessata anche la via digestiva e possono essere presenti metastasi a distanza. La prognosi è severa e non sono in questi casi giustificati comportamenti chirurgici aggressivi.
La terapia chirurgica può invece presentare un ruolo fondamentale nel trattamento delle forme avanzate di carcinomi ben differenziati.
Nei casi di infiltrazione superficiale della trachea o della laringe da parte del tumore prevale un atteggiamento chirurgico conservativo. Viene attuata la cosiddetta “shaving resection”, che consiste nel distacco del tumore dal piano cartilagineo delle vie aeree. Il residuo di malattia, in genere di piccola entità, viene successivamente trattato con radioterapia esterna o con iodio-131. I risultati di questo approccio, in letteratura, vengono riferiti sovrapponibili in termini di sopravvivenza ad interventi più radicali.
Interventi chirurgici demolitivi con conservazione della funzione respiratoria possono trovare indicazione nei carcinomi ben differenziati a lenta evoluzione, in cui la neoplasia infiltri la parete laringea o tracheale “a tutto spessore”. Lo scopo di queste procedure è radicalizzare, quando possibile, l’exeresi della neoplasia, ma soprattutto di impedire l’instaurarsi di una stenosi delle vie aeree e di prevenire il rischio di morte da asfissia per emorragia nell’albero respiratorio.
Si tratta di interventi chirurgici che richiedono grande competenza e una notevole esperienza da parte del chirurgo, che risulta decisiva nel garantire radicalità all’intervento e nel contenere, in limiti accettabili, la percentuale di complicanze. L’indicazione ad una resezione laringea o tracheale, anche in considerazione della morbilità non trascurabile di queste procedure, non può prescindere da un’attenta valutazione del rischio operatorio (età del paziente, condizioni generali, comorbilità presenti), dell’ estensione e dell’aggressività della malattia, dell’assenza di altri focolai metastatici non suscettibili di trattamento.
Gli interventi demolitivi con salvataggio delle vie aeree e della funzione vocale più comunemente utilizzati sono (2,3):
- l’emilaringectomia verticale, che prevede un’asportazione della porzione di laringe infiltrata dal tumore;
- la resezione circonferenzale di uno o più anelli tracheali, con ricostruzione diretta della continuità del lume tracheale (4);
- resezioni parziali della parete tracheale (“fenestrazioni”) e ricostruzione della parete mediante copertura con fibre o aponeurosi dei muscoli pre-tiroidei.
Il coinvolgimento delle vie digestive consente una più limitata possibilità di intervento (5). Solo nel caso in cui il carcinoma si estende posteriormente alla faringe, coinvolgendo il seno piriforme, anche con sviluppo intra-luminale, è possibile eseguire l’exeresi monolaterale del seno piriforme mediante una faringectomia laterale: questo intervento può garantire una radicalità oncologica senza sacrificare la funzione fonatoria e il meccanismo della deglutizione.
Più difficoltosa è la preservazione delle vie digestive in caso di interessamento dell’esofago, associato, quasi costantemente, a un coinvolgimento della trachea da parte della neoplasia. Se la parete del viscere è infiltrata solo parzialmente, nella porzione più esterna, è possibile asportare la tonaca muscolare salvaguardando l’integrità della sottomucosa e della mucosa. Se l’esofago è invece coinvolto a tutto spessore, si rende necessaria una esofagectomia totale (approccio cervico-toraco-addominale) con ripristino della continuità del tratto digestivo mediante anastomosi tra faringe e stomaco tubulizzato o, più raramente, con il colon destro escluso dal transito intestinale. L’esofagectomia è un intervento gravato da una significativa morbilità e mortalità: l’indicazione ad una procedura così demolitiva deve essere pertanto commisurata a una concreta prospettiva di radicalità oncologica e ad una ragionevole convinzione di poter incidere favorevolmente sulla prognosi della malattia.
I trattamenti adiuvanti con radioterapia o con terapia radiometabolica devono essere considerati, in ogni caso, parte integrante anche di queste procedure chirurgiche, per garantire un migliore controllo locale della malattia e per ridurre in modo significativo la percentuale di recidive.
Bibliografia
- Andersen PE, et al. Differentiated carcinoma of the thyroid with extrathyroidal extention. Am J Surg 1995, 170: 467-70.
- Mc Caffrey TV. Invasive disease: management of the larynx. In Randolph GW: Surgery of the thyroid and parathyroid glands. Ed Saunders 2003, cap 26: 343.
- Grillo HC. Invasive disease: management of the trachea. In Randolph GW: Surgery of the thyroid and parathyroid glands. Ed Saunders 2003, cap 27: 350.
- Ozaki O, et al. Surgery for patients with thyroid carcinoma invading the trachea: circumferential sleeve resection followed by end-to-end anastomosis. Surgery 1995, 117: 268-71.
- Mellière DJ, et al. Thyroid carcinoma with tracheal or esophageal involvement: limited or maximal surgery? Surgery 1993, 113: 166-72.
Trattamento delle metastasi ossee
Alessandro Gasbarrini1, Michele Cappuccio2
1Chirurgia vertebrale oncologica e degenerativa, Istituto Ortopedico Rizzoli, Bologna
2Ortopedia e traumatologia – Chirurgia vertebrale, Ospedale Maggiore, Bologna
(aggiornato al 25 novembre 2015)
SOMMARIO
Il numero di pazienti con metastasi ossea sintomatica che giunge all’osservazione del chirurgo ortopedico è in costante aumento. L’individuazione del trattamento più idoneo è di fondamentale importanza per questi pazienti, in quanto una corretta scelta terapeutica ha notevoli implicazioni sulla qualità di vita residua. Viene proposto un algoritmo di trattamento multi-disciplinare del paziente con metastasi ossee centrato sul paziente, nel quale sono coinvolte diverse figure professionali, quali l’oncologo, il radioterapista, l’anestesista e il chirurgo ortopedico.
INTRODUZIONE
L’incidenza di metastasi scheletriche in corso di malattia neoplastica viscerale è inferiore solo alla localizzazione polmonare ed epatica. La scelta del trattamento più idoneo assume importanza cruciale per il paziente, che può essere gravemente inabilitato dalla presenza di una metastasi ossea non trattata.
Trattandosi della manifestazione di una malattia sistemica, le metastasi scheletriche necessitano di un trattamento multi-disciplinare, in cui radioterapia, terapia farmacologica e chirurgia devono integrarsi, al fine di ottenere il miglior controllo locale possibile della lesione (1).
I capisaldi del trattamento chirurgico di una lesione metastatica sono stati esaurientemente indicati in quattro punti da Sherry e coll nel 1982 (2):
- poiché la prima procedura è quella che ha la migliore probabilità di successo, bisogna cercare di ridurre al minimo il rischio di recidiva locale o di progressione di malattia e quindi di un secondo intervento;
- si deve ricostituire quanto più è possibile del difetto osseo; la sostituzione protesica è spesso un’opzione migliore della riduzione e sintesi;
- si deve cercare di rendere più breve possibile l’ospedalizzazione, tenendo sempre in mente la ridotta aspettativa di vita del paziente;
- si deve mirare al più rapido ritorno a uno stato funzionale autonomo, eliminando lunghi periodi di immobilizzazione.
A livello vertebrale il trattamento di un paziente con malattia metastatica deve anche mirare a evitare un deterioramento della funzione neurologica, oltre a dare stabilità alla colonna vertebrale e ripristinare un corretto allineamento sagittale. In pratica il trattamento chirurgico deve mirare ad ottenere un buon controllo locale, riducendo al minimo la possibilità di recidiva locale, ed eliminare il dolore oncologico e/o neurologico con una bassa morbilità peri-operatoria e post-operatoria.
APPROCCIO AL TRATTAMENTO CHIRURGICO DEL PAZIENTE CON METASTASI OSSEA
La valutazione del trattamento da eseguire in un paziente affetto da metastasi ossea dipende da numerosi fattori e coinvolge come si è detto figure professionali diverse, facenti parte di un vero team multi-disciplinare. Oltre al chirurgo ortopedico oncologico, le altre figure coinvolte sono l’anestesista, che deve partecipare all’eventuale intervento chirurgico, l’oncologo, il radioterapista, il terapista del dolore e di volta in volta il chirurgo generale e/o toracico in caso di presenza di metastasi viscerali o il neurochirurgo per metastasi encefaliche.
Vi sono alcune differenze per quanto riguarda la localizzazione metastatica alle ossa lunghe degli arti rispetto alle localizzazioni vertebrali, anche se i principi oncologici rimangono i medesimi. Di seguito vengono riportati i vari fattori determinanti il tipo di trattamento da eseguire.
Operabilità (ASA score)
L’operabilità, da valutarsi ad opera dell’anestesista, è il primo fattore determinante e discriminante sul tipo di trattamento da eseguire. L’anestesista va anche informato sul tipo di intervento chirurgico al quale il paziente dovrebbe essere sottoposto, la durata prevista e il sanguinamento intra-operatorio. A tal proposito, l’anestesista deve sapere che interventi ritenuti di chirurgia maggiore, possono risultare meno “impegnativi” di interventi minori e di minor durata ma che possono produrre sanguinamenti intra-operatori notevoli (3), soprattutto in tumori intensamente vascolarizzati nei quali non si è riusciti ad effettuare una completa embolizzazione delle afferenze vascolari della lesione. L’ASA score è un parametro fondamentale, anche per la sua correlazione con la sopravvivenza a breve e medio termine nei pazienti metastatici sottoposti a trattamento chirurgico (4).
| Tabella 1 Valutazione dello stato del paziente secondo la American Society of Anestesiology (ASA) |
|
| ASA 1 | Paziente in buona salute |
| ASA 2 | Presenza di una malattia sistemica minore senza alcuna limitazione funzionale |
| ASA 3 | Presenza di una malattia sistemica grave con moderata limitazione funzionale |
| ASA 4 | Presenza di una malattia sistemica grave con costante pericolo per la sopravvivenza |
| ASA 5 | Paziente prossimo al decesso, che si prevede non possa sopravvivere senza l’intervento |
Valutazione del rischio di frattura patologica (FP)
Tale valutazione deve essere effettuata dall’ortopedico o dal chirurgo vertebrale. Vi è differenza tra il rischio di frattura di una metastasi localizzata agli arti, rispetto al rischio di frattura di una osteolisi vertebrale.
Metastasi delle ossa lunghe
I parametri tradizionalmente proposti come indicatori di rischio di frattura degli arti sono una lesione di dimensioni > 25 mm, una lesione interessante più del 50% della circonferenza o del diametro dell’osso, l’aspetto osteolitico, il dolore ingravescente, in particolare se successivo anche al trattamento radioterapico.
Il sistema di valutazione del rischio di frattura più noto, per quanto riguarda lo scheletro appendicolare, è quello proposto da Mirels nel 1989 (5), con un sistema a punti che tiene conto della sede anatomica, del grado del dolore, dell’aspetto radiografico (litico, misto, addensante) e delle dimensioni della lesione rispetto al diametro del segmento osseo. Altri autori hanno proposto l’aggiunta di ulteriori parametri al sistema proposto da Mirels, in particolare suggerendo come criteri di rischio aggiuntivo la localizzazione al femore prossimalmente al piccolo trocantere e nella metà prossimale dell’omero, il fatto che il paziente non sia in trattamento con bisfosfonati, la presenza di osteoporosi primaria o secondaria.
Van Der Linden nel 2004 (6) ha presentato un interessante studio in cui in 102 pazienti è stata valutata la correlazione tra frattura e presenza della maggior parte tra i fattori di rischio: l’unico criterio che risultava statisticamente significativo era l’interessamento longitudinale della corticale > 30 mm.
Il femore è il segmento osseo più a rischio per frattura patologica per le notevoli sollecitazioni meccaniche in flessione e torsione. Le regioni più a rischio in tale segmento sono il collo, la regione sotto-trocanterica e sovra-condiloidea.
Metastasi vertebrali
Il rischio di frattura in una lesione metastatica vertebrale è stato definito da un gruppo di autori facenti parte del “Spine Oncology Study Group” e prende il nome di SINS (Spinal Instability Neoplastic Score) (7). È un sistema a punteggio che prende in considerazione vari fattori, dalla localizzazione della lesione, al dolore, al tipo di lesione ossea e al suo coinvolgimento all’interno della vertebra, alla presenza o meno di collasso vertebrale. Il punteggio totale è quindi individuato da 6 elementi e può variare da 0 a 18:
- da 0 a 6: lesione stabile;
- da 13 a 18: lesione instabile e quindi suscettibile di trattamento chirurgico;
- da 7 a 12: gli autori raccomandano una consulenza del chirurgo vertebrale per rischio di FP.
| Tabella 2 Punteggio per l’instabilità spinale neoplastica (Spinal Instability Neoplastic Score – SINS) |
|
| Elementi | Punteggio |
| Localizzazione | |
| Giunzionale (occipite-C2, C7-T2, T11-L1, L5-S1) | 3 |
| Rachide mobile (C3-C6, L2-L4) | 2 |
| Rachide semi-rigido (T3-T10) | 1 |
| Rachide rigido (S2-S5) | 0 |
| Dolore che recede in posizione supina e/o dolore sotto carico/movimento | |
| Sì | 3 |
| No (dolore occasionale, non meccanico) | 1 |
| Lesione asintomatica | 0 |
| Lesione ossea | |
| Litica | 2 |
| Mista (litica/addensante) | 1 |
| Addensante | 0 |
| Allineamento radiografico del rachide | |
| Presenza di sublussazione/traslazione | 4 |
| Presenza di cifosi/scoliosi di nuova insorgenza | 2 |
| Allineamento normale | 0 |
| Cuneizzazione vertebrale | |
| Cuneizzazione > 50% | 3 |
| Cuneizzazione < 50% | 2 |
| Non cuneizzazione, con coinvolgimento del corpo > 50% | 1 |
| Nessuna delle precedenti | 0 |
| Coinvolgimento degli elementi vertebrali posteriori | |
| Bilaterale | 3 |
| Unilaterale | 1 |
| Nessuna delle precedenti | 0 |
Sensibilità dell’istotipo tumorale alle terapie non chirurgiche
Questa valutazione deve essere effettuata da oncologi e radioterapisti in rapporto all’istotipo tumorale della lesione metastatica da trattare.
È necessario avere una diagnosi istologica della lesione, soprattutto in presenza di lesione solitaria con anamnesi negativa per tumore. L’istotipo della lesione tumorale è fondamentale non solo per la determinazione della prognosi quoad vitam del paziente, ma anche per valutare l’eventuale sensibilità alle terapie non chirurgiche. Come risposta prevista alle terapie adiuvanti, deve essere considerata la potenzialità della lesione ossea di riparare e ossificare dopo trattamento locale (radioterapia) o sistemico (chemioterapia, terapia ormonale, radioiodio, immunoterapia, ecc).
La sensibilità dell’istotipo tumorale alle terapie adiuvanti non è solo importante per i pazienti che non possono essere operati, ma assume valore cruciale anche a livello chirurgico. In caso di lesione non sensibile ad alcuna terapia, bisognerà prendere in considerazione la terapia chirurgica escissionale. Al contrario, in caso di lesioni rispondenti alle terapie adiuvanti, la chirurgia ortopedica può essere di supporto per un eventuale rischio di FP ed è di tipo funzionale.
Prognosi del paziente: istotipo e numero di metastasi ossee e/o viscerali e loro trattabilità
Esistono controversie sul trattamento di una metastasi ossea isolata, soprattutto in assenza di FP. In molti casi si tende a trattare una metastasi isolata, come un tumore primitivo, in maniera curativa (8), con una resezione ampia, senza dare importanza ad altri fattori. La resezione tumorale in una malattia metastatica determina sicuramente un miglior controllo locale della malattia (9), ma non è assolutamente dimostrato che aumenti la sopravvivenza del paziente. In realtà, anche in questi casi è molto importante la sensibilità alle terapie adiuvanti.
Al momento attuale le lesioni metastatiche che si giovano di un trattamento aggressivo di resezione in blocco a margini ampi, sono le metastasi da carcinoma renale a cellule chiare, sia in termini di sanguinamento intra-operatorio, sia in termini di controllo locale. Attualmente, infatti, non esistono terapie non chirurgiche in grado di controllare adeguatamente tale istotipo tumorale. Per quanto riguarda le metastasi uniche da tiroide, alcuni autori sostengono che l’asportazione del tumore permette una maggior efficacia della terapia con radioiodio. L’asportazione con margini ampi garantisce un minor sanguinamento.
La presenza di metastasi viscerali, polmonari ed epatiche, soprattutto se non operabili, è tra i fattori prognostici “quoad vitam” più negativi (10,11).
Sede ossea nelle metastasi degli arti
Molta importanza assume anche la localizzazione della lesione all’interno del segmento scheletrico interessato. Le ossa lunghe si possono suddividere in una parte diafisaria e nelle estremità articolari meta-epifisarie. A livello biomeccanico e ricostruttivo esistono differenze fondamentali nel trattamento di lesioni metastatiche diafisarie o meta-epifisarie (3). È sempre utile eseguire, oltre alle radiografie standard nelle 2 proiezioni del segmento scheletrico interessato, anche RM e TC. La RM è attualmente la metodica migliore nel determinare l’estensione della lesione metastatica all’interno del segmento scheletrico interessato ed è anche molto utile nel determinare la presenza di eventuali “skip metastases”, mentre con la TC si riesce a studiare meglio la struttura ossea e la qualità del coinvolgimento a livello corticale o spongioso.
ALGORITMO di TRATTAMENTO
In base alla valutazione dei parametri suddetti, viene proposto un algoritmo di trattamento delle metastasi dello scheletro appendicolare (fig. 1), e uno per il trattamento delle metastasi vertebrali (fig. 2) (12-14).
L’algoritmo di trattamento proposto è centrato sul paziente, è multi-disciplinare perché coinvolge figure professionali diverse, è dinamico e in costante aggiornamento. Non è un sistema statico a punteggio, nel quale la somma di diversi parametri determina il tipo di trattamento da eseguire. I diversi istotipi tumorali vengono presi in considerazione solo in base alla loro sensibilità o resistenza alle terapie adiuvanti. La sensibilità alle terapie non chirurgiche, ad esempio, è un parametro molto importante che tende a cambiare nel corso degli anni in rapporto alla scoperta di nuovi farmaci e/o protocolli terapeutici. In questi casi il percorso all’interno della flow-chart tende a cambiare in rapporto all’evoluzione e al progresso scientifico.
È centrato sul paziente in quanto più che la malattia si prende in considerazione il malato, pianificando per lo stesso l’iter più idoneo. Esistono 4 output per questo algoritmo: la chirurgia escissionale, la chirurgia palliativa, la terapia del dolore e le terapie adiuvanti (chemio, radioterapia, terapia ormonale e immunoterapia).


CONCLUSIONI
L’algoritmo di trattamento delle metastasi dello scheletro appendicolare rappresenta uno strumento per la valutazione del tipo di trattamento più idoneo nel paziente con metastasi ossee. Le caratteristiche principali sono:
- è semplice da applicare e intuitivo;
- è multi-disciplinare, in quanto non sono previste solo opzioni chirurgiche e sono coinvolte figure professionali diverse;
- è individualizzato e centrato sul paziente e non sulla malattia metastatica e le sue caratteristiche;
- è sempre attuale e aggiornato in rapporto alla scoperta di nuovi farmaci e protocolli terapeutici.
BIBLIOGRAFIA
- Damron TA, Sim FH. Surgical treatment for metastatic disease of the pelvis and the proximal end of the femur. Instr Course Lect 2000, 49: 461-70.
- Sherry HS, Levy RN, Siffert RS. Metastatic disease of bone in orthopedic surgery. Clin Orthop 1982, 169: 44-52.
- Capanna R, Campanacci DA. The treatment of metastases in the appendicular skeleton. J Bone Joint Surg Br 2001, 83: 471-81.
- Chamogeorgakis T, Anagnostopoulos CE, Connery CP, et al. Independent predictors for early and midterm mortality after thoracic surgery. Thorac Cardiovasc Surg 2007, 55: 380-4.
- Mirels H. Metastatic disease in long bones. A proposed scoring system for diagnosing impending pathologic fractures. Clin Orthop 1989, 249: 256-64.
- Van der Linden YM, Dijkstra PDS, Kroon HM, et al. Comparative analysis of risk factors for pathological fracture with femoral metastases. Results based on a randomized trial of radiotherapy. J Bone Joint Surg 2004, 86B: 566-73.
- Fisher CG, Di Paola CP, Ryken TC, et al. A novel classification system for spinal instability in neoplastic disease: an evidence-based approach and expert consensus from the Spine Oncology Study Group. Spine (Phila PA 1976) 2010, 35: E1221-9.
- Lin PP, Mirza AN, Lewis VO, et al. Patient survival after surgery for osseous metastases from renal cell carcinoma. J Bone Joint Surg Am 2007, 89: 1794-801.
- Li H, Gasbarrini A, Cappuccio M, et al. Outcome of excisional surgeries for the patients with spinal metastases. Eur Spine J 2009, 18: 1423-30.
- Tokuhashi Y, Matsuzaki H, Oda H, et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis. Spine 2005, 30: 2186-91.
- Tomita K, Kawahara N, Kobayashi T, et al. Surgical strategy for spinal metastases. Spine 2001, 26: 298-306.
- Cappuccio M, Bandiera S, Babbi L, et al. Management of bone metastases. Eur Rev Med Pharmacol Sci 2010, 14: 407-14.
- Gasbarrini A, Cappuccio M, Mirabile L, et al. Spinal metastases: treatment evaluation algorithm. Eur Rev Med Pharmacol Sci 2004, 8: 265-74.
- Gasbarrini A, Li H, Cappuccio M, et al. Efficacy evaluation of a new treatment algorithm for spinal metastases. Spine (Phila PA 1976) 2010, 35: 1466-70.
Radioterapia esterna dei tumori tiroidei avanzati e delle recidive locali
Mattia Falchetto Osti, Linda Agolli
Cattedra di Radioterapia, Università “La Sapienza”, Roma, Facoltà di Medicina e Psicologia
PREMESSE E RAZIONALE
Le neoplasie della tiroide sono un gruppo eterogeneo di malattie per quanto riguarda l’incidenza, la storia naturale, la prognosi e la terapia: mentre solo una minoranza (5-7%) di pazienti con carcinoma tiroideo differenziato (DTC) presenta una malattia caratterizzata da uno stadio avanzato con estensione tale di malattia da richiedere l’intervento di un trattamento radioterapico aggiunto alla chirurgia e al trattamento medico, l’approccio multidisciplinare è richiesto in una quota maggiore di pazienti con carcinoma midollare (MTC) e di fatto nella quasi totalità dei pazienti con carcinoma anaplastico.
Le forme differenziate, come il carcinoma follicolare e quello papillare, hanno una buona prognosi, con sopravvivenza libera da malattia di circa il 90% a 20 anni. Il DTC e l’MTC hanno una crescita lenta, ma possono beneficiare di un trattamento locale in caso di malattia localmente avanzata o di recidiva regionale o presenza di sintomi locali quali disfonia, disfagia e dispnea dovuti alla diffusione di malattia nei tessuti adiacenti. Le forme indifferenziate (ITC) hanno un decorso sfavorevole, con scarsa risposta al trattamento e in casi selezionati possono essere avviati ad una terapia locale come la radioterapia, sia per una palliazione dei sintomi locali che per una non responsività ad altri tipi di trattamento. Pertanto, è necessario un approccio integrato multidisciplinare per migliorare la sopravvivenza e il controllo della malattia.
UTILIZZO DELLA RADIOTERAPIA
La radioterapia a fasci esterni (EBRT- external beam radiotherapy) è un'opzione nel trattamento dei carcinomi tiroidei localmente avanzati o delle recidive locoregionali, ma attualmente mancano studi prospettici randomizzati controllati che definiscano linee guida riguardanti il ruolo, la dose e la tempistica dell’EBRT nei carcinomi tiroidei. In letteratura esistono solo studi retrospettivi effettuati su casistiche eterogenee e su piccoli numeri di pazienti arruolati.
Carcinomi differenziati
Nelle forme differenziate le recidive locoregionali si verificano più frequentemente a livello dei linfonodi cervicali (90% dei casi) e le ricadute a distanza riguardano solo il 20% dei pazienti. Il trattamento radioterapico può essere adottato in questi pazienti, soprattutto se le lesioni sono non iodio-captanti. Nei carcinomi differenziati è stato dimostrato che la radioterapia a fasci esterni è vantaggiosa in termini di sopravvivenza e controllo locale di malattia in pazienti con età > 45 anni, residuo post-operatorio macroscopico ed estensione massiva extra-tiroidea (T4) o linfonodi positivi (N+) [1].
In uno studio retrospettivo condotto su 729 pazienti con DTC è stato dimostrato che la radioterapia aumenta l’intervallo libero da malattia e la sopravvivenza cancro-correlata nei pazienti ad alto rischio di recidiva (massiva estensione extra-tiroidea, età > 45 anni) [2]. Altri studi retrospettivi eseguiti su un minore numero di pazienti confermano l’efficacia dell’EBRT solo nei pazienti ad alto rischio. Negli ultimi 40 anni, sono stati pubblicati diversi studi retrospettivi che riportano risultati contrastanti, probabilmente dovuti ai bias riguardanti la selezione di pazienti con caratteristiche disomogenee [3]. In alcuni studi retrospettivi viene riportato solo un beneficio sul controllo locale dopo EBRT adiuvante in pazienti con malattia avanzata (pT4/N+) o residuo macroscopico post-operatorio (R2) o recidiva loco regionale [4-7], in assenza di beneficio evidente sulla sopravvivenza globale [6]. I limiti di questi studi sono abbastanza evidenti: mancanza di gruppi di confronto o presenza di controlli con diverse caratteristiche cliniche, mancata esclusione di fattori di confondimento, assenza di outcome primari a causa della lunga storia naturale della malattia. I risultati migliori (nel controllo locale e nell'arresto della progressione a distanza dei pazienti a rischio trattati con RT) si hanno nei pazienti con istologia papillare classica [8].
Per garantire un controllo adeguato, deve essere erogata al target una dose totale ≥ 50 Gy con frazionamento convenzionale [9] in frazioni da 2 Gy/die sui linfonodi sovra-claveari, latero-cervicali e mediastinici superiori. Un sovradosaggio fino a 60-70 Gy può essere erogato alle zone a rischio (residuo macroscopico, linfonodi positivi, letto chirurgico).
Carcinoma midollare
Il trattamento principale del MTC è quello chirurgico e la radioterapia adiuvante viene impiegata in pazienti con malattia localmente avanzata, linfonodi positivi o con livelli di calcitonina elevati dopo l’intervento chirurgico. In letteratura sono disponibili pochi studi con casistiche che prendono in considerazione esclusivamente il MTC. È stato riportato solo un lieve miglioramento del controllo locale in pazienti selezionati sottoposti a EBRT adiuvante, come in quelli in stadio avanzato T4/N+ con estensione extra-capsulare e con margini chirurgici positivi R1/R2 [10-11].
Generalmente vengono somministrati 40 Gy in 20 frazioni da 2 Gy/die per 5 giorni a settimana ai linfonodi latero-cervicali, sovra-claveari e mediastinici superiori, con un sovradosaggio di 10 Gy a livello del letto chirurgico [12]. L’EBRT può essere presa in considerazione anche per masse inoperabili o recidive locoregionali, ma in assenza di metastasi a distanza.
Neoplasie indifferenziate
Questi tumori sono a rapida progressione locale, spesso inoperabili alla diagnosi, con presenza di sintomi locali importanti per la rapida crescita tumorale con infiltrazione dei tessuti circostanti. A conferma del carattere aggressivo locale, la causa più frequente di morte è per soffocamento o asfissia secondaria ad ostruzione delle vie aree superiori. Quindi in questo gruppo di pazienti potrebbe essere utilizzato un trattamento locale come l’EBRT a fini palliativi [13-14]. Tali neoplasie necessitano di un approccio multidisciplinare per aumentare la sopravvivenza e le possibilità di cura. I tassi di risposta dopo EBRT come terapia neoadiuvante sono di circa 45% con dosi di 50-60 Gy, e quindi bisogna valutare il rapporto rischio/beneficio prima di decidere sul trattamento [15].
Nelle forma indifferenziate sono preferibili trattamenti ipofrazionati (50 Gy in 20 frazioni o 40 Gy in 15 frazioni), che aumentano il tempo mediano di sopravvivenza, oppure anche trattamenti RT iperfrazionati con dose totale di 60 Gy erogata in due frazioni giornaliere da 1.5 Gy ciascuna a distanza di 6 ore [13]. La radioterapia si utilizza con modalità palliative anche per le metastasi a distanza (ossee, encefaliche, polmonari).
TECNICA
Il trattamento viene pianificato utilizzando una tecnica tridimensionale conformazionale sulla base della TC di centraggio pre-trattamento. Per l’immobilizzazione del paziente durante le sedute di radioterapia viene utilizzata una maschera personalizzata, che permette di effettuare un trattamento ad alta precisione. Per verificare il posizionamento e garantire una terapia efficace vengono eseguiti periodicamente controlli attraverso immagini portali digitali.
EFFETTI COLLATERALI
Possibili effetti acuti possono essere: reazioni cutanee, mucositi, esofagiti, laringiti, xerostomia e disgeusia.
Possibili effetti tardivi possono essere: fibrosi cutanea, stenosi esofagea, carie dentali, xerostomia, linfedema sotto-mentoniero. Il trattamento radioterapico aumenta anche il rischio di secondi tumori, con un picco dopo 15-20 anni dal trattamento. Per questo motivo le indicazioni alla EBRT sono legate ad una categoria di pazienti con età > 45 anni.
Per ridurre i tassi di tossicità sono state utilizzate nuove tecniche come la IMRT, ma i risultati disponibili al momento non sono univoci.
CONCLUSIONI
Non esistono ad oggi studi basati sulle evidenze cliniche che dimostrino i benefici della radioterapia nel carcinoma della tiroide.
L’EBRT viene presa in considerazione:
- in tutte le istologie con modalità post-operatoria nei pazienti a rischio (malattia avanzata T4/N+, residuo macroscopico, età > 45 anni);
- nel caso di pazienti inoperabili dopo valutazione rischio/beneficio;
- nel trattamento delle recidive locoregionali;
- come palliazione dei sintomi locali o delle metastasi ossee.
BIBLIOGRAFIA
- Wilson PC, Millar BM, Brierly JD. The management of advanced thyroid cancer. Clin Oncol 2004, 16: 561-8.
- Bierly J, Tsang R, Panzanella T, et al. Prognostic factors and the effect of treatment with radioactive iodine and external beam radiation on patients with differentiated thyroid cancer seen at a single institution over 40 years. Clin Endocrinol 2005, 63: 418-27.
- Powell C, Newbold K, Harrington KJ, et al. External beam radiotherapy for differentiated thyroid cancer. Clin Oncol 2010, 22: 456-63.
- Chow SM, Law SC, Mendenhall WM, et al. Papillary thyroid carcinoma: prognostic factors and the role of radioiodine and external radiotherapy. Int J Radiat Oncol 2002, 52: 784-95.
- Kim Th, Yang DS, Jung KY, et al. Value of external irradiation for locally advanced papillary thyroid cancer. Int J Radiat Oncol 2003, 55: 1006-12.
- Keum KC, Suh YG, Koom WS, et al. The role of postoperative external beam radiotheapy in the management of patients with papillary thyroid cancer invading the trachea. Int J Radiat Oncol 2006, 65: 474-80.
- Terezakis SA, Lee KS, Ghossein RA, et al. Role of external beam radiotherapy in patients with advanced or recurrent non anaplastic thyroid cancer: memorial Sloan-Kettering Cancer Centre experience. Int J Radiat Oncol 2009, 73: 795-801.
- Farahati J, Reiners C, Stuschke M, et al. Differentiated thyroid cancer. Impact of adjuvant external radiotherapy in patients with perithyroidal tumor infiltration (stage pT4). Cancer 1996, 77: 172-80.
- Ford D, Giridharam S, McConkey C, et al. External beam radiotherapy in the management of differentiated thyroid cancer. Clin Oncol 2003, 15: 337-41.
- Brierley J, Tsang J, Simpson WJ, et al. Medullary thyroid cancer: analysis of survival and prognostic factors and the role of radiation therapy in local control. Thyroid 1996, 6: 305-10.
- Schwartz DL, Rana V, Shaw S, et al. Postoperative radiotherapy for advanced medullary thyroid cancer - local disease control in the modern era. Head Neck 2008, 30: 883-8.
- Brierley J, Maxon HR. Radioiodine and external radiation therapy in the treatment of thyroid cancer. In: Thyroid Cancer 1998: 285-317.
- Wang Y, Tsang J, Asa S, et al. Clinical outcome of anaplastic thyroid carcinoma treated with radiotherapy of once- and twice-daily fraction regimens. Cancer 2006, 107: 1786-92.
- Are C, Shaha AR. Anaplastic thyroid carcinoma: biology, pathogenesis, prognostic factors, and treatment approaches Ann Surg Oncol 2006, 13: 453-64.
- Tennvall J, Lundell G, Wahlberg P, et al. Anaplastic thyroid carcinoma: three protocols combining doxorubicine, radiotherapy and surgery. Br J Cancer 2002, 86: 1848-53.
Target therapy nei tumori tiroidei avanzati
Laura Rizza, Valerio Renzelli*, Francesca Rota, Paola Di Giacinto, Paolo Zuppi, Roberto Baldelli
UOSD di Endocrinologia, AO S. Camillo-Forlanini, Roma
*UOC di Endocrinologia, Università Sapienza - AO S. Andrea, Roma
(aggiornato al 16 maggio 2019)
Introduzione
Nei paesi occidentali l’incidenza del carcinoma tiroideo negli ultimi 20 anni è notevolmente aumentata grazie al perfezionamento delle procedure diagnostiche che hanno permesso di evidenziare forme tumorali allo stadio iniziale. Infatti, i micro-carcinomi tiroidei differenziati rappresentano ormai circa il 40% dei casi e hanno una prognosi eccellente solo con l’utilizzo di un trattamento chirurgico standard. Esistono inoltre forme tumorali indifferenziate, quali il carcinoma anaplastico (ATC), che si manifesta con una frequenza < 5%, caratterizzato da una frequente metastatizzazione e con prognosi infausta entro i primi 3-6 mesi dalla diagnosi (1, 2). Dalle cellule parafollicolari, cellule C, della ghiandola deriva invece il carcinoma midollare della tiroide (MTC), che rappresenta circa il 5-8% di tutti i carcinomi tiroidei e ha una prognosi intermedia tra i due istotipi precedentemente elencati.
È importante sottolineare che in circa un terzo dei casi i tumori tendono a perdere la classica differenziazione, che corrisponde a una concomitante perdita della capacità di captare il radioiodio. In questi pazienti, come pure in quelli con MTC metastatico e ATC, non esistono a oggi cure efficaci standardizzate: la chemioterapia o la radioterapia esterna hanno infatti dimostrato scarsa efficacia, con una risposta < 25% dei casi trattati (3). Pertanto, i pazienti con malattia di grado avanzato rapidamente progressiva e non rispondenti a terapia con radioiodio sono stati sottoposti, fino a questo momento, a schemi di chemioterapia con risposte scarse, transitorie e parziali. A tale scopo sono state utilizzate associazioni di agenti citotossici, come doxorubicina, 5-fluorouracile, cisplatino e taxani, trattando tutti i tipi istologici di carcinoma tiroideo avanzato, sia esso differenziato, midollare o anaplastico. Tali farmaci hanno dimostrato scarsa efficacia e il loro utilizzo è stato pressoché abbandonato.
Grazie a diversi studi che hanno permesso la scoperta delle diverse tappe della carcinogenesi tiroidea, è oggi possibile un nuovo approccio terapeutico ai tumori con istotipo particolarmente aggressivo e/o con un grado avanzato di malattia non rispondente agli schemi terapeutici standard (4). In particolare, è stato dimostrato che:
- l’insorgenza dei carcinomi papilliferi (PTC) è dovuta in circa l’80% dei casi a una singola mutazione attivante uno degli oncogeni, quali BRAF e RAS, oppure a riarrangiamenti del proto-oncogene RET (RET/PTC), che codificano tutti per alcune chinasi che attivano la via intra-cellulare delle MAPK (unità regolatrice della crescita cellulare)(4);
- nel carcinoma follicolare della tiroide (FTC) si ritrovano mutazioni del gene RAS in circa il 20% dei casi, mentre nel 30% circa si riscontrano riarrangiamenti di PAX8/PPARγ (4);
- per quanto riguarda il carcinoma midollare, si ritrovano mutazioni puntiformi attivanti di RET nel 95% circa delle forme ereditarie e in circa il 50% dei casi sporadici (4).
La conoscenza dei diversi meccanismi molecolari coinvolti nel processo di oncogenesi ha permesso lo sviluppo di nuove molecole che hanno come bersaglio tappe chiave nel processo di sviluppo di una neoplasia. Sono generalmente molecole strutturalmente piccole, che hanno la capacità di inibire la funzione enzimatica tirosin-chinasica (TK) o anticorpi in grado di bloccare l’attività biologica di molecole specifiche. Le tirosin-chinasi intervengono anche nel processo di neo-angiogenesi tumorale, che viene attivato in seguito all’interazione tra fattori di crescita dell’endotelio vascolare (VEGF) e specifici recettori TK. Altri recettori TK e i rispettivi ligandi, tra cui il fattore di crescita epidermico EGF e il suo recettore EGF-R, possono rappresentare un bersaglio per farmaci inibitori della TK (TKI).
Negli ultimi anni sono partiti studi sperimentali con nuove molecole terapeutiche aventi come bersaglio diretto specifiche proteine codificate da proto-oncogeni attivati costitutivamente o da geni che intervengono come fattori di crescita cellulare e/o vascolare. Tali farmaci sono in grado di bloccare o rallentare lo stimolo cronico della crescita e diffusione tumorale e sono alla base della ormai definita target therapy. I limiti attuali di queste molecole utilizzate in monoterapia sono la stabilizzazione di malattia ottenuta tra il 30 e il 70% dei casi e la risposta oggettiva di riduzione della massa tumorale in misura ancora minore.
Come per altre patologie oncologiche, l’immunoterapia inizia a essere utilizzata anche nel campo dei tumori della tiroide.
Il trattamento con TKI nel carcinoma della tiroide è prerogativa di pazienti con una malattia localmente avanzata o metastatica, che non risponde a trattamenti convenzionali quali chirurgia e radioiodio (4-10).
Target therapy nei confronti di chinasi correlate ad oncogeni (5-10)
L’FDA ha recentemente approvato l’utilizzo di un inibitore di MEK (trametinib) in associazione a un inibitore di BRAF V600E-mutato, il vemurafenib, come terapia combinata per le forme di ATC portatrici della mutazione BRAF V600E, a seguito di uno studio di fase 2 e di uno studio “real-world”, che hanno dimostrato risposte modeste, ma incoraggianti, a questo tipo di terapia. Gli effetti collaterali degli inibitori di BRAF sono principalmente astenia, febbre, artralgia, anemia, diarrea e complicanze dermatologiche, incluso carcinomi della cute, quest’ultima prevenibile con l’ associazione con inibitore di MEK.
L’attivazione di HER2 (ErbB2) ed HER3 (ErbB3) si traduce in un’attivazione della via di segnale sia della MAPK che della PI3K, che rappresenta uno dei meccanismi di fuga delle cellule BRAF-mutanti resistenti a vemurafenib. Su questa base è in corso uno studio di fase I, nei pazienti affetti da DTC e ATC, sull’utilizzo combinato di lapatinib (bloccante HER 2/3) e dabrafenib (inibitore di BRAF); inoltre è in corso uno studio in cui pazienti affetti da tumori solidi con mutazioni di HER, incluso quello tiroideo, sono in trattamento con neratinib (inibitore di ERBB).
In alcuni carcinomi della tiroide sono stati anche identificati geni di fusione STRN-ALK (fino al 4% degli ATC e al 9% degli scarsamente differenziati) ed è stato riportato il caso di una paziente con ATC e iperespressione di ALK, con regressione del 90% di metastasi polmonari dopo trattamento con crizotinib (inibitore di ALK).
Nei carcinomi mediati principalmente da mutazioni sul gene RET, come PTC, MTC e ATC e negli scarsamente differenziati di derivazione papillare, sono stati condotti due studi con due inibitori selettivi di RET, BLU-667 e LOXO-292, con discreti risultati e buona tollerabilità dei farmaci. Tra gli effetti collaterali astenia e stipsi per entrambi, ipertensione e ipertransaminasemia per il primo, nausea, xerostomia e dispnea nel secondo.
Target therapy a valle della cascata di escape tumorale (5-10)
Nei carcinomi della tiroide iodio-refrattari sono in corso di valutazione gli inibitori di mTOR (temsirolimus ed everolimus), sia da soli che in associazione con altri farmaci (sorafenib); inoltre, nell’ATC è in studio un inibitore di mTOR di seconda generazione, MLN0128, i cui effetti collaterali più frequenti sono stati mucositi, anoressia, iperglicemia, alterazioni delle transaminasi, pancitopenia.
Target therapy nei confronti del segnale correlato alle chinasi (5-10)
Sono attualmente approvati quattro inibitori di chinasi multiple per i carcinomi avanzati tiroidei, a seguito di studi di validazione che hanno mostrato un vantaggio nella sopravvivenza libera da progressione statisticamente significativo rispetto al placebo: sorafenib e lenvatinib per i carcinomi differenziati e scarsamente differenziati della tiroide (rispettivamente con gli studi DECISION e SELECT), vandetanib e cabozantinib per MTC metastatico o recidivante (studi ZETA ed EXAM). Altre molecole, non attualmente approvate nel trattamento dei carcinomi tiroidei, sono axitinib, sunitinib, pazopanib, motesanib, imatinib e gefitinib. La maggior parte di questi agenti ha in comune la proprietà di inibire i recettori del VEGF a concentrazioni nanomolari, avendo come principale bersaglio l’angio-genesi tumorale e, viste le analogie strutturali tra le chinasi del RET e del VEGF-R, queste molecole hanno un duplice bersaglio d’azione. Anche in questo caso gli effetti collaterali più frequenti sono eruzioni cutanee, diarrea, astenia, ipertensione arteriosa e prolungamento del QT. Questi farmaci prevedono una somministrazione per via orale ed è ormai abbastanza evidente la loro capacità di ridurre/stabilizzare le lesioni metastatiche in una percentuale significativa di casi.
Immunoterapia nei carcinomi della tiroide (6,7,9)
I recenti risultati in immunoterapia in oncologia, in particolare nel campo del melanoma, con l’utilizzo di ipilimumab (antagonista di CTLA-4), nivolumab, pembrolizumab e spartalizumab (antagonisti di PD-1) ed atezolizumab (antagonista di PD-L1), hanno spinto la valutazione di questo approccio anche nei tumori avanzati della tiroide, considerate le evidenze pre-cliniche della produzione di citochine e chemochine da parte del carcinoma tiroideo; inoltre PD-L1 è espresso nei DTC e ATC. Sono attualmente in corso alcuni studi su tumori solidi con inclusa una coorte di carcinomi tiroidei; tuttavia, sono ancora pochi i dati su questo tipo di terapia. Sono anche in corso studi di immunoterapia in combinazione sia con altri farmaci immunoterapici (nivolumab ed ipilimumab) che di atezolizumab con altre target therapy.
Re-differenziazione dei carcinomi tiroidei iodio-refrattari (6,8)
L’utilizzo di inibitori di MEK o BRAF, isolatamente, nei carcinomi iodio-refrattari, associati in più del 40% dei PTC alla mutazione BRAF V600E e a una ridotta espressione di NIS (symporter sodio-iodio), ha portato in alcuni casi al ripristino della captazione di iodio. Si aprirebbe quindi la possibilità di poter trattare nuovamente con 131I i carcinomi refrattari.
Conclusioni (1-10)
È importante sottolineare che tutti i protocolli sperimentali hanno valutato la risposta del farmaco tramite le modificazioni dimensionali delle lesioni metastatiche (quelle considerate come target), valutate secondo i classici criteri RECIST (Response Evaluation Criteria in Solid Tumors), in base ai quali una risposta parziale è definita come una riduzione > 30% delle lesioni target, una progressione di malattia corrisponde a un aumento del 20% e la stabilità è uno stato intermedio tra le due condizioni. La migliore compliance al trattamento è legata sicuramente alla somministrazione orale. Complessivamente i farmaci sono abbastanza ben tollerati e l’adesione dei pazienti agli schemi terapeutici è eccellente, anche se la presenza di effetti collaterali può a volte richiedere la riduzione della dose giornaliera del farmaco. Inoltre, la validazione degli inibitori di chinasi multiple ha permesso di espandere l’utilizzo a un numero sempre maggiore di pazienti, con risultati soddisfacenti. Sebbene la maggior parte dei pazienti abbia presentato almeno uno tra gli effetti avversi “comuni”, questi risultano di solito di grado lieve-moderato e comunque non richiedono un’interruzione definitiva della terapia.
Dato importante è che lo studio genetico di questi pazienti permette una maggiore selezione dei possibili candidati a un trattamento specifico e diretto; ne sono un esempio i già citati basket trial, in cui i pazienti sono inclusi nello studio non in base al tipo di tumore solido, ma al gene ed al tipo di mutazione riscontrato nello stesso.
Bibliografia
- Langmuir PB, Yver A. Vandetanib for the treatment of thyroid cancer. Clin Pharmacol Ther 2012, 91: 71-80.
- Schlumberger M, Chougnet C, Baudin E, et al; pour le réseau Tuthyref. Refractory thyroid cancers. Presse Med 2011, 40: 1189-98.
- Marotta V, Guerra A, Sapio MR, et al. RET/PTC rearrangement in benign and malignant thyroid diseases: a clinical standpoint. Eur J Endocrinol 2011, 165: 499-507.
- Bhaijee F, Nikiforov YE. Molecular analysis of thyroid tumors. Endocr Pathol 2011, 22: 126-33.
- Valerio L, et al. Targeted therapy in thyroid cancer: state of the art. Clin Oncol (R Coll Radiol) 2017, 29: 316-24.
- Rao SN, Cabanillas ME. Navigating systemic therapy in advanced thyroid carcinoma: from standard of care to personalized therapy and beyond. J Endocr Soc 2018, 13: 1109-30.
- Antonelli A, Ferrari SM, Fallahi P. Current and future immunotherapies for thyroid cancer. Expert Rev Anticancer Ther 2018, 18: 149-59.
- Bible KC, Ryder M. Evolving molecularly targeted therapies for advanced-stage thyroid cancers. Nat Rev Clin Oncol 2016, 13: 403-16.
- Naoum GE, et al. Novel targeted therapies and immunotherapy for advanced thyroid cancers. Mol Cancer 2018, 17: 51.
- Hadoux J, et al. Management of advanced medullary thyroid cancer. Lancet Diabetes Endocrinol 2016, 4: 64-71.

