Anatomia della tiroide e corrispondenza con imaging e chirurgia
Pierpaolo Trimboli
Servizio di Endocrinologia e Diabetologia, Ospedale Israelitico di Roma
ANATOMIA
Forma e posizione
La tiroide è costituita da due lobi laterali, uniti da un istmo mediano. I due lobi hanno forma conica, e si estendono da metà altezza della cartilagine tiroidea fino al quinto anello tracheale. Hanno una lunghezza di circa 3 cm, uno spessore che varia da 0.5 cm dell’apice a 2 cm della base. L’istmo unisce i due lobi in prossimità della loro base, all’altezza dei primi due anelli tracheali. Dal margine superiore dell’istmo può dipartire verso l’alto un prolungamento ghiandolare di lunghezza variabile, che prende il nome di lobo piramidale. Esso rappresenta una testimonianza del percorso compiuto dalla ghiandola durante il suo sviluppo embrionale. Le dimensioni complessive della tiroide variano molto a seconda dell’età e del sesso.
Rapporti
La tiroide è applicata sulla superficie ventrale della laringe e dei primi due anelli tracheali, parzialmente coperta dai muscoli sternocleido-mastoideo, sterno-tiroideo e omoioideo, e dalla fascia cervicale media. La ghiandola si trova all’interno di una guaina fibrosa (guaina tiroidea), attraverso la quale è in contatto con gli organi circostanti. Posteriormente alla guaina tiroidea dipartono tralci connettivali che assicurano l’organo alla laringe (legamento sospensore), alla cartilagine laringea e ai primi anelli tracheali (legamenti laterali interni), e alla guaina che circonda il fascio vascolo-nervoso del collo (legamenti laterali esterni). Posteriormente, il lobo sinistro è inoltre in contatto con il tubo faringo-esofageo, dove decorre il nervo laringeo inferiore. La ghiandola è ricoperta dall’interno all’esterno dalla propria guaina connettivale, dallo spazio pericoloso tiroideo (un intreccio di arterie e vene dell’organo) e dalla guaina peri-tiroidea.
Vasi e nervi
La tiroide è irrorata dalle arterie tiroidee superiori destra e sinistra, rami delle carotidi comuni esterne, e dalle arterie tiroidee inferiori destra e sinistra, rami del tronco tireo-cervicale della succlavia. A volte è presente l’arteria tiroidea ima, ramo dell’arteria brachi-cefalica oppure della carotide comune, che raggiunge dal basso l’istmo. I rami di divisione dell’arteria tiroidea inferiore sono in stretto contatto con il nervo laringeo inferiore (o ricorrente), ramo del nervo vago.
Le vene reflue dal circolo intra-tiroideo formano un plesso nello spazio pericoloso, da cui originano le vene tiroidee superiori destra e sinistra (tributarie della vena giugulare interna omolaterale) e inferiori destra e sinistra (tributarie della vena brachio-cefalica omolaterale).
I vasi linfatici sono tributari della catena giugulare interna (verso l’alto) e dei linfonodi para-tracheali e pre-tracheali (verso il basso).
La tiroide riceve nervi dal simpatico cervicale e dai due nervi laringei del nervo vago.
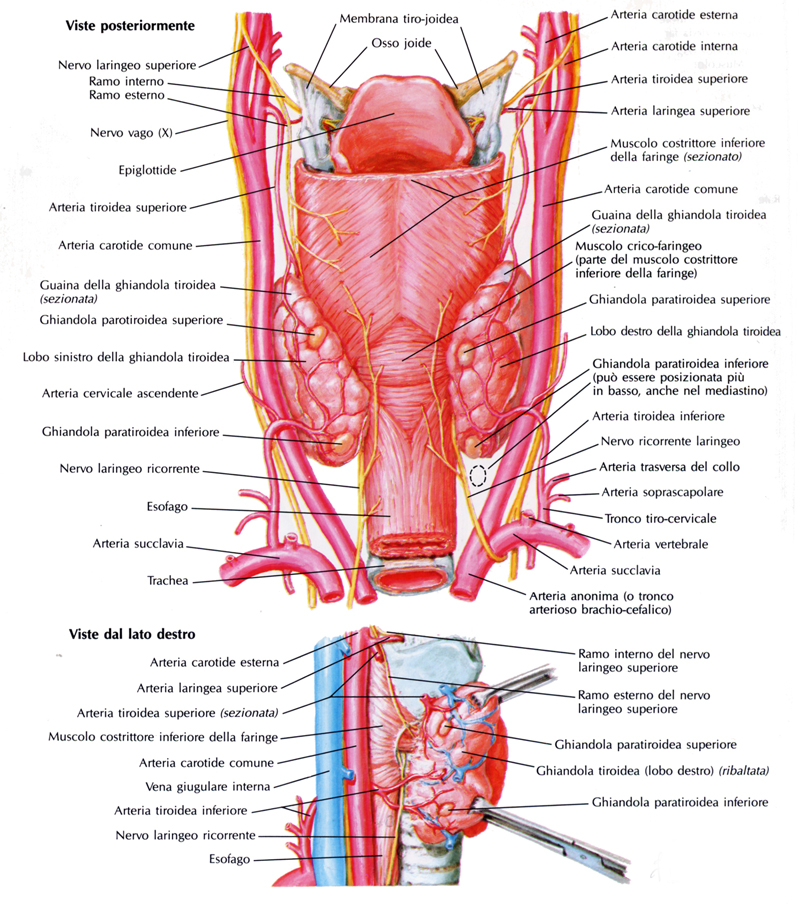
Figura 1. Rappresentazione di vasi e nervi della tiroide.
Struttura
La ghiandola tiroidea è suddivisa in lobuli, formati da esili tralci che si dipartono dalla capsula connettivale. I vasi e i nervi raggiungono le singole unità funzionali con i tralci connettivali.
Follicoli tiroidei. La tiroide ha una organizzazione follicolare. È costituita infatti da una serie di vescicole (follicoli tiroidei) con una parete (l’epitelio follicolare). L'epitelio follicolare è formata da uno strato singolo di cellule follicolari (o tireociti), e costituisce una cavità all’interno della quale si ritrova un materiale amorfo (colloide). I tireociti sono responsabili della sintesi e immissione in circolo dei due ormoni tiroidei, T3 e T4. Le dimensioni dei follicoli variano molto a seconda dello stato funzionale. In una condizione di ipofunzionalità si riscontrano facilmente macrofollicoli, con una cavità molto dilatata ripiena di colloide. I follicoli con questo atteggiamento non contribuiscono a fornire ormoni circolanti, ma costituiscono una forma di riserva di ormoni. I tireociti sono caratterizzati da una doppia polarità: nella fase di sintesi operano sul lato luminale accumulando colloide, nella fase di immissione ormonale in circolo operano sul versante opposto. Nella prima fase viene prodotta una glicoproteina (tireoglobulina) in parte nel reticolo endoplasmatico e in parte nell’apparato di Golgi. Oltre alla tireoglobulina, le vescicole contengono un enzima ossidativo (perossidasi tiroidea) che ossida gli ioduri che i tireociti captano dal sangue. Nella fase di immissione di ormoni in circolo la membrana cellulare forma estroflessioni che attorniano gocciole di colloide e per fagocitosi le introducono all’interno del tireocita, ricco in questa fase di fagosomi. Con la formazione di complessi di fagolisosomi avviene la scissione degli ormoni tiroidei, e quindi la loro emissione.
Cellule parafollicolari o cellule C. Oltre ai tireociti, la tiroide possiede un altro tipo cellulare (cellule parafollicolari, o cellule C), intercalate tra i tireociti o sparse nell’interstizio tra i follicoli. Sono voluminose cellule a citoplasma chiaro, presenti sulla membrana basale del follicolo, ma sprovviste di una faccia luminale. Queste cellule sono facilmente riconoscibili al microscopio elettronico per la presenza di un reticolo endoplasmatico rugoso meno evidente e di un apparato di Golgi peri-nucleare. Il loro citoplasma contiene numerose vescicole di secrezione. Le cellule C producono la calcitonina, un polipeptide di 32 aminoacidi, accumulato all’interno di vescicole di secrezione insieme a serotonina e somatostatina.
Linfonodi del collo di interesse tiroideo
I linfonodi del collo possono essere classificati, in base alla loro sede, in sei livelli, dall'alto verso il basso. Il VII livello è costituito dai linfonodi del mediastino alto. Tutti i livelli possono essere sede di ripetizione metastatica di tumori a partenza da varie strutture della testa, del collo, dell'addome superiore e del torace (Figura 2). I linfonodi di interesse nella patologia tumorale tiroidea sono principalmente quelli del III e IV omolaterali con il lobo tiroideo sede del tumore primario, e quelli del VI livello (compartimento centrale). Meno frequentemente vengono compromessi anche quelli del V livello (sovraclaveari), omolateralmente con il tumore. Talvolta anche i linfonodi del VII livello possono essere sede di metastasi da tumori differenziati della tiroide. Questi ultimi risultano non valutabili ecograficamente.
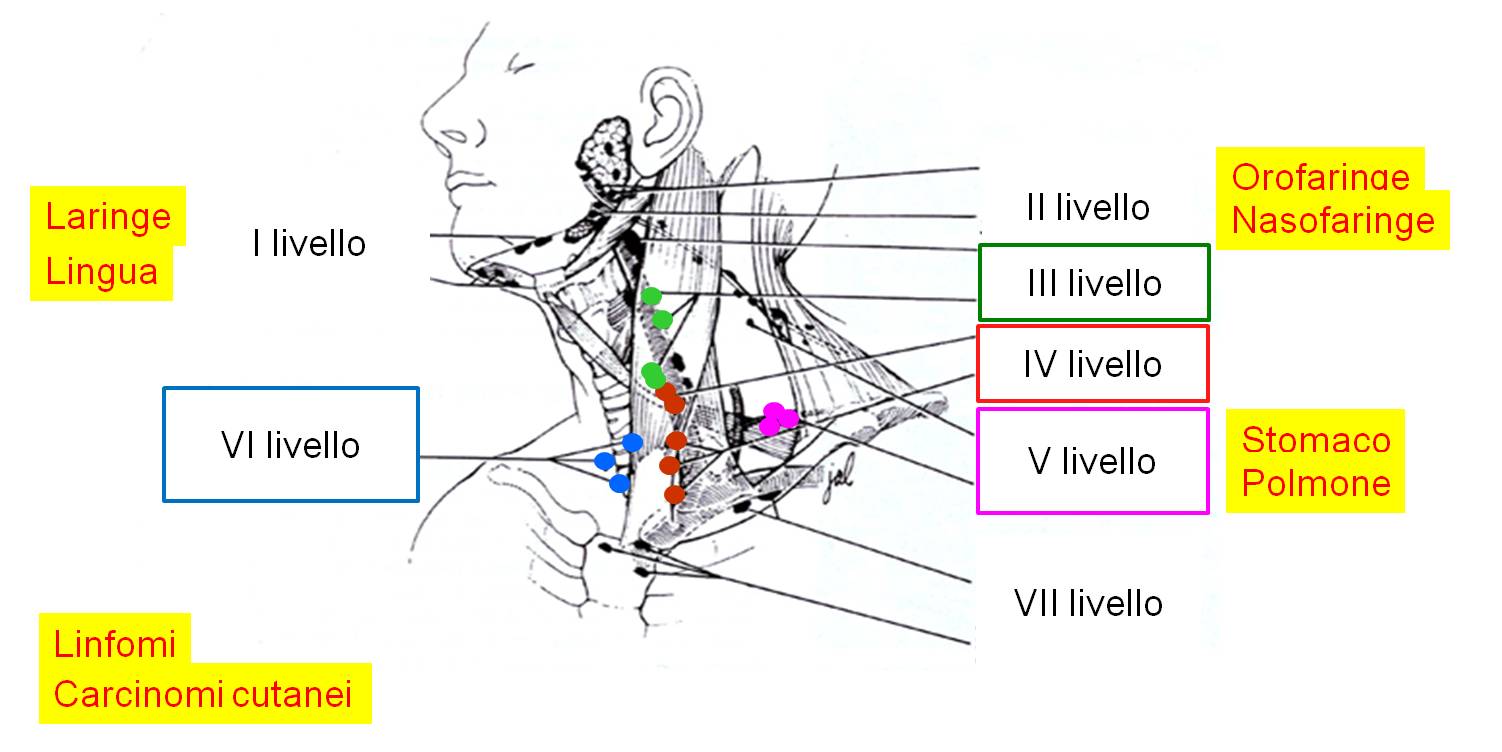
Figura 2. Rappresentazione schematica della anatomia dei linfonodi del collo di interesse tiroideo. I livelli interessati da possibili metastasi tiroidee sono, in ordine di frequenza, VI, IV, III, V, II e I. In giallo sono evidenziati gli altri organi in grado di dare metastasi cervicali.
Bibliografia
1. Trattato di Anatomia Umana. Ed. edi-ermes. Cap 13 (vol II).
CORRISPONDENZA TRA ANATOMIA ED ECOGRAFIA TIROIDEA
Sulla base delle conoscenze anatomiche, l’ecografia rappresenta il miglior metodo di valutazione della morfologia tiroidea. La densità ecografica della ghiandola tiroidea si presenta tipicamente superiore (iperecogena) rispetto alle strutture vicine, e questo la rende facilmente visualizzabile (figura 3). La visualizzazione della tiroide consente di valutare le dimensioni dei due lobi e il volume della ghiandola, i suoi profili, l’omogeneità e l’ecogenicità della sua struttura, l'eventuale presenza di noduli palpabili e non.
La tiroide in condizioni normali si presenta con profili regolari, con ecostruttura omogenea ed ecogenicità conservata, cioè come detto iperecogena rispetto alle strutture circostanti. L’omogeneità del tessuto è legata alla normale organizzazione follicolare, mentre l’ecogenicità si associa al normale rapporto tra cellule e colloide.
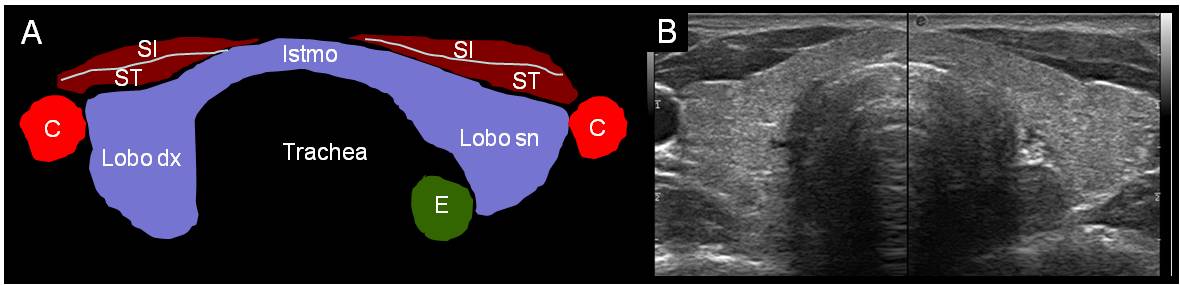
Figura 3. Corrispondenza fra strutture anatomiche e visualizazione ecografica in sezione trasversa (C = carotide, SI = muscolo sterno-ioideo, ST = muscolo sterno-tiroideo, E = esofago)
Alterazioni ecografiche ghiandolari
Diversi studi hanno dimostrato come un quadro ecografico tiroideo con ecostruttura disomogenea ed ecogenicità ridotta si associ a condizioni di tiroidite cronica e/o ipotiroidismo istologicamente dimostrabili (1-3). In una tiroide con tale aspetto, l’ecostruttura è disomogenea per sofferenza ghiandolare, e l’ecogenicità è ridotta a causa dell’alterato rapporto colloide/cellule a favore delle cellule, in questo caso di tipo infiammatorio. Al contrario, pochi studi hanno analizzato l’associazione tra ecostruttura ed ecogenicità normali e funzione tiroidea. Un recente lavoro, non di popolazione, indica come il 20% circa dei soggetti adulti con tiroide ecograficamente normale presenterebbe un’alterazione biochimica tiroidea (4). Tuttavia, queste alterazioni di laboratorio potrebbero non avere un reale significato clinico, e si può ipotizzare che una tiroide normale all’esame ecografico presenti una normale funzione e negatività sierica di anticorpi anti-tiroidei. Studi basati sulla popolazione sarebbero necessari per chiarire questi aspetti. Per quanto riguarda infine la corrispondenza tra stima ecografica del volume tiroideo e anatomia, non esistono ad oggi studi che abbiano chiarito quale sia il normale volume ghiandolare in un soggetto adulto. Diversi autori riportano invece come in soggetti in età infantile o adolescenziale il volume tiroideo aumenti con l’aumentare dell’età e del peso corporeo.
Classificazione ecografica dei noduli e corrispondenza anatomica
I noduli tiroidei si presentano ecograficamente come lesioni focali, con ecostruttura ed ecogenicità variabili in base alla diversa struttura tissutale. Generalmente i noduli tiroidei possono essere distinti ecograficamente in solidi, isoecogeni o ipoecogeni, misti con quote solide più o meno prevalenti, o anecogeni e privi di aree solide. Questa sommaria classificazione ecografica ha una buona corrispondenza con l’anatomia nodulare solo in alcuni casi.
- Nei noduli isoecogeni, definiti tali perchè l'ecogenicità è non dissimile dal tessuto ghiandolare sano circostante, è conservato il rapporto colloide/cellule.
- I noduli ipoecogeni, definiti tali quando l'ecogenicità è inferiore al tessuto ghiandolare sano circostante, hanno invece un aumento della quota cellulare rispetto alla colloide. La scarsa colloide e l'abbondante cellularità è una caratteristica tipica delle neoplasie tiroidee sia citologicamente che istologicamente.
- Riguardo la struttura nei noduli misti c'è una preponderanza della quoata liquida ed una quota solida variabile mentre i noduli cistici (anecogeni) sono completamente liquidi o quasi.
Gli apparecchi ecografici di ultima generazione permettono la valutazione delle caratteristiche dei margini nodulari. In alcuni casi è possibile evidenziare un'irregolarità dei margini e questo rappresenta una caratteristica ecografica di forte sospetto. Non sono ad oggi disponibili studi che analizzino la corrispondenza istologica di noduli con margini classificati ecograficamente come irregolari (figura 4).
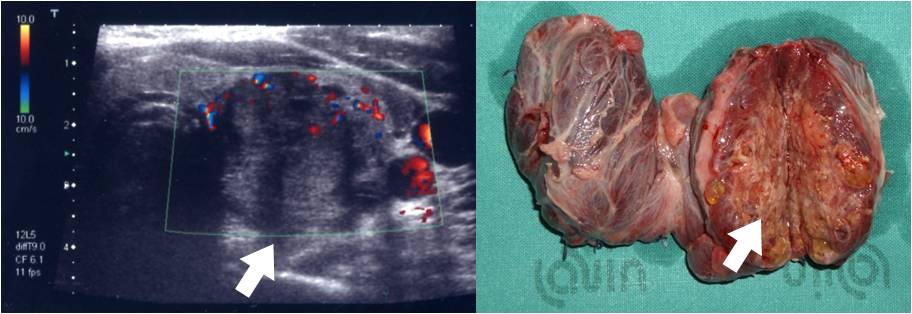
Figura 4. Nodulo tiroideo del lobo sinistro ghiandolare. Il nodulo si presenta all'ecografia solido, ipoecogeno, con margini irregolari (segni di invasione) e lievi cenni di vascolarizzazione. Dopo l'escissione chirurgca si può notare la corrispondenza del quadro ecografico con la valutazione macroscopica dell'irregolarità dei margini nodulari.
Bibliografia
- Rago T, Chiovato L, Grasso L, et al. Thyroid ultrasonography as a tool for detecting thyroid autoimmune diseases and predicting thyroid disfunction in apparently healthy subjects. J Endocrinol Invest 2001, 24: 763-9.
- Marcocci C, Vitti P, Cetani F, et al. Thyroid ultrasonography helps to identify patients with diffuse lymphocytic thyroiditis who are prone to develop hypothyroidism. J Clin Endocrinol Metab 1991, 72: 209-13.
- Rago T, Di Coscio G, Ugolini C, et al. Clinical features of thyroid autoimmunity are associated with thyroiditis on histology and are not predictive of malignancy in 570 patients with indeterminate nodules on cytology who had a thyroidectomy. Clin Endocrinol (Oxf) 2007, 67: 363-9.
- Trimboli P, Rossi F, Thorel F, et al. One in five subjects with normal thyroid ultrasonography has altered thyroid tests. Endocr J 2012, 59: 137-43.
Lo iodio e i disordini da carenza iodica
Pierpaolo Trimboli
Servizio di Endocrinologia e Diabetologia, Ospedale Israelitico di Roma
Lo iodio è un oligoelemento scarsamente rappresentato in natura. Anche nell'organismo umano si ritrovano piccole quantità di iodio. L’acqua e gli alimenti rappresentano la fonte principale di apporto iodico per l'uomo, mentre lo iodio inalato (per es. in prossimità del mare) costituisce soltanto una quota minima del fabbisogno iodico giornaliero. Una volta ingerito, lo iodio viene assorbito dall’intestino e trasportato nei tessuti che hanno la possibilità di captarlo. La principale sede di utilizzo è la tiroide che lo impiega per la sintesi degli ormoni tiroidei T3 e T4. Un adeguato apporto di iodio è, infatti, essenziale per la normale funzione tiroidea e per la fisiologica crescita e sviluppo dei diversi organi e apparati che risentono dell’azione degli ormoni tiroidei. La principale via di escrezione dello iodio (98%) è quella renale, tanto che l’apporto iodico si valuta attraverso la determinazione della concentrazione (μg/L) dello iodio urinario (ioduria), esame ancora non di largo impiego.
L’apporto giornaliero raccomandato di iodio è in stretta relazione al suo fabbisogno, che varia nell’arco della vita in funzione delle diverse condizioni fisiologiche (tabella 1).
| Tabella 1 Fabbisogno giornaliero di iodio (in µg/die) |
||
| Età | Raccomandato | Massimo |
| 0-7 anni | 90 | 200 |
| 8-12 anni | 120 | 600 |
| Adulti | 150 | 600 |
| Gravidanza ed allattamento | 250 | 600 |
Sulla base della ioduria è possibile classificare l'apporto iodico della popolazione (tabella 2).
| Tabella 2 Classificazione dell’apporto iodico |
|
| Ioduria (mediana) µg/L | Classificazione |
| < 20 | Deficit severo |
| 20-49 | Deficit moderato |
| 50-99 | Deficit lieve |
| 100-199 | Ottimale |
| 200-299 | Più che ottimale |
L’Italia, come gran parte dell’Europa, è stata classificata paese a carenza iodica lieve, con differenze tra il Nord ed il Sud (al 2009 la ioduria era, rispettivamente, di 98 µg/L vs 79 µg/L). La carenza iodica deve essere eradicata con l’uso del sale fortificato con iodio (in Italia il sale è addizionato con iodato di potassio nella misura di 30 mg/kg sale, pari a 30 µg/g di sale) (1).
Le malattie da deficit dell’apporto iodico (IDD, Iodine Deficiency Disorders)
L’insufficiente apporto iodico alimentare determina una serie di manifestazioni cliniche, denominate malattie da deficit dell’apporto iodico (IDD, Iodine Deficiency Disorders), che si manifestano, a seconda della gravità, della durata e del periodo di esposizione alla carenza iodica con vari quadri clinici:
- nel feto: aborti, natimortalità, anomalie congenite
- nel neonato: aumento della mortalità perinatale, gozzo, ipotiroidismo, cretinismo (neurologico e mixedematoso), ritardato sviluppo psicomotorio e mentale
- nell’adolescente: gozzo, ipotiroidismo giovanile, variabile ritardo mentale, ritardo dell’accrescimento, aumentata suscettibilità alle radiazioni.
La manifestazione clinica più evidente e frequente della carenza iodica è il gozzo, cioè l’aumento di volume della tiroide non riferibile a processi flogistici o neoplastici. È più frequente nel sesso femminile (F/M= 9/1), e durante la pubertà e la gravidanza.
Per la diagnosi delle IDD, è fondamentale la raccolta dei dati anamnestici, con particolare attenzione all’età, alla familiarità, alla zona di provenienza e di residenza del paziente e alle abitudini alimentari. Segue l’esame obiettivo della regione anteriore del collo e la diagnosi strumentale che si avvale principalmente dell’ecografia tiroidea. Gli esami di laboratorio necessari sono: TSH, FT3, FT4, ioduria. Quest’ultimo è utilizzato specialmente nelle indagini epidemiologiche ed in condizioni particolari quali la gravidanza e l’allattamento, in cui è necessario accertare che venga soddisfatta l’aumentata richiesta di apporto iodico. La gravidanza rappresenta infatti una condizione fisiologica in cui la tiroide va incontro ad un adattamento funzionale. Durante la gestazione, infatti, si verificano quattro eventi che determinano un aumentato fabbisogno giornaliero di iodio: aumentata clearance renale, passaggio di iodio transplacentare, incremento di captazione da parte della tiroide, aumentata richiesta periferica di ormone tiroideo (2). In considerazione di queste modificazioni a carico del metabolismo dello iodio che si verificano nel corso della gravidanza, risulta dunque importante monitorare l’apporto iodico ed eventualmente correggerne una condizione di carenza (3).
In età adolescenziale a volte il sintomo predominante della carenza iodica è la ridotta velocità di crescita staturale: questo perché il deficit di ormoni tiroidei provoca sia la diminuita secrezione di GH, sia il suo minore effetto sulla cartilagine di accrescimento.
Per i quadri di ipotiroidismo si rinvia al relativo capitolo.
Bibliografia
- Panunzi C. Gozzo e deficit iodico. In: Manuale per la valutazione e l'inquadramento delle patologie della tiroide. AME 2011.
- Glinoer D. The regulation of thyroid function during normal pregnancy: importance of the iodine nutrition status. Best Pract Res Clin Endocrinol Metab 2004, 18: 133-52.
- The Public Health Committee of the American Thyroid Association. Iodine supplementation for Pregnancy and Lactation - United States and Canada: Recommendations of the American Thyroid Association. Thyroid 2006, 16: 949-51.
Sintesi, trasporto e metabolismo degli ormoni tiroidei
Leone Ferrari
Endocrinologia, Ospedali Riuniti, Bergamo
Unità morfo-funzionale deputata alla sintesi, immagazzinamento e immissione in circolo degli ormoni tiroidei è il follicolo tiroideo, le cui cellule epiteliali o acinari, sono finalizzate a tale scopo. I follicoli tiroidei sono di forma grossolanamente sferica e di dimensioni estremamente variabili a seconda dello stato funzionale, con un diametro medio di 300 micron. Sono costituiti da un involucro esterno, monostratificato, di tireociti, che poggia su un capillare, da cui è separato da una membrana basale bilaminare, e da un lume centrale riempito da colloide omogenea, costituita da una miscela di proteine, principalmente tireoglobulina, e altre iodoproteine, nonché da proteine sieriche e albumina.
I tireociti presentano una polarità bi-direzionale:
- dalla membrana basale verso il lume nella parte più esterna della cellula, in cui avviene la biosintesi e il deposito degli ormoni tiroidei;
- dal lume verso la membrana basale nella parte centrale della cellula, dove avviene il riassorbimento degli ormoni e la loro immissione nella circolazione sanguigna.
Oltre ai tireociti, esistono alcune cellule, isolate o in piccoli gruppi, che nell’adulto costituiscono l’1% della popolazione cellulare tiroidea. Sono definite cellule parafollicolari o cellule C, non aggettano nel lume follicolare, hanno colorito chiaro, sono di origine neuroectodermica, dalla cresta neurale, e producono calcitonina.
Gli ormoni tiroidei sono due: L-Tiroxina o Tetraiodotironina (T4) e L-Triiodotironina (T3). La produzione della T4 è esclusivamente tiroidea, mentre quella della T3 avviene per circa il 20% nella tiroide e per il resto nei tessuti periferici, per desiodazione in posizione 5’ della T4. La sintesi degli ormoni tiroidei è strettamente correlata al metabolismo dello Iodio, che ne è infatti un costituente indispensabile e fondamentale, rappresentando il 65% del peso della T4 e il 58% del peso della T3.
Biosintesi
La prima tappa dell’iter biosintetico degli ormoni tiroidei è costituita dall’estrazione dello Iodio dal plasma e dalla sua concentrazione nella cellula follicolare. La tiroide normale presenta una concentrazione di Iodio che è 20-50 volte più alta rispetto al plasma, in relazione alla quantità di Iodio disponibile e all’attività della ghiandola. La proteina responsabile del trasporto dello ioduro, il NIS o Sodio/Ioduro Symporter, è localizzata in sede latero-basale della membrana plasmatica dei tireociti. L’accumulo di ioduro NIS-mediato è un processo di trasporto attivo che sfrutta l’energia liberata dall’ingresso nel tireocita, secondo gradiente, di 2 ioni sodio e dal simultaneo trasferimento intra-tiroideo dello ioduro contro gradiente. Il trasporto di ioduro è quindi energia-dipendente e richiede la presenza di una pompa Na-K ATP-asi, che sposta continuamente gli ioni Na al di fuori delle cellule follicolari, creando un gradiente favorevole al NIS per lo spostamento intra-cellulare di ioni Na e Ioduro. Una volta che lo iodio si è accumulato nella parte basale del tireocita, viene veicolato verso la porzione apicale, seguendo un flusso preferenziale di trasporto passivo garantito da canali specifici, uno dei quali è la Pendrina, regolati dall’interazione TSH-recettore. Raggiunta la porzione peri-apicale e laterale della cellula, lo iodio viene ossidato per opera della tireo-perossidasi (TPO), generando H2O2, e incorporato nei residui di tirosina della tireoglobulina, ottenendo dei composti intermedi con uno (Monoiodo-tirosina - MIT) o due (Diiodo-tirosina - DIT) atomi di Iodio: il successivo accoppiamento di tali molecole darà origine alla T4 (2 DIT) o alla T3 (MIT + DIT). La Tireoglobulina così ottenuta, viene immagazzinata nel lume follicolare.

Secrezione
Il processo di secrezione degli ormoni tiroidei inizia con il riassorbimento della colloide sotto lo stimolo del TSH, da parte di villi e pseudopodi presenti sulla superficie luminale della cellula, con un processo di macropinocitosi. Le macrovescicole di colloide vengono veicolate verso la parte basale e centrale dei tireociti e sottoposte a proteolisi. Gli ormoni tiroidei incorporati nella tireoglobulina, così liberati, vengono immessi nel torrente circolatorio dove, legati a specifiche proteine di trasporto, vengono veicolati ai tessuti bersaglio.
Trasporto
Gli ormoni tiroidei circolano nel sangue pressochè esclusivamente legati a proteine; solo lo 0.03% della T4 e lo 0.3% della T3 circolano in forma libera.
La Thyroxine Binding Globulin (TBG) è una glicoproteina sintetizzata nel fegato, con un’alta affinità di legame per gli ormoni tiroidei: trasporta il 75% della T4 e l’80% della T3.
La Trans-tiretina o Thyroxine Binding Pre-Albumin (TTR o TBPA) è una proteina prodotta nel fegato, formata da 4 subunità identiche, con un’affinità di legame per gli ormoni tiroidei 10 volte inferiore alla TBG: trasporta il 10% della T4 e il 5% della T3.
L’albumina, di cui esistono 4 isoforme con diversa affinità per gli ormoni tiroidei (una sola a maggiore affinità per la T4 e minore per la T3), trasporta il 12% della T4 e una quota meno significativa di T3.
Infine, una quota pari a circa il 3% della T4 circola legata ad alcune lipoproteine, in particolare alla Apo-lipoproteina A1, che è una HDL.
Il ruolo fondamentale delle proteine vettrici, mantenendo costante il rapporto fra ormoni liberi e ormoni legati, è quello di impedire brusche fluttuazioni degli ormoni tiroidei costituendo una riserva prontamente disponibile di ormone tiroideo. Esiste un equilibrio dinamico tra ormone legato e ormone libero: le singole molecole sono in equilibrio tra pool libero e pool legato, rimanendo legate alle proteine per intervalli che dipendono dalle caratteristiche cinetiche della proteina a cui si sono temporaneamente legate. Per esempio, la singola molecola di T4 rimane libera nel siero per intervalli di circa 1.25 millisecondi prima di rilegarsi per periodi intorno a 6.25 secondi. Quindi, in ogni istante, una frazione intorno allo 0.2-0.3% di tutte le molecole di T4 è transitoriamente libera (frazione costante in condizioni di equilibrio “indisturbate”, come quelle che si trovano in vitro). Se in un determinato momento rimuovessimo dal siero il pool di molecole di ormone libero, la concentrazione di FT4 sarebbe ripristinata in 3-4 millisecondi.
Metabolismo
L’emivita della T4 nel siero è di 7-8 giorni, mentre quella della T3 è di 24 ore.
La T4 è da considerare a tutti gli effetti un pro-ormone, mentre la molecola biologicamente attiva è la T3.
Ruolo chiave nell’omeostasi e nel metabolismo pre-recettoriale degli ormoni tiroidei è giocato dalle desiodasi. Se ne conoscono 3 diversi tipi, denominati D1, D2 e D3.
- La desiodasi di tipo I (D1), localizzata principalmente nel fegato, nel rene e nella tiroide, catalizza la desiodazione della T4 in posizione 5’ a dare T3 e la desiodazione della rT3 in 3,3’-T2. È la responsabile della produzione dell’80% della T3 circolante.
- La desiodasi di tipo II (D2), localizzata nel sistema nervoso centrale, nell’ipofisi, nel tessuto adiposo bruno, nella placenta e nella pelle, catalizza la desiodazione della T4 in posizione 5’ a dare T3 contribuendo al mantenimento di livelli costanti di T3 intra-cellulare.
- La desiodasi di tipo III (D3), localizzata nel sistema nervoso centrale e nella placenta, catalizza la desiodazione in posizione 5; poiché l’integrità dell’anello interno degli ormoni tiroidei è indispensabile per la loro attività biologica, quest’ultima desiodasi ha un’attività prevalentemente inattivante.
In termini percentuali la T4 viene metabolizzata in T3 per il 35%, in rT3 per il 40%, glicuronata o sulfonata per il 15% o come altro prodotto metabolico per il resto e secreta con la bile. La maggior parte della T4 e dei suoi metaboliti è secreta con le feci.
Il destino catabolico post-recettoriale degli ormoni tiroidei è legato all’intervento di specifiche proteasi, che da una parte catabolizzano la componente aminoacidica e dall’altra liberano lo Iodio, che in tal modo viene recuperato nel pool degli ioduri e come tale riutilizzato.
Bibliografia
- Molina P. Fisiologia Endocrina. Lange Physiology Series. McGraw-Hill, 2004: 84-8.
- Arvan P, Di Jeso B. Thyroglobulin structure, function and biosynthesis. In: The thyroid: fundamental and clinical text, 9th ed, Braverman LE, Utiger RD (Eds), Lippincott Williams and Wilkins, Philadelphia, 2005: 77.
- Bianco AC, Larsen PL. Intracellular pathways of iodothyronine metabolism. In: The thyroid: fundamental and clinical text, 9th ed, Braverman LE, Utiger RD (Eds), Lippincott Williams and Wilkins, Philadelphia, 2005: 109.
- Kopp P, Solis JC. Thyroid hormone synthesis. Section B. Clinical management of thyroid disease. Saunders Elsevier, 2009: 19-32.
- Miot F, Dumont JE, Rousset BA. Thyroid Hormone Synthesis and Secretion. www.Thyroidmanager.org Chapter 2. Last Revised: July 1, 2010.
Azioni degli ormoni tiroidei
Leone Ferrari
Endocrinologia, Ospedali Riuniti, Bergamo
Gli ormoni tiroidei, in particolare la T3, hanno importanti effetti nell’organismo, per quanto riguarda lo sviluppo dell’embrione e la crescita del bambino, mentre la loro azione nell’adulto si manifesta prevalentemente a livello metabolico.
Il primo atto della loro azione è l’ingresso nella cellula bersaglio. Questo non è passivo, legato solo alle loro caratteristiche di liposolubilità, come si riteneva in passato, ma in prevalenza mediato da specifici trasportatori di membrana. Alcuni di questi trasportatori sono stati identificati e caratterizzati: tra gli MCT (Mono-Carboxylate Transporter), che trasportano composti monocarbossilati, le proteine MCT-8 e MCT-10 sono state identificate come trasportatori ad alta affinità per gli ormoni tiroidei; tra gli OATP (Organic Anion-Transporting Polypeptide), le isoforme 1, 2 e 3 costituiscono trasportatori trans-membrana di numerosi ormoni, compresi T4 e T3.
Una volta veicolati nella cellula bersaglio, gli ormoni tiroidei svolgono le loro azioni genomiche attraverso l’interazione della T3 con specifici recettori nucleari, in grado di legarsi al DNA in corrispondenza di particolari sequenze (TRE: Thyroid Hormone-Responsive Element), per attivare o inibire geni bersaglio. Si conoscono 2 tipi di recettori nucleari degli ormoni tiroidei, Alfa e Beta, con diverse isoforme, di cui le principali sono le Alfa-1 e Alfa-2 e le Beta-1 e Beta-2. I recettori Beta-1 sono espressi prevalentemente, ma non esclusivamente nel fegato, nell’encefalo e nel rene, mentre i recettori Beta-2 sono molto più frequenti nell’ipofisi e in alcune zone dell’encefalo, come l’ipotalamo. Anche i recettori Alfa-1 sono pressoché ubiquitari, ma con maggiore presenza nel muscolo scheletrico e nel grasso bruno.
Alcune azioni degli ormoni tiroidei si manifestano pressoché immediatamente dopo il loro ingresso nelle cellule bersaglio ed è pertanto improbabile che siano legate all’interazione ormone-recettore nucleare ed al successivo effetto genomico. Tali azioni non genomiche si manifesterebbero prevalentemente a livello della membrana cellulare (come l’incremento indotto dalla T3 della captazione degli zuccheri), o a livello lisosomiale. Farebbero parte di queste azioni non genomiche l’effetto indotto dalla T4 di attivazione della Desiodasi di tipo II nelle cellule nervose, che ne influenzerebbe l’arborizzazione, il trasporto assonale e i contatti inter-cellulari, come pure l’azione di controllo dell’attività mitocondriale e quindi dello stato energetico cellulare.
Effetti metabolici
Gli ormoni tiroidei hanno effetto sinergico con le catecolamine sulla termogenesi, sia obbligatoria, che facoltativa. Il processo di termogenesi coinvolge tutti i substrati energetici.
Metabolismo glucidico. La T3 favorisce la glicogenolisi e la gluconeogenesi; attiva inoltre i geni che codificano per proteine ad attività enzimatica sull’ossidazione del glucosio.
Metabolismo lipidico. La T3 stimola sia la lipogenesi, che la lipolisi. Il metabolismo del colesterolo è aumentato sia per azione catabolica diretta, sia per aumento dei recettori cellulari per le LDL.
Metabolismo proteico. Gli ormoni tiroidei stimolano in generale la biosintesi proteica, con effetto trofico sulla muscolatura, ma un loro eccesso determina catabolismo muscolare e proteolisi.
Effetti sui tessuti periferici
Encefalo. Gli ormoni tiroidei manifestano i loro effetti principali sullo sviluppo dell’encefalo durante il periodo intra-uterino e nel periodo neonatale. Bambini affetti da ipotiroidismo congenito da deficit genetici o da carenza iodica importante manifestano deficit neurologici e ritardo mentale. L’azione della T3 si manifesta sia a livello trofico, determinando la crescita assonale e l’arborizzazione dendritica, sia attraverso la regolazione dell’attività trascrizionale di numerosi geni coinvolti in molteplici funzioni cellulari.
Cuore. Gli ormoni tiroidei inducono un incremento della sintesi proteica complessiva a livello cardiaco e regolano la trascrizione di numerose proteine essenziali per la funzione contrattile, come le catene pesanti della miosina. Regolano inoltre il numero dei recettori ß-adrenergici a livello cardiaco e vascolare, aumentando in tal modo la sensibilità alle catecolamine. I risultati di queste azioni sono la riduzione delle resistenze vascolari periferiche, l’aumento del volume ematico ed effetti cronotropi e inotropi positivi: il risultato finale di questa azione combinata a livello periferico e cardiaco è l’aumento della gittata cardiaca, in grado di fornire una maggiore quantità di ossigeno in risposta alla maggiore richiesta dei tessuti periferici indotta dalla T3.
Fegato. Gli ormoni tiroidei hanno molteplici effetti a livello epatico, in particolare sulla sintesi proteica ad attività enzimatica, che regola la lipogenesi e la lipolisi, la gluconeogenesi, nonché i processi ossidativi. L’induzione della sintesi di enzimi ad azione lipogenica da parte della T3 a livello epatico è sia diretta, che mediata dal sinergismo con GH, insulina e dalla maggiore o minore presenza di substrato (viene infatti inibita dal digiuno e attivata dall’ingestione di alimenti). La T3 interviene inoltre sulla sintesi di recettori per le LDL, influenzando a seconda degli stati di iper- o ipotiroidismo, la maggiore o minore clearance del colesterolo. Gli ormoni tiroidei influenzano inoltre la proliferazione e l’apoptosi degli epatociti.
Rene. La T3 aumenta il flusso renale e la filtrazione glomerulare; stimola inoltre la biosintesi di eritropoietina.
Ipofisi. Gli ormoni tiroidei, oltre a regolare con meccanismo di feed-back negativo la biosintesi e la secrezione del TSH, regolano anche la biosintesi e la secrezione di altre tropine ipofisarie. La T3 stimola la secrezione di GH, ma ha effetti variabili sulla sua sintesi, tant’è che il bambino ipotiroideo manifesta un deficit di crescita, ma presenta livelli normali di GH. Sulla prolattina la T3 esercita effetti simili a quelli esercitati sul TSH, quindi prevalentemente inibitori, sia diretti, che indiretti. La T3 regola negativamente LH e FSH, riducendo la trascrizione dei geni che codificano sia per la subunità alfa, che beta.
Osso. L’azione degli ormoni tiroidei è indispensabile sia per la crescita, che per lo sviluppo osseo. Sia gli osteoblasti, che gli osteoclasti sono stimolati dagli ormoni tiroidei, direttamente attraverso la stimolazione di geni specifici e indirettamente attraverso la stimolazione di GH e IGF-I. Nel feto la T3 è indispensabile per lo sviluppo lineare delle ossa, mentre nell’adulto partecipa ai meccanismi del rimodellamento scheletrico.
Tessuto adiposo. Gli ormoni tiroidei regolano lo sviluppo e la funzione del tessuto adiposo bruno e bianco. La T3 induce differenziazione dei pre-adipociti in adipociti e l’attivazione di geni che codificano per proteine ad attività enzimatica prevalentemente lipolitica.
Bibliografia
- Molina P. Fisiologia Endocrina. Lange Physiology Series. McGraw-Hill, 2004: 84-8.
- Yen PM. Physiological and Molecular Basis of Thyroid Hormone Action. Physiol Rev 2001, 81: 1097-142.
- Yen PM. Genomic and nongenomic actions of thyroid hormones. In: The thyroid: fundamental and clinical text, 9th ed, Braverman LE, Utiger RD (Eds), Lippincott Williams and Wilkins, Philadelphia, 2005: 135.
Asse ipotalamo-ipofisi-tiroide
Leone Ferrari
Endocrinologia, Ospedali Riuniti, Bergamo
Si parla di asse Ipotalamo-Ipofisi-Tiroide perché i principali protagonisti della regolazione della funzione tiroidea sono, in senso cranio-caudale:
- il TRH secreto dai nuclei paraventricolare e sopraottico dell’Ipotalamo;
- il TSH prodotto e secreto dall’ipofisi;
- la T4 e la T3 prodotte dalla tiroide, che sono regolate e a loro volta regolano la secrezione del TRH e del TSH.
TRH
Il TRH è sintetizzato principalmente, ma non esclusivamente, dai neuroni del nucleo para-ventricolare dell’ipotalamo come macromolecola proteica, il pre-pro-TRH. Questo viene progressivamente clivato durante il trasporto assonale fino all’eminenza mediana, dove è secreto nel plesso portale ipotalamo-ipofisario come tripeptide biologicamente attivo. Altri peptidi TRH-simili sono secreti in numerosi altri tessuti, come l’ipofisi, la tiroide, l’encefalo, il cuore, il fegato, le gonadi e la prostata, ma, pur avendo caratteristiche di immuno-reattività simili, non hanno un ruolo definito a livello ipofisario, che è invece esclusiva del TRH ipotalamico.
La secrezione del TRH è pulsatile. È sotto stretto controllo inibitorio degli ormoni tiroidei e in parte del TSH.
La sua azione è principalmente di stimolo sulla sintesi e la secrezione del TSH adeno-ipofisario attraverso il legame a specifici recettori di membrana accoppiati alle proteine-G, ma anche della prolattina, del GH e probabilmente dell’ACTH. Poco dopo il legame con il recettore, il TRH viene rapidamente inattivato da una specifica peptidasi posta sulla superficie delle cellule, denominata TRH-DE (TRH-degrading ectoenzyme), che è regolata positivamente dagli ormoni tiroidei e il cui ruolo è di regolare e modulare la secrezione del TSH ipofisario.

Struttura del TRH (Pyr-HYs-Pro-NH2)
TSH
Il TSH è una glicoproteina eterodimerica, costituita da una componente oligosaccaridica e da due subunità proteiche, alfa e beta. La subunità alfa, identica a quella di FSH, LH e hCG, è costituita da 92 aminoacidi, con 5 ponti disulfurici; è legata in modo stretto, ma non covalente alla subunità beta ed è indispensabile per esprimere la bio-attività ormonale. La subunità beta è costituita da 118 aminoacidi, con 6 ponti disulfurici, presenta un’identità biologica del 30-80% con le altre glicoproteine, ed è la depositaria della specificità dell'azione biologica dell’ormone, poiché interagisce direttamente con il recettore cellulare del TSH.
La componente oligosaccaridica del TSH ha il compito di mantenere l'assemblaggio e la conformazione spaziale della molecola, prevenirne la degradazione intra- ed extra-cellulare, facilitarne la secrezione nel torrente circolatorio, la distribuzione e la clearance. In definitiva, poiché un diverso grado di glicosilazione è in grado di variare la bioattività del TSH, si va facendo strada il concetto di regolazione qualitativa della funzione del TSH.
Il TSH ha un’emivita di circa un’ora; ha una secrezione pulsatile indipendente dal TRH ma comune alla prolattina, con picchi di 0.6 mU/L ogni circa due ore. Il ritmo di secrezione è circadiano, con nadir pomeridiano e un picco fra le 21 e le 2 del mattino, coincidente con l’inizio del sonno. La variazione circadiana del TSH è controllata dal TRH attraverso la modulazione del tono dopaminergico.
Il TSH secreto a livello ipofisario viene veicolato attraverso la circolazione generale alla tiroide, dove si lega ad un recettore specifico di membrana, appartenente alla superfamiglia dei recettori accoppiati alla proteina G, la cui attivazione c-AMP-mediata, spiega la maggior parte degli effetti del TSH.
Il TSH ha un ruolo essenziale per la differenziazione e lo sviluppo della ghiandola tiroidea e per la sua attività funzionale in quanto stimola:
- iperplasia e ipertrofia dei tireociti;
- captazione e organificazione dello iodio da parte del tireocita;
- esocitosi della tireoglobulina nel lume follicolare, endocitosi nella colloide e secrezione degli ormoni tiroidei in circolo
- vascolarizzazione ghiandolare.
Il controllo principale dell’asse Ipotalamo-Ipofisi-Tiroide è esercitato dagli ormoni tiroidei con un meccanismo di feed-back negativo sulla secrezione del TRH e del TSH (long loop feed-back). Il TSH, a sua volta, esercita un effetto inibitorio sulla secrezione del TRH (short feed-back) a livello ipotalamico e sulla sua secrezione a livello ipofisario (ultra-short feed-back). Il risultato finale è, in condizioni fisiologiche, una notevole stabilità dei livelli circolanti di TSH, che si riflette a cascata sulla secrezione degli ormoni tiroidei. Al contrario, in condizioni patologiche, una ridotta produzione di ormone tiroideo determina un rapido incremento della sintesi e secrezione del TRH e del TSH, con conseguente stimolazione a livello tiroideo della biosintesi e del rilascio di T4 e T3, mentre un incremento abnorme di ormoni tiroidei è in grado di inibire altrettanto prontamente la sintesi e la secrezione di TRH e di TSH. La correlazione tra TSH e FT4 non è lineare, ma log-lineare: se l’FT4 si dimezza, il TSH non raddoppia ma aumenta di molte decine di volte; il TSH risulta quindi l’indicatore più sensibile degli ipo- e degli ipertiroidismi lievi.
L’effetto finale degli ormoni tiroidei si traduce in un importante dispendio energetico. Si rende pertanto necessario un rigoroso controllo della loro sintesi e secrezione, e poiché esso è in gran parte esercitata dal TSH, questo spiegherebbe la notevole stabilità e le scarse fluttuazioni che lo stesso TSH subisce. Il feed-back tra FT4 e TSH non scatta nel momento in cui il limite di riferimento viene superato, ma quando viene raggiunto un determinato set-point per “l’innesco” del feedback, che è specifico per ogni individuo: il feed-back di inibizione sul TSH si può verificare quindi a una concentrazione di FT4 che, pur essendo all’interno dell’intervallo di riferimento per la popolazione generale, è “anomala” per quel particolare soggetto.
Bibliografia
- Molina P. Fisiologia Endocrina. Lange Physiology Series. McGraw-Hill, 2004: 84-8.
- Mariotti S. Normal Physiology of the Hypothalamic-Pituitary-Thyroidal System and Relation to the Neural System and Other Endocrine Gland. www.Thyroidmanager.org Last Revised: June 1, 2011.
Diagnostica generale delle malattie tiroidee
Diagnostica biochimica e ormonale delle malattie tiroidee
TSH e ormoni tiroidei nella diagnostica delle tireopatie
Romolo Dorizzi
Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
TSH
L’ipofisi ha una funzione di biosensore e regolatore dell’attività degli ormoni tiroidei: quando l’attività biologica degli ormoni tiroidei scende al di sotto del set-point fisiologico, l’ipofisi risponde aumentando la concentrazione di TSH e viceversa. Quando l’ipofisi funziona in modo regolare, la funzione del TSH è quella di monitorare l’adeguatezza della funzione tiroidea.
Le strategie per la diagnostica di laboratorio di base delle tireopatie sono almeno due.
La strategia imperniata sul TSH, proposta da Klee e Hay circa 20 anni fa e impiegata da allora alla Mayo Clinic, “capitalizzava” il trend causato dalla disponibilità a partire dalla fine degli anni ‘80 di metodi di misurazione del TSH sempre più soddisfacenti, che si associava ad un progresso molto più lento dei metodi per la determinazione degli ormoni tiroidei liberi, che hanno ormai sostituito quasi universalmente quelli per la determinazione degli ormoni tiroidei totali.
Il concetto di base era quello di classificare come eutiroideo il soggetto con una concentrazione di TSH all’interno dell’intervallo di riferimento ed approfondire la valutazione con successivi esami solo in quei pazienti il cui valore di TSH superava i limiti di riferimento.
La strategia riproposta anche recentemente dalla British Thyroid Association (BTA) prevede l’esecuzione di TSH e FT4 in tutte le situazioni in cui lo stato dell’asse ipofisi-tiroide non è noto, oppure non è intatto o è in equilibrio instabile, per esempio in:
- pazienti in cui ipotiroidismo ed ipertiroidismo sono stati diagnosticati recentemente;
- gravidanza;
- diagnosi e trattamento dell’ipotiroidismo centrale;
- resistenza agli ormoni tiroidei;
- adenoma ipofisario TSH-secernente;
- nei primi mesi di trattamento sostitutivo e soppressivo.
Pertanto, mentre l’approccio basato sul TSH è il più appropriato nei pazienti che sono già stati valutati, la BTA raccomanda negli altri casi l’esecuzione contemporanea di TSH ed FT4.
E’ stata quindi la scuola endocrinologica della Mayo Clinic a promuovere negli anni scorsi il superamento del pannello tradizionale degli esami tiroidei, costituito da TSH, FT4, FT3, Ab anti-TPO e Ab anti-Tg, con la modalità di richiesta degli esami tiroidei denominata “TSH reflex o a cascata”. Tale modalità è “appropriata” in particolare nella popolazione ambulatoriale.
Il perno dell’algoritmo proposto è il TSH, il primo esame eseguito. Successivamente (figura):
- se la concentrazione di TSH rientra all’interno dell’intervallo di riferimento, il soggetto viene classificato come eutiroideo e non sono eseguiti ulteriori esami;
- se la concentrazione di TSH è inferiore al limite inferiore dell’intervallo di riferimento o ad un limite decisionale, viene misurato l’FT4 nella stessa provetta e nella stessa seduta analitica;
- se la concentrazione di questo risulta aumentata, la cascata si ferma ed il paziente viene classificato come ipertiroideo;
- se invece la concentrazione dell’FT4 rientra all’interno dell’intervallo di riferimento, viene misurato l’FT3;
- se, infine, la concentrazione del TSH è superiore al limite superiore dell’intervallo di riferimento, sono misurati, nella stessa provetta e nella stessa seduta analitica, l’FT4 e/o gli Ab anti-TPO.
E’ necessario sottolineare che, poichè la determinazione degli Ab anti-TPO è utile nella diagnosi ma non nel follow-up, nel caso la cascata preveda anche la determinazione degli Ab anti-TPO, è necessario predisporre un algoritmo diagnostico e uno di monitoraggio, rispettivamente con o senza Ab anti-TPO.

TSH reflex diagnostico (quello di monitoraggio non prevede la misurazione degli Ab anti-TPO)
Naturalmente il TSH reflex può essere adottato dal clinico e accettato dal paziente se rispetta tutte le seguenti condizioni:
- è automatico;
- richiede un singolo accesso del paziente al laboratorio;
- il campione raccolto deve essere sufficiente per l’esecuzione di tutti gli esami che possono essere necessari (e sufficienti) all’iter diagnostico;
- il referto deve essere disponibile negli stessi tempi richiesti dall’esecuzione degli esami tiroidei nelle modalità tradizionali.
Alcune Regioni hanno già pubblicato delle delibere che normano gli aspetti organizzativi ed amministrativi del TSH riflesso che è richiesto dal medico ospedaliero e di Medicina generale con le stesse modalità con cui richiede gli altri esami di laboratorio.
Sono sempre più numerose le evidenze che concentrazioni alterate di TSH possono ritornare spontaneamente all’interno dell’intervallo di riferimento dopo alcuni anni (addirittura la metà dei soggetti con TSH tra 5 e 10 mU/L presentano valori all’interno dell’intervallo di riferimento dopo 5 anni anche se non sono stati sottoposti ad alcuna terapia) e che concentrazioni elevate di TSH dopo la 7°-8° decade di età sembrano essere associate con una maggiore longevità. Si rafforza pertanto la posizione di quanti raccomandano un approccio prudente nella gestione di soggetti con concentrazione di TSH superiori ai limiti di riferimento con quadro clinico asintomatico soprattutto dopo i 70 anni. Possibili spiegazioni sono che l’aumento del TSH sia secondario ad altre patologie, ad alterazioni del ritmo sonno-veglia legate a patologia o lavoro, a oscillazioni fisiologiche dello stato autoimmunitario o a un semplice fenomeno di “regressione verso la media”.
Bibliografia
- Ross DS. Serum thyroid-stimulating hormone measurement for assessment of thyroid function and disease. Endocrinol Metab Clin North Am 2001, 30: 245-64.
- Allahabadia A, Weetman AP. Dynamic thyroid stimulating hormone tests: do they still have a role? J Endocrinol Invest 2003, 26 (7 Suppl): 31-8.
- Warren RE, Perros P, Nyirenda MJ, Frier BM. Serum thyrotropin is a better predictor of future thyroid dysfunction than thyroid autoantibody status in biochemically euthyroid patients with diabetes: implications for screening. Thyroid 2004, 14: 853-7.
- Association for Clinical Biochemistry, British Thyroid Foundation. UK Guidelines for the use of thyroid function tests (data di consultazione: 26.2.2012).
- Klee GG, Hay ID. Role of thyrotropin measurements in the diagnosis and management of thyroid disease. Clin Lab Med 1993, 13: 673-82.
- Castello R, Celebrano M, Dorizzi RM. La diagnostica tiroidea: il TSH riflesso. Dialogo sui farmaci 2006, 9: 84-6.
- Meyerovitch J, Rotman-Pikielny P, Sherf M, et al. Serum thyrotropin measurements in the community. Five-year follow-up in a large network of primary care physicians. Arch Intern Med 2007, 167: 1533-8.
- Diez JJ, Iglesias P, Burman KD. Spontaneous normalization of thyrotropin concentrations in patients with subclinical hypothyroidism. J Clin Endocrinol Metab 2005, 90: 4124–7.
- Atzmon G, Barzilai N, Hollowell JG, et al. Extreme longevity is associated with increased serum thyrotropin. J Clin Endocrinol Metab 2009, 94: 1251-4.
- Peeters RP. Thyroid function and longevity: new insights into an old dilemma. J Clin Endocrinol Metab 2009, 94: 4658–60.
- Dorizzi RM, Nizzoli M. Gli intervalli di riferimento in Endocrinologia; il caso del TSH. RIMeL/IJLaM 2009, 5 (Suppl): 52-61
FT4 e FT3
I metodi attualmente disponibili sottostimano frequentemente la concentrazione degli ormoni liberi nei soggetti eutiroidei, quando il legame agli ormoni tiroidei è marcatamente diminuito come nel deficit severo di TBG e nelle patologie gravi non tiroidee. Nei pazienti eutiroidei con patologie non tiroidee, il TSH supera il limite superiore di riferimento in oltre il 10% dei casi e quello inferiore all’incirca nella stessa percentuale. Nei pazienti con ipotiroxinemia da patologia non tiroidea severa si può avere una lieve soppressione del TSH; al momento del recupero del paziente, il TSH presenta un importante aumento transitorio (anche > 20 mU/L) non in relazione con l’FT4, che fa ipotizzare che sia legato a TSH immunoreattivo con bioattività ridotta. I pazienti che stanno recuperando da una patologia non tiroidea severa possono presentare transitoriamente valori di FT4 bassi o nei limiti di norma (anche misurati con il metodo di riferimento in dialisi simmetrica) e TSH diminuito (soprattutto se trattati con L-T3) e vanno ristudiati successivamente per la diagnosi differenziale con ipotiroidismo.
La relazione tra TSH e FT4 è alterata significativamente in tutte le patologie non tiroidee, in particolare in quelle psichiatriche. In ambito ospedaliero la maggior parte delle alterazioni di FT4 si riscontra nei pazienti con patologie non tiroidee medio-gravi e non in quelli con patologia tiroidea:
- FT4 è aumentato nel 10-40% dei soggetti ospedalizzati e nel 10-50% di quelli con patologie psichiatriche;
- FT4 è diminuito nel 20% dei pazienti critici, nel 25% dei soggetti con insufficienza renale cronica, nel 40% di quelli con epatopatia cronica e nell’80% di quelli con insufficienza renale acuta.
Il dosaggio di TSH è l’esame più affidabile, tranne che nei pazienti trattati con glucocorticoidi e dopamina (che inibiscono direttamente la secrezione di TSH) e in quelli con patologie che inducono insufficienza ipofisaria. In questi casi può essere utile ripetere la determinazione del TSH, poiché nei casi in cui non è presente tireopatia la sua concentrazione tende a riportarsi nell’intervallo di riferimento.
In presenza di TSH aumentato, quando la concentrazione di FT4 è francamente diminuita si parla di insufficienza tiroidea conclamata, quando è nei limiti si parla di ipotiroidismo subclinico.
L’FT3 è di scarsa utilità nell’ipotiroidismo, perche può rimanere nei limiti quando l’FT4 è diminuita. Rilevante dal punto di vista pratico può essere la sindrome con bassa T3, in cui T3 è diminuita in assenza dei sintomi da ipotiroidismo, che può presentarsi in pazienti con patologie acute e croniche non tiroidee.
La misurazione dell’FT3 trova indicazione solo in alcune condizioni sempre in associazione all’FT4:
- nel sospetto di ipertiroidismo con TSH soppresso e T4 normale, per identificare la T3-tireotossicosi e per distinguere questa entità dalla tireotossicosi subclinica;
- nel corso di terapia anti-tiroidea, per identificare un eccesso persistente di T3, nonostante valori normali di T4;
- per fare diagnosi di ipertiroidismo da amiodarone, che non deve essere basato sul solo eccesso di T4, data la frequenza di ipertiroxinemia eutiroidea nel corso di trattamento con amiodarone;
- durante una terapia sostitutiva o soppressiva ad alte dosi di T4, o dopo assunzione accidentale o intenzionale di un sovradosaggio di T4 per identificare un eccesso di T3.
Bibliografia
- Demers LM, Spencer CA. Laboratory medicine practice guidelines: laboratory support for the diagnosis and monitoring of thyroid disease. Clin Endocrinol (Oxf) 2003, 58: 138-40.
- Kaptein EM. Clinical application of free thyroxine determinations. Clin Lab Med 1993, 13: 653-72.
- Klee GG. Clinical usage recommendations and analytic performance goals for total and free triiodothyronine measurements. Clin Chem 1996, 42: 155-9.
- Midgley JE, Christofides ND. Point: legitimate and illegitimate tests of free-analyte assay function. Clin Chem 2009, 55: 439-41.
- Wilcox RB, Nelson JC. Counterpoint: legitimate and illegitimate tests of free-analyte assay function: we need to identify the factors that influence free-analyte assay results. Clin Chem 2009, 55: 442-4.
Anticorpi nello studio delle tireopatie
Romolo Dorizzi
Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
Anticorpi anti-perossidasi e anti-tireoglobulina
La patologia flogistica cronica della tiroide è di solito il risultato di un processo autoimmune in cui sono prodotti anticorpi contro uno o più antigeni specifici della tiroide, la perossidasi tiroidea (TPO), la Tg ed il recettore per il TSH.
Gli anticorpi anti-tireoperossidasi (anti-TPO) ed anti-Tg sono strettamente associati al processo autoimmune distruttivo dell’ipotiroidismo da tiroidite di Hashimoto. Gli anticorpi anti-TPO erano conosciuti come anticorpi anti-microsomi poichè i metodi inizialmente messi in commercio usavano microsomi tiroidei come antigeni per sviluppare anticorpi. Gli anticorpi anti-TPO hanno oramai sostituito gli anticorpi anti-microsomi (anche se i due metodi danno dei risultati clinici simili), la cui determinazione è ostacolata dalla disponibilità limitata di tessuto tiroideo umano, dal fatto che contengono antigeni tiroidei ed auto-anticorpi irrilevanti e dalla frequente contaminazione delle preparazioni di microsomi con Tg. Nelle malattie autoimmuni tiroidee, il sistema immunitario libera anticorpi che attaccano la TPO, l’enzima che permette l’aggiunta dello iodio sui residui tirosinici della Tg per la sintesi della T4 o della T3.
Poiché molti soggetti sani presentano anticorpi anti-TPO (in circa il 10% della popolazione soprattutto nelle donne, con la prevalenza della positività che aumenta con l'età), non è chiaro quale sia il significato delle basse concentrazioni di anticorpi anti-TPO. D’altra parte la grande maggioranza dei pazienti affetti da malattie autoimmuni della tiroide come tiroidite di Hashimoto (90-95% dei casi), tiroidite atrofica, tiroidite post-partum, malattia di Basedow (80% dei casi) presentano in circolo anticorpi anti-TPO. In generale, poiché gli anticorpi anti-Tg sono di solito associati agli anticorpi anti-TPO, risultano poco utili in ambito clinico. Tuttavia, gli Ab anti-Tg sono gli unici anticorpi elevati in alcuni casi di tireopatia autoimmune; pertanto, in caso la clinica o gli esami strumentali siano suggestivi, è appropriato misurare anche gli anticorpi anti-Tg (AbTg) che possono risultare gli unici aumentati.
Lievi e moderati incrementi degli AbTg possono essere presenti nei pazienti con malattie autoimmuni non tiroidee (per esempio lupus e sindrome di Sjogren). Gli anticorpi anti-Tg sono positivi anche in pazienti affetti da carcinoma differenziato della tiroide, in una percentuale almeno doppia rispetto alla popolazione normale. Gli anticorpi anti-TPO sono più strettamente correlati con la disfunzione tiroidea e studi autoptici hanno dimostrato una stretta relazione tra la presenza di questi anticorpi e l'infiltrazione linfocitica della tiroide, anche quando la tiroide è normale. Anche se il soggetto è asintomatico, la presenza di anticorpi circolanti indica una patologia tiroidea occulta.
Metodi sensibili per la determinazione degli anticorpi anti-Tg sono utilizzati esclusivamente per identificare quei soggetti in cui la presenza di questi anticorpi possono interferire nella determinazione della Tg.
Sia gli AbTPO che gli AbTg non hanno nessun ruolo nel monitoraggio delle tireopatie autoimmuni.
I metodi per la determinazione degli auto-anticorpi antitiroide si possono distinguere in:
- immunochimici: immunofluorescenza indiretta, fissazione del complemento, agglutinazione passiva, immunodiffusione, immunoprecipitazione, immunoblotting;
- immunometrici: radioimmunologici, immunoenzimatici, immunodosaggi in fluorescenza e in chemiluminescenza (che ne hanno permesso la misurazione quantitativa).
| Alterazioni delle concentrazioni di Ab anti-TPO | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Età avanzata (soprattutto nel genere femminile) M. di Graves Tiroidite di Hashimoto Altre patologie autoimmuni (a basso titolo): lupus o s. di Sjogren |
|
| Modificazioni farmaco-indotte | Glucocorticoidi Farmaci immunosoppressivi |
Sulfonamidi Anti-convulsivanti |
| Alterazioni delle concentrazioni di Ab anti-Tg | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | M. di Graves Tiroidite di Hashimoto Carcinoma tiroideo differenziato Altre patologie autoimmuni (a basso titolo): lupus o s. di Sjogren |
|
| Modificazioni farmaco-indotte | Glucocorticoidi Farmaci immunosoppressivi |
Sulfonamidi Anti-convulsivanti |
Bibliografia
- Pop VJ, De Vries E, Van Baar AL, et al. Maternal thyroid peroxidase antibodies during pregnancy: a marker of impaired child development? J Clin Endocrinol Metab 1995, 80: 3561-6.
- Hollowell JG, Staehling NW, Flanders WD, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002, 87: 489-99.
- Spencer CA, LoPresti JS. Measuring thyroglobulin and thyroglobulin autoantibody in patients with differentiated thyroid cancer. Nat Clin Pract Endocrinol Metab 2008, 4: 223-33.
- Kim WG, Yoon JH, Kim WB, et al. Change of serum antithyroglobulin antibody levels is useful for prediction of clinical recurrence in thyroglobulin-negative patients with differentiated thyroid carcinoma. J Clin Endocrinol Metab 2008, 83: 4683-9.
- Anderson JW, et al. Diagnostic value of thyroid antibodies. J Clin Endocrinol Metab 1967, 37: 937-44.
- Sinclair D. Analytical aspects of thyroid antibodies estimation. Autoimmunity 2008, 41: 46-54.
- Brown RS. Autoimmune thyroid disease: unlocking a complex puzzle. Curr Opin Pediatr 2009, 21: 523-8.
- Tozzoli R. L’evoluzione della tecnologia e le ricadute sui percorsi diagnostici delle malattie autoimmuni. RIMEL/IJLaM 2006, 2: 141-50.
- La’ulu SL, Slev PR, Roberts WL. Performance characteristics of 5 automated thyroglobulin autoantibody and thyroid peroxidase autoantibody assays. Clin Chim Acta 2007, 376: 88-95.
Anticorpi anti-recettore del TSH
Risale al 1956 la prima segnalazione dell’esistenza di una sostanza diversa dal TSH in grado di stimolare la tiroide, la cui maggiore differenza era il tempo prolungato di azione (Long-ActingThyroid Stimulator o LATS). Solo molto più tardi è diventato chiaro che il LATS non era una proteina simile al TSH, ma una immunoglobulina in grado di stimolare il recettore per il TSH e causare l’ipertiroidismo. Gli auto-anticorpi anti-recettore del TSH (TRAb), eterogenei funzionalmente (policlonali), agiscono, come il TSH, sia sulla via del cAMP che su quella del fosfo-inositolo e sono in grado, quindi, di stimolare e di bloccare la sintesi ormonale e la crescita ghiandolare. Possono quindi sia mimare l’azione ormonale del TSH inducendo un vero e proprio ipertiroidismo, come si osserva nel morbo di Basedow, che antagonizzarne l’azione fino ad arrivare ad un vero e proprio ipotiroidismo. Questo quadro si verifica soprattutto nel neonato, in seguito al passaggio placentare di auto-anticorpi IgG.
La determinazione dei TRAb può essere utile nella diagnosi della malattia di Basedow e anche durante il trattamento, poichè il loro titolo correla con la prognosi. La presenza di TRAb nel corso della gravidanza costituisce un fattore di rischio di patologia tiroidea fetale o neonatale, data la capacita di queste molecole di attraversare la placenta.
Possono essere prodotti contemporaneamente o in epoche successive TRAb di volta in volta stimolanti o inibenti e questa eterogeneità spiega la difficoltà di mettere a punto dei metodi di misura accurati e l’osservazione clinica di pazienti con m. di Basedow che vanno in remissione spontanea durante la gravidanza, o ipotiroidismi transitori indotti da radioiodio.
Nella determinazione dei TRAb, come quella di tutti i metodi immunometrici, i risultati sono strettamente metodo-dipendenti e possono essere molto diversi: per la diversità degli standard secondari impiegati e per la preparazione di recettori o cellule utilizzati, per la contaminazione del reagente antigenico con altri auto-antigeni, per l’architettura del dosaggio (competitivo/non competitivo) e per gli epitopi differenti all’interno dell’eterogenea popolazione di anticorpi presenti nel siero del paziente riconosciuti dai diversi metodi.
Gli auto-anticorpi riconoscono un numero di epitopi minore rispetto agli anticorpi eterologhi. I metodi attuali riconoscono gli epitopi in modo molto diverso, portando a specificità differente con conseguente bias per la popolazione auto-anticorpale. Anche metodi che impiegano lo stesso materiale come standard possono avere intervalli di riferimento molto diversi.
I metodi per la misura dei TRAb possono essere di due tipi:
- i TBII misurano la capacita di un siero o di una immunoglobulina di bloccare il legame tra il TSH “marcato” con tracciante con 125I e la preparazione in vitro del recettore dell’ormone, disponibile oggi anche di origine umana ricombinante. Questi metodi non sono in grado di distinguere TRAb stimolanti da TRAb bloccanti e sono, in qualche caso, standardizzati con lo standard WHO (MRC 90/672)
- i bioassay impiegano preparazioni cellulari per misurare gli effetti biologici dei TRAb:
- alcuni utilizzano come antigene la porzione N-terminale del dominio extra-cellulare, in grado di mimare l’azione ormonale (anticorpi “stimolanti”);
- altri utilizzano come antigene la porzione C-terminale che evidenzia gli anticorpi “bloccanti”.
La maggior parte dei bioassay oggi impiegati si basa sulla produzione di secondo messaggero a seguito di attivazione del recettore del TSH presente su una preparazione.
| Alterazioni delle concentrazioni di Ab anti-recettore del TSH | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | M. di Graves Tiroidite di Hashimoto Coriocarcinoma |
|
| Modificazioni farmaco-indotte | Glucocorticoidi Immunosoppressivi |
|
Bibliografia
- Kung AW, Lau KS, Kohn LD. Characterization of thyroid-stimulating blocking antibodies that appeared during transient hypothyroidism after radioactive iodine therapy. Thyroid 2000, 10: 909-17.
- Giovanella L, Ceriani L, Garancini S. Clinical applications of the 2nd generation assay for anti-TSH receptor antibodies in Graves’ disease. Evaluation in patients with negative 1st generation test. Clin Chem Lab Med 2001, 39: 25-8.
- Gartner R. Thyroid diseases in pregnancy. Curr Opin Obstet Gynecol 2009, 21: 501-7.
- Morgenthaler NG, Ho SC, Minich WB. Stimulating and blocking thyroid-stimulating hormone (TSH) receptor autoantibodies from patients with Graves' disease and autoimmune hypothyroidism have very similar concentration, TSH receptor affinity, and binding sites. J Clin Endocrinol Metab 2007, 92: 1058-65.
- Quadbeck B, Hoermann R, Hahn S, et al. Binding, stimulating and blocking TSH receptor antibodies to the thyrotropin receptor as predictors of relapse of Graves' disease after withdrawal of antithyroid treatment. Horm Metab Res 2005, 37: 745-50.
- Davies TF, Ando T, Lin RY, et al. Thyrotropin receptor-associated diseases: from adenomata to Graves disease. J Clin Invest 2005, 115: 1972-83.
- Kung AW, Jones BM. A change from stimulatory to blocking antibody activity in Graves' disease during pregnancy. J Clin Endocrinol Metab 1998, 83: 514-8.
- Michalek K, Morshed SA, Latif R, et al. TSH receptor autoantibodies. Autoimmun Rev 2009, 9: 113-6.
- Atger M, Misrahi M, Young J, et al. Autoantibodies interacting with purified native thyrotropin receptor. Eur J Biochem 1999, 265: 1022-31.
- Massart C, Gibassier J, d'Herbomez M. Clinical value of M22-based assays for TSH-receptor antibody (TRAb) in the follow-up of antithyroid drug treated Graves' disease: comparison with the second generation human TRAb assay. Clin Chim Acta 2009, 407: 62-6.
- Attanasio R, Borretta G, Buonomo L, et al. Manuale per la valutazione e l’inquadramento delle patologie della tiroide. AME 2011.
- Gupta MK. Thyrotropin-receptor antibodies in thyroid diseases: advances in detection techniques and clinical application. Clin Chem Acta 2000, 293: 1-29.
- Eckstein A, Esser J, Mann K, Schott M. Clinical value of TSH receptor antibodies measurement in patients with Graves’ orbitopathy. Pediatr Endocrinol Rev 2010, 7 Suppl 2: 198-203.
- Kasagi K, Konishi J, Iida Y, et al. A sensitive and practical assay for thyroid stimulating antibodies using FRTL-5 thyroid cells. Acta Endocrinol 1987, 115: 30-6.
- Michelangeli VP, Munro DS, Poon CW, et al. Measurement of thyroid stimulating immunoglobulins in a new cell line transfected with a functional human TSH receptor (JPO9 cells), compared with an assay using FRTL-5 cells. Clin Endocrinol 1994, 40: 645-52.
- Morgenthaler NG, Pampel I, Aust G, et al. Application of a bioassay with CHO cells for the routine detection of stimulating and blocking autoantibodies to the TSH-receptor. Horm Metab Res 1998, 30: 162-8.
- Shibayama K, Ohyama Y, Yokota Y, et al. Assays for thyroid-stimulating antibodies and thyrotropin-binding inhibitory immunoglobulins in children with Graves' disease. Endoc J 2005, 52: 505-10.
- Pedersen IB, Knudsen N, Perrild H, et al. TSH-receptor antibody measurement for differentiation of hyperthyroidism into Graves' disease and multinodular toxic goitre: a comparison of two competitive binding assays. Clin Endocrinol 2001, 55: 381-90.
- Zimmermann-Belsing T, Nygaard B, Rasmussen AK, et al. Use of the 2nd generation TRAK human assay did not improve prediction of relapse after antithyroid medical therapy of Graves' disease. Eur J Endocrinol 2002, 146: 173-7.
- Schott M, Morgenthaler NG, Fritzen R, et al. Levels of autoantibodies against human TSH receptor predict relapse of hyperthyroidism in Graves' disease. Horm Metab Res 2004, 36: 92-6.
Tireoglobulina
Romolo Dorizzi
UO Patologia Clinica-Laboratorio Unico AUSL della Romagna, Pievesestina di Cesena (FC)
(aggiornato al 23 maggio 2017)
Fisiologia
La tireoglobulina (Tg) è la proteina più abbondante nella tiroide (rappresenta fino al 75% del contenuto proteico della tiroide e la sua concentrazione nel lume follicolare può raggiungere una concentrazione di 200-300 g/L).
Si tratta di una grossa proteina di 670 kDa, prodotta esclusivamente dalle cellule follicolari tiroidee normali e neoplastiche, costituita da due subunità identiche, estesamente modificate a livello post-traduzionale da processi di glicosilazione, fosforilazione, sulfonazione e iodinazione.
Le sue funzioni fisiologiche sono quelle di pro-ormone per la tiroxina e la tri-iodotironina; fornisce, quindi, una matrice per la sintesi degli ormoni tiroidei e agisce da deposito dello iodio in forma di precursori inattivi come mono- e di-iodotirosina. L’organismo attinge a tale deposito quando la disponibilità di iodio esogeno è scarsa.
I 20 siti di glicosilazione della proteina sono associati con catene multiple, molto ramificate, che determinano elevata eterogeneità. Sono state attribuite numerose funzioni biologiche agli oligosaccaridi: iodinazione e sintesi degli ormoni, interazioni della Tg con i microsomi tiroidei, interazione con i recettori di membrana, immunoreattività della Tg. Le catene peptidiche contengono residui fosforici, solforici e iodio, la cui quantità dipende da quella dello iodio trasportato nella cellula e dalle azioni catalitiche della tireoperossidasi.
La Tg presenta struttura diversa, a seconda dei differenti stati fisiologici: per esempio, la presenza o l’assenza di TSH causa livelli diversi di ramificazione e di complessità delle catene glucidiche, ovvero la Tg prodotta da tessuti tiroidei affetti da patologie maligne è meno iodinata di quella prodotta da tessuti affetti da patologie benigne e presenta alterazioni delle cariche della superficie. Gli epitopi anticorpali possono essere in tali regioni influenzando l’immunogenicità della molecola, soprattutto rispetto agli anticorpi monoclonali. Anticorpi diversi impiegati da strumenti diversi possono riconoscere in modo diverso la stessa molecola e misurarla in modo molto diverso, obbligando a usare lo stesso metodo per il follow-up di un paziente.
Dopo la secrezione, la Tg viene eliminata con un’emivita di 2-4 giorni dopo l’intervento chirurgico, ma dopo altri trattamenti può variare di molto e dopo la terapia radiometabolica possono passare anche tre mesi o più perché la Tg circolante non sia più misurabile.
Utilizzo diagnostico
La Tg è prodotta esclusivamente dalle cellule tiroidee e presenta una specificità molto elevata per il tessuto tiroideo. Da questo deriva la principale applicazione clinica della determinazione della Tg: il follow-up del carcinoma differenziato della tiroide (DTC). La Tg non ha nessun ruolo nella diagnosi del cancro della tiroide, ma rappresenta un indicatore sensibile e specifico del DTC dopo tiroidectomia totale e ablazione con radioiodio del tessuto residuo, soprattutto se misurato dopo sospensione della terapia sostitutiva o dopo stimolazione con TSH ricombinante.
I pazienti con DTC a basso rischio di recidiva cominciano a essere trattati in modo meno aggressivo rispetto al passato: per esempio, sono trattati con emitiroidectomia, non sono sottoposti ad ablazione con radioiodio dopo tiroidectomia totale e non sono trattati con terapia soppressiva del TSH. In questi gruppi di pazienti la Tg può risultare misurabile e deve essere monitorato il trend della sua concentrazione nel tempo, che può subire oscillazioni per fattori analitici e variazioni della concentrazione del TSH. In queste situazioni la stimolazione con TSH non migliora l’accuratezza diagnostica e la gestione del paziente si deve basare sulla clinica e sulla diagnostica per immagini.
La Tg è molto poco specifica al di fuori di tale ambito e la sua concentrazione aumenta in numerose patologie della tiroide, come gozzo nodulare, tiroidite cronica autoimmune e tiroidite subacuta, gozzo tossico e morbo di Basedow. La Tg è indosabile in caso di ipotiroidismo da agenesia tiroidea e nei limiti o aumentata se l’ipotiroidismo è secondario a gozzo da disormonogenesi o da tiroide ectopica. Nella tireotossicosi factitia la concentrazione di Tg non è elevata, ma risulta non dosabile.
Un piccolo numero di carcinomi di derivazione follicolare presenta una produzione di Tg bassissima o assente. Di solito questo fenomeno si osserva nelle forme poco differenziate e può anche essere acquisito da tumori in progressione che nella de-differenziazione perdono la capacità di produrre Tg. In questi casi, la misura di Tg con o senza stimolazione ha una sensibilità diagnostica ridotta. Questo è il motivo per cui è sempre necessario misurare la Tg in tutti i pazienti prima di programmare il follow-up del cancro della tiroide con tale determinazione. Poiché la maggior parte di questi tumori tende a metastatizzare a strutture loco-regionali, nel follow-up accanto al dosaggio di Tg è necessaria l’ecografia del collo a elevata risoluzione.
I metodi ad elevata sensibilità oggi disponibili, che consentono la misurazione accurata di concentrazioni di Tg ≤ 0.1 µg/L, hanno diminuito l’impiego dei test di stimolazione della Tg, dato che hanno le stesse prestazioni diagnostiche dei test di stimolazione, con valori predittivi positivi e negativi del 90-100%. I metodi per la misurazione della Tg sono immunometrici e quindi soggetti a interferenze di vario genere, come quelle legate a reazioni crociate con agenti diversi, come gli anticorpi anti-tireoglobulina (TgAb), presenti nel siero di circa il 20–30% dei pazienti con DTC, anche a concentrazioni più basse di quelle che si misurano nelle tireopatie autoimmuni. Sono più frequenti nelle donne e sono presenti in circa il 60% dei pazienti con tireopatia autoimmune.
In presenza di TgAb, è più frequente trovare una Tg indosabile e la presenza di TgAb suggerisce la presenza di Tg. Quando la Tg è misurabile nonostante la presenza di TgAb, possono essere ipotizzati la presenza di un residuo o di una recidiva. Nei pazienti TgAb-positivi si possono ottenere risultati più accurati impiegando metodi in Spettrometria di Massa, diventati disponibili recentemente ma ancora poco impiegati perché meno sensibili rispetto ai metodi immunometrici.
Sono meno frequenti gli anticorpi eterofili, che possono dare risultati falsamente positivi: quando sospettati, deve essere richiesto al laboratorio di verificarne la presenza.
La difficoltà di accesso a servizi di citopatologia tiroidea validi (almeno il 20% dei risultati di FNA risultano non diagnostici o inaccurati) e il risultato non diagnostico di almeno il 10% degli FNA da linfonodo, a causa di aspirati pauci-cellulari anche in presenza di adeguato supporto citopatologico, ha aumentato l’interesse nella determinazione della Tg nel liquido di lavaggio dell’ago dopo FNA, come ausilio diagnostico per il carcinoma metastatico della tiroide.
| Alterazioni delle concentrazioni di tireoglobulina | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Ipotiroidismo da agenesia tiroidea Tireotossicosi factitia Ab anti-Tg |
Gozzo nodulare Gozzo tossico M. di Graves Tiroidite di Hashimoto Tiroidite subacuta Carcinoma tiroideo differenziato Anticorpi eterofili |
| Modificazioni farmaco-indotte | Ormoni tiroidei (alte dosi) | TSH-ricombinante |
| Confronto fra metodi per il dosaggio della tireoglobulina | ||||
| Metodo | Produttore | Sensibilità (μg/L) | TAT | |
| Analitica | Funzionale | |||
| ECLIA | Roche | 0.04 | 0.1 | 18 min |
| ICMA | Diasorin | 0.20 | 1.0 | 30 min |
| ICMA | Beckman | 0.01 | 0.1 | 40 min |
| ICMA | Siemens | 0.20 | 0.9 | 90 min |
| ELISA | RSR | 0.03 | 0.05 | overnight |
| TRACE | Thermo Fisher | 0.01 | 0.15 | 20 min |
Sensibilità analitica: minima concentrazione dell'analita che può essere distinta da zero; il valore corrisponde alla media + 2 (3) DS di 20 replicati del calibratore 0 o di un campione che non contenga l'analita.
Sensibilità funzionale (o limite di quantificazione): la concentrazione minima dell'analita che può essere misurata in modo affidabile, che corrisponde alla concentrazione dell'analita alla quale il coefficiente di variazione interdosaggi (20 misure ripetute) non supera il 20%.
Turn around time (TAT): tempo che intercorre tra il momento del prelievo e l'acquisizione del risultato da parte del richiedente.
Bibliografia
- Evans C, Tennant, Perros P. Serum thyroglobulin in the monitoring of differentiated thyroid cancer. Scand J Clin Lab Invest 2016, 76 suppl 245: S119-23.
- Giovanella L, Feldt-Rasmussen U, Verburg FA, et al. Thyroglobulin measurement by highly sensitive assays: focus on laboratory challenges. Clin Chem Lab Med 2015, 53: 1301-14.
- Giovanella L, Clark PM, Chiovato L, et al. Thyroglobulin measurement using highly sensitive assays in patients with differentiated thyroid cancer: a clinical position paper. Eur J Endocrinol 2014, 171: R33-46.
- Rotteveel-de Groot DM, Ross HA, Janssen MJR, et al. Evaluation of the highly sensitive Roche thyroglobulin II assay and establishment of a reference limit for thyroglobulin-negative patient samples. Pract Lab Med 2016, 5: 6–13.
- Spencer C, LoPresti J, Fatemi S. How sensitive (second-generation) thyroglobulin measurement is changing paradigms for monitoring patients with differentiated thyroid cancer, in the absence or presence of thyroglobulin autoantibodies. Curr Opin Endocrinol Diabetes Obes 2014, 21: 394–404.
- Crane MS, Strachan MWJ, Toft AD, Beckett GJ. Discordance in thyroglobulin measurements by radioimmunoassay and immunometric assay: a useful means of identifying thyroglobulin assay interference. Ann Clin Biochem 2013, 50: 421–32.
- Netzel BC, Grebe SKG, Carranza Leon BG, et al. Thyroglobulin (Tg) testing revisited: Tg assays, TgAb assays, and correlation of results with clinical outcomes. J Clin Endocrinol Metab 2015, 100: E1074–83.
- Giovanella L, Feldt-Rasmussen U, Verburg FA, et al. Thyroglobulin measurement by highly sensitive assays: focus on laboratory challenges. Clin Chem Lab Med 2015, 53: 1301–14.
Calcitonina
Romolo Dorizzi
Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
Il carcinoma midollare della tiroide (MTC) deriva dalla cellule C della tiroide che producono la calcitonina ed è stato descritto per la prima volta nel 1959. Risale al 1968 la prima segnalazione della elevata concentrazione di CT nei pazienti con MTC.
Il valore basale di CT svolge un ruolo di marcatore per il MTC e la misurazione della CT rappresenta il punto critico nella valutazione iniziale e nel follow-up a lungo termine dei pazienti con MTC. Valori elevati equivalgono a diagnosi di carcinoma midollare della tiroide, una volta escluse le poche altre cause di elevata calcitoninemia (tabella).
Attualmente non esiste accordo universale tra le società scientifiche sulle indicazioni cliniche della misurazione della CT. Mentre in Italia e in Francia la determinazione routinaria della CT nel paziente con patologia nodulare della tiroide è sostenuta da alcuni anni sulla base di casistiche molto rilevanti, negli Stati Uniti la questione è stata accesamente dibattuta fino ad oggi e la posizione è meno netta. Riassumendo le varie posizioni, si può concludere che la determinazione della calcitonina è indicata nelle seguenti situazioni cliniche:
- noduli tiroidei situati al polo superiore dei lobi;
- calcificazioni intra-nodali o altri caratteri ecografici sospetti per malignità;
- adenopatie cervicali con caratteri clinici o ecografici sospetti per metastasi;
- cellule ossifile o reperto di lesione follicolare all’esame citologico
- pazienti che devono essere sottoposti a terapia chirurgica per patologia nodulare tiroidea, al fine di pianificare un’adeguata estensione dell’intervento che, in caso di sospetto MTC, deve essere preceduto da screening per feocromocitoma;
- pazienti con sospetto clinico per MTC o con familiarità, certa o sospetta, per MTC o per MEN 2.
| Altterazioni delle concentrazioni di calcitonina | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Anticorpi anti-calcitonina |
Carcinoma midollare della tiroide |
| Modificazioni farmaco-indotte | Adrenalina | Inibitori di pompa protonica Glucocorticoidi Beta-bloccanti Glucagone |
Bibliografia
- Massoll N, Mazzaferri EL. Diagnosis and management of medullary thyroid carcinoma. Clin Lab Med 2004, 24: 49-83.
- Elisei R, Bottici V, Luchetti F, et al. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab 2004, 89: 163-8.
- Niccoli P, Wion-Barbot N, Caron P, et al. Interest of routine measurement of serum calcitonin: study in a large series of thyroidectomized patients. J Clin Endocrinol Metab 1997, 82: 338-41.
- Hodak SP, Burman KD. The calcitonin conundrum-is it time for routine measurement of serum calcitonin in patients with thyroid nodules? J Clin Endocrinol Metab 2004, 89: 511-4.
- Deftos LJ. Should serum calcitonin be routinely measured in patients with thyroid nodules-will the law answer before endocrinologists do? J Clin Endocrinol Metab 2004, 89: 4768-9.
- Levy-Bohbot N, Patey M, Larbre H, et al. How to interprete hypercalcitoninemia? Rev Med Interne 2006, 27: 610-5.
- Cohen R, Campos JM, Salaun C, et al. Preoperative calcitonin levels are predictive of tumor size and postoperative calcitonin normalization in medullary thyroid carcinoma. J Clin Endocrinol Metab 2000, 85: 919-22.
- Borget I, De Pouvourville G, Schlumberger M. Calcitonin determination in patients with nodular thyroid disease. J Clin Endocrinol Metab 2007, 92: 425-7.
- Attanasio R, Borretta G, Buonomo L, et al. Manuale per la valutazione e l’inquadramento delle patologie della tiroide. AME 2011.
Effetti dei farmaci sugli esami tiroidei
Romolo Dorizzi
Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
I numerosi effetti dei farmaci sull’asse ipofisi-tiroide sono riassunti in tabella.
Gli effetti sul TSH sono in genere fisiologici, mentre la gran parte di quelli sulla stima dell’FT4 sono metodologici. Il litio e i composti ricchi di iodio, in particolare l’amiodarone, possono alterare la funzionalità tiroidea.
La correlazione tra ormoni tiroidei circolanti e manifestazioni cliniche delle disfunzioni tiroidee indotte dall’amiodarone può essere scarsa, a causa dell’interazione del farmaco o dei suoi metaboliti con i recettori degli ormoni tiroidei. Nelle regioni iodio-replete l’anomalia indotta più frequentemente è l’ipotiroidismo che è particolarmente frequente nei pazienti con tiroidite autoimmune. L’amiodarone causa due tipi di tirotossicosi, una dovuta direttamente a eccesso di iodio e l’altra attribuita a una forma particolare di tiroidite. L’ipertiroxinemia benigna eutiroidea compare in un quarto dei pazienti trattati e si manifesta con concentrazioni aumentate di FT4, normali di TSH, normali o diminuite di FT3.
Il litio, usato nei disordini bipolari, ha numerosi effetti sull’asse ipofisi-tiroide, il più importante dei quali è l’inibizione della liberazione dell’ormone. Il litio può esacerbare o attivare una patologia tiroidea autoimmune con sviluppo di gozzo e, eventualmente, ipotiroidismo; è stata segnalata anche una tireotossicosi da litio. TSH, F4 e FT3 danno di solito un indice accurato dello status tiroideo durante la terapia con litio.
La fenitoina causa frequentemente concentrazioni basse di T4 totale e una diminuzione apparente dell’FT4 dovuta principalmente a un artefatto da diluizione. Farmaci come fenitoina e furosemide possono spiazzare T4 e T3 dalla TBG, ma risulta tecnicamente difficile misurare tale fenomeno con i metodi attuali per l’FT4 che usano campioni diluiti. Le molecole che competono sono si solito meno legate del T4 alle proteine, cosicché con una progressiva diluizione, la concentrazione libera della molecola che compete diminuisce prima della concentrazione dell’FT4. Se il T4, con una frazione libera di circa 1:4000 in un campione non diluito, è confrontato con un farmaco che ha una frazione libera di 1:50, la progressiva dissociazione manterrà la concentrazione di T4 libera alla diluizione di 1:100, mentre la concentrazione di farmaco libero diminuisce marcatamente dopo una diluizione di solo 1:10. Inoltre fenitoina e carbamazepina accelerano la clearance di T4 e T3 mediante induzione degli enzimi citocromo P450 epatici e la fenitoina riduce l’assorbimento intestinale di T4. Pertanto è necessario aumentare la posologia di levo-tiroxina nei pazienti in trattamento.
L’infusione di dopamina alla dose di 5-10 μg determina una riduzione immediata della secrezione di TSH: in Terapia Intensiva può normalizzare i livelli di TSH nei pazienti ipotiroidei con malattie severe extra-tiroidee.
Il propranololo diminuisce la T3 circolante soprattutto per la riduzione della sua produzione a partire dalla T4. Tale proprietà è solo del propanololo e non di altri beta bloccanti quali il metoprololo o l’atenololo o dell’alfa e beta-bloccante labetololo. L’effetto dei beta bloccanti potrebbe essere mediato da un’azione sulle membrane cellulari.
I farmaci che si legano fortemente all’albumina interferiscono con il legame della T4 e della T3 con l’albumina stessa. Eparina e eparina a basso peso molecolare determinano un aumento apparente della concentrazione della FT4 in vitro (aumento dovuto al rilascio in vivo della lipasi, seguito dalla produzione in vitro degli acidi grassi non esterificati in vitro). Anche sole 10 U.I. di eparina possono causare questo artefatto e causare aumenti apparenti di FT4 rendendo più utile la determinazione di T4 e T3 totali rispetto a quella di FT4 e FT3 nei pazienti in terapia con Eparina.
La rifampicina è uno dei più potenti induttori degli enzimi citocromo-P450 epatici. Nei soggetti eutirodei si verifica un aumento compensatorio della secrezione della T4, mentre la conversione da T4 a T3 resta normale e la produzione e la cinetica della T3 non si modificano; i soggetti rimangono eutiroidei.
Idrossido di alluminio, solfato di ferro, sucralfato, preparati a base di soia possono ridurre l’assorbimento della T4 assunta per os, probabilmente legando la T4 nel lume intestinale. In presenza di un asse ipotalamo-ipofisi-tiroide funzionante, questi farmaci non esercitano alcun effetto, mentre nei pazienti in terapia con levo-tiroxina abbassano T4 e TSH. Questa interazione può essere ridotta al minimo, aumentando l’intervallo tra l’assunzione di levo-tiroxina e quella dei potenziali inibitori del suo assorbimento.
| Farmaci interferenti e meccanismo d'azione | |||
| Farmaco | Modifiche | Meccanismo | Rilevanza clinica |
| Idrossido alluminio | TSH↑, fT3↓, fT4↓ | Riduzione dell'assorbimento della tiroxina | Potenzialmente rilevante |
| Amiodarone | TSH↑, fT3 =, fT4↑ | Molto frequente all'inizio: significa esposizione | Nessuna |
| TSH↑↑, fT3↓, fT4↓ | Ipotiroidismo: frequente | Rilevante | |
| TSH↓, fT3↑, fT4↑ | Tireotossicosi, molto grave: rischio più elevato nella ipertrofia tiroidea | Molto rilevante | |
| ASA e FANS (solo alte dosi acute) | T3 Tot↓, T4 tot↓ | Riduzione quota ormoni legati alle proteine | Nessuna |
| fT3↑, fT4↑ | Dismissione di ormoni che divengono liberi dalle proteine | Raramente rilevante | |
| Calcio carbonato | TSH↑, fT3↓, fT4↓ | Riduzione dell'assorbimento della tiroxina | Potenzialmente rilevante |
| Carbamazepina, diazepam | T3 Tot↓, T4 tot↓, fT3↑, fT4↑ | Riduzione quota ormoni legati alle proteine | Nessuna |
| Colestiramina | TSH↑, fT3↓, fT4↓ | Riduzione dell'assorbimento della tiroxina | Potenzialmente rilevante |
| Contraccettivi, gravidanza | fT3 fT4 TSH = T3 tot T4 Tot ↑ | Incremento proteine leganti e quota ormone totale | Nessuna |
| Corticosteroidi (alte dosi) | TSH ↓ | Blocco a livello ipofisario | Nessuna |
| fT3↓, fT4↓ | Blocco della dismissione degli ormoni tiroidei e della conversione T4 →T3 | Utile negli stati di iperfunzione | |
| Difenilidantoina | TSH ↓ | Riduzione quota ormoni legati alle proteine | Nessuna |
| fT3↓, fT4↓ | Aumento della clearance ormonale | Nessuna | |
| Dopamina, Dopamino-agonisti | TSH ↓ | Riduzione della secrezione di TSH da stimolo del recettore D1 ipofisario inibitore | Nessuna |
| Eparine | T3 Tot↓, T4 tot↓, fT3↑, fT4↑ | Transitoria e modesta riduzione quota ormoni legati alle proteine | Nessuna |
| Furosemide (solo alte dosi acute) | T3 Tot↓, T4 tot↓ | Riduzione quota ormoni legati alle proteine | Nessuna |
| fT3↑, fT4↑ | Dismissione di ormoni che divengono liberi dalle proteine | Raramente rilevante | |
| Interferone alfa | TSH↑, fT3↓, fT4↓ | Ipotiroidismo, frequente | Rilevante |
| TSH↓, fT3↑, fT4↑ | Ipertiroidismo, meno frequente | Molto rilevante | |
| Iodofori | TSH↑, fT3↓, fT4↓ | Ipotiroidismo, frequente | Rilevante |
| TSH↓, fT3↑, fT4↑ | Tireotossicosi, con rischio più elevato nei pazienti con gozzo | Rilevante | |
| Litio | TSH↑, fT3↓, fT4↓ | Riduzione della dismissione degli ormoni tiroidei - gozzo | Poco rilevante |
| Metoclopramide, anti-dopaminergici in genere | TSH↑ | Incremento del TSH mediante blocco del recettore ipofisario inibitore | Nessuna |
| Penicillina (solo alte dosi acute) | T3 Tot↓, T4 tot↓ | Riduzione quota ormoni legati alle proteine | Nessuna |
| fT3↑, fT4↑ | Dismissione di ormoni che divengono liberi dalle proteine | Raramente rilevante | |
| Soia | TSH↑, fT3↓, fT4↓ | Riduzione dell'assorbimento della tiroxina | Potenzialmente rilevante |
| Sucralfato | TSH↑, fT3↓, fT4↓ | Riduzione dell'assorbimento della tiroxina | Potenzialmente rilevante |
Bibliografia
- Stockigt JR, Lim CF. Medications that distort in vitro tests of thyroid function, with particular reference to estimates of serum free thyroxine. Best Pract Res Clin Endocrinol Metab 2009, 23: 753-67.
- Stockigt JR. Assessment of thyroid function: towards an integrate laboratory – clinical approach. Clin Biochem Rev 2003, 24: 109-22.
- Surks MI, Sievert R. Drugs and thyroid function. N Engl J Med 1995, 333: 1688-94.
Mezzi di contrasto iodati e funzione tiroidea
Luca Piantoni
UOC Malattie Endocrine, Polo Ospedaliero Integrato S. Eugenio e CTO A. Alesini, Azienda USL Roma C
(aggiornato al 25 novembre 2015)
Nonostante sia una nozione diffusamente conosciuta, non esistono studi ben condotti che documentino in modo certo l’eventuale interferenza di somministrazione di mezzo di contrasto iodato (MCI) con la funzione tiroidea.
I MCI, specie quelli per TC o coronarografia, costituiscono una causa di sovra-esposizione allo iodio. La concentrazione iodica dei MCI varia da 320 a 370 mg/mL, e una tipica dose di MCI contiene 15-37 g di iodio totale e 2.500-5000 μg di iodio libero, cioè una quantità di iodio enormemente superiore sia alla dose giornaliera consigliata (pari negli adulti a 150 μg) che a quella massima tollerabile (negli adulti pari a circa 1100 μg/die).
Nello studio caso-controllo della Harvard Medical School di Boston, su oltre 4.000 pazienti reclutati ci sono stati 178 casi di ipertiroidismo e 213 di ipotiroidismo. L’interesse di questo lavoro conferma che una possibile interferenza negativa del MdC iodato con la funzione tiroidea si esplica non solo con un aumentato rischio di ipertiroidismo ma anche con la situazione opposta di ipotiroidismo.
Fattori di rischio per tireotossicosi sono pre-esistente gozzo nodulare non tossico, malattia di Graves latente o presenza di deficit iodico di lunga durata. Gli studi che hanno valutato la relazione tra MCI e ipertiroidismo nei soggetti eutiroidei sono modesti e gravati da notevoli bias metodologici. L’eventuale tireotossicosi è generalmente transitoria e pauci-sintomatica, ma può comparire anche molte settimane dopo il MCI. Nei soggetti a rischio di sviluppare una tireotossicosi da MCI, soprattutto se cardiopatici e con fibrillazione atriale, può essere preso in considerazione un trattamento profilattico con metimazolo (20 mg/die) e/o perclorato (900 mg/die, con la difficoltà attuale alla sua reperibilità) dal giorno precedente al MCI e per i successivi 14 giorni, efficaci nel mantenere i valori di TSH e ioduria immodificati dopo coronarografia.
I fattori di rischio di ipotiroidismo iodio-indotto sono tiroidite di Hashimoto, pregressa tiroidectomia parziale, storia di tiroidite post-partum, tiroidite subacuta, terapia con alfa-interferone, tireotossicosi amiodarone-indotta tipo 2. L’ipotiroidismo è spesso transitorio e l’eventuale terapia tiroxinica va monitorata per adeguamento o sospensione.
Le linee guida sui mezzi di contrasto redatte dalla European Society of Urogenital Radiology contengono alcune importanti raccomandazioni, tutte condivisibili:
- non somministrare MCI a soggetti con ipertiroidismo conclamato (ove a giudizio del clinico l’esame non sia sostituibile, sarà compito dell’endocrinologo gestire il trattamento pre- e post-esame);
- dopo MCI monitorare strettamente i soggetti a rischio di tireotossicosi iodio-indotta;
- non è opportuna la profilassi con anti-tiroidei, eccetto che nei soggetti a rischio di tireotossicosi iodio-indotta, soprattutto se residenti in aree a carenza iodica.
Per quanto riguarda quest’ultimo aspetto, possiamo aggiungere che, alla luce delle evidenze precedentemente esposte, la profilassi con anti-tiroidei può essere molto opportuna nei cardiopatici.
Inoltre, sempre in accordo con le evidenze scientifiche disponibili, potrebbe essere condivisibile affermare che i soggetti a rischio di ipotiroidismo iodio-indotto debbono essere strettamente monitorati dopo somministrazione di MCI.
Bibliografia
- Lee SY, Rhee CM, Leung AM, et al. A Review: radiographic iodinated contrast media-induced thyroid dysfunction. J Clin Endocrinol Metab 2015, 100: 376-83.
- Rhee CM, Bhan I, Alexander EK, Brunelli SM. Association between iodinated contrast media exposure and incident hyperthyroidism and hypothyroidism. Arch Intern Med 2012, 172: 153–9.
- Rhee CM, Lynch KE, Zandi-Nejad K, et al. Iodinated contrast media exposure and incident hyperthyroidism and hypothyroidism in a community-based cohort. Endocrinol Stud 2013, 3: e8.
- Marraccini P, Bianchi M, Bottoni A, et al. Prevalence of thyroid dysfunction and effect of contrast medium on thyroid metabolism in cardiac patients undergoing coronary angiography. Acta Radiol 2013, 54: 42–7.
- Società Italiana di Radiologia Medica. Linee guida sui mezzi di contrasto.
- European Society of Urogenital Radiology. Linee guida sui mezzi di contrasto.
- Brancato D. Disfunzione tiroidea da mezzi di contrasto. AME Flash 2/2015.
Test con TSH ricombinante
Rinaldo Guglielmi & Luana Buonomo
Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale
Indicazioni
Ristadiazione di soggetti operati per carcinoma tiroideo differenziato e già sottoposti a siderazione del residuo. Il test viene eseguito per valutare la risposta della Tg e la scintigrafia whole body con 131I nei casi sospetti per recidiva.
Condizioni preliminari
- esecuzione: in regime ambulatoriale e/o day-service
- non necessità di digiuno
- se si effettua anche scintigrafia whole body con 131I, dieta iodio-priva nelle 2 settimane prima del test, come da istruzioni fornite e spiegate al paziente al momento della programmazione
- test di gravidanza preliminare in soggetti di sesso femminile in età fertile
- studio ecografico preliminare del collo
Materiale necessario
Kit di rhTSH (Thyrogen) contenente 2 fl da 0.9 mg
1 siringa da 2.5 mL
Acqua per preparazioni iniettabili
Ricostituzione della fiala di rhTSH
- diluire il contenuto della fiala di rhTSH con 1.2 mL di acqua per preparazioni iniettabili
- aspirare 1 mL di soluzione, pari a 0.9 mg di tireotropina-alfa, ovvero l’esatta dose da somministrare per via intramuscolare profonda in sede glutea
| Esecuzione | ||||||
| Giorno | Ora | Prelievo | Procedure | PA | FC | Note |
| 1 | 9.00 | TSH, Tg, TgAb | rhTSH 0.9 mg im | |||
| 2 | 9.00 | rhTSH 0.9 mg im | ||||
| 3 | 9.00 | TSH, Tg | Dose diagnostica 131I | |||
| 4 | 9.00 | |||||
| 5 | 9.00 | TSH, Tg | WBS | |||
Valutazione dei risultati
La conferma dell’avvenuta siderazione del residuo e l’esclusione di possibili recidive della neoplasia vengono fornite dall’indosabilità della Tg di base e dopo stimolo con rhTSH, dalla negatività del WBS (e dalla negatività dell’ecografia della loggia tiroidea e delle stazioni linfonodali cervicali). Falsi negativi possono essere determinati dalla presenza di anticorpi anti-Tg.
Attendibilità
Elevato valore predittivo negativo (fino a 99-100%), ma modesto valore predittivo positivo (intorno al 30%).
- Spencer CA, Fatemi S, Singer P, et al. Serum basal thyroglobulin measured by a second-generation assay correlates with the recombinant human thyrotropin-stimulated thyroglobulin response in patients treated for differentiated thyroid cancer. Thyroid 2010, 20: 587-95.
Test di stimolo del TSH con TRH
Rinaldo Guglielmi & Luana Buonomo
Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale
Indicazioni
Diagnosi differenziale tra TSHoma e s. da resistenza agli ormoni tiroidei.
Condizioni preliminari:
- esecuzione: in regime ambulatoriale o day-service
- digiuno
- monitoraggio PA e FC durante tutta la durata del test
- illustrazione dei possibili effetti collaterali: nausea e vomito, cefalea, bocca secca, urgenza minzionale, flushing al volto, sudorazione
Materiale necessario
TRH fl da 200 µg
| Esecuzione | ||||||
| Tempi (minuti) | Orario | Prelievo per TSH | PA | FC | Note | |
| 0 | ||||||
| TRH 200 µg ev in bolo | ||||||
| 15 | ||||||
| 30 | ||||||
| 60 | ||||||
Risposta del soggetto normale: picco di TSH a 20’
- paziente < 40 anni: aumento del TSH a 5-6 mU/L;
- paziente > 40 anni: aumento del TSH a 2-3.5 mU/L.
Risposta patologica:
- picco ritardato è tipico di una patologia ipofisaria;
- ipertiroidismo primitivo: mancata risposta del TSH;
- ipotiroidismo: esagerata risposta del TSH;
- TSHoma: manca il fisiologico incremento del TSH.
Attendibilità
Risposta caratterizzata da grande variabilità inter-individuale e bassa sensibilità. il mancato aumento del TSH è suggestivo, ma non diagnostico, di TSHoma.
Bibliografia
- Faglia G. The clinical impact of the thyrotropin-releasing hormone test. Thyroid 1998, 8: 903-8.
Test di soppressione con TITRE
Rinaldo Guglielmi & Luana Buonomo
Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale
Indicazioni
Diagnosi differenziale tra le forme di inappropriata secrezione del TSH.
Condizioni preliminari
- esecuzione: in regime di ricovero ordinario
- non necessità digiuno
- necessità di monitoraggio elettrocardiografico notturno, monitoraggio PA e FC durante tutta la durata del test
- illustrazione dei possibili effetti collaterali: sintomatologia compatibile con ipertiroidismo (tachicardia, agitazione, tremori, insonnia)
Materiale necessario
Apparecchiature per monitoraggio elettrocardiografico notturno, monitoraggio PA e FC
Titre cp 20 µg
| Esecuzione | |||||||||
| Giorno | Data | Ora | TiTre cp | TSH | SHBG | PA | Fc | Sintomi | Firma IP |
| 1 | 7 | ||||||||
| 8 | 1 | ||||||||
| 16 | 1 | ||||||||
| 24 | 1 | ||||||||
| 2 | 8 | 1 | |||||||
| 16 | 1 | ||||||||
| 24 | 1 | ||||||||
| 3 | 8 | 1 | |||||||
| 16 | 1 | ||||||||
| 24 | 1 | ||||||||
| 4 | 8 | 2 | |||||||
| 16 | 1 | ||||||||
| 24 | 2 | ||||||||
| 5 | 8 | 2 | |||||||
| 16 | 1 | ||||||||
| 24 | 2 | ||||||||
| 6 | 8 | 2 | |||||||
| 16 | 1 | ||||||||
| 24 | 2 | ||||||||
| 7 | 8 | 4 | |||||||
| 16 | 3 | ||||||||
| 24 | 3 | ||||||||
| 8 | 8 | 4 | |||||||
| 16 | 3 | ||||||||
| 24 | 3 | ||||||||
| 9 | 8 | 4 | |||||||
| 16 | 3 | ||||||||
| 24 | 3 | ||||||||
| 10 | 8 | ||||||||
Risposta del soggetto normale
TSH indosabile dal 4° giorno (e SHBG aumentato)
Risposta patologica
TSHoma: mancata soppressione del TSH
Resistenza agli ormoni tiroidei: soppressione incompleta di TSH e mancato aumento SHBG
Attendibilità
Scarsità di dati per la comparsa di effetti collaterali
Bibliografia
- Refetoff S, Dumitrescu AM. Syndromes of reduced sensitivity to thyroid hormone: genetic defects in hormone receptors, cell transporters and deiodination. Best Pract Res Clin Endocrinol Metab 2007, 21: 277-305.

