Trattamento laser percutaneo nella patologia nodulare benigna della tiroide
Claudio M Pacella
Ospedale Regina Apostolorum, Albano Laziale (RM)
(26 marzo 2012)
- Per la descrizione dei principi di base e delle caratteristiche tecniche dell’ablazione laser si rimanda alla “Overview sulle tecniche ablative percutanee”.
- Per le applicazioni della tecnica di ablazione laser nella patologia maligna primitiva e secondaria della tiroide si rinvia al capitolo su “Le tecniche mini-invasive per la citoriduzione delle recidive di neoplasia tiroidea”
- In questo capitolo tratteremo le indicazioni, la tecnica e i risultati della metodica di ablazione mediante energia laser nelle lesioni benigne della tiroide
Introduzione
Dopo lo studio di fattibilità ex vivo su pezzi operatori di tessuto tiroideo e la descrizione di due volontari affetti da nodulo tiroideo autonomo (> 40 mL) trattati per via percutanea con termoablazione laser (1), sono apparsi numerosi lavori, sia come case report (2-5) che come studi di coorte monocentrici non randomizzati (6-14)e randomizzati (15-18). In alcune di queste casistiche sono stati inclusi anche noduli funzionanti (3, 4, 7, 8, 14, 19, 20). Per un’analisi di questi lavori è bene conoscere i parametri riferibili all’agente fisico usato e quelli riferibili alle caratteristiche fisiche, morfologiche e biologiche dei noduli sottoposti ad ablazione termica.
Metodi
Esistono differenti tipi di sorgente laser e differenti modalità di cessione dell’energia al tessuto bersaglio:
- energia da laser a diodo ad onda continua di 980 nm con potenze variabili da 3 a 10 W e aghi di 22 G con fibre ottiche di quarzo di 400 µm (3, 11, 14),
- lunghezze d’onda di 810 nm con potenze di 3-5 W e aghi da 21 G (2, 20, 21)
- sorgenti a diodo di 820 nm con potenze di uscita di 1.5-3.5 W e aghi da 18 G e fibre da 0.4 mm (4, 6, 15, 18, 22).
La sorgente più usata è quella al Nd:YAG ad onda continua di 1064 nm, con potenze di uscita di 3 W e fibre ottiche di quarzo a punta piatta di 300 µm. L’energia viene portata nel tessuto con aghi di 21 G (7-9, 12, 13, 16, 17).
Per la cessione dell’energia alcuni autori muovono la fibra durante la manovra di ablazione nel corso di una (13, 16, 23) o più sessioni (11, 14), mentre altri mantengono fissa la sorgente e terminano la procedura quando l’area di ecogenicità generata nell’area bersaglio rimane stazionaria (4, 6, 15, 18, 22, 24). In questo caso il criterio per la fine del trattamento non è pianificato, ma varia in base all'ecogenicità che si sviluppa nel nodulo attorno alla punta della sorgente di calore, sia fissa che in movimento.

Figura 1: la fotografia mostra l'ago sottile centimetrato da 21 G, da cui fuoriesce per 5 mm la fibra ottica di quarzo di 300 µm a punta piatta
La tecnica seguita dalla maggioranza degli operatori - il 90% dei centri italiani - impiega aghi da 21 G (fig 1) con sorgente laser al Nd:YAG (8). Essa consiste nel posizionare lungo l’asse maggiore del nodulo uno o più aghi sottili (fino a 4) ed eseguire una o più illuminazioni (fino a 3). Posizionato sotto guida ecografica l’ago nella parte centrale (in caso di nodulo sferico) o nella parte distale (in caso di nodulo lenticolare), si procede all’inserimento nel lume dell’ago, liberato dal mandrino, della fibra di quarzo a punta piatta di 300 µm. Quindi la punta dell’ago viene retratta di 5 mm, in modo che la fibra nuda entri direttamente in contatto con il tessuto da ablare. La punta della fibra deve essere a una distanza di sicurezza di almeno 15 mm dalle strutture critiche del collo, quali vasi epi-aortici e trachea. Questo criterio di sicurezza deve essere accuratamente controllato mediante scansioni ecografiche biplanari.
L’uso degli aghi sottili consente di posizionare uno o più aghi in rapporto alle dimensioni, alla forma e alla sede del nodulo. Si possono usare più sorgenti, posizionandole a distanza di 1 cm fra loro, in maniera da personalizzare il trattamento in rapporto alla morfologia e alla volumetria del nodulo. Per ottimizzare i risultati (massima area di coagulazione in tempi brevi), la disposizione spaziale e il numero delle sorgenti sono scelte dall’operatore di volta in volta, in maniera da avere un'uniforme distribuzione dell’energia nel contesto del nodulo (25). Le energie variano da 1200 Joules a 1800 Joules per sorgente. In caso di noduli di piccole dimensioni (fino a 5 mL), è possibile usare una singola fibra ed eseguire una singola illuminazione o più raramente due illuminazioni retraendo cranialmente l’ago e la fibra di 1.5 cm (pull-back) dalla prima zona trattata, in modo da depositare energia, con la seconda illuminazione, nella parte ancora non trattata situata posteriormente alla precedente. Per i noduli più grandi di 5 mL e fino a 30 mL, si usano due aghi, distanziati fra loro di 1 cm, disposti l’uno accanto all’altro sullo stesso piano o meglio, per poter controllare in simultanea e in tempo reale le due sorgenti, l’uno sull’altro. Si impostano usualmente 3 W di potenza d’uscita e si cedono energie fino a 1800 Joules per sorgente. I tempi in gioco sono pari a 400-600 sec (1W x 1 sec = 1 Joule).
I volumi calcolati con la formula dell’ellissoide sono utili per definire il rapporto fra il volume iniziale dei noduli, il volume delle aree di coagulazione e il volume finale dopo ablazione. Alla fine del trattamento, non appena gran parte del gas da ebollizione legato alle alte temperature (più di 120-130°C alla punta della fibra) è scomparso, è possibile eseguire un controllo dell’area coagulativa (è improprio parlare di area di necrosi) usando mezzo di contrasto ultrasonografico di seconda generazione (SonoVue), che consente la valutazione della reale estensione della zona distrutta. La manovra ablativa ha avuto successo quando l’area “ablata” ha un volume almeno pari al 40% del volume iniziale del nodulo. La massima estensione dell’area ablata si ottiene a 72 ore dal trattamento (26), in ragione del fatto che il danno cellulare continua nei giorni successivi al trattamento, anche, ma non solo, per ischemia da fenomeni trombotici dei piccoli e medi vasi che irrorano il tessuto tiroideo. Con questa tecnica è possibile ottenere risultati utili ed importanti con una singola sessione. Nei noduli > 30 mL è possibile sia eseguire più illuminazioni nella stessa sessione (fino a 3 ma non più di 3) sia pianificare due sessioni a distanza variabile di alcune settimane o di 3-6 mesi.
Prima di posizionare gli aghi-diffusori che vanno messi secondo piani il più possibile paralleli al piano orizzontale del nodulo, deve essere eseguita sotto guida ecografica un'anestesia locale con lidocaina o naropina al 2%, scollando con un ago sottile (23-27 G) i piani sub-capsulari dai piani superficiali sottocutanei, in modo da creare un cuscinetto liquido perifericamente al lobo in cui è situato il nodulo da sottoporre a trattamento di ablazione. Il trattamento è eseguito sotto sedazione cosciente, iniettando endovena diazepam (2-10 mg) o midazolam (2-5 mg) in una singola dose o in dosi frazionate (13). Taluni preferiscono non sottoporre il paziente a sedazione, per meglio controllare, durante la procedura, le reazioni del paziente che, da sveglio, può avvertire l’operatore di qualsiasi effetto molesto durante l’erogazione dell’energia termica. Infatti, basta smettere di erogare energia perché qualsiasi disturbo cessi all’istante (16).
Indicazioni
I noduli da sottoporre a trattamento ablativo devono essere uniformemente o prevalentemente solidi, con non più del 20% di contenuto liquido distribuito nel contesto del parenchima. Percentuali più alte vanno valutate dall’operatore, che può aspirare la componente liquida prima della termo-ablazione del restante parenchima solido o sottoporre la componente liquida ad alcolizzazione mirata e solo dopo a termoablazione. I noduli “spongiformi”, rari e con aspetto a “spugna” per microcisti disseminate nel nodulo e componente liquida superiore al 60% dovrebbero essere preferenzialmente trattati con alcol.
Criteri di eligibilità sono:
- età del paziente > 18 anni;
- nodulo singolo o nodulo dominante ben identificabile ecograficamente e clinicamente nell’ambito di un gozzo;
- ecostruttura solida o prevalentemente solida con componente liquida ≤ 20% del volume totale;
- lesione non iperfunzionante (mancata captazione alla scintigrafia con 99mTc);
- TSH ed ormoni tiroidei sierici nei limiti della norma;
- 2 esami citologici negativi per sospetto di neoplasia (classe TIR 2 della Classificatione SIAPEC) (VPN del 99.8%) non antecedente a più di sei mesi;
- sintomi di compressione locale (senso di costrizione alla gola e/o difficoltà alla deglutizione);
- “danno” cosmetico;
- inoperabilità per rischio anestesiologico o cardiovascolare, non resecabilità o rifiuto dell’intervento chirurgico.
Criteri di esclusione (oltre a quelli che sono l'opposto dei sovrariportati criteri di inclusione)
- storia familiare di cancro della tiroide;
- pregresso trattamento radiante del collo.
Necessaria la sospensione di eventuale trattamento anti-coagulante per 48 ore o anti-aggregante per 72 ore. I pazienti devono essere sottoposti a visita laringoscopica diretta preliminare.
Risultati clinici
I dati disponibili riportano riduzioni volumetriche ad un anno comprese fra il 43% e l‘82% (17, 21)(tab 1).

Sono disponibili dati a tre (13) e a 5 anni (18), con valori rispettivamente del 48% e del 51%, a testimonianza della persistenza della riduzione volumetrica nel tempo.
E’ stata segnalata una percentuale di ricrescita del 9% (11/122 casi) a tre anni (13), ma questo dato non è stato confermato da una casistica a 5 anni (18).
E’ stata segnalata una sola complicanza maggiore, costituita dalla perforazione della trachea, suturata 4 settimane dopo l’evento (27), e dovuta all’errato posizionamento della sorgente in contiguità con il tubo tracheale durante la fase iniziale di apprendimento dell’operatore. La paralisi transitoria delle corde vocali è riportata solo da alcuni centri, con percentuali variabili dallo 0.8% (8) all’1.6% (13).
Durante il trattamento il dolore locale o irradiato è relativamente frequente nei pazienti senza sedazione cosciente e/o nel periodo di apprendimento (13). La persistenza di dolore lieve o moderato per qualche giorno dopo la procedura è poco frequente ed è comunque ben controllato con analgesici.
Aspetti in corso di definizione
Recenti comunicazioni da studi prospettici monocentrici (28) e da RCT multicentrici (in fase di pubblicazione) confortano la scelta della tecnica degli aghi multipli sottili. Devono essere ancora stabilite sia le modalità di esecuzione che il ruolo di questa procedura nell’iter terapeutico dei noduli benigni della tiroide.
Alcuni problemi aperti:
- alla luce della stretta correlazione fra la lunghezza d’onda usata e le proprietà ottiche del tessuto irradiato resta incerto quale sorgente sia più efficace. Alcuni studi sono a favore delle sorgenti a diodo con lunghezza d’onda di 980 nm (29), altri a favore delle sorgenti al Nd:YAG con lunghezza d’onda di 1064 nm (30). La sorgente a diodo presenta vantaggi di penetrazione nel tessuto con tempi di esposizione ridotti rispetto alla sorgente al Nd:YAG. Allo stato attuale, però, non esistono dati comparativi tra le due sorgenti;
- circa le modalità di cessione dell’energia, muovere la sorgente durante la procedura (in pratica retrarre l’ago e la fibra in senso caudo-craniale lungo l’asse lungo del nodulo) rappresenta un sistema di cessione della luce laser molto elaborato (13, 14, 23). Questa metodologia è operatore-dipendente e può esporre il tessuto dell’area bersaglio a temperature non idonee ad ottenere la morte delle cellule. Infatti il valore della temperatura in cui si ottiene la morte cellulare è legato al tipo di tessuto e a fattori multipli (31, 32). Nell’area target i valori della temperatura variano in rapporto al tempo, alle modalità di “cottura” e alla sede. Alla periferia della zona di ablazione, infatti, il valore della temperatura varia da 30° a 77°C in caso di tessuto normale e tra 41° e 64°C in caso di tumore (31). Per indurre un danno irreversibile alle cellule, è necessario mantenere per almeno 4-6 minuti una temperatura di 50-54°C e muovendo la punta della fibra non si rimane un tempo sufficiente ad ottenere livelli di temperatura utili a distruggere le cellule. Questo metodo unisce alla complessità di esecuzione anche una possibile incompleta distruzione delle cellule bersaglio, che pertanto soffrono solo di un danno funzionale e possono ricrescere nel tempo (1)(fig 2).

Figura 2: microfotografia di una sezione congelata colorata per l'enzima succinico-deidrogenasi, che documenta riduzione dell'attività dell'enzima nelle cellule situate alla periferia (frecce) della zona di coagulazione (in alto a sinistra). Le cellule hanno subito solo un danno funzionale. Le temperature nella zona critica (margine esterno della zona di coagulazione) non hanno indotto un danno cellulare irreversibile (morte)(Pacella CM, et al. Radiology 2000, 217: 673-7)
- usare la stazionarietà dell’area ecogena attorno alla punta della fibra come criterio per giudicare la fine del trattamento (4, 6, 15, 18, 24) è empirico. L’area ecogena che si sviluppa durante il trattamento può assumere forma e volume non prevedibili. Talora si allarga con gradualità intorno alla punta della fibra fino ad assumere forma e volume irregolari a margini mal definiti e rimanere stabile entro un periodo di tempo variabile, talora si può diffondere e distribuire in maniera non uniforme sull’intero volume del nodulo sottoposto a trattamento, in altri casi ancora l’area ecogena appare filiforme e circonda l’asse lungo della fibra radiante o l’asse maggiore dell’ago. Quindi la forma e le dimensioni dell’area ecogena sono solo una guida grossolana dell’entità del danno termico indotto (1).
Alla luce di quanto sopra, è necessario pianificare in anticipo il trattamento di ablazione, stabilendo tempi e modi di cessione dell’energia. Nel caso di lesione tumorale, l’unico criterio valido è la completa distruzione del tumore con un ampio margine di sicurezza soprattutto nel caso di metastasi, ma noi dobbiamo ottenere solo un debulking del nodulo, il più grande possibile, per quel determinato nodulo di quel determinato volume per ottenere una riduzione di almeno il 50% del volume basale. Le variabili in gioco sono molte: tipo di energia e di sorgente, lunghezza d’onda, potenza di uscita, tempo di irradiazione, modalità di cessione, tipo di tessuto e sue proprietà ottiche e termiche legate alla morfologia dei noduli, alla loro vascolarizzazione, alla quantità di colloide e alla componente fibrosa. Pertanto, l’entità della riduzione volumetrica risulta non prevedibile e questo spiega anche la variabilità dei valori di energia per millilitro di tessuto riportati dai vari autori (tab. 1).
L’entità della riduzione volumetrica dipende da fenomeni reattivi al danno termico indotto, variabili di tessuto a tessuto e da paziente a paziente (corredo genetico delle cellule tiroidee ed eventuale mutazione somatica alla base del loro indice di proliferazione). Questo spiega, accanto agli altri fattori sopra esposti, la mancata correlazione statistica tra riduzione volumetrica e quantità di energia depositata documentata da alcuni autori (6, 15, 22). Esistono dati clinici, confermati anche da dati sperimentali (33, 34), a supporto di una correlazione significativa tra volume di coagulazione indotta ed energia ceduta (8, 10, 16, 17) e ancora tra energia ceduta e volume iniziale del nodulo, mentre esiste una correlazione non significativa tra energia ceduta e riduzione volumetrica (dati personali non pubblicati).
Alla luce di quanto finora detto, dobbiamo tenere invariati i parametri legati all’agente fisico in uso per conoscere il comportamento delle variabili legate alla morfologia, alla struttura e alla biologia dei noduli. La tecnica degli aghi multipli sottili risponde, almeno in parte, a queste esigenze, mantenendo fissi il tipo di sorgente, le potenze, i tempi di esposizione e il rapporto tra numero di sorgenti e volumi dei noduli.
Confronto fra tecniche di ipertermia
La tecnica a radiofrequenza è stata definita “sligtly superior to laser ablation in terms of efficacy and milder adverse effects” (35) da parte dei cultori della tecnica a radiofrequenza “ moving shot”. In realtà, le popolazioni messe a confronto non sono confrontabili, sia per i volumi iniziali (17.9 ±12.6 mL nel caso del laser vs 8.7±4.8 mL nel caso della radiofrequenza con ago raffreddato), sia per il contenuto “cistico” dei noduli sottoposti alle manovre di ablazione. Infatti, i pazienti sottoposti alla tecnica laser hanno noduli solidi o prevalentemente solidi (con componente cistica ≤ 20% della componente solida) (3, 6-9, 11, 13-18, 21, 22, 36), mentre i pazienti sottoposti a radiofrequenza con moving shot hanno noduli con componente solida variabile da 0 a 100% (37-39).
Non sono disponibili dati sulla percentuale di pazienti con noduli cistici rispetto a quelli con noduli solidi nella popolazione sottoposta a RF. Una comparazione può essere tentata con la radiofrequenza con ago da 14 G (40, 41), che arruola noduli mediamente più grandi per il grande calibro dell’ago usato e l’espansione degli uncini. In questo caso i volumi medi iniziali tra le due tecniche sono comparabili (17.9±12.6 mL per il laser vs 19.8±4.8 mL per la RF con ago uncinato), ma nel caso della RF viene riportata una componente solida > 30%, il che significa che esiste una significativa componente cistica che gioca un ruolo non trascurabile nella percentuale di riduzione volumetrica. A conferma di quanto discusso sono i dati non ancora pubblicati dell’analisi uni- e multivariata della popolazione sottoposta allo studio RCT multicentrico italiano. Gli unici fattori predittivi condizionanti l’entità della riduzione volumetrica sono il volume iniziale dei noduli e la presenza della componente liquida. Stiamo parlando di una popolazione con noduli solidi o prevalentemente solidi e quindi con componente liquida ≤ 20% sottoposti ad ablazione laser. Questo dato conferma che più i noduli sono piccoli, più si riducono e in presenza di una modesta componente liquida, come appunto quella del 20%, si riducono ancor più facilmente.
Conclusioni
Il trattamento ablativo con ipertermia trova la sua indicazione nei casi di nodulo singolo o dominante ben identificabile ecograficamente e clinicamente e a carattere non iperfunzionante (scintigrafia con 99mTc e TSH e ormoni tiroidei sierici nei limiti della norma).
Sono necessari due esami citologici negativi per malignità (classe TIR 2 della classificatione SIAPEC) non antecedenti più di sei mesi.
Il trattamento è reso appropriato dalla presenza di sintomi di compressione locale (senso di costrizione alla gola e/o difficoltà alla deglutizione), “danno” cosmetico o crescita progressiva senza caratteri di sospetto clinico.
E’ opportuno eseguire la sola terapia ipertermica nel caso di noduli solidi o prevalentemente solidi. Nei casi con componente cistica compresa tra il 20 e il 50% è opportuno effettuare una PEI prima della termoablazione (42). Opportuno eseguire la sola PEI nei casi con vasta componente liquida (> 50%).
Bibliografia
- Pacella CM, Bizzarri G, Guglielmi R, et al. Thyroid tissue: US-guided percutaneous interstitial laser ablation-a feasibility study. Radiology 2000, 217: 673-7.
- Cakir B, Topaloglu O, Gul K, et al. Ultrasound-guided percutaneous laser ablation treatment in inoperable aggressive course anaplastic thyroid carcinoma: the introduction of a novel alternative palliative therapy--second experience in the literature. J Endocrinol Invest 2007, 30: 624-5.
- Rotondi M, Amabile G, Leporati P, et al. Repeated laser thermal ablation of a large functioning thyroid nodule restores euthyroidism and ameliorates constrictive symptoms. J Clin Endocrinol Metab 2009, 94: 382-3.
- Dossing H, Bennedbaek FN, Hegedus L. Ultrasound-guided interstitial laser photocoagulation of an autonomous thyroid nodule: the introduction of a novel alternative. Thyroid 2003, 13: 885-8.
- Cakir B, Gul K, Ersoy R, et al. Subcapsular hematoma complication during percutaneous laser ablation to a hypoactive benign solitary thyroid nodule. Thyroid 2008, 18: 917-8.
- Dossing H, Bennedbaek FN, Karstrup S,et al. Benign solitary solid cold thyroid nodules: US-guided interstitial laser photocoagulation--initial experience. Radiology 2002, 225: 53-7.
- Spiezia S, Vitale G, Di Somma C, et al. Ultrasound-guided laser thermal ablation in the treatment of autonomous hyperfunctioning thyroid nodules and compressive nontoxic nodular goiter. Thyroid 2003, 13: 941-7.
- Pacella CM, Bizzarri G, Spiezia S, et al. Thyroid tissue: US-guided percutaneous laser thermal ablation. Radiology 2004, 232: 272-80.
- Papini E, Guglielmi R, Bizzarri G, et al. Ultrasound-guided laser thermal ablation for treatment of benign thyroid nodules. Endocr Pract 2004, 10: 276-83.
- Cakir B, Topaloglu O, Gul K, et al. Effects of percutaneous laser ablation treatment in benign solitary thyroid nodules on nodule volume, thyroglobulin and antithyroglobulin levels, and cytopathology of nodule in 1 yr follow-up. J Endocrinol Invest 2006, 29: 876-84.
- Amabile G, Rotondi M, De Chiara G, et al. Low-energy interstitial laser photocoagulation for treatment of nonfunctioning thyroid nodules: therapeutic outcome in relation to pretreatment and treatment parameters. Thyroid 2006, 16: 749-55.
- Valcavi R, Bertani A, Pesenti M, et al. Laser and Radiofrequency ablation procedures. In: Baskin HJ, Duick DS, Levine RA eds. Thyroid ultrasound and ultrasound guided FNA biopsy. Second Edition. New York: Springer 2008: 191-218.
- Valcavi R, Riganti F, Bertani A, et al. Percutaneous laser ablation of cold benign thyroid nodules: a 3-year follow-up study in 122 patients. Thyroid 2010, 20: 1253-61
- Amabile G, Rotondi M, Pirali B, et al. Interstitial laser photocoagulation for benign thyroid nodules: time to treat large nodules. Lasers Surg Med 2011, 43: 797-803.
- Dossing H, Bennedbaek FN, Hegedus L. Effect of ultrasound-guided interstitial laser photocoagulation on benign solitary solid cold thyroid nodules - a randomised study. Eur J Endocrinol 2005, 152: 341-5.
- Gambelunghe G, Fatone C, Ranchelli A, et al. A randomized controlled trial to evaluate the efficacy of ultrasound-guided laser photocoagulation for treatment of benign thyroid nodules. J Endocrinol Invest 2006, 29: RC23-6.
- Papini E, Guglielmi R, Bizzarri G, et al. Treatment of benign cold thyroid nodules: a randomized clinical trial of percutaneous laser ablation versus levothyroxine therapy or follow-up. Thyroid 2007, 17: 229-35.
- Dossing H, Bennedbaek FN, Hegedus L. Long-term outcome following interstitial laser photocoagulation of benign cold thyroid nodules. Eur J Endocrinol 2011, 165: 123-8.
- Barbaro D, Orsini P, Lapi P, et al. Percutaneous laser ablation in the treatment of toxic and pretoxic nodular goiter. Endocr Pract 2007, 13: 30-6.
- Cakir B, Gul K, Ugras S, et al. Percutaneous laser ablation of an autonomous thyroid nodule: effects on nodule size and histopathology of the nodule 2 years after the procedure. Thyroid 2008, 18: 803-5.
- Cakir B, Topaloglu O, Gul K,et al. Effects of percutaneous laser ablation treatment in benign solitary thyroid nodules on nodule volume, thyroglobulin and anti-thyroglobulin levels, and cytopathology of nodule in 1 yr follow-up. J Endocrinol Invest 2006, 29: 876-84.
- Dossing H, Bennedbaek FN, Hegedus L. Effect of ultrasound-guided interstitial laser photocoagulation on benign solitary solid cold thyroid nodules: one versus three treatments. Thyroid 2006, 16: 763-8.
- Valcavi R, Frasoldati A. Ultrasound-guided percutaneous ethanol injection therapy in thyroid cystic nodules. Endocr Pract 2004, 10: 269-75.
- Dossing H, Bennedbaek FN, Bonnema SJ, et al. Randomized prospective study comparing a single radioiodine dose and a single laser therapy session in autonomously functioning thyroid nodules. Eur J Endocrinol 2007, 157: 95-100.
- Pacella CM, Bizzarri G, Francica G, et al. Percutaneous laser ablation in the treatment of hepatocellular carcinoma with small tumors: analysis of factors affecting the achievement of tumor necrosis. J Vasc Interv Radiol 2005, 16: 1447-57.
- Nikfarjam M, Muralidharan V, Malcontenti-Wilson C, et al. Progressive microvascular injury in liver and colorectal liver metastases following laser induced focal hyperthermia therapy. Lasers Surg Med 2005, 37: 64-73.
- Di Rienzo G, Surrente C, Lopez C, et al. Tracheal laceration after laser ablation of nodular goitre. Interac Cardiovasc Thorac Surg 2012, 14: 115-6.
- Achille G, Grammatica L. Percutaneous Ultrasound-Guided Laser Ablation in Cold Benign Thyroid Nodules: A prospective Study on 68 Patients Treated at "Istituto Giovanni Paolo II" of Bari. 2012 work in progress.
- Ahrar K, Gowda A, Javadi S, et al. Preclinical assessment of a 980-nm diode laser ablation system in a large animal tumor model. J Vasc Interv Radiol 2010, 21: 555-61.
- Jayasree RS, Gupta AK, Bodhey NK, et al. Effect of 980-nm diode laser and 1064-nm Nd:YAG laser on the intervertebral disc--in vitro and in vivo studies. Photomed Laser Surg 2009, 27: 547-52.
- Mertyna P, Hines-Peralta A, Liu ZJ, et al. Radiofrequency ablation: variability in heat sensitivity in tumors and tissues. J Vasc Interv Radiol 2007, 18: 647-54.
- Nikfarjam M, Muralidharan V, Christophi C. Mechanisms of focal heat destruction of liver tumors. J Surg Res 2005, 127: 208-23.
- Ritz JP, Lehmann KS, Zurbuchen U, et al. Ex vivo and in vivo evaluation of laser-induced thermotherapy for nodular thyroid disease. Lasers Surg Med 2009, 41: 479-86.
- Ritz JP, Lehmann KS, Schumann T, et al. Effectiveness of various thermal ablation techniques for the treatment of nodular thyroid disease--comparison of laser-induced thermotherapy and bipolar radiofrequency ablation. Lasers Med Sci 2011, 26: 545-52.
- Huh JY, Baek JH, Choi H, et al. Symptomatic Benign Thyroid Nodules: Efficacy of Additional Radiofrequency Ablation Treatment Session--Prospective Randomized Study. Radiology 2012, 263: 909-16.
- Cakir B, Ugras NS, Gul K, et al. Initial report of the results of percutaneous laser ablation of benign cold thyroid nodules: evaluation of histopathological changes after 2 years. Endocr Pathol 2009, 20: 170-6.
- Kim YS, Rhim H, Tae K, et al. Radiofrequency ablation of benign cold thyroid nodules: initial clinical experience. Thyroid 2006, 16: 361-7.
- Jeong WK, Baek JH, Rhim H, et al. Radiofrequency ablation of benign thyroid nodules: safety and imaging follow-up in 236 patients. Eur Radiol 2008, 18: 1244-50.
- Baek JH, Kim YS, Lee D, et al. Benign predominantly solid thyroid nodules: prospective study of efficacy of sonographically guided radiofrequency ablation versus control condition. AJR Am J Roentgenol 2010, 194: 1137-42.
- Deandrea M, Limone P, Basso E, et al. US-guided percutaneous radiofrequency thermal ablation for the treatment of solid benign hyperfunctioning or compressive thyroid nodules. Ultrasound Med Biol 2008, 34: 784-91.
- Spiezia S, Garberoglio R, Di Somma C, et al. Efficacy and safety of radiofrequency thermal ablation in the treatment of thyroid nodules with pressure symptoms in elderly patients. J Am Geriatr Soc 2007, 55: 1478-9.
- Dossing H, Bennedbaek FN, Hegedus L. Beneficial effect of combined aspiration and interstitial laser therapy in patients with benign cystic thyroid nodules: a pilot study. Br J Radiol 2006, 79: 943-7.
Termo-ablazione con micro-onde nella patologia tiroidea
Daniele Barbaro & Raffaella Forleo
UO Endocrinologia, ASL Nordovest Toscana
(aggiornato al febbraio 2024)
Introduzione e principi fisici
Negli ultimi 30 anni, dopo i primi lavori pionieristici con la termo-ablazione laser (LA), le tecniche mini-invasive non chirurgiche eco-guidate in ambito tiroideo hanno acquisito un’enorme rilevanza (1). In particolare le metodiche di termo-ablazione rappresentano quelle più ampiamente impiegate in campo tiroideo, anche se recentemente vi sono studi con metodiche diverse quali la crio-ablazione.
Il principio della termo-ablazione è che il calore applicato per un certo periodo di tempo può determinare un danno tissutale irreversibile. Le metodiche impiegate da più tempo e per le quali esiste una più ampia letteratura scientifica sono la LA e la radiofrequenza (RF). Oltre a queste si ricorda l’High Frequency Ultrasonography (HIFU) e l’ablazione con micro-onde (MWA), della quale andremo a trattare nello specifico. Vale la pena di ricordare che l’HIFU, per la quale vi era stato un iniziale interesse in quanto totalmente non intrusiva (nessun uso di aghi o antenne inserite per via percutanea), ha mostrato un’efficacia apparentemente inferiore alle altre metodiche, pur in presenza di notevole componente dolorosa durante l’esecuzione.
Il principio della MWA (1) si basa sul particolare effetto delle radiazioni elettro-magnetiche (RE) con la materia organica e dipende dalla lunghezza d’onda e relativa frequenza. Come noto, lo spettro elettro-magnetico è l'insieme di tutte le possibili frequenze della RE: comprende la parte di spettro visibile, che occupa la sezione centrale per frequenza e lunghezza d’onda e che costituisce la luce percepita dai nostri occhi. In rapporto allo spettro visibile, avremo dunque RE a frequenza minore e maggiore. Le onde di frequenza minore (e dunque di lunghezza d’onda più ampia), vanno dall’infrarosso alle onde radio. Esse hanno minore energia, risultando scarsamente dannose per gli organismi viventi, con effetto termico in caso di vicinanza alla fonte di emissione. Viceversa, come noto, le radiazioni a frequenza elevata, dall'ultravioletto ai raggi gamma, hanno un effetto ionizzante e producono danni biologici.
Nell’ambito delle RE, le micro-onde sono RE nello spettro con frequenza più bassa rispetto al visibile, in particolare nella parte a più alta frequenza fra le radiofrequenze (fig 1).
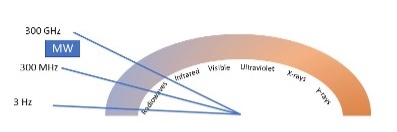
Figura 1
In sostanza, dunque, le micro-onde fanno parte delle radiofrequenze e hanno una frequenza compresa tra 300 MHz e 300 GHz (corrispondenti a lunghezze d’onda tra 1 m e 1 mm). L’effetto biologico è comunque diverso fra RF e MWA. Nei cosiddetti trattamenti con RF (lunghezza d’onda > 1 mm e frequenza < 300 MHz), il campo elettro-magnetico oscillante riesce a spostare gli ioni, dando origine all'assorbimento di energia sotto forma di calore, fenomeno relativamente lento. A frequenze più elevate, cioè con MWA, il tipo di interazione con la materia cambia e non si ha più spostamento di ioni a causa della loro inerzia. In sostanza le micro-onde interagiscono con i dipoli (e l’acqua è un dipolo naturale), che si mettono a oscillare in sintonia con il campo elettro-magnetico. È il movimento dei dipoli che genera sempre per "attrito" l'assorbimento di energia da parte del tessuto e quindi la formazione di calore, fenomeno più rapido rispetto al movimento di ioni che avviene nelle RF (fig 2).
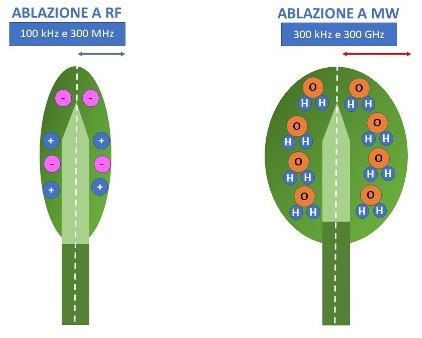
Figura 2
Per le loro caratteristiche fisiche, dunque, le micro-onde sembrerebbero l’energia elettro-magnetica ideale per l’applicazione clinica nelle termo-ablazioni, in particolare, per la possibilità di raggiungere temperature elevate in tempi molto rapidi. Come vedremo dopo, anche altri parametri rappresentano aspetti clinico/pratici di fondamentale importanza, tra cui il monitoraggio dell’energia erogata e il momento in cui spostare l’antenna nella tecnica “moving shot”.
Il trattamento in pratica
La MWA ha notevoli analogie con la RF più propriamente detta. Vi è un generatore con modalità specifica per la tiroide e un display di controllo. Gli aghi, più specificatamente chiamati antenne, hanno diametri variabili a secondo delle ditte produttrici (14-17 G per la tiroide). Le antenne vengono inserite all’interno del nodulo sotto guida ecografica (quelle da 16-17 G non necessitano di pre-incisione). Per noduli piuttosto piccoli l’antenna può essere mantenuta ferma all’interno del nodulo, mentre per noduli di maggiori dimensioni si esegue l’approccio trans-istmico e il “moving shot”, spostando l’antenna allorché compare la tipica iperecogenicità indicativa di danno tissutale irreversibile (1,3,4).
La MWA differisce dalla RF, in quanto il monitoraggio non dipende dall’impedenza evidenziata dalla macchina, ma dall’aspetto ecografico della singola area trattata: dunque è lo stesso monitoraggio ecografico che determina il movimento dell’ago. Nella MWA il calore per induzione non viene penalizzato dai grossi vasi e il volume trattato è più omogeneo. Una peculiarità della MWA è inoltre che l’ipertermia non si sviluppa in modo totalmente anteriore rispetto all’estremità dell’antenna, ma tende a estendersi un po' anche posteriormente, come riportato in figura 2. Certamente la MWA appare di grande interesse, seppur può essere di gestione un po' più difficile: infatti, poiché il calore non risente dei dissipatori fisiologici, quali i vasi sanguigni, e dell’eventuale carbonizzazione, è potenzialmente più rischiosa a livello tiroideo, dove vi sono strutture contigue particolarmente delicate. La durata del trattamento dipende dai Watt erogati e dal tempo, i quali determinano il volume della conseguente ipertermia generata dall’antenna (tabella) e ovviamente dal volume globale del nodulo, comunque nell’ordine della decina di minuti.
| Tempo | Potenza | ||
| 20 W | 25 W | 30 W | |
| 15 sec | 5 x 8 mm | 5 x 8.5 mm | 5 x 9 mm |
| 20 sec | 5 x 9 mm | 5.5 x 9 mm | 5.5 x 9.5 mm |
| 25 sec | 5.5 x 9 mm | 6 x 9.5 mm | 6 x 10 mm |
| 30 sec | 6 x 9.5 mm | 6.5 x 10 mm | 6.5 x 10.5 mm |
Indicazioni alla MWA, efficacia e complicanze
Le indicazioni in ambito tiroideo sono sostanzialmente le stesse delle altre tecniche di termo-ablazione, in particolare noduli tiroidei benigni (BTN) sintomatici, a cui si è aggiunta la recente possibile indicazione per i carcinomi tiroidei di piccole dimensioni.
La letteratura è certamente meno ricca rispetto a quella sulle tecniche più usate, quali LA e RF: al momento della scrittura dell’articolo digitando su PubMed “microwaves, thyroid ablation” si trovano 234 lavori contro i 524 lavori su LA e i 736 per RF (per contro, per HIFU i lavori sono meno di 100).
Una sintesi della letteratura, con particolare riferimento ai lavori più significativi, mostra che la MWA può rappresentare un’opzione in campo tiroideo. Una prima metanalisi nel 2018 (3), comprendente 9 studi per un totale di 1461 pazienti, aveva mostrato buona efficacia e una percentuale di complicanze maggiori di circa il 5% (danno ricorrenziale, rottura del nodulo, altri danni nervosi). In questa metanalisi era stata inoltre valutata la differenza fra l’utilizzo di MWA con antenna raffreddata e non: i dati circa il comfort del paziente e le complicanze minori (in particolare il dolore) erano nettamente a favore dell’antenna raffreddata, mentre non vi era differenza per le complicanze maggiori. Nello studio con più ampia casistica (115 pazienti) di comparazione con altre metodiche, sono stati valutati in tutto 144 noduli (con componente solida > 75%) utilizzando la tecnica “moving shot”. I risultati erano sovrapponibili a quelli della RF: la variazione del volume a 1, 3, 6, 9 e 12 mesi è stata del 30.5%, 56.0%, 69.3%, 76.6% e 84.7% (4).
Globalmente considerati, i lavori sembrano dunque indicare una sostanziale sovrapposizione dei risultati fra RF e MWA, anche se una più recente recente metanalisi che ha esaminato 5 studi, per un totale di 899 pazienti con 956 BTN trattati con RF e 869 pazienti con 938 BTN trattati con MWA, sembra leggermente a favore della RF (5). Non vi era differenza a 3 e 6 mesi, mentre la riduzione volumetrica a 12 mesi era maggiore con RF (86.2% vs 80.0%, p = 0.036). Nessuna differenza viceversa è stata notata in termini di complicazioni maggiori o minori. La RF dunque, secondo questa metanalisi, potrebbe avere un miglior risultato a lungo termine. Peraltro, come accennato, parametri quali dimensioni dei noduli e ipervascolarizzazione possono costituire un bias, influendo nella preferenza verso una delle metodiche e dunque anche nei risultati.
Più recentemente la varie metodiche di termo-ablazione son state proposte e utilizzate anche in campo oncologico tiroideo. Vi è evidenza dell’ottima efficacia della MWA su carcinomi papillari di piccole dimensioni. In uno fra i primi studi su 15 pazienti (21 noduli con diagnosi citologica di carcinoma papillare) la MWA ha ottenuto una riduzione del volume a 36 mesi del 98.8 ± 5.6%. Durante il periodo di follow-up (36-48 mesi), 20 dei 21 noduli hanno mostrato un completo riassorbimento e non è stato trovato alcun nodulo con tendenza alla ricrescita. Questo studio aveva utilizzato un’antenna da 16 G con finestra di diffusione da 3.5 mm e basse potenze (20 Watt) (6).
Sempre in campo oncologico vi sono studi di confronto MWA vs RF. In un recentissimo studio retrospettivo (gennaio 2021-dicembre 2022) su 512 pazienti, 346 trattati con RF e 166 con MWA, i risultati erano uguali in termini di scomparsa delle lesioni e mancata recidiva (7). Inoltre, sono recentemente comparsi lavori circa l’impiego con successo di MWA anche in carcinomi papillari multi-focali e nelle metastasi latero-cervicali (7-10). L’impiego in campo oncologico per tutte le termo-ablazioni rappresenta a nostro giudizio una possibilità da tener presente solo in casi particolari.
Conclusioni
La MWA utilizza una frequenza più alta nell’ambito delle radiofrequenze che viene generata da un’antenna. L’interazione avviene con l’acqua (dipoli naturali) ed è rapida.
La metodica è eco-guidata e richiede esperienza. A parità di potenza, il diametro della necrosi è maggiore di quello ottenuto con RF.
Indicazioni e attenzioni speciali sono simili a quelle delle altre termo-ablazioni, in particolare della RF, con cui c’è la maggiore affinità. Andrà definito se alcune caratteristiche dei noduli debbano orientare preferibilmente verso MWA piuttosto che RF.
MWA merita forse una speciale attenzione, dovuta al fatto che il riscaldamento si estende un po' posteriormente e non è bloccato da carbonizzazione né dissipato da componenti liquide.
Le possibili complicanze maggiori non sembrano più frequenti rispetto alla RF.
Bibliografia
- Hu QL, Kuo JH. Choice in ablative therapies for thyroid nodules. J Endocr Soc 2023, 7: bvad078.
- Goldberg SN. Radiofrequency tumor ablation: principles and techniques. Eur J Ultrasound 2001, 13: 129-47.
- Zheng BW, Wang JF, Ju JX, et al. Efficacy and safety of cooled and uncooled microwave ablation for the treatment of benign thyroid nodules: a systematic review and meta-analysis. Endocrine 2018, 62: 307-17.
- Yue W, Wang S, Wang B, et al. Ultrasound guided percutaneous microwave ablation of benign thyroid nodules: safety and imaging follow-up in 222 patients. Eur J Radiol 2013, 82: e11-6.
- Wu W, Gong X, Zhou Q, et al. Ultrasound-guided percutaneous microwave ablation for solid benign thyroid nodules: comparison of MWA versus control group. Int J Endocrinol 2017, 2017: 9724090.
- Guo DM, Chen Z, YX, Hong-Hui S. Comparison of radiofrequency ablation and microwave ablation for benign thyroid nodules: a systematic review and meta-analysis. Clin Endocrinol (Oxf) 2021, 95: 187-96.
- Teng D, Sui G, Liu C, et al. Long-term efficacy of ultrasound-guided low power microwave ablation for the treatment of primary papillary thyroid microcarcinoma: a 3-year follow-up study. J Cancer Res Clin Oncol 2018, 144: 771-9.
- Li N, Dong Y, Ding Y, et al. Comparison of the efficacy and safety of ultrasound-guided radiofrequency ablation and microwave ablation for the treatment of unifocal papillary thyroid microcarcinoma: a retrospective study. Int J Hyperthermia 2024, 41: 2287964.
- Zhou HD, Yu XY, Wei Y, et al A preliminary study on the microwave ablation of multifocal papillary thyroid microcarcinoma. Acad Radiol 2024, DOI: 10.1016/j.acra.2024.01.007.
- Zhang S, Liu Y, Zhou B, Xu H. Efficacy and safety of percutaneous ultrasound-guided thermal ablation in the treatment of cervical metastatic lymph nodes from papillary thyroid carcinoma. Clin Hemorheol Microcirc 2024, DOI: 10.3233/CH-231998.
Classificazione 2022 dei tumori tiroidei secondo l’Organizzazione Mondiale della Sanità
Francesca Perticone
Endocrinologia e Malattie del Metabolismo, Ospedale San Raffaele, Milano
(aggiornato ad agosto 2024)
Nel 2022 è stata pubblicata dall’OMS la quinta classificazione dei tumori endocrini e neuroendocrini, all’interno della quale la sezione sui tumori tiroidei rappresenta il capitolo più ampio (1). In questa nuova edizione sono stati apportati cambiamenti alla nomenclatura utilizzata per definire diverse proliferazioni tiroidee, con lo scopo di rispecchiare maggiormente la biologia, l’istologia, la patogenesi e il profilo molecolare dei tumori della tiroide. Tali caratteristiche sono, infatti, associate a specifici comportamenti clinici, in termini di diffusione loco-regionale e a distanza, risposta alla terapia radio-metabolica, rischio di recidiva e prognosi. Particolare attenzione è stata data inoltre ad alcuni aspetti istologici e molecolari, che consentono di definire il grado e l’attività proliferativa del tumore, ai fini di agevolare la stratificazione clinica del rischio e la valutazione prognostica.
LESIONI BENIGNE (tabella 1)
La quarta edizione della classificazione OMS delle neoplasie endocrine prevedeva un’unica lesione tiroidea benigna, l’adenoma follicolare. Nella corrente edizione tale lesione è stata meglio caratterizzata e riclassificata in entità distinte, sulla base di specifiche caratteristiche istologiche e del profilo molecolare; è stata inoltre introdotta l’espressione “malattia follicolare nodulare della tiroide” per indicare quei quadri caratterizzati da plurimi noduli, tradizionalmente definiti come “gozzo ” (1).
| Tabella 1 Lesioni tiroidee benigne |
||
| Istologia | Profilo molecolare | |
| Malattia follicolare nodulare della tiroide | Lesioni iperplastiche e adenomatose multiple | Frequentemente ma non sempre clonali |
| Adenoma follicolare | Neoplasia follicolare incapsulata non invasiva | Frequenti mutazioni di RAS |
| Adenoma follicolare con architettura papillare | Adenoma follicolare con crescita papillare centripeta intra-follicolare (non atipie nucleari del PTC) | Associato a mutazioni di TSH-R, GNAS e/o EZH1 (adenomi iperfunzionanti) e DICER1 (non iperfunzionanti) |
| Adenoma oncocitico | Adenoma follicolare con > 75% di oncociti | Alterazioni genoma mitocondriale/gene GRIM19, variazioni numero di copie |
Il termine “gozzo multi-nodulare” è ritenuto inaccurato, dal momento che l’architettura dei noduli tiroidei in questi quadri è altamente variabile e include sia formazioni adenomatose che iperplastiche. Si suggerisce pertanto di sostituirlo con l’espressione “malattia follicolare nodulare della tiroide”, a indicare la natura follicolare di proliferazioni che possono presentare o meno crescita clonale, sviluppandosi quindi come adenomi o lesioni iperplastiche. La clonalità di alcune di tali lesioni spiega come possano talvolta presentarsi foci di evoluzione maligna (2).
Per “adenoma follicolare” si intende invece una neoplasia a crescita follicolare, incapsulata e non invasiva.
Secondo la nuova classificazione OMS, un’entità distinta è rappresentata dall’”adenoma follicolare con architettura papillare”, una neoplasia benigna a crescita follicolare, incapsulata e non invasiva, caratterizzata da una crescita papillare centripeta intra-follicolare, più organizzata rispetto al carcinoma papillare della tiroide (PTC) e con cellule prive delle alterazioni tipiche del PTC. Il profilo molecolare di questa neoplasia è differente rispetto all’adenoma follicolare. Mentre nell’adenoma follicolare sono infatti frequenti le mutazioni del gene RAS, gli adenomi follicolari con architettura papillare presentano spesso mutazioni attivanti il TSH-R (fino al 70% dei casi), mutazioni del gene GNAS e/o di EZH1 (3). Tali mutazioni si traducono in attivazione dell’adenil-ciclasi con incremento dell’AMP ciclico intra-cellulare, con conseguente stimolazione della funzione e della proliferazione cellulare. Si tratta, infatti, spesso di adenomi autonomi, determinanti un’iperfunzione tiroidea, caratteristici della sindrome di McCune-Albright (dovuta a mutazioni germinali di GNAS) e del Carney complex (caratterizzato da mutazioni inattivanti di PRKAR1A, che causano anch’esse attivazione costitutiva della via cAMP-protein-chinasi A) (4). Gli adenomi follicolari ad architettura papillare non iperfunzionanti possono invece presentare mutazioni del gene DICER1 e sono stati riportati anche in pazienti con sindrome DICER1 (5). L’associazione con l’iperfunzione tiroidea e con alcune sindromi genetiche rende quindi importante la distinzione clinica di tale entità.
L’”adenoma oncocitico” viene riconosciuto dalla nuova classificazione come lesione distinta, per indentificare quelle lesioni follicolari benigne con percentuale di cellule oncocitarie ≥ 75%. Tali tumori presentano, infatti, un profilo molecolare specifico, caratterizzato da alterazioni del genoma mitocondriale, mutazioni del gene GRIM19 e/o variazioni del numero di copie (presenti in più di un terzo dei casi) (1).
NEOPLASIE A BASSO RISCHIO (tabella 2)
Le neoplasie incluse in questa categoria erano già contemplate e definite nella quarta classificazione OMS del 2017, anche se descritte in capitoli diversi. L’attuale edizione ha ampliato lo spettro delle lesioni a basso rischio, includendo in tale categoria, oltre al NIFTP, anche i tumori a incerto potenziale di malignità e il tumore ialinizzante trabecolare (1). Si tratta di neoplasie con caratteristiche morfologiche e comportamento clinico intermedio tra i tumori benigni e maligni. Pur possedendo, infatti, la potenzialità di sviluppare metastasi linfonodali e a distanza, l’incidenza di tali eventi è estremamente bassa (6).
| Tabella 2 Neoplasie tiroidee a basso rischio |
||
| Istologia | Profilo molecolare | |
| Neoplasia tiroidea follicolare non invasiva con aspetti nucleari simil-papillari (NIFTP) | Neoplasia follicolare con caratteristiche nucleari di PTC, non invasione capsulare/vascolare, non sottotipi aggressivi, non corpi psammomatosi, papille < 1% |
Frequenti mutazioni di RAS (per il NIFTP la mutazione BRAF -V600E esclude la diagnosi) |
| Tumore tiroideo follicolare a incerto potenziale di malignità (FT-UMP) | Neoplasia follicolare incapsulata con dubbia invasione capsulare/ vascolare (WD-UMP ha caratteristiche nucleari di PTC) | |
| Tumore tiroideo ben differenziato a incerto potenziale di malignità (WD-UMP) | ||
| Tumore tiroideo ialinizzante trabecolare (HTT) | Architettura trabecolare, caratteristiche nucleari di PTC | Riarrangiamenti gene GLIS |
Il termine NIFTP è stato proposto nel 2016 e i criteri diagnostici sono rimasti invariati rispetto all’edizione del 2017, ma è stato introdotto come criterio di esclusione la presenza della mutazione V600E del gene BRAF. Nell’attuale edizione inoltre possono essere classificati come NIFTP anche tumori del diametro ≤ 1 centimetro e neoplasie con > 75% di cellule oncocitarie (NIFTP oncocitico) (7).
I “tumori a incerto potenziale di malignità (UMP)” sono definiti come neoplasie ben delimitate, per le quali l’invasione capsulare e/o vascolare rimangono dubbie dopo attenta e minuziosa valutazione da parte del patologo. È stata confermata la suddivisione di tali tumori in follicolare (FT-UMP) e ben differenziato (WD-UMP), caratterizzati, rispettivamente, da architettura follicolare e da caratteristiche nucleari cellulari, più o meno pronunciate, simili a quelle del PTC. Nei centri in cui questi termini vengono utilizzati nell’abituale pratica clinica, l’incidenza di tali neoplasie è compresa tra lo 0.5 e il 3% delle tiroidectomie (8). Sia i NIFTP che gli UMP presentano elevata prevalenza di mutazioni del gene RAS (1).
Il “tumore ialinizzante trabecolare (HTT)” è caratterizzato da alterazioni nucleari simili al PTC e da architettura trabecolare, con accumulo di materiale ialino intra-trabecolare come conseguenza della secrezione di una proteina attiva sulla membrana basale. L’HTT presenta specifiche alterazioni molecolari, non identificate in altri tumori tiroidei: non sono comuni, infatti, le mutazioni di RAS e BRAF, mentre è tipica la presenza di riarrangiamenti del gene GLIS (in particolare PAX8::GLIS3 e con minor frequenza PAX8::GLIS1), che portano a incremento nell’espressione di geni correlati alla matrice extra-cellulare (9).
NEOPLASIE MALIGNE (tabella 3)
La nuova classificazione OMS ha apportato importanti modifiche al capitolo delle neoplasie maligne, ai fini di correlare maggiormente la definizione istopatologica dei carcinomi al loro comportamento biologico e clinico (1). Rispetto alla precedente edizione, i cambiamenti principali riguardano:
- l’introduzione di due nuove e distinte entità: la variante follicolare invasiva incapsulata del PTC (IEFV-PTC) e il carcinoma tiroideo differenziato ad alto grado (DHGTC);
- la suddivisione del carcinoma oncocitico (sconsigliato l’utilizzo dell’espressione “a cellule di Hürthle) in tre sottotipi (minimamente invasivo, angio-invasivo e ampiamente invasivo), parimenti a quanto già previsto per il carcinoma follicolare;
- l’abolizione del carcinoma squamoso come entità a sé stante, da considerare invece come sottotipo o particolare aspetto morfologico del carcinoma anaplastico;
- la sostituzione del termine “variante” con “sottotipo”, per definire i diversi possibili aspetti architetturali del PTC;
- l’introduzione di un sistema per la valutazione del grading del carcinoma midollare.
| Tabella 3 Neoplasie maligne della tiroide |
|||
| Peculiarità | Profilo molecolare | Caratteristiche cliniche | |
| Carcinoma follicolare (FTC) Carcinoma oncocitico (OCA) Variante follicolare incapsulata invasiva del PTC (IEFV-PTC) |
Suddivisione in:
|
Frequenti mutazioni del gene RAS |
|
|
Carcinoma papillare (PTC) |
Sottotipi:
|
Frequenti mutazioni di BRAF e di altri geni della via MAP-chinasi |
|
|
Carcinoma differenziato ad alto grado (DHGTC) |
Modalità di crescita simile ai carcinomi differenziati Necrosi e/o conta mitotica ≥ 5/2 mm² |
Più frequenti mutazioni di BRAF |
|
|
Carcinoma scarsamente differenziato (PDTC) |
Modalità di crescita solida, trabecolare e/o insulare Necrosi e/o conta mitotica ≥ 3/2 mm² |
Più frequenti mutazioni di RAS | |
|
Carcinoma anaplastico (ATC)
|
Indifferenziato, comprende anche il carcinoma squamoso | BRAF possibile target genetico | Molto aggressivo, rapida prognosi infausta |
Per quanto riguarda il carcinoma follicolare (FTC) rimane la suddivisione, già prevista dalla quarta edizione, in carcinoma minimamente invasivo (con sola invasione capsulare), incapsulato angio-invasivo (definizione ancora controversa in merito al numero di vasi coinvolti) e ampiamente invasivo. Tali tumori sono caratterizzati da una sopravvivenza libera da malattia a 40 mesi molto variabile, rispettivamente del 97% per l’FTC minimamente invasivo, dell’81% per quello angio-invasivo e del 45% per l’FTC ampiamente invasivo (1). I tumori minimamente invasivi sono considerati a basso rischio di recidiva e possono essere trattati con la sola resezione locale, mentre gli FTC con invasione vascolare e/o con ampia invasione nel parenchima circostante richiedono generalmente un approccio terapeutico più aggressivo (es tiroidectomia di completamento, terapia radiometabolica adiuvante) (10). Si tratta, come è noto, di tumori che presentano frequenti mutazioni di RAS, tendono a crescere in modo espansivo, con alterazioni nucleari lievi e tendenza alla disseminazione per via ematogena.
Il carcinoma papillare (PTC) è un tumore a crescita tendenzialmente infiltrativa (occasionalmente anche espansiva e molto raramente confinata in una cisti), con alterazioni nucleari caratteristiche e particolarmente pronunciate, che tende a diffondersi per via linfatica. Le mutazioni più frequenti riguardano geni che coinvolgono la via delle MAP-chinasi, con netta prevalenza per la mutazione V600E di BRAF. Nel 10% dei PTC vi è una mutazione di TERT come secondo evento patogenetico, associato a comportamento clinico più aggressivo. I riarrangiamenti di RET sono un’altra possibile alterazione genetica alla base del PTC, specialmente nei tumori indotti da radiazioni, mentre alterazioni meno comuni sono le fusioni dei geni NTRK. Nella corrente classificazione il PTC è suddiviso in diverse sotto-categorie definite “sottotipi”. Il termine “variante” viene sconsigliato, per maggiore uniformità con le classificazioni di altri tumori e per evitare una possibile confusione con il termine di diagnostica molecolare “variante genetica”:
- il sottotipo classico è caratterizzato dalla crescita in papille;
- il sottotipo follicolare infiltrativo non ha crescita in papille, ma follicolare infiltrativa, con caratteristiche nucleari tipiche del PTC e comportamento clinico simile;
- i sottotipi aggressivi sono:
- il PTC a cellule alte (che nel 90% circa dei casi presenta la mutazione BRAF-V600E);
- il PTC a cellule colonnari;
- il PTC hobnail;
- il PTC sclerosante diffuso, caratterizzato dal coinvolgimento diffuso, uni- o bilaterale, del parenchima tiroideo con infiltrazione linfatica diffusa, densa sclerosi e numerosi corpi psammomatosi (che sono generalmente visibili in ecografia come foci iperecogeni distribuiti diffusamente all’interno del parenchima), spesso in associazione a un quadro di tiroidite cronica;
- il PTC solido/trabecolare può mimare il carcinoma scarsamente differenziato, ma, a differenza di quest’ultimo, non presenta aree di necrosi né alto indice mitotico;
- sottotipi di PTC a impatto prognostico non chiarito:
- PTC classico oncocitico;
- PTC Warthin-like;
- PTC a cellule chiare (raro).
La variante follicolare incapsulata invasiva del PTC (IEFVT-PTC) non è più considerata un sottotipo di PTC, ma un’entità diagnostica distinta, che presenta le caratteristiche nucleari tipiche del PTC, crescita follicolare espansiva e profilo molecolare caratterizzato da mutazioni del gene RAS. La presenza di chiara invasione capsulare lo differenzia dal NIFTP e dal WD-UMP. Si tratta di un tumore che non può chiaramente essere classificato né tra i carcinomi follicolari (per la presenza di alterazioni nucleari caratteristiche del PTC), né tra i carcinomi papillari (per l’associazione con le mutazioni di RAS, la crescita espansiva e il comportamento biologico con tendenza all’invasività locale e alle metastasi per via ematogena) (2). Visto il comportamento analogo agli altri tumori RAS-mutati, anche l’IEFVT-PTC è suddiviso in minimamente invasivo, angio-invasivo e ampiamente invasivo (1).
Il termine carcinoma oncocitico (OCA) deve essere utilizzato per i tumori maligni follicolari composti da almeno il 75% di cellule oncocitarie. L’espressione “carcinoma a cellule di Hürthle” è sconsigliata, dal momento che Hürthle descrisse in realtà le cellule C parafollicolari della tiroide e non le cellule oncocitarie. Non vi sono differenze significative nella classificazione istologica degli OCA rispetto alla quarta edizione OMS, se non la suddivisione (come per l’FTC e l’IEFVT-PTC) in carcinoma minimamente invasivo, angio-invasivo e ampiamente invasivo. I carcinomi oncocitici rappresentano circa il 5% delle neoplasie tiroidee, sono spesso associati a mutazioni del gene RAS e hanno comportamento simile ai carcinomi follicolari. È stata tuttavia segnalata una minore responsività di tali neoplasie alla terapia radiometabolica, fattore che potrebbe rendere più complesso il trattamento di eventuali recidive (11).
L’attuale classificazione OMS si è proposta inoltre di caratterizzare meglio il sottogruppo di tumori tiroidei con prognosi intermedia tra i tumori ben differenziati (a decorso tendenzialmente favorevole) e il carcinoma anaplastico (a rapida evoluzione infausta). Si riconoscono, infatti, nella nuova edizione due tipi di carcinoma di derivazione follicolare, non anaplastico, ad alto grado:
- il carcinoma tiroideo scarsamente differenziato (PDTC) è un carcinoma invasivo che presenta scarsa differenziazione cellulare all’esame istologico. I criteri diagnostici sono la crescita solida, trabecolare e/o insulare e la presenza di necrosi tumorale (segno caratteristico di questi tumori). Se quest’ultima è assente, per differenziare questi tumori dal sottotipo solido/trabecolare del PTC è necessario che la conta mitotica superi almeno le 3 mitosi/2 mm² (si preferisce l’utilizzo dei mm² rispetto ai “campi”, trattandosi di una misura standard con maggiore riproducibilità);
- il carcinoma differenziato ad alto grado (DHGTC), categoria introdotta nell’attuale edizione, si riferisce a quei tumori che conservano ancora chiare caratteristiche di differenziazione cellulare ma elevato indice proliferativo, in termini di necrosi tumorale e di attività mitotica. Presentano modalità di crescita simile a quella dei tumori ben differenziati, per la maggior parte di tipo papillare. Per la diagnosi è necessaria la presenza di necrosi tumorale e/o una conta mitotica ≥ 5 mitosi/2 mm² (2).
Le caratteristiche cliniche ed epidemiologiche dei DHGTC sono simili a quelle dei PDTC: tumori aggressivi, nel 50% dei casi iodio-refrattari, che si manifestano come masse in rapida crescita, con dimensioni generalmente > 4 cm e caratteristiche di alto rischio di recidiva e mortalità (es estesa invasione vascolare, infiltrazione dei tessuti muscolari, invasione peri-neurale, metastasi linfonodali) (12). Rappresentano dall’1 al 6.7% dei carcinomi tiroidei, con maggiore incidenza in Europa e in Sud America. La sopravvivenza a 10 anni specifica per malattia è del 60% per i PDTC e del 56% per i DHGTC (13).
Entrambi i tumori presentano frequenti mutazioni di BRAF, RAS o fusioni dei geni RET o NTRK3; le mutazioni di RAS sono più frequenti nei PDTC e quelle di BRAF maggiormente associate ai DHGTC (2). Si possono inoltre riscontrare seconde mutazioni associate a comportamento più aggressivo, come quelle di TERT, di PIK3CA e di TP53.
Per quanto riguarda il carcinoma anaplastico (ATC), nella corrente edizione viene classificato come tale anche il carcinoma a cellule squamose, che non rappresenta più quindi un’entità separata. Recenti studi multicentrici hanno, infatti, dimostrato che l’atteggiamento e la prognosi di questi tumori sono sovrapponibili. Viene inoltre sottolineata l’importanza per questi tumori di una rapida ricerca della mutazione V600E di BRAF, dal momento che può rappresentare un potenziale obiettivo terapeutico di farmaci inibitori di BRAF e MEK (14).
Una delle principali novità della quinta classificazione OMS dei tumori tiroidei è l’introduzione di un sistema per la valutazione del grading del carcinoma midollare (MTC). Tale sistema è stato validato da due studi indipendenti (e da un successivo studio di coorte) ed è risultato un parametro predittivo di recidiva e di sopravvivenza, indipendentemente da stadio di malattia, dimensioni del tumore, caratteristiche epidemiologiche, livelli di CEA e calcitonina e dalla presenza di mutazione del gene RET (15). Per definire “ad alto grado” un MTC, è necessaria la presenza di almeno uno dei seguenti parametri: necrosi tumorale, conta mitotica ≥ 5 mitosi/2 mm² e/o un indice proliferativo Ki67 ≥ 5%. Negli studi di validazione circa un quarto degli MTC sono risultati ad alto grado.
La quinta classificazione OMS dei tumori tiroidei ha inoltre suddiviso i restanti tumori tiroidei, estremamente rari, in quattro categorie:
- carcinomi intra-tiroidei delle ghiandole salivari (carcinoma muco-epidermoide e carcinoma secretore), con caratteristiche istologiche simili ai tumori delle ghiandole salivari (rispettivamente 48 e 12 casi descritti in letteratura);
- carcinomi tiroidei a incerta istogenesi:
- carcinoma muco-epidermoide sclerosante con eosinofilia (meno di 60 casi descritti, assenza di positività per marcatori espressi dalle cellule follicolari);
- carcinoma tiroideo cribriforme morulare (un tempo classificato come variante del PTC, viene classificato invece come entità distinta per il peculiare profilo molecolare caratterizzato dall’assenza di mutazioni di BRAF e altri geni della via delle MAP-chinasi, con tipiche alterazioni di geni della via Wnt/ß-catenina, come APC; può essere associato con la poliposi adenomatosa familiare);
- tumori timici intra-tiroidei (timoma, tumore epiteliale fusato con elementi simil-timici, carcinoma timico), che si ritengono di provenienza da cellule timiche ectopiche o da residui sulla linea timica di differenziazione embrionale;
- neoplasie tiroidee embrionali (tireoblastoma).
TUMORI FOLLICOLARI CON CARATTERISTICHE NUCLEARI DEL PTC (tabella 4)
Da quanto finora esposto, emerge come sia possibile riconoscere uno spettro di neoplasie tiroidee a crescita follicolare, con caratteristiche dei nuclei cellulari tipiche del PTC (ingrandimento del nucleo, contorni irregolari, distribuzione periferica della cromatina, nucleoplasma chiaro, presenza di pseudo-inclusi citoplasmatici,…), che comprendono forme indolenti (NIFTP, WD-UMP) e forme maligne quali l’IEFV-PTC.
| Tabella 4 Neoplasie follicolari della tiroide con caratteristiche nucleari del PTC |
|||
| NIFTP | WD-UMP | IEVF-PTC | |
| Invasione capsulare/ vascolare | Assente | Dubbia | Presente |
| Metastasi linfonodali | No | No | Rare |
| Metastasi a distanza | No | Rare | Frequenti nell’IEVF-PTC ampiamente invasivo |
| Approccio terapeutico | Lobectomia e follow-up | Angio-invasivo e ampiamente invasivo richiedono generalmente tiroidectomia + RAI | |
| Mutazione BRAF-V600E | Assente | ||
| Mutazioni RAS | Frequenti | ||
Per la diagnosi differenziale è necessaria una minuziosa e accurata valutazione della capsula tumorale, dal momento che l’invasione della stessa identifica le forme maligne, che richiedono approccio terapeutico e follow-up più aggressivi. Sono lesioni capsulate e ben delimitate, associate a mutazioni del gene RAS, che tendono pertanto a crescere in modo espansivo e non presentano tendenza all’invasione linfatica. Le forme maligne (IEVF-PTC) sono angio-invasive e danno metastasi a distanza per via ematogena.
La diagnosi differenziale pre-operatoria (sia ecografica che citologica) di tali neoplasie è molto difficile, dal momento che le caratteristiche morfologiche e cellulari sono sovrapponibili, e le mutazioni del gene RAS si possono riscontrare anche nelle forme benigne, rendendo pertanto spesso necessario l’intervento chirurgico per la valutazione della capsula tumorale.
Per quanto riguarda invece la diagnosi differenziale con altre neoplasie, il NIFTP si distingue dall’adenoma follicolare per le anomalie citologiche, mentre l’IEVF-PTC si distingue dal PTC per la crescita follicolare espansiva. Il sottotipo follicolare infiltrativo del PTC ha invece un comportamento biologico e un profilo molecolare identici al PTC (con crescita infiltrativa, tendenza alle metastasi linfonodali e frequente associazione con le mutazioni di BRAF); si differenzia da quest’ultimo solo per l’assenza di papille e viene pertanto considerato una variante del PTC e non un’entità clinica distinta.
CONCLUSIONI
La quinta edizione della classificazione OMS delle neoplasie tiroidee si differenzia dalle precedente per il maggior rilievo dato all’istopatogenesi e al profilo molecolare, parametri che hanno dimostrato una chiara correlazione con il comportamento biologico e clinico di queste neoplasie. L’introduzione del concetto di “grado”, sia per i tumori differenziati dell’epitelio follicolare che per il carcinoma midollare, consente inoltre di identificare in maniera più accurata quel sottogruppo di tumori tiroidei aggressivi e a prognosi sfavorevole, permettendo al clinico di riconoscerli più rapidamente e di impostare le adeguate terapie e controlli più ravvicinati. Punto cardine di questa nuova classificazione è infatti l’integrazione degli aspetti morfologici e istologici delle neoplasie tiroidee con il profilo molecolare e l’attività proliferativa delle stesse, nell’ottica di produrre uno schema solido, che rispecchi anche gli aspetti clinici di tali neoplasie.
BIBLIOGRAFIA
- Baloch ZW, Asa SL, Barletta JA, et al. Overview of the 2022 WHO classification of thyroid neoplasms. Endocr Pathol 2022, 33: 27-63.
- Juhlin CC, Mete O, Baloch ZW. The 2022 WHO Classification of thyroid tumors: novel concepts in nomenclature and grading. Endocr Relat Cancer 2022, 30: e220293.
- Cameselle-Teijerio JM, Eloy C, Sobrinho-Simoes M. Pitfalls in challenging thyroid tumors: emphasis on differential diagnosis and ancillary biomarkers. Endocr Pathol 2020, 31: 197-217.
- Kamilaris CDC, Faucz FR, Voutetakis A, Stratakis CA. Carney complex. Exp Clin Endocrinol Diabetes 2019, 127: 156-64.
- Doerfler WR, Nikitiski AV, Morariu EM, et al. Molecular alteration in Hürthle cells nodules and preoperative cancer risk. Endocr Relat Cancer 2021, 28: 301-9.
- Parente DN, Kluijfhout WP, Bongers PJ, et al. Clinical safety of renaming encapsulated follicular variant of papillary thyroid carcinoma: is NIFTP truly benign? World J Surg 2018, 42: 321-6.
- Nikiforov YE, Baloch ZW, Hodak SP, et al. Change in diagnostic criteria for noninvasive follicular thyroid neoplasm with papillary-like nuclear features. JAMA Oncol 2018, 4: 1125-6.
- Carney JA, Hirokawa M, Lloyd RV, et al. Hyalinizing trabecular tumors of the thyroid gland are almost all benign. Am J Surg Pathol 2008, 32: 1877-89.
- Nikiforova MN, Nikitski AV, Panebianco F, et al. GLIS rearrangement is a genomic hallmark of hyalinizing trabecular tumor of the thyroid gland. Thyroid 2019, 29: 161-73.
- O' Neill CJ, Vaughan L, Learoyd DL, et al. Management of follicular thyroid carcinoma should be individualised based on degree of capsular and vascular invasion. Eur J Surg Oncol 2011, 37: 181-5.
- Sugino K, Kameyama K, Ito K, et al. Does Hürthle cell carcinoma of the thyroid have a poorer prognosis than ordinary follicular thyroid carcinoma? Ann Surg Oncol 2013, 20: 2944-50.
- Rivera M, Ghossein RA, Schoder H, et al. Histopathologic characterization of radioactive iodine-refractory fluorodeoxyglucose-positron emission tomography-positive thyroid carcinoma. Cancer 2008, 113: 48-56.
- Xu B, David J, Dogan S, et al. Primary high-grade non-anaplastic thyroid carcinoma: a retrospective study of 364 cases. Histopathology 2022, 80: 322-37.
- De Leo S, Trevisan M, Fugazzola L. Recent advances in the management of anaplastic thyroid cancer. Thyroid Res 2020, 13: 17.
- Alzumaili B, Xu B, Spanheimer PM, et al. Grading of medullary thyroid carcinoma on the basis of tumor necrosis and high mitotic rate is an independent predictor of poor outcome. Mod Pathol 2020, 33: 1690-701.
Stadiazione dei tumori tiroidei differenziati
Andrea Frasoldati1, Mario Cappagli2 & Virginia Cappagli3
1Endocrinologia, Arcispedale S Maria Nuova, Reggio Emilia
2Ex SSD Endocrinologia, Ospedale S. Andrea, La Spezia
3Endocrinologia e malattie del metabolismo, Università di Pisa
(aggiornato al 17 marzo 2020)
Il carcinoma differenziato della tiroide (DTC) si caratterizza per un’ottima prognosi, con una probabilità di guarigione che può essere complessivamente stimata attorno al 90% dei casi. La maggior parte dei pazienti è infatti guarita dopo il trattamento iniziale (intervento chirurgico ± terapia radiometabolica con 131-I); tuttavia circa il 5-20% dei pazienti presenterà nel corso del follow-up metastasi/recidiva loco-regionale di malattia, mentre un gruppo più limitato (5-10%) svilupperà metastasi a distanza. Circa il 60-70% di questi ultimi casi e più in generale il 5% di tutti i tumori tiroidei diventerà refrattario al radioiodio, con un conseguente impatto prognostico negativo.
Disporre di sistemi di stratificazione del rischio è importante per stimare la prognosi di malattia e scegliere quindi i trattamenti più indicati, da un lato evitando un monitoraggio eccessivamente intensivo e prolungato, con conseguente dispendio di risorse, in pazienti a basso o bassissimo rischio, e dall’altro sorvegliando con strumenti appropriatamente sensibili e specifici i pazienti a rischio intermedio o elevato di sviluppare ripresa e/o progressione di malattia.
Per la stadiazione del tumore tiroideo sono stati proposti e utilizzati numerosi sistemi (TNM, AMES, MACIS, ecc), ma nessuno è superiore all’altro. Se tutti questi sistemi avevano il “difetto” di valutare la malattia tumorale tiroidea in modo statico, con l’introduzione nella pratica clinica delle linee guida ATA 2015 e la successiva revisione da parte delle società italiane è stato proposto un nuovo sistema di stadiazione di tipo dinamico della stratificazione del rischio. La dinamicità di questo sistema parte dal presupposto che la storia naturale del paziente e della sua malattia ci impone di formulare periodici aggiornamenti del suo inquadramento prognostico. In particolare, tali aggiornamenti avvengono in tre momenti principali:
- in fase post-chirurgica, in base ai dati clinico-anamnestici di partenza e al dato istopatologico;
- post-terapia ablativa con 131I (qualora eseguita), che integra i dati istopatologici con il risultato della scintigrafia post-dose e della tireoglobulina (Tg) misurata in condizioni di stimolazione;
- sulla base di quanto emerso dal follow-up iniziale e dalla risposta ai provvedimenti terapeutici (chirurgia e/o radioiodio).
STADIAZIONE DEL TUMORE TIROIDEO 1: FASE POST-CHIRURGICA
La stadiazione del tumore tiroideo nella fase post-chirurgica tiene conto di fattori prognostici correlati al paziente (es. età, sesso) e alla neoplasia (dimensioni, invasività, multi-focalità, metastasi). Dalle modalità di impiego (e non impiego) di questi fattori sono scaturiti nel corso degli scorsi decenni diversi sistemi di classificazione prognostica (1,2).
Il sistema maggiormente utilizzato è il sistema TNM (tumore-node-metastasis), elaborato dalla American Joint Committee on Cancer (AJCC), che permette di predire il rischio di morte malattia-correlato (2-4). Le principali novità introdotte nell’ultima versione del TNM, 8° edizione (tabella 1), rispetto alla versione precedente riguardano:
- l’aumento del cut-off di età da 45 a 55 anni;
- la minor rilevanza del significato prognostico negativo di alcune caratteristiche istologiche tumorali (es. metastasi linfonodali loco-regionali, minima estensione extra-tiroidea) a favore dell’estensione ai muscoli peri-tiroidei.
| Tabella 1 Stadiazione TNM per i tumori tiroidei differenziati (papillare o follicolare) (modificato da AJCC Cancer Staging Manual, 8th Edition, 20) |
||
| T | ||
| T1 | T1a | Tumore < 1 cm |
| T1b | Tumore 1-2 cm, limitato alla tiroide | |
| T2 | Tumore 2-4 cm, limitato alla tiroide | |
| T3 | T3a | Tumore > 4 cm, limitato alla tiroide |
| T3b | Tumore di qualsiasi dimensione, con estensione macroscopica ai muscoli peri-tiroidei | |
| T4 | T4a | Tumore di qualsiasi dimensione, con invasione tessuti molli, laringe, trachea, esofago, nervo ricorrente |
| T4b | Tumore di qualsiasi dimensione, con invasione fascia pre-vertebrale, carotide, vasi mediastinici | |
| N | ||
| Nx | Linfonodi loco-regionali non valutati | |
| N0 | Nessuna evidenza di metastasi linfonodali | |
| N1 | N1a | Presenza di metastasi linfonodali del VI o VII livello |
| N1b | Presenza di metastasi linfonodali ai linfonodi laterali del collo e retro-faringei | |
| M | ||
| M0 | Assenza di metastasi a distanza | |
| M1 | Presenza di metastasi a distanza | |
I criteri per definire le classi di rischio sono identici per tutti i tipi e le varianti istologiche del DTC (tabella 2).
| Tabella 2 Stadiazione TNM e gruppi prognostici per i tumori tiroidei differenziati (papillare o follicolare) (modificato da: AJCC Cancer Staging Manual, 8th Edition, 2016) |
||||
| Stadio | T | N | M | Sopravvivenza a 10 anni |
| < 55 anni | ||||
| I | Qualsiasi | Qualsiasi | M0 | 98-100% |
| II | Qualsiasi | Qualsiasi | M1 | 85-95% |
| ≥ 55 anni | ||||
| I | T1 | N0/Nx | M0 | 98-100% |
| T2 | N0/Nx | M0 | ||
| II | T1 | N1 | M0 | 85-95% |
| T2 | N1 | M0 | ||
| T3a/b | Qualsiasi N | M0 | ||
| III | T4a | Qualsiasi N | M0 | 60-70% |
| IVa | T4b | Qualsiasi N | M0 | < 50% |
| IVb | Qualsiasi T | Qualsiasi N | M1 | |
Il sistema MACIS (tabella 3) (6) considera 5 variabili: metastasi a distanza (Metastases), età (Age), radicalità chirurgica (Complete surgical treatment), invasività locale (Invasiveness) e dimensioni della neoplasia primitiva (Size). Predice il rischio di mortalità patologia-correlata. In analogia al sistema UICC/AJCC, individua 4 classi di rischio, ma non tiene conto della presenza o meno di metastasi linfonodali.
| Tabella 3 Sistema MACIS: attribuzione punteggio |
||
| Metastasi | Assenti | 0 |
| Presenti | 3 | |
| Età | < 40 | 3.1 |
| ≥ 40 | 0.08 x età | |
| Radicalità | Completa | 0 |
| Incompleta | 1 | |
| Invasività | Assente | 0 |
| Presente | 1 | |
| Dimensioni tumore | 0.3 x dimensioni tumore in cm | |
| Classificazione prognostica MACIS | ||
| Punteggio | Stadio | Mortalità |
| < 6 | 1 | 1% |
| 6-6.99 | 2 | 11% |
| 7-7.99 | 3 | 44% |
| > 8 | 4 | 76% |
Il sistema EORTC, pubblicato nel 1979, fu il primo a raggruppare sotto un unico sistema la stadiazione di tutti i tipi istologici di carcinoma tiroideo, compresi il carcinoma midollare e anaplastico (tabella 4) (6). Identifica 5 gruppi di rischio, utilizzando come parametri: età, genere, tipo istologico, estensione del tumore primitivo, numero dei siti metastatici. Rispetto agli altri sistemi, assegna al sesso maschile un valore prognostico peggiorativo, tiene conto del tipo e sottotipo istologico, attribuendo un rischio più elevato ai follicolari con aspetti di scarsa differenziazione e considera la molteplicità dei siti metastatici.
| Tabella 4 Classificazione prognostica EORTC |
|
| Somma | |
| Calcolo punteggio | Età alla diagnosi (anni) Sesso maschile: + 12 Tumore midollare: + 10 Tumore scarsamente differenziato: +10 Tumore anaplastico: + 45 Estensione extra-capsulare: +10 Almeno un focolaio di metastasi a distanza: + 15 Siti metastatici plurimi: + 15 (in aggiunta al precedente) |
| Gruppi di rischio in base al punteggio EORTC gruppo 1: < 50 gruppo 2: 50-65 gruppo 3: 66-83 gruppo 4: 84-108 gruppo 5: ≥ 109 |
|
Il punteggio AMES (tabella 5) (7), introdotto alla fine degli anni ’80, è complessivamente simile al MACIS, pur essendo stato costruito su una casistica comprensiva di PTC e FTC. Propone infatti come fattori di rischio età, metastasi a distanza, estensione extra-tiroidea e dimensioni del tumore primitivo. Tuttavia, viene suggerito un cut-off di età differenziato tra maschi e femmine. Inoltre, a differenza del MACIS, il diametro della neoplasia non costituisce una variabile continua, ma viene proposto un cut-off dimensionale critico di 5 cm. Inoltre, a differenza di quanto avviene nel sistema AJCC, i pazienti con metastasi a distanza vengono tutti considerati ad alto rischio, indipendentemente dall'età.
| Tabella 5 Classificazione prognostica AMES |
||
| Basso rischio | Tutti i pazienti più giovani (maschi ≤ 40 anni, donne ≤ 50 anni) se M0 Pazienti di età superiore solo se:
|
|
| Rischio elevato |
Tutti i pazienti M1
|
|
Negli anni ’90 ha goduto di una certa fortuna, in virtù della semplicità e immediatezza, il sistema cosiddetto Clinical Class (tabella 6) (8) a 4 classi di rischio, messo a punto dal gruppo di Chicago e quindi anche denominato dalla città nordamericana. Si tratta di un sistema che non tiene conto di parametri che hanno un valore prognostico unanimemente riconosciuto, quali età e dimensioni della neoplasia primitiva e non considera sesso e tipo istologico.
| Tabella 6 Clinical Class |
|
| Classe I | Tumore confinato alla tiroide |
| Classe II | Metastasi cervicali |
| Classe III | Tumore ad estensione extra-tiroidea o non completamente asportato |
| Classe IV | Metastasi a distanza |
Abbastanza simile al precedente è il sistema OSU (Ohio State University), proposto dal gruppo di Mazzaferri (9), che identifica 4 classi di rischio (tabella 7). Anch’esso non tiene conto dell’età, ma valuta le dimensioni del tumore primitivo e l’eventuale multi-focalità.
| Tabella 7 Sistema di classificazione prognostica OSU |
||||||
| Classe | Dimensioni T (cm) | N | Multi-focalità (> 3 foci) | Invasività locale | M | Mortalità (%) |
| I | < 1.5 | N0 | No | No | M0 | 0 |
| II | 1.5-4.49 | N1 | Sì | No | M0 | 6 |
| III | ≥ 4.5 | N0/N1 | Sì/No | Sì | M0 | 14 |
| IV | Qualsiasi | N0/N1 | Sì/No | Sì/No | M1 | 65 |
Interessante per alcuni suoi aspetti di originalità e per la sua aderenza alla clinica è il sistema a 3 livelli di rischio formulato dal gruppo del Memorial Sloan Kettering di New York, e quindi definito con l’acronimo MSK, su una casistica di oltre mille pazienti con PTC e FTC (10) (tabella 8). Tale sistema non tiene conto del superamento capsulare, né della presenza di linfonodi metastatici, ma dell’età (utilizzando il cut-off dei 45 anni), del diametro tumorale (con il cut-off di 4 cm), della presenza di metastasi a distanza, e del tipo e grading istologico.
| Tabella 8 Sistema di stratificazione prognostica MSK |
||||
| Classe di rischio | Età (anni) | Metastasi | Dimensioni T (cm) | Istologia e grading |
| Bassa | < 45 | M0 | < 4 | PTC |
| Intermedia | < 45 | M1 | > 4 | FTC e/o alto grado |
| > 45 | M0 | < 4 | PTC | |
| Elevata | > 45 | M1 | > 4 | FTC e/o alto grado |
Uno dei limiti principali comune ai sistemi di classificazione prognostica sopracitati è quello di essere stati costruiti per valutare la mortalità specifica per la malattia. Proprio per questo, non costituiscono uno strumento sufficientemente accurato per valutare invece il rischio di recidiva loco-regionale, un problema di più frequente riscontro nella pratica clinica. Inoltre, molti sistemi di classificazione non attribuiscono a PTC e FTC un diverso profilo di rischio, né considerano la maggiore aggressività tipica di alcune varianti istologiche del PTC (es. cellule alte, cellule colonnari, sclerosante diffusa), o la minore pericolosità associata al FTC minimamente invasivo. A tale riguardo, è opportuno sottolineare che il diverso rischio prognostico che differenzia PTC e FTC secondo alcuni autori non è da ricondursi all’istologia per sè, ma piuttosto al fatto i pazienti con FTC, per un ritardo di diagnosi, presentano mediamente un’età più avanzata e una neoplasia più estesa, spesso già caratterizzata da metastasi a distanza (11). I lavori di confronto tra i diversi sistemi di classificazione, in particolare quelli pubblicati dal gruppo di Toronto su una casistica originale di circa 300 casi (12) e quelli, più recenti, del gruppo di Wurzburg su oltre 1200 pazienti (13), sono concordi nell’indicare che il sistema AJCC presenta un'adeguata accuratezza prognostica unita ad una maggior semplicità di utilizzo e maggior diffusione nella pratica clinica. Non è peraltro da escludersi che nel prossimo futuro possa affermarsi l’impiego di sistemi di classificazione prognostica differenziati nei pazienti con PTC o FTC: secondo i risultati ottenuti da diverse casistiche, il sistema MACIS sarebbe il più accurato per l’inquadramento prognostico dei pazienti con FTC rispetto agli altri sistemi (14-16).
STRATIFICAZIONE DEL RISCHIO 2: FASE POST-TRATTAMENTO ABLATIVO
Un modello di stratificazione del rischio appartenente a una fase successiva a quella immediatamente post-chirurgica è quello proposto dalle nuove linee guida dell’American Thyroid Association (ATA) (17), che rivedono il modello precedentemente descritto delle linee guida del 2009, e riviste anche dalla consensus delle società italiane (18). Tale modello prevede la suddivisione dei pazienti in tre classi di rischio (basso/intermedio/elevato) sulla base dell’integrazione di dati di tipo anatomo-patologico, molecolare e clinico, prendendo in considerazione alcune “nuove” variabili, come il grado di invasione vascolare tumorale, il numero di linfonodi coinvolti e lo stato mutazionale del tumore (tabella 9).
| Tabella 9 Rischio iniziale di recidiva secondo American Thyroid Association 2015 |
|
| Rischio basso | PTC con le seguenti caratteristiche:
PTC intra-tiroideo, variante follicolare capsulata. |
| Rischio intermedio | Tumore con invasione microscopica dei tessuti lassi peri-tiroidei. Tumore con istologia aggressiva. PTC con invasione vascolare. N1 clinico o riscontro istologico N1 con > 5 metastasi (< 3 cm di diametro max). MicroPTC multi-focale con estensione extra-tiroidea (inclusi i casi BRAF V600E +). Presenza di iodiocaptazione nel collo alla scintigrafia post-dose di 131-I. |
| Rischio alto | Tumore con invasione macroscopica dei tessuti lassi peri-tiroidei. Resezione tumorale incompleta. Presenza di metastasi a distanza. Tg post-operatoria suggestiva di metastasi a distanza. Riscontro istologico N1 con metastasi > 3 cm di diametro max. FTC con invasione vascolare massiva > 4 foci. |
Tale modello è in grado di predire il rischio di recidiva/persistenza di malattia, che varia dal < 1% nel basso rischio a > 50% nell’alto rischio (17). Sulla base quindi delle classi di rischio, dovrebbe essere presa la decisione se sottoporre il paziente a terapia ablativa con 131-I (17-18):
- basso rischio: non è routinariamente raccomandata;
- rischio basso-intermedio o intermedio: dovrebbe essere presa in considerazione, soprattutto nei casi con età avanzata, varianti istologiche aggressive, invasione vascolare, ecc;
- alto rischio: è raccomandata routinariamente.
STRATIFICAZIONE DEL RISCHIO 3: RISPOSTA INIZIALE AL TRATTAMENTO CON RADIOIODIO
Il nuovo concetto introdotto dalle linee guida ATA 2015 è quello per cui la stratificazione iniziale del rischio di recidiva/persistenza di malattia non è un concetto statico, ma dinamico e deve pertanto essere aggiornata durante il follow-up dei pazienti, alla luce dei trattamenti effettuati e della risposta ottenuta. La risposta al trattamento iniziale si basa sulla valutazione dei seguenti parametri a distanza di 6-12 mesi dalla terapia con radioiodio:
- Tg circolante in condizioni basali o dopo stimolazione;
- ecografia cervicale;
- eventuali indagini strumentali aggiuntive (TC o 18F-FDG TC-PET) in casi selezionati.
L’insieme di questi dati permette una nuova suddivisione dei pazienti in quattro diverse categorie (17) (tabella 10). Ad ogni tipo di risposta corrisponde una riclassificazione del rischio di recidiva (17). Tale sistema è già stato testato nella pratica clinica, che ne ha confermato la validità nel predire il rischio di recidiva di malattia (19).
| Tabella 10 Risposta al trattamento iniziale |
||||
| Risposta | Tg sierica/AbTg | Ecografia | Altro imaging (TC/WBS/PET) | Rischio recidiva |
| Eccellente (tutti i criteri indicati) | < 0.2 ng/mL (in terapia soppressiva con L-T4). < 1 ng/mL (dopo rhTSH). |
Negativa | Negativo | 1-4% |
| Biochimica incompleta (uno qualsiasi dei criteri indicati) | > 1 ng/mL (in terapia soppressiva con L-T4). > 10 ng/mL (dopo rhTSH) Incremento del titolo di AbTg. |
Negativa | Negativo | 20-30% |
| Strutturale incompleta (uno qualsiasi dei criteri indicati) | Qualsiasi valore di Tg o AbTg. | Positiva per persistenza/recidiva di malattia loco-regionale | Positiva per persistenza/ comparsa di malattia a distanza | 50-85% |
| Indeterminata | Tg 0.2-1 ng/mL (in terapia soppressiva con L-T4). Tg 1-10 ng/mL (dopo rhTSH). Titolo anticorpale AbTg stabile o in riduzione. |
Presenza di immagini aspecifiche | Presenza di immagini aspecifiche | 15-20% |
La determinazione della tireoglobulina sierica costituisce un parametro chiave dell’inquadramento prognostico, ma va tenuto di contro che i valori di Tg possono essere influenzati da diversi parametri: la quantità di tessuto residuo dopo l’intervento e/o la terapia ablativa, il livello di soppressione dei valori di TSH, il dosaggio utilizzato per la determinazione e il tempo intercorso tra l’intervento chirurgico/terapia ablativa e la misurazione analitica (17).
BIBLIOGRAFIA
- Gilliland FD, Hunt WC, Morris DM, et al. Prognostic factors for thyroid carcinoma. Cancer 1997, 79: 564-73.
- Tuttle M, Morris LF, Haugen B, et al. Thyroid- differentiated and anaplastic carcinoma (Chapter 73). In: Amin MB, et al (Eds). AJCC Cancer Staging Manual, 8th edition. Springer International Publishing, New York, NY, USA 2017.
- Loh KC, Greenspan FS, Gee L, et al. Pathological tumor-node-metastasis (pTNM) staging for papillary and follicular thyroid carcinomas: a retrospective analysis of 700 patients. J Clin Endocrinol Metab 1997, 82: 3553-6.
- Ito Y, Miyauchi A, Jikuzono T, et al. Risk factors contributing to a poor prognosis of papillary thyroid carcinoma: validity of UICC/AJCC TNM classification and stage grouping. World J Surg 2007, 31: 838-48.
- Hay ID, Bergstralh EJ, Goellner JR, et al. Predicting outcome in papillary thyroid carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients surgically treated at one institution during 1940 through 1989. Surgery 1993, 114: 1050-8.
- Byar DP, Green SB, Dor P, et al. Prognostic index for thyroid carcinoma. A study of the E.O.R.T.C. Thyroid Cancer Cooperative Group. Eur J Cancer 1979, 15: 1033-41.
- Cady B, Rossi R. An expanded view of risk-group definition in differentiated thyroid carcinoma. Surgery 1988, 104: 947-53.
- DeGroot LJ, Kaplan EL, McCormick et al. Natural history, treatment, and course of papillary thyroid carcinoma. J Clin Endocrinol Metab 1990, 71: 414-24.
- Mazzaferri EL, Jhiang SM. Long term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994, 97: 418-28.
- Shaha AR, Loree TR, Shah JP. Intermediate-risk group for differentiated thyroid carcinoma of thyroid. Surgery 1994, 116: 1036-40.
- Verburg FA, Mäder U, Luster M, et al. Histology does not influence prognosis in differentiated thyroid carcinoma when accounting for age, tumour diameter, invasive growth and metastases. Eur J Endocrinol 2009, 160: 619-24.
- Brierley JD, Panzarella T, Tsang RW, et al. A comparison of different staging systems predictability of patient outcome. Thyroid carcinoma as an example. Cancer 1997, 79: 2414-23.
- Verburg FA, Mäder U, Kruitwagen CL, et al. A comparison of prognostic classification systems for differentiated thyroid carcinoma. Clin Endocrinol (Oxf) 2010, 72: 830-8.
- Teo KW, Yuan NK, Tan WB, Parameswaran R. Comparison of prognostic scoring systems in follicular thyroid cancer. Ann R Coll Surg Engl 2017, 99: 479–84.
- Lang BH, Lo CY, Chan WF, et al. Staging systems for papillary thyroid carcinoma: a review and comparison. Ann Surg 2007, 245: 366-78.
- Lang BH, Lo CY, Chan WF, et al. Staging systems for follicular thyroid carcinoma: application to 171 consecutive patients treated in a tertiary referral centre. Endocr Relat Cancer 2007, 14: 29-42.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016, 26: 1–133.
- Pacini F, Basolo F, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849–76.
- Tuttle RM, Tala H, Shah J, et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new ATA staging system. Thyroid 2010, 12: 1341-9.
Manifestazioni cliniche dei tumori della tiroide
Andrea Frasoldati
UO Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia
Il carcinoma tiroideo differenziato (DTC) comprende le neoplasie maligne a sviluppo dall’epitelio follicolare (tabella 1), corrispondenti ad oltre il 90% dei casi di carcinoma primitivo della tiroide (1-3). Il DTC è in larga prevalenza (85-90%) rappresentato dal carcinoma papillare (papillary thyroid carcinoma, PTC), la cui crescente incidenza è alla base del boom epidemiologico dei tumori tiroidei realizzatosi negli ultimi 15 anni (4-5). Nettamente distanziato per incidenza dal PTC, è il carcinoma tiroideo follicolare (follicular thyroid carcinoma = FTC), che corrisponde a circa il 10% dei casi.
| Tabella 1 Classificazione istologica dei tumori primitivi maligni della tiroide (adattata dalla classificazione istologica WHO 1988 (1) e AFIP 1992 (2) |
||
| Tumori dell’epitelio follicolare | Carcinoma papillare | classico variante follicolare variante sclerosante diffusa variante a cellule alte o colonnari |
| Carcinoma follicolare | minimamente invasivo ampiamente invasivo |
|
| Carcinoma oncocitario (cellule di Hürthle) | minimamente invasivo ampiamente invasivo |
|
| Carcinoma scarsamente differenziato | insulare altre varianti |
|
| Carcinoma indifferenziato (anaplastico) | ||
| Altri tumori epiteliali | Carcinoma squamo-cellulare Carcinoma mucoepidermoide Carcinoma mucinoso |
|
| Tumori delle cellule parafollicolari (cellule C) | Carcinoma midollare | |
| Tumori misti epitelio follicolare/parafollicolare | ||
| Tumori non di derivazione epiteliale | Linfomi Sarcomi |
|
Carcinoma tiroideo papillare
Presenta la massima incidenza nella IV-V decade ed una netta prevalenza nel sesso femminile (5,6,7,8). Le forme familiari, un tempo considerate rare, si ritiene corrispondano al 5-15% dei casi di PTC (9).
Nei paesi a più elevato sviluppo, la maggior parte delle nuove diagnosi di PTC avviene su noduli di riscontro incidentale o rivelati da un’ecografia tiroidea eseguita per motivi aspecifici. Il profilo citologico corrisponde solitamente alle classi Tir-4 e Tir-5, tuttavia esiste una quota minoritaria di PTC, in genere rappresentati dalla variante follicolare, in cui l’esame citologico fornisce spesso un risultato indeterminato (Tir-3). Anche se rari, i falsi negativi citologici sono peraltro possibili.
Il PTC corrisponde spesso ad una lesione di piccole dimensioni: in una percentuale vicina al 50%, la neoplasia presenta un diametro ≤ 1 cm (papillary microcarcinoma = PMC) (8,10). Un tempo quasi esclusivamente di riscontro istologico incidentale, i PMC oggi sono nella maggior parte dei casi diagnosticati mediante esame citologico (10).
Nei pazienti con PTC, la frequenza di metastasi linfonodali loco-regionali (compartimento centrale del collo e distretto latero-cervicale) alla diagnosi è elevata (35-50%)(8). Anche per questa ragione, la storia naturale della malattia si caratterizza per frequenti recidive loco-regionali di malattia (10-20%), possibili a anche a distanza di molti anni dalla tiroidectomia. E’ interessante sottolineare che alcune delle maggiori casistiche di PMC pubblicate negli ultimi anni riportano una frequenza di estensione extra-tiroidea (pT3) e di metastasi linfonodali (pN1) rispettivamente corrispondenti al 15-30% ed al 20-35%, percentuali non dissimili da quelle che si registrano nei PTC di dimensioni superiori (10-16). Anche la bilateralità dei foci neoplastici non è infrequente nel PMC, verificandosi in circa il 15% (12-19%) dei casi (10-16). Pertanto, anche se la maggioranza (57-82%) dei pazienti con PMC presenta una stadiazione pT1N0, l’opportunità di un trattamento chirurgico di tipo conservativo è a tutt’oggi controversa. Ampie casistiche di PMC nordamericane e giapponesi caratterizzate da un lungo periodo di follow-up evidenziano che il rischio di recidiva loco-regionale di malattia nei pazienti trattati con chirurgia monolaterale e nei pazienti sottoposti a tiroidectomia totale o quasi-totale è sostanzialmente sovrapponibile (14,16).
ll PTC presenta una ridotta frequenza di metastasi a distanza (~5%); la sede prevalente è il polmone e nella maggior parte dei casi si tratta di localizzazioni multiple a carattere micro-nodulare, iodocaptanti e quindi responsive al trattamento con radioiodio. Nelle forme caratterizzate da evoluzione sfavorevole, possono comparire metastasi ossee e cutanee, più raramente epatiche e cerebrali (8). Il rischio di metastasi a distanza nel PMC è estremamente ridotto e i casi di mortalità aneddotici (10-16).
Nella maggior parte dei casi (70-80%) il PTC è rappresentato dalle varianti istologiche classica e follicolare, entrambe caratterizzate da una prognosi decisamente favorevole (17-21); sono tuttavia possibili varianti istologiche dotate di maggiore aggressività (tabella 2) (21,22).
| Tabella 2 Profilo clinico-epidemiologico di PTC e FTC |
||||||
| Istologia | Frequenza | Età di massima incidenza | Rapporto F:M | Metastasi loco-regionali | Metastasi a distanza | Sopravvivenza a 10 anni |
| PTC | 80% | 30-55 | 3:1 | 30-50% | 5-7% | 90-95% |
| FTC | 10-15% | 45-70 | 3:1 | 10-15% | 10-15% | 80-85% |
La variante a cellule alte, descritta originariamente nella seconda metà degli anni ’70, ha una prevalenza approssimativamente compresa nelle varie casistiche tra il 5 e il 15%. Le prime serie pubblicate indicavano una più elevata frequenza di secondarietà linfonodali (50-57%) e soprattutto di metastasi a distanza (25-31%) rispetto alle varianti classica o follicolare del PTC (23-25). Inoltre, la frequenza di recidiva loco-regionale risulterebbe circa 4 volte maggiore a quanto osservato nella variante classica del PTC (26). Alcuni autori ritengono comunque che la maggiore pericolosità della variante a cellule alte derivi da un’età media dei pazienti più elevata (V-VI decade) e da dimensioni della neoplasia alla diagnosi superiori rispetto a quelle riscontrate nel PTC classico. Inoltre il rapporto femmine:maschi (1.8:1) indicherebbe una più alta frequenza relativa nel sesso maschile. In altri termini, la variante a cellule alte non sarebbe per sè un fattore indipendente di prognosi sfavorevole (26,27), ma la più alta probabilità di un'evoluzione negativa della malattia deriverebbe dalle caratteristiche del paziente e dall’estensione iniziale del tumore. Il PTC a cellule alte si caratterizza comunque anche per una maggiore probabilità che le localizzazioni metastatiche non siano iodocaptanti, elemento che concorre ad una più elevata mortalità (23.6% vs 1.5 %)(26).
La variante a cellule colonnari è decisamente più rara (0.5%), è spesso associata ad una prognosi sfavorevole, con un’aumentata frequenza di metastasi a distanza e un’aumentata mortalità. Tuttavia, la maggior parte dei casi pubblicati è rappresentata da case report isolati e non è possibile derivare forti evidenze cliniche a riguardo (28).
La variante sclerosante diffusa, anch’essa rara (1-2%), si caratterizza per alcune peculiarità: viene spesso diagnosticata in individui giovani (massima incidenza nella III decade), di sesso femminile (4-5:1), e si associa a tiroidite cronica linfocitaria (29,30). Si tratta di una variante che pone particolari problemi in ambito diagnostico, poiché l’associazione con la tiroidite cronica e l’estensione di tipo diffuso nel parenchima tiroideo concorrono a rendere la neoplasia di non agevole individuazione ecografica. Spesso proprio la presenza di metastasi linfonodali guida la diagnosi, analogamente a quanto avviene in una quota di PMC. La mortalità associata a tale variante si ritiene non sia significativamente superiore a quanto osservato nelle forme classiche di PTC (29,30).
La variante solida o trabecolare ha anch’essa una frequenza dell’1-2%, che sale al 20-30% nelle casistiche delle neoplasie tiroidee indotte da radiazione. Tale variante, analogamente alla variante insulare, si associa ad una prognosi sfavorevole; proprio l’architettura solida/trabecolare o insulare della neoplasia viene identificata come uno dei criteri per definire una neoplasia tiroidea come scarsamente differenziata (poorly differentiated thyroid carcinoma, PDTC) (31,32).
Nel loro complesso, le evidenze disponibili suggeriscono che tutte le varianti istologiche sopra indicate presentano una maggiore pericolosità. Se da un lato ciò suggerisce l’opportunità di una particolare attenzione nella gestione clinica dei pazienti con questi tipi di neoplasia, le modalità di trattamento suggerite dalle linee guida non differiscono in modo sostanziale da quelle relative alle forme usuali di PTC. La stadiazione della neoplasia riveste infatti attualmente un ruolo di primo piano nel determinare la gestione clinica del paziente; occorre tuttavia ricordare che sono allo studio nuove proposte classificative dei tumori dell’epitelio follicolare, con l’obiettivo di realizzare una sintesi efficace tra criteri istopatologici tradizionali (es. invasività di capsula e vasi), e dati clinici ricavati dalle maggiori casistiche pubblicate (33).
Carcinoma tiroideo follicolare
Presenta la massima incidenza in una fascia di età più avanzata (V-VI decade) rispetto al PTC; inoltre, la frequenza di metastasi linfonodali è significativamente più bassa (10-20 %), mentre aumenta (10-15%) quella delle metastasi ematogene (10-12%).
Alla diagnosi il FTC si presenta in genere come un tumore monofocale, di grosse dimensioni (3-5 cm di diametro); per questo può corrispondere ad un nodulo palpabile.
La diagnosi di FTC è sempre istologica: la citologia nella maggior parte dei casi corrisponde a quadri di proliferazione (o neoformazione) follicolare (Tir-3) e sono possibili falsi negativi. All’esame istologico, il grado di invasione vascolare permette di distinguere forme “minimamente invasive”, a comportamento sostanzialmente benigno, da forme “ampiamente invasive”, spesso caratterizzate da metastasi a distanza (34-38).
Il carcinoma a cellule di Hürthle presenta un profilo clinico sostanzialmente sovrapponibile a quello del carcinoma follicolare, con l’importante caratteristica di risultare non infrequentemente insensibile al radioiodio. Inoltre, il carcinoma a cellule di Hürthle presenta multifocalità e metastasi linfonodali con una frequenza intermedia tra quella osservata nel PTC e quella assai contenuta del FTC (39).
| Tabella 3 Classificazione clinico-prognostica dei tumori tiroidei maligni |
|
| Grado di malignità | Tumore |
| Basso | Carcinoma papillare variante classica e follicolare Carcinoma follicolare minimamente invasivo Carcinoma a cellule di Hürthle minimamente invasivo |
| Intermedio | Carcinoma papillare variante a cellule alte Carcinoma papillare variante a cellule colonnari Carcinoma follicolare ampiamente invasivo Carcinoma a cellule di Hürthle ampiamente invasivo Carcinoma midollare Carcinoma scarsamente differenziato (es. insulare) Carcinoma misto midollare/follicolare Carcinoma mucoepidermoide Linfomi |
| Alto | Carcinoma indifferenziato (anaplastico) Carcinoma squamocellulare Sarcomi |
Bibliografia
- Hedinger C, Williams ED, Sobin LH. Histological typing of thyroid tumours. Second edition. No. 11 in: International Histological Classification of Tumours, World Health Organization. Springer-Verlag, Berlin, 1988.
- Rosai J, Carcangiu ML, Delellis RA. Tumours of the thyroid gland. In: Atlas of Tumour Pathology, third series. Armed Forces Institute of Pathology, Washington DC, 1992
- Sobrinho-Simoes M, Fonseca E. Recently described tumours of thyroid. In: Recent Advances in Histopathology no.16, Anthony PP and Macsween RNM (Eds). Churchill Livingstone, Edinburgh, 1994, pp 213-229.
- Hundahl SA, Fleming ID, Fremgen AM, et al. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995. Cancer 1998, 83: 2638-84.
- Davies L, Welch HG. Increasing incidence of thyroid cancer in the United States, 1973–2002. JAMA 2006, 295: 2164-7.
- Kent WDT, Hall SF, Isotalo PA, et al. Increased incidence of differentiated thyroid cancer and detection of subclinical disease. CMAJ 2007, 177: 1357-61.
- Lam AKY, Lo CY, Lam KSL. Papillary carcinoma of thyroid: a 30-year clinicopathologic review of the histological variants. Endocr Pathol 2005, 16: 323-30.
- Tuttle RM, Leboeuf R, Martorella AJ. Papillary thyroid cancer: monitoring and therapy. Endocrinol Metab Clin North Am 2007, 36: 753–78.
- Nosé V. Familial thyroid cancer: a review. Mod Pathol 2011, Suppl 2: S19-33.
- Bernet V. Approach to patient with incidental papillary microcarcinoma. J Clin Endocrinol Metab 2010, 95: 3586-92.
- Baudin E, Travagli JP, Ropers J, et al. Microcarcinoma of the thyroid. The Goustave-Roussy Institute experience. Cancer 1998, 83: 553-9.
- Chow S-M, Law SCK, Chan JKC, et al. Papillary microcarcinoma of the thyroid – prognostic significance of lymph node metastasis and multifocality. Cancer 2003, 98: 31-40.
- Roti E, Rossi R, Trasforini G, et al. Clinical and histological characteristics of papillary thyroid microcarcinoma: results of a retrospective study in 243 patients. J Clin Endocrin Metab 2006, 91: 2171-8.
- Hay ID, Hutchinson ME, Gonzalez-Losada T, et al. Papillary thyroid microcarcinoma: a study of 900 cases observed in a 60-year period. Surgery 2008, 144: 980-8.
- Mercante G, Frasoldati A, Pedroni C, et al. Prognostic factors affecting neck lymph node recurrence and distant metastasis in papillary microcarcinoma of the thyroid: results of a study in 445 patients. Thyroid 2009, 19: 1-10.
- Sugitani I, Fujimoto Y. Management of low-risk papillary thyroid carcinoma: unique conventional policy in Japan and our efforts to improve the level of evidence. Surg Today 2010, 40: 199-215.
- Kesmodel SB, Terhune KP, Canter RJ, et al. The diagnostic dilemma of follicular variant of papillary thyroid carcinoma. Surgery 2003, 134: 1005–12.
- Zidan J, Karen D, Stein M, et al. Pure versus follicular variant of papillary thyroid carcinoma: clinical features, prognostic factors, treatment, and survival. Cancer 2003, 97: 1181-5.
- Liu J, Singh B, Tallini G, et al. Follicular variant of papillary thyroid carcinoma: a clinicopathologic study of a problematic entity. Cancer 2006, 107: 1255-64.
- Lang BH, Lo CY, Chan WF, et al. Classical and follicular variant of papillary thyroid carcinoma: a comparative study on clinicopathologic features and long-term outcome. World J Surg 2006, 30: 752-8.
- Gonzales-Gonzales R, Bologna-Molina R, Carreon-Burgiaga RG et al. Papillary thyroid carcinoma: differential diagnosis and prognostic values of its different variants. Review of the literature. ISRN Oncology 2011, 2011: 915925.
- Silver CE, Owen RP, Rodrigo JP, et al. Aggressive variants of papillary thyroid carcinoma. Head & Neck 2011, 33: 1052–9.
- Sywak M, Pasieka JL, Ogilvie T. A review of thyroid cancer with intermediate differentiation. J Surg Oncol 2004, 86: 44-54.
- Machens A, Holzhausen H, Lautenschlager C, et al. The tall-cell variant of papillary thyroid cancer: a multivariate analysis of clinical risk factors. Langenbecks Arch Surg 2004, 389: 278-82.
- Michels JJ, Jacwua M, Henry-Amar M, et al. Prevalence and prognostic significance of tall cell variant of papillary thyroid carcinoma. Hum Pathol 2007, 38: 212-9.
- Leung AK, Chow SM, Law SC. Clinical features and outcome of the tall cell variant of papillary thyroid carcinoma. Laryngoscope 2008, 118: 32-8.
- Jalisi S, Ainsworth T, LaValley M. Prognostic outcome of tall-cell variant papillary thyroid cancer: a metanalysis. J Thyr Res 2010, article 325602.
- Wenig BM, Thompson LD, Adair CF, et al. Thyroid papillary carcinoma of columnar cell type: a clinico-pathologic study of 16 cases. Cancer 1998, 82: 740-53.
- Falvo L, Giacomelli L, D’Andrea V, et al. Prognostic importance of sclerosing variant in papillary thyroid carcinoma. Am Surg 2006, 72: 438-44.
- Thompson LD, Wioeneke JA, Heffess CS. Diffuse sclerosing variant of papillary thyroid carcinoma: a clinicopathologic and immunophenotypic analysis of 22 cases. Endocr Pathol 2005, 16: 331-48.
- Nikiforov YE. Radiation-induced thyroid cancer: what we have learned from Chernobyl. Endocr Pathol 2006, 17: 307-17.
- Rufini V, Salvatori M, Fadda G, et al. Thyroid carcinomas with a variable insular component: prognostic significance of histopathologic patterns. Cancer 2007, 110: 1209-17.
- Kakudo K, Bai Y, Liu Z, et al. Classification of thyroid follicular cell tumors: with special reference to borderline lesions. Endocr J 2012, 59: 1-12.
- Thompson LD, Wieneke JA, Paal E, et al. A clinicopathologic study of minimally invasive follicular carcinoma of the thyroid gland with a review of the English literature. Cancer 2001, 91: 505-24.
- D'Avanzo A, Ituarte P, Treseler P, et al. Prognostic scoring systems in patients with follicular thyroid cancer: a comparison of different staging systems in predicting the patient outcome. Thyroid 2004, 14: 453-8.
- Lo CY, Chan WF, Lam KY, et al. Follicular thyroid carcinoma: the role of histology and staging systems in predicting survival. Ann Surg 2005, 242: 708-15.
- Kakudo K, Bai Y, Katayama S, et al. Classification of follicular cell tumors of the thyroid gland: analysis involving Japanese patients from one institute. Pathol Int 2009, 59: 359-67.
- Suster S. Thyroid tumors with a follicular growth pattern: problems in differential diagnosis. Arch Pathol Lab Med 2006, 130: 984-8.
- Kushchayeva Y, Duh QY, Kebebew E, et al. Comparison of clinical characteristics at diagnosis and during follow-up in 118 patients with Hurthle cell or follicular thyroid cancer. Am J Surg 2007, 19: 457–62.
Overview sulla gestione clinica dei tumori differenziati della tiroide
Marco Capezzone
UOSD Endocrinologia, Ospedale Misericordia di Grosseto, USL Toscana sud-est Grosseto
(aggiornato al 30/6/2025)
INTRODUZIONE
I tumori maligni della tiroide comprendono carcinomi derivati dalle cellule follicolari (carcinoma papillare, carcinoma follicolare e carcinoma anaplastico) e dalle cellule para-folllicolari (carcinoma midollare). Forme più rare sono i linfomi primitivi della tiroide e i sarcomi. La tiroide inoltre può essere sede di metastasi da parte di neoplasie maligne di altri organi (mammella, rene, colon, melanoma).
Questo capitolo è dedicato alla gestione clinica dei tumori differenziati tiroidei (DTC). Per specifici approfondimenti si rimanda ai capitoli su manifestazioni cliniche, chirurgia, terapia radiometabolica, radioterapia esterna, follow-up.
Benché vi siano alcune differenze rilevanti nel comportamento biologico del carcinoma papillare (PTC) rispetto al follicolare (FTC, che compare in media in età più avanzata e si associa più frequentemente a metastasi a distanza), ai fini della pratica clinica la gestione dei DTC può essere trattata in comune (1), perchè la prognosi è simile se valutata per stadio (2,3).
L’incidenza dei DTC ha mostrato negli ultimi trent’anni un incremento superiore a quello di altre neoplasie (4,5). L’aumento è in parte conseguenza delle migliorate capacità diagnostiche per la diffusione dell’ecografia (US) e dell’agoaspirato della tiroide (FNA) (fenomeno della sovra-diagnosi) (6). Tuttavia, l’aumentata incidenza dei DTC riguarda non solo i microPTC, ma anche tumori di maggiori dimensioni e pertanto le cause sono multi-fattoriali (7). A fronte della più elevata frequenza dei DTC, la mortalità tumore-specifica è rimasta invariata nel tempo, confermando l’importanza della diagnosi precoce e della gestione terapeutica integrata.
1. TERAPIA CHIRURGICA
La chirurgia è la principale modalità terapeutica per i DTC. L’intervento chirurgico dovrebbe essere eseguito da chirurghi con esperienza nella chirurgia della tiroide, per minimizzare il rischio di ipoparatiroidismo e di lesioni a carico dei nervi ricorrenti. Sono disponibili opzioni terapeutiche diverse, in rapporto a tipo istologico, età, estensione della malattia e alla preferenza e condizioni generali del paziente (1).
La scelta dell’approccio chirurgico deve essere sempre preceduta dall’attenta stadiazione pre-operatoria, basata principalmente sulla valutazione US dei linfonodi latero-cervicali e del comparto centrale, al fine di pianificare la corretta procedura chirurgica. L’US del collo può arrivare a identificare linfonodi patologici in circa il 20-30% dei pazienti (8). Per confermare il sospetto di malignità, nei linfonodi di diametro > 10 mm dovrebbe essere eseguito FNA eco-guidato con dosaggio della tireoglobulina (Tg) sull’eluato. In pazienti con malattia locale potenzialmente avanzata potrebbero essere richiesti altri metodi di diagnostica per immagini (RM, TC con contrasto, laringoscopia ed endoscopia), per definire in modo accurato l’estensione del coinvolgimento tracheale, esofageo, laringeo o vascolare (9). Nei casi localmente avanzati, la TC del collo-mediastino con MdC permette di valutare in fase pre-operatoria il coinvolgimento delle catene linfonodali e pianificare il trattamento chirurgico ottimale. In questi casi il beneficio di un’accurata pianificazione chirurgica supera il ritardo temporale della somministrazione del radioiodio necessario dopo l’utilizzo del MdC iodato.
In assenza di studi prospettici, le conclusioni riguardo l’approccio chirurgico ottimale sono basate su analisi retrospettive e su opinioni degli esperti. Nei pazienti con PTC o FTC sono indicate queste procedure.
Assenza di estensione extra-tiroidea, assenza di metastasi linfonodali o a distanza:
- tumori unilaterali ≤ 1 cm: l’approccio preferito è la lobectomia, salvo che non ci siano chiare indicazioni a rimuovere anche il lobo contro-laterale (ad esempio cancro controlaterale clinicamente evidente, storia pregressa di irradiazione nella regione testa-collo, forte familiarità per carcinoma tiroideo). In casi selezionati in alternativa all’intervento chirurgico può essere proposta la sorveglianza attiva (10);
- tumori di 1-4 cm: la procedura chirurgica iniziale può essere sia la tiroidectomia totale che la lobectomia. La tiroidectomia totale dovrebbe essere scelta in base a preferenza del paziente, presenza di anomalie ecografiche nel lobo controlaterale (noduli, tiroiditi, linfoadenopatie aspecifiche, che potrebbero rendere difficoltoso il follow-up) o al potenziale beneficio del radio-iodio sia come terapia adiuvante sia per facilitare il follow-up (11,12);
- tumori > 4 cm: è infrequente il riscontro di un PTC > 4 cm senza coinvolgimento linfonodale o estensione extra-tiroidea. Pertanto, la maggioranza di questi pazienti viene sottoposta a tiroidectomia totale, anche se in pazienti attentamente selezionati a basso rischio potrebbe essere presa in considerazione la lobectomia (1).
In pazienti selezionati in modo appropriato la lobectomia, con o senza istmectomia, è un’alternativa accettabile alla tiroidectomia totale, per l’evidenza di dati che riportano bassa mortalità, bassi tassi di recidiva e minore tasso di complicanze chirurgiche. Nei pazienti con tumore intra-tiroideo studi retrospettivi e meta-analisi hanno mostrato tassi di sopravvivenza simili tra i pazienti sottoposti a tiroidectomia totale e a lobectomia (13,14). Sebbene nei pazienti trattati con lobectomia tiroidea il rischio di recidiva loco-regionale sia leggermente aumentato, queste recidive possono essere trattate chirurgicamente in maniera efficace al momento del riscontro.
Presenza di estensione extra-tiroidea e/o metastasi (linfonodali e/o a distanza) in tumori di ogni diametro: questi pazienti devono essere sottoposti a tiroidectomia totale.
Storia di pregressa irradiazione sul collo e sulla testa in tumori di ogni diametro: dato l’elevato rischio di recidiva tumorale che questi pazienti presentano con interventi chirurgici meno estesi, deve sempre essere eseguita tiroidectomia totale (1).
MicroPTC multi-focale:
- se foci < 5 mm la lobectomia con istmectomia è una procedura appropriata;
- se foci > 5 mm, soprattutto se con diametro di 8-9 mm di, è preferibile eseguire il completamento della tiroidectomia.
Le indicazioni per il completamento della tiroidectomia includono:
- carcinoma tiroideo poco differenziato;
- invasione linfatica o invasione vascolare;
- malattia multi-focale con foci > 10 mm.
Dissezione linfonodale:
- del compartimento centrale del collo (livello VI):
- deve essere eseguita quando vi è evidenza di impegno linfonodale alla stadiazione pre-operatoria o all’esplorazione intra-operatoria;
- è controversa in assenza di metastasi evidenziabili (dissezione profilattica). Consente una stadiazione isto-patologica più completa, definendo il pN e orientando più precisamente verso l’opportunità di un trattamento ablativo con radio-iodio. Tuttavia non si associa a riduzione significativa della mortalità a lungo termine, mentre è seguita da incremento delle complicanze permanenti (ipoparatiroidismo e danno del nervo laringeo ricorrente). Dovrebbe essere presa in considerazione solo nei DTC di ampie dimensioni (> 4 cm) o con estensione extra-capsulare, caratteristiche associate con elevata frequenza a metastasi linfonodali (15). Deve comunque essere eseguita in ambienti chirurgici con specifica competenza e alto volume di interventi di tiroidectomia;
- latero-cervicale: deve essere eseguita in presenza di metastasi linfonodali ecograficamente o clinicamente accertate. La dissezione deve essere funzionale (risparmiando l’integrità di muscoli, fibre nervose e vasi del collo) ed estesa ai compartimenti II, III, IV e V del collo (16,17).
L’impiego dell’ecografia intra-operatoria o della chirurgia radio-guidata potrebbe essere utile in caso di re-intervento per recidiva linfonodale o nel letto tiroideo in pazienti già sottoposti a precedente linfoadenectomia, per ridurre i tempi operatori e minimizzare il rischio di complicanze.
Approccio chirurgico più aggressivo: deve essere impiegato nei tumori avanzati della tiroide che coinvolgono i muscoli e le strutture vitali del collo. L’intervento deve consentire il miglioramento dell’aspettativa e/o della qualità di vita e non deve essere causa di alterazioni anatomiche o funzionali invalidanti. In queste circostanze è necessaria un’accurata stadiazione pre-operatoria da condurre con TC o RM del collo e torace con MdC, studio endoscopico delle vie aeree e digestive superiori, e, ove possibile, PET-TC con 18F-fluorodeossiglucosio (18,19).
2. STADIAZIONE
La stadiazione post-operatoria dei pazienti con DTC riveste un ruolo fondamentale per la gestione nel tempo della malattia. Dopo l’intervento chirurgico, deve essere valutata l’assenza o la presenza di malattia persistente e il rischio di recidiva, per individuare la necessità di trattamento terapeutico aggiuntivo, in particolare la terapia ablativa con radioiodio. Sebbene la stratificazione iniziale del rischio possa essere utilizzata per guidare le decisioni iniziali sulla strategia di follow-up diagnostica e terapeutica, è importante ricordare che le stime iniziali del rischio potrebbero cambiare man mano che vengono accumulati nuovi dati durante il follow-up (stratificazione dinamica del rischio) (1,20). Pertanto, nella pratica clinica è opportuno utilizzare tre sistemi di stadiazione, in grado di guidare la condotta clinica in fasi diverse.
Il rischio di mortalità tumore-specifico può essere definito sulla base dei dati isto-patologici disponibili dopo l’intervento chirurgico (tabella 1). Il sistema di stadiazione più diffuso e accettato è il TNM, adottato dalla UICC e dall’AJCC (21). Si distinguono 4 stadi, caratterizzati da un rischio crescente di mortalità, sulla base di età, dimensioni del tumore, estensione locale di malattia e presenza di metastasi a distanza (tabella 2). La predittività del TNM è soddisfacente nel definire la mortalità ma, essendo basata sui soli dati anatomo-patologici, è meno precisa nel definire il rischio di recidiva o persistenza di malattia.
| Tabella 1 Stadiazione TNM per il tumore della tiroide (papillare, follicolare, scarsamente differenziato, a cellule di Hürthle e anaplastico) (modificato da 21) |
||
| Categoria | Criteri | |
| T (tumore primitivo)* | Tx | Il tumore primitivo non può essere valutato |
| T0 | Non evidenza di tumore primitivo | |
| T1 | Tumore ≤ 2 cm, limitato alla tiroide | |
| T1a | Tumore ≤ 1 cm | |
| T1b | Tumore > 1 cm ma ≤ 2 cm | |
| T2 | Tumore > 2 cm ma ≤ 4 cm, limitato alla tiroide | |
| T3 | Tumore > 4 cm limitato alla tiroide, o con macroscopica estensione extra-tiroidea, con invasione solo dei muscoli anteriori del collo | |
| T3a | Tumore limitato alla tiroide | |
| T3b | Tumore di qualunque dimensione, con estensione extra-tiroidea macroscopica solo nei muscoli anteriori del collo (sterno-ioideo, sterno-tiroideo, omo-ioideo) | |
| T4 | Tumore di qualsiasi dimensione, con invasione macroscopica extra-tiroidea | |
| T4a | L’estensione extra-tiroidea invade tessuto sotto-cutaneo, trachea, laringe, esofago, o nervo ricorrente | |
| T4b | L’estensione extra-tiroidea infiltra la fascia pre-vertebrale o l’arteria carotidea o i vasi mediastinici | |
| N (linfonodi)** | Nx | Linfonodi regionali non valutabili |
| N0 | Assenza di metastasi ai linfonodi regionali | |
| N1 | Presenza di metastasi ai linfonodi regionali | |
| N1a | Uni- o bilaterali ai linfonodi del VI o VII livello | |
| N1b | Ai linfonodi del collo omolaterali, bilaterali o controlaterali (livelli I, II, III, IV o V) o ai linfonodi retro-faringei | |
| M (metastasi) | M0 | Assenti metastasi a distanza |
| M1 | Presenti metastasi a distanza | |
|
*Tutte le categorie possono essere suddivise in:
**I linfonodi regionali sono il compartimento centrale laterale del collo e i linfonodi del mediastino superiore |
||
| Tabella 2 Raggruppamento in stadi (modificato da 21) |
||||||
| Stadio | T | N | M | T | N | M |
| Età < 55 anni |
Età ≥ 55 anni |
|||||
| I | Qualsiasi | Qualsiasi | M0 | T1/T2 | N0/Nx | M0 |
| II | Qualsiasi | Qualsiasi | M1 | T1/T2 | N1 | M0 |
| T3a/b | Qualsiasi | M0 | ||||
| III | T4a | Qualsiasi | M0 | |||
| IVa | T4b | Qualsiasi | M0 | |||
| IVb | Qualsiasi | Qualsiasi | M1 | |||
Il rischio di malattia persistente e/o di recidiva è meglio definito dal sistema di stadiazione clinico-patologica dell’American Thyroid Association (ATA). Questo sistema stratifica i pazienti principalmente sulla base delle caratteristiche clinico-patologiche. Il rischio di recidiva è dinamico, distinto in tre categorie (basso, intermedio e alto) (tabella 3) (1,20).
| Tabella 3 Rischio iniziale di recidiva secondo American Thyroid Association (modificato da 1) |
|
| Basso |
PTC con le seguenti caratteristiche:
FTC intra-tiroideo ben differenziato, con invasione capsulare e invasione vascolare assente o minima (< 4 foci). |
| Intermedio | Tumore con invasione microscopica dei tessuti lassi peri-tiroidei. Tumore con istologia aggressiva (a cellule alte, insulare, a cellule colonnari, a cellule di Hürthle, carcinoma follicolare, variante hobnail). PTC con invasione vascolare. N1 clinico o riscontro istologico N1 con > 5 metastasi (< 3 cm di diametro max). MicroPTC multi-focale con estensione extra-tiroidea (inclusi i casi con mutazione BRAF V600E). Presenza di iodio-captazione nel collo alla scintigrafia post-dose di 131I. |
| Alto | Tumore con invasione macroscopica dei tessuti lassi peri-tiroidei. Resezione tumorale incompleta con residuo macroscopico. Presenza di metastasi a distanza. Tg post-operatoria suggestiva di metastasi a distanza. Riscontro istologico N1 con metastasi > 3 cm di diametro max. FTC con invasione vascolare massiva > 4 foci. |
La stratificazione dinamica del rischio del Memorial-Sloan Kettering Cancer Center consente di modificare nel tempo il rischio di recidiva o decesso del paziente sulla base della risposta alla terapia nel corso del follow-up. La ri-stratificazione, condotta sulla base dei risultati dei primi due anni, permette di descrivere lo stato clinico in qualsiasi momento durante il follow-up. A ogni visita, i pazienti vengono classificati in base a uno dei seguenti risultati clinici (tabella 4):
- risposta eccellente: nessuna evidenza clinica, biochimica o strutturale di malattia;
- risposta incompleta biochimica: Tg aumentata o valori in aumento degli Ab anti-Tg, in assenza di malattia localizzabile;
- risposta strutturale incompleta: persistenza o recidiva loco-regionale o metastasi a distanza;
- risposta indeterminata: reperti non specifici biochimici o strutturali, che non possono con sicurezza essere classificati né benigni né maligni. Questo include pazienti con livelli di Ab anti-Tg stabili o in riduzione, senza sicura evidenza strutturale di malattia.
| Tabella 4 Classificazione dinamica del rischio di recidiva o mortalità |
|||
| Risposta | Intervento iniziale | ||
| Tiroidectomia totale + ablazione con 131I | Tiroidectomia totale senza 131I | Lobectomia | |
| Eccellente | Ab anti-Tg indosabili e imaging negativo. | ||
| Tg non stimolata < 0.2 ng/mL o stimolata < 1 ng/mL. | Tg stabile non stimolata < 30 ng/mL. | ||
| Biochimica incompleta | Livelli di Ab anti-Tg in aumento e imaging negativo. | ||
| Tg non stimolata > 1 ng/mL* o stimolata > 10 ng/mL*. | Tg non-stimolata > 5 ng/mL* o stimolata > 10 ng/mL* o livelli in aumento con livelli simili di TSH. | Tg non-stimolata > 30 ng/mL* o livelli in aumento con livelli simili di TSH. | |
| Strutturale incompleta | Evidenza strutturale o funzionale di malattia, indipendentemente da Tg o Ab anti-Tg. | ||
| Indeterminata | Risultati non specifici negli studi di imaging, in assenza di malattia strutturale o funzionale, o livelli di Ab anti-Tg stabili o in riduzione. | ||
| Debole captazione nel letto tiroideo al WBS. | |||
| Tg non stimolata tra 0.2-1 ng/mL* o stimolata tra 1-10 ng/mL*. | Tg non stimolata tra 0.2-5 ng/mL* o stimolata tra 2-10 ng/mL*. | ||
| *in assenza di Ab anti-Tg interferenti | |||
3. TERAPIA RADIOMETABOLICA
Il trattamento ablativo con 131I provoca, attraverso l’emissione di radiazioni β, la distruzione del tessuto tiroideo residuo e degli eventuali residui microscopici di malattia; consente inoltre di visualizzare la persistenza di malattia e le eventuali metastasi a distanza con la scintigrafia whole-body post-dose, completando la stadiazione della neoplasia, e rende il dosaggio della Tg sierica un marcatore di malattia sensibile e di semplice impiego per il follow-up.
È impiegata nel DTC come trattamento adiuvante dopo l’intervento di tiroidectomia totale, perché è in grado di ridurre significativamente il rischio di recidiva di malattia a 10 anni e di ridurre, in minor misura, la mortalità tumore-specifica.
Attualmente è riservata solo ai pazienti ad alto rischio e ad alcuni selezionati a rischio intermedio, perchè non sembra migliorare la prognosi nei pazienti con micro-carcinoma o con stadiazione iniziale a basso rischio (1,20,22-24).
Per le indicazioni, modalità di preparazione ed esecuzione, norme protezionistiche, risultati e complicanze vedi i capitoli dedicati. Gravidanza e allattamento costituiscono una controindicazione assoluta alla terapia con 131I.
Nel tentativo di standardizzare la terminologia, un gruppo di lavoro inter-societario, con rappresentanti di ATA, European Thyroid Association, European Association of Nuclear Medicine e Society of Nuclear Medicine and Molecular Imaging ha raggiunto il seguente consenso riguardo agli obiettivi della terapia con 131I nel DTC.
Ablazione del residuo post-chirurgico: l'obiettivo primario è la distruzione del tessuto tiroideo residuo, presumibilmente benigno, dopo la tiroidectomia totale, al fine di facilitare la stadiazione iniziale e il follow-up. Questo, a sua volta, consentirà di:
- migliorare la specificità delle misurazioni della Tg come marcatore tumorale;
- aumentare la specificità della scintigrafia con 131I per l'individuazione di malattia recidivante o metastatica, eliminando l'assorbimento del tessuto sano residuo.
Nei pazienti con basso rischio ATA (T1a/T1b, N0/Nx, M0/Mx), l'ablazione del residuo non è generalmente raccomandata. Tuttavia, la valutazione di caratteristiche specifiche potrebbe portare a prenderla in considerazione in singoli pazienti.
Nei pazienti a rischio intermedio o basso-intermedio (T1/T2, N1a/N1b, M0/Mx), l'ablazione dovrebbe essere presa in considerazione, in particolare in presenza di caratteristiche avverse (età avanzata, tumori di dimensioni maggiori, linfonodi macroscopici o clinicamente evidenti o presenza di estensione extra-tiroidea, o istologia aggressiva o invasione vascolare) (25).
Nei pazienti ad alto rischio o a rischio intermedio-alto (T3(T4, qualsiasi N, qualsiasi M), l'ablazione è raccomandata di routine.
Trattamento adiuvante: l'obiettivo primario è la distruzione dei depositi tumorali subclinici (che possono essere presenti o meno dopo la resezione chirurgica di tutto il tessuto tumorale primario) e dei focolai metastatici. Poiché il trattamento adiuvante viene somministrato in base al rischio di persistenza/recidiva di malattia in assenza di evidenza di malattia biochimica o strutturale, è ipotizzabile che alcuni pazienti selezionati per il trattamento adiuvante possano essere già stati trattati in modo adeguato con l'intervento chirurgico primario. Pertanto, la decisione di raccomandare il trattamento adiuvante richiede un bilanciamento tra il rischio oncologico (rischio di persistenza/recidiva di malattia e mortalità specifica per malattia) e i rischi associati al trattamento adiuvante (rischi a breve e lungo termine di 131I) e il potenziale beneficio del trattamento adiuvante (potenziale di riduzione delle recidive, miglioramento della sopravvivenza libera da progressione e/o miglioramento della mortalità specifica per malattia). Pertanto, in pazienti opportunamente selezionati, i potenziali benefici potrebbero includere:
- distruzione dei focolai microscopici subclinici di malattia residui dopo chirurgia;
- riduzione del rischio di recidiva;
- miglioramento della sopravvivenza specifica per malattia;
- miglioramento della sopravvivenza libera da progressione.
Trattamento di malattia nota: l'obiettivo primario in questo caso è la distruzione della malattia macroscopica clinicamente evidente (evidenziata da valori anomali di Tg o da reperti strutturali), non suscettibile di terapia chirurgica (1,20,24). Il trattamento con radioiodio della malattia residua e della malattia metastatica può ridurre il rischio di recidiva e mortalità, soprattutto nelle lesioni di piccole dimensioni avide di radioiodio. La terapia con radioiodio ad alte dosi è un efficace mezzo terapeutico per le metastasi polmonari e, in minor misura, per le altre metastasi a distanza (scheletro, fegato, cervello). Complessivamente, i pazienti trattati con 131I per metastasi a distanza hanno una sopravvivenza a 5 anni che è circa il doppio dei non trattati. La risposta terapeutica è migliore nei pazienti con metastasi polmonari di piccole dimensioni non visualizzabili radiologicamente.
4. TERAPIA CON ORMONE TIROIDEO
Dopo la tiroidectomia iniziale, è necessaria la terapia con levotiroxina (LT4) per prevenire (e curare) l’ipotiroidismo e, nella maggior parte dei pazienti, per ridurre al minimo la potenziale stimolazione del TSH sulla crescita di un eventuale residuo neoplastico. L’ipotesi che valori soppressi di TSH riducano il rischio di mortalità in tutti i pazienti con DTC non è stata dimostrata (26).
È importante sottolineare che la dose di LT4 va adattata all’estensione della malattia e alla probabilità di recidiva. Queste decisioni possono essere basate in parte sulla stadiazione tramite il TNM, in combinazione con il sistema di rischio di recidiva proposto dall’ATA.
La terapia deve essere monitorata con il TSH sierico, misurato annualmente e 6-8 settimane dopo qualsiasi aggiustamento della dose (1).
Pazienti a basso rischio:
- trattati con tiroidectomia e con livelli sierici di Tg dosabili (con o senza ablazione del residuo): mantenere valori di TSH tra 0.1 e 0.5 mU/L;
- trattati con tiroidectomia e con livelli sierici di Tg non rilevabili (con o senza ablazione del residuo): il TSH può essere mantenuto tra 0.5 e 3.0 mU/L;
- trattati con lobectomia: il trattamento con LT4 potrebbe non essere necessario nel paziente il cui TSH si mantiene nell’intervallo desiderato (dal limite inferiore della norma a 3 mU/L) (1).
Pazienti a rischio intermedio: mantenere valori di TSH tra 0.1 e 0.5 mU/L (1).
Pazienti a rischio alto: mantenere valori di TSH < 0.1 mU/L (1).
Adeguamento degli obiettivi di TSH in base alla risposta alla terapia: per il follow-up a lungo termine, bisogna basarsi sulla risposta alla terapia e sulla presenza di comorbilità che aumentano i potenziali rischi di soppressione prolungata del TSH (come menopausa, età avanzata, tachicardia/fibrillazione atriale, osteopenia/osteoporosi) (27).
- Nei pazienti a rischio intermedio che dimostrano eccellente risposta alla terapia durante i primi uno-due anni di follow-up, la dose può essere ridotta per consentire al TSH di tornare nel range di normalità.
- Per i pazienti che inizialmente presentavano malattia ad alto rischio ma che hanno eccellente risposta clinica alla terapia, è accettabile un obiettivo di TSH da 0.1 a 0.5 mU/L fino a cinque anni, dopodiché il grado di soppressione può essere ulteriormente allentato (con sorveglianza continua per il rischio di recidiva).
- Nei pazienti in remissione completa, mantenere i livelli di TSH nel range della norma.
5. RADIOTERAPIA ESTERNA
Ha scarsa indicazione nel trattamento iniziale dei DTC (1,28). Può essere utilizzata come trattamento adiuvante per ridurre/rallentare la recidiva di malattia in pazienti con neoplasie localmente avanzate (pT4). Può essere utile in particolare per i pazienti più anziani con estensione extra-tiroidea macroscopica al momento dell’intervento chirurgico o in pazienti più giovani, selezionati, con malattia estesa e caratteristiche istologiche sfavorevoli (ad esempio, istologia insulare o scarsamente differenziata), la cui malattia viene resecata ma in cui esiste alta probabilità di malattia microscopica residua (29).
La radioterapia esterna è un trattamento palliativo efficace per le metastasi a distanza (prevalentemente cerebrali o scheletriche, soprattutto se iperalgiche), non controllabili dal solo trattamento con radioiodio (30,31).
6. FOLLOW-UP
Anche se la maggioranza delle recidive dei DTC ha luogo entro 5 anni dal trattamento iniziale (32), il follow-up deve essere esteso per tutta la vita, perché si possono verificare recidive anche alcune decadi dopo la diagnosi della neoplasia.
Elementi essenziali del follow-up sono la determinazione della Tg e l’ecografia del collo (33,34). La scintigrafia whole-body è importante nella stadiazione post-dose ablativa, ma ha un ruolo limitato nel follow-up a lungo termine: deve essere impiegata nei soli casi ad alto rischio o con sospetta recidiva di malattia (Tg sierica in incremento), in assenza di lesioni cervicali dimostrabili all’esame ecografico (1).
Gli accertamenti da eseguire nel corso del follow-up dipendono dalla risposta clinica iniziale al trattamento e dalla classe di rischio.
Follow-up a breve termine dopo trattamento iniziale (chirurgia e radioiodio)
In tutti i pazienti, nel primo anno dopo il trattamento iniziale (che sia lobectomia o tiroidectomia, con o senza terapia ablativa con 131I) misurare dopo 3 mesi TSH, FT4, Tg e Ab anti-Tg. L’obiettivo di TSH in questa fase andrà modulato sulla base della classe di rischio del paziente (cfr sopra). Successivamente la frequenza del monitoraggio della Tg dipenderà dalla risposta alla terapia e il dosaggio dovrebbe essere eseguito usando sempre lo stesso metodo (preferibile un metodo con sensibilità funzionale di 0.05-0.1 ng/mL). Nei pazienti con presenza di Ab anti-Tg, le concentrazioni sieriche di Tg da sole non possono essere utilizzate come marcatore per rilevare la persistenza o la recidiva di malattia. Con i nuovi e più sensibili test ultrasensibili di Tg (sensibilità funzionale < 0.1 ng/mL), le concentrazioni sieriche di Tg (misurate durante la terapia TSH-soppressiva con LT4) sono correlate alle concentrazioni di Tg stimolate da TSH ricombinante (rhTSH) e, pertanto, possono rendere superflua la necessità di misurazioni stimolate da rhTSH (35). L'interpretazione dei livelli sierici di Tg dipende dalla terapia iniziale e dalla presenza di Ab anti-Tg.
- Tiroidectomia + ablazione con 131I: in questi pazienti la risposta viene considerata ottimale se Tg non stimolata < 0.2 ng/mL (o stimolata con rhTSH < 1 ng/mL).
- Tiroidectomia senza ablazione con 131I: l'interpretazione della Tg dipende dalle dimensioni del residuo tiroideo. Molti pazienti hanno livelli basali di Tg non rilevabili (< 0.2 ng/mL), mentre valori in aumento nel tempo sono sospetti per la crescita del tessuto tiroideo o per il cancro.
- Lobectomia: sebbene non siano stati definiti criteri specifici per distinguere il tessuto tiroideo residuo normale dal cancro tiroideo persistente o recidivante, la maggior parte dei pazienti con risposta eccellente dovrebbe avere un livello di Tg sierica < 30 ng/mL e molti pazienti hanno livelli di Tg compresi tra 2 e 10 ng/mL.
- Presenza di anticorpi anti-Tg elevati: i valori di Tg sierica non sono affidabili in presenza di aumento del titolo di Ab anti-Tg, che può riscontrarsi nel 25% dei pazienti affetti da DTC (1). È opportuno procrastinare di alcuni mesi la ristadiazione prevista a 6-12 mesi, in attesa di una loro possibile normalizzazione. Le variazioni della concentrazione degli Ab anti-Tg possono essere usate come marcatore surrogato di malattia, posto che gli Ab siano determinati costantemente con lo stesso metodo. Generalmente, nei pazienti in remissione di malattia la negativizzazione degli Ab anti-Tg si verifica dopo una mediana di circa tre anni. La ricomparsa degli Ab anti-Tg dopo precedente negativizzazione o l’aumento del titolo anticorpale può essere indicativo di recidiva e/o persistenza di malattia.
- Imaging: nel primo anno dopo il trattamento del DTC (lobectomia, tiroidectomia con o senza ablazione con iodio radioattivo) si deve eseguire ecografia del collo, in genere a intervalli di 6-12 mesi a seconda della valutazione del rischio. Successivamente, la frequenza dell'US dipende dalla risposta alla terapia. La recidiva tumorale nel collo e la presenza di metastasi linfonodali può essere rilevata dall'esame clinico o dall'aumento delle concentrazioni sieriche di Tg, ma l'US è la tecnica più sensibile per la localizzazione (1,36). L’impiego della scintigrafia diagnostica con 131I non è indicata di routine e trova possibile applicazione solo in casi selezionati (1,20,24).
Follow-up a lungo termine
I controlli successivi dovranno essere previsti basandosi sulla risposta al trattamento iniziale e sui risultati dei controlli successivi, ridefinendo in maniera dinamica lo stato di malattia.
- Pazienti a basso rischio ATA con risposta eccellente alla terapia (Tg on L-T4 indosabile, Tg dopo stimolo < 1 ng/mL e US cervicale negativa per persistenza di malattia nel controllo 6-12 mesi dopo la terapia iniziale): controllo clinico ogni 12-18 mesi, con determinazione della Tg on L-T4 e degli Ab anti-Tg e con l’US del collo.
- I pazienti con risposta indeterminata hanno una minima possibilità di evoluzione verso una persistenza di malattia, per cui non necessitano di controlli frequenti e il trattamento con LT4 dovrà essere di tipo semi-soppressivo.
- I pazienti con risposta incompleta biochimica (in genere 10-20% in tutte le categorie di rischio) dovrebbero eseguire periodiche misurazioni di Tg e Ab anti-Tg on L-T4 e US del collo ogni 6-12 mesi. Il progressivo incremento dei valori di Tg con tempo di raddoppio < 12 mesi indica progressione rapida della malattia e richiede esami morfologici per valutare la presenza di malattia strutturale. Il test di stimolo della Tg con rhTSH può essere utile solo per ri-stadiare i pazienti, dopo terapie aggiuntive. In questi pazienti viene raccomandata la soppressione del TSH moderata (0.1-0.5 mIU/mL) o completa (< 0.1 mIU/mL), da individualizzare in accordo ai livelli di Tg e Ab anti-Tg e al loro trend di incremento.
- I pazienti con risposta strutturale incompleta necessitano di stretto follow-up, con esecuzione periodica di esami morfologici per valutare lo stato di malattia e il bisogno di un appropriato trattamento terapeutico. Il programma individuale di follow-up dovrebbe essere pianificato in base al diametro e al sito delle metastasi, alla captazione con 131I e in base all’intensità di captazione alla FDG-PET. Il TSH dovrebbe essere mantenuto indosabile (< 0.1 mU/L) (1).
BIBLIOGRAFIA
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Boucai L, Zafereo M, Cabanillas ME. Thyroid cancer: a review. JAMA 2024, 331: 425-3
- Yamazaki H, Sugino K, Katoh R, et al. Management of follicular thyroid carcinoma. Eur Thyroid J 2024, 13: e240146.
- Li M, Dal Maso L, Pizzato M, Vaccarella S. Evolving epidemiological patterns of thyroid cancer and estimates of overdiagnosis in 2013-17 in 63 countries worldwide: a population-based study. Lancet Diabetes Endocrinol 2024, 12: 824-36.
- Seib CD, Sosa JA. Evolving understanding of the epidemiology of thyroid cancer. Endocrinol Metab Clin North Am 2019, 48: 23-35.
- Vaccarella S, Franceschi S, Bray F, et al. Worldwide thyroid-cancer epidemic? The increasing impact of overdiagnosis. N Engl J Med 2016, 375: 614-7.
- Kitahara CM, Schneider AB. Epidemiology of thyroid cancer. Cancer Epidemiol Biomarkers Prev 2022, 31: 1284-97.
- Zhao H, Li H. Meta-analysis of ultrasound for cervical lymph nodes in papillary thyroid cancer: diagnosis of central and lateral compartment nodal metastases. Eur J Radiol 2019, 112: 14-21.
- Yeh MW, Bauer AJ, Bernet VA, et al. American Thyroid Association statement on preoperative imaging for thyroid cancer surgery. Thyroid 2015, 25: 3-14.
- Cho SJ, Suh CH, Baek JH, et al. Active surveillance for small papillary thyroid cancer: a systematic review and meta-analysis. Thyroid 2019, 29: 1399-1408.
- Barney BM, Hitchcock YJ, Sharma P, et al. Overall and cause-specific survival for patients undergoing lobectomy, near-total, or total thyroidectomy for differentiated thyroid cancer. Head Neck 2011, 33: 645-9.
- Abelleira E, Jerkovich F. Dynamic risk assessment in patients with differentiated thyroid cancer. Rev Endocr Metab Disord 2024, 25: 79-93.
- Mendelsohn AH, Elashoff DA, Abemayor E, St John MA. Surgery for papillary thyroid carcinoma. Is lobectomy enough? Arch Otolaryngol Head Neck Surg 2010, 136: 1055-61.
- Adam MA, Pura J, Gu L, et al. Extent of surgery for papillary thyroid cancer is not associated with survival. An analysis of 61,775 patients. Ann Surg 2014, 260: 601-5; discussion 605-7.
- Chen L, Wu YH, Lee CH, et al. Prophylactic central neck dissection for papillary thyroid carcinoma with clinically uninvolved central neck lymph nodes: a systematic review and meta-analysis. World J Surg 2018, 42: 2846-57.
- Eskander A, Merdad M, Freeman JL, Witterick IJ. Pattern of spread to the lateral neck in metastatic well-differentiated thyroid cancer: a systematic review and meta-analysis. Thyroid 2013, 23: 583-92.
- Lombardi D, Paderno A, Giordano D, et al. Therapeutic lateral neck dissection in well-differentiated thyroid cancer: analysis on factors predicting distribution of positive nodes and prognosis. Head Neck 2018, 40: 242-50.
- Avenia N, Vannucci J, Monacelli M, et al. Locally invasive thyroid cancer: options for a treatment. Updates Surg 2017, 69: 249-53.
- Russell MD, Kamani D, Randolph GW. Modern surgery for advanced thyroid cancer: a tailored approach. Gland Surg 2020, 9 suppl 2: S105-19.
- Filetti S, Durante C, Hartl D, et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019, 30: 1856-83.
- Amin MB, Greene FL, Edge SB, et al. The eighth edition AJCC cancer staging manual: continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA Cancer J Clin 2017, 67: 93-9.
- Mitchell AL, Gandhi A, Scott-Coombes D, Perros P. Management of thyroid cancer: United Kingdom national multidisciplinary guidelines. J Laryngol Otol 2016, 130: S150-60.
- Silberstein EB, Alavi A, Balon HR, et al. The SNMMI practice guideline for therapy of thyroid disease with 131I 3.0. J Nucl Med 2012, 53: 1633-51.
- Pacini F, Basolo F, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Ruel E, Thomas S, Dinan M, et al. Adjuvant radioactive iodine therapy is associated with improved survival for patients with intermediate-risk papillary thyroid cancer. J Clin Endocrinol Metab 2015, 100: 1529-36.
- Gubbi S, Al-Jundi M, Foerster P, et al. The effect of thyrotropin suppression on survival outcomes in patients with differentiated thyroid cancer: a systematic review and meta-analysis. Thyroid 2024, 34: 674-86.
- Biondi B, Cooper DS. Benefits of thyrotropin suppression versus the risks of adverse effects in differentiated thyroid cancer. Thyroid 2010, 20: 135-46.
- Kiess AP, Agrawal N, Brierley JD, et al. External-beam radiotherapy for differentiated thyroid cancer locoregional control: a statement of the American Head and Neck Society. Head Neck 2016, 38: 493-8.
- Fussey JM, Crunkhorn R, Tedla M, et al. External beam radiotherapy in differentiated thyroid carcinoma: a systematic review. Head Neck 2016, 38 suppl 1: E2297-305.
- Blomain E, Berta S, Hug N, et al. Radiotherapy for brain metastases from thyroid cancer: an institutional and national retrospective cohort study. Thyroid 2022, 32: 781-8.
- Dudzinski SO, Cabanillas ME, Hamidi S, et al. Definitive radiotherapy for oligometastatic and oligoprogressive thyroid cancer: a potential strategy for systemic therapy deferral. J Natl Compr Canc Netw 2024, 23: e247072.
- Durante C, Costante G, Filetti S. Differentiated thyroid carcinoma: defining new paradigms for postoperative management. Endocr Relat Cancer 2013, 20: R141-54.
- Leenhardt L, Erdogan MF, Hegedus L, et al. 2013 European Thyroid Association guidelines for cervical ultrasound scan and ultrasound-guided techniques in the postoperative management of patients with thyroid cancer. Eur Thyroid J 2013, 2: 147-59.
- Miyauchi A, Kudo T, Miya A, et al. Prognostic impact of serum thyroglobulin doubling-time under thyrotropin suppression in patients with papillary thyroid carcinoma who underwent total thyroidectomy. Thyroid 2011, 21: 707-16.
- Castagna MG, Tala Jury HP, Cipri C, et al. The use of ultrasensitive thyroglobulin assays reduces but does not abolish the need for TSH stimulation in patients with differentiated thyroid carcinoma. J Endocrinol Invest 2011, 34: e219-23.
- Torlontano M, Crocetti U, Augello G, et al. Comparative evaluation of recombinant human thyrotropin-stimulated thyroglobulin levels, 131I whole-body scintigraphy, and neck ultrasonography in the follow-up of patients with papillary thyroid microcarcinoma who have not undergone radioiodine therapy. J Clin Endocrinol Metab 2006, 91: 60-3.
Terapia chirurgica dei tumori tiroidei differenziati
Andrea Frasoldati°, Corrado Pedroni*, Davide Giordano*, Verter Barbieri*
Divisione ORL* e °UOC Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia.
Premesse
La tiroidectomia totale (TT) rappresenta il trattamento chirurgico standard del carcinoma tiroideo differenziato (differentiated thyroid carcinoma, DTC). Tuttavia, la sempre più frequente diagnosi ecografica e citologica di neoplasie di piccole dimensioni e la prognosi eccellente della malattia hanno negli ultimi anni alimentato la discussione circa l’opportunità di un approccio di tipo conservativo (1-5). In particolare, le principali linee-guida suggeriscono che l’emitiroidectomia, o la semplice lobectomia, possano essere sufficienti nel caso di neoplasie di piccole dimensioni, unifocali, in assenza di estensione extra-capsulare e/o di secondarietà linfonodali (6-10). Tali considerazioni si applicano sia nel caso della diagnosi citologica di carcinoma papillare (papillary thyroid carcinoma, PTC), sia nel caso del riscontro istologico di neoplasia a bassa aggressività, come la variante classica del PTC, o le forme minimamente invasive di carcinoma tiroideo follicolare (follicular thyroid carcinoma, FTC) e carcinoma a cellule di Hürtle (HTC) (6-10).
Un secondo argomento di accesa discussione è quello relativo alla chirurgia dei linfonodi del compartimento centrale nel paziente con PTC. Come è noto, tale neoplasia si caratterizza per un'elevata frequenza di metastasi linfonodali, e l'asportazione dei linfonodi del compartimento centrale (central neck dissection, CND) è stata da tempo proposta come misura necessaria anche in chiave profilattica, per conseguire una corretta stadiazione della neoplasia e una più elevata probabilità di guarigione (6-10). Analogamente a quanto si è verificato per l’estensione della chirurgia di T, il numero crescente di neoplasie diagnosticate in fase precoce, e in particolare, delle diagnosi pre-operatorie di microPTC, ha posto in discussione l’opportunità del ricorso sistematico alla CND, in assenza di un evidente coinvolgimento linfonodale, specie quando si consideri la potenziale morbilità associata a tale procedura (11-14). I seguenti paragrafi saranno pertanto dedicati a questi due controversi temi:
- l’approccio chirurgico al microcarcinoma papillare (microPTC)
- indicazioni, limiti e morbilità della CND.
Sarà inoltre dettagliatamente affrontato, in relazione agli argomenti sopra citati, il tema dello studio pre-operatorio del paziente con DTC.
In questo capitolo non si affrontano i temi di tecnica chirurgica relativi alla tiroidectomia totale e alla resezione dei linfonodi locoregionali.
Approccio chirurgico al microcarcinoma tiroideo papillare
I microPTC, cioè i carcinomi papillari di diametro < 1cm corrispondono a una quota significativa (~50%) dei PTC di nuova diagnosi (15-17); mentre un tempo essi costituivano nella quasi totalità dei casi un riscontro istologico incidentale (18), oggi sono in larga maggioranza (75-85%) diagnosticati in fase pre-operatoria, mediante agoaspirazione ecoguidata (19-20). Pertanto, poiché sempre più spesso siamo chiamati a formulare l’indicazione chirurgica in pazienti con evidenza ecografica e citologica di microPTC, dobbiamo domandarci quale tipo di intervento sia preferibile nel nostro paziente e quali siano i criteri che devono guidare la nostra scelta. Un approccio razionale a tale problema deve tenere conto dei seguenti fattori:
- la probabilità che il microPTC corrisponda ad una malattia multifocale bilaterale
- la probabilità che la neoplasia si estenda oltre la capsula tiroidea (= pT3)
- la probabilità che presenti metastasi linfonodali (N1).
Tutti questi elementi suggeriscono infatti una maggiore aggressività della neoplasia e giustificano l’adozione di una chirurgia più estensiva.
Dalla revisione delle principali casistiche di microPTC pubblicate negli ultimi anni, si ricava che la frequenza dei casi pT3 è mediamente del 25% (17-29%), analogamente a quanto avviene per i casi pN1 (15-30%), mentre le forme multifocali hanno una frequenza di poco superiore (23-35%), con un 15% (12-19%) di focalità bilaterale. Complessivamente, i pazienti con stadiazione pT1N0 costituiscono il gruppo prevalente (57-82%) (17, 21-26), ed è pertanto verosimile che l’adozione sistematica della tiroidectomia totale in tutti i pazienti con microPTC possa rappresentare un overtreatment per una quota di pazienti approssimativamente corrispondente al 50%. In altri termini, circa la metà dei pazienti con PTC di diametro < 1 cm potrebbe essere curata dalla sola emitiroidectomia.
L’ampia (900 pazienti) casistica di microPTC della Mayo Clinic dimostra che la percentuale di recidiva loco-regionale di malattia valutata a 10 e 20 anni dall’intervento non presenta differenze statisticamente significative tra i pazienti trattati con chirurgia monolaterale (9.8%) e quelli trattati con tiroidectomia totale o quasi-totale (5.5%) (24).
Analoga osservazione proviene dalle casistiche del Giappone, paese in cui da diversi anni l’emitiroidectomia rappresenta l’approccio chirurgico di elezione al microPTC. I dati pubblicati dal Cancer Institute Hospital di Tokyo, relativi a una serie di 450 pazienti trattati con chirurgia conservativa, mostrano un tasso di recidiva loco-regionale dell’8.0% vs. il 10.5% osservato nel gruppo di pazienti trattati con TT, con una sopravvivenza libera da malattia rispettivamente pari al 95.7% e all’89.2% (27).
I dati provenienti da due ampi studi multicentrici nordamericani forniscono risultati solo in apparenza contrastanti: infatti, il registro REER su 5432 pazienti non evidenzia differenze significative in termini di sopravvivenza tra i pazienti che hanno ricevuto una TT e quelli trattati con la sola lobectomia (28). L’analisi dei dati relativi agli oltre 52.000 pazienti del National Cancer Database mostrerebbe una diminuzione del rischio di recidiva e di mortalità nei pazienti trattati con TT, ma tale differenza assume rilevanza significativa solo nei pazienti con neoplasia di diametro > 1 cm (29).
Secondo alcuni autori, la chirurgia conservativa potrebbe essere proposta con sufficiente sicurezza non solo nei microPTC, ma in tutti i casi di DTC a basso rischio prognostico: in uno studio retrospettivo canadese su circa 200 pazienti con DTC di diametro > 1 cm, dei quali 126 sottoposti a chirurgia conservativa, e seguiti per un follow-up medio di 10 anni, l’incidenza di recidiva loco-regionale risultava 1.9% nei pazienti a basso rischio sottoposti a chirurgia conservativa, una percentuale inaspettatamente più bassa di quella osservata nei pazienti a basso rischio sottoposti a TT (30).
Nel loro insieme, i dati sopra riportati suggeriscono che l’adozione di un approccio chirurgico conservativo rappresenti una scelta del tutto adeguata nei pazienti con microPTC o più in generale nei pazienti con malattia intratiroidea e non estesamente plurifocale.
Il problema è naturalmente quello di disporre, prima dell’intervento, di elementi sufficienti per una corretta stratificazione prognostica del paziente, poiché anche nell’ambito dei microPTC una minoranza di pazienti presenterà una malattia capace di progressione (23,25,26,31). Due recenti studi retrospettivi entrambi provenienti dalla Cina indicano l’opportunità di eseguire una chirurgia estensiva (TT e CND) nei pazienti con microPTC multifocale aventi un diametro complessivo > 10 mm o il diametro della focalità principale ≥ 7 mm (32-33).
| Tabella 1. Caratteristiche cliniche dei microcarcinomi papillari in alcune delle principali casistiche della letteratura |
|||||||
| Autore | N | Diagnosi pre-chirurgica | < 5 mm | pT3 | pN1 | Multifocalità | Bilateralità |
| Baudin 1998 | 281 | 32.8% | 49% | 15% | 43% | 40% | 16% |
| Hay 2008 | 900 | 40% | ? | 2%* | 30% | 23% | 12% |
| Chow 2003 | 203 | ND | 34.6% | 20.7% | 24.6% | 31% | ND |
| Roti 2006 | 243 | 79.6% | 35% | 17% | 13% | 32% | 19% |
| Mercante 2009 | 445 | 83.5% | 34.2% | 29.9% | 25.6% | 35% | 13.5% |
* La casistica della Mayo Clinic comprende unicamente neoplasie con Grade 1
Nelle casistiche più recenti la quota delle diagnosi pre-chirurgiche è di circa l’80%, circa il doppio di quanto descritto nelle precedenti. La frequenza delle forme bilaterali è mediamente circa il 15%.
| Tabella 2. Frequenza di recidiva locoregionale in rapporto al tipo di trattamento chirurgico in alcune casistiche di microPTC |
||||
| Autore | N | Follow-up medio (anni) | Trattati con chirurgia monolaterale (%) | Frequenza di recidive (chirurgia monolaterale vs bilaterale) |
| Hay 1992 | 535 | 16 | 39 (7.4%) | 11.8 vs 1.8% |
| Baudin 1998 | 281 | 4.3 | 86 (30.6% | 8.2 vs 2.3% |
| Chow 2003 | 203 | 8.4 | 16 (7.9%) | 12.5 vs 5.3% |
| Hay 2008 | 900 | 17.2 | 135 (14%) | 9.8 vs 5.5% |
| Mercante 2009 | 445 | 5.3 | 41 (9.2%) | 0 vs 3.2% |
La significatività del confronto statistico è limitata dalla numerosità nettamente più contenuta dei casi trattati con chirurgia conservativa.
Studio pre-operatorio
Come abbiamo visto, il trattamento chirurgico del paziente con DTC deve essere pianificato sulla base della stadiazione pre-operatoria della malattia e in particolare della sua estensione loco-regionale (1-2, 6-8, 34-36). Tali informazioni nella maggior parte dei casi vengono ricavate dallo studio ecografico della regione cervicale; l’ecografia è infatti la tecnica dotata della maggiore sensibilità nell'individuazione delle metastasi linfonodali cervicali (37-42). A dimostrazione di ciò, l’impiego sistematico dell'ecografia pre-operatoria ha prodotto la riduzione del tasso di recidiva loco-regionale di malattia (37, 43-46).
L’ecografia deve fornire sede, dimensioni e ubicazione del tumore primitivo (T); in particolare, dovranno essere valutati i segni o gli indizi di infiltrazione e/o superamento della capsula tiroidea, di multifocalità e soprattutto di bilateralità della neoplasia. L’esatta localizzazione del focolaio neoplastico individuato mediante esame citologico (es. terzo superiore, medio o inferiore del lobo, porzione anteriore o posteriore, laterale o mediale) può facilitare l’individuazione della lesione durante l’intervento, particolarmente utile nei casi di patologia multinodulare nei quali sia richiesto un accertamento istologico intra-operatorio. Anche nelle mani più esperte, tuttavia, l’individuazione certa di una minima estensione extra-capsulare della malattia non può essere confermata né esclusa con certezza dall’ecografia: il potere predittivo positivo (PPV) di un giudizio ecografico di superamento capsulare corrisponde infatti al 55-80% (46,48-51). Nell’individuazione della malattia bilaterale, l’ecografia ottiene risultati lusinghieri con un PPV del 70-100% (45,47-50).
Il punto centrale dello studio ecografico pre-operatorio è rappresentato dalla valutazione di N (51). Come è noto, il compartimento centrale (livelli VI-VII) è certamente l’area maggiormente coinvolta dalle metastasi del DTC (52-56); tuttavia, lo studio ecografico di tale distretto anatomico prima della tiroidectomia non presenta purtroppo elevata accuratezza, facendo registrare numerosi falsi negativi (36-42, 44-51, 57,58). Come discuteremo nel paragrafo dedicato alla CND, la limitata sensibilità dell’ecografia nella valutazione pre-tiroidectomia dei linfonodi del compartimento centrale costituisce uno degli argomenti “forti” a favore della CND profilattica. Lo studio ecografico del compartimento laterale, completato nei casi dubbi/sospetti da esame citologico e dosaggio intra-lesionale di tireoglobulina, è invece di indiscussa importanza, perché la dimostrazione di metastasi latero-cervicali pone indicazione allo svuotamento del compartimento linfatico latero-cervicale (lateral neck dissection = LND) (37-39, 43-45, 59, 60). I livelli più frequentemente ed estesamente coinvolti dalle metastasi del DTC sono nell’ordine il III, il IV e il II, mentre Il V livello è interessato in una quota limitata di casi, in genere caratterizzati da estesa metastatizzazione degli altri livelli (52-56,59-66). Il coinvolgimento del compartimento laterale si realizza tipicamente in associazione a quello del compartimento centrale, ma esiste la possibilità di localizzazioni laterali isolate (“skip metastasis”) (54,59,67). La sensibilità dell’ecografia nell’individuare le metastasi linfonodali nel compartimento laterale è nettamente superiore a quanto riportato per il compartimento centrale (75-90% vs. 25-50%) (36-42,44-51,57,58).
E’ indispensabile che le informazioni raccolte dalla stadiazione ecografica vengano collegialmente valutate dall’equipe multispecialistica, al fine di formulare l’indicazione chirurgica più appropriata. Questa dovrà sempre essere esaustivamente discussa con il paziente, al quale andranno rappresentati rischi e benefici potenziali associati alle diverse opzioni disponibili. Inoltre, deve essere sottolineato che l’ecografia non esaurisce naturalmente le opzioni di indagini strumentali, che possono rendersi opportune in sede pre-chirurgica. In particolare, la TC con mezzo di contrasto può essere occasionalmente utile a meglio definire i rapporti della neoplasia con gli altri organi cervico-mediastinici e in particolare a evidenziare o escludere l’eventualità di un'infiltrazione tracheale o esofagea.
Un promettente contributo alla discussione inerente l’estensione della chirurgia nel PTC si basa sul ruolo della mutazione di BRAF come fattore predittivo prognostico. Secondo numerosi studi, la mutazione di BRAF sarebbe associata a neoplasie maggiormente aggressive, più suscettibili di atteggiamenti infiltrativi, e gravate da un aumentato rischio di persistenza e/o recidiva di malattia (68-71). E’ stato pertanto suggerito che nei pazienti con carcinoma papillare BRAF+ trovino sempre indicazione la TT e la CND, indipendentemente dalla dimensioni della neoplasia e dall'assenza di segni di multifocalità ed invasività loco-regionale nello studio pre-operatorio. In altre parole, la dimostrazione pre-operatoria della mutazione di BRAF, consentendo di etichettare il paziente come a rischio prognostico elevato, autorizzerebbe la pianificazione di un approccio chirurgico più aggressivo (72-73).
La chirurgia di N nel compartimento centrale (CND = central neck dissection)
Secondo quanto indicato dalle principali linee-guida (6-8), la CND è:
- sempre raccomandata in caso di evidenza pre- o intra-chirurgica di metastasi linfonodali;
- consigliata ma opzionale in presenza di neoplasie con estensione extra-capsulare (pT3), quando non vi sia evidenza macroscopica di metastasi linfonodali;
- non indicata in presenza di neoplasie di piccole dimensioni, ben differenziate e senza caratteri invasivi (pT1).
Pertanto, se la CND trova indicazione in tutti i pazienti con coinvolgimento linfonodale evidente in fase pre- o intra-operatorio, resta a tutt’oggi controversa l’indicazione alla chirurgia profilattica sistematica, mono- o bilaterale, del compartimento centrale, come testimoniano le numerose recenti rassegne sull’argomento (11-14, 74-79).
Gli elementi a favore della CND profilattica possono essere così riassunti:
- la CND sistematica offre la possibilità di stadiare in modo più accurato la neoplasia, identificando metastasi che sono spesso occulte alla valutazione ecografica pre-operatoria (11-13,14, 80);
- la persistenza di metastasi linfonodali non riconosciute e quindi asportate in occasione della prima chirurgia, sarebbe alla base di una quota predominante dei casi di “recidiva” loco-regionale di malattia, con conseguente necessità di un re-intervento (7,11,14,44,48,81,82). In particolare, uno studio svedese su 195 pazienti seguiti per un lungo periodo di follow-up (mediana = 13 anni) indicherebbe che la recidiva loco-regionale è correlata a un rischio aumentato di mortalità e che la CND migliora i dati di sopravvivenza (83);
- i livelli post-intervento di tireoglobulina (Tg) risultano significativamente più bassi nei pazienti sottoposti a CND (84);
- in mani esperte, la CND profilattica non causerebbe un incremento significativo della morbilità chirurgica (85,86).
In realtà, i dati della letteratura su quest’ultimo aspetto sono controversi: in numerosi studi, infatti, la CND si associa a una maggiore incidenza di paralisi cordale e/o di ipoparatiroidismo permanente (87-91). Tra le possibili cause di tali discrepanze, è che la definizione anatomica della CND non è univoca come quella della LND: la procedura seguita in diversi centri può pertanto non essere del tutto sovrapponibile. Inoltre, l’adozione della CND monolaterale piuttosto che bilaterale, dato non sempre chiaramente esplicitato in tutti gli studi, può determinare un diverso grado di morbilità (79). Le casistiche basate sulla CND unilaterale documentano infatti una frequenza di ipocalcemia permanente piuttosto limitata, pari allo 0-1.8% (84,85,92).
Nella casistica retrospettiva del nostro centro (1052 pazienti) il ricorso alla CND ipsi – o bilaterale non sembra comportare un incremento significativo dell'incidenza di danno ricorrenziale (rispettivamente 0.5% e 2.3%) rispetto alla sola TT (1.0%) (93). Invece, la CND bilaterale, ma non quella monolaterale, determina un aumento del rischio di lesione su base traumatica o ischemica delle paratiroidi, con un incremento significativo dell’ipoparatiroidismo permanente rispetto a quanto osservato con la sola TT (16.2% vs. 6.3%) (93).
Contro la CND profilattica, oltre ad una maggiore morbilità, l’altro argomento forte è costituito dall’assenza di un beneficio clinico certo (11,13,75,78,79). In uno studio su 266 pazienti seguiti per un follow-up medio di circa 7 anni, la frequenza delle recidive regionali appariva del tutto confrontabile nei pazienti sottoposti alla sola TT (85.6%) e in quelli sottoposti a CND (88.2%) (94). Nell’esperienza del gruppo dell’MD Anderson (Houston, Texas, USA), oltre il 60% dei 210 casi sottoposti a reintervento nel compartimento centrale per persistenza/recidiva di malattia erano già stati sottoposti a CND terapeutica o profilattica in occasione della prima chirurgia, ad indicare la dubbia efficacia di tale approccio (95). Lo studio, in accordo con precedenti evidenze della letteratura (96,97) fornisce indirettamente un altro elemento di segno contrario all’opportunità della CND sistematica, poiché dimostra che:
- la seconda chirurgia sul compartimento centrale non costituisce un intervento gravato da una maggiore morbilità: nella casistica dell’MD Anderson la frequenza di ipoparatiroidismo e di danno ricorrenziale non riconducibile all’infiltrazione neoplastica del nervo risulta infatti rispettivamente pari all’1% e allo 0.2% (95);
- la necessità di reintervenire sul compartimento centrale non pregiudica il conseguimento di un pieno controllo della malattia, con il 98% dei pazienti rioperati libero da malattia nel follow-up di lungo periodo (95).
Alcuni autori sottolineano l’importanza di limitare la CND ai pazienti a rischio più elevato di recidiva loco-regionale di malattia. In uno studio retrospettivo condotto dal gruppo dell’Università di Istanbul su 343 pazienti con PTC sottoposti a TT senza CND e seguiti per un follow-up medio di 9 (±4) anni, i casi di recidiva loco-regionale di malattia erano 22 (6%) e i casi fatali 5 (2%) (98). L’età > 60 anni, il diametro del tumore primitivo > 3 cm, l’estensione microscopica extra-capsulare della neoplasia e le varianti istologiche dotate di maggiore aggressività costituivano i fattori di rischio per recidiva loco-regionale e mortalità, ad indicare l’opportunità di riservare la CND ai casi che presentano tali caratteristiche (98).
Come indicato nel paragrafo dedicato allo studio pre-operatorio del paziente, la ricerca della mutazione di BRAF potrebbe nel prossimo futuro costituire un efficace strumento per la stratificazione prognostica del paziente e quindi anche per il planning chirurgico (72,73).
Nei pazienti a basso rischio prognostico con studio ecografico pre-operatorio negativo, la CND potrebbe essere riservata secondo alcuni autori solo ai casi in cui valutazione clinica dei linfonodi del compartimento centrale in corso di intervento risulta dubbia o sospetta (81,99). La dissezione del compartimento centrale viene cioè in questi casi sostituita da una esplorazione chirurgica, che in assenza di rilievo di linfonodi sospetti può concludersi senza ulteriori manipolazioni, con rischio ridotto di complicanze. Nella serie di 304 pazienti sottoposti a TT per diagnosi citologica di PTC studiati presso il Rhode Island Hospital (Providence, USA), i pazienti non sottoposti a CND sulla base di questo tipo di approccio erano il 63%. Nei 161 pazienti di questo gruppo considerati a basso rischio prognostico, solo 3 (1.8%) presentavano evidenza ecografica di persistenza di malattia nel compartimento centrale nella valutazione a sei mesi dall’intervento (81).
Un approccio bilanciato rispetto alle due opposte posizioni (CND bilaterale sistematica vs CND solo nei casi di evidenza macroscopica pre- o intra-operatoria di metastasi linfonodali) è rappresentato dal ricorso alla CND monolaterale, cioè la dissezione del solo compartimento centrale ipsilaterale alla sede della neoplasia primitiva. Nei pazienti con tumore di diametro < 1-2 cm, apparentemente limitati a un unico lobo e senza evidenza pre- o intra-chirurgica di metastasi ipsilaterali, la probabilità di metastasi controlaterali risulta assai limitata (92,100). La dimensione della neoplasia primitiva, in particolare, sembra costituire un fattore di rischio indipendente per la presenza di metastasi nel compartimento centrale controlaterale (101). Al tempo stesso, la morbilità operatoria, in particolare l’ipocalcemia del post-operatorio, risulta in alcuni studi significativamente più contenuta in caso di CND monolaterale (86,93).
Considerazioni conclusive
- In presenza di una diagnosi citologica certa di DTC, la TT rappresenta sempre un'opzione giustificata.
- Nei casi di tumori di piccole dimensioni ( < 1.0 cm), senza evidenza di bilateralità e/o coinvolgimento linfonodale e/o evidente estensione extra-capsulare, la sola lobectomia tiroidea può rappresentare un provvedimento altrettanto adeguato rispetto alla TT. La tendenza prevalente nella maggior parte dei paesi occidentali favorisce un uso estensivo della TT. La stadiazione ecografica pre-chirurgica e la disponibilità di marcatori biomolecolari in grado di fornire indicazioni sul comportamento prognostico della neoplasia consentiranno con tutta probabilità nei prossimi anni un ampliamento della quota di pazienti con microPTC trattati con modalità conservativa.
- In mancanza di studi prospettici e controllati di lungo periodo, la cui esecuzione appare peraltro irrealistica, la controversia sul trattamento chirurgico ottimale dei linfonodi del compartimento centrale appare destinata a restare priva di una risposta definitiva (74-76, 102-103). Possono essere sintetizzati i seguenti concetti generali:
- il ricorso alla CND sistematica espone il paziente ad un rischio aumentato di morbilità post-chirurgica, in particolare di ipoparatiroidismo permanente. Tale rischio è ridotto quando la procedura viene eseguita in centri con elevata esperienza e ciò suggerisce di limitare un impiego diffuso ed estensivo della CND;
- L’adozione della CND monolaterale si associa ad una minore morbilità rispetto alla CND bilaterale e può rappresentare l’opzione preferenziale in molti pazienti con evidenza pre-chirurgica di PTC monolaterale di piccole dimensioni;
- la CND ricopre un ruolo protettivo nei confronti della recidiva loco-regionale di malattia nei pazienti a maggiore rischio prognostico. La sua efficacia resta dubbia nel caso di neoplasie di minori dimensioni (es. microPTC);
- Nei prossimi anni, lo sforzo della ricerca clinica dovrà essere quello di identificare con la maggiore accuratezza possibile i criteri clinico-ecografici e biomolecolari in grado di individuare i pazienti suscettibili di beneficiare della CND mono- o bilaterale, consentendo la definizione di protocolli di trattamento patient-tailored.
Bibliografia
- Elaraj DM. Clark OH. Changing management in patients with papillary thyroid cancer. Curr Treat Opin Oncol 2007, 8: 305-13.
- Suliburk J, Delbridge L. Surgical management of well-differentiated thyroid cancer: state of the art. Surg Clin North Am 2009, 89: 1171-91.
- Sippel RS, Chen H. Controversies in the Surgical Management of Newly Diagnosed and Recurrent/Residual Thyroid Cancer. Thyroid 2009, 19: 1373-80.
- Pacini F, Castagna MG. Approach to and treatment of differentiated thyroid carcinoma. Med Clin North Am 2012, 96: 369-83.
- Momesso DP, Vaisman F, Cordeiro de Noronha Pessoa CH, et al. Small differentiated thyroid cancer: Time to reconsider clinical management and treatment. Surg Oncol 2012, 21: 257-62.
- Cooper DS, Doherty GM, Haugen BR et al, American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167–214.
- Hartl DM, Travagli J-P. The updated ATA guidelines for management of thyroid nodules and differentiated thyroid cancer: the surgical perspective. Thyroid 2009, 19: 1149-51.
- Pacini F, Castagna MG, Brilli L, et al, ESMO Guidelines Working Group. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010, 21 Suppl 5: 214-9.
- Clerici T, Kolb W, Beutner U, et al. German Association of Endocrine Surgeons. Diagnosis and treatment of small follicular thyroid carcinomas. Br J Surg 2010, 97: 839-44.
- NCCN Practice guidelines in Oncology. Thyroid carcinoma. version 3.2012.
- Shaha AR. Prophylactic central compartment dissection in thyroid cancer: a new avenue of debate. Surgery 2009, 146: 1224-7.
- Mazzaferri EL, Doherty GM, Steward DL. The pros and cons of prophylactic central compartment lymph node dissection for papillary thyroid carcinoma. Thyroid 2009, 19: 683-9.
- Carling T, Long III WD, Udelsman R. Controversy surrounding the role of routine central lymph node dissection for differentiated thyroid cancer. Curr Opin Oncol 2010, 22: 30-4.
- Zeiger MA. Evolution in the surgical management of well differentiated thyroid cancer: to dissect or not dissect the central lymph node compartment. J Surg Oncol 2010, 101: 101-2.
- Davies L, Welch J. Increasing Incidence of Thyroid Cancer in the United States, 1973-2002. JAMA 2006, 295: 2164-7.
- Enewold L, Zhu K, Ron E, et al. Rising Thyroid Cancer Incidence in the United States by Demographic and Tumor Characteristics, 1980-2005. Cancer Epidemiol Biomarkers Prev 2009, 18: 784-91.
- Bernet V. Approach to patient with incidental papillary microcarcinoma. J Clin Endocrinol Metab 2010, 95: 3586-92.
- Bradly DP, Reddy V, Prinz RA, et al. Incidental papillary carcinoma in patients treated surgically for benign thyroid diseases. Surgery 2009, 146: 1099-104.
- Kent WDT, Hal FH, Isotalo PA, et al. Increased incidence of differentiated thyroid carcinoma and detection of subclinical disease. Can Med Ass J 2007, 177: 1357-61.
- Elisei R, Molinaro E, Agate L, et al. Are the Clinical and Pathological Features of Differentiated Thyroid Carcinoma Really Changed over the Last 35 Years? Study on 4187 Patients from a Single Italian Institution to Answer this Question. J Clin Endocrinol Metab 2010, 95: 1516–27.
- Baudin E, Travagli JP, Ropers J, et al. Microcarcinoma of the Thyroid Gland. The Gustave-Roussy Institute Experience. Cancer 1998, 83: 553–9.
- Hay ID. Papillary Thyroid Microcarcinoma: A Study of 535 Cases Observed in a 50 year Period. Surgery 1992, 112: 1139-46, discussion 1146-7.
- Chow SM, Law SCK, Chan JKC, et al. Papillary Microcarcinoma of the Thyroid—Prognostic Significance of Lymph Node Metastasis and Multifocality. Cancer 2003, 98: 31–40.
- Roti E, Rossi R, Trasforini G et al. Clinical and Histological Characteristics of Papillary Thyroid Microcarcinoma: Results of a Retrospective Study in 243 Patients. J Clin Endocrinol Metab 2006, 91: 2171–8.
- Hay ID, Hutchinson ME, Gonzalez-Losada T, et al. Papillary thyroid microcarcinoma: A study of 900 cases observed in a 60-year period. Surgery 2008, 144: 980-8.
- Mercante G, Frasoldati A, Pedroni C, et al. Prognostic Factors Affecting Neck Lymph Node Recurrence and Distant Metastasis in Papillary Microcarcinoma of the Thyroid: Results of a Study in 445 Patients. Thyroid 2009, 19: 1-10.
- Sugitani I, Fujimoto Y. Management of low-risk papillary thyroid carcinoma: unique conventional policy in Japan and our efforts to improve the level of evidence. Surg Today 2010, 40: 199-215.
- Haigh PI, Urban DR, Rotstein LE. Extent of thyroidectomy is not a major determinant of survival in low- or high-risk papillary thyroid cancer. Ann Surg Oncol 2005, 12: 81-9.
- Bilimoria KY, Bentrem Dj, Ko CY, et al. Extent of surgery affects survival for papillary thryoid cancer. Ann Surg 2007, 246: 375-84.
- Hassanain M, Wexler M. Conservative management of well-differentiated thyroid cancer. Can J Surg 2010, 53: 109-18.
- Lin JD, Chen ST, Chao TC, et al. Diagnosis and therapeutic strategy for papillary thyroid microcarcinoma. Arch Surg 2005, 140: 940-5.
- Zhao Q, Ming J, Liu C, et al. Multifocality and Total Tumor Diameter Predict Central Neck Lymph Node Metastases in Papillary Thyroid Microcarcinoma. Ann Surg Oncol 2012, Sep 13. [Epub ahead of print]
- Zhou YL, Gao EL, Zhang W, et al. Factors predictive of papillary thyroid micro-carcinoma with bilateral involvement and central lymphnode metastasis: a retrospective study. World J Surg Oncol 2012, 10: 67-72.
- Grant CS, Stulak JM, Thompson GB, et al. Risks and adequacy of an optimized surgical approach to the primary surgical management of papillary thyroid carcinoma treated during 1999-2006. World J Surg 2010, 34: 1239-46.
- Choi JS, Kim J, Kwak JY, et al. Preoperative staging of papillary thyroid carcinoma: comparison of ultrasound imaging and CT. AJR Am J Roentgenol 2009, 193: 871-8.
- King AD. Imaging for staging and management of thyroid cancer. Cancer Imaging 2008, 25: 57-69.
- Kouvaraki MA, Shapiro SE, Fornage BD, et al. Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer. Surgery 2003, 134: 946-54.
- Ito Y, Tomoda C, Uruno T, et al. Preoperative ultrasonographic examination for lymphnode metastasis: usefulness when designing lymph node dissection for papillary microcarcinoma of the thyroid. World J Surg 2004, 28: 498-501.
- Stulak JM, Grant CS, Farley DR, et al. Value of preoperative ultrasonography in the surgical management of initial and reoperative papillary thyroid cancer. Arch Surg 2006, 141: 489-94; discussion 494-6.
- Kim E, Park JS, Son KR, et al. Preoperative diagnosis of cervical metastatic lymph nodes in papillary thyroid carcinoma: comparison of ultrasound, computed tomography, and combined ultrasound with computed tomography. Thyroid 2008, 18: 411-8.
- Sipos JA. Advances in ultrasound for the diagnosis and management of thyroid cancer. Thyroid 2009, 9: 1363-72.
- Lew JI, Solorzano CC. Use of ultrasound in the management of thyroid cancer. Oncologist 2010, 15: 253-8.
- Sugitani I, Fujimoto Y, Yamada K, et al. Prospective outcomes of selective lymph node dissection for papillary thyroid carcinoma based on preoperative ultrasonography. World J Surg 2008, 32: 2494-502.
- Roh JL, Park JY, Kim JM, et al. Use of preoperative ultrasonography as guidance for neck dissection in patients with papillary thyroid carcinoma. J Surg Oncol 2009, 99: 28-31.
- González HE, Cruz F, O'Brien A, et al. Impact of preoperative ultrasonographic staging of the neck in papillary thyroid carcinoma. Arch Otolaryngol Head Neck Surg 2007, 133: 1258-62.
- Marshall CL, Lee JE, Xing Y, et al. Routine pre-operative ultrasonography for papillary thyroid cancer: effects on cervical recurrence. Surgery 2009, 146: 1063-72.
- Park JS, Son KR, Na DG, et al. Performance of preoperative sonographic staging of papillary thyroid carcinoma based on the sixth edition of the AJCC/UICC TNM classification system. AJR Am J Roentgenol 2009, 192: 66-72.
- Choi JS, Kim J, Kwak JY, et al. Preoperative staging of papillary thyroid carcinoma: comparison of ultrasound imaging and CT. AJR Am J Roentgenol 2009, 193: 871-8.
- Moon HJ, Yoon JH, Kwak JY, et al. Positive predictive value and interobserver variability of preoperative staging sonography for thyroid carcinoma. AJR Am J Roentgenol 2011, 197: W324-30.
- Choi JS, Chung WY, Kwak JY, et al. Staging of Papillary Thyroid Carcinoma with Ultrasonography: Performance in a Large Series. Ann Surg Oncol 2011, 18: 3572-8.
- Sohn Y-M, Kwak JY, Kim E-K, et al. Diagnostic Approach for Evaluation of Lymph Node Metastasis From Thyroid Cancer Using Ultrasound and Fine-Needle Aspiration Biopsy. AJR 2010, 194: 38-43.
- Gimm O, Rath FW, Fralle H. Pattern of lymph node metastases in papillary thyroid carcinoma. Br J Surg 1998, 85: 252-4.
- Sivanandan R, Soo KC. Pattern of cervical lymph node metastases from papillary carcinoma of the thyroid. Br J Surg 2001, 88: 1241-4.
- Yüce I, Ça?l? S, Ali Bayram A, et al. Regional metastatic pattern of papillary thyroid carcinoma. Eur Arch Oto-Rhino-Laryngol 2010, 267: 437-41.
- Mirallié E, Visset J, Sagan C, et al. Localization of cervical node metastasis of papillary thyroid carcinoma. World J Surg 1999, 23: 970-3; discussion 973-4.
- Takada H, Kikumori T, Imai T, et al. Patterns of lymph node metastases in papillary thyroid carcinoma: results from consecutive bilateral cervical lymph node dissection. World J Surg 2011, 35: 1560-6.
- Ahuja AT, Chow L, Chick W, et al. Metastatic cervical nodes in papillary carcinoma of the thyroid: ultrasound and histological correlation. Clin Radiol 1995, 50: 229-31.
- Wu LM, Gu HY, Qu XH, et al. The accuracy of ultrasonography in the preoperative diagnosis of cervical lymph node metastasis in patients with papillary thyroid carcinoma: A meta-analysis. Eur J Radiol 2012, 81: 1798-805.
- Chung YS, Kim JY, Bae JS, et al. Lateral lymph node metastasis in papillary thyroid carcinoma: results of therapeutic lymph node dissection. Thyroid 2009, 19: 241-6.
- Clark OH. Thyroid cancer and lymph node metastases. J Surg Oncol 2011, 103: 615–8.
- Wada N, Duh QY, Sugino K et al. Lymph node metastasis from 259 papillary thyroid microcarcinomas: frequency, pattern of occurrence and recurrence, and optimal strategy for neck dissection. Ann Surg 2003, 237: 399-407.
- Kupferman ME, Patterson M, Mandel SJ, et al. Patterns of lateral neck metastasis in papillary thyroid carcinoma. Arch Otolaryngol Head Neck Surg 2004, 130: 857-60.
- Caron NR, Tan YY, Ogilvie JB, et al. Selective modified radical neck dissection for papillary thyroid cancer – is level I, II and V dissection always necessary? World J Surg 2006, 30: 833-40.
- Yanir Y, Doweck I. Regional metastases in well-differentiated thyroid carcinoma: pattern of spread. Laryngoscope 2008, 118: 433-6.
- Kupferman ME, Weinstock YE, Santillan AA, et al. Predictors of level V metastasis in well-differentiated thyroid cancer. Head Neck 2008, 30: 1469-74.
- Roh J-L, Kim J-M, Park C. Lateral Cervical Lymph Node Metastases from Papillary Thyroid Carcinoma: Pattern of Nodal Metastases and Optimal Strategy for Neck Dissection. Ann Surg Oncol 2008, 15: 1177-82.
- Machens A, Holzhausen H-J, Dralle H. Skip metastases in thyroid cancer leaping the central lymph node compartment. Arch Surg 2004, 139: 43-5.
- O'Neill CJ, Bullock M, Chou A, et al. BRAF (V600E) mutation is associated with an increased risk of nodal recurrence requiring reoperative surgery in patients with papillary thyroid cancer. Surgery 2010, 148: 1139–45; discussion 1145–6.
- Kwak JY, Kim EK, Chung WY, et al. Association of BRAFV600E mutation with poor clinical prognostic factors and US features in Korean patients with papillary thyroid microcarcinoma. Radiology 2009, 253: 854–60.
- Nikiforova MN, Nikiforov YE. Molecular diagnostics and predictors in thyroid cancer. Thyroid 2009, 19: 1351–61.
- Hwang J, Shin JH, Han BK, et al. Papillary thyroid carcinoma with BRAFV600E mutation: sonographic prediction. AJR Am J Roentgenol 2010, 194: W425–30.
- Xing M, Clark D, Guan H, et al. BRAF mutation testing of thyroid fine-needle aspiration biopsy specimens for preoperative risk stratification in papillary thyroid cancer. J Clin Oncol 2009, 27: 2977–82.
- Yip L, Nikiforova MN, Carty SE, et al. Optimizing surgical treatment of papillary thyroid carcinoma associated with BRAF mutation. Surgery 2009, 146: 1215–23.
- Vergez S, Sarini J, Percodani J et al. Lymph node management in clinically node-negative patients with papillary thyroid carcinoma. Eur J Surg Onc 2010, 36: 777-82.
- Zetoune T, Keutgen X, Buitrago D et al. Prophylactic Central Neck Dissection and Local Recurrence in Papillary Thyroid Cancer: A Meta-analysis. Ann Surg Oncol 2010, 17: 3287-93.
- Hughes DT, Doherty GM. Central neck dissection for papillary thyroid cancer. Cancer Control 2011, 18: 83-8.
- Wong KP, Lang BH. The Role of Prophylactic Central Neck Dissection in Differentiated Thyroid Carcinoma: Issues and Controversies. J Oncol 2011; 2011: 127929.
- Iyer NG, Shaha AR. Central compartment dissection for well differentiated thyroid cancer … and the band plays on. Curr Opin Otolaryngol Head Neck Surg 2011, 19: 106-12.
- Cooper DS, Tufano RP. Prophylactic Central Neck Dissection in Differentiated Thyroid Cancer: A Procedure in Search of an Indication. Thyroid 2012, 22: 341-3.
- Shindo M, Wu JC, Park EE, et al. The importance of central compartment elective lymph node excision in the staging and treatment of papillary thyroid cancer. Arch Otolaryngol Heah Neck Surg 2006, 132: 650-4.
- Monchik JM, Simon CJ, Caragacianu DL, et al. Does failure to perform prophylactic level VI node dissection leave persistent disease detectable by ultrasonography in patients with low-risk papillary carcinoma of the thyroid? Surgery 2009, 146: 1182-7.
- Sadowski BM, Snyder SK, Lairmore TC. Routine bilateral central lymph node clearance for papillary thyroid cancer. Surgery 2009, 146: 696-703; discussion 703-5.
- Tisell LE, Nilsson B, Molne J, et al. Improved Survival of Patients with Papillary Thyroid Cancer after Surgical Microdissection. World J Surg 1996, 20: 854–9.
- Sywak M, Cornford L, Roach P, et al. Routine ipsilateral level VI lymphadenectomy reduces postoperative thyroglobulin levels in papillary thyroid cancer. Surgery 2006, 140: 1000-7.
- Shindo M, Stern A. Total thyroidectomy with and without selective central compartment dissection. Archiv Otolaryngol Head Neck Surg 2010, 136: 584-7.
- Palestini N, Borasi A, Cestino L, et al. Is central neck dissection a safe procedure in the treatmentof papillary thyroid cancer? Our experience. Langenbecks Arch Surg 2008, 393: 693–8.
- Henry JF, Gramatica L, Denizot A, et al. Morbidity of profilactic lymph node dissection in the central neck area in patients with papillary thyroid carcinoma. Langenbecks Arch Surg 1998, 383: 165-9.
- Cheah WK, Arici C, Ituarte PH, et al. Complications of neck dissection for thyroid cancer. World J Surg 2002, 26: 1013-6.
- Roh JL, Park JY, Park CI. Total thyroidectomy plus neck dissection in differentiated papillary thyroid carcinoma patients: pattern of nodal metastasis, morbidity, recurrence and postoperative levels of serum PTH. Am Surg 2007, 245: 604-10.
- Cavicchi O, Piccin O, Caliceti U, et al. Transient hypoparathyroidism following thyroidectomy: a prospective study and multivariate anlalysis of 604 consecutive patients. Otolaryngol Head Neck Surg 2007, 137: 654-8.
- Rosenbaum MA, McHenry CR. Central Neck Dissection for Papillary Thyroid Cancer. Arch Otolaryngol Head Neck Surg 2009, 135: 1092-7.
- Lee YS, Kim SW, et al. Extent of routine central lymph node dissection with small papillary thyroid carcinoma. World J Surg 2007, 31: 1954-9.
- Giordano D, Valcavi R, Thompson GB, et al. Complications of central neck dissection in patients with papillary thyroid carcinoma: results of a study on 1087 patients and review of the literature. Thyroid 2012, 22: 911-7.
- Zuniga S, Sanabria A. Prophylactic Central Neck Dissection in Stage N0 Papillary Thyroid Carcinoma. Arch Otolaryngol Head Neck Surg 2009, 135: 1087-91.
- Clayman GL, Agarwal G, Edeiken BS, et al. Long-Term Outcome of Comprehensive Central Compartment Dissection in Patients with Recurrent/Persistent Papillary Thyroid Carcinoma. Thyroid 2011, 21: 1309-16.
- Kim MK, Mandel SH, Langer JE, et al. Morbidity Following Central Compartment Reoperation for Recurrent or Persistent Thyroid Cancer. Arch Otolaryngol Head Neck Surg 2004, 130: 1214-6.
- Alvarado R, Sywak MS, Delbridge L, Sidhu SB. Central lymph node dissection as a secondary procedure for papillary thyroid cancer: Is there added morbidity? Surgery 2009, 145: 514-8.
- Giles Y, Tunca F, Boztepe H, et al. The long term outcome of papillary thyroid carcinoma patients without primary central lymph node dissection: expected improvement of routine dissection. Surgery 2009, 146: 1188-95.
- Shen WT, MD, Ogawa L, Ruan D, et al. Central neck lymph node dissection for papillary thyroid cancer: the reliability of surgeon judgment in predicting which patients will benefit. Surgery 2010, 148: 398-403.
- Moon T-A, Umunna B, Kato M, et al. Ipsilateral Versus Bilateral Central Neck Lymph Node Dissection in Papillary Thyroid Carcinoma. Ann Surg 2009, 250: 47–52.
- Koo BS, Choi EC, Yoon YH, et al. Predictive factors for ipsilateral or contralateral central lymph node metastasis in unilateral papillary thyroid carcinoma. Ann Surg 2009, 249: 840-4.
- Shan CX, Zhang W, Jiang DZ, et al. Routine central neck dissection in differentiated thyroid carcinoma: a systematic review and meta-analysis. Laryngoscope 2012, 122: 797-804.
- Carling T, Carty SE, Ciarleglio MM, et al. American Thyroid Association Design and Feasibility of a Prospective Randomized Controlled Trial of Prophylactic Central Lymph Node Dissection for Papillary Thyroid Carcinoma. Thyroid 2012, 22: 237-44.
Terapia medico-nucleare dei tumori differenziati tiroidei
Massimo Salvatori
Istituto di Medicina Nucleare, Università Cattolica del S. Cuore-Roma
(aggiornato al 12 giugno 2022)
Dopo quasi 80 anni dal primo impiego, la terapia con radioiodio (131I) gioca ancora un ruolo fondamentale nella gestione del carcinoma differenziato della tiroide (DTC) con recenti innovazioni e cambiamenti, come l’indicazione personalizzata in base al rischio individuale, le nuove modalità di preparazione del paziente, l’impiego di attività di radioiodio differenti rispetto al passato e l’uso dell’imaging ibrido [tomografia computerizzata per emissione di fotone singolo/tomografia computerizzata (SPECT/CT) e tomografia per emissione di positroni/tomografia computerizzata (PET/TC)] per la diagnosi di metastasi o a fini prognostici (1).
Negli ultimi anni sono stati meglio compresi i meccanismi di accumulo cellulare del radioiodio, in particolare il rapporto con l’espressione sulla membrana cellulare del Sodio-Iodio Symporter (NIS) (2), ed è stato introdotto il concetto di refrattarietà alla terapia con radioiodio con introduzione della terapia con inibitori molecolari delle tirosin-chinasi (TKI) (3).
Questo capitolo mira a fare il punto sugli aspetti generali e clinici della terapia con 131I del DTC, con riferimento a quanto riportato nelle più recenti linee guida (4-9) e consensus nazionali (10) ed internazionali (11):
- la prima parte analizza le basi molecolari della terapia con 131I, le tre tipologie in cui viene classificata, la preparazione del paziente e le indagini diagnostiche pre-trattamento;
- la seconda parte tratta le modalità di somministrazione del radioiodio, la scintigrafia corporea globale con attività terapeutica di 131I (TxWBS), la valutazione della risposta al trattamento, i rischi ed effetti collaterali della terapia e gli aspetti legislativi;
- la terza parte, relativa al trattamento ablativo e adiuvante, illustra le indicazioni e le attività da somministrare;
- la quarta parte affronta il tema della terapia delle metastasi loco-regionali e a distanza, dei pazienti con Tg elevata e imaging negativo e dei DTC refrattari al radioiodio.
Aspetti generali della terapia con radioiodio (parte I)
Massimo Salvatori
Istituto di Medicina Nucleare, Università Cattolica del S. Cuore-Roma
(aggiornato al 12 giugno 2022)
BASI MOLECOLARI DELLA TERAPIA CON RADIOIODIO
La terapia con radioiodio rappresenta in medicina nucleare il prototipo delle terapie molecolari e costituisce il primo e più noto esempio di teragnostica, parte della medicina di precisione finalizzata al trattamento personalizzato del paziente, in cui il 131I viene utilizzato per imaging molecolare (grazie all’emissione di fotoni gamma) e per radioterapia molecolare (in virtù dell’emissione di particelle beta).
Dopo la prima somministrazione a scopo clinico di una dose terapeutica di radioiodio da parte di Saul Hertz nel gennaio 1941, per più di 50 anni il radioiodio è stato ampiamente utilizzato per la diagnosi e il trattamento del DTC senza che se ne conoscessero a fondo i meccanismi di accumulo nelle cellule tiroidee normali e tumorali (1).
La clonazione nel 1996 del Sodio-Iodio Symporter (NIS), glicoproteina di membrana costituita da 643 amminoacidi, responsabile del trasporto attivo di due molecole di sodio contro una di iodio, ha reso più chiare le basi molecolari dell’accumulo del radioiodio nella cellula tiroidea normale e tumorale. L’efficacia della terapia con radioiodio è altamente dipendente dall’espressione del NIS sulla membrana cellulare tiroidea, cosa che avviene in più del 70% dei DTC (2). Il NIS è scarsamente o per nulla espresso nei carcinomi tiroidei poco differenziati e nelle forme anaplastiche, in cui viceversa si osserva una elevata espressione del trasportatore di membrana di tipo 1 per il glucosio (GLUT-1), presupposto molecolare all’impiego diagnostico in questi tumori della PET/TC con 18F-fluoro-desossiglucosio (FDG PET/TC) (2).
L’espressione del NIS nelle cellule follicolari tiroidee è modulata principalmente dal TSH attraverso la via dell’AMP ciclico, presupposto della stimolazione endogena o esogena del TSH prima della somministrazione di radioiodio a fini diagnostici e terapeutici. Oltre che nelle cellule tiroidee, è presente una moderata espressione di NIS anche nelle ghiandole salivari, nella mucosa gastrica, nell’intestino tenue, nei dotti naso-lacrimali e nella mammella in fase di allattamento (2).
MODALITÀ DI TERAPIA CON RADIOIODIO
Dopo iniziale tiroidectomia totale o near-total, il radioiodio può essere somministrato a fini terapeutici con tre diverse finalità: trattamento ablativo, trattamento adiuvante e terapia di metastasi iodo-captanti loco-regionali o a distanza (4) (tab 1).
| Tabella 1 Terapia con radioiodio del carcinoma differenziato della tiroide: tipologia e scopo delle diverse modalità di trattamento |
||||
| Facilitare il follow-up | Migliorare | |||
| stadiazione iniziale | DFS | DSS | ||
| Trattamento ablativo | + | + | ||
| Trattamento adiuvante | + | + | + | |
| Terapia delle metastasi | + | + | + | + |
| DFS: disease free survival, sopravvivenza libera da malattia DSS: disease specific survival, sopravvivenza specifica da malattia |
||||
Il trattamento ablativo non ha solo lo scopo di eliminare il residuo tiroideo, ma è finalizzato soprattutto a facilitare il successivo follow-up con dosaggio della tireoglobulina (Tg) e a migliorare la stadiazione iniziale attraverso la TxWBS.
Il trattamento adiuvante, eseguito sempre dopo iniziale tiroidectomia totale, si differenzia da quello ablativo per l’impiego di un’attività di radioiodio più elevata, al fine di eliminare la malattia residua sospettata ma non provata, soprattutto in pazienti ad alto rischio di recidiva di malattia. Tale trattamento, oltre che a facilitare il follow-up e aumentare l’accuratezza della stadiazione iniziale, tende anche a migliorare la sopravvivenza libera da malattia (DFS).
La terapia delle metastasi iodo-captanti loco-regionali o a distanza ha lo scopo di migliorare la DFS e la sopravvivenza tumore-specifica (DSS), eliminando o riducendo il carico di malattia residua.
Le indicazioni e l’attività di radioiodio da utilizzare nel trattamento ablativo e adiuvante verranno trattate nella terza parte, mentre quelle relative alla terapia delle metastasi nella quarta parte di questo capitolo.
PREPARAZIONE DEL PAZIENTE
Prima della somministrazione di radioiodio a scopo diagnostico o terapeutico, il paziente deve essere adeguatamente preparato, in maniera da ottimizzare la prestazione.
Stimolazione del TSH
Allo scopo di aumentare l’accumulo di radioiodio nella cellula tiroidea normale o tumorale attraverso una maggiore espressione del NIS, è necessario raggiungere un livello ematico di TSH ≥ 30 mUI/L. Questo può essere ottenuto in due differenti maniere.
La stimolazione per via endogena prevede la sospensione della terapia ormonale sostitutiva, che può essere effettuata secondo due schemi (analoghi in termini di raggiungimento dei livelli ematici di TSH necessari e di efficacia ablativa):
- sospensione della L-tiroxina 4 settimane prima del trattamento;
- sospensione della L-tiroxina 6 settimane prima del trattamento, con somministrazione di triiodotironina in tre dosi quotidiane frazionate nelle prime 4 settimane.
La stimolazione per via esogena avviene attraverso la somministrazione di tireotropina alfa umana ricombinante (rhTSH, Thyrogen®), forma altamente purificata di TSH ottenuta con tecnica del DNA ricombinante. Mentre il paziente continua la terapia con L-T4, vengono somministrate, attraverso iniezione i.m. in due giorni consecutivi, due dosi da 0.9 mg di rhTSH, seguite dalla somministrazione di radioiodio al terzo giorno. In questo modo si ottiene un pronto ed elevato innalzamento del TSH ematico, con successiva rapida scomparsa (4).
Indicazione e contro-indicazioni all’uso di rhTSH. Per la preparazione al trattamento ablativo con attività da 30 a 100 mCi (da 1.1 a 3.7 GBq) nei pazienti sottoposti a tiroidectomia sub-totale o totale che non presentano metastasi a distanza rhTSH e sospensione della terapia ormonale sono equivalenti, perché le normali cellule tiroidee presentano elevata espressione di NIS altamente funzionante e non richiedono prolungata stimolazione del TSH per un adeguato accumulo e ritenzione di 131I. Due studi clinici prospettici randomizzati di non inferiorità hanno dimostrato che, in termini di efficacia ablativa, la preparazione con rhTSH non è inferiore alla sospensione della terapia ormonale in caso di ablazione con 30 mCi e 100 mCi (12-13).
Il tessuto neoplastico metastatico tiroideo è invece più disomogeneo rispetto al normale tessuto tiroideo, mostra minore densità cellulare e possiede NIS meno funzionante. In caso di terapia delle metastasi, per ottenere elevato accumulo e adeguata ritenzione tumorale di 131I è quindi necessario un prolungato innalzamento del TSH nel tempo, che si ottiene soltanto attraverso la sospensione della terapia ormonale. L’uso del rhTSH non è stato infatti approvato in presenza di metastasi a distanza, ad eccezione dei seguenti casi:
- incapacità a raggiungere adeguati livelli di TSH (≥ 30 mUI/L) con stimolazione endogena per condizioni cliniche concomitanti (ad es. ipopituitarismo, metastasi funzionanti);
- gravi condizioni cliniche potenzialmente aggravate dall’ipotiroidismo iatrogeno, come:
- anamnesi positiva per ictus o TIA;
- franca cardiomiopatia (classe NYHA III o IV);
- severa insufficienza renale (stadio ≥ 3);
- disturbi psichiatrici gravi (depressione grave, psicosi).
Dieta ipoiodica ed interferenza da farmaci o prodotti iodati
L’esposizione ad eccessive quantità di iodio stabile può influenzare negativamente l’accumulo di attività diagnostiche o terapeutiche di radioiodio. Può essere prescritta una dieta ipoiodica, da seguire per 1-2 settimane prima della terapia con 131I e finalizzata ad ottenere bassi livelli di ioduria (idealmente ≤ 50 µg/die), ma la sua utilità non è dimostrata in maniera univoca e non esistono studi prospettici che abbiano determinato il cut-off di ioduria sopra il quale viene compromessa l’efficacia del trattamento con radioiodio (14). Non è ugualmente noto quale sia la dieta migliore né la durata del tempo di osservazione delle prescrizioni dietetiche. In caso di dieta ipoiodica, è importante non ridurre l’assunzione di sale non iodato, poiché questo può comportare una condizione di iposodiemia, soprattutto in pazienti sottoposti a sospensione della terapia ormonale (4).
Nella programmazione del trattamento è inoltre importante indagare su possibili esposizioni ad alte dosi di iodio stabile proveniente da m.d.c. radiologici organo-iodati o da farmaci come l’amiodarone (14). Quando si sospetti un significativo carico di iodio, può essere eseguita la misura della ioduria prima del trattamento, in maniera routinaria o in casi selezionati (14).
Test di gravidanza per donne in età fertile e allattamento al seno
In caso di trattamento di donne in età fertile, prima della somministrazione di radioiodio, è necessario ottenere un test di gravidanza negativo nelle 72 ore precedenti, ad eccezione ovviamente dei casi di pregressa isterectomia o di donne in fase post-menopausale (4). In donne con parto recente, l’eventuale allattamento al seno dovrebbe essere sospeso per escludere un possibile accumulo nelle mammelle di radioiodio per espressione mammaria di NIS (4). Considerando l’elevata radio-sensibilità del tessuto mammario, per donne che abbiano allattato di recente, può essere consigliabile eseguire prima della terapia una scintigrafia diagnostica con 123I o con bassa dose di 131I per escludere la presenza di accumulo mammario di radioiodio ed in caso positivo ritardare la somministrazione terapeutica di 131I (4).
DIAGNOSTICA PRE-TRATTAMENTO
L’indicazione al trattamento ablativo o adiuvante viene posta in base alla categoria di rischio del paziente e allo stato di malattia post-operatorio, tramite:
- dosaggio della tireoglobulina, in corso di terapia con L-T4 (Tg on L-T4) e/o dopo stimolazione del TSH (TSH-Tg);
- ecografia del collo;
- in casi selezionati scintigrafia corporea globale con attività diagnostica di radioiodio (DxWBS).
Considerando l’emivita di 1-3 giorni, il dosaggio della Tg, insieme con quello degli anticorpi anti-Tg (AbTg), deve essere eseguito non prima di 3-4 settimane dall’intervento chirurgico, quando quasi tutti i pazienti raggiungono il nadir. Il valore predittivo della Tg è influenzato da numerosi fattori, come l’entità del tessuto tiroideo residuo (funzione del tipo di intervento chirurgico eseguito e della sua radicalità), l’eventuale presenza di metastasi loco-regionali o a distanza, il livello del TSH al momento del dosaggio, la sensibilità funzionale del kit utilizzato, il cut-off impiegato e il tempo trascorso dalla tiroidectomia totale (4,5). Ad oggi non sono stati definiti con certezza i livelli di Tg on L-T4 e di TSH-Tg utili a porre indicazione al trattamento ablativo con radioiodio. In generale, i livelli post-operatori di Tg sono più utili per identificare i pazienti che possono beneficiare del trattamento che nell’identificare quelli che non richiedono ablazione. Ad esempio, un valore di Tg > 5–10 ng/mL in un paziente che per categoria di rischio non sarebbe candidato al trattamento suggerisce l’utilità di un trattamento ablativo allo scopo di migliorare la stadiazione iniziale e favorire il follow-up. Viceversa, in un paziente classificato ad alto rischio e quindi candidato al trattamento ablativo, un valore di Tg < 1 ng/mL non esclude la potenziale presenza di malattia residua e quindi la possibilità di omettere il trattamento. In un paziente classificato a basso rischio, un valore di Tg post-operatoria < 1 ng/mL tende invece generalmente a confermare la sua corretta classificazione (5).
L’ecografia del collo è la metodica più efficace nell’identificare la malattia strutturale e risulta particolarmente utile dopo tiroidectomia in caso di sospette metastasi linfonodali loco-regionali residue. Valutando i risultati dell’ecografia in maniera combinata con l’esame citologico da ago-aspirato (FNA) e la Tg si ottiene un’accuratezza diagnostica prossima al 100%. I limiti dell’ecografia comprendono la dipendenza dall’operatore, l’elevata frequenza del rilievo di immagini non specifiche e la difficoltà o impossibilità di studiare strutture profonde o ostacolate da ossa o aria (4,5).
Il DxWBS fornisce informazioni sull’entità del normale tessuto tiroideo residuo e sull’eventuale presenza di metastasi iodo-captanti linfonodali o a distanza (15). L’esecuzione del DxWBS prima del trattamento ablativo con radioiodio viene omessa in alcuni Centri per almeno tre motivi:
- scarso impatto sulla decisione di trattare il paziente, che viene presa in genere in base alla categoria di rischio del paziente e ai valori di Tg post-tiroidectomia;
- timore di provocare stunning del tessuto tiroideo, con possibile ridotta efficacia del trattamento. Per questo, nel caso venga eseguito, si raccomanda di somministrare una bassa attività di 131I (o di utilizzare, se disponibile, il 123I) e di ridurre a 24-48 ore l’intervallo di tempo tra DxWBS e terapia con 131I;
- la sua sensibilità nel diagnosticare metastasi è di molto inferiore a quella del TxWBS (4).
In altri Centri viene regolarmente eseguito, perché le informazioni ottenute con il DxWBS possono modificare la stadiazione del rischio, la decisione se eseguire o meno la terapia con 131I e la strategia da seguire nel follow-up a lungo termine (15). L’impiego della SPECT/TC in corso di DxWBS permette di aumentare in maniera significativa l’accuratezza diagnostica della metodica, definendo meglio sede, numero e natura delle lesioni, soprattutto in aree critiche come la regione del collo, dove aiuta a distinguere il residuo presente in loggia tiroidea dalle metastasi linfonodali loco-regionali (15).
La FDG PET/TC viene oggi utilizzata soprattutto nel follow-up di pazienti che dopo trattamento iniziale presentano TxWBS negativo ma elevati livelli di Tg ematica circolante (generalmente > 10 ng/mL) (16). Può comunque essere indicata anche prima della somministrazione della terapia con 131I, ma solo in pazienti con DTC ad alto rischio accuratamente selezionati, nei quali si sospetti la presenza di metastasi non iodo-captanti. In questi casi, i risultati della metodica risultano complementari a quelli ottenuti con TxWBS, evidenziando lesioni FDG-positive non-iodocaptanti e permettendo a volte di modificare la gestione (17).
La PET/TC con 124I viene impiegata in pochi Centri per il calcolo dosimetrico dell’attività da somministrare, soprattutto in pazienti con metastasi a distanza. Problematiche legate all’approvvigionamento del 124I e l’assenza di evidenze cliniche e di valutazioni di costo/efficacia rendono attualmente assai limitato il suo impiego (18).
BIBLIOGRAFIA
- McCready VR. Radioiodine - the success story of Nuclear Medicine: 75th Anniversary of the first use of Iodine-131 in humans. Eur J Nucl Med Mol Imaging 2017, 44: 179-82.
- Portulano C, Paroder-Belenitsky M, Carrasco N. The Na+/I− symporter (NIS): mechanism and medical impact. Endocr Rev 2014, 35: 106–49.
- Schlumberger M, Brose M, Elisei R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes Endocrinol 2014, 2: 356–8.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Filetti S, Durante C, Hartl D, et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019, 30: 1856–83.
- Haddad RI, Nasr C, Bischoff L, et al. NCCN guidelines insights: thyroid carcinoma, version 2.2018. J Natl Compr Canc Netw 2018, 16: 1429-40.
- Mitchell AL, Gandhi A, Scott-Coombes D, et al. Management of thyroid cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016, 130 suppl S2: S150–60.
- Avram AM, Giovanella L, Greenspan B, et al. SNMMI procedure standard/EANM practice guideline for nuclear medicine evaluation and therapy of differentiated thyroid cancer: abbreviated version. J Nucl Med 2022, 63: 15N-35N.
- Luster M, Clarke SE, Dietlein M, et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. European Association of Nuclear Medicine (EANM). Eur J Nucl Med Mol Imaging 2008, 35: 1941-59.
- Pacini F, Basolo, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Pacini F, Fuhrer D, Elisei R, et al. ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J 2022, 11: e210046.
- Mallick U, Harmer C, Yap B, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med 2012, 366: 1674–85.
- Schlumberger M, Catargi B, Borget I, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med 2012, 366: 1663–73.
- Jury HPT, Castagna MG, Fioravant C, et al. Lack of association between urinary iodine excretion and successful thyroid ablation in thyroid cancer patients. J Clin Endocrinol Metab 2010, 95: 230-7.
- Avram AM, Fig LM, Frey KA, et al. Preablation 131-I scans with SPECT/CT in postoperative thyroid cancer patients: what is the impact on staging? J Clin Endocrinol Metab 2013, 98: 1163-71.
- Salvatori M, Biondi B, Rufini V. Imaging in endocrinology: 2-[18F] -fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography in differentiated thyroid carcinoma: clinical indications and controversies in diagnosis and follow-up. Eur J Endocrinol 2015, 173: R115-30.
- Rizzo A, Perotti G, Zagaria L, et al. 18F-FDG PET/CT concurrent with first radioiodine post-therapeutic scan in high risk differentiated thyroid cancer: a useful tool or just an expensive diversion? Q J Nucl Med Mol Imaging 2022, DOI: 10.23736/S1824-4785.22.03364-7.
- Weber M, Binse I, Nagarajah J, et al. The role of 124I PET/CT lesion dosimetry in differentiated thyroid cancer. Q J Nucl Med Mol Imaging 2019, 63: 235-52.
Aspetti generali della terapia con radioiodio (parte II)
Massimo Salvatori
Istituto di Medicina Nucleare, Università Cattolica del S. Cuore-Roma
(aggiornato al 12 giugno 2022)
MODALITÀ DI SOMMINISTRAZIONE DEL RADIOIODIO
Il radiofarmaco utilizzato e registrato per la terapia del DTC è lo 131I in forma di ioduro di sodio, per la cui preparazione è opportuno utilizzare sistemi automatici di dispensazione e attuare norme che minimizzino il rischio di dispersione della radioattività nell’ambiente. Nella quasi totalità dei casi il radiofarmaco viene somministrato per via orale in forma di capsule, formulazione preferibile dal punto di vista radio-protezionistico, in quanto riduce la possibilità di contaminazione degli operatori e dell’ambiente dovuta alla seppur minima volatilità del prodotto. In alternativa, può essere utilizzata la formulazione in soluzione liquida, che consente di calibrare con maggiore facilità l’attività da somministrare, riduce l’irraggiamento della parete gastrica per un più rapido assorbimento e permette un’agevole somministrazione anche nei pazienti che presentano difficoltà a deglutire. È possibile ricorrere anche alla somministrazione per via endovenosa, da prendere in considerazione in pazienti con vomito incoercibile, difficoltà di deglutizione o non collaboranti.
SCINTIGRAFIA CORPOREA GLOBALE DOPO TERAPIA
Dopo la somministrazione di terapia con radioiodio viene eseguita una scintigrafia corporea globale (TxWBS) per diagnosticare eventuali metastasi iodo-captanti loco-regionali o a distanza (1) (fig 1). La metodica presenta elevata sensibilità diagnostica (superiore a quella della Tg) ed è spesso in grado di svelare metastasi non note, permettendo un accurato restaging della malattia, una modifica dell’iniziale stratificazione prognostica e una personalizzazione del trattamento e del successivo follow-up. È stato riportato che in pazienti a rischio intermedio o elevato è in grado di rilevare metastasi in una percentuale di pazienti compresa tra il 6% e il 13% (1). La TxWBS viene normalmente eseguita a distanza di 3-7 giorni dal trattamento, anche se la cinetica del radioiodio nelle diverse lesioni può essere differente ed alcune possono essere rilevate con imaging precoce, mentre altre con rilevazioni tardive. In uno studio che ha confrontato immagini ottenute tre e sette giorni dopo la somministrazione del trattamento, nell’80.5% dei casi è stata riportata concordanza tra le immagini precoci e tardive, nel 7.5% dei casi le immagini precoci fornivano più informazioni rispetto a quelle tardive e nel 12% dei casi le immagini tardive fornivano più informazioni rispetto a quelle precoci (2).

Figura 1
Scintigrafia corporea globale dopo terapia con 131I (TxWBS) in paziente con residuo tiroideo e metastasi ossea del rachide lombare
A sinistra: immagine whole-body di tipo planare. Si può osservare, a partire dall’alto, residuo nel letto tiroideo, attività nello stomaco, metastasi ossea del rachide lombare (freccia) e radioattività vescicale
A destra: le immagini SPECT/TC nei piani assiale, coronale e sagittale permettono di meglio localizzare la metastasi ossea presente nel rachide lombare (freccia)
L’accuratezza diagnostica del TxWBS può essere ulteriormente migliorata con l’impiego della tomografia computerizzata per emissione di fotone singolo/tomografia computerizzata (SPECT/TC) (fig 1). A confronto con l’imaging planare, la SPECT/TC rivela un maggior numero di lesioni (maggiore sensibilità), distingue meglio fisiologiche zone di captazione del radioiodio da sedi di malattia (migliore specificità) e mette in evidenza metastasi in sedi non attese (3,4). La SPECT/TC suggerisce a volte l’approccio terapeutico più opportuno verso una determinata lesione e riduce il ricorso ad altre forme di imaging tomografico (TC, RM, FDG PET/TC) (4).
RISPOSTA AL TRATTAMENTO
Dopo tiroidectomia totale il paziente con DTC viene stratificato in base al rischio di mortalità tumore-specifica (predetto dal sistema di classificazione TNM) e al rischio di malattia residua o di recidiva, stimato con il sistema di classificazione dell’American Thyroid Association (ATA) che prevede tre categorie di rischio (basso, intermedio ed elevato) (1). Questa iniziale classificazione, definita “statica”, guida la terapia post-chirurgica e l’inziale follow-up e può essere modificata in base alla risposta al trattamento.
Dopo 6-18 mesi il paziente viene riclassificato con un sistema di classificazione definito “dinamico”, basato sul risultato del dosaggio della Tg, degli AbTg e dell’imaging diagnostico (5). Il tipo di risposta al trattamento guida il follow-up a lungo termine e suggerisce la necessità e la tipologia di eventuali ulteriori trattamenti. Dopo tiroidectomia e trattamento ablativo con radioiodio, vengono utilizzate quattro categorie per definire il tipo di risposta al trattamento iniziale (1) (tab 1).
| Tabella 1 Classificazione della risposta alla tiroidectomia totale e terapia con 131I |
|
| Risposta al trattamento | Dati clinici, biochimici e strutturali |
| Eccellente o completa | Non evidenza di malattia clinica, biochimica (AbTg indosabili e Tg < 0.2 ng/mL o TSH-Tg < 1 ng/mL) o strutturale |
| Biochimica incompleta | Livelli dosabile di Tg (Tg ≥ 1 ng/mL o TSH-Tg ≥ 10 ng/mL) o AbTg in crescita, senza evidenza strutturale di malattia |
| Strutturale incompleta | Persistenza o evidenza di malattia loco-regionale o a distanza |
| Indeterminata | Dati biochimici o strutturali non chiaramente classificabili |
Risposta eccellente al trattamento iniziale viene definita una situazione in cui l’imaging è negativo e la Tg e gli AbTg sono indosabili (1). Se la risposta è eccellente, la probabilità di recidiva è (5):
- per pazienti inizialmente classificati a basso rischio prossima allo zero;
- per pazienti inizialmente classificati a rischio intermedio intorno all’1-2%;
- per pazienti inizialmente classificati a rischio elevato può arrivare al 14%.
Risposta biochimica incompleta, definita dalla presenza di livelli dosabili di Tg evidenti 6-8 mesi dopo il trattamento iniziale, viene riscontrata in circa il 10% dei pazienti a basso rischio e nel 20% dei pazienti a rischio intermedio (1). Tale situazione clinica è generalmente monitorata con il dosaggio ogni 6-12 mesi di Tg e AbTg e con la valutazione non del singolo risultato ma del loro andamento temporale:
- livelli di Tg stabili o in declino nel tempo sono indicativi di remissione e fino a due terzi di questi pazienti entrano nel gruppo di risposta eccellente senza necessità di ulteriori trattamenti;
- livelli crescenti nel tempo di Tg saranno altamente sospetti per persistenza/recidiva di malattia e dovranno essere valutati con ecografia ed eventualmente altre indagini strumentali. L’incremento nel tempo degli AbTg è associato ad aumentato rischio di recidiva, mentre un rapido tempo di raddoppio della Tg (< 12 mesi) è associato non solo a recidiva ma anche a possibile prognosi severa (5).
Risposta strutturale incompleta è definita dalla presenza di residuo di malattia, localizzato il più delle volte nel collo ed evidenziato attraverso tecniche di imaging (1). L’ecografia e l’FNA (con eventuale dosaggio della Tg nel liquido di lavaggio) rappresentano le metodiche di riferimento per sospetta recidiva nel collo. In caso di metastasi a distanza, il DxWBS permette di dimostrare la presenza e l’entità di accumulo di radioiodio, suggerendo l’opportunità o meno di una terapia con 131I. La TC e la FDG PET/TC permettono di definire sede, numero, dimensioni e metabolismo delle lesioni. La scelta tra quale tra le due metodiche utilizzare e la necessità o meno di impiegare m.d.c. dipende dalla sede delle lesioni, mentre la frequenza con cui impiegare la TC è determinata dal tasso di crescita del tumore. La FDG PET/TC permette di studiare rapidamente il corpo intero e fornisce informazioni non solo di tipo diagnostico ma anche prognostico (6). Lesioni FDG-positive sono, infatti, probabilmente resistenti al radioiodio anche se la sola positività alla FDG PET-TC non permette di escludere il ricorso alla terapia con 131I. Inoltre, anche il riscontro di un accumulo di FDG di elevata intensità non è sicuramente indicativo di rapida progressione di malattia.
Per risposta indeterminata si intende la presenza di alterazioni aspecifiche all’imaging o al dosaggio di Tg e AbTg, situazione osservata nel 12-23% dei pazienti a rischio-basso intermedio. Nell’80-90% di questi casi il successivo follow-up non mostra recidiva clinica o strumentale di malattia (1,5). Rimane non chiara l’importanza clinica di un valore di Tg basso ma dosabile, che a volte può essere spiegato con il dosaggio della TSH-Tg. Il test eseguito dopo alcuni anni dall’iniziale trattamento permette di riclassificare la maggior parte delle risposte indeterminate in risposte eccellenti (5). Come ricordato, molto importante è l’andamento nel tempo dei valori di Tg e AbTg, anche per stabilire la frequenza con cui eseguire gli accertamenti (generalmente condotti su base annuale) e per porre indicazione all’uso dell’ecografia del collo o di altre tecniche di imaging (1,5).
RISCHI ED EFFETTI COLLATERALI
In base all’epoca di comparsa, vengono classificati e divisi in precoci e tardivi, sebbene alcuni dei rischi classificati come precoci possano apparire più tardivamente rispetto a quando attesi (tab 2). La terapia con 131I è sicura e presenta un rischio molto basso di complicanze, ma è fondamentale essere certi che i benefici siano superiori ai potenziali rischi, specialmente in caso di somministrazione di trattamenti multipli con elevate attività cumulative e nei pazienti giovani.
| Tabella 2 Potenziali rischi ed effetti collaterali della terapia con 131I del DTC |
|
| Precoci | Tardivi |
|
Nausea da gastrite e vomito. |
Leucemia e secondi tumori. |
Effetti precoci
Possono comparire nei primi giorni o nelle prime settimane dopo la terapia, sono più frequenti in caso di elevate attività di 131I utilizzate per metastasi a distanza, sono generalmente reversibili, possono essere facilmente gestiti e per la loro comparsa sono necessari elevati valori di dose assorbita da parte dei normali organi o tessuti (8).
Gli effetti sull’apparato gastro-enterico, come nausea da gastrite e vomito, possono comparire 4-12 ore dopo la somministrazione di 131I e si risolvono in genere entro 36-48 ore. Possono essere prevenuti utilizzando anti-emetici e lassativi, che riducono la dose di radiazione all’apparato gastro-enterico e al corpo intero.
Le ghiandole salivari esprimono NIS, concentrando iodio 30-40 volte più del sangue, e questo può portare alla comparsa, con incidenza variabile, di scialo-adenite con possibile successiva xerostomia. Per prevenire o ridurne la severità, vengono utilizzati diversi metodi, come l’idratazione, l’uso di succo di limone o di chewing gum e agenti colinergici, anche se non esistono evidenze né a favore né contro la loro efficacia (1).
Elevate attività di 131I, come dose singola o cumulativa, possono comportare il rischio di ostruzione del dotto naso-lacrimale, con possibile epifora e predisposizione allo sviluppo di infezioni.
Molto rara è la comparsa di tiroidite da radiazioni, con modesta, transitoria dolorabilità nel collo ed edema della regione in pazienti con ampio residuo tiroideo, complicanza che può essere facilmente risolta o limitata con l’uso per pochi giorni di farmaci anti-infiammatori steroidei e non.
Quando la dose di radiazione assorbita dal midollo osseo è < 2 Gy, la possibile comparsa di depressione midollare acuta, con riduzione di leucociti e piastrine, è un fenomeno generalmente transitorio, con nadir 1–2 mesi dopo la somministrazione di 131I e risoluzione spontanea dopo 60-90 giorni (9). L’evento potrebbe avere maggiore rilevanza in pazienti con metastasi ossee multiple, dopo somministrazione di elevate attività cumulative e in pazienti pediatrici o anziani. Quando compare, la depressione si risolve spontaneamente senza terapia, è difficile che diventi permanente ed è stato riportato che possa dipendere non solo dalla quantità di attività somministrata, ma anche dalla funzionalità renale (1).
Effetti tardivi
Il più importante è la potenziale associazione tra terapia con 131I e rischio di comparsa di secondo tumore solido o di neoplasia ematologica (SPM), argomento molto dibattuto in letteratura con risultati non univoci e a volte contraddittori (7-14). Alcuni studi riportano la presenza di un piccolo incremento a lungo termine del rischio di SPM (9), mentre altri negano tale associazione (10). Sebbene una revisione sistematica della letteratura riporti un incremento del rischio relativo pari a 1.19 per secondi tumori solidi e a 2.5 per leucemia (11), una seconda metanalisi ha concluso che non esistono chiare evidenze e che sono necessari studi più approfonditi (12).
Studi condotti sul registro del programma Surveillance, Epidemiology, and End Results ipotizzano, senza però riportare evidenze, una maggiore sensibilità alle radiazioni ionizzanti dei bambini rispetto agli adulti, a causa della ridotta distanza tra gli organi, della maggiore concentrazione dell’attività in organi più piccoli, e della presenza di cellule più radio-sensibili perché in fase di crescita e di attiva proliferazione (13). Mentre non esistono evidenze di rischio di SPM per somministrazione di singole attività di 1.1-3.7 GBq (30-100 mCi) (1), il rischio potrebbe essere maggiore per singole attività più elevate o per attività cumulative > 22.2 GBq (600 mCi) (9).
È stato osservato che per stabilire un chiaro rapporto tra comparsa di SPM e terapia con 131I dovrebbero essere presi in considerazione diversi aspetti, come l’età al momento dell’esposizione, il tempo di latenza tra esposizione e comparsa di SPM, l’uso di un modello dosimetrico utile a stabilire un rapporto dose/risposta e l’impiego di gruppi di controllo di pazienti con DTC trattati e non trattati con radioiodio a parità di sesso ed età (14).
Altre potenziali complicanze tardive della terapia con 131I sono rappresentate dall’infertilità e dalla potenziale compromissione della riproduzione. Nel 20–27% di donne in età fertile è stata riportata amenorrea/oligomenorrea temporanea per 4-10 mesi, attribuita all’esposizione delle gonadi al radioiodio presente nel sangue, nelle urine e nelle feci (1). Non è dimostrato un aumento di infertilità, aborti, malformazioni fetali e conseguenze sui nascituri, mentre in donne in fase pre-menopausale è stato riportato un anticipo medio di circa un anno della menopausa rispetto alla popolazione generale (7,8). Negli uomini, dopo somministrazione di elevate attività cumulative di radioiodio, è stato osservato un transitorio incremento dell’FSH e un calo della motilità spermatica, con riduzione temporanea della conta degli spermatozoi (1,8). Non sono riportati invece effetti sulla riproduzione, in termini di infertilità a lungo termine o rischi per il nascituro, anche se in caso di trattamenti multipli con elevate attività dovrebbe essere presa in considerazione la crioconservazione del seme e dovrebbe essere evitato il concepimento per almeno 6 mesi dopo il trattamento, in maniera da permettere il rimpiazzo di spermatozoi irradiati ed evitare potenziali transitorie anomalie cromosomiche (7,8).
ASPETTI NORMATIVI
I principali obblighi legislativi relativi alla terapia con 131I sono stati per diversi anni dettati dal D.Lgs 230/95 e soprattutto dal D.Lgs 187/00 (15). Il D.Lgs 101/2020 vigore dal 27 agosto 2020 ha sostituito e integrato tali decreti, pur mantenendone l’impianto generale (16). Sono stati conservati i principi fondamentali di giustificazione e di ottimizzazione, con programmazione individuale dell’esposizione dei volumi bersaglio e necessità che le dosi ai tessuti non bersaglio siano le più basse ragionevolmente ottenibili. Viene ribadito l’obbligo di trattamento in regime di ricovero protetto in caso di somministrazioni di attività > 600 MBq (16 mCi) e quello di fornire all’atto della dimissione del paziente informazioni ed istruzioni scritte, atte a non superare limiti e vincoli di dose per popolazione e familiari. L’unica vera novità riguarda l’introduzione dell’obbligo di effettuare una determinazione radiometrica al termine del ricovero in degenza protetta (16). La misura, eseguita in collaborazione tra l’esperto di radio-protezione e lo specialista in fisica medica, deve permettere di indicare il periodo di tempo necessario affinché il paziente dimesso possa soddisfare le raccomandazioni fornite dal medico specialista atte ad evitare il superamento dei vincoli di dose di 3 mSv/trattamento (per soggetti di età 18-60 anni) e 15 mSv/trattamento (per soggetti > 60 anni) (16). La puntuale applicazione di quanto richiesto nell’articolo permetterà una più precisa e personalizzata durata delle norme di comportamento da parte del paziente, troppo spesso protratte in maniera eccessiva e non necessaria.
BIBLIOGRAFIA
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Salvatori M, Perotti G, Villani MF, et al. Determining the appropriate time of execution of an I-131 post-therapy whole-body scan: comparison between early and late imaging. Nucl Med Commun 2013, 34: 900–8.
- Grewal RK, Tuttle RM, Fox J, et al. The effect of posttherapy 131I SPECT/CT on risk classification and management of patients with differentiated thyroid cancer. J Nucl Med 2010, 51: 1361-7.
- Xue YL, Qiu ZL, Song HJ, Luo QY. Value of 131I SPECT/CT for the evaluation of differentiated thyroid cancer: a systematic review of the literature. Eur J Nucl Med Mol Imaging 2013, 40: 768–78.
- Lamartina L, Grani G, Durante C, et al. Follow-up of differentiated thyroid cancer - what should (and what should not) be done. Nature Rev Endocrinol 2018, 14: 538-51.
- Salvatori M, Biondi B, Rufini V. Imaging in endocrinology: 2-[18F] -fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography in differentiated thyroid carcinoma: clinical indications and controversies in diagnosis and follow-up. Eur J Endocrinol 2015, 173: R115-30.
- Fard-Esfahani A, Emami-Ardekani A, Fallahi B, et al. Adverse effects of radioactive iodine-131 treatment for differentiated thyroid carcinoma. Nucl Med Commun 2014, 35: 808–17.
- Rizzo A, Annunziata S, Salvatori M. Side effects of theragnostic agents currently employed in clinical practice. Q J Nucl Med Molec Imaging 2021, 65: 315-26.
- Rubino C, de Vathaire F, Dottorini ME, et al. Second primary malignancies in thyroid cancer patients. Br J Cancer 2003, 89: 1638–44.
- Hirsch D, Shohat T, Gorshtein A, et al. Incidence of nonthyroidal primary malignancy and the association with 131I treatment in patients with differentiated thyroid cancer. Thyroid 2016, 26: 1110–6.
- Sawka AM, Thabane L, Parlea L, et al. Second primary malignancy risk after radioactive iodine treatment for thyroid cancer: a systematic review and meta-analysis. Thyroid 2009, 19: 451-7.
- Yun Yu C, Saeed O, Goldberg AS, et al. A systematic review and meta-analysis of subsequent malignant neoplasm risk after radioactive iodine treatment of thyroid cancer. Thyroid 2018, 28: 1662-73.
- Iyer NG, Morris LG, Tuttle RM, et al. Rising incidence of second cancers in patients with low-risk (T1N0) thyroid cancer who receive radioactive iodine therapy. Cancer 2011, 117: 4439–46.
- Verburg FA, Hoffmann M, Iakovou I, et al. Errare humanum est, sed in errare perseverare diabolicum: methodological errors in the assessment of the relationship between I-131 therapy and possible increases in the incidence of malignancies. Eur J Nucl Med Mol Imaging 2020, 47: 519-22.
- Decreto Legislativo 26 maggio 2000, n. 187. Attuazione della direttiva 97/43/Euratom in materia di protezione sanitaria delle persone contro i pericoli delle radiazioni ionizzanti connesse ad esposizioni mediche. Gazzetta Ufficiale Serie Generale n 157 del 7 luglio 2000. Modificato dall’art. 39, Legge 1 marzo 2002, n. 39. Gazzetta Ufficiale Serie Generale n 72 del 26 marzo 2002, suppl ordinario n 54.
- Decreto Legislativo 31 luglio 2020, n. 101. Attuazione della direttiva 2013/59/Euratom, che stabilisce norme fondamentali di sicurezza relative alla protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti, che abroga le direttive 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom e 2003/122/Euratom e riordino della normativa di settore. Gazzetta Ufficiale Serie Generale n 201 del 12 agosto 2020, suppl ordinario n 29.
Trattamento ablativo o adiuvante del carcinoma differenziato della tiroide
Massimo Salvatori
Istituto di Medicina Nucleare, Università Cattolica del S. Cuore-Roma
(aggiornato al 12 giugno 2022)
Dopo iniziale tiroidectomia totale o near-total, il radioiodio può essere somministrato come trattamento ablativo (con lo scopo di eliminare residuo tiroideo, facilitare il follow-up e migliorare la stadiazione iniziale) (fig 1) o come trattamento adiuvante (volto ad eliminare anche malattia residua sospettata ma non provata in pazienti ad alto rischio di recidiva). La differenza tra le due modalità di trattamento è rappresentata non solo dai diversi obiettivi, ma anche dall’attività di radioiodio utilizzata, più elevata nella forma adiuvante.

Figura 1
Trattamento ablativo in paziente con DTC
A sinistra: 131I WBS dopo tiroidectomia totale (residuo in loggia tiroidea)
A destra: 131I WBS dopo trattamento ablativo con radioiodio
Qui si affronta il tema dell’indicazione al trattamento ablativo/adiuvante, tra gli argomenti più controversi nella gestione del DTC, e della somministrazione di basse o alte attività ablative. Si rimanda ad altri capitoli per:
- preparazione del paziente e diagnostica pre-trattamento;
- modalità di somministrazione del radioiodio, scintigrafia corporea globale dopo terapia, risposta al trattamento, rischi ed effetti collaterali e aspetti legislativi.
INDICAZIONI AL TRATTAMENTO
Sebbene nelle diverse linee guida (LG) (1-9) e linee di consenso europee (10) ed italiane (11) sulla gestione del DTC esistano differenze nella definizione di rischio (12), è condiviso il principio che l’indicazione al trattamento ablativo/adiuvante debba essere posta in base alla categoria di rischio del paziente e ai risultati delle indagini diagnostiche post-tiroidectomia, in particolare tireoglobulina (on L-T4 e post TSH) ed ecografia.
Nell’ultima edizione delle LG ATA, per definire la categoria di rischio del paziente, viene raccomandato il contemporaneo impiego di due sistemi di classificazione che assumono un diverso significato prognostico (2):
- TNM, emanato dall’Union for International Cancer Control (UICC) è indicativo del rischio di mortalità tumore-specifica. L’ultima edizione (8°) ha introdotto importanti modifiche (13), che hanno portato al down-staging di circa il 35% dei pazienti (14). Tra le novità va ricordato il down-staging dell’estensione extra-tiroidea con minima infiltrazione della capsula (in precedenza classificata pT3b ed ora stadiata solo in base alle dimensioni della neoplasia pT1, pT2 o pT3a) e il cut-off di età (aumentato da 45 a 55 anni), per definire il rischio di mortalità in pazienti con metastasi (13). Esiste un sistema di calcolo online per stratificare i pazienti in base a queste nuove raccomandazioni;
- American Thyroid Association (ATA) è indicativo del rischio di presenza di malattia residua o di recidiva. Era già presente nelle LG del 2009 (1) ed è stato poi perfezionato nella terza edizione del 2015 (2). Il sistema, basato su dati desunti da un referto anatomo-patologico di elevata qualità, stima un rischio assoluto di recidiva variabile da < 1% al 55% e prevede tre categorie di rischio (basso ≤ 5%, intermedio 6-20%, elevato > 20%). È importante sottolineare che non esiste una netta separazione tra le tre classi di rischio, ma un passaggio continuo e graduale (2).
Questa iniziale classificazione del paziente, eseguita con i due diversi sistemi e definita “statica”, può essere poi modificata nel corso del follow-up in maniera “dinamica”, in base all’evoluzione della malattia e alla risposta al trattamento (risposta eccellente, biochimica incompleta, strutturale incompleta o indeterminata), con eventuale passaggio da una categoria all’altra in senso migliorativo o meno (2,14,15). Mentre la classificazione statica iniziale serve a guidare eventuali trattamenti post-tiroidectomia, l’appartenenza alla nuova categoria di rischio, definita in base alla risposta al trattamento iniziale, suggerisce soprattutto la modalità e l’intensità del successivo follow-up (2,15).
Poiché il rischio di mortalità da DTC è in assoluto molto basso, per l’indicazione al trattamento ablativo si utilizza soprattutto il punteggio ATA di rischio di recidiva/residuo di malattia (2). Mentre non esistono dubbi sull’indicazione al trattamento ablativo nei pazienti ad alto rischio, esiste una significativa controversia riguardo i pazienti a rischio basso o intermedio, dovuta all’assenza di dati provenienti da studi clinici controllati, prospettici e randomizzati (RCT), difficili da eseguire a causa dell'ampio campione di pazienti necessario e della lunga durata del follow-up richiesto, conseguenza della particolare biologia del tumore tiroideo. La letteratura fornisce, quindi, dati derivati da studi retrospettivi ed osservazionali, caratterizzati da non pochi limiti. Sono state pubblicate eccellenti revisioni sull’argomento (16-18).
Nel prossimo futuro saranno probabilmente disponibili dati clinici più affidabili, grazie a due RCT attualmente in corso (Estimabl2, IoN study), finalizzati a valutare l’utilità del trattamento ablativo nei pazienti a rischio basso/intermedio (19,20). In particolare, lo studio IoN ha lo scopo di definire se durante un follow-up di 5 anni il tasso di sopravvivenza libero da malattia (DFS), è diverso tra i pazienti sottoposti o meno a trattamento ablativo con 1.1 GBq (50 mCi) di 131I (19). Alcune perplessità su questo studio sono state avanzate in relazione alla durata del follow-up, che potrebbe essere troppo breve per evidenziare differenze prognostiche tra gruppi, che diventano evidenti e significative solo dopo più di 10 anni dal trattamento (12).
A causa, quindi, della mancanza di dati certi e nell’attesa dei risultati degli RCT in corso, al momento esistono due atteggiamenti diversi, uno orientato verso un uso selettivo e personalizzato del trattamento ablativo, che riduce le indicazioni nei pazienti a rischio basso e basso/intermedio, l’altro che propende per un uso più estensivo del trattamento anche in questi pazienti.
Uso selettivo
L’indicazione all’uso selettivo dell’ablazione con 131I è suggerita soprattutto dalle ultime LG ATA, nelle quali viene riportato che la maggior parte dei DTC a basso rischio presenta un andamento clinico favorevole, con tasso di sopravvivenza > 90% e tasso di recidiva < 5-10%, poco influenzati dal tipo di trattamento (2). Secondo tale documento, un ritardo nel trattamento, quando necessario, non avrebbe significativo impatto sulla sopravvivenza tumore-specifica e il riscontro post-operatorio di malattia residua minima, persistente o recidivante risulterebbe frequente e spesso di scarsa rilevanza clinica. Inoltre, la diagnosi e il trattamento precoce dell’eventuale malattia residua minima offrirebbero uno scarso vantaggio clinico. Salvo casi particolari, quindi, il trattamento ablativo non è raccomandato di routine nei pazienti a basso rischio ATA e nei pazienti con micro-carcinoma papillifero uni-focale e multi-focale (21).
Uso estensivo
L’indicazione a un uso molto selettivo del trattamento ablativo suggerito dalle LG ATA non ha trovato d’accordo molti clinici e l’European Association of Nuclear Medicine (EANM) non ha dato il suo endorsement, sostenendo che “… a tuttora non sono disponibili studi prospettici controllati che indichino con precisione quali pazienti con DTC a basso rischio potrebbero trarre beneficio dalla terapia post-operatoria con 131I” (22). L’EANM sostiene che le LG ATA del 2015 sono troppo riluttanti nel raccomandare il trattamento con radioiodio e che solo 11 delle 191 raccomandazioni riportate in tale LG sono basate su evidenze di alta qualità, mentre 97 sono basate su evidenze di bassa qualità (22). Viene, quindi, proposto un uso più estensivo del trattamento ablativo, soprattutto in pazienti con metastasi linfonodali, con tumori pT2 (fino a 4.0 cm di diametro) e pT3 o pT1-3 N1a o N1b, che nelle LG ATA non sono candidati di routine alla terapia con radioiodio o per i quali il trattamento è solo da considerare (12,18). A seguito di un meeting tra rappresentanti di ATA, EANM, SNMMI ed ETA, tenutosi in Martinica nel 2018, è stato pubblicato un documento congiunto, nel quale vengono formulati 9 principi condivisi relativi alla terapia con 131I del DTC. Il 5° principio riguarda la selezione dei pazienti candidati a terapia con 131I e stabilisce che devono essere valutati più fattori di rischio rispetto a quelli analizzati nelle LG ATA (12, 23).
Indicazioni da Linee Guida e Consensus Conferences
Al netto delle divergenze di opinione sopra riportate, le LG e linee di consenso emanate dalle diverse Società Scientifiche riportano indicazioni sostanzialmente analoghe, con differenze non molto significative. Ad esempio, le LG ATA ed ESMO (2,3) e le linee di consenso emanate da ETA (10) e da sei Società Scientifiche Italiane (11) concordano sul fatto che i pazienti a basso rischio senza malattia residua nota o probabile dopo chirurgia non dovrebbero essere trattati con 131I; invece, dovrebbero essere trattati tutti i pazienti a elevato rischio e il radioiodio dovrebbe essere usato in maniera selettiva nei pazienti a rischio intermedio (tab 1). Di seguito viene riportata una sintesi di tali indicazioni, rimandando alle pubblicazioni in originale per un maggiore approfondimento (1-11).
| Tabella 1 Indicazione al trattamento ablativo/adiuvante da alcune LG e consensi sul DTC |
|||
| Raccomandato | Uso selettivo | Non raccomandato | |
| ATA 2016 (2) | Rischio ATA alto. | Rischio ATA basso/intermedio (T1b-T3, con qualsiasi N). Rischio ATA basso/intermedio (N1a o N1b, con qualsiasi T). |
Rischio ATA basso. Micro-carcinoma papillifero (≤ 1 cm) uni- o multi-focale. |
| ESMO 2019 (3) | Rischio ATA alto. | Altre forme di rischio ATA basso. Rischio ATA intermedio. |
Rischio ATA basso (pT1a, N0/Nx). |
| Consenso Italiano 2018 (11) | Rischio ATA intermedio/alto. Rischio ATA alto. |
Rischio ATA intermedio. Rischio ATA basso/intermedio (T1-2, N1a-N1b, M0-Mx). |
Rischio ATA basso (T1a-b, N0-Nx, M0-Mx). |
| ETA 2022 (10) | Rischio ATA alto. | Rischio ATA basso con Tg > 2 ng/mL on L-T4 o TSH-Tg > 5-10 ng/mL. Rischio ATA intermedio. |
Rischio ATA basso con Tg indosabile on L-T4 o TSH-Tg < 1 ng/mL. Micro-carcinoma papillifero (≤ 1 cm). |
Pazienti con micro-carcinoma papillifero. Sebbene pochi studi abbiano evidenziato vantaggi in questo gruppo (12), il trattamento ablativo non viene raccomandato di routine dopo lobectomia o tiroidectomia totale per pazienti con PTC ≤1.0 cm uni- o multi-focale (micro-carcinomi papilliferi o “very-low risk” secondo la terminologia usata nelle LG ATA del 2015), in assenza di metastasi loco-regionali o di altri fattori prognostici sfavorevoli (1-11).
Pazienti a basso rischio. La maggior parte delle LG è concorde nel ritenere che il trattamento ablativo con radioiodio non sia giustificato di routine in questi pazienti (1-9), in cui la probabilità di recidiva/persistenza di malattia è molto bassa (3%), così come la mortalità tumore-specifica (2). Peraltro, non vi sono evidenze che una diagnosi precoce di recidiva abbia impatto sulla sopravvivenza. L’impiego di radioiodio rispetto alla semplice sorveglianza clinica non sembra migliorare né la sopravvivenza globale e libera da malattia né il rischio di recidiva, anche se per questo i dati sono più eterogenei (2). Comunque, EANM, ATA, Society of Nuclear Medicine and Molecular Imaging (SNMMI) ed ETA hanno recentemente pubblicato un documento congiunto, nel quale riconoscono che tali raccomandazioni non sono basate su studi di elevata qualità (23). Nel documento si conclude che la decisione a favore o contro l’ablazione con 131I nei pazienti a basso rischio deve essere presa in maniera individualizzata, in base alle particolari caratteristiche del tumore, ad aspetti relativi al singolo paziente (es. presenza di comorbilità, parere del paziente, aspetti emozionali), qualità e disponibilità della chirurgia, dell’ecografia, dell’imaging scintigrafico e del dosaggio della Tg, e infine in base alle preferenze del team multi-disciplinare che localmente si occupa della gestione del DTC (23). Infine, i benefici attesi dal trattamento ablativo dovrebbero essere pesati rispetto ai rischi e alla riduzione della qualità di vita (QoL) (23).
Pazienti a rischio intermedio. In questa categoria si osservano le maggiori differenze tra le varie LG. Il trattamento ablativo o adiuvante dovrebbe essere sempre preso in considerazione nei pazienti con istotipi aggressivi, tumori > 4 cm, evidente estensione extra-capsulare, presenza di metastasi linfonodali al di fuori del compartimento centrale (malattia N1b), ed età > 45 anni (11). Una revisione della letteratura ha evidenziato un significativo beneficio (miglioramento della sopravvivenza generale, tumore-specifica e libera da malattia) in circa la metà degli studi non-randomizzati eseguiti in pazienti a rischio intermedio (25). Sono necessari, comunque, più studi per valutare l’efficacia del trattamento ablativo nei vari sottogruppi di questa ampia categoria e la decisione se effettuare o meno il trattamento con radioiodio deve essere sempre condivisa con il paziente, in particolare in questa classe in cui le evidenze sono meno forti.
Pazienti a rischio elevato. Tutte le LG e linee di consenso pubblicate raccomandano il trattamento post-chirurgico di routine con 131I nei pazienti ad alto rischio (1-11). Studi prospettici multicentrici dimostrano che in tali pazienti il trattamento è associato a migliore sopravvivenza e ridotta mortalità tumore-specifica. In questi pazienti il più delle volte è giustificato un trattamento adiuvante con attività di radioiodio più elevate rispetto a quelle impiegate nel trattamento ablativo.
ATTIVITÀ DI RADIOIODIO
La scelta dell’attività di radioiodio da somministrare nella terapia del DTC si basa su due diverse modalità: attività fisse stabilite su base empirica e attività calcolate su base dosimetrica. Nel trattamento ablativo o adiuvante vengono utilizzate quasi esclusivamente attività fisse, basse o elevate. Le attività calcolate su base dosimetrica vengono utilizzate, in alternativa alle attività fisse, per la terapia delle metastasi loco-regionali e a distanza e verranno quindi trattate nel capitolo relativo.
Trattamento ablativo
Due studi prospettici randomizzati di non-inferiorità (25,26) hanno confrontato i risultati ottenuti impiegando attività di radioiodio basse (1.1–1.85 GBq = 30–50 mCi) e alte (≥ 3.7 GBq = ≥ 100 mCi) nel trattamento ablativo di pazienti sottoposti a tiroidectomia totale o near-total dopo preparazione con sospensione della terapia ormonale o rhTSH. Non è stata riscontrata nessuna differenza di efficacia ablativa, anche se sono necessari più dati per valutare l’impatto delle basse attività di radioiodio sull’esito a lungo termine (27-30).
In base ai dati attualmente disponibili, mentre efficacia ablativa, tasso di recidiva e mortalità tumore-specifica non risultano inferiori nei pazienti trattati con basse attività, gli eventi avversi a breve termine risultano più elevati in quelli trattati con elevate attività. Per questi motivi, è generalmente preferita la somministrazione di basse attività di 131I per il trattamento ablativo dei DTC a rischio basso/intermedio, in pazienti giovani, con residui tiroidei di piccole dimensioni e senza caratteristiche sfavorevoli (2). Attività più elevate possono essere utilizzate per l’ablazione di pazienti ad alto rischio o con ampi residui tiroidei. Lo stato di malattia post-operatorio (valutato con Tg, ecografia, WBS se del caso) può essere utilizzato non solo per porre indicazione al trattamento ablativo, ma anche per la scelta dell’attività da somministrare (2).
Trattamento adiuvante
La somministrazione nel trattamento adiuvante di attività più elevate di quelle impiegate per la semplice ablazione (fino a 5.5 GBq = 150 mCi) trova una sua logica considerando che lo scopo è quello di eliminare non solo il residuo tiroideo, ma anche la malattia microscopica sospettata ma non provata in pazienti ad alto rischio di recidiva (2,31,32). Comunque, gli unici studi oggi disponibili (retrospettivi, non multicentrici, condotti su piccoli gruppi di pazienti e caratterizzati da breve follow-up) non dimostrano in maniera significativa che l’aumento dell’attività somministrata sia associato a miglioramento dell’esito clinico in pazienti a rischio intermedio/elevato e senza evidenza di malattia residua (29,30,33). Anche per le attività da somministrare in questo tipo di trattamento è necessario condurre adeguati RCT, in grado di valutare molteplici aspetti, come l’esito clinico, la QoL e il grado di tossicità.
BIBLIOGRAFIA
- Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167-214.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Filetti S, Durante C, Hartl D, et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019, 30: 1856–83.
- Mitchell AL, Gandhi A, Scott-Coombes D, et al. Management of thyroid cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016, 130 suppl S2: S150–60.
- Perros P, Boerlart K, Colley S, et al. Guidelines for the management of thyroid cancer. Clin Endocrinol 2014, 81: 1-122.
- Haddad RI, Nasr C, Bischoff L, et al. NCCN guidelines insights: thyroid carcinoma, version 2.2018. J Natl Compr Canc Netw 2018, 16: 1429-40.
- Dietlein M, Eschner W, Grunwald F, et al. Procedure guidelines for radioiodine therapy of differentiated thyroid cancer, Version 4. Nuklearmedizin 2016, 55: 77-89.
- Luster M, Clarke SE, Dietlein M, et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. European Association of Nuclear Medicine (EANM). Eur J Nucl Med Mol Imaging 2008, 35: 1941-59.
- Avram AM, Giovanella L, Greenspan B, et al. SNMMI procedure standard/EANM practice guideline for nuclear medicine evaluation and therapy of differentiated thyroid cancer: abbreviated version. J Nucl Med 2022, 63: 15N-35N.
- Pacini F, Fuhrer D, Elisei R, et al. ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J 2022, 11: e210046.
- Pacini F, Basolo, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Eilsberger F, Verburg FA. Controversies in radioiodine treatment of low- and intermediate-risk thyroid cancer. Clin Oncol 2021, 33: 68-74.
- Brierley JD, Gospodarowicz MK, Wittekind C. UICC TNM Classification of Malignant Tumours, 8th John Wiley & Sons Inc. Oxford: 2016.
- Araque KA, Gubbi S, Klubo-Gwiezdzinska J. Updates on the management of thyroid cancer. Horm Metab Res 2020, 52: 562–77.
- Lamartina L, Grani G, Durante C, et al. Follow-up of differentiated thyroid cancer - what should (and what should not) be done. Nature Rev Endocrinol 2018, 14: 538-51.
- Sawka AM, Thephamongkhol K, Brouwers M, et al. Clinical review 170: a systematic review and metaanalysis of the effectiveness of radioactive iodine remnant ablation for well-differentiated thyroid cancer. J Clin Endocrinol Metab 2004, 89: 3668-76.
- Sawka AM, Brierley JD, Tsang RW, et al. An updated systematic review and commentary examining the effectiveness of radioactive iodine remnant ablation in well-differentiated thyroid cancer. Endocrinol Metab Clin North Am 2008, 37: 457-80.
- Verburg FA, Flux G, Giovanella L, et al. Differentiated thyroid cancer patients potentially benefitting from postoperative I-131 therapy: a review of the literature of the past decade. Eur J Nucl Med Mol Imag 2020, 47: 78-83.
- Mallick U, Ledermann J. IoN- is ablative radio-iodine necessary for low risk differentiated thyroid cancer patients (IoN). NCT01398085 (consultato il 4 giugno 2022).
- gov website. Differentiated thyroid cancer: is there a need for radioiodine ablation in low risk patients? (ESTIMABL2) NCT01837745 (consultato il 4 giugno 2022).
- Leboulleux S, Bournaud C, Chougnet CN, et al. Thyroidectomy without radioiodine in patients with low-risk thyroid cancer. N Engl J Med 2022, 386: 923-32.
- Verburg FA, Aktolun C, Chiti A, et al. Why the European Association of Nuclear Medicine has declined to endorse the 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2016, 43: 1001-5.
- Tuttle RM, Ahuja S, Avram AM, et al. Controversies, consensus, and collaboration in the use of 131I therapy in differentiated thyroid cancer: a joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the European Thyroid Association. Thyroid 2019, 29: 461-70.
- Nabhan F, Ringel MD. Thyroid nodules and cancer management guidelines: comparisons and controversies. Endocr Relat Cancer 2017, 24: R13–26.
- Schlumberger M, Catargi B, Borget I, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med 2012, 366: 1663–73.
- Mallick U, Harmer C, Yap B, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med 2012, 366: 1674–85.
- Ruel E, Thomas S, Dinan M, et al. Adjuvant radioactive iodine therapy is associated with improved survival for patients with intermediate-risk papillary thyroid cancer. J Clin Endocrinol Metab 2015, 100: 1529-36.
- Verburg FA, Mader U, Reiners C, et al. Long-term survival in DTC is worse after low-activity initial post-surgical I-131 therapy in both high and low risk patients. J Clin Endocrinol Metab 2014, 99: 4487-96.
- Mäenpää HO, Heikkonen J, Vaalavirta L, et al. Low vs. high radioiodine activity to ablate the thyroid after thyroidectomy for cancer: a randomized study. PLoS ONE 2008, 3: e1885.
- Elisei R, Schlumberger M, Driedger A, et al. Follow-up of low-risk differentiated thyroid cancer patients who underwent radioiodine ablation of postsurgical thyroid remnants after either recombinant human thyrotropin or thyroid hormone withdrawal. J Clin Endocrinol Metab 2009, 94: 4171-9.
- Castagna MG, Cevenini G, Theodoropoulou A, et al. Post-surgical thyroid ablation with low or high radioiodine activities results in similar outcomes in intermediate risk differentiated thyroid cancer patients. Eur J Endocrinol 2013, 169: 23-9.
- Han JM, Kim WG, Kim TY, et al. Effects of low-dose and high-dose postoperative radioiodine therapy on the clinical outcome in patients with small differentiated thyroid cancer having microscopic extrathyroidal extension. Thyroid 2014, 24: 820-5.
- Sabra M, Grewal R, Ghossein RM, et al. Higher administered activities of radioactive iodine are associated with less structural persistent response in older, but not younger, papillary thyroid cancer patients with lateral neck lymph node metastases. Thyroid 2014, 24: 1088-95.
Terapia con radioiodio delle metastasi del carcinoma differenziato della tiroide
Massimo Salvatori
Istituto di Medicina Nucleare, Università Cattolica del S. Cuore-Roma
(aggiornato al 12 giugno 2022)
METASTASI LINFONODALI LOCO-REGIONALI
Le metastasi linfonodali rappresentano la prima causa di recidiva loco-regionale insieme alle recidive nel letto tiroideo e a quelle nei tessuti molli (fig 1). Sono molto frequenti nei carcinomi papilliferi nei giovani e la neoplasia può interessare l’intero linfonodo, con superamento della capsula, o solo parte di esso. Quando viene coinvolto meno del 20% del linfonodo (tessuto neoplastico ≤ 2.0 mm) si parla di micro-metastasi linfonodali (1).
Le metastasi linfonodali possono essere localizzate a livello latero-cervicale (II, III, e IV livello) e/o a livello anteriore (VI livello e mediastino). L’ecografia, con FNA ed eventuale dosaggio della Tg nel liquido di lavaggio, rappresenta la metodica diagnostica d’elezione.
Le metastasi linfonodali mediastiniche vengono invece evidenziate attraverso indagini tomografiche morfo-strutturali (TC, RM) o di tipo metabolico-funzionale (131I SPECT/TC, FDG PET/TC) (1).
Figura 1
Metastasi linfonodali iodo-captanti in paziente con carcinoma papillifero della tiroide
Quando possibile, la dissezione chirurgica per compartimenti rappresenta la principale opzione terapeutica e l’intervento può contribuire al miglior controllo regionale della malattia per i DTC maggiormente invasivi (T3-T4) (1).
Per i DTC a basso rischio (T1b–T2, N0) non è indicata la dissezione profilattica di routine dei linfonodi del compartimento centrale del collo (pre-laringei, pre-tracheali e para-tracheali), il cui impiego varia da centro a centro (2). Controversa è la sua efficacia sulla sopravvivenza libera da malattia (DFS) e non esistono evidenze né a favore né contro. Un vantaggio può essere rappresentato dalla possibilità di identificare micro-metastasi non visibili all’ecografia pre-operatoria, informazione utile a fini prognostici e per il successivo trattamento e follow-up (3). I rischi sono rappresentati dal transitorio ipoparatiroidismo e dall’overdiagnosis e overtreatment di micro-metastasi subcliniche che il più delle volte hanno scarsa rilevanza clinica. La valutazione dei potenziali benefici della dissezione profilattica dei linfonodi centrali del collo è oggetto di un RCT attualmente in corso (ESTIMABL3-NCT03570021) (4).
La terapia con radioiodio di metastasi linfonodali iodo-captanti, in alternativa alla chirurgia, trova scarso impiego a causa del basso valore di dose assorbita raggiunto e della conseguente ridotta efficacia clinica. Risulterebbe, infatti, efficace solo in caso di raggiungimento di dosi assorbita dal tumore ≥ 8000 cGy e per foci neoplastici di piccole dimensioni intensamente captanti il radioiodio, condizioni quasi mai realizzate (1). Inoltre, è frequente, anche in presenza di linfonodi iodo-captanti, la coesistenza di piccole metastasi non-iodocaptanti. In casi selezionati, la terapia con 131I viene utilizzata a scopo adiuvante e come completamento della chirurgia linfonodale, anche se i risultati non sono soddisfacenti (5). La somministrazione di radioiodio a dosi terapeutiche può infine essere utilizzata per tecniche di chirurgia radio-guidata, allo scopo di facilitare l’identificazione e l’asportazione di lesioni localizzate nel tessuto cicatriziale pre-trattato e per la valutazione finale dell’efficacia del trattamento chirurgico (6).
METASTASI A DISTANZA
Sono presenti in meno del 10% dei pazienti con DTC, in circa la metà dei casi già al momento della diagnosi iniziale del tumore, mentre nel resto dei casi vengono diagnosticate anche decenni dopo il trattamento iniziale. Sono molto rare nei DTC a basso rischio, ma molto più frequenti nelle forme ad alto rischio con sottotipi istologici aggressivi (varianti tall-cell, hobnail, solide, diffuse, sclerosanti diffuse e colonnari), in caso di tumori di ampie dimensioni con invasione vascolare ed extra-tiroidea e in presenza di diffuso interessamento metastatico linfonodale.
Le sedi più frequenti sono rappresentate da polmoni (circa il 50% dei casi), scheletro (circa il 25% dei casi) e polmoni e scheletro contemporaneamente (circa il 15% dei casi) (7-9); sedi meno frequenti sono encefalo, fegato e cute. La presenza di metastasi a distanza incide in modo importante sulla sopravvivenza, con mortalità tumore-specifica del 55-65% a 5 anni e del 75% a 10 anni dalla diagnosi.
Le metastasi a distanza vengono in genere diagnosticate per la presenza di sintomatologia clinica o attraverso il TxWBS o altre tecniche di imaging (TC, FDG PET/TC, RM) eseguite per il rilievo di elevati livelli di Tg ematica circolante.
Le terapie disponibili, curative o palliative, sono rappresentate dall’escissione chirurgica (quando possibile e solo per malattia loco-regionale), dalla terapia con radioiodio (per malattia iodo-captante e iodo-responsiva), dalla radioterapia a fasci esterni (EBRT) o altre terapie dirette loco-regionali (radio-frequenza, crio-ablazione, ecc), dalla terapia ormonale TSH-soppressiva e dalla terapia con inibitori delle MAPK/ERK chinasi (MEK) per malattia refrattaria al radioiodio (1).
La possibilità di impiegare la terapia con 131I nella cura delle metastasi a distanza prevede la dimostrazione della loro capacità iodo-captante (espressione di NIS intatto) attraverso 131I-WBS planare o SPECT/TC. Nel caso in cui le metastasi iodo-captanti risultino anche FDG-positive alla PET/TC, esiste il fondato sospetto di scarsa risposta al trattamento con radioiodio (10).
Metastasi polmonari
I criteri chiave nella gestione del paziente con metastasi polmonari sono rappresentati in primo luogo dalle dimensioni delle metastasi, che possono essere già evidenti allo studio Rx del torace (lesioni macro-nodulari), evidenti solo alla TC del torace (lesioni micro-nodulari) o non evidenti nemmeno alla TC (fig 2). Oltre il criterio dimensionale, di fondamentale importanza risulta la capacità iodo-captante da parte delle lesioni e l’eventuale risposta a precedenti somministrazioni di radioiodio. Infine, nella scelta dell’opzione terapeutica è da considerare anche la stabilità o la progressione strutturale nel tempo delle metastasi (1).
Figura 2
Micro-metastasi polmonari da carcinoma papillifero della tiroide < 2 mm
A sinistra: 131I WBS con intenso e diffuso accumulo di radioiodio in entrambi i polmoni
A destra: Rx del torace negativa
Le micro-metastasi polmonari iodo-captanti (< 2 mm, Rx/TC negative) presentano elevati tassi di risposta completa alla terapia con 131I (11) (tab 1). Vanno trattate fino a quando risulta evidente una risposta biochimica (andamento della Tg) e/o scintigrafica, anche se non è definito l’intervallo di tempo che deve trascorrere tra un trattamento e l’altro, generalmente indicato tra sei mesi e un anno. La polmonite e la fibrosi sono complicanze molto rare associate a ripetuti trattamenti con alte dosi di radioiodio in pazienti con micro-metastasi polmonari di tipo diffuso intensamente captanti (1,11). La terapia con 131I eseguita con calcolo dosimetrico limita tale rischio, permettendo di non superare la soglia di 2.9 GBq (80 mCi) di ritenzione di radioiodio al corpo intero e di 2 Gy di dose assorbita al midollo osseo. Il sospetto di fibrosi polmonare impone una consulenza pneumologica, l’esecuzione di test di funzionalità respiratoria e limita il ricorso a ulteriori trattamenti con radioiodio (1).
| Tabella 1 Metastasi polmonari da DTC: pattern scintigrafico/radiologico vs esito clinico (modificata da Casara D et al, J Nucl Med 1993, 34: 1626) |
|||
| N pazienti | 131I WBS e Rx torace | Sopravvivenza a 10 anni | Remissione completa |
| 42 (31%) | 131I WBS+ Rx- | 96% | 78% |
| 54 (40%) | 131I WBS+ Rx+ | 36% | 3.7% |
| 38 (29%) | 131I WBS- Rx+ | 11% | 0% |
Le macro-metastasi polmonari iodo-captanti, Rx/TC positive, possono essere trattate con 131I, ma la risposta al trattamento è molto variabile e inferiore a quella delle metastasi micro-nodulari (tab 1). L’intervallo di tempo che deve trascorrere tra un trattamento e l’altro e l’attività somministrata vanno individualizzati tenendo conto di vari fattori, come la risposta clinica, l’età del paziente e la presenza di eventuali altre metastasi a distanza. La comparsa di effetti collaterali, come depressione midollare e scialo-adenite, può limitare il ricorso a ripetuti trattamenti (1,11,12).
Una significativa risposta al trattamento con 131I è in genere associata a calo dei valori di Tg e/o a riduzione delle dimensioni o della progressione della malattia. Viceversa, una riduzione dei valori di Tg e dell’accumulo di radioiodio senza riduzione volumetrica delle lesioni o con loro progressiva crescita indica refrattarietà alla terapia con 131I. Pazienti in buone condizioni cliniche e con singole metastasi polmonari facilmente accessibili possono essere sottoposti a resezione chirurgica o ablazione con radio-frequenza (1).
Metastasi ossee
Le metastasi ossee sono più frequenti nei carcinomi follicolari (7–28%) rispetto ai papilliferi (1.4–7%) e coinvolgono soprattutto il rachide (35%) (fig 3), il bacino (25%) e la gabbia toracica (18%) (fig 4). A volte la diagnosi di metastasi ossee avviene prima o contemporaneamente a quella del tumore primitivo e tale situazione clinica presenta una prognosi più severa rispetto a metastasi ossee che compaiono più tardi durante il follow-up. Le metastasi ossee si possono presentare con sintomatologia dolorosa persistente, mostrano in genere scarso accumulo di radioiodio e se localizzate nel rachide possono determinare compressione midollare (13).
Figura 3
131I SPECT/TC: metastasi ossea del rachide lombare intensamente captante il radioiodio
Figura 4
131I SPECT/TC: metastasi ossea costale iodo-captante
Possono essere utilizzate varie modalità terapeutiche, scelte in base al singolo caso clinico. In presenza di lesioni singole ed in pazienti in buone condizioni cliniche il trattamento associato a migliori risultati clinici è quello chirurgico seguito da EBRT (14). Quando la chirurgia non è possibile, può essere utilizzata la EBRT e/o tecniche di radiologia interventistica, come la cemento-plastica e l’ablazione termica. In alternativa, vengono utilizzate la vertebro-plastica percutanea e tecniche conservative come l’ablazione con radio-frequenze e la crio-terapia. In caso di metastasi multiple deve sempre essere preso in considerazione l’impiego di inibitori del riassorbimento osseo (bisfosfonati o denosumab) che riduce il rischio di fratture patologiche.
La terapia con radioiodio di metastasi ossee iodo-captanti è associata ad aumento della sopravvivenza, anche se raramente permette di arrivare alla guarigione completa (15). Può controllare temporaneamente la malattia e ridurre la sintomatologia in caso di lesioni intensamente captanti. La risposta al trattamento dipende da vari fattori, come il numero delle lesioni, le loro dimensioni e la capacità di accumulo di radioiodio. I limiti della terapia con 131I nella cura delle metastasi ossee sono dovuti alle dimensioni spesso ampie delle lesioni, allo scarso accumulo di radioiodio e soprattutto alla disomogenea distribuzione della dose assorbita dovuta a cause macroscopiche (zone di necrosi, alterata vascolarizzazione, aree di osteolisi) e biomolecolari (ridotta espressione di NIS). La terapia con 131I viene spesso associata ad altre forme di trattamento diretto (chirurgia, EBRT, embolizzazione) o sistemico (bisfosfonati) e può essere eseguita dopo stabilizzazione chirurgica (16).
TERAPIA CON 131I IN PAZIENTI CON TG ELEVATA ED IMAGING NEGATIVO
In pazienti già sottoposti a tiroidectomia totale e trattamento ablativo, che presentano un significativo e progressivo incremento dei valori di Tg ematica circolante (Tg off LT4 > 10 ng/mL o rhTSH Tg > 5 ng/mL) e/o degli AbTg e con negatività dell'imaging strutturale (ecografia, TC, RM) e metabolico (DxWBS e FDG-PET/TC), può essere presa in considerazione la somministrazione di un trattamento empirico di radioiodio, allo scopo di localizzare possibili sedi di recidiva e come potenziale cura di piccole metastasi non suscettibili di terapia chirurgica in quanto non evidenti all’imaging strutturale (17). Sebbene non esistano evidenze che tali trattamenti empirici comportino aumento della sopravvivenza, in circa la metà dei casi viene evidenziata la sede di persistenza/recidiva di malattia con TxWBS e si osserva il calo dei valori di Tg (1).
Mentre il beneficio maggiore dei trattamenti empirici si osserva nei pazienti con micro-metastasi polmonari, il trattamento trova scarsa indicazione in caso di lesioni PET/TC positive, che generalmente non mostrano capacità iodo-captante. Inoltre, è da sottolineare che la FDG-PET/TC mostra una sensibilità diagnostica superiore al TxWBS per la diagnosi di lesioni secondarie in pazienti con Tg elevata e imaging strutturale negativo (fig 5) (10).

Figura 5
Paziente con Tg elevata (25 ng/mL on L-T4) in follow-up per DTC
A sinistra: 131I TxWBS (3.7 GBq = 100 mCi) negativa per metastasi
A destra: FDG PET/TC positiva per metastasi nel polmone di sinistra (freccia)
ATTIVITÀ DI RADIOIODIO
Nonostante la terapia con 131I risulti efficace in molti pazienti, resta incerta l’attività ottimale di radioiodio da utilizzare nella terapia delle metastasi. Esistono due diverse modalità di scelta dell’attività da somministrare: attività fisse stabilite su base empirica e attività calcolate su base dosimetrica (18). Sebbene esistano vantaggi teorici nell’uso di attività calcolate su base dosimetrica, le attuali linee guida non forniscono raccomandazioni sulla loro superiorità rispetto alla somministrazione di attività fisse o empiriche (1).
Attività fisse
L’impiego di attività fisse prevede in genere la somministrazione di 3.7–5.5 GBq (100–150 mCi) di radioiodio per recidive loco-regionali e 5.5-7.4 GBq (150–200 mCi) per metastasi a distanza (tab 2).
| Tabella 2 Possibile schema di terapia del DTC con 131I (modificata da Avram AM, et al. J Nucl Med 2022, 63: 189) |
||
| Strategia terapeutica | Quadro clinico | Attività somministrata di 131I |
| Terapia adattata al rischio e alla diagnostica post-operatoria | Trattamento ablativo | 1.11–1.85 GBq (30–50 mCi) |
| Trattamento adiuvante | 1.85–3.7 GBq (50–100 mCi) | |
| Malattia loco-regionale (non estesa) | 3.7–5.6 GBq (100–150 mCi) | |
| Malattia loco-regionale (estesa) o metastasi a distanza (ridotti volumi di malattia) | 5.6–7.4 GBq (150–200 mCi) | |
| Dosimetria al sangue/corpo intero | Metastasi a distanza (ampi volumi di malattia) | ≥ 7.4 GBq (≥ 200 mCi), massima attività tollerata |
La terapia con attività fisse ha il vantaggio di essere una modalità di trattamento collaudata, semplice, pratica e a basso costo (1). Le complicanze sono rare e di grado accettabile.
I limiti sono rappresentati dal fatto che la dose erogata alle lesioni può essere inferiore a quella necessaria e quella agli organi critici superiore alla soglia di sicurezza. Inoltre, si rischia di non sfruttare l’effetto “dose rate” e di ridurre l’efficacia di attività successive erogando alle lesioni dosi sub-letali (1). Dovrebbero essere evitate attività stabilite su base empirica > 5.5 GBq (150 mCi) in pazienti > 70 anni, potenzialmente in grado di superare la dose tollerata dai tessuti sani e dal corpo intero (18). Nel caso in cui il DxWBS mostri diffuse metastasi polmonari intensamente iodo-captanti, si dovrebbe eseguire una valutazione dosimetrica, per evitare una ritenzione polmonare di radioiodio > 3 GBq (80 mCi) dopo 48 ore dalla somministrazione (18).
Attività dosimetriche
L’attività di 131I calcolata su base dosimetrica utilizza due metodi diversi, impiegati quando possibile anche in maniera congiunta:
- dose massima al midollo (metodo di Benua) permette di calcolare l’attività massima di 131I che si può somministrare senza avere significativa depressione midollare per superamento della dose di 2 Gy al midollo (19); è più semplice, alla portata di tutti i Centri e non è inficiato da possibili errori di calcolo come quello del volume delle lesioni, spesso difficile da eseguire (19,20);
- dose al tumore (metodo di Maxon) permette di calcolare l’attività da somministrare necessaria per ottenere un adeguato valore di dose assorbita da parte delle lesioni (≥ 80-100 Gy) (18).
I metodi dosimetrici sono spesso impiegati nel trattamento dei DTC in età pediatrica o in situazioni particolari, come insufficienza renale o estese metastasi polmonari. Non è possibile un confronto tra i due metodi, in quanto l’analisi della letteratura non fornisce dati significativi in termini di successivo esito clinico.
La diffusione della PET/TC con 124I, oggi riservata a pochi Centri, permetterà probabilmente in futuro di aumentare la qualità e l’attendibilità della dosimetria alle lesioni. Gli studi più importanti attualmente in corso con 124I PET/TC si stanno svolgendo in alcuni Centri statunitensi e tedeschi.
DTC REFRATTARI AL RADIOIODIO
Nonostante l’elevata efficacia della terapia con 131I delle metastasi da DTC, circa un terzo dei pazienti con malattia localmente avanzata o metastatica a distanza diviene refrattaria al radioiodio, con tasso di sopravvivenza a 5 anni che crolla al 10% (rispetto a circa il 60% dei pazienti con metastasi iodo-captanti).
Le seguenti quattro diverse situazioni cliniche definiscono una condizione di refrattarietà al radioiodio (1,21-24):
- malattia metastatica o significativo residuo loco-regionale che fin dall’inizio non accumula radioiodio alla scintigrafia corporea globale con attività terapeutica di 131I (txWBS);
- malattia metastatica o significativo residuo loco-regionale, inizialmente iodocaptante, che nel tempo perde la capacità di accumulare 131I;
- presenza di multiple metastasi a distanza, con alternanza di lesioni iodo-captanti e non iodo-captanti;
- metastasi a distanza che vanno incontro a progressione strutturale, nonostante significativo accumulo di 131
La condizione di refrattarietà al radioiodio è piuttosto rara (4-5 per milione di popolazione) e la prognosi dipende principalmente dal carico di malattia e dal tasso di crescita del tumore. Negli anni passati diversi studi hanno valutato la capacità di alcuni farmaci di ripristinare l’accumulo di radioiodio in pazienti refrattari alla 131I terapia: carbonato di litio, acido retinoico, e più recentemente inibitori delle MAPK/ERK chinasi (MEK). In particolare, risultati interessanti documentati con 124I PET/TC sono stati ottenuti con il selumetinib, inibitore delle MEK 1 e 2, che ha permesso il ripristino dell’accumulo di 131I in 8 pazienti su 20 refrattari al radioiodio (24).
Non esistono molte opzioni terapeutiche per il trattamento dei DTC refrattari al radioiodio. L’approccio più interessante vede l’impiego di inibitori molecolari delle tirosin-chinasi (MKI) che agiscono su angio-genesi, crescita e progressione tumorale (fig 6). A tale scopo, a seguito di studi clinici multi-centrici, prospettici e randomizzati di fase III, sono stati approvati da FDA e EMA il sorafenib e il lenvatinib (23). A causa dei diversi criteri di arruolamento, l’efficacia dei due farmaci non può essere confrontata in base ai risultati riportati nei due studi (24).
Figura 6
Paziente con DTC refrattario al radioiodio e multiple metastasi a distanza in terapia con TKI
A sinistra: 131I TxWBS negativa per metastasi a distanza
A destra: la PET/TC mostra la presenza di numerosissime metastasi a distanza FDG-positive
È importante sottolineare che non tutti i pazienti con DTC refrattari al radioiodio necessitano di essere immediatamente sottoposti a terapia con MKI. La strategia di trattamento dovrebbe essere basata su molteplici fattori, come la sintomatologia, il carico tumorale, il performance status ECOG, le caratteristiche delle lesioni e lo stato di progressione della malattia valutato con criteri RECIST (21,22). Molto importante è anche l’opinione del paziente, con il quale vanno discussi vantaggi e limiti della terapia, inclusi gli importanti effetti collaterali (21-24).
BIBLIOGRAFIA
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Zhao WJ, Luo H, Zhou YM, et al. Evaluating the effectiveness of prophylactic central neck dissection with total thyroidectomy for cN0 papillary thyroid carcinoma: an updated meta-analysis. Eur J Surg Oncol 2017, 43: 1989–2000.
- Chen L, Wu YH, Lee CH, et al. Prophylactic central neck dissection for papillary thyroid carcinoma with clinically uninvolved central neck lymph nodes: a systematic review and meta-analysis. World J Surg 2018, 42: 2846-57.
- ESTIMation of the ABiLity of Prophylactic Central Compartment Neck Dissection to Modify Outcomes in Low-risk Differentiated Thyroid Cancer (ESTIMABL3). NCT03570021.
- Yim JH, Kim WB, Kim EY, et al. Adjuvant radioactive therapy after reoperation for locoregionally recurrent papillary thyroid cancer in patients who initially underwent total thyroidectomy and high-dose remnant ablation. J Clin Endocrinol Metab 2011, 96: 3695–700.
- Garbaccio V, Menga M, Mensa G, et al. Impact of radioguided occult lesion localization in the management of cervical recurrences from differentiated thyroid cancer. Q J Nucl Med Mol Imaging 2022, 66: 43-51.
- Verburg FA, Hänscheid H, Luster M. Radioactive iodine (RAI) therapy for metastatic differentiated thyroid cancer. Best Pract Res Clin Endocrinol Metab 2017, 31: 279-90.
- Avram AM, Zukotynski K, Nadel HR, et al. Management of differentiated thyroid cancer: the standard of care. J Nucl Med 2022, 63: 189-95.
- Durante C, Haddy N, Baudin E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab 2006, 91: 2892-9.
- Salvatori M, Biondi B, Rufini V. Imaging in endocrinology: 2-[18F] -fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography in differentiated thyroid carcinoma: clinical indications and controversies in diagnosis and follow-up. Eur J Endocrinol 2015, 173: R115-30.
- Ilgan S, Karacalioglu AO, Pabuscu Y, et al. Iodine-131 treatment and high-resolution CT: results in patients with lung metastases from differentiated thyroid carcinoma. Eur J Nucl Med Mol Imaging 2004, 31: 825-30.
- Zhang X, Liu DS, Luan ZS, et al. Efficacy of radioiodine therapy for treating 20 patients with pulmonary metastases from differentiated thyroid cancer and a meta-analysis of the current literature. Clin Transl Oncol 2018, 20: 928-35.
- Mazziotti G, Formenti AM, Panarotto MB, et al. Real-life management and outcome of thyroid carcinoma-related bone metastases: results from a nationwide multicenter experience. Endocrine 2018, 59: 90–101.
- Kato S, Demura S, Shinmura K, et al. Current management of bone metastases from differentiated thyroid cancer. Cancers (Basel) 2021, 13: 4429.
- Wu D, Gomes Lima CJ, Moreau SL, et al. Improved survival after multimodal approach with 131I treatment in patients with bone metastases secondary to differentiated thyroid cancer. Thyroid 2019, 29: 971-8.
- Muresan MM, Olivier P, Leclere J, et al. Bone metastases from differentiated thyroid carcinoma. Endocr Relat Cancer 2008, 15: 37-49.
- Silberstein EB. The problem of the patient with thyroglobulin elevation but negative iodine scintigraphy: the TENIS syndrome. Semin Nucl Med 2011, 41: 113-20.
- Van Nostrand D, Atkins F, Yeganeh F, et al. Dosimetrically determined doses of radioiodine for the treatment of metastatic thyroid carcinoma. Thyroid 2002, 12: 121-34.
- Verburg FA, Luster M, Giovanella L, et al. The reset button revisited: why high activity 131I therapy of advanced differentiated thyroid cancer after dosimetry is advantageous for patients. Eur J Nucl Med Mol Imaging 2017, 44: 915–7.
- Lassmann M, Hanscheid H, Chiesa C, et al. EANM Dosimetry Committee series on standard operational procedures for pre-therapeutic dosimetry I: blood and bone marrow dosimetry in differentiated thyroid cancer therapy. Eur J Nucl Med Mol Imaging 2008, 35: 1405-12.
- Schlumberger M, Brose M, Elisei R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes Endocrinol 2014, 2: 356–8.
- Sabra MM, Sherman EJ, Tuttle RM. Tumor volume doubling time of pulmonary metastases predicts overall survival and can guide the initiation of multikinase inhibitor therapy in patients with metastatic, follicular cell-derived thyroid carcinoma. Cancer 2017, 123: 2955-64.
- Berdelou A, Borget I, Godbert Y, et al. Lenvatinib for the treatment of radioiodine-refractory thyroid cancer in real-life practice. Thyroid 2018, 28: 72-8.
- Araque KA, Gubbi S, Klubo-Gwiezdzinska J. Updates on the management of thyroid cancer. Horm Metab Res 2020, 52: 562–77.
Follow-up dei tumori differenziati della tiroide
Massimo Torlontano1, Marco Attard2, Umberto Crocetti1, Michela Massa1
1Unità Operativa di Endocrinologia, IRCCS Casa Sollievo della Sofferenza, San Giovanni Rotondo
2Unità Operativa di Endocrinologia, Ospedali Riuniti Villa Sofia - Cervello, Palermo
(aggiornato al 15 luglio 2018)
INTRODUZIONE
Anche se la maggior parte dei carcinomi differenziati della tiroide (CDT) ha bassa aggressività, si possono sviluppare metastasi loco-regionali nel 5-20% e metastasi a distanza nel 10-15% dei casi. La sopravvivenza a 20 anni è del 98-99% per i carcinomi papillari e dell’80-90% per i follicolari.
In letteratura sono state descritte in passato recidive di malattia anche 20 anni dopo il trattamento iniziale (riferite a casistiche di pazienti operati dagli anni ’50 agli ’80-’90). I dati recenti, ottenuti da casistiche degli anni 2.000, in cui l’ecografia del collo è stata utilizzata come metodica d’elezione nel follow-up, dimostrano percentuali di persistenza/recidiva di malattia molto basse (< 5% nei pazienti a basso rischio, che costituiscono circa l’80% del totale). Per tali motivi, il primo scopo del follow-up dovrebbe essere quello di identificare e rassicurare la gran parte dei pazienti considerati liberi da malattia e con rischio di recidiva trascurabile (< 1%). Questi pazienti necessiteranno nel corso degli anni di controlli sempre meno impegnativi e con minore consumo di risorse.
PUNTI CARDINE DEL FOLLOW-UP
I principali obiettivi del follow-up sono:
- poiché il rischio di mortalità nei pazienti affetti da CDT è basso, il primo obiettivo è quello di calcolare il rischio di persistenza/recidiva. La classificazione dell'American Thyroid Association (ATA) distingue i pazienti in 3 classi di rischio (basso, intermedio ed alto), anche nell’ultima edizione del 2015 (tab 1) (1);
- identificare nel primo anno post-intervento i pochi pazienti con persistenza di malattia;
- individuare nel corso del follow-up a lungo termine possibili recidive tumorali;
- riclassificare i pazienti nel corso del follow-up (stratificazione dinamica): la maggior parte dei pazienti a rischio alto o intermedio, una volta riconosciuti liberi da malattia, vengono declassati come a basso rischio;
- modulare la terapia sostitutivo-soppressiva con levotiroxina: i pazienti liberi da malattia necessitano di un dosaggio solo sostitutivo, mentre quello soppressivo o semi-soppressivo (TSH indosabile oppure ai limiti inferiori del range) è riservato ai pazienti con persistenza/recidiva di malattia accertata o sospetta.
| Tabella 1 Classificazione dei pazienti secondo il grado di rischio (linee guida ATA) |
||
| Basso |
Intermedio (una delle seguenti) |
Alto (una delle seguenti) |
| Non metastasi locali o a distanza. Non invasione loco-regionale. Chirurgia radicale. Non istotipi aggressivi (a cellule alte o colonnari, insulare) nè angio-invasione. Non captazioni patologiche di 131I alla WBS post-dose ablativa (se eseguita). Carcinoma follicolare con minima angio-invasione (< 4 foci). N1 con ≤ 5 micro-metastasi (< 2 mm). Micro-carcinoma papillifero intra-tiroideo uni- o multi-focale con mutazione BRAFV600E (se conosciuta). |
Metastasi locali. Invasione microscopica dei tessuti molli. Istotipi aggressivi o carcinoma papillifero con angio-invasione. Captazioni patologiche di 131I al collo alla WBS post-dose. N1 con > 5 metastasi linfonodali (< 3 cm). Micro-carcinoma papillifero con estensione extra-tiroidea e mutazione BRAFV600E (se conosciuta). |
Metastasi a distanza. Invasione macroscopica. Chirurgia incompleta. Livelli post-operatori di Tg suggestivi per metastasi a distanza. N1 con almeno 1 metastasi linfonodale > 3 cm. Carcinoma follicolare con ≥ 4 foci di angio-invasione. |
Le linee guida
Le linee guida di riferimento adottate sono quelle dell'ATA del 2015 (1) e il Consenso italiano del 2018, redatto a cura di 6 Società Scientifiche: Associazione Italiana di Medicina Nucleare, Associazione Italiana della Tiroide, Associazione Medici Endocrinologi, Società Italiana di Anatomia Patologica e Citologia, Società Italiana di Endocrinologia, Società Italiana di Endocrino-Chirurgia (2).
Evoluzione degli strumenti di screening e diagnostici
Fino agli anni 2000, il protocollo standard di follow-up dei pazienti affetti da CDT era basato sulla misurazione dei livelli sierici di tireoglobulina (Tg) e sull’esecuzione di una scintigrafia whole body (WBS) diagnostica con 131I in sospensione di levo-tiroxina. Successivamente, numerosi studi hanno dimostrato la scarsa utilità della scintigrafia, in particolare nei pazienti a basso rischio, e contemporaneamente l'alta sensibilità dell'ecografia del collo nell'individuare la presenza di malattia locale. Infine, l'introduzione nella pratica clinica del TSH ricombinante umano (rhTSH) e successivamente lo sviluppo di dosaggi “ultra-sensibili” della Tg hanno contribuito a modificare radicalmente i protocolli di monitoraggio clinico dei pazienti con CDT (3-6).
Ruolo della scintigrafia total body
Attualmente è consigliata solo nei pazienti appartenenti alla fascia dell'alto rischio o in quelli che presentano durante il follow-up livelli dosabili di Tg e normalità degli esami morfologici (in primis l'ecografia del collo). Le linee guida recenti scoraggiano l'utilizzo di routine di questa metodica nel follow-up dei pazienti a basso rischio, a causa della sua scarsa sensibilità (0-30% a seconda delle casistiche pubblicate).
Ruolo dell’ecografia del collo nel follow-up
L’esame ecografico eseguito con sonde ad alta frequenza (8-14 mHz) costituisce la metodica più sensibile nel valutare l’eventuale presenza di metastasi linfonodali o malattia locale residua in sede cervicale. Raggiunge una sensibilità prossima al 100% se eseguita in combinazione con il dosaggio della Tg stimolata o con l’esame citologico e/o il dosaggio della Tg nel liquido di aspirazione (7-10). Oltre all'alta sensibilità, la metodica permette un’individuazione delle metastasi più precoce rispetto al dosaggio della Tg e talvolta anche della citologia in caso di metastasi di piccole dimensioni. L’esame è, però, strettamente operatore-dipendente ed è quindi necessario che chi lo effettua (possibilmente lo stesso clinico che ha in carico il paziente) abbia una sufficiente esperienza nella valutazione dei linfonodi del collo e utilizzi strumenti di nuova generazione, che permettano una buona valutazione delle strutture superficiali. Rappresentano elementi di sospetto per linfoadenopatia metastatica:
- alto: aspetto solido, margini irregolari, presenza di micro-calcificazioni o aree cistiche e ipervascolarizzazione;
- basso: assenza di ilo e forma arrotondata.
Ruolo del TSH umano ricombinante
In alternativa alla sospensione della terapia con L-tiroxina, negli anni 2000 è stato introdotto per uso diagnostico il TSH umano ottenuto mediante metodica ricombinante (rhTSH). La stimolazione ottenuta con rhTSH permette al paziente di proseguire la terapia con L-tiroxina ed evitare quindi lo stato di ipotiroidismo, potenzialmente dannoso soprattutto in soggetti anziani o cardiopatici. I livelli di Tg ottenuti dopo stimolazione esogena con rhTSH sono mediamente più bassi rispetti a quelli ottenuti dopo stimolazione endogena del TSH (da ipotiroidismo), ma il cut-off di 1-2 ng/mL permette ugualmente un’adeguata valutazione dello stato clinico del paziente. Gli effetti collaterali del rhTSH sono rari e transitori e consistono soprattutto in cefalea, nausea e stanchezza di breve durata; molto rari i fenomeni allergici. Infine, l’elevato costo del farmaco è compensato soprattutto dalla migliore qualità di vita e dalla riduzione del periodo di sospensione dell’attività lavorativa rispetto ai soggetti sottoposti all’ipotiroidismo (24-48 ore rispetto a 15-20 giorni) (4,6,8).
Ruolo della tireoglobulina ultra-sensibile
Negli ultimi anni sono stati introdotti nuovi dosaggi immuno-chemi-luminometrici di tireoglobulina (Tg ultra-sensibile, di II generazione), con una sensibilità funzionale di 0.1-0.2 ng/mL (molto più bassa rispetto a 0.9-1.0 ng/mL dei metodi di I generazione). L'aumentata sensibilità del metodo di dosaggio permette una migliore accuratezza diagnostica durante il follow-up e, in presenza di valori < 0.1-0.2 ng/mL, si può evitare di ricorrere alla stimolazione con rhTSH (11-14).
Valore predittivo negativo e positivo della tireoglobulina nei pazienti a basso rischio
Il dosaggio della Tg stimolata (dopo sospensione della terapia o rhTSH) durante il follow-up ha un valore predittivo negativo (NPV) molto alto (> 98%). Questo significa che, se la Tg è < 1-2 ng/mL dopo stimolazione, la probabilità che quel dato paziente possa sviluppare una successiva recidiva di malattia durante il follow-up è molto bassa (< 2%): questo è il tipico paziente a basso rischio o ri-classificato come tale durante il follow-up (stratificazione dinamica), che necessiterà negli anni successivi di controlli più diluiti nel tempo (anche ogni 18-24 mesi), costituiti da esami ematochimici, comprendenti Tg e anticorpi anti-Tg (TgAb), ed ecografia del collo come unico esame strumentale. Al contrario, il valore predittivo positivo (PPV) della Tg è molto basso (non > 30% nelle varie casistiche), specialmente se il dosaggio viene eseguito troppo precocemente, pochi mesi dopo il trattamento iniziale (chirurgia + ablazione del residuo): ciò significa che in 7 pazienti su 10 gli iniziali valori dosabili di Tg rimarranno stabili nel tempo o si ridurranno fino a diventare indosabili, a dimostrazione che la produzione di Tg deriva in questi casi dalla persistenza di cellule tiroidee normali e non tumorali, destinate generalmente a morire nei mesi o anni successivi per l'effetto ritardato nel tempo del radioiodio. Pertanto, la presenza di livelli dosabili bassi di Tg stimolata (ad es. 2-5 ng/mL), in assenza di evidenza clinica di persistenza di malattia (negatività di ecografia del collo, più eventuale WBS diagnostica in casi selezionati dubbi), dovrebbe prevedere semplicemente la ripetizione del test di stimolazione dopo 2-3 anni (15).
Tireoglobulina ultra-sensibile e TSH ricombinante: l'una esclude l'altro?
Come accennato precedentemente, l'introduzione dei nuovi dosaggi ultra-sensibili della Tg è potenzialmente in grado di semplificare ulteriormente il follow-up: la maggior parte degli studi più recenti propone di eseguire un singolo dosaggio della Tg 6-12 mesi dopo il trattamento iniziale e riservare il test di stimolo ai soli pazienti che presentino livelli dosabili (> 0.1-0.2 ng/mL). Questo comporterebbe la riduzione dell'esecuzione del test a non più del 30% dei pazienti, con notevoli risparmi economici.
Tempo di raddoppiamento della tireoglobulina
Nel follow-up dei pazienti affetti da carcinoma midollare, il tempo di raddoppiamento della calcitonina nei soggetti con persistenza di livelli dosabili costituisce un importante fattore prognostico per la sopravvivenza. Analogamente, è stato recentemente evidenziato, sulla base di dati retrospettivi, che il tempo di raddoppiamento della Tg nei pazienti con sospetta persistenza di malattia è un predittore di sopravvivenza causa-specifica, di recidiva di malattia, di sviluppo di metastasi a distanza molto più potente rispetto alla classiche stime di rischio utilizzate sulla base dei normali fattori prognostici: la sopravvivenza a 10 anni nel gruppo di pazienti con tempo di raddoppiamento della Tg < 1 anno era del 50%, contro il 95% di quelli con raddoppiamento a 1-3 anni. L'utilizzo di questo criterio contribuisce alla riclassificazione dei pazienti dopo circa 2 anni dal trattamento iniziale nelle categorie "remissione di malattia" o "persistenza di malattia" (16).
È utile ripetere il test di stimolo nel corso del follow-up?
Nella pratica clinica non è raro incontrare pazienti che, in assenza di chiare indicazioni da parte delle linee guida, nel corso del follow-up sono stati sottoposti a ripetute stimolazioni diagnostiche con rhTSH. In realtà, negli ultimi anni alcuni studi hanno abbastanza chiaramente dimostrato la scarsa utilità della ripetizione del test nei pazienti che apparivano liberi da malattia dopo la prima stimolazione (NPV > 98%) (vedi sopra). La ripetizione del test dopo 2-3 anni andrebbe riservata a quella ridotta percentuale di pazienti (20-30%) che risultano positivi al primo, ma in assenza di malattia rilevabile. Come detto precedentemente, ai successivi controlli i 2/3 di questi pazienti presenteranno livelli in calo o indosabili di Tg, a conferma dell'assenza di malattia residua (17-18).
I pazienti con anticorpi positivi
Oltre il 20% dei pazienti presenta positività dei TgAb nel post-intervento. Nella maggior parte dei casi, soprattutto se è stata anche eseguita l'ablazione del residuo, i livelli decrescono progressivamente fino a diventare indosabili; nel frattempo, però, il dosaggio della Tg è inaffidabile per possibile interferenza (possibili valori falsamente negativi). In questi casi è consigliabile attendere il calo dei livelli di TgAb per eseguire l'eventuale test di stimolo e nel frattempo utilizzare gli stessi TgAb come marcatore tumorale surrogato, ancorchè grossolano: il riscontro di un progressivo innalzamento dei valori, se confermato nello stesso laboratorio, è da interpretare come sospetto per persistenza/recidiva di malattia.
I micro-carcinomi tiroidei
I micro-carcinomi (diametro massimo ≤ 1 cm), generalmente a istotipo papillifero, rappresentano attualmente la grande maggioranza dei tumori differenziati diagnosticati ogni anno. È molto raro che abbiano un'evidenza clinica, perchè difficilmente palpabili, date le ridotte dimensioni; più spesso la diagnosi è quindi incidentale nel corso di ecografie cervicali eseguite per vari motivi o ecocolor-Doppler dei vasi del collo, oppure evidenziati all’esame istologico definitivo dopo una tiroidectomia per gozzo.
Le attuali linee guida dell'ATA non danno chiare indicazioni riguardo al tipo di follow-up, cui sottoporre questa gran massa di pazienti. Questi tumori nella stragrande maggioranza dei casi hanno un comportamento clinicamente indolente e non hanno alcun impatto sullo stato generale di salute, ma coesistono anche rari casi di micro-carcinomi aggressivi, che possono dare metastasi loco-regionali e più raramente anche a distanza. Una recente meta-analisi riporta percentuali di recidive di malattia variabili da 0.3 a 37%.
In assenza di chiare indicazioni da parte delle attuali linee guida, è quindi importante stabilire se, in assenza di fattori di rischio, sia possibile utilizzare un follow-up più “leggero" in questo tipo di pazienti. Attualmente, i pazienti con micro-carcinomi trattati con radioiodio perché associati a fattori di rischio vengono inclusi nel normale follow-up dei CDT. La maggior parte dei micro-carcinomi (70-80%) rientra invece nella categoria del rischio molto basso, che presenta le seguenti caratteristiche: istotipi ben differenziati, unifocali, senza superamento della capsula tiroidea e senza metastasi linfonodali o a distanza, in assenza di storia di precedente irradiazione del collo o familiarità. Un recente studio retrospettivo multicentrico, riguardante il follow-up di questa categoria di pazienti a rischio molto basso (follow-up 5-23 anni, mediana 6.7), sottoposti o no ad ablazione del residuo e seguiti dall'inizio mediante ecografia cervicale, ha dato i seguenti risultati: assenza di persistenza o recidiva di malattia in tutti i pazienti; livelli di Tg in terapia < 1 ng/mL al termine del follow-up in tutti i pazienti che erano stati sottoposti all’ablazione del residuo e nel 93% di quelli non ablati; i livelli di Tg in tutti i 12 pazienti con Tg > 1 ng/mL apparivano comunque stabili o in decremento, compatibili con la semplice persistenza di piccoli residui di tessuto tiroideo normale e non neoplastico, e nessuno presentava evidenza clinica o strumentale di persistenza/recidiva di malattia. Tali risultati sembrano escludere la necessità di sottoporre questa grossa popolazione di pazienti a rischio molto basso a terapie o indagini diagnostiche impegnative per il paziente, costose e/o potenzialmente dannose, quali l’ablazione del residuo con radioiodio, la WBS diagnostica, il dosaggio della Tg dopo stimolazione con rhTSH (19).
QUALE FOLLOW-UP
Poiché si stanno progressivamente riducendo le indicazioni al trattamento radiometabolico e anche alla tiroidectomia totale, è in fase di crescita la popolazione di pazienti sottoposti a sola tiroidectomia o lobectomia ed è quindi necessario disegnare modelli diversi di follow-up, in relazione all’ablazione del residuo con radioiodio e alla chirurgia completa o parziale (20-22).
Follow-up dei pazienti sottoposti a tiroidectomia totale + ablazione del residuo
I pazienti apparentemente liberi da malattia dopo terapia radiometabolica non necessitano di ulteriori trattamenti (radiometabolici o chirurgici) e vengono posti inizialmente in terapia semi-soppressiva con levo-tiroxina (livelli di TSH intorno a 0.1-0.5 mU/L, da monitorare ogni 3 mesi circa). Il primo follow-up completo viene eseguito 6-12 mesi dopo il trattamento iniziale ed è costituito dal dosaggio di fT3, fT4, TSH, Tg e TgAb e dall'esecuzione di ecografia del collo.
La tabella 2 illustra le raccomandazioni in relazione alla risposta alla terapia iniziale.
| Tabella 2 Tipo di follow-up secondo risposta alla terapia iniziale con tiroidectomia totale + ablazione |
|||
| Tipo di risposta | Parametri | Follow-up successivo | Livelli di TSH |
| Eccellente | Assenza di segni biochimici ed ecografici o clinici di persistenza di malattia. | Ogni 12-24 mesi: misurazione di Tg basale e TgAb ed ecografia del collo. | Range normale-basso (0.5-2 mUI/L). |
| Biochimica incompleta | Imaging negativo, livelli di Tg basali o stimolati misurabili o livelli di TgAb in aumento. | Ogni 6-12 mesi: dosaggio di Tg e TgAb ed ecografia del collo. In caso di incremento progressivo dei livelli di Tg e/o TgAb: indagini morfologiche di II livello (TC, RM, PET). |
Individualizzati, dai limiti inferiori del range (0.1-0.5 mUI/L) fino alla soppressione totale (< 0.1 mUI/L). |
| Strutturale incompleta | Imaging con evidenza di malattia, indipendentemente dai livelli di Tg e di TgAb. | Programma individualizzato in base alla sede della malattia (locale o a distanza) e alle dimensioni delle metastasi. In caso di positività dell’esame ecografico per linfadenopatie o malattia locale, confermata dall’esame citologico e/o dal dosaggio della Tg nel liquido di aspirazione, è consigliata, quando possibile, l’asportazione chirurgica (il radioiodio non è generalmente in grado di distruggere completamente il tessuto metastatico linfonodale o tumorale residuo). |
Soppressione (o semi-soppressione in pazienti ad alto rischio cardio-vascolare o anziani). |
Follow-up dei pazienti sottoposti a sola tiroidectomia totale o lobo-istmectomia
Nei pazienti trattati con sola tiroidectomia totale, senza successiva ablazione del residuo con radioiodio, è frequente il riscontro, dopo l'intervento chirurgico, di livelli dosabili di Tg, legati alla presenza del residuo di tessuto tiroideo (generalmente bassi se il residuo è piccolo): questi livelli di Tg sono destinati nella grande maggioranza dei casi a ridursi nel tempo per la progressiva morte delle cellule, probabilmente legata a inadeguata vascolarizzazione in seguito all'atto chirurgico.
Nei pazienti trattati con semplice lobo-istmectomia è previsto il riscontro di livelli dosabili di Tg, ma non esistono cut-off standardizzati. Alcuni autori suggeriscono che livelli stabili, non stimolati di Tg < 30 ng/mL sono un buon predittore di risposta eccellente al trattamento; al contrario, in presenza di un normale lobo tiroideo, la presenza/assenza e il trend dei TgAb non vanno considerati.
La tabella 3 illustra le raccomandazioni in relazione alla risposta alla terapia iniziale.
| Tabella 3 Tipo di follow-up secondo risposta alla terapia iniziale con sola tiroidectomia totale o lobo-istmectomia |
||
| Tipo di risposta | Parametri | Follow-up successivo |
| Eccellente | Ecografia negativa, livelli stabili di Tg (compatibili con la presenza di un lobo tiroideo) | Ridurre livello di intensità del follow-up (controlli annuali e successivamente anche più dilatati nel tempo) |
| Biochimica incompleta | Ecografia negativa, livelli di Tg elevati (sproporzionati rispetto alla sola presenza di un lobo tiroideo), oppure in aumento | Indagini di II livello ed eventuali terapie aggiuntive |
| Strutturale incompleta | Evidenza di malattia residua, indipendentemente dai livelli di Tg | Consigliata chirurgia di completamento ed ulteriori indagini o terapie secondo necessità |
| Indeterminata | Aspetti ecografici non specifici e/o trend della Tg non valutabile | Controlli periodici ecografici e di Tg |
CONCLUSIONI
I protocolli di follow-up dei pazienti con CDT hanno subito notevoli cambiamenti negli ultimi anni e sono ancora in fase di modifica col crescere delle nostre conoscenze in merito. La costante è che col crescere delle informazioni dalla letteratura si semplifica sempre più il modello di follow-up, e le metodiche più costose o impegnative o potenzialmente dannose (WBS, stimolazione con rhTSH, metodiche di immagine quali la PET/TC) vanno sempre più chiaramente limitate a piccoli gruppi di pazienti in cui sia sospettata o accertata la persistenza o recidiva di malattia.
BIBLIOGRAFIA
- Haugen BR, Alexander EK, Bible KC, et al. American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2015, 26: 1-133.
- Pacini F, Basolo F, Bellantone R, et al. Italian consensus on diagnosis and treatment of differentiated thyroid cancer: joint statements of six Italian societies. J Endocrinol Invest 2018, 41: 849-76.
- Cailleux AF, Baudin E, Travagli JP, et al. Is diagnostic iodine-131 useful after total thyroid ablation for differentiated thyroid cancer? J Clin Endocrinol Metab 2000, 8: 175-8.
- Mazzaferri EL, Kloos RT. Is diagnostic iodine-131 scanning with recombinant human TSH useful in the follow-up of differentiated thyroid cancer after thyroid ablation? J Clin Endocrinol Metab 2002, 87: 1490–8.
- Pacini F, Capezzone M, Elisei R, et al. Diagnostic 131-iodine whole-body scan may be avoided in thyroid cancer patients who have undetectable stimulated serum Tg levels after initial treatment. J Clin Endocrinol Metab 2002, 87: 1499–501.
- Torlontano M, Crocetti U, D’Aloiso L, et al. Serum thyroglobulin and 131I whole body scan after recombinant human TSH stimulation in the follow-up of low-risk patients with differentiated thyroid cancer. Eur J Endocrinol 2003, 148: 19–24.
- Frasoldati A, Pesenti M, Gallo M, et al. Diagnosis of neck recurrences in patients with differentiated thyroid carcinoma. Cancer 2003, 97: 90–6.
- Pacini F, Molinaro E, Castagna MG, et al. Recombinant human thyrotropin-stimulated serum thyroglobulin combined with neck ultrasonography has the highest sensitivity in monitoring differentiated thyroid carcinoma. J Clin Endocrinol Metab 2003, 88: 3668–73.
- Torlontano M, Attard M, Crocetti U, et al. Follow-up of low-risk patients with papillary thyroid cancer: role of neck ultrasonography in detecting lymph node metastases. J Clin Endocrinol Metab 2004, 89: 3402–7.
- Leboulleux S, Girard E, Rose M, et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer. J Clin Endocrinol Metab 2007, 92: 3590-4.
- Schlumberger M, Hitzel A, Toubert ME, et al. Comparison of seven serum thyroglobulin assays in the follow-up of papillary and follicular thyroid cancer patients. J Clin Endocrinol Metab 2007, 92: 2487-95.
- Spencer C, Fatemi S, Singer P, et al. Serum basal thyroglobulin measured by a second-generation assay correlates with the recombinant human thyrotropin–stimulated thyroglobulin response in patients treated for differentiated thyroid cancer. Thyroid 2010, 20: 587-95.
- Brassard M, Borget I, Edet-Sanson A, et al. Long-term follow-up of patients with papillary and follicular thyroid cancer: a prospective study on 715 patients. J Clin Endocrinol Metab 2011, 96: 1352-9.
- Castagna MG, Tala Jury HP, Cipri C, et al. The use of ultrasensitive thyroglobulin assays reduces but does not abolish the need for TSH stimulation in patients with differentiated thyroid carcinoma. J Endocrinol Invest 2011, 34: 219-23.
- Baudin E, Do Cao C, Cailleux AF, et al. Positive predictive value of serum thyroglobulin levels, measured during the first year of follow-up after thyroid hormone withdrawal, in thyroid cancer patients. J Clin Endocrinol Metab 2003, 88: 1107-11.
- Miyauchi A, Kudo T, Miya A, et al. Prognostic impact of serum thyroglobulin doubling-time under thyrotropin suppression in patients with papillary thyroid carcinoma who underwent total thyroidectomy. Thyroid 2011, 21: 707-16.
- Castagna MG, Brilli L, Pilli T, et al. Limited value of repeat recombinant thyrotropin (rhTSH)-stimulated thyroglobulin testing in differentiated thyroid carcinoma patients with previous negative rhTSH-stimulated thyroglobulin and undetectable basal serum thyroglobulin levels. J Clin Endocrinol Metab 2008, 93: 76-81.
- Crocetti U, Durante C, Attard M, et al. Predictive value of recombinant human TSH stimulation and neck ultrasonography in differentiated thyroid cancer patients. Thyroid 2008, 18: 1049-53.
- Durante C, Attard M, Torlontano M, et al. Identification and optimal postsurgical follow-up of patients with very low-risk papillary thyroid microcarcinomas. J Clin Endocrinol Metab 2010, 95: 4882-8.
- Durante C, Montesano T, Lamartina L, et al. Long-term surveillance of papillary thyroid cancer patients who do not undergo postoperative radioiodine remnant ablation: is there a role for serum thyroglobulin measurement? J Clin Endocrinol Metab 2012, 97: 2748-53.
- Torlontano M, Crocetti U, Augello G, et al. Comparative evaluation of recombinant human thyrotropin-stimulated thyroglobulin levels, 131I whole-body scintigraphy, and neck ultrasonography in the follow-up of patients with papillary microcarcinoma who have not undergone radioiodine therapy. J Clin Endocrinol Metab 2006, 91: 60–3.
- Momesso DP, Vaisman F, Yang SP, et al. Dynamic risk stratification in patients with differentiated thyroid cancer treated without radioactive iodine. J Clin Endocrinol Metab 2016, 101: 2692–700.
PET nei tumori tiroidei
Annibale Versari
Servizio di Medicina Nucleare, Arcispedale Santa Maria Nuova, Reggio Emilia
Le tradizionali tecniche di imaging utilizzate nei pazienti con carcinoma differenziato della tiroide (differentiated thyroid carcinoma, DTC) sono l'ecografia, perché esplora molto bene il collo, e la scintigrafia con radioiodio, perché la differenziazione del tumore permette di conservare in parte la funzione del tessuto da cui il tumore ha preso origine e cioè la captazione dello iodio, sia stabile che radioattivo. Questa capacità viene utilizzata sia ai fini diagnostici (scintigrafia) che terapeutici (terapia radiometabolica).
In circa l’80% dei casi il carcinoma tiroideo è ben differenziato e le neoplasie ben differenziate spesso hanno una ridotta captazione del 18F-fluordesossiglucosio (FDG), il radiofarmaco più impiegato nelle indagini PET/TC. Questo ha limitato l’impiego della PET/TC nel carcinoma tiroideo quasi esclusivamente ai casi di persistenza di malattia o sospetta recidiva con positività della tireoglobulinemia ma negatività della scintigrafia total-body con 131I. Attualmente comunque l’interesse della PET/TC in questo campo sta crescendo, sia per la frequenza non trascurabile di captazioni focali di FDG in ambito tiroideo in corso di PET eseguite per altri motivi, sia per la disponibilità di nuovi traccianti che studiano metabolismi diversi dal glucosio e l’espressione recettoriale.
CAPTAZIONE TIROIDEA OCCASIONALE
La captazione incidentale di FDG in corso di PET/TC eseguita per altre indicazioni è un reperto non trascurabile, ormai ben documentato in letteratura [1-2-3] (tabella).
| Captazione tiroidea incidentale in corso di FDG PET/TC | ||
| Chen W et al, 2009 | Bae JS et al, 2009 | |
| N | 2594 | 3379 |
| Captazione tiroidea | 3.8% (focale 1.8%, diffusa 2%) | 8.4% |
| Captazione focale | 63% neoplasia | 30.9% neoplasia |
| Captazione diffusa | 100% tiroidite cronica | 6.4% neoplasia |
Le caratteristiche della captazione possono essere diverse come anche il loro significato. Una captazione diffusa, bilaterale e simmetrica è solitamente in relazione a morbo di Graves o tiroidite e ha un basso rischio di malignità (< 2%) [4]. Tale rischio aumenta nettamente in caso di captazione focale (> 30%) e il reperto merita sempre un approfondimento diagnostico. L’ecografia può stratificare ulteriormente questo rischio di malignità: se l’ecografia depone per benignità il rischio scende al 13%, mentre se depone per malignità la percentuale di rischio sale oltre il 75% [5]. In circa l’80% dei casi si tratta di carcinomi papillari, mentre nel restante 20% di carcinomi follicolari, linfomi, carcinomi midollari e metastasi. Secondo alcuni autori, tale captazione incidentale è da ritenersi indicativa di peggiore prognosi [6].
SOSPETTA PERSISTENZA DI MALATTIA O RECIDIVA
L’indicazione alla FDG-PET riguarda i casi con positività della tireoglobulinemia ma negatività della scintigrafia total-body con 131I [7-8]. In pazienti tiroidectomizzati e sottoposti a terapia ablativa con radioiodio, la produzione di tireoglobulina è legata alla presenza di cellule neoplastiche differenziate e valori > 10 ng/mL sono espressione di metastasi in più dell’85% dei casi. La presenza di anticorpi anti-tireoglobulina è un ostacolo al dosaggio della Tg; comunque valori anticorpali persistentemente elevati sono considerati sospetti per persistenza o recidiva di malattia anche in presenza di Tg indosabile [9]. La perdita della capacità di concentrare il radioiodio è indice di perdita di differenziazione, che in genere corrisponde a un aumento dell’attività glicolitica e quindi a una maggiore possibilità di captazione del FDG. Per questo motivo la FDG-PET/TC può essere molto utile in questi pazienti.
L’impiego del rhTSH come stimolo per migliorare la sensibilità della FDG-PET ha dato risultati controversi e, al momento, non esiste una chiara indicazione al suo impiego routinario [10-11].
Numerosi dati di letteratura dimostrano l’utilità clinica della FDG-PET nella diagnosi di localizzazioni neoplastiche non-iodocaptanti. Una metanalisi su 571 pazienti riporta una sensibilità dell’83% e una specificità dell’84% [12]. La sensibilità può essere ridotta nelle localizzazioni linfonodali di modesta entità e nelle metastatizzazioni polmonari miliariformi. Fra le cause di falsa positività figurano la sarcoidosi e i granulomi polmonari.

Figura 1 - FDG-PET/TC: captazione incidentale di FDG a livello tiroideo destro in corso di follow-up per carcinoma esofageo. Istologia: carcinoma papillare.

Figura 2 - FDG-PET/TC: captazione incidentale di FDG a livello tiroideo sinistro in corso di indagine per sospetta recidiva di carcinoma del colon. Istologia: carcinoma papillare.

Figura 3 - FDG-PET/TC in paziente con sospetta recidiva di carcinoma tiroideo differenziato. La tireoglobulinemia era patologica e la scintigrafia total-body con 131I negativa. Reperto PET: localizzazioni secondarie linfonodali latero-cervicali sinistre.

Figura 4 - FDG-PET/TC in paziente con sospetta recidiva di carcinoma tiroideo differenziato. La tireoglobulinemia era patologica e la scintigrafia total-body con 131I negativa. Reperto PET: aree di captazione del FDG multiple bilaterali polmonari riferibili a localizzazioni secondarie.
NUOVI RADIOFARMACI
124Iodio
Il radioiodio è il tracciante tradizionale per lo studio del carcinoma tiroideo:
- 131I è economico, largamente disponibile ma con ridotta risoluzione;
- 123I è costoso, meno disponibile ma con immagini di miglior qualità.
Questi vengono rilevati mediante gamma-camera e SPECT. La recente introduzione delle apparecchiature ibride SPECT/TC, che rilevano nella stessa seduta le immagini scintigrafiche metaboliche e le immagini morfologiche con successiva fusione, ha migliorato molto la specificità e la capacità di localizzazione delle lesioni, sia pure lasciando invariata la sensibilità.
L’ampia diffusione della PET/TC, con la sua ottima risoluzione spaziale, nettamente superiore a quella della SPECT, ha generato un crescente interesse per l’impiego del 124I, un isotopo emettitore di positroni con un’emivita di 4.2 giorni, che unisce il vantaggio dell’utilizzo PET con la specificità del tracciante “iodio” per il tessuto tiroideo. Dati di letteratura, sia pure ancora modesti, riportano una maggior sensibilità e capacità di localizzazione superiore alla scintigrafia con 131I, sia pre- che post-terapia ablativa [13]. Superiorità è riportata anche rispetto alla FDG-PET/TC (sensibilità 80% contro 70%) [14].
68Ga-Analoghi della somatostatina
La perdita della capacità iodo-captante da parte delle metastasi da carcinoma differenziato della tiroide rappresenta un problema sia diagnostico che terapeutico. Un’opportunità interessante per affrontare questo problema può essere offerta dall’espressione recettoriale di questi tumori, che spesso esprimono i recettori per la somatostatina [15]. La medicina nucleare è in grado di valutare i recettori della somatostatina nei tumori neuroendocrini con analoghi della somatostatina radiomarcati, sia in scintigrafia, SPECT e SPECT/TC (111In-Octreoscan), che in PET/TC (68Ga-DOTATOC/DOTATATE/DOTANOC) [16]. La positività di queste indagini offre interessanti prospettive terapeutiche per questi pazienti. Nella nostra esperienza, la PET/TC con 68Ga-DOTATOC è risultata positiva in circa il 50% dei pazienti con DTC non iodo-captante, con metastasi sospette o accertate in cui l'abbiamo utilizzata. La presenza di una positività allo studio PET/TC con 68Ga-DOTATOC è importante per la possibilità di candidare i pazienti a terapia radiorecettoriale con 90Y/177Lu-DOTATOC/DOTATATE.

Figura 5 – 68Ga-DOTATOC PET/TC in paziente con metastasi polmonari multiple da carcinoma tiroideo differenziato, non-iodocaptanti. Reperto PET: aree multiple di captazione del tracciante recettoriale a livello polmonare, scheletrico e linfonodale. Il paziente è stato poi sottoposto a terapia radiorecettoriale.
CONCLUSIONI
Le indagini convenzionali come ecografia e scintigrafia con radioiodio conservano il loro significato nello studio del carcinoma differenziato della tiroide. La PET/TC vede comunque accrescere il proprio ruolo, che si avvale sia di traccianti tradizionali come FDG che di nuovi radiofarmaci (124I e 68Ga-DOTATOC/DOTATATE/DOTANOC).
BIBLIOGRAFIA
- Shie P, Cardarelli R, Sprawls K, et al. Systematic review: prevalence of malignant incidental thyroid nodules identified on fluorine-18 fluorodeoxyglucose positron emission tomography. Nucl Med Commun 2009, 30: 742-8.
- Chen W, Parsons M, Torigian DA, et al. Evaluation of thyroid FDG uptake incidentally identified on FDG-PET/CT imaging. Nucl Med Commun 2009, 30: 240-4.
- Bae JS, Chae BJ, Park WC, et al. Incidental thyroid lesions detected by FDG-PET/CT: prevalence and risk of thyroid cancer. World J Surg Oncol 2009, 7: 63.
- Are C, Hsu JF, Schoder H, et al. FDG-PET detected thyroid incidentalomas: need for further investigation? Ann Surg Oncol 2007, 14: 239-47.
- Kwak JY, Kim EK, Yun M, et al. Thyroid incidentalomas identified by 18F-FDG PET: sonographic correlation. AJR Am J Roentgenol 2008, 191: 598-603.
- Are C, Hsu JF, Ghossein RA, et al. Histological aggressiveness of fluorodeoxyglucose positron-emission tomogram (FDG-PET)-detected incidental thyroid carcinomas. Ann Surg Oncol 2007, 14: 3210-5.
- Finkelstein SE, Grigsby PW, Siegel BA, et al. Combined [18F]Fluorodeoxyglucose positron emission tomography and computed tomography (FDG-PET/CT) for detection of recurrent, 131I-negative thyroid cancer. Ann Surg Oncol 2008, 15: 286-92.
- Kim SJ, Lee TH, Kim IJ, et al. Clinical implication of F-18 FDG PET/CT for differentiated thyroid cancer in patients with negative diagnostic iodine-123 scan and elevated thyroglobulin. Eur J Radiol 2009, 70: 17-24.
- Torréns JI, Burch HB. Serum thyroglobulin measurement. Utility in clinical practice. Endocrinol Metab Clin North Am 2001, 30: 429-67.
- Chin BB, Patel P, Cohade C, et al. Recombinant human thyrotropin stimulation of fluoro-D-glucose positron emission tomography uptake in well-differentiated thyroid carcinoma. J Clin Endocrinol Metab 2004, 89: 91-5.
- Petrich T, Börner AR, Otto D, et al. Influence of rhTSH on [(18)F]fluorodeoxyglucose uptake by differentiated thyroid carcinoma. Eur J Nucl Med Mol Imaging 2002, 29: 641-7.
- Dong MJ, Liu ZF, Zhao K, et al. Value of 18F-FDG-PET/PET-CT in differentiated thyroid carcinoma with radioiodine-negative whole-body scan: a meta-analysis. Nucl Med Commun 2009, 30: 639-50.
- Phan HT, Jager PL, Paans AM, et al. The diagnostic value of 124I-PET in patients with differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2008, 35: 958-65.
- Freudenberg LS, Antoch G, Frilling A, et al. Combined metabolic and morphologic imaging in thyroid carcinoma patients with elevated serum thyroglobulin and negative cervical ultrasonography: role of 124I-PET/CT and FDG-PET. Eur J Nucl Med Mol Imaging 2008, 35: 950-7.
- Forssell-Aronsson EB, Nilsson O, Bejegård SA, et al. 111In-DTPA-D-Phe1-octreotide binding and somatostatin receptor subtypes in thyroid tumors. J Nucl Med 2000, 41: 636-42.
- Rodrigues M, Li S, Gabriel M, et al. 99mTc-depreotide scintigraphy versus 18F-FDG-PET in the diagnosis of radioiodine-negative thyroid cancer. J Clin Endocrinol Metab 2006, 91: 3997-4000.
Carcinoma midollare della tiroide
Danni da radiazioni e misure di prevenzione in caso di incidenti nucleari
Marco Chianelli
UOC di Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale (RM)
Nei paragrafi che seguono verranno presentati e discussi in modo sintetico alcuni concetti generali inerenti le possibili conseguenze socio-sanitarie del rilascio accidentale di materiale radioattivo in seguito a danni di centrali nucleari.
QUALI SONO LE POSSIBILI MALATTIE A LIVELLO ENDOCRINO CUI LA POPOLAZIONE E' MAGGIORMENTE ESPOSTA?
L’unica ghiandola endocrina che corre il rischio di ammalarsi in seguito alla contaminazione da sostanze radioattive è la tiroide. Tra le sostanze radioattive tipicamente disperse nell’ambiente in seguito al danno di un reattore di una centrale nucleare c’è lo iodio-131 (131I). Lo iodio si accumula nella tiroide e vi rimane per alcuni giorni. Pertanto, in presenza di elevate concentrazioni di 131I nell’aria, nei liquidi o nei cibi, questo si accumula nella tiroide e la irradia. L’irraggiamento della tiroide da parte dI 131I non necessariamente esita in un danno clinicamente rilevante. Lo 131I viene impiegato routinariamente per lo studio della funzione tiroidea e non provoca alcun danno alle bassi dosi somministrate. Il nostro organismo, infatti, è dotato da sempre di sistemi per la riparazione dei danni indotti da basse dosi di radiazioni, a cui siamo costantemente esposti per la presenza di elementi radioattivi nel terreno e attraverso l’atmosfera con le radiazioni cosmiche. Per esempio, i livelli di dose assorbita dal fondo naturale di radiazioni nella regione Lazio sono pari a circa 2.4 mSv/anno. Quando i danni prodotti dalle radiazioni eccedono la capacità riparatrice dell’organismo, possono tradursi in un danno clinicamente rilevante. La possibilità che questo avvenga, aumenta con l’aumentare della dose di radiazioni a cui è esposta la tiroide. Per livelli di radiazioni elevati (> 100 mSv nell’adulto) la probabilità di ammalare di tumore della tiroide aumenta significativamente. L’esperienza di Chernobyl ci ha insegnato che i tumori della tiroide indotti dalle radiazioni compaiono dopo circa 10-20 anni. È necessaria, pertanto, una sorveglianza medica per tutta la vita nei soggetti eventualmente contaminati.
QUALI SONO I RISCHI MAGGIORI PER QUANTI ENTRANO IN CONTATTO CON LE SOSTANZE RADIOATTIVE?
Dipende dall’intensità e dal tipo delle radiazioni assorbite.
- Nelle persone che si trovano nelle immediate vicinanze di materiale radioattivo che emette radiazioni con elevata intensità i danni maggiori e più precoci sono al midollo osseo e all’intestino, con conseguente suscettibilità alle infezioni, possibili emorragie e malassorbimento del cibo. Questa sindrome acuta da radiazioni si verifica solo per livelli di radioattività molto elevati; non riguarda la popolazione generale ma solo il personale che si trova all’interno del reattore al momento dell’incidente.
- Per la popolazione che vive nelle zone limitrofe, o che mangia alimenti contaminati provenienti dalle zone coinvolte, il rischio deriva dalla possibile ingestione con il cibo o inalazione dall’aria di sostanze disperse in seguito all’incidente. Caratteristico è stato il riscontro di latte radioattivo in seguito all’incidente di Chernobyl, come conseguenza dell’erba contaminata mangiata dalle mucche.
Le sostanze rilasciate in seguito all’incidente sono, oltre allo 131I:
- lo Stronzio-90, assorbito dall’osso, che può causare tumori ossei e leucemia;
- il Cesio-137 che si accumula con preferenza nei muscoli;
- il Plutonio che è tossico soprattutto se viene inalato e può causare tumori del polmone.
QUALI SONO LE CATEGORIE MAGGIORMENTE A RISCHIO?
Bambini di età < 10 anni.
Le donne in stato di gravidanza non per sè stesse ma perchè il feto è particolarmente sensibile agli effetti nocivi delle radiazioni:
- nel primo trimestre, durante la formazione degli organi, possono verificarsi malformazioni a vari organi e apparati;
- a partire dal secondo trimestre, quando la tiroide è già formata e funzionante, lo iodio radioattivo eventualmente assorbito dalla madre, si accumula anche nella tiroide del feto. Questo può ridurre la capacità della tiroide di produrre ormoni e determinare un quadro di ipotiroidismo congenito.
Un’altra categoria a rischio aumentato sono i pazienti affetti da insufficienze renale in terapia con dialisi, a causa di una ridotta capacità di eliminare le sostanze radioattive contaminanti e per una maggiore sensibilità alle radiazioni.
COME ARGINARE UN'EVENTUALE ESPOSIZIONE A SOSTANZE RADIOATTIVE
Contaminazione della tiroide da 131I
La somministrazione di un eccesso di iodio non radioattivo, sotto forma di ioduro di potassio (KI), può ridurre, fino a bloccare, l’accumulo dello iodio radioattivo all’interno della tiroide. La somministrazione del farmaco non trova indicazione per soggetti di età > 40 anni e per valori di dose assorbita da parte della tiroide < 100 mSv.
L’efficacia della somministrazione di KI varia in relazione alla modalità di assunzione: è massima quando viene assunto in modo preventivo, iniziando due giorni prima della contaminazione, per diminuire gradualmente con il passare del tempo, fino ad annullarsi se somministrato dopo 96 ore dall’incidente. L’assunzione deve durare per cinque giorni dopo la contaminazione. Lo KI deve essere assunto solo se raccomandato dalle autorità sanitarie locali, in seguito a prescrizione medica secondo le modalità indicate e sotto controllo medico.
Non esiste in Italia un farmaco commercialmente disponibile a base di ioduro di potassio. Normalmente viene prescritta la soluzione di Lugol al 5%, che viene preparata in farmacia, previa presentazione di ricetta medica (non rimborsata dal Servizio Sanitario Nazionale). La dose giornaliera è di 7 gocce per tre volte al giorno, che possono essere assunte con gli alimenti. L’assunzione di KI può determinare sintomi influenzali, mal di testa, lacrimazione, congiuntivite, arrossamenti del volto, dolore alle ghiandole salivari, laringite, bronchite, ipo e ipertiroidismo.
Contaminazione di altri organi
Esistono, infine altri farmaci che possono essere utili per la contaminazione di altri organi in caso di contaminazione con altre sostanze radioattive (90Sr, 137Cs, Pu). La prescrizione di tali medicamenti (quali il Ca-DTPA) è solitamente riservata ai pazienti sotto sorveglianza in centri specializzati per la gestione di incidenti nucleari.
LETTURE CONSIGLIATE
- Christodouleas JP, Forrest RD, Ainsley CG, et al. Short-term and long-term health risks of nuclear-power-plant accidents. N Engl J Med 2011, 364: 2334-41.
- U.S. Department of Health and Human Services Food and U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Guidance. Potassium Iodide as a Thyroid Blocking Agent in Radiation Emergencies. December 2001.
- Cardis E, Kesminiene A, Ivanov V, et al. Risk of thyroid cancer after exposure to 131I in childhood. J Natl Cancer Inst 2005, 97: 724–32.
Generalità sul carcinoma midollare e forma sporadica
Simona Censi
UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
Il carcinoma midollare della tiroide (MTC), descritto per la prima volta come entità clinico-patologica specifica nel 1959 (1), è un tumore maligno raro, che origina dalle cellule C para-follicolari della tiroide (2), derivanti dalla cresta neurale, e ha la peculiarità di secernere calcitonina (CT), come le normali cellule C para-follicolari. Possono essere sintetizzati e secreti anche altri peptidi, quali il CEA (frequente) e in casi rari CRH, ACTH, peptidi PTH-relati, insulina, glucagone.
Il MTC rappresenta meno del 5% dei tumori maligni della tiroide, con recenti dati SEER (Surveillance, Epidemiology, and End Results), basati su database USA, che lo danno attorno all’1-2%, anche a causa dell’over-diagnosi di carcinoma papillare della tiroide negli ultimi decenni (3).
La prevalenza aggiustata per età è in aumento, con una variazione percentuale annua dell’1.87% tra il 1993 e il 2012 (4). Le cause di questo incremento di diagnosi sono tuttora ignote.
Nel 20-25% dei casi insorge nel contesto di forme familiari legate a mutazioni germinali dell’oncogene RET. Nel 75-80% dei casi si presenta in forma sporadica (MTCs), con lieve prevalenza nel sesso femminile (F:M = 1.5:1).
Nella forma sporadica il picco di incidenza avviene tra 4° e 6° decade, quasi sempre come nodulo unico ai due terzi superiori di un lobo tiroideo (sede di prevalente localizzazione delle cellule C); le forme multi-focali non eccedono il 15-20% e non è frequente la coesistenza di gozzo multi-nodulare. Nel MTCs è descritta in percentuali molto variabili (23-66%) una mutazione somatica (presente solo nelle cellule tumorali, e valutabile su campione istologico) del gene RET (che codifica per un recettore trans-membrana ad attività tirosin-kinasica) (5). La mutazione più frequente è a carico del codone 918, esone 16, ed è associata a maggiore aggressività della neoplasia. Mutazioni somatiche dell’oncogene RAS sono state riscontrate in circa il 10-20% degli MTC sporadici (6,7) e vi è generale accordo in letteratura che la presenza di tale mutazione driver si associ a minor aggressività (8). Vale la pena di specificare che la mutazione driver nei casi di MTC sporadico rimane sconosciuta in una percentuale che si attesta attorno al 18% dei casi, anche impiegando tecniche sensibili come la Next Generation Sequencing (7).
Bibliografia
- Hazard JB, Hawk WA, Crile G. Medullary (solid) carcinoma of the thyroid; a clinicopathologic entity. J Clin Endocrinol Metab 1959, 19: 152–61.
- Williams ED. Histogenesis of medullary carcinoma of the thyroid. J Clin Pathol 1966, 19: 114-8.
- Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Kitahara CM, Sosa JA. The changing incidence of thyroid cancer. Nat Rev Endocrinol 2016, 12: 646–53.
- Elisei R, Cosci B, Romei C, et al. Prognostic significance of somatic RET oncogene mutations in sporadic medullary thyroid cancer: a 10-year follow-up study. J Clin Endocrinol Metab 2008, 93: 682–7.
- Ciampi R, Mian C, Fugazzola L, et al. Evidence of a low prevalence of RAS mutations in a large medullary thyroid cancer series. Thyroid 2013, 23: 50–7.
- Ciampi R, Romei C, Ramone T, et al. Genetic landscape of somatic mutations in a large cohort of sporadic medullary thyroid carcinomas studied by next-generation targeted sequencing. iScience 2019, 20: 324–36.
- Gild ML, Clifton-Bligh RJ, Wirth LJ, et al. Medullary thyroid cancer - Updates and challenges. Endocr Rev 2023, 44: 934-46.
Forma familiare del carcinoma midollare
Simona Censi
UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
Il carcinoma midollare della tiroide (MTC) ereditario è determinato da una mutazione puntiforme (sostituzione di un singolo residuo aminoacidico) germinale (presente in tutte le cellule) attivante del gene (RET - REarranged during Transfection), che codifica per un recettore trans-membrana ad attività tirosin-kinasica, identificato nel 1985 (1) e localizzato sul braccio lungo del cromosoma 10 (10q11.2). L’attivazione fisiologica di RET avviene per interazione con uno dei suoi ligandi endogeni (fattore neurotrofico di derivazione dalle cellule gliali – GDFN –, neurturina – NRTN –, persepina – PSNP –, artemina – ARTN) e con un cofattore di membrana. La formazione del complesso ligando-recettore induce dimerizzazione del recettore e fosforilazione di specifici substrati intra-cellulari.
RET esercita una funzione di controllo fisiologico della differenziazione cellulare, essenziale per lo sviluppo dei neuroni simpatici, parasimpatici ed enterici, del rene, delle cellule para-follicolari C della tiroide e per la spermatogenesi.
La forma familiare di MTC rappresenta il 20-25% di tutti gli MTC, ad elevata penetranza (> 90% all’età di 50 anni) ed è componente unica o manifestazione clinica prevalente di MEN 2 (Neoplasia Endocrina Multipla) (tabella 1):
- MEN 2A: la manifestazione clinica di MTC avviene in genere tra la 3° e la 4° decade;
- MEN 2B: forma più rara, con maggiore aggressività biologica di MTC, che si sviluppa in età infantile (2); spesso i pazienti non hanno familiarità per la sindrome: in oltre il 50% dei pazienti la sindrome è sostenuta da mutazione germinale de novo di RET.
| Tabella 1 Manifestazioni cliniche delle sindromi MEN 2 e loro prevalenza |
||
| Sindrome | Frequenza | Caratteri clinici |
| MEN 2a | ~90-95% | Carcinoma midollare della tiroide (~100%) Feocromocitoma (40-50%) Iperparatiroidismo (20-30%) Varianti:
|
| MEN 2b | ~5-10% | Carcinoma midollare della tiroide (100%) Feocromocitoma (~50%) Habitus marfanoide, neuromi mucosi, ganglioneuromatosi del tratto gastro-enterico, ipertrofia dei nervi corneali |
Storicamente, era riconosciuta una variante delle sindromi MEN conosciuta come “FMTC” (familial medullary thyroid carcinoma), che identificava pazienti con mutazione germinale di RET, ma all’interno di famiglie che presentavano l’MTC come unica manifestazione (ad es. in presenza di mutazione del codone G533C nell’esone 8). In realtà, in alcune di queste famiglie sono stati poi descritti casi di feocromocitoma, arrivando quindi alla conclusione, nelle ultime linee guida ATA, che l’FMTC non dovesse più essere classificata come una sindrome a sé stante, ma come un continuum con la MEN 2A, per non incorrere nel rischio di un mancato riconoscimento di un feocromocitoma (3).
MEN 2A: il 95% di questi pazienti presenta mutazione di RET nei codoni 609, 611, 618, o 620 dell’esone 10 o nel codone 634 dell’esone 11 (4). La penetranza dell’MTC è virtualmente del 100%, mentre una porzione minore di pazienti sviluppa feocromocitoma e iperparatiroidismo primitivo (PHPT), con una frequenza che dipende dal tipo di mutazione RET (vedi tabella 2). I feocromocitomi che si sviluppano nel contesto di sindromi MEN 2A sono quasi sempre benigni, multicentrici e bilaterali. Prima dello sviluppo dell’attuale diagnostica biochimica e genetica per la diagnosi di MTC e mutazione germinale di RET, il feocromocitoma rappresentava la principale causa di morte nei pazienti con MEN 2A (3,5). Il PHPT che si sviluppa nel contesto della MEN 2A è in genere lieve e asintomatico. Anche in questo caso la frequenza dipende dal tipo di mutazione di RET (vedi tabella 2).
- MEN 2A con lichen amiloide cutaneo (CLA): il lichen amiloide cutaneo è un raro disordine, che si può presentare sporadicamente oppure nel contesto di sindromi ereditarie, tra le quali la MEN 2A. La CLA nel contesto della MEN 2A si caratterizza per la presenza di lesioni dermatologiche particolarmente evidenti nella regione scapolare (dermatomi T2-T6). I classici sintomi di CLA includono un intenso prurito, che migliora con l’esposizione solare e peggiora durante i periodi di stress. Le lesioni iperpigmentate di sviluppano solo successivamente, apparentemente a seguito del grattamento. La CLA può essere già presente in età giovanile, prima dell’evidenza clinica di MTC, servendo quindi da precursore della sindrome. La CLA nella MEN 2A si verifica quasi esclusivamente nei pazienti portatori della mutazione di RET nel codone 634 (in circa il 36% dei casi), anche se è stata riportata anche nel codone 804 (3,6,7).
- MEN 2A con Hirschsprung (HD): mutazioni germinali di RET sono presenti nel 50% dei pazienti con HD ereditario e nel 15-20% dei casi di HD sporadico (8). Le mutazioni di RET coinvolte nell’HD nel contesto della MEN 2A sono mutazioni puntiformi dei codoni dell’esone 10: 609 (15%), 611 (5%), 618 (30%) e 620 (50%). L’HD compare nel 7% circa dei pazienti con MEN 2A, viceversa, il 2-5% dei pazienti con HD ha una MEN 2A. L’HD è nella maggior parte dei casi evidente subito dopo la nascita, tuttavia è opportuno escludere l’HD in pazienti adulti con mutazioni di RET nel codone 10 e che lamentino sintomatologia intestinale suggestiva.
MEN 2B: nella sindrome normalmente l’MTC si presenta nella prima infanzia ed è altamente aggressivo, con metastasi regionali e a distanza. In circa il 75% dei casi la MEN 2B si manifesta con mutazioni de novo, mentre nel restante 25% dei casi vi è una storia familiare. Circa il 95% dei pazienti MEN 2B è portatore di mutazioni nell’esone 16 (codone M918T) e meno di un 5% presenta una mutazione dell’esone 15 (codone A883F). Approssimativamente il 50% dei pazienti con MEN 2B sviluppa feocromocitoma. Inoltre i pazienti MEN 2B presentano alcune caratteristiche fenotipiche coinvolgenti la facies (alacrimia infantile, palpebre superiori spesse e invertite, lieve ptosi palpebrale, labbra ispessite, neuromi coinvolgenti la lingua e la mucosa del cavo orale), malformazioni scheletriche (habitus marfanoide, faccia stretta e lunga, piede cavo, petto escavato, scoliosi, epifisiolisi della testa femorale), ganglioneuromatosi lungo tutto il tratto aero-digestivo (3). Praticamente tutti i report in letteratura sulla MEN 2B riguardano la mutazione del codone M918T, mentre l’andamento clinico dei pazienti con mutazione del codone A883F è molto meno nota. Tuttavia, report recenti suggeriscono che i pazienti con mutazione del codone A883F sviluppino MTC con comportamento meno aggressivo se comparato alla mutazione M918T (3).
Originariamente, le linee guida ATA classificavano le mutazioni germinali di RET in 4 categorie (A,B,C,D), corrispondenti a un’aggressività progressivamente peggiore dell’MTC (da A a D) (10). Dato che questo tipo di classificazione generava confusione tra i clinici, le ultime linee guida ATA hanno riclassificato le mutazioni germinali di RET, con la categoria D diventata ora “highest risk (HST)”, la categoria C riclassificata in “high risk (H)” e le categorie A e B raggruppate nella categoria “moderate risk (MOD)”. L’ATA-HST comprende le mutazioni della MEN 2B con mutazione del codone M918T, l’ATA-H i pazienti con mutazione RET nel codone C634 e i pazienti con mutazione del codone A883F e l’ATA-MOD tutte le mutazioni germinali di RET diverse dalla M918T, C634 e A883F.
| Tabella 2 Correlazione tra le mutazioni germinali dell’oncogene RET, il rischio di MTC, l’incidenza di feocromocitoma (FEO), iperparatiroidismo primitivo (PHPT), lichen amiloide cutaneo (CLA) e Hirschsprung (HD) |
||||||
| Mutazione RET | Esone | Rischio di MTC | Incidenza di FEO* | Incidenza di PHPT* | CLA | HD |
| G533C | 8 | MOD | + | - | No | No |
| C609F/G/R/S/Y | 10 | MOD | +/++ | + | No | Sì |
| C611F/G/S/Y/W | 10 | MOD | +/++ | + | No | Sì |
| C618F/R/S | 10 | MOD | +/++ | + | No | Sì |
| C620F/R/S | 10 | MOD | +/++ | + | No | Sì |
| C630R/Y | 11 | MOD | +/++ | + | No | No |
| D631Y | 11 | MOD | +++ | - | No | No |
| C634F/G/R/S/W/Y | 11 | H | +++ | ++ | Sì | No |
| K666E | 11 | MOD | + | - | No | No |
| E768D | 13 | MOD | - | - | No | No |
| L790F | 13 | MOD | + | - | No | No |
| V804L | 14 | MOD | + | + | No | No |
| V804M | 14 | MOD | + | + | Sì | No |
| A883F | 15 | H | +++ | - | No | No |
| S891A | 15 | MOD | + | + | No | No |
| R912P | 16 | MOD | - | - | No | No |
| M918T | 16 | HST | +++ | - | No | No |
| * incidenza: + attorno al 10%, ++ 20-30%, +++ attorno al 50% | ||||||
BIBLIOGRAFIA
- Takahashi M, Ritz J, Cooper GM. Activation of a novel human transforming gene, ret, by DNA rearrangement. Cell 1985, 42: 581-8.
- Williams ED. Histogenesis of medullary carcinoma of the thyroid. J Clin Pathol 1966, 19: 114-8.
- Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015, 25: 567–610.
- Raue F, Frank-Raue K. Genotype-phenotype correlation in multiple endocrine neoplasia type 2. Clinics (Sao Paulo) 2012, 67 suppl 1: 69-75.
- Lips C, Landsvater RM, Hoppener J, et al. Clinical screening as compared with DNA analysis in families with multiple endocrine neoplasia type 2A. N Engl J Med 1994, 331: 828–35.
- Tanaka A, Arita K, Lai-Cheong JE, et al. New insight into mechanisms of pruritus from molecular studies on familial primary localized cutaneous amyloidosis. Br J Dermatol 2009, 161: 1217–24.
- Verga U, Fugazzola L, Cambiaghi S, et al. Frequent association between MEN 2A and cutaneous lichen amyloidosis. Clin Endocrinol (Oxf) 2003, 59: 156–61.
- Attié T, Pelet A, Edery P, et al. Diversity of RET proto-oncogene mutations in familial and sporadic Hirschsprung disease. Hum Mol Genet 1995, 4: 1381–6.
- Jasim S, Ying AK, Waguespack SG, et al. Multiple endocrine neoplasia type 2B with a RET proto-oncogene A883F mutation displays a more indolent form of medullary thyroid carcinoma compared with a RET M918T mutation. Thyroid 2011, 21: 189–92.

