Test di stimolo con calcio gluconato
Simona Censi
UOC di Endocrinologia, Dipartimento di Medicina (DIMED), Azienda Ospedaliera-Università di Padova
(aggiornato al 15/7/2024)
| Test con calcio gluconato | |
| Indicazioni |
|
| Meccanismo d’azione | Le cellule-C para-follicolari esprimono calcium-sensing-receptor in grado di riconoscere il Ca++. La stimolazione di questi recettori porta al rilascio di calcitonina, che sarà più accentuato in presenza di MTC rispetto a un’iperplasia a cellule-C, per essere sostanzialmente assente in caso di tumore neuroendocrino. |
| Controindicazioni | È necessaria un’accurata raccolta anamnestica, per escludere patologie cardiache (es, pregressa torsione di punta, alterazioni del QTc, frequenza < 40 bpm o > 110 bpm e/o presenza di BAV di II o III grado) e assunzione di farmaci, in particolare glicosidi cardioattivi, come la digitale. |
| Precauzioni | Il test va eseguito secondo una procedura rigorosa, in considerazione delle possibili modifiche repentine nei livelli di calcemia con effetti potenzialmente pro-aritmici. |
| Condizioni e manovre preliminari |
|
| Materiale necessario per l’esecuzione | Calcio gluconato 10% fl (contenenti 100 mg/mL di Ca) |
| Relazione con età, sesso, peso corporeo, gravidanza | Dose da somministrare: 25 mg/kg. La quantità di calcio da somministrare deve essere calcolata sul peso corporeo aggiustato (ABW), per evitare il sovra-dosaggio nei soggetti con obesità (fare riferimento alla formula di correzione dal sito www.manuelsweb.com/IBW.htm). Esempio: maschio di 90 kg e 170 cm.
|
| Esecuzione | L’infusione deve essere eseguita alla velocità di 4 mL/min, in almeno 3 minuti (nell’esempio di sopra i 18.9 mL da somministrare in 4 minuti prevedono una velocità di 18.9/4 = 4.7 mL/min). I prelievi vanno eseguiti al basale e poi, partendo dopo la fine dell’infusione, a +2, +5 e +10 minuti, mettendo subito le provette in ghiaccio, per evitare la degradazione a temperatura ambiente della CT da parte delle proteasi plasmatiche. |
| Dosaggio | Calcitonina |
| Possibili effetti collaterali | Il più frequente è la sensazione transitoria di calore, mentre l’alterazione del ritmo più frequentemente registrata è una transitoria bradicardia sinusale; alterazioni del gusto, moderato flushing al volto, parestesie facciali (infrequenti). |
| Parametri da monitorare durante l’esecuzione | ECG |
| Interpretazione | Cut-off > 79 pg/mL nelle femmine (sensibilità 100%, specificità 50%) e > 466 pg/mL nei maschi (sensibilità 94.4%, specificità 80%). |
| Attendibilità e ripetibilità dei risultati | Analoga a quella del test con pentagastrina (non più disponibile e con maggiori effetti collaterali). |
| Giudizio complessivo costo-beneficio e costo-efficacia | In considerazione della sua esecuzione indaginosa, il test è spesso disponibile solo nei centri di terzo livello o comunque attrezzati e con personale esperto nella sua esecuzione. |
| Bibliografia |
|
La sindrome da bassa T3
Romolo Dorizzi
Laboratorio, UO Corelab-Laboratorio Unico di Area Vasta Romagna, Pievesestina di Cesena (FC)
La sindrome da basso T3 (SBT3), o Low T3 Syndrome o Euthyroid Sick Syndrome (ESS) o Non Thyroidal Illness Syndrome (NTIS) può essere descritta come un’alterazione degli esami di funzionalità tiroidea che compare nel corso di malattie non tiroidee (MNT), in assenza di disfunzioni della ghiandola stessa o dell’asse ipotalamo-ipofisario. Dopo la risoluzione della malattia non tiroidea le anomalie degli esami sono completamente reversibili.
Sono state descritte molte alterazioni degli esami tiroidei in corso di una grande varietà di MNT. Le più significative sono quelle caratterizzate da bassi livelli di T3 ed alti livelli di rT3 (da cui deriva il nome della sindrome), anche se anche TSH, T4 e FT4 possono essere interessati dallo stesso tipo di alterazioni.
Alterazioni dell’omeostasi tiroidea si possono verificare in numerose patologie, come malnutrizione cronica, digiuno prolungato, sepsi, infarto del miocardio, bypass coronarico, trapianto di midollo, ustioni, interventi chirurgici, cancro, traumi e la maggioranza delle patologie acute o croniche gastrointestinali, polmonari, cardiovascolari, renali e metaboliche. La prevalenza di una o più anomalie degli esami di funzionalità tiroidea nella NTIS è stata riportata essere compresa tra il 40 ed il 70%.
La prima risposta dell’asse tiroideo ad uno stress fisico severo consiste in una rapida diminuzione del T3 e un aumento dell’rT3, soprattutto come conseguenza di una conversione periferica alterata dell’FT4. Questo fenomeno è dovuto all’inibizione della 5’-monodeiodinazione, che diminuisce ogni volta che l’introito calorico è basso e durante ogni MNT anche lieve. La concentrazione di TSH e T4 aumentano per qualche ora e poi ritornano ai valori di partenza e nei pazienti più gravi anche la concentrazione di T4 può diminuire. Anche se la concentrazione del singolo valore di TSH nella malattia critica acuta è nei limiti, il profilo del TSH è alterato e il picco notturno è assente.
Nel paziente cronico, si aggiungono a queste alterazioni una perdita della secrezione pulsatile del TSH e una caduta del T3, del T4 e dell’FT4. Quando diminuisce l’FT4, si verifica una diminuzione molto forte del T3, che può diventare indosabile mentre la rT3 può rientrare nell’intervallo di riferimento. Le alterazioni sono consistenti con un quadro di ipotiroidismo centrale transitorio. Nella fase di recupero da una NTI, un aumento del TSH (transitoriamente anche oltre il limite superiore del range di normalità) può precedere la normalizzazione del T4.
Meccanismi fisiopatologici
Sono stati proposti diversi meccanismi fisiopatologici per spiegare il fenomeno.
- Alterazioni dell’asse ipotalamo-ipofisario:
- Citochine proinfiammatorie: Interleuchina 1 e 6, TNF-alfa e IFN-beta agiscono sui nuclei paraventricolari dell’ipotalamo, riducendo la produzione di TRH.
- Il digiuno porta ad un abbassamento del livello omeostatico del T3 ed abbassa il “set point” dell’asse ipotalamo-ipofisario. La leptina svolge un’azione significativa tra i mediatori cerebrali e neuroendocrini che concorrono a questo fenomeno.
- Riduzione delle proteine di trasporto degli ormoni tiroidei legata alla condizione della fase acuta: TBG, transtiretina (prealbumina) ed albumina. Dopo un by-pass chirurgico, i livelli di TBG possono abbassarsi del 60% in 12 ore e questo può essere responsabile della diminuzione della concentrazione di T4 e T3.
- Inibizione del legame con le proteine di trasporto e della captazione dell’ormone da parte delle cellule. Spesso, nelle malattie acute, il fegato produce una forma di TBG desialilata, con minor affinità per gli ormoni tiroidei; inoltre, alcuni inibitori del legame con le proteine di trasporto stesse sarebbero associati alla presenza di acidi grassi non esterificati (NEFA) presenti in pazienti critici. Tutto ciò concorre ulteriormente ad abbassare la concentrazione degli ormoni totali.
- Inibizione del trasporto di membrana degli ormoni tiroidei. Tale trasporto richiede energia e la presenza di specifiche proteine che fungono da recettore. Nonostante queste ultime appaiano “sovra-espresse” in pazienti malati, si registra un minor passaggio di ormoni tiroidei all’interno delle cellule. La causa di ciò sarebbe da ascrivere ad inibitori del trasporto come bilirubina, NEFA, acido ippurico e furanoico, spesso aumentati in pazienti critici o alla deplezione di ATP concomitante a molte malattie.
- Riduzione dell’attività deiodinasica: tre tipi di deiodinasi (D1, D2, D3) sono responsabili della trasformazione della T4 in T3, trasformazione che per l’80% avviene a livello dei tessuti periferici. Le citochine, prodotte nella fase acuta, riducono le quantità di mRNA deputato alla sintesi delle deiodinasi D1 (epato-renale) e D2 (del muscolo scheletrico), mentre attivano la deiodinasi D3 che, a livello muscolare ed epatico, porta alla produzione di rT3. Oltre a ciò, la D1 è selenio-dipendente e nei malati critici si ha particolare riduzione di questo oligoelemento (anche se le evidenze sull’importanza di questo fenomeno sono deboli).
Un cenno particolare meritano i metodi di misura degli ormoni tiroidei. Secondo le revisioni critiche più recenti, molti metodi di misura routinaria sono estremamente sensibili ad interferenze che in pazienti malati portano a sottostimare la concentrazione “vera” degli ormoni tiroidei liberi. Studi di confronto con metodi di riferimento hanno ridotto la frequenza di malati con basso FT3 dal 70-80% al 27%. Queste osservazioni fanno ritenere che frequentemente le alterazioni degli ormoni tiroidei in corso di patologie non tiroidee siano riconducibili alla riduzione delle proteine di trasporto e solo molto raramente ad una variazione della concentrazione degli ormoni liberi. L'opportunità di trattare questi quadri mediante somministrazione di ormoni tiroidei è controversa: anzi, il trattamento sembra essere di scarso beneficio se non addirittura dannoso. E’ stato infatti ipotizzato che le alterazioni ormonali durante una grave malattia possano risultare protettive, in quanto impediscono un catabolismo tessutale eccessivo.
Gli esami di funzionalità tiroidea devono essere eseguiti nei pazienti con una patologia severa solo quanto il sospetto di una disfunzione tiroidea è molto elevato. In questo caso l’esecuzione del TSH non è sufficiente e deve essere accompagnata dalla determinazione dell’FT3 e dell’FT4.
Bibliografia
- Warner MH, Beckett GJ. Mechanism behind the non-thyroidal illness syndrome: an update. J Endocr 2010, 205: 1-13.
- Michalaki M, Vagenakis AG, Makri M. Dissociation of the early decline in serum T(3) concentration and serum IL-6 rise and TNFalpha in nonthyroidal illness syndrome induced by abdominal surgery. J Clin Endocrinol Metab 2001, 86: 4198-205.
- Chopra IJ. Euthyroid sick syndrome: is it a misnomer? J Clin Endocrinol Metab 1997, 82: 329-34.
- Bondanelli M, Zatelli MC, Ambrosio MR, et al. Systemic illness. Pituitary 2008, 11: 187-207.
Principi teorici e aspetti tecnici dell'ecografia tiroidea
Claudio M. Pacella
Ospedale Regina Apostolorum, Albano Laziale (RM)
(26 Febbraio 2012)
Fisica degli ultrasuoni
Gli ultrasuoni sono onde acustiche (onde sonore o onde di pressione), con una frequenza di vibrazione al di sopra di 20 chilohertz (kHz) che non sono percepite dell’orecchio umano. L’onda ultrasonora è una deformazione sinusoidale dello spazio in un determinato supporto materiale come l’aria, l’acqua o un tessuto. L’onda acustica, al contrario dei raggi X, necessita di un supporto materiale deformabile.
Le onde ultrasonore inducono localmente delle modificazioni cicliche della densità, della pressione e della temperatura (variabili acustiche) del mezzo elastico attraversato e quindi uno spostamento transitorio delle molecole intorno alla loro posizione di equilibrio. Infatti, ogni elemento del mezzo attraversato dall’onda meccanica oscilla avanti e indietro intorno alla sua posizione di riposo. Il movimento oscillatorio delle molecole si propaga poco a poco in senso longitudinale, senza spostamento di materia e l’onda ultrasonora consiste in una serie longitudinale di compressioni e rarefazioni ad una velocità media di 1540 m/sec.
Gli ultrasuoni usati in diagnostica ecografica sono onde meccaniche, che si propagano con frequenza di vibrazione variabile da 1 a 15 megahertz (MHz). Nella diagnostica ecografica della tiroide si usano frequenze comprese tra 3.5 e 15 MHz: le più alte vengono usate per l’esplorazione dei tessuti più superficiali, mentre si usano frequenze basse per esplorare i tessuti profondi. La scelta di queste frequenze è il risultato di un compromesso tra la capacità di penetrazione degli ultrasuoni nei tessuti, che aumenta a frequenze basse, e la qualità dell’immagine ecografica, che migliora a frequenze alte.
Un impulso ultrasonoro è un onda di pressione, limitata nel tempo e nello spazio. L’impulso viene prodotto da un dispositivo (trasduttore) comunemente chiamato sonda, e inviato nel tessuto bersaglio. La frequenza dell’onda (numero di picchi di pressione per secondo) e la sua lunghezza (distanza tra due picchi pressori) dipendono dalle caratteristiche costruttive della sonda. Man mano che l’onda sonora così prodotta viaggia nel tessuto lungo un tragitto lineare (beam line), un treno di echi di ritorno si dirige verso il trasduttore, dove viene rilevato e analizzato per creare l’immagine ecografica.
Fino al 1970 le onde sonore di riflessione provenienti dalle strutture sottoposte ad esame venivano analizzate in A-mode (Amplitude-mode), sotto forma di picchi verticali lungo l’asse orizzontale di uno schermo a raggi catodici. In tal modo venivano rilevate le dimensioni delle formazioni in esame sotto forma di picchi di differente altezza lungo un asse orizzontale (ampiezza dell’onda in funzione del tempo).
Con l’avvento della analisi bidimensionale, gli echi riflessi vengono analizzati e trasformati in punti luminosi (brigtness-mode) o B-mode. Nelle immagini in B-mode le strutture più riflettenti appaiono più luminose di quelle meno riflettenti (scala dei grigi o Gray-scale resolution). In parole più semplici, l’immagine ecografica è la rappresentazione spaziale delle proprietà di riflessione di una porzione di tessuto di spessore definito. Un'immagine completa si ottiene inviando e ricevendo più volte, in sequenza, il segnale ultrasonoro secondo linee direzionali contigue. Tutti gli echi riflessi in un determinato tempo vengono “rilevati e analizzati” dal trasduttore, che li distribuisce sullo schermo secondo la loro diversa intensità e la loro differente dislocazione nello spazio. L’immagine che ne deriva è formata da un insieme di punti (pixel) di diversa luminosità, più o meno uniformemente distribuiti nello spazio (speckle image).
Nella maggior parte delle applicazioni diagnostiche, le immagini possono essere ricostruite con una frequenza compresa tra 20-40 Hz (fino a 25 Hz - ossia 25 immagini/sec) (temporal resolution). La risoluzione temporale di un'ecografia è il tempo minimo che separa due immagini successive, senza che ci siano perdite di informazioni (motion-mode) o M-mode. Questa modalità di scansione sta alla base dell’immagine real-time che, al pari della fluoroscopia a raggi X, ci dà informazioni in tempo reale sulle strutture in movimento, come arterie e vene e ci permette di visualizzare gli aghi nelle manovre bioptiche.
Gli ultrasuoni, mentre attraversano i tessuti, perdono la loro energia, nel senso che il fascio perde di intensità secondo un coefficiente lineare di attenuazione, che dipende dalle proprietà meccaniche (elasticità, densità e viscosità) del tessuto attraversato (impedenza acustica specifica). In parole più semplici, il tessuto offre, per così dire, resistenza al passaggio dell’onda e ogni tessuto ha un suo specifico grado di resistenza (attenuation). Il coefficiente di attenuazione (impedenza) aumenta con l’aumentare della frequenza dell’onda sonora. In caso di tessuto omogeneo si ha una diminuzione esponenziale dell’energia contenuta in un'onda sonora, che decresce più velocemente al crescere della frequenza. In un tessuto omogeneo l’onda continua a propagarsi in profondità fino a dissipare tutta la sua energia e, vista la stretta correlazione tra la frequenza dell’onda e l’impedenza del tessuto, per visualizzare gli echi di ritorno da strutture profonde dobbiamo usare le frequenze più basse. Quando l’onda acustica attraversa un tessuto eterogeneo (due tessuti con caratteristiche differenti), parte dell’energia viene riflessa all’interfaccia fra i due tessuti e torna verso il trasduttore. Quindi gli echi visualizzati dal trasduttore sono il risultato della interazione dell’impulso acustico incidente con le differenti strutture del mezzo attraversato. I meccanismi alla base della interazione ultrasuoni/tessuti biologici sono tre: la riflessione, la diffusione e l’assorbimento.
L’intensità dell’eco riflesso correla con l’impedenza del tessuto e aumenta con l’aumentare della differenza di impedenza fra i tessuti. Se i tessuti hanno identica impedenza, non ci sono echi riflessi. Se la differenza di impedenza tra i tessuti è molto elevata (ad es. tessuto-aria) quasi tutta l’energia del raggio incidente verrà riflessa e si propaga in una direzione ben definita verso il trasduttore (riflessione speculare). Ad es. le pareti intestinali riflettono il 99.9% dell’energia incidente, mentre l’osso riflette il 30% dell’energia incidente e, come tutte le interfacce molto riflettenti, è all’origine dell’ombra acustica. Questo tipo di interazione avviene quando l’onda incontra grossi ostacoli con area di interfaccia larga, come ad es. tra fegato e diaframma. In questi casi l’oggetto è di dimensioni più grandi della lunghezza d’onda dell’impulso incidente.
La diffusione è il secondo meccanismo di interazione tra l’onda ultrasonora e la materia e si produce quando l’onda ultrasonora incontra ostacoli di forma irregolare, con dimensioni inferiori alla lunghezza d’onda dell’impulso incidente, come ad es. le cellule del sangue. In questo caso l’oggetto colpito dall’onda, vibrando ritrasmette parte dell’energia dell’onda incidente in tutte le direzioni, con diversi angoli di riflessione (scattering). Questa distinzione schematica tra la riflessione prodotta da un grosso ostacolo e la diffusione prodotta da un piccolo ostacolo ci serve per comprendere le modalità di formazione dell’immagine ecografica. In pratica, nell’organismo ci sono ostacoli di ogni grandezza e tutti vengono visualizzati sullo schermo in B-mode grazie a queste due modalità di interazione. In generale, la riflessione ci dà informazioni sui contorni degli organi, mentre la diffusione ci fornisce informazioni sulle strutture interne agli organi stessi. Nell’immagine ultrasonora la maggior parte dei tessuti appare come un insieme di sottili e piccole macchie di diversa intensità, più o meno uniformemente distribuite nello spazio. Questo segnale a macchia (speckle signal), che ci dà informazioni sulla struttura dei parenchimi è, quindi, il risultato dei molteplici echi di scattering che nascono dalle interazioni ultrasuoni/tessuto.
Il terzo meccanismo di interazione è l’assorbimento. In questo tipo di interazione parte dell’energia meccanica dell’impulso incidente viene dissipata sotto forma di energia termica nel tessuto biologico. L’assorbimento è dovuto sia alla viscosità del tessuto che alle reazioni chimiche dell’organismo colpito dalla radiazione ultrasonora. L’energia assorbita provoca un aumento della temperatura del mezzo biologico e non contribuisce alla formazione dell’immagine ecografica.
Le differenze in ampiezza degli echi di ritorno producono l’immagine con diversi gradi di grigio, mentre le differenze nel tempo di rilevamento degli stessi ci dà informazioni sulla profondità della loro sede di origine.
Per avere informazioni sugli echi in movimento, come ad es. quelli generati dalle cellule del sangue, bisogna sfruttare l’effetto Doppler. Se il segnale di ritorno proviene da un oggetto in movimento rispetto al trasduttore, si osserva un cambiamento in ampiezza e in frequenza degli echi riflessi, che si correlano con la velocità dell’oggetto in movimento e con la sua direzione rispetto alla sonda di rilevamento. L’effetto Doppler (CD) rivela la variazione di frequenza dell’eco di ritorno che si verifica ogni volta che il suono è emesso da un oggetto che si avvicina o si allontana dal rivelatore. Con questo metodo è possibile avere informazioni, sotto forma di curve e di segnali sonori, sulla presenza di flusso, sulla sua velocità, sulla direzione del sangue e sulle sue variazioni nel tempo. Con il power Doppler (PW) possiamo avere informazioni sulla presenza di flusso nel tessuto in esame, indipendentemente dalla sua velocità, e quindi avere informazioni accurate sul decorso dei vasi in caso di vascolarizzazione tumorale.
Gli ultrasuoni sono prodotti dalla cosidetta piezoelettricità, che è la proprietà che possiedono certi materiali di poter trasformare l’energia elettrica in energia meccanica, e quindi onde elettriche in onde meccaniche, e viceversa. Alla superficie di questi materiali, opportunamente tagliati, si osservano scariche elettriche quando sono sottoposti a compressione meccanica e, inversamente, si deformano quando sono sottoposti a differenze di potenziale. Il cristallo piezoelettrico più conosciuto è il quarzo, che è stato sostituito nelle applicazioni mediche da materiali in ceramica e da polimeri o da materiali composti dalla associazione di questi due prodotti. Il trasduttore che trasforma un tipo di energia in un’altra, è costituito da questi materiali diversamente assemblati per trasformare l’energia elettrica in energia meccanica e viceversa [1-5].
Strumentazione
L’esame ecografico di un organo di piccolo volume e con ecostruttura fine come la tiroide deve essere analizzato con mezzi tecnici di alta qualità. E’ importante lavorare e studiare i dettagli semiologici su immagini di grandi dimensioni ma ad alta definizione.
Gli ecografi odierni sono ecografi digitali, in grado di convertire i segnali elettrici in numeri. Tutte le operazioni sono eseguite da un processore. Tale trattamento del segnale consente:
- una riduzione del rumore di fondo;
- segnali puliti e senza distorsione;
- rapida e regolare riproducibilità dei ritardi di attivazione dei cristalli, con focalizzazione ottimale a qualunque profondità;
- facilità e versatilità di impiego delle macchine;
- possibilità di selezionare frequenze diverse sullo stesso trasduttore “mulifrequency” (es. 2.25-5 MHz, 7-10 MHz, 8-12 MHz, ecc);
- possibilità di utilizzare differenti formati di scansione;
- possibilità di usare fasci obliqui per ottimizzare la focalizzazione e la percezione del segnale (steering).
In generale si usano tre tipi di sonde:
- una sonda di base lineare, o di superficie, ad alta frequenza (10-14 MHz) e ad alta definizione. Deve essere possibilmente di piccole dimensioni, per renderla maneggevole e facilmente adattabile al collo del paziente, ed equipaggiata con modulo Doppler colore, in grado di registrare i flussi dei piccoli vasi. Presenta il vantaggio di un ampio campo di vista e una buona risoluzione dei piani superficiali. Ha l’inconveniente di fornire immagini piccole e avere una limitata capacità di studio delle strutture profonde per una non favorevole geometria del fascio;
- una sonda convex a grande raggio, o addominale (trapezoidale), con grande campo di vista, è adatta alla misurazione in altezza dei lobi. La frequenza bassa di base di 3.5 MHz fornisce immagini di mediocre qualità e quindi non è utile per lo studio della struttura della ghiandola. Deve essere strettamente riservata alla biometria della tiroide;
- una sonda convex a piccolo raggio, con frequenza intermedia (6-8 MHz), ci permette di studiare agevolmente, grazie al piccolo raggio di curvatura, le strutture plongeantes o retro-sternali. La qualità dell’immagine è un compromesso tra le due prima menzionate, ma comunque consente una risoluzione delle strutture situate in profondità migliore rispetto alla sonda ad alta frequenza. E’ in genere settoriale e quindi maneggevole, ma nel contempo ha lo svantaggio di non dare informazioni sui piani superficiali e ha un campo di vista ridotto.
Le moderne sonde “small parts” si avvalgono di un numero molto elevato di elementi piezoelettrici disposti l’uno accanto all’altro (sino a 200, a seconda del campo di vista e delle dimensioni del trasduttore) a formare una cortina lineare (linear array) ad attivazione pulsata. Sono trasduttori elettronici che usano la tecnologia “a larga banda”, riportata sul loro involucro esterno ad indicare un intervallo di frequenze (es. 5-12 MHz) in relazione all’ampiezza di banda dello spettro emesso (al contrario di quanto avveniva in passato con le sonde meccaniche, contrassegnate con una sola frequenza nominale: ad esempio, 7.5 MHz). Questa tecnologia consente l’emissione di impulsi ultrasonori estremamente brevi con conseguente ottimizzazione della risoluzione spaziale laterale (assiale o di profondità) dell’immagine, definita come l’abilità di un trasduttore di visualizzare con nitidezza (sharpness) come entità separate due linee adiacenti alle diverse profondità (sistemi multifrequenza) lungo l’asse di propagazione del fascio (fig. 1).

Figura 1. L'immagine mostra una sonda lineare multifrequenza. Si tratta di un trasduttore elettronico con tecnologia "a larga banda", riportata sull'involucro esterno dello strumento a indicare l'intevallo di frequenze fruibili (4-13 MHz). Il trasduttore è molto maneggevole e consente sia studi di superficie e vascolari che di profondità (per cortesia della ESAOTE SpA, Genova)
Sul piano pratico, nello studio della tiroide, tali trasduttori permettono una precisa rappresentazione del parenchima ghiandolare e consentono di evidenziare lesioni focali di piccole dimensioni (> 3 mm). Si ottiene con tali sonde la soppressione pressoché completa delle riverberazioni nel campo vicino, con nitidezza dei contorni delle strutture più superficiali della loggia tiroidea come i muscoli sotto-ioidei o il tessuto sottocutaneo della regione anteriore del collo. In più, con il perfezionamento del sistema ad impulsi (chirp coded excitation) è possibile, grazie alla focalizzazione elettronica, opportunamente regolata e selezionata dall’esaminatore, coniugare ad una ottima risoluzione assiale una buona capacità di penetrazione e quindi una valutazione più accurata dei gozzi voluminosi o ad estrinsecazione profonda.
Con i cosidetti trasduttori a matrice 1.5 D, che al posto di una singola filiera di elementi piezoelettrici come nei convenzionali trasduttori lineari elettronici (1D), presentano una matrice di cristalli di piccole dimensioni, ordinati in fila lungo l’asse zy e in colonna lungo l’asse z, è possibile avere una immagine molto omogenea lungo tutto l’asse delle profondità insieme ad una marcata riduzione del rumore di fondo e ad un ottimo rapporto contrasto-rumore.
Grazie alla tecnologia informatica e alla disponibilità di un elevato numero di canali (512, 1024), con la tecnica compound è possibile migliorare sia il rapporto segnale/rumore che il rapporto contrasto/rumore, riducendo in tal modo gli artefatti e rendere l’immagine più nitida nel senso di una migliore delineazione dei dettagli anatomici sia normali che patologici. Con il “beam steering”, infatti, ogni singola immagine ecotomografica è il risultato dell’invio di un numero variabile di frame, ottenuti ciascuno con un diverso angolo di steering e interpolati sulla base di alcuni algoritmi che separano le componenti dovute al segnale da quelle dovute al rumore. In pratica, la cancellazione del segnale proveniente dal rumore è molto significativa e nel caso della tiroide si ottengono vantaggi nella valutazione delle strutture anecogene, come le cisti, nelle quali si ottiene la cancellazione degli echi interni spuri.
Grazie al più elevato rapporto contrasto/rumore è possibile differenziare con maggior confidenza lesioni di piccole dimensioni, specialmente se caratterizzate da una ecostruttura simile al parenchima contiguo, da lievi disomogeneità localizzate. La ricostruzione dell’immagine basata su diversi angoli di incidenza del fascio comporta un migliore “effetto bordo”, legato agli echi riflessi da interfacce situate in posizione non parallela al trasduttore, con la contemporanea riduzione degli artefatti più frequenti e di comune osservazione, quali le ombre acustiche laterali e il cono d’ombra posteriore. Ad esempio, in caso di una lesione rotondeggiante con cono d’ombra posteriore, la diversa inclinazione del fascio consente una riduzione dell’estensione del cono d’ombra e una migliore delineazione del margine anteriore della lesione, per la più efficiente percezione degli echi provenienti da superfici curve (fig. 2).

Figura 2: il disegno mostra una semplificazione della tecnica compund ad attivazione pulsata. Ogni immagine si ottiene interpolando una serie variabile di frame con diversa angolazione (steering). In pratica la diversa inclinazione del fascio determina una marcata riduzione dell'ombra acustica posteriore insieme a una simultanea migliore delineazione (sharpness) dei contorni anteriori di un oggetto rotondeggiante sottoposto a questo tipo di scansione
Tra le innovazioni più recenti va menzionata la cosidetta “extended-field-of-view”, che consente di ampliare le dimensioni laterali del campo di vista dell’immagine ecotomografica mediante un processo di interpolazione tra linee di vista adiacenti in tempo reale. Si ottiene in tal modo una visione panoramica molto nitida di un distretto corporeo di dimensioni superiori rispetto all’ingombro del trasduttore. Nel caso della tiroide è possibile ottenere una visione panoramica completa e molto nitida dell’intera ghiandola e dei rapporti di essa con le strutture adiacenti, quali la trachea, i muscoli sternocleido-mastoidei, le carotidi comuni e le giugulari, con una singola immagine, mediante una sola scansione di traslazione del trasduttore in senso trasversale, oppure rappresentare un’intero lobo secondo il suo asse longitudinale. In tal modo è possibile delineare con chiarezza i reali rapporti topografici di eventuali lesioni con le strutture circostanti [6-9].

Figura 3: console ecografica.
A destra della tastiera e dall’alto in basso i comandi più importanti: PRESET = tasto per scegliere un programma predefinito; PROBE = tasto per selezionare la sonda più adatta alla tipologia d’esame, alla profondità e al distretto anatomico che si desidera studiare; Patient ID = dati di identificazione del paziente; Start/End =inizio e fine dell’esame; BIOPSY = tasto per selezionare il software per le manovre bioptiche; ARCHIVE REV = tasto per selezionare e rivedere un esame archiviato; EXAM REV = tasto per rivedere l’esame in corso; REPORT = tasto per il reporting; MENU = tasto che permette di selezionare i dati che si desiderano immagazzinare nel corso dell’indagine; POWER = tasto per scelta dell’intensità degli echi riprodotti (GAIN = guadagno); MEASURE = tasto che permette la misura delle immagini ecografiche prodotte, con accanto il tasto con l’indicazione +….+ che sono i markers da posizionare ai margini delle immagini da misurare (le dimensioni del’istmo della tiroide, le dimensioni di un lobo, quelle di una formazione solida o liquida, ecc, ecc).
In sede centrale sono indicati i tasti che consentono l’esame Doppler: PW = doppler pulsato e color Doppler (CMF) con il tasto AUDIO che consente di apprezzare in sonoro le velocità di flusso in funzione del tempo; i tasti PW e CW consentono di aprire una finestra di campionamento (box colore) sull’immagine B-Mode, all’interno del quale vi sono migliaia di volumi campione che permettono di visualizzare tutti i flussi presenti indicando nel contempo direzione, velocità e turbolenze; PRF = frequenza di ripetizione del segnale ultrasonoro in trasmissione; FREQ/TEI = frequenza in Doppler PW e CMF in trasmissione.
A sinistra i tasti più importanti sono: Contrast per selezionare il programma di studio dell’organo o della lesione con mezzo di contrasto ecografico; M-MODE per analizzare le onde ultrasonore in monodimensionale e B-MODE in bi-dimensionale (vedi testo); CLIP = per acquisire una serie di immagini in sequenza; L’asterisco permette il fermo immagine.
Tecnica d’esame
Il paziente deve essere disteso supino sul letto d’esame con il collo iperesteso sopra un cuscino o sopra un supporto a cuneo di gommapiuma o materiale similare. In caso di pazienti con collo corto o cifosi cervicale, la rotazione del collo dal lato opposto a quello della sonda può migliorare la valutazione della ghiandola.
L’ecografo usualmente è posto a destra del letto d’esame nello stesso lato dell’operatore, che con la mano destra può manovrare la sonda ed eseguire la scansione del collo del paziente, mentre con la mano sinistra può configurare le caratteristiche fisiche dell’ecografo necessarie all’indagine sia all’inizio che durante l’esecuzione dell’esame.
La tiroide deve essere esplorata in tutta la sua interezza, prima con scansioni preliminari trasversali e longitudinali e poi sistematicamente analizzata secondo piani longitudinali a partire dalla linea mediana per l’esplorazione dell’istmo e poi spostando la sonda lateralmente per analizzare in dettaglio la porzione mediale, centrale e laterale di ciascun lobo, avendo come riferimento cranio-caudale l’osso ioide e il giugulo. L’istmo deve essere sempre valutato con attenzione, non dimenticando di estendere le scansioni cranialmente per rilevare l’eventuale presenza di un lobo piramidale o di un dotto tireo-glosso. Lo studio deve essere completato lateralmente con la valutazione dell’asse vascolare rappresentato dalla carotide e dalla giugulare che rappresentano il confine laterale di ciascun lobo.
Attenta deve essere la valutazione delle catene linfonodali latero-cervicali. Quindi si devono eseguire scansioni di dettaglio secondo piani trasversali sia dei poli che della parte centrale di ciascun lobo. Scansioni caudali ai poli inferiori e al giugulo servono per evidenziare eventuali linfonodi patologici ricorrenziali. La valutazione dei poli inferiori della ghiandola può essere migliorata durante la deglutizione, con lo scopo di sollevare momentaneamente la porzione caudale dei lobi stessi al di sopra del margine superiore del piano sternale.
Quando si esegue l’esame con color Doppler è bene selezionare regolazioni della macchina idonee allo studio dei flussi intra-parenchimali. Le macchine hanno preset specifici per lo studio dei flussi lenti. Per valutare il decorso dei vasi è più utile ricorrere al power-Doppler, data la sua minore sensibilità all’angolo Doppler.
Per un'eventuale analisi spettrale, onde ottenere stime velocimetriche del flusso sia delle arterie intra-parenchimali che dei grossi vasi tiroidei, bisogna ricorrere alla correzione angolare, parametro non necessario quando si debbano effettuare misure semi-quantitative, come l’indice di resistenza o di pulsatilità.
Refertazione
L’esame ecografico può dare informazioni importanti sia in caso di patologia diffusa che in caso di patologia nodulare della ghiandola.
Nella patologia nodulare l’indagine deve fornire informazioni utili al management clinico delle lesioni e fornire dati morfologici sulla loro eventuale malignità. Pertanto bisogna accuratamente ricercare e descrivere in maniera appropriata i seguenti caratteri.
- Per le dimensioni, il nodulo grande va misurato secondo i tre diametri perpendicolari fra loro e va calcolato il volume moltiplicando i tre valori per 0.5 (volume ellissoide), mentre in caso di lesioni piccole basta il solo diametro più grande. I calipers di riferimento vanno posti al margine esterno della lesione e, quando presente, all’esterno dell’alone.
- In base al contenuto, il nodulo va classificato tenendo conto del rapporto percentuale della componente liquida rispetto a quella solida. Quindi si definisce solido il nodulo con una percentuale liquida ≤ 10%, prevalentemente solido quando la componente fluida è compresa tra il 10% e il 50%, prevalentemente cistico quando la componente fluida cade in un range tra il 50 e il 90%, cistico quando la componente cistica supera il 90%. Si definisce spongiforme un nodulo costituito da un aggregato di multiple microcisti variamente disseminate in più del 50% del volume del nodulo [10].
- La forma di un nodulo è rotonda, ovoide o irregolare. E’ il rapporto fra il diametro antero-posteriore del nodulo e il suo diametro assiale, misurati sia con scansioni trasversali che longitudinali, che definisce la sua forma. E’ rotondo quando il suo diametro antero-posteriore è uguale al suo diametro trasverso o ovoide quando il suo diametro antero-posteriore è inferiore al suo diametro trasverso; è più alto che largo, ma sempre di forma ovoidale, quando il suo diametro antero-posteriore è più lungo del suo diametro trasverso; è irregolare quando non è riconducibile a nessuna delle tre categorie prima riportate [11].
- Il margine può essere liscio, irregolarmente spiculato o sfumato mal definito. Con le sonde ad alta definizione il margine mal definito può essere più propriamente valutato e classificato studiando con attenzione i contorni, se semplicemente lobulati o seghettati ed appuntiti [12].
- La ecogenicità ci dà informazioni sulla componente solida del nodulo, che può essere classificata come segue:
- marcatamente ipoecogeno quando la sua ecogenicità è più bassa di quella del muscolo adiacente;
- ipoecogeno quando il suo grado di ecogenicità è inferiore a quello del tessuto ghiandolare tiroideo contiguo;
- isoecogeno quando la sua ecogenicità è simile a quella del parenchima ghiandolare contiguo;
- iperecogeno quando il nodulo appare più ecogeno del tessuto contiguo [11-13].
- Le calcificazioni possono essere microcalcificazioni, quando appaiono sotto forma di sottili echi puntiformi con dimensioni inferiori al mm o meno, con o senza cono d’ombra posteriore, o macrocalcificazioni, quando le calcificazioni hanno dimensioni superiori al mm con definito cono d’ombra posteriore, o sono calcificazioni ad anello quando sono disposte alla periferia del nodulo con morfologia curvilinea o a guscio d’uovo[14].
- La invasione extra-ghiandolare va ricercata verificando se il nodulo appare completamente immerso nella ghiandola o invece oltrepassa la capsula del lobo invadendo le strutture adiacenti come il tessuto peri-tiroideo, la trachea, l’esofago o la cartilagine tiroidea.
- La vascolarizzazione con il color-Doppler, ma più opportunamente con il power-Doppler, va studiata per valutare la tortuosità del decorso dei vasi intra-nodulari o peri-nodulari e l'irregolarità delle pareti dei vasi in esame. La differenziazione va fatta fra l’assenza di vascolarizzazione, la presenza di vascolarizzazione peri-nodulare o intra-nodulare o vascolarizzazione diffusa [15].
- In caso di noduli multipli sarà bene descriverne numero, sede, morfologia e struttura, riportando i dati in un grafico o in un disegno di riferimento per confrontarli ad ogni nuovo esame. In caso di gozzo sarà bene studiare solo il nodulo o i noduli sospetti per malignità.
Bibliografia
- Zagzebski J (ed). Essentials of ultrasound physics. St Louis, Mo: Mosby, 1996.
- Thomenius K (ed). Instrumentation for B-mode imaging. Oak Brook, Ill: Radiological Society of North America, 2000.
- Burns PN. The physical principles of Doppler and spectral analysis. J Clin Ultrasound 1987, 15: 567-90.
- Martinoli C, Derchi LE, Rizzatto G, et al. Power Doppler sonography: general principles, clinical applications, and future prospects. Eur Radiol 1998, 8: 1224-35.
- Carson P. Ultrasound tissue interaction. In: Goldman L, Fowlkes J (eds). Categorical course in diagnostic radiology physics: CT and US cross-sectional imaging. Oak Brook, Ill Radiological Society of North America 2000: 9-20.
- Rizzatto G. Evolution of ultrasound transducers: 1.5 and 2D arrays. Eur Radiol 1999, 9 Suppl 3: S304-6.
- Rizzatto G. Superficial structures. Ultrasound Med Biol 2000, 26 Suppl 1: S116-22.
- Jedrzejewicz T. System architecture for various image reconstruction and processing techniques. Eur Radiol 1999, 9 Suppl 3: S334-7.
- Whittingham TA. Broadband transducers. Eur Radiol 1999, 9 Suppl 3: S298-303.
- Moon WJ, Jung SL, Lee JH, et al. Benign and malignant thyroid nodules: US differentiation--multicenter retrospective study. Radiology 2008, 247: 762-70.
- Kim EK, Park CS, Chung WY, et al. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid. AJR Am J Roentgenol 2002, 178: 687-91.
- Papini E, Guglielmi R, Bianchini A, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 2002, 87: 1941-6.
- Frates MC, Benson CB, Charboneau JW, et al. Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology 2005, 237: 794-800.
- Yoon DY, Lee JW, Chang SK, et al. Peripheral calcification in thyroid nodules: ultrasonographic features and prediction of malignancy. J Ultrasound Med 2007, 26: 1349-55; quiz 1356-7.
- Frates MC, Benson CB, Doubilet PM, et al. Can color Doppler sonography aid in the prediction of malignancy of thyroid nodules? J Ultrasound Med 2003, 22: 127-31; quiz 132-4.
Ecografia tiroidea nella pratica clinica
Vincenzo Di Donna1, Erika Leone1, Enrico Papini2, Salvatore Maria Corsello1
1Fondazione Policlinico Universitario “A. Gemelli” IRCCS, Roma
2Ospedale Regina Apostolorum, Albano Laziale (RM)
(aggiornato all'11 gennaio 2020)
Questo capitolo è dedicato all’impiego clinico della ecografia nella patologia tiroidea. Per i presupposti teorici della ecografia, gli strumenti e le modalità di esecuzione vedi “Aspetti tecnici della ecografia tiroidea”; per la procedura dell’ecografia come guida all’ago-aspirato e come ausilio nelle terapie termo-ablative dei noduli tiroidei vedi “Ago-aspirato eco-guidato tiroideo” e “Overview sulle tecniche ablative percutanee"; per le immagini ecografiche illustranti i quadri clinici vedi “Atlante ecografico di patologia tiroidea”.
L’ecografia è la metodica di imaging gold standard per la valutazione diagnostica della patologia tiroidea, con particolare riferimento alla stima del rischio di malignità dei noduli e alla conseguente indicazione all’ago-aspirato.
INDICAZIONI ALL’ESECUZIONE DELL’ESAME ECOGRAFICO
L’ecografia tiroidea non deve essere usata per lo screening della popolazione generale, in considerazione dell'elevata prevalenza della patologia nodulare (50-60%), della frequenza relativamente bassa (~5%) delle neoplasie maligne e del comportamento generalmente scarsamente aggressivo dei carcinomi differenziati, che ne costituiscono la grande maggioranza (> 90%) (1-3).
Indicazioni all’esecuzione dell’esame ecografico:
- anamnesi con fattori di rischio per malignità (pregressa irradiazione del distretto testa-collo, anamnesi familiare di carcinoma midollare e/o MEN 2 e/o carcinoma papillifero in parenti di 1° grado, disfonia, disfagia o dispnea persistenti);
- gozzo o noduli tiroidei palpabili;
- adenopatia cervicale con caratteri sospetti per malignità;
- reperto incidentale di lesione focale tiroidea, evidenziata da altre tecniche di imaging (TAC, RM, 18F-FDG-PET, scintigrafia con 99mTc-sestaMIBI). Tale indicazione ha particolare rilievo nei casi di captazione focale in corso di 18F-FDG-PET o scintigrafia con 99mTc-sestaMIBI, a causa del più elevato rischio di malignità in tali circostanze;
- sospetto clinico di tireopatia diffusa (gozzo, tiroidite di Hashimoto, morbo di Graves, tiroidite subacuta);
- follow-up delle tireopatie accertate;
- valutazione precedente alla tiroidectomia o al trattamento con radio-iodio.
PATOLOGIA TIROIDEA DIFFUSA
In linea generale si possono individuare i seguenti criteri di base (4,5).
Volume
Non c’è ad oggi un consenso unanime su quale sia il normale volume ghiandolare, che appare comunque correlato al sesso, al peso corporeo e, soprattutto in epoca pediatrica, all’età.
Il gozzo è, per definizione, caratterizzato da un aumento di volume della ghiandola in toto (secondo alcuni autori volume > 20 cc, secondo altri diametro antero-posteriore dei lobi > 2 cm).
La tiroidite di Hashimoto può evolvere sia verso una marcata ipertrofia, sia verso una progressiva ipotrofia della ghiandola.
Il morbo di Graves è associato a gozzo diffuso.
La tiroidite subacuta può associarsi a volume normale o aumentato.
Nelle fasi avanzate dei carcinomi indifferenziati o dei sarcomi (rari) e nel linfoma tiroideo, è generalmente presente un notevole e irregolare aumento volumetrico di un lobo o dell’intera ghiandola.
Ecogenicità ed eco-struttura
La tiroide normale appare tipicamente iperecogena rispetto alle strutture vicine, in relazione a un fisiologico rapporto tra cellule e colloide, con profili regolari ed eco-struttura omogenea legata alla fisiologica organizzazione follicolare del parenchima ghiandolare (fig. 1).

Figura 1. Tiroide normale
L’ipoecogenicità è espressione di flogosi ed è causata dall’aumento delle cellule infiammatorie rispetto alla colloide. La flogosi può essere acuta (molto rara dopo l’avvento degli antibiotici), subacuta (tiroidite di De Quervain) o cronica (tiroidite autoimmune). La marcata ipoecogenicità ha un elevato valore predittivo per tireopatia autoimmune (fino al 95% dei casi) e si associa a margini ghiandolari lobulati o irregolari (6).
Nella tiroidite subacuta generalmente si riscontrano aree intensamente ipoecogene, a distribuzione zonale o lobare, la cui scansione ecografica provoca caratteristicamente dolore (fig. 2). La ripetizione dell’indagine ecografica nel tempo o in corso di terapia anti-infiammatoria consente di evidenziare cambiamenti nella localizzazione ed estensione delle aree di flogosi (9,10).

Figura 2. Tiroidite subacuta: a sinistra istmo e regione para-istmica destra, a destra lobo destro.
Nelle tireopatie autoimmuni le aree ipoecogene sono generalmente diffuse e possono evolvere sotto forma di aree lobulate delimitate da setti ecogeni, espressione di fibrosi reattiva, assumendo un carattere pseudo-nodulare, che è necessario distinguere dalle vere lesioni tiroidee (fig. 3). Rispetto a queste ultime, le aree pseudo-nodulari sono nella maggior parte dei casi mal delimitabili e meno riproducibili nel passaggio tra le scansioni trasversale e longitudinale. La disomogeneità dell’eco-struttura ghiandolare può essere fine o grossolana, diffusa o, in alcuni casi, circoscritta solo ad alcune porzioni della ghiandola (forme localizzate).

Figura 3. Quadro ecografico di tiroidite cronica autoimmune: diffusa ipoecogenicità ed ecostruttura disomogenea con aree pseudo-nodulari ipoecogene e strie fibrose iperecogene
Il linfoma della tiroide, primitivo o espressione di una malattia sistemica, si presenta generalmente come un gozzo teso e dolorabile, spesso con caratteristiche ecografiche simili alla tiroidite di Hashimoto. Il pattern ecografico tipico del linfoma tiroideo è costituito da una massa solida nell’ambito di una ghiandola fortemente aumentata di volume, ipoecogena (rispetto al tessuto tiroideo circostante) o, più spesso, molto ipoecogena (rispetto ai muscoli pre-tiroidei), con caratteristiche variabili dei margini (7,8) (fig. 4). L’ipoecogenicità è in questo caso dovuta sia all’aumento delle cellule infiammatorie che neoplastiche.

Figura 4. Linfoma tiroideo
Nelle fasi avanzate dei carcinomi indifferenziati o in alcune rare forme di neoplasia (e.g. carcinoma sclerosante diffuso, sarcoma tiroideo), può essere coinvolto un intero lobo, che assume un'ecostruttura disomogenea e rimaneggiata, con ipoecogenicità, anche in questo caso determinata dall’aumento delle cellule sia infiammatorie che neoplastiche, invasione delle parti molli peri-ghiandolari, linfoadenopatie secondarie spesso inglobate. La presenza di zone di necrosi e grossolane calcificazioni è utile per la diagnosi differenziale con il linfoma tiroideo.
Vascolarizzazione
L’esame Doppler può evidenziare ipervascolarizzazione delle aree sede di flogosi, generalmente moderata nella tiroidite di Hashimoto e assente nelle aree di tiroidite subacuta.
La malattia di Basedow è caratterizzata da aumento diffuso della vascolarizzazione, che, quando particolarmente elevata e caotica, assume l’aspetto del cosiddetto “inferno tiroideo” (11) (fig. 5).

Figura 5. A sinistra tiroidite cronica autoimmune, a destra morbo di Basedow, con quadro di "inferno tiroideo".
PATOLOGIA NODULARE
Il rischio di malignità è simile nei pazienti con nodulo tiroideo singolo o con lesioni multiple nel contesto di un gozzo. In caso di tireopatie multi-nodulari, oltre alla descrizione sintetica del volume e della struttura ghiandolari, bisogna descrivere numero, sede e dimensioni dei noduli. Maggiore attenzione e dettaglio nella descrizione devono essere specificamente focalizzati sui noduli che presentino caratteristiche ecografiche associate a maggior rischio di malignità e sulla presenza/assenza di adenopatie sospette o segni di crescita extra-capsulare.
Numerosi studi, sia retrospettivi che prospettici, hanno cercato di identificare le caratteristiche ecografiche maggiormente predittive del rischio di malignità dei noduli tiroidei. Le valutazioni di specificità e sensibilità riportate in letteratura per i diversi parametri sono molto variabili e a volte gravate da bias metodologici ed elevata eterogeneità degli studi. Inoltre, l'accuratezza diagnostica dei segni ecografici di malignità consente solo in una minoranza dei casi la certezza della diagnosi di natura delle lesioni e la loro corretta interpretazione varia in rapporto all’esperienza dell’operatore e al livello di attrezzatura utilizzata (12,13). Sono riportati di seguito i singoli parametri ecografici sul cui significato diagnostico c’è il maggior consenso in letteratura. La grande maggioranza dei dati disponibili si riferisce alla popolazione adulta e al carcinoma papillifero della tiroide.
Forma
L’aspetto “taller than wide” (nodulo “più alto che largo”, con diametro antero-posteriore maggiore del diametro trasverso nella scansione trasversale) è associato a maggior rischio di malignità, con elevata specificità (fig. 6). Lo sviluppo prevalentemente verticale del nodulo è, infatti, fortemente predittivo di malignità, perché espressione di una crescita centrifuga della lesione attraverso i piani tissutali. Le lesioni benigne, al contrario, tendono ad accrescersi orizzontalmente, lungo una direzione parallela ai piani ghiandolari (fig. 7). La sensibilità diagnostica di questo parametro tuttavia è bassa, perché i carcinomi differenziati (e in particolare i micro-carcinomi) tendono ad apparire come lesioni rotondeggianti e ben delimitate.

Figura 6. Nodulo tiroideo in scansione longitudinale, fortemente ipoecogeno a sviluppo prevalentemente verticale, a margini irregolari e con presenza di alcuni spot iperecogeni intra-lesionali. I rapporti del nodulo con i piani posteriori sono sospetti per invasione della capsula tiroidea.

Figura 7. Nodulo con accrescimento orizzontale lungo una direzione parallela ai piani ghiandolari.
Margini
Il reperto di margini spiculati o micro-lobulati è fortemente predittivo di malignità, perché espressione di accrescimento infiltrativo e non espansivo (fig. 8). Al contrario, margini indistinti e mal definiti possono essere presenti sia in lesioni maligne che benigne. Alcuni noduli benigni, infatti, sono incompletamente incapsulati e i loro margini possono confondersi con il tessuto tiroideo circostante.

Figura 8. Margini spiculati, con micro-calcificazioni. Carcinoma papillifero.
Margini lisci e ben definiti, così come la presenza di un alone ipoecogeno periferico uniformemente sottile (“halo sign”), sono caratteri fortemente predittivi di benignità (fig. 9); si pensa che l’alone periferico possa essere dovuto alla capsula del nodulo, ai vasi circostanti o alla compressione del parenchima adiacente. Si ricordi tuttavia che i micro-carcinomi papilliferi di piccole dimensioni appaiono spesso come lesioni tondeggianti a margini ben definiti.

Figura 9. Halo sign.
Ecogenicità
L’ipoecogenicità è dovuta all’aumento della quota cellulare rispetto alla colloide. Una marcata ipoecogenicità (simile a quella dei muscoli pre-tiroidei) è associata ad aumento del rischio di malignità con elevata specificità (fig. 10); talvolta può essere difficile distinguerla dall’ecogenicità di una raccolta liquida densa, ma l'uso del Doppler e i cambiamenti di posizione sono dirimenti nei casi dubbi. È importante differenziarla dalla debole ipoecogenicità (valutata rispetto al parenchima tiroideo circostante), perché questa è comune tanto alla patologia maligna che benigna e ha una minore accuratezza diagnostica (fig. 11).

Figura 10. Nodulo tiroideo marcatamente ipoecogeno a margini regolari in sede para-carotidea. In caso di marcata ipoecogenicità può essere difficile distinguere un nodulo solido da una raccolta liquida densa. L'uso dell'ecodoppler e i cambiamenti di posizione sono dirimenti nei casi dubbi.

Figura 11. Nodulo debolmente ipoecogeno: a sinistra scansione trasversale, a destra scansione longitudinale.
L’isoecogenicità, legata al mantenimento del normale rapporto colloide/cellule, soprattutto nel contesto di noduli multipli, omogenei e parzialmente confluenti nell’ambito di una ghiandola aumentata di volume, è fortemente suggestiva di gozzo nodulare benigno (fig. 12).

Figura 12. Scansione longitudinale della tiroide. È presente nodulo con ecogenicità e tessitura del tutto simile al tessuto tiroideo circostante (isoecogeno). I margini sono ben definiti da un sottile alone ipoecogeno incompletamente visualizzato.
Sia l’aspetto spongiforme, definito da una isoecogenicità con multiple e fini cribrature colloidi (> 50% del nodulo) (fig. 13), che l’anecogenicità, indicativa di una lesione fluida, sono altamente suggestivi di benignità. In particolare, le lesioni cistiche con assenza di aggetti endo-luminali o pareti ispessite sono pressoché invariabilmente benigne (fig. 14). Cautela deve essere rivolta, al contrario, alle lesioni complesse, caratterizzate da ampia ma non esclusiva componente liquida, soprattutto se in presenza di micro-calcificazioni o intensa vascolarizzazione.

Figura 13. Nodulo «spongiforme»

Figura 14. Nodulo cistico con setto periferico
Le neoplasie follicolari (sia adenomi che carcinomi) generalmente appaiono come noduli isoecogeni o debolmente ipoecogeni, omogenei, con vascolarizzazione intra-nodulare e alone periferico ben definito.
Micro-calcificazioni
Sono fortemente sospette per un carcinoma papillifero, perché espressione della presenza di corpi psammomatosi (depositi calcifici laminari all’interno delle papille tumorali). Sfortunatamente, l’elevata specificità di questo reperto si associa a una sensibilità piuttosto bassa. Il cono d’ombra posteriore è normalmente assente in caso di micro-calcificazioni singole (fig. 8), mentre può essere presente per quelle raggruppate (fig. 15). È necessaria un’attenta diagnosi differenziale rispetto a spot iperecogeni di altra natura, principalmente le “comet tails” provocate dall’interfaccia fra le componenti solide e colloidi dei noduli misti (fig. 16).

Figura 15. Nodulo ipoecogeno lobo destro, di aspetto rotondeggiante, con numerose micro-calcificazioni intra-lesionali. il raggrupparsi delle micro-calcificazioni causa un cono d'ombra posteriore normalmente assente in caso di singole micro-calcificazioni.

Figura 16. Artefatto «comet tail»
Alcuni carcinomi papilliferi, in particolare la variante sclerosante, possono apparire anche come micro-calcificazioni intra-parenchimali diffuse (“a cielo stellato” o a “tempesta di neve”), in assenza di noduli associati (14-16).
Macro-calcificazioni
Possono essere intra-nodulari o a guscio d’uovo (figg. 17-18), continue, frammentate o grossolane ("coarse calcifications"), nel contesto di gozzi di vecchia data (come evoluzione di aree distrofiche o emorragiche), ma anche in un'elevata percentuale di carcinomi midollari e anaplastici. Il loro significato deve quindi essere valutato nel contesto degli altri caratteri ecografici della lesione: sono caratteri di sospetto marcata ipoecogenicità, disomogeneità strutturale, irregolarità o mancata delimitazione dei margini (fig. 19). In particolare, è suggestiva di malignità la presenza di una rima calcifica interrotta, con estensione del tessuto nodulare oltre il margine calcifico stesso.

Figura 17. Calcificazione «a guscio d'uovo»

Figura 18. Macro-calcificazione intra-nodulare con cono d'ombra posteriore.

Figura 19. Macro-calcificazioni grossolane e micro-calcificazioni (carcinoma papillifero)
Estensione extra-capsulare
L’estensione della lesione oltre la capsula tiroidea e l’invasione dei muscoli pre-tiroidei o dei tessuti e organi vicini, sono altamente indicativi di malignità, con specificità molto alta (prossima al 100%), ma sensibilità molto bassa. L’estensione extra-capsulare va sospettata in caso di rigonfiamento, interruzione e abutment (deformazione a forma di spalla; controversa dal punto di vista del significato clinico) della linea iperecogena che rappresenta la capsula tiroidea (fig. 20).

Figura 20. A sinistra, nodulo affiorante a livello della capsula tiroidea, che appare come una linea iperecogena interrotta. A destra, nodulo che deforma la capsula tiroidea senza chiara evidenza di estensione extra-ghiandolare (abutment).
Linfoadenopatie
La presenza di linfoadenopatie con caratteri sospetti per malignità (aumento di volume con assenza di ilo vascolare, degenerazione cistica, micro-calcificazioni) ha specificità molto alta (prossima al 100%), soprattutto in caso di associazione di più segni, ma sensibilità relativamente bassa. Costituiscono caratteri di sospetto meno specifici, soprattutto se isolati, l’aspetto rotondeggiante (diametro antero-posteriore ≥ diametro longitudinale), l’ipoecogenicità e la presenza di vascolarizzazione vivace e con arborizzazione anomala (17) (fig. 21).

Figura 21. Metastasi linfonodale da carcinoma papillifero: a sinistra scansione trasversa, a destra scansione longitudinale.
Vascolarizzazione
L'ipervascolarizzazione intra-lesionale è frequente nei carcinomi tiroidei, ma il reperto è di comune osservazione anche nei noduli benigni, soprattutto se funzionalmente autonomi. Inoltre, alcuni micro-carcinomi papilliferi possono apparire avascolari al segnale color- o power-Doppler. La vascolarizzazione intra-lesionale caotica presenta maggiore specificità (fig. 22).

Figura 22. Da sinistra a destra: vascolarizzazione esclusivamente periferica in due noduli contigui citologicamente benigni; vascolarizzazione periferica con segnali intra-nodulari accennanti in adenoma follicolare; intensa vascolarizzazione intra-lesionale a carattere caotico in carcinoma follicolare tiroideo.
Dimensioni e accrescimento
Il volume del nodulo e la sua velocità di accrescimento non consentono di distinguere, nella maggioranza dei casi, le lesioni benigne da quelle maligne. Molti noduli benigni presentano una crescita lenta nel tempo, ma solo una minoranza di tumori a comportamento aggressivo (carcinomi scarsamente differenziati o anaplastici, linfomi e sarcomi della tiroide) si distinguono da essi per il rapido incremento dimensionale (nel corso di settimane o mesi).
In considerazione della variabilità inter ed intra-osservatore dell'esame ecografico, vi è ampio consenso nel ritenere significativa una crescita del nodulo se maggiore di 2 mm e del 20% in almeno due diametri oppure se maggiore del 50% del suo volume.
Secondo una revisione sistematica e metanalisi di 41 studi dal 1989 al 2012, su circa 30.000 noduli non selezionati in più di 10.000 pazienti con diagnosi di malignità confermata istologicamente, il rischio di malignità delle singole caratteristiche ecografiche, espresso in termini di Odds Ratio, varia come riportato in tabella 1 (18).
| Tabella 1 Odds ratio (OR) delle singole caratteristiche ecografiche associate con aumentato rischio di malignità (modificata da 18) |
|||
| Caratteristica ecografica | OR | Intervallo di confidenza (95%) | P |
| Forma “taller than wide” | 10.15 | 6.72-15.33 | < 0.001 |
| Assenza di “halo sign” | 7.14 | 3.71–13.71 | 0.004 |
| Micro-calcificazioni | 6.76 | 4.72–9.69 | < 0.001 |
| Margini irregolari | 6.12 | 3.12–12.02 | < 0.001 |
| Ipoecogenicità | 5.07 | 3.47–7.43 | < 0.001 |
| Ecostruttura solida | 4.69 | 2.63–8.36 | < 0.001 |
| Vascolarizzazione intra-nodulare | 3.31 | 1.81–0.06 | < 0.001 |
| Nodulo ≥ 4 cm | 1.63 | 1.04–2.55 | 0.03 |
| Nodulo singolo | 1.43 | 1.09–1.88 | 0.01 |
INDICAZIONI ALL’AGO-ASPIRATO (FNA)
Nessun carattere ecografico da solo è in grado di predire con sufficiente accuratezza il rischio di malignità e dovrebbe essere usato un approccio basato sulla combinazione di più caratteristiche (“classic pattern” approach). Negli ultimi dieci anni sono stati proposti vari sistemi di classificazione dei reperti ecografici del nodulo tiroideo, al fine di: uniformare il linguaggio di refertazione, stratificare il rischio di malignità, guidare l’indicazione all’agoaspirato tiroideo, diagnosticare le neoplasie maligne clinicamente significative ed evitare il rischio di overdiagnosis e overtreatment. Sono inoltre allo studio sia un sistema unico di classificazione, che raccolga e sintetizzi gli elementi principali degli altri, sia sistemi di intelligenza artificiale in grado di migliorare la performance diagnostica dell’ecografia tiroidea.
Sono riportati di seguito i sistemi sui quali si ha maggior consenso a livello internazionale (1,2,19-23), tutti basati principalmente sul carcinoma papillifero e ancora in fase di validazione in studi prospettici su larga scala. La valutazione dei fattori di rischio clinici per carcinoma della tiroide deve comunque sempre costituire parte integrante della valutazione diagnostica del nodulo tiroideo.
EU-TIRADS (European Thyroid Imaging and Reporting Data System)
Comprende 5 categorie: normale, benigno, rischio basso, rischio intermedio, rischio alto (tabella 2).
| Tabella 2a Definizioni EU-TIRADS |
|
| Composizione | Solido: componente liquida < 10%. Misto prevalentemente solido: componente liquida 10-50%. Misto prevalentemente cistico: componente liquida 50-90%. Cistico: totalmente o quasi totalmente liquido. |
| Forma | Ovale: diametro antero-posteriore (AP) < diametro trasverso (T) nelle scansioni trasversa e longitudinale. Arrotondata: diametro AP = T nelle scansioni trasversa e longitudinale. “Taller than wide”: diametro AP/T >1. “Taller than long”: diametro AP/longitudinale (L) >1. |
| Ecogenicità | Nella tiroidite autoimmune l'ecogenicità può essere definita rispetto alle ghiandole salivari sotto-mandibolari considerata come normale. Debole ipoecogenicità: rispetto al tessuto tiroideo normale. Marcata ipoecogenicità: rispetto ai muscoli pre-tiroidei. |
| Ecostruttura | Disomogenea: porzione solida del nodulo mista iso ed ipoecogena. Omogenea: porzione solida del nodulo di aspetto uniforme. |
| Margini | Irregolari: spiculati (irregolari con angoli acuti) o micro-lobulati (ondulati) se presenti almeno una lobulazione o spiculazione. Mal definiti: mancanza di una chiara delimitazione rispetto al tessuto tiroideo circostante. Regolari. |
| Macro-calcificazioni | Foci ecogeni > 1 mm con ombra posteriore. |
| Spot iperecogeni | Foci ecogeni peri-millimetrici, che possono corrispondere a:
|
| Estensione extra-tiroidea | Va sospettata in caso di rigonfiamento, interruzione e abutment della capsula tiroidea. |
| Vascolarizzazione | Tipo I: assenza di flusso. Tipo II: flusso peri-nodulare e/o intra-nodulare lieve. Tipo III: flusso intra-nodulare marcato e peri-nodulare lieve. |
| Tabella 2b Classificazione EU-TIRADS |
|||
| Categoria | Caratteristiche noduli | Rischio di malignità (%) | Indicazione a FNA |
| EU-TIRADS 1 | Assenti | / | / |
| EU-TIRADS 2 (benigno) | Totalmente cistici (anche settati). Interamente spongiformi. |
~ 0 | Sintomi compressivi |
| EU-TIRADS 3 (rischio basso) | Con forma ovale, margini lisci, iso o iperecogeni, senza caratteristiche di rischio alto. | 2-4 | > 20 mm* |
| EU-TIRADS 4 (rischio intermedio) |
Con forma ovale, margini lisci, debole ipoecogenicità**, senza caratteristiche di rischio alto.
|
6-17 | > 15 mm |
| EU-TIRADS 5 (rischio alto) | Con almeno uno tra:
|
26-87 | > 10 mm° < 10 mm in caso di linfonodi sospetti o crescita del nodulo, preferenza del paziente |
| In caso di linfonodi sospetti e/o estensione extra-tiroidea: eseguire sempre FNA. *In caso di noduli isoecogeni raggruppati o confluenti: eseguire FNA in caso di uno o più noduli > 20 mm. **In caso di ecogenicità eterogenea della componente solida, la presenza di tessuto ipoecogeno classifica il nodulo nel rischio intermedio. °In caso di un primo esame citologico benigno, l’FNA dovrebbe essere ripetuto entro 3 mesi per ridurre il tasso di falsi negativi. |
|||
ACR TI-RADS (American College of Radiology Thyroid Imaging and Reporting Data System)
Comprende 5 categorie definite da un punteggio numerico da attribuire alle singole caratteristiche ecografiche: benigno, non sospetto, lievemente sospetto, moderatamente sospetto, altamente sospetto (tabella 3).
| Tabella 3a Definizioni e punteggi ACR TI-RADS |
|
| Composizione (i punteggi vanno assegnati in base alla componente predominante) | Cistica o quasi completamente cistica: 0 punti. Spongiforme (piccole aree cistiche in almeno il 50%): 0 punti. Mista cistica e solida: 1 punto. Solida o quasi completamente solida: 2 punti. Nel caso la composizione non possa essere determinata a causa delle calcificazioni, assegnare 2 punti. |
| Forma (nella scansione trasversa, con misurazione dell’altezza parallela al fascio US e della larghezza perpendicolare al fascio US, anche se generalmente è un aspetto evidente alla semplice ispezione visiva) | Wider than tall: 0 punti: Taller than wide: 3 punti. |
| Ecogenicità | Anecogenicità (noduli cistici o quasi completamente cistici): 0 punti. Iso o iperecogenicità: 1 punto. Ipoecogenicità: 2 punti. Marcata ipoecogenicità (rispetto ai muscoli pre-tiroidei): 3 punti. Nel caso l’ecogenicità non possa essere determinata, assegnare 1 punto. |
| Margini | Lisci: 0 punti. Mal definiti: 0 punti. Lobulati (protrusioni nel tessuto adiacente) o irregolari (frastagliati, spiculati o ad angolo acuto): 2 punti. Nel caso i margini non possano essere determinati, assegnare 0 punti. |
| Foci ecogeni | Nessuno o artefatti comet tails (V-shaped, > 1 mm, nelle porzioni cistiche del nodulo): 0 punti. Macro-calcificazioni (presenza di ombra posteriore): 1 punto. Rima calcifica periferica (completa o incompleta): 2 punti. Foci ecogeni puntati (più piccoli delle macro-calcificazioni, senza ombra acustica, possono corrispondere a corpi psammomatosi associati con il carcinoma papillifero, quando presenti nella porzione solida del nodulo, piccoli artefatti comet tails o rinforzi acustici posteriori, quando presenti nelle porzioni cistiche del nodulo): 3 punti. |
| Estensione extra-tiroidea | Estesa (franca invasione dei tessuti molli adiacenti e/o delle strutture vascolari, altamente indicativa di malignità) o minima (da sospettare in caso di rigonfiamento, interruzione o abutment della capsula tiroidea): 3 punti. |
| Tabella 3b Classificazione ACR TI-RADS |
|||
| Punteggio | Categoria | Rischio di malignità (%) | Indicazione all’ FNA |
| 0 punti | TR1 (benigno) | 2 | No |
| 2 punti | TR2 (non sospetto) | 2 | No |
| 3 punti | TR3 (lievemente sospetto) | 5 | ≥ 25 mm* |
| 4-6 punti | TR4 (moderatamente sospetto) | 5-20 | ≥ 15 mm |
| ≥ 7 punti | TR5 (altamente sospetto) | > 20 | ≥ 10 mm < 10 mm in caso di linfonodi sospetti, sede peri-tracheale o peri-ricorrenziale, preferenza del paziente |
| In caso di linfonodi sospetti e/o estensione extra-tiroidea: eseguire sempre FNA. Si raccomanda di misurare i noduli nei tre assi: dimensione massima su un’immagine assiale, dimensione massima perpendicolare alla precedente misurazione sulla stessa immagine e dimensione longitudinale massima su un’immagine sagittale. Per i noduli con orientamento obliquo, queste misure potrebbero essere differenti da quelle usate per definire un nodulo “taller than wide”, ma questa discrepanza raramente ha rilevanza clinica. Le misurazioni dovrebbero includere anche l’alone del nodulo se presente. *Il cut-off di 20 mm che i principali sistemi di classificazione utilizzano per porre indicazione all’esecuzione dell’FNA nei noduli a basso rischio, deriva dall’osservazione che il rischio cumulativo di metastasi a distanza da DTC aumenta oltre tale soglia. Il sistema ACR TI-RADS innalza il limite a 25 mm sulla base del rilievo di una tendenza dell’ecografia a sovra-stimare le dimensioni dei noduli rispetto ai campioni istologici. |
|||
AACE/ACE/AME (American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi)
Comprende 3 categorie (rischio basso, intermedio, alto) e un atlante di immagini di riferimento (tabella 4).
| Tabella 4a Definizioni AACE/ACE/AME |
|
| Composizione | Spongiforme se spazi micro-cistici > 50%. Prevalentemente cistico: componente liquida > 50%. |
| Forma | "Taller than wide” se diametro AP/T ≥ 1 nella scansione trasversa o longitudinale. |
| Ecogenicità | Debole ipoecogenicità: rispetto al tessuto tiroideo normale. Marcata ipoecogenicità: rispetto ai muscoli pre-tiroidei. |
| Margini | Mal definiti: mancanza di chiara delimitazione rispetto al tessuto tiroideo circostante per più del 50% del perimetro nodulare. Regolari: lisci. Irregolari: spiculati o lobulati. |
| Calcificazioni | Macro-calcificazioni “coarse”. Micro-calcificazioni: foci ecogeni puntati < 1 mm, senza ombra acustica posteriore, possibile in caso di raggruppamento. Calcificazioni periferiche: rima calcifica o “a guscio d’uovo”; se discontinue e associate ad alone esterno spesso e marcatamente ipoecogeno, sono predittive di malignità. In caso di incertezza, descrivere “spot iperecogeni di incerto significato”. |
| Vascolarizzazione | Assenza di flusso sanguigno: assenza di rilevante color-fow mapping sia in periferia che nella porzione centrale del nodulo. Pattern periferico: vascolarizzazione prevalentemente lungo il bordo del nodulo. Pattern intra-nodulare: marcata vascolarizzazione nella parte centrale del nodulo, chiaramente aumentata rispetto al tessuto peri-nodulare. |
| Tabella 4b Classificazione AACE/ACE/AME |
|||
| Categoria | Caratteristiche | Rischio di malignità (%) | Indicazione all’FNA |
| Classe 1 (rischio basso) | Noduli in gran parte cistici (> 50%), con artefatti di riverberazione non associati a segni ecografici di sospetto. Noduli isoecogeni spongiformi confluenti o con alone regolare. |
~ 1 | > 20 mm e incremento volumetrico Anamnesi indicativa di elevato rischio neoplastico Prima della chirurgia o di terapia ablativa minimamente invasiva |
| Classe 2 (rischio intermedio) | Noduli debolmente ipoecogeni e isoecogeni, di forma ovoidale-arrotondata, con margini regolari o indefiniti. Possono essere presenti:
|
5-15 | > 20 mm |
| Classe 3 (rischio alto) | Noduli con almeno 1 tra:
|
50-90 | ≥ 10 mm. Tra 5 e 10 mm:
|
| In caso di linfonodi sospetti o estensione extra-tiroidea: eseguire sempre FNA. Per la valutazione delle dimensioni e della crescita dei noduli, si raccomanda di utilizzare il volume calcolato con la formula dell’ellissoide, più accurato rispetto al diametro maggiore sull’asse longitudinale, gravato da maggiore variabilità inter-osservatore. |
|||
ATA (American Thyroid Association)
Comprende 5 categorie (benigno, sospetto molto basso, sospetto basso, sospetto intermedio, sospetto alto) e un atlante di immagini di riferimento (tabella 5).
| Tabella 5 Classificazione ATA |
|||
| Categoria | Caratteristiche | Rischio di malignità (%) | Indicazione all’FNA |
| Benigno | Noduli totalmente cistici. | < 1 | No* |
| Sospetto molto basso | Noduli spongiformi o parzialmente cistici, senza caratteristiche di sospetto delle successive categorie. | < 3 | ≥ 20 mm** |
| Sospetto basso | Noduli iso o iperecogeni. Noduli parzialmente cistici con aree solide eccentriche, senza caratteristiche di sospetto elevato. |
5–10 | ≥ 15 mm |
| Sospetto intermedio | Noduli ipoecogeni con margini lisci, senza caratteristiche di sospetto elevato. | 10–20 | ≥ 10 mm |
| Sospetto alto | Noduli ipoecogeni solidi o parzialmente cistici con almeno uno tra:
|
> 70-90 | ≥ 10 mm < 10 mm in caso di linfonodi sospetti, estensione extra-tiroidea, preferenza del paziente |
| In caso di linfonodi sospetti e/o estensione extra-tiroidea: eseguire sempre FNA. *L’aspirazione delle cisti può essere considerata per il drenaggio a scopo decompressivo o estetico. **Opzionale, anche l’osservazione è una scelta ragionevole. |
|||
BIBLIOGRAFIA
- Gharib H, Papini F, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules – 2016 Update. Endocr Pract 2016, 22: 622-39.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Lamartina L, Grani G, Durante C, et al. Screening for differentiated thyroid cancer in selected populations. Lancet Diabetes Endocrinol 2020, 8: 81-8.
- Ahn HS, Kim DW, Lee YJ, et al. Diagnostic accuracy of real-time sonography in differentiating diffuse thyroid disease from normal thyroid parenchyma: a multicenter study. AJR Am J Roentgenol 2018, 211: 649-54.
- Dighe M, Barr R, Bojunga J, et al. Thyroid ultrasound: state of the art part 1 – Thyroid ultrasound reporting and diffuse thyroid diseases. Med Ultrason 2017, 19: 79-93.
- Pedersen OM, Aardal NP, Larssen TB, et al. The value of ultrasonography in predicting autoimmune thyroid disease. Thyroid 2000, 10: 251-9.
- Sharma A, Jasim S, Reading CC, et al. Clinical presentation and diagnostic challenges of thyroid lymphoma: a cohort study. Thyroid 2016, 26: 1061-7.
- Ota H, Ito Y, Matsuzuka F, et al. Usefulness of ultrasonography for diagnosis of malignant lymphoma of the thyroid. Thyroid 2006, 16: 983-7.
- Frates MC, Marqusee E, Benson CB, et al. Subacute granulomatous (de Quervain) thyroiditis: grayscale and color Doppler sonographic characteristics. J Ultrasound Med 2013, 32: 505-11.
- Lee YJ, Kim DW. Sonographic characteristics and interval changes of subacute thyroiditis. J Ultrasound Med 2016, 35: 1653-9.
- Rosario PW, Santos JB, Nunes NS, et al. Color flow Doppler sonography for the etiologic diagnosis of thyrotoxicosis. Horm Metab Res 2014, 46: 505-9.
- Hoang JK, Lee WK, Lee M, et al. US features of thyroid malignancy: pearls and pitfalls. Radiographics 2007, 27: 847-60.
- Grani G, Lamartina L, Cantisani V, et al. Interobserver agreement of various thyroid imaging reporting and data systems. Endocr Connect 2018, 7: 1-7.
- Kwak JY, Kim EK, Son EJ, et al. Papillary thyroid carcinoma manifested solely as microcalcifications on sonography. AJR Am J Roentgenol 2007, 189: 227-31.
- Zhang Y, Xia D, Lin P, et al. Sonographic findings of the diffuse sclerosing variant of papillary carcinoma of the thyroid. J Ultrasound Med 2010, 29: 1223-6.
- Lee JY, Shin JH, Han BK, et al. Diffuse sclerosing variant of papillary carcinoma of the thyroid: imaging and cytologic fndings. Thyroid 2007, 17: 567-73.
- Leboulleux S, Girard E, Rose M, et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer. J Clin Endocrinol Metab 2007, 92: 3590-4.
- Campanella P, Ianni F, Rota CA, et al. Quantification of cancer risk of each clinical and ultrasonographic suspicious feature of thyroid nodules: a systematic review and meta-analysis. Eur J Endocrinol 2014, 170: R203-11.
- Russ G, Bonnema SJ, Erdogan MF, et al. European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: the EU-TIRADS. Eur Thyroid J 2017, 6: 225-37.
- Tessler FN, Middleton WD, Grant EG, et al. ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee. J Am Coll Radiol 2017, 14: 587-95.
- Shin JH, Baek JH, Chung J, et al. Ultrasonography diagnosis and imaging-based management of thyroid nodules: revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations. Korean J Radiol 2016, 17: 370-95.
- Grani G, Lamartina L, Ascoli V, et al. Reducing the number of unnecessary thyroid biopsies while improving diagnostic accuracy: toward the "right" TIRADS. J Clin Endocrinol Metab 2019, 104: 95-102.
- Castellana M, Castellana C, Treglia G, et al. Performance of five ultrasound risk stratification systems in selecting thyroid nodules for FNA. A meta-analysis. J Clin Endocrinol Metab DOI: 10.1210/clinem/dgz170.
Atlante ecografico di patologia tiroidea
ALTERAZIONI DIFFUSE

Lieve ipoecogenicità diffusa (tiroidite autoimmune cronica)

Lieve ipoecogenicità diffusa (tiroidite autoimmune cronica)

Ecostruttura disomogenea (tiroidite autoimmune cronica)

Aree ipoecogene focali multiple (tiroidite autoimmune cronica)

Marcata ipoecogenicità e strie fibrose intense (tiroidite di Hashimoto)

Ingrandimento tiroide ed ecostruttura disomogenea (malattia di Graves)

Ipoecogenicità e strie fibrose (tiroidite autoimmune cronica)

Margini posteriori lobulati e aspetti pseudo-nodulari (malattia di Graves)

Margini posteriori lobulati (tiroidite autoimmune cronica)

Forma ipo-atrofica di tiroidite autoimmune cronica

Ingrandimento tiroideo asimmetrico in tiroidite autoimmune cronica

Ingrandimento tiroideo asimmetrico in tiroidite autoimmune cronica

Linfonodi reattivi nel compartimento centrale del collo (tiroidite autoimmune cronica)

Pseudo-nodulo da alterazioni fibrotiche (tiroidite autoimmune cronica)

Vascolarizzazione marcatamente aumentata (malattia di Hashimoto)

Vascolarizzazione marcatamente aumentata (malattia di Graves)

“Inferno” tireotossico (malattia di Graves)

“Inferno” tireotossico (malattia di Graves)

Area ipoecogena irregolare in tiroidite attinica

Aree ipoecogene diffuse, mal definite, di estensione variabile (tiroidite subacuta di De Quervain)

Tiroidite subacuta (di De Quervain)

Tiroidite subacuta (di De Quervain) in trattamento steroideo

Tiroidite subacuta (di De Quervain) in trattamento steroideo

Tiroidite di Riedel

Tiroidite di Riedel

Tiroidite acuta suppurativa

Tiroidite acuta suppurativa

Linfoma tiroideo

Linfoma tiroideo
ALTERAZIONI FOCALI

Aspetto ipoecogeno

Margini irregolari

Microcalcificazioni

Flusso intra-lesionale (a sinistra) e pri-lesionale (a destra): il flusso intra-lesionale è rilevato fino al 70% delle lesioni maligne e fino al 50% delle benigne

Aspetto “più alto che largo”

Ghiandola ingrandita, micronoduli multipli confluenti, isoecogeno, non capsula: iperplasia (TI-RADS2)

’il cavaliere bianco' (TI-RADS2)

Lesione anecogena, margini sottili e regolari, non segnale vascolare, non segni sospetti: cisti semplice (TI-RADS2)

Segno della “coda di cometa”: spot iperecogeni intra-colloidei, diametro 0.5-2 mm, associato con aspetto a coda di cometa, mobile con la postura

Area ipoecogena, disomogenea, a margini sfumati; frequentemente multiple e bilaterali, con scarsa vascolarizzazione: tiroidite subacuta (contesto clinico) (TI-RADS2)

Macrocalcificazioni (cono d'ombra posteriore, isolate, senza componente tissutale, non segnali vascolari): TI-RADS2

Piccole aree liquide in > 50% del nodulo, aree isoecogene di spessore variabile, non segni sospetti: nodulo spongiforme (TI-RADS2)

Multiple aree liquide in > 50% del nodulo, setti isoecogeni di spessore variabile, non segni sospetti: nodulo spongiforme (TI-RADS2)

Lesioni cistiche sospette

Forma regolare “più largo che alto” (TI-RADS 3)

Spot iperecogeni (accumuli di colloide densa) (TI-RADS 3)

Alone sottile e regolare (TI-RADS 3)

Nodulo isoecogeno + macrocalcificazioni (TI-RADS3)

Moderata ipoecogenicità (TI-RADS 4A)

Moderata ipoecogenicità (attenzione al gain)

Margini sfumati

Nodulo fortemente ipoecogeno (più ipoecogeno dei muscoli superficiali) (TI-RADS 4B)

Margini spiculati (irregolari con angoli acuti) (TI-RADS 4B)

Margini lobulati (ondulati, con almeno 3 piccole sporgenze) (TI-RADS 4B)

Margini lobulati (ondulati, con almeno 3 piccole sporgenze) (TI-RADS 4B)

Microcalcificazioni (spot iperecogeni, tondi o lineari, diametro < 1mm, senza cono d’ombra posteriore a meno che vi sia aggregazione) (TI-RADS 4B)

Microcalcificazioni

Rima di calcificazione irregolare

Forma irregolare (più alto che largo) (TI-RADS 4B)

Score elastografico 4 (TI-RADS 4B)

Segni sospetti multipli (marcata ipoecogenicità, margini microlobulati e forma più alta che larga) (TI-RADS 5)

Segni sospetti multipli (marcata ipoecogenicità, margini irregolari, forma più alta che larga e crescita extra-capsulare) (TI-RADS-5)

Segni sospetti multipli (marcata ipoecogenicità, margini microlobulati, microcalcificazioni, forma più alta che larga e linfonodo patologico) (TI-RADS-5)
LINFONODI

Criteri di benignità linfonodale: presenza di ilo, aspetto piatto e allungato, L/S > 2, non segni sospetti, ilo ben vascolarizzato

Modificazioni vascolari: dal linfonodo benigno al maligno
Linfonodo normale (sopra): vascolarizzazione centrale
Linfonodo maligno (sotto): vascolarizzazione periferica

Criteri per malignità linfonodale: aspetto cistico

Criteri per malignità linfonodale: aspetto simile al tessuto tiroideo normale

Criteri per malignità linfonodale: vascolarizzazione sparsa, mista o periferica

Criteri per malignità linfonodale: assenza di ilo
Linfonodi con ilo normalmente ecogeno sono benigni
L’ilo non è visibile nel 30% dei linfonodi istologicamente normali

Criteri per malignità linfonodale: dimensioni e forma
La dimensione non è un buon predittore di malignità (la maggior parte dei linfonodi normali ha un asse corto 8 mm: buon indicatore di malignità)
La localizzazione linfonodale è utile per le decisioni
Forma: arrotondata
Indice di Steinkamp: asse maggiore/asse minore < 2

Criteri per malignità linfonodale: microcalcificazioni
Elastografia tiroidea
Francesca Ianni1 & Vincenzo Di Donna2
1Ambulatorio di Endocrinologia e Diabetologia, ASL Rieti e Latina
2Fondazione Policlinico “Agostino Gemelli” IRCCS, Roma
(aggiornato al 12 settembre 2021)
INTRODUZIONE
L’elastosonografia (o elastografia) è una tecnica di diagnostica ecografica che ha lo scopo di fornire un’informazione sul grado di elasticità o rigidità (“stiffness”) del tessuto in esame. Il principio su cui si basa è lo stesso della palpazione nell’ambito della semeiotica medica, partendo dal presupposto che diversi processi patologici (neoplastici, infiammatori) inducono alterazioni delle caratteristiche fisiche dei tessuti. Si è visto infatti che i noduli tiroidei maligni, in particolare il carcinoma papillare, appaiono più frequentemente rigidi, perché oltre ad una proliferazione di cellule maligne, si verifica una modifica dello stroma di sostegno, con prevalenza di collagene e fibromioblasti, che conferisce minore deformabilità al tessuto neoformato.
Il riscontro di consistenza dura alla palpazione di un nodulo tiroideo è associato ad aumentato rischio di malignità. Tuttavia, l’attendibilità della palpazione è limitata dalla capacità dell’operatore, dalla scarsa precisione nella discriminazione spaziale e dall’impossibilità di raggiungere le strutture profonde. Noduli piccoli, profondi e localizzati nel contesto di tireopatie multi-nodulari non possono essere palpati con accuratezza. L’elastografia, quindi, è stata proposta come “palpazione elettronica” (1), introdotta per la prima volta in letteratura nel 1991 (2) e descritta come applicazione clinica per la tiroide nel 2005 (3).
L’elastografia fornisce una valutazione della deformabilità di una struttura in risposta a una forza meccanica applicata; si basa sul principio di elasticità dei materiali. Nonostante la non uniformità elastica delle strutture corporee, è comunque stata verificata l’efficacia nell’utilizzo diagnostico dell’applicazione delle leggi fisiche sull’elasticità. Secondo tale principio, un corpo elastico, sottoposto a una forza (sforzo o stress) misurabile in relazione a una unità di superficie, reagisce con una deformazione, sia in direzione assiale (parallela alla direzione di tale forza) che trasversale (perpendicolare a tale direzione). Il rapporto tra sforzo applicato e deformazione che ne deriva costituisce il modulo di elasticità di un materiale.
Una trattazione specifica esula dallo scopo di questo capitolo, tuttavia si rammentano in figura 1 le equazioni su cui si basano i software elastosonografici:
- per la direzione assiale il modulo di elasticità (E) di Young: può essere ottenuto tramite la legge di Hooke: E = σ/ε (dove σ = sforzo applicato per unità di superficie, ε = strain, espansione per unità di lunghezza) (fig 1a);
- per la direzione trasversale le onde meccaniche trasversali (shear waves), determinate dallo spostamento dei tessuti e rappresentate dal modulo di rigidità G: ν = rapporto di Poisson’s che esprime la resistenza offerta da un materiale al cambiamento della forma, stimato nel corpo umano intorno a 0.5, quindi si approssima che E = 3G; ρ = densità del mezzo; Cs = velocità di propagazione delle onde (fig.1b).
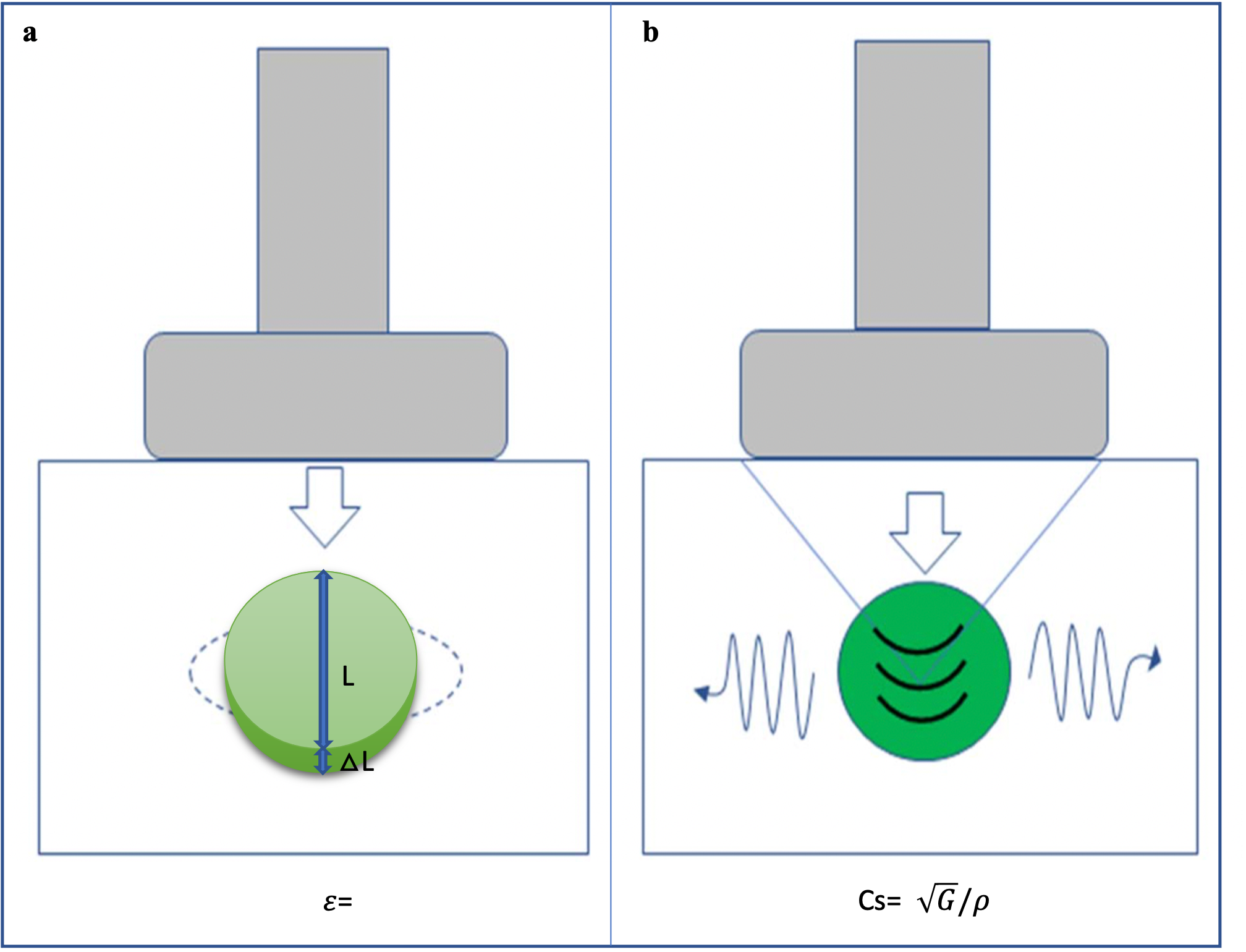
Figura 1. a: modulo di elasticità di Young (E); b: modulo di rigidità (G).
METODICHE DI ELASTOSONOGRAFIA
Le metodiche elastografiche attualmente disponibili nelle varie apparecchiature ecografiche, si possono comprendere in due categorie (fig 2).
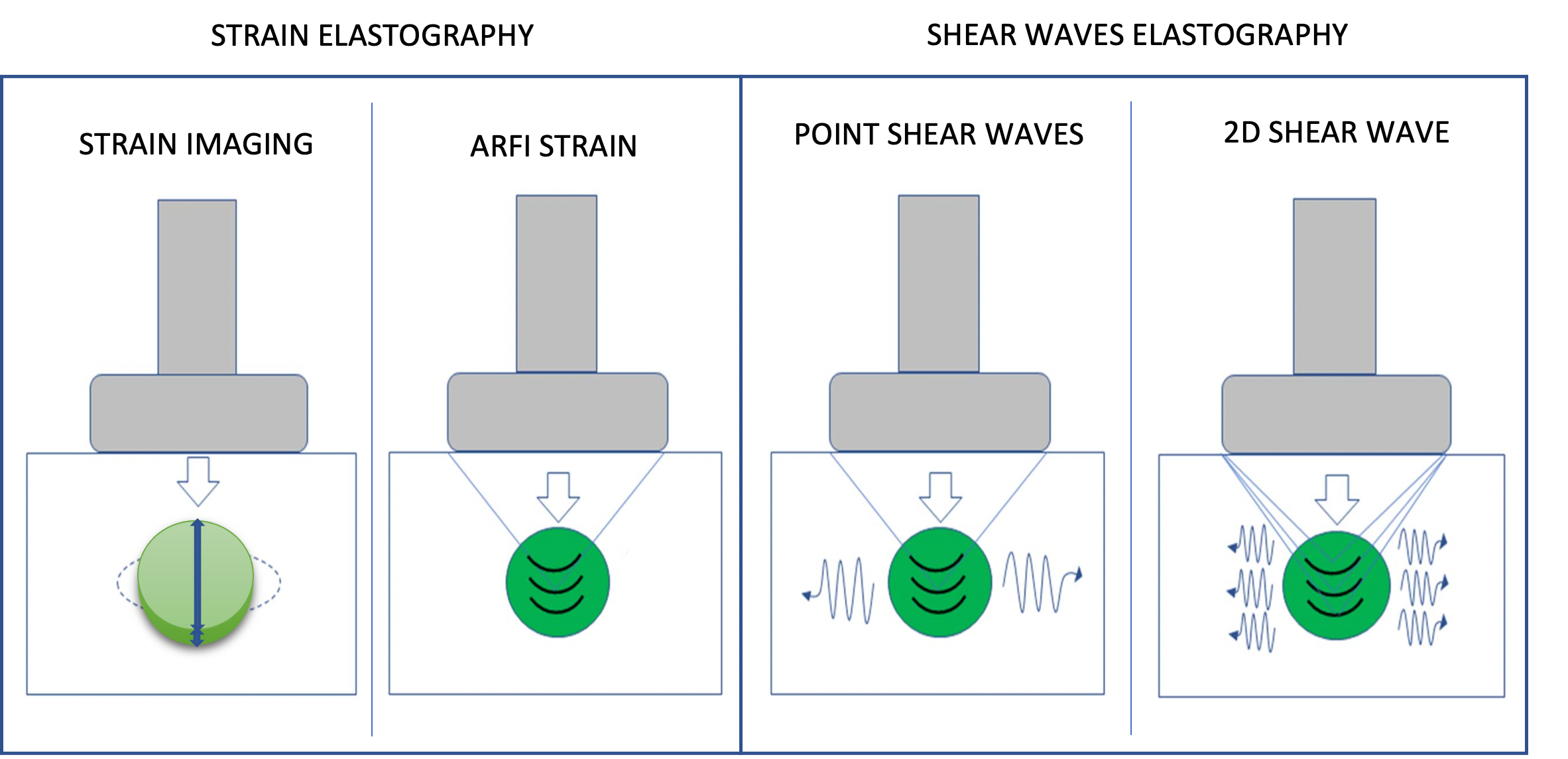
Figura 2. Metodiche elastosonografiche per la tiroide.
Strain elastography: a sinistra, misura dello spostamento longitudinale, parallelo alla sorgente dell’impulso; ne fanno parte la strain imaging, con compressioni esterne o intrinseche fisiologiche, e ARFI strain imaging, che utilizza un fascio di ultrasuoni focalizzati come forza applicata.
Shear waves elastography, SWE: a destra, propagazione della velocità delle onde trasverse, shear waves; ne fanno parte la point SWE, che utilizza un singolo fascio di ultrasuoni, e la 2D-SWE, che utilizza multiple zone focali dal fascio di ultrasuoni focalizzati.
Strain elastography
È stata la prima tecnica elastografica e, in base al tipo di forza esterna applicata, si distingue in “strain imaging” (compressione manuale o da movimento fisiologico interno cardio-vascolare o respiratorio) e “acoustic radiation force impulse (ARFI) strain imaging” (fascio di ultrasuoni focalizzati ad alta intensità). Nella pratica l’ARFI strain imaging è meno utilizzata per la ghiandola tiroidea.
La strain elastography misura la variazione di profondità del segnale all’interno del tessuto (parallela alla forza applicata) nelle fasi di compressione/decompressione. Viene visualizzata in real-time come mappa di colore codificata (convenzionalmente dal rosso, massima elasticità, al blu, massima rigidità), chiamata “elastogramma”, che appare come box sovrapposto all’immagine B-mode (fig 3). L’elastogramma fornisce una valutazione qualitativa e operatore-dipendente, tuttavia si può ottenere una misurazione semi-quantitativa detta “strain ratio”, rappresentata dal rapporto tra la deformazione tissutale misurata nella lesione in esame (region of interest, ROI) e la deformazione tissutale di una porzione di tessuto normale di riferimento. Uno strain ratio > 1 indica che il tessuto in esame è più rigido del tessuto normale di riferimento.

Figura 3. Nodulo tiroideo solido ipoecogeno eterogeneo e a margini irregolari, risultato prevalentemente “hard”, con strain ratio di 3.98. Esame istologico: carcinoma papillare tiroideo (4).
Shear wave elastography
Utilizza ARFI di breve durata per creare onde trasversali (“shear waves”) all’interno della struttura in esame, misurando la velocità di propagazione di tali onde a partire dall’epicentro verso la periferia. A differenza della precedente tecnica, fornisce una misurazione quantitativa della rigidità tissutale (espressa in velocità di propagazione delle shear waves o in kPa dal modulo di Young) di un campione di tessuto. Ci sono due tecniche:
- point shear wave elastography (pSWE), che utilizza un unico fascio di ultrasuoni focalizzati come nell’ARFI strain imaging, ma fornisce una valutazione quantitativa, misurando la velocità di propagazione delle shear waves perpendicolari al piano di eccitazione;
- two-dimensional shear wave elastography (2D-SWE) è una tecnica innovativa che, anziché basarsi su un singolo punto focale, scansiona in rapida successione multiple zone focali, più velocemente della velocità di propagazione delle shear waves indotte, creando un cono quasi cilindrico di shear wave (5).
I vantaggi di tale tecnica includono la visualizzazione in tempo reale di un elastogramma quantitativo sovrapposto all’immagine B-mode, che fornisce informazioni sia anatomiche che di rigidità del tessuto in esame.
ELASTOGRAFIA DEI NODULI TIROIDEI
L’elastografia fornisce un’informazione complementare all’ecografia convenzionale, riguardo la rigidità del tessuto in esame, che va ad aggiungersi agli altri parametri ecografici (ecostruttura, ecogenicità, margini, presenza di calcificazioni, vascolarizzazione). Come gli altri, è un parametro operatore-dipendente, riproducibile ma con un’accuratezza diagnostica nel discriminare i noduli tiroidei maligni risultata variabile tra gli studi finora pubblicati. Questo è dovuto ai limiti intrinseci della tecnica elastografica impiegata e all’esperienza dell’operatore (tab 1).
| Tabella 1 Condizioni che possono indurre artefatti o inficiare l’affidabilità diagnostica dell’elastografia nei noduli tiroidei |
| Noduli con calcificazioni (aumento rigidità). |
Noduli con aree liquide:
|
| Vicinanza alla carotide (le pulsazioni interferiscono sulla valutazione). |
| Posizione istmica o para-istmica (rigidità della trachea). |
| Posizione ai poli inferiori dei lobi tiroidei (eccessiva profondità, specie in caso di gozzo immerso). |
| Noduli > 3 cm (compressione inefficace). |
| Esperienza dell’operatore (qualità delle compressioni manuali nel caso della strain elastography e interferenza da compressione nel caso della shear waves elastography). |
| Istotipo del tumore (il carcinoma follicolare e il midollare appaiono più frequentemente soffici). |
L’impiego clinico dell’elastografia può essere di aiuto soprattutto in determinate circostanze, quali noduli con rischio ecografico intermedio e/o classe citologica indeterminata (TIR3A, TIR3B) o ripetutamente non diagnostica per noduli solidi (TIR1).
Nell’ambito dei noduli tiroidei maligni, il carcinoma papillare è maggiormente associato ad aumentata rigidità, mentre i carcinomi follicolari, e ancor di più i carcinomi midollari, presentano più frequentemente elasticità della lesione.
Di seguito un excursus delle diverse metodiche elastosonografiche attualmente disponibili, in riferimento alla diagnostica della patologia nodulare della tiroide.
Strain imaging
L’interpretazione qualitativa dell’elastogramma è stata codificata in punteggi di rigidità, derivati per analogia da quello proposto per la patologia mammaria (6). Vengono principalmente impiegati il punteggio di Asteria a 4 punti (7) e quello di Rago a 5 punti (8) riportati in tabella 2.
| Tabella 2 Punteggi di elasticità del nodulo tiroideo |
||
| Punteggio e descrizione | Immagine | |
| Punteggi di Asteria | 1: completamente elastico (verde, soft) |  |
| 2: prevalentemente elastico |  |
|
| 3: prevalentemente rigido |  |
|
| 4: completamente rigido |  |
|
| Punteggi di Rago | 1: completamente elastico (soft) |  |
| 2: prevalentemente elastico |  |
|
| 3: elasticità solo alla periferia della lesione |  |
|
| 4: assenza completa di elasticità |  |
|
| 5: assenza completa di elasticità sulla lesione e sul cono d’ombra posteriore |  |
|
Il cut-off di 2 e 3 per la scala di Asteria e di 3 e 4 per quella di Rago è largamente accettato per discriminare benignità/malignità dei noduli tiroidei sulla base della rigidità rispetto al parenchima circostante. In una meta-analisi della strain elastography è stata riportata, con i criteri di Asteria, una sensibilità del 92% e una specificità del 90% per la diagnosi di noduli tiroidei maligni (9). Nello sforzo di raggiungere una standardizzazione del suo impiego, è stato riportato in letteratura un buon livello di concordanza fra gli operatori per la valutazione qualitativa della strain elastography (10). Nel corso degli anni sono tuttavia stati riportati risultati variabili in termini di accuratezza diagnostica per discriminare la malignità di un nodulo tiroideo. Per superare i limiti della valutazione qualitativa mediante elastogramma, è possibile in apparecchiature di seconda generazione effettuare una valutazione semi-quantitativa mediante la “strain-ratio”. Si tratta di un’analisi “off-line”, cioè eseguita sull’immagine statica, dei valori di deformazione (“strain”) del nodulo, attraverso l’analisi delle variazioni in radio-frequenza prima e dopo lo stress applicato; il calcolo viene eseguito selezionando una regione di interesse all’interno della formazione nodulare in esame e una regione di riferimento in corrispondenza di un’area di normale elasticità parenchimale. Si ottiene così un indice di deformazione (“strain index”), che può essere messo in relazione a valori di riferimento propri dell’organo in esame: esso sarà più elevato tanto più alta sarà la rigidità della struttura sottoposta a esame.
Shear waves elastography (pSWE E 2D-SWE)
Nella pSWE una sola zona focale (posizionata sulla lesione target) fornisce l’elasticità espressa in metri al secondo e non c’è una mappa colore. È stato proposto il valore di 2.5-2.8 m/s come cut-off di velocità al di sopra del quale sospettare la natura maligna del nodulo tiroideo, con sensibilità e specificità intorno al 96% (11) (fig 4). È monodimensionale, ha una sola ROI che calcola esclusivamente il valore medio e non fornisce misurazioni real-time.

Figura 4. Nodulo tiroideo sinistro marcatamente ipoecogeno, “taller than wide” e a margini lievemente irregolari. Alla pSWE, elevata rigidità, con velocità di 7.3 m/s. Esame istologico: carcinoma papillare tiroideo variante follicolare (10).
Con la 2D-SWE si crea una mappa colore bidimensionale come l’elastogramma, in cui la valutazione è quantitativa (ogni bit di colore codifica la velocità delle shear waves in m/s oppure l’elasticità espressa in KPa). È possibile tracciare ROI all’interno del box, in cui sono istantaneamente calcolati i valori di rigidità minima, massima e media e la deviazione standard, che aumenta all’aumentare dell’eterogeneità del tessuto. Se si analizzano due ROI, se ne ricava il rapporto di elasticità tra le due. Sono stati proposti vari cut-off di rigidità sospetti per lesione maligna per indice medio di elasticità (da 34.5 a 65 kPa), con buoni valori di sensibilità e specificità. Tuttavia, nonostante le speranze iniziali, in letteratura non sono state riportate finora percentuali di accuratezza diagnostica significativamente maggiori della strain elastography. In una recente revisione (12) è stato messo in luce come l’eterogeneità del processo di acquisizione della SWE (livello di compressione manuale esercitata, tipo di scansione, timing dell’ottenimento dell’immagine statica, posizionamento della ROI ottimale) e l’eterogeneità dei noduli tiroidei, che talvolta presentano aree interne con diversa elasticità, danno ragione della variabilità dei cut-off proposti per l’indice di elasticità. Ad ogni modo, in una meta-analisi di 13 studi, comprendente 1854 noduli tiroidei, è stata riportata una sensibilità dell’81% e una specificità dell’84%, sottolineando il ruolo complementare di questa tecnica per coadiuvare l’ecografia tradizionale nella stratificazione del rischio neoplastico del nodulo tiroideo (13) (fig 5).

Figura 5. Nodulo tiroideo solido ipoecogeno “taller than wide” e a margini irregolari. Alla 2D-SWE nella ROI velocità di 3.7 m/s ed elasticità di 40.9 kPa. Esame istologico: carcinoma papillare tiroideo (14).
Elastografia nelle tireopatie diffuse
Nella valutazione elastografica delle tireopatie diffuse si è tentato di distinguere la tiroidite di Hashimoto dalla malattia di Graves o la prima dalla tiroidite di De Quervain. La sovrapposizione dei dati di rigidità tra questi gruppi, che appare solitamente aumentata, non ha ad oggi portato ad alcun risultato di utilità clinica. Secondo alcuni autori, l’elastografia potrebbe aiutare nella diagnosi differenziale fra pseudo-noduli (isoelastici al parenchima) e veri noduli (aumentata rigidità) (15).
Elastografia dei linfonodi del collo
L’elastosonografia potrebbe aiutare a distinguere i linfonodi maligni dai benigni. Alcune meta-analisi, infatti, riportano una maggiore rigidità dei linfonodi maligni, con sensibilità dell’81% e specificità dell’85% per la SWE. Tuttavia, sono necessari ulteriori studi per definirne un utilizzo clinico nella pratica quotidiana (16).
BIBLIOGRAFIA
- Zhao C-K, Xu H-X. Ultrasound elastography of the thyroid: principles and current status. Ultrasonography 2019, 38: 106–24.
- Ophir J, Cespedes I, Ponnekanti H, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrason Imaging 1991, 13: 111–34.
- Lyshchik A, Higashi T, Asato R, et al. Thyroid gland tumor diagnosis at US elastography. Radiology 2005, 237: 202–11.
- Dighe M, Barr R, Bojunga J, et al. Thyroid ultrasound: state of the art. Part 2 – Focal thyroid lesions. Med Ultrason 2017, 19, 195-210.
- Bercoff J, Tanter M, Fink M. Supersonic shear imaging: A new technique for soft tissue elasticity mapping. IEEE Trans Ultrason Ferroelectr Freq Control 2004, 51: 396-409.
- Ueno E, Ito A. Diagnosis of breast cancer by elasticity imaging. Eizo Joho Medical 2004, 36: 2-6.
- Asteria C, Giovanardi A, Pizzocaro A, et al. US-elastography in the differential diagnosis of benign and malignant thyroid nodules. Thyroid 2008, 18: 523-31.
- Rago T, Santini F, Scutari M, et al. Elastography: new developments in ultrasound for predicting malignancy in thyroid nodules. J Clin Endocrinol Metab 2007, 92: 2917-22.
- Bojunga J, Herrmann E, Meyer G, et al. Real-time elastography for the differentiation of benign and malignant thyroid nodules: a meta-analysis. Thyroid 2010, 20: 1145–50.
- Ragazzoni F, Deandrea M, Mormile A, et al. High diagnostic accuracy and interobserver reliability of real-time elastography in the evaluation of thyroid nodules. Ultrasound Med Biol 2012, 38: 1154-62.
- Zhang FJI, Han RL. The value of acoustic radiation force impulse (ARFI) in the differential diagnosis of thyroid nodules. Eur J Radiol 2013, 82: e686-90.
- Swan KZ, Nielsen VE, Bonnema SJ. Evaluation of thyroid nodules by shear wave elastography: a review of current knowledge. J Endocrinol Invest 2021, 44: 2043–56.
- Liu BJ, Li DD, Xu HX, et al. Quantitative shear wave velocity measurement on acoustic radiation force impulse elastography for differential diagnosis between benign and malignant thyroid nodules: a meta-analysis. Ultrasound Med Biol 2015, 41: 3035-43.
- Kyriakidou G, Friedrich-Rust M, Bon D, et al. Comparison of strain elastography, point shear wave elastography using acoustic radiation force impulse imaging and 2D-shear wave elastography for the differentiation of thyroid nodules. PLoS One 2018, 13: e0204095.
- Yildirim D, Gurses B, Gurpinar B, et al. Nodule or pseudonodule? Differentiation in Hashimoto’s thyroiditis with sonoelastography. J Int Med Res 2011, 39: 2360-9.
- Suh CH, Choi YJ, Baek JH, Lee JH. The diagnostic performance of shear wave elastography for malignant cervical lymph nodes: A systematic review and meta-analysis. Eur Radiol 2017, 27: 222-30.
Scintigrafia e captazione tiroidea
Alberto Baroli & Luca Giovanni Pedrazzini
UOSC Medicina Nucleare, AO Ospedale di Circolo di Busto Arsizio (VA)
Metodologia
La scintigrafia tiroidea è un esame morfo-funzionale per la valutazione del parenchima ghiandolare e dei noduli.
Può essere eseguita dopo somministrazione di Tecnezio metastabile ev (99-m-Tc) o di radioiodio per os (131-I o 123-I). Il tecnezio non è un tracciante fisiologico, poiché viene solo intrappolato dalle cellula follicolare della tiroide e dismesso dopo circa 20 minuti. Il radioiodio è un tracciante fisiologico perché, dopo essere stato intrappolato, viene organificato dalla cellula tiroidea, con lo stesso meccanismo seguito dallo iodio organico. Per ragioni radio-protezionistiche (esposizione del paziente e della popolazione generale molto più bassa con 99-m-Tc; ridotto tempo di dimezzamento fisico del 99-m-Tc che è 6 ore vs 8 giorni di 131-I), di disponibilità (il 99-m-Tc si può conservare mentre lo 131-I deve essere ordinato alla demande) e di costi, oggi viene eseguita in prima battuta la scintigrafia tiroidea con Tecnezio, riservando lo iodio radioattivo a particolari situazioni (adenoma autonomo o struma multinodulare iperfunzionante che deve essere sottoposto a terapia con radioiodio per cura dell’iperfunzione nodulare).
Dopo 20-30 minuti dall'infusione ev di tecnezio, il paziente viene posto con il collo esteso davanti ad un apparato rivelatore di radiazioni (gamma camera) per l’ acquisizione dell’immagine scintigrafica.
Ruolo e risultati
In periodo pre-ecografico, la scintigrafia tiroidea ha avuto un ruolo di primo piano nell’identificazione del numero e della funzione dei noduli (“freddi “ o “caldi”) in accordo con il rilievo palpatorio, e per la scelta dell’esecuzione dell’ago-aspirato. Con l’avvento dell’ecografia ad alta risoluzione, il ruolo della scintigrafia tiroidea è stato ridimensionato, ma continua a mantenere precise indicazioni nell’iter clinico-diagnostico (1-3).
Circa il 10% dei noduli appare "caldo" all'esame scintigrafico, mentre un altro 10% circa risulta "tiepido" ovvero isocaptante rispetto al restante parenchima tiroideo (cosiddetti "warm" in inglese). Di conseguenza l'80% dei noduli tiroidei risultano "freddi" all'esame scintigrafico. Queste percentuali possono essere applicate sia all'esame eseguito con tecnezio, sia a quello eseguito con iodio radioattivo (4-7).
Da ricordare che alla scintigrafia posso essere visibili SOLO noduli di diametro > 1.5 cm (più raramente piccoli noduli superficiali di 1 cm). L’esame ha utilità limitata se non assente in presenza di struma uni- o pluri-nodulare in eutiroidismo, in cui l'ecografia identifica con precisione il numero, la disposizione e le caratteristiche dei noduli, indicando quelli sui quali appare indicato l’accertamento citologico mediante agoaspirazione ecoguidata (3-8).
Le indicazioni principali sono (5-6):
- strumi uni- o pluri-nodulari e ipertrofie ghiandolari, in presenza di ipertiroidismo bioumorale;
- sospetta tiroidite subacuta di De Quervain;
- differenziazione delle tireotossicosi da Amiodarone (tipo I e II);
- diagnosi differenziale delle forme di ipotiroidismo congenito;
- valutazione stato funzionale di nodulo con diagnosi citologica di proliferazione follicolare;
- sospetta presenza di tessuto tiroideo ectopico;
- valutazione estensione retrosternale del gozzo.
Adenoma autonomo. Il quadro scintigrafico si presenta con un nodulo singolo, intensamente captante il radiotracciante, con esclusione funzionale del restante parenchima tiroideo. L’esclusione funzionale può essere parziale o totale. In presenza di esclusione funzionale del parenchima tiroideo e di TSH inibito, il nodulo “caldo” può non essere sottoposto ad agoaspirazione, poichè numerose evidenze indicano questi noduli come benigni (9).
Struma multinodulare iperfunzionante. Il quadro scintigrafico presenta una ghiandola di dimensioni aumentate, con uno o più noduli “caldi” e la possibile presenza di noduli “freddi”. In questo caso l’esclusione funzionale del restante parenchima tiroideo è parziale. I noduli “freddi” vanno esaminati citologicamente, mentre quelli “caldi” vanno agoaspirati solo se esiste un sospetto ecografico, altrimenti possono essere considerati benigni.
Tiroidite subacuta di DeQuervain. Quando la malattia coinvolge tutta la ghiandola, il quadro scintigrafico non evidenzia la tiroide. Nei casi di coinvolgimento parziale può essere debolmente visibile una parte di un lobo o parti di parenchima. Tali quadri, in accordo con il quadro clinico di tiroide dura, dolente e pseudo-nodulare alla palpazione, di TSH inibito e modica elevazione delle frazioni libere tiroidee, di febbricola perdurante da alcuni giorni o settimane, permettono di fare diagnosi. Dopo un adeguato ciclo di terapia cortisonica, la scintigrafia può essere ripetuta per verificare la completa risoluzione di malattia (tiroide captante, in sede sovra-giugulare mediana, di contorni regolari se non sono presenti noduli).
Morbo di Basedow. La ghiandola è rappresentata con elevata attività di captazione, di solito di volume aumentato ma di morfologia regolare (assenza di noduli di dimensioni superiori al centimetro di diametro, che sono al di sotto della risoluzione spaziale della metodica), con scarsa captazione da parte dei tessuti peri-ghiandolari (ridotta attività radioattiva di “fondo”). Il quadro scintigrafico, in accordo con una ghiandola ipertrofica in toto, TSH inibito, FT3 e FT4 molto elevati, permette di fare diagnosi ed impostare una adeguata terapia tireostatica. La diagnosi è ulteriormente suffragata dalla positività dei TRAb (anticorpi anti-recettore del TSH).
Ipertiroidismo da amiodarone. In presenza di noduli e con captazione intra-ghiandolare presente ma bassa, si definisce di tipo I. In assenza di noduli e con captazione intra-ghiandolare assente si definisce di tipo II. La distinzione dei 2 tipi di ipertiroidismo porta a scelte terapeutiche differenti: nel tipo I perclorato e/o tireostatico, nel tipo II cortisonico.
Ipotiroidismo congenito. Nell’agenesia completa, ovviamente, non si evidenzia la tiroide. E' possibile la presenza di tessuto tiroideo in sede linguale o retro-linguale, ben evidenziato dalla captazione del radiotracciante, che comunque non produce sufficienti quantità di ormone tiroideo. Nei difetti di organificazione la ghiandola può essere in sede, di piccole dimensioni, con scarsa captazione ed elevata attività di fondo.
Struma a sviluppo retro-sternale. La difficoltà tecnica dell'ecografia, legata alla riflessione degli echi da parte del tessuto tiroideo lontano dalla sonda e posto non in posizione trasversale, non permette di valutare gli strumi retro-sternali. Sebbene ora esistono tecniche di imaging più precise per l’identificazione del numero e delle dimensioni dei noduli retro-sternali (TC), la semplicità ed il basso costo della scintigrafia può iniziare a dare indicazioni sulla presenza di uno struma indovato nel mediastino, in assenza di sintomatologia compressiva o di riscontro palpatorio di noduli tiroidei.
Bibliografia
- Gharib H, et al. AACE, AME, ETA medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest 2010, 33: 287.
- Bahn RS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011, 21: 593-646.
- Meller J, Becker W. The continuing importance of thyroid scintigrapthy in the era of high-resolution ultrasound. Eur J Nucl Med 2002, 29: 425-38.
- Associazione Italiana di Medicina Nucleare ed Imaging Molecolare (AIMN). Linee guida procedurali a cura dei Gruppi di Studio. 2005 (consultabile su www.aimn.it/pubblicazioni/LG/LG.php).
- Milas Z, et al. New guidelines for the management of thyroid nodules and differentiated thyroid cancer. Minerva Endocrinol 2011, 36: 53-70.
- Elpida S, et al. A survey of thyroid gland scintigraphy. J Nucl Med Technol 2009, 37: 173-8.
- Becker DV, et al. Society of Nuclear Medicine procedure guidelines for thyroid scintigraphy. In Procedure Guidelines Manual. Reston, VA: Society of Nuclear Medicine, 2005: 50-1-50-6.
- www.thyroidmanager.org
- Hamburger J. Evolution of toxicity in solitary nontoxic autonomously functioning thyroid nodules. J Clin Endocrinol Metab 1980, 50: 1089-93.
Il ruolo della radiologia tradizionale nelle tireopatie
Giancarlo Bizzarri
UOC di diagnostica per immagini, Ospedale Regina Apostolorum, Albano Laziale (RM)
All’esame radiologico “diretto” della regione cervicale la tiroide normale è indistinguibile dai tessuti molli contigui, presentandosi come una tenue opacità in sede cervicale bassa. La radiografia standard del torace può tuttavia evidenziare l’incremento di volume della ghiandola sotto forma di aumento della sua naturale opacità o per la presenza di noduli calcifici. Calcificazioni grossolane sono riconducibili ad aree involutive in gozzi inveterati o possono essere espressione di macrocalcificazioni (“coarse calcifications”) in carcinomi midollari. Dato il potere di risoluzione della metodica, le microcalcificazioni dei carcinomi papillari non sono in genere evidenziabili.
L’esame stratigrafico può dimostrare deviazione tracheale (per l’effetto compressivo esercitato dalla tiroide), sotto forma di spostamento o scoliosi dell’area di ipertrasparenza della via aerea superiore. A tale reperto si associa, in caso di gozzo esteso verso il giugulo, la visualizzazione dell’allargamento del profilo del mediastino antero-superiore. Il gozzo intra-toracico è, infatti, una causa relativamente comune di masse mediastiniche retro-sternali, para-tracheali e retro-tracheali individuate nella routine radiografica del torace. L’opacità si presenta omogenea, radiopaca e a margini lisci-sagomati. Nella maggior parte dei gozzi a sviluppo anteriore si può osservare uno spostamento controlaterale dell’osso ioide, della trachea e della laringe, associata a deviazione posteriore dell’esofago.

La presenza di ripetizioni metastatiche polmonari da carcinoma tiroideo può essere rilevata alla radiografia del torace solo in caso di dimensioni superiori a 5-10 mm, a causa dello scarso potere di risoluzione della metodica.
Esofagogramma
In presenza di gozzo cervico-mediastinico, allo scopo di programmare un corretto approccio chirurgico in assenza di tecniche pesanti di diagnostica per immagini, la radiologia tradizionale può risultare utile nella valutazione dei rapporti con l’esofago di un gozzo o di una sospetta neoplasia a livello del passaggio cervico-toracico. Lo studio dell’esofago cervico-toracico viene eseguito con mezzo di contrasto (solitamente bario in sospensione o in compresse). Nell’esofagogramma normale l’esofago assume un aspetto a forma di nastro, con profilo continuo e privo di deficit di riempimento. L’esofagogramma mantiene un valido ruolo nella diagnosi differenziale di pazienti con gozzo voluminoso che accusino disfagia, poiché consente di dimostrare compressioni esofagee indotte da un aumento di volume della tiroide che impronta e devia il viscere. Suggestivo è il cosiddetto “segno del forcone”: l’esame diretto del torace in proiezione laterale con l’esofago opacizzato evidenzierà un’opacità toracica, corrispondente al gozzo, che impegna lo spazio tra la trachea anteriormente (visibile per l’aria al suo interno) e l’esofago posteriormente (visibile per il mezzo di contrasto).
In caso di neoplasia tiroidea localmente avanzata, l’esofagogramma può rivelare la presenza di rigidità ed irregolarità della parete nel corso del transito del bario, indizio di infiltrazione neoplastica per contiguità dell’organo.

Sia l’esame radiologico diretto che l’esofagogramma sono stati utilizzati per la loro semplicità di esecuzione ed i bassi costi. Tuttavia, poiché possono dare solo informazioni indirette su dimensioni e morfologia della ghiandola, nella stadiazione pre-operatoria devono essere sostituite da tecniche più accurate, quali ecografia, TC o RM e PET/TC.
Bibliografia
- De Groot LJ. Endocrinology. Adult and Pediatric. 6th Edition. Saunders Elsevier, Philadelphia 2010.
- Ross DS. Diagnostic approach to and treatment of thyroid nodule. www.uptodate.com (ultimo accesso 06-4-2011).
- Mazzaferri EL. Endocrine Tumors. Blackwell Scientific Publications, Oxford 1993.
TC e RM della tiroide
Giancarlo Bizzarri
UOC di Diagnostica per Immagini, Ospedale Regina Apostolorum, Albano Laziale (RM)
Aspetti generali
Tomografia computerizzata (TC) e risonanza magnetica (RM) devono essere utilizzate solo come tecniche di secondo livello nello studio di immagini della tiroide. Hanno tuttavia precise indicazioni diagnostiche:
- nei gozzi voluminosi, per la valutazione dell’estensione retro-sternale e dell’entità della possibile compressione o dislocazione tracheale;
- nell’identificazione di tiroidi accessorie e nella definizione di lesioni mediastiniche di incerta origine;
- nelle forme neoplastiche, per una corretta definizione dell’estensione di malattia e dei rapporti con le strutture vascolari, ai fini della pianificazione dell’intervento chirurgico.
TC e RM sono generalmente comparabili per determinare l’anatomia della ghiandola, l’estensione della tiroide nel torace e lo spostamento delle strutture adiacenti. La decisione su quale tecnica utilizzare si basa su diversi fattori. È importante ricordare che l’assenza di mdc contenente iodio rende necessaria la RM nei pazienti con tireotossicosi o allergia a mdc.
| Elementi per la scelta tra TC e RM | ||
| Vantaggi | Svantaggi | |
| TC |
Maggiore disponibilità |
Esposizione a radiazioni ionizzanti |
| RM |
Esatta definizione dell’invasione vascolare o dell’interessamento delle vie aeree |
Minore disponibilità |
Per questi motivi la TC dovrebbe essere in genere preferita in prima battuta, specialmente nei pazienti poco collaboranti, ma la RM è preferibile nella stadiazione del carcinoma della tiroide o di problemi nell’uso del mdc.
Tomografia computerizzata
In condizioni di base il tessuto tiroideo è discretamente visualizzato alla TC per il suo alto contenuto di iodio, che ne aumenta la densità (50-80 HU) rispetto alle altre strutture del collo. Dopo somministrazione endovenosa di mdc, tuttavia, la valutazione dei dettagli della ghiandola è più nitida e consente una migliore identificazione dei rapporti con le strutture cervicali.
Con le apparecchiature multidetettore di nuova generazione (MDCT) sono acquisite scansioni volumetriche con sezioni dello spessore di 0.5-0.6 mm e possibilità di successive ricostruzioni multiplanari (MPR). In particolare, possono ottenersi ricostruzioni standard su piani assiali (perpendicolari all’asse maggiore del corpo), coronali (perpendicolari all’asse antero-posteriore) e sagittali (perpendicolari all’asse latero-laterale).
In corso di esami TC del collo e del torace eseguiti per altri motivi possono essere identificati occasionalmente aumenti di volume della tiroide per patologia diffusa o focale, mono o multinodulare. Le formazioni nodulari presentano densità variabile a seconda del contenuto: bassa in caso di contenuto colloidale o cistico; medio-alta in caso di contenuto siero-emorragico, e alta in presenza di noduli calcifici. La TC, tuttavia, non consente di discriminare alcuni parametri fondamentali per definire il rischio di malignità dei noduli, come ipoecogenicità e caratteri dei margini. Anche se la maggior parte delle informazioni necessarie per la valutazione di un gozzo retro-sternale può essere ottenuta senza iniezione di mdc, questo è necessario per la definizione precisa del rapporto con le strutture aeree, muscolari e vascolari del collo e del torace.
La dimostrazione della continuità anatomica di una massa del mediastino superiore con la tiroide in sede cervicale dimostra che una lesione mediastinica è di origine tiroidea. La densità alla TC di un gozzo retro-sternale è variabile, ma il riscontro di una densità maggiore rispetto al tessuto muscolare suggerisce l’origine tiroidea della lesione. Infatti, timo, linfonodi, incluso il linfoma, e tumori polmonari raramente hanno densità superiore a quella del muscolo. Calcificazioni sono presenti nel 50-80% dei gozzi retro-sternali e possono essere puntiformi, lineari, a guscio d’uovo o amorfe. Calcificazioni grossolane possono essere presenti sia in lesioni benigne che maligne (dal 11% al 17% dei casi).
Risonanza magnetica
La RM evidenzia i tessuti sulla base delle loro proprietà magnetiche, e l’iniezione di mdc fornisce un’eccellente definizione delle strutture anatomiche del collo e del mediastino.
Il gozzo retro-sternale si presenta come un’area di bassa, normale o aumentata intensità di segnale nelle immagini T1-pesate, mentre le cisti emorragiche hanno intensità di segnale più elevata per la presenza di prodotti di degradazione del sangue (metaemoglobina). Le aree di eterogeneità strutturale all’interno del gozzo possono essere meglio individuate utilizzando immagini pesate in T2. Le calcificazioni all’interno dei gozzi appaiono come aree di bassa intensità di segnale.
Cancro della tiroide
Il ruolo primario di TC e RM nella valutazione del cancro della tiroide è costituito dalla stadiazione pre-operatoria e dal follow-up delle recidive di malattia.
Nella stadiazione pre-operatoria TC e/o RM non sono necessarie di routine. Queste metodiche sono tuttavia indispensabili, insieme a tracheoscopia ed esofagogramma, nel pianificare l’intervento chirurgico nei casi di carcinoma localmente avanzato. TC e RM forniscono, infatti, informazioni sull’invasione della cartilagine tiroidea, dell’esofago e dei grossi vasi del collo e mediastino, orientando il tipo di intervento chirurgico o evidenziando l’impossibilità di resezione chirurgica radicale. La RM è lo studio più sensibile nell’individuare l’invasione della cartilagine tracheale, del nervo laringeo ricorrente o dell’esofago.
L’utilizzo ottimale di queste metodiche di immagine nel periodo post-operatorio richiede un tempo di attesa di 4-6 settimane, necessario al riassorbimento dell’edema post-chirurgico. L’impiego in fase precoce della RMN o della TC è di fatto limitata più ad un confronto con il quadro pre-operatorio che alla ricerca di recidive precoci, in quanto il sovvertimento delle fasce muscolari e del grasso cervicale rende poco attendibile l’imaging precoce.
Il follow-up delle neoplasie differenziate è basato sull’uso dell’ultrasonografia e sul dosaggio ematico della Tg. Non è raro, tuttavia, che in alcuni pazienti si osservi un incremento della Tg in assenza di imaging positivo all’ultrasonografia e alla WBS. In questi casi trova indicazione l’utilizzo di TC e RMN. Nessuno studio prospettico controllato ha confrontato l’accuratezza diagnostica della TC vs la RM nella ricerca delle metastasi del cancro della tiroide. Comunque, la RM viene utilizzata in modo preferenziale nel follow-up del cancro tiroideo, per evitare l’assunzione di mdc iodato.
Alla RM tutti i linfonodi appaiono simili al muscolo nelle sequenze T1-pesate e brillanti nelle sequenze T2-pesate. Le adenopatie maligne appaiono di dimensioni aumentate (> 1 cm) e rotondeggianti, ma le caratteristiche dimensionali non rappresentano un fattore discriminante (le metastasi linfonodali possono svilupparsi in linfonodi di 4-5 mm, non riconoscibili a TC e RMN). Le microcalcificazioni delle metastasi linfonodali del PTC sono visualizzate alla TC ma non alla RM. Se la WBS è negativa in associazione a Tg elevata, è necessario ottenere un imaging polmonare nella ricerca di una disseminazione ematogena del carcinoma tiroideo. La TC è la metodica più usata, perché dotata di una maggiore risoluzione spaziale ed in grado di evidenziare piccole nodulazioni polmonari (comunque > 5 mm). Nello studio TC del polmone può essere ottenuto un livello di risoluzione soddisfacente anche senza l’uso di mdc.
L’impiego di un inquadramento multidisciplinare rende più sensibile e specifica la ricerca delle recidive del cancro della tiroide, e l’applicazione di metodiche di fusione (PET/TC) permette di riconoscere anche lesioni più piccole.
Bibliografia
- Gharib H, Papini E, Paschke R, et al; AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest 2010, 33: 1-50.
- Jennings A. Evaluation of substernal goiters using computed tomography and MR imaging. Endocrinol Metab Clin North Am 2001, 30: 401-14.
- Wartofsky L. Thyroid Cancer. A comprehensive guide to clinical management. 2nd Edition. 2005. Humana Press.
- Weber AL, Randolph G, Aksoy FG. The thyroid and parathyroid glands. CT and MR imaging and correlation with pathology and clinical findings. Radiol Clin North Am 2000, 38: 1105-29.
Atlante di immagini TC ed RMN della tiroide
Antonio Bianchini1 e Irene Misischi2
1UOC di Diagnostica per Immagini e 2UOC di Endocrinologia e Malattie Metaboliche
Ospedale Regina Apostolorum, Albano Laziale, Roma

Paziente di 78 anni con linfoma primitivo della tiroide
TC del collo (sezione assiale senza mdc): grossolana iperplasia di entrambi i lobi tiroidei e della regione istmica, con fenomeni compressivi sulla trachea che, al di sotto della laringe, presenta calibro nettamente ridotto con diametro trasverso minimo pari a circa 4 mm. Tale espanso occupa lo spazio retro-faringeo, retro-laringeo e retro-tracheale, estendendosi caudalmente al di sotto della carena. Filiforme il lume dell'esofago adiacente.

Paziente di 74 anni con carcinoma midollare della tiroide
TC del collo (sezione assiale senza mdc): estesa massa tumorale con aree calcifiche, infiltrazione e dislocazione della trachea, con gettone neoplastico endo-luminale (freccia)

Paziente di 68 anni con carcinoma follicolare della tiroide
TC del collo (sezione assiale con mdc) prima (a destra) e dopo (a sinistra) termo-ablazione laser (LTA).
Nell'immagine a destra: tessuto a densità solida parenchimatosa ad enhancement patologico, paratracheale sinistra da recidiva di carcinoma follicolare.
Nell'immagine a sinistra: il controllo post-LTA documenta completa ablazione dell’area patologica (scomparsa dell’enhancement contrastografico)

Paziente di 82 anni con angio-sarcoma primitivo della tiroide
TC del collo (sezione assiale con mdc): voluminoso espanso solido del lobo sinistro con enhancement disomogeneo (freccia), dislocazione laterale dell’asse vascolare e controlaterale dell’asse tracheale, con fenomeni infiltrativi dell’esofago.

Paziente di 72 anni con carcinoma midollare della tiroide inoperabile
TC del collo (ricostruzione sagittale senza mdc): processo espansivo tiroideo destro, che disloca posteriormente e infiltra la trachea con gettoni neoplastici

Paziente di 72 anni con carcinoma midollare della tiroide inoperabile
RMN del collo (sezione coronale T1 pesata senza mdc): voluminosa formazione espansiva del lobo destro della tiroide, con estensione intra-toracica in contiguità con l’emergenza dei vasi epi-aortici. La formazione comprime e disloca controlateralmente il lume della trachea, che risulta stenosato (freccia).
Paziente di 83 anni
Acquisizione TC volumetrica dopo somministrazione di mdc con ricostruzioni VR (3D) del parenchima tiroideo: la ricostruzione 3D consente un’accurata definizione del volume ghiandolare e dei rapporti con le strutture ossee e vascolari
Agoaspirato tiroideo ecoguidato
Enrico Papini e Irene Misischi
Endocrinologia, Ospedale Regina Apostolorum, Albano Laziale
(12 Febbraio 2012)
La biopsia della tiroide è la procedura di scelta per l’inquadramento della patologia nodulare tiroidea e la selezione delle lesioni da sottoporre ad intervento chirurgico (Patologia Nodulare della Tiroide: Approccio Diagnostico) (1). La biopsia dovrebbe essere effettuata sotto guida ecografica anche nei noduli palpabili per la maggiore accuratezza del prelievo, la documentazione della sua sede, la migliore qualità del materiale e la riduzione del rischio di complicanze (2-3, 5-6).
L’aspirazione con ago sottile (“fine needle aspiration biopsy”: FNA) è la tecnica più appropriata nella pratica clinica, mentre la biopsia con ago tranciante per prelievo microistologico (“core-needle biopsy”: CNB) deve essere ristretta a circostanze selezionate (vedi: Biopsia della Tiroide) (2-4) .
Le indicazioni cliniche ed ecografiche alla FNA dei noduli tiroidei sono descritti nei capitoli Patologia Nodulare della Tiroide: Approccio Diagnostico, e Utilità della Ecografia Tiroidea.
1. Preparazione alla procedura
La procedura deve essere chiaramente descritta al paziente prima dell’esecuzione, perché la sua cooperazione è indispensabile per la buona riuscita dell’esame. In particolare, il paziente deve essere rassicurato circa il basso rischio di complicanze e la breve durata del dolore locale e deve essere istruito a non ritrarsi o contrarre i muscoli del collo, a non parlare o deglutire e a non compiere respiri profondi durante la procedura (2).
È necessaria la conferma della mancata assunzione di aspirina, anti-aggreganti, anti-coagulanti e dell’assenza di condizioni emorragipare. I pazienti in trattamento con aspirina devono sospenderla cinque giorni prima della procedura. Il trattamento anti-coagulante con dicumarolici può essere sostituito nello stesso periodo con eparina sottocutanea, da sospendere la sera precedente l'esame. In assenza di complicanze, il trattamento anti-aggregante può essere ripreso 12 ore dopo la FNA (2).
Prima di iniziare la FNA, il paziente deve leggere e firmare un consenso informato scritto (2). Esso deve descrivere con parole ben comprensibili:
- i possibili rischi (dolore locale persistente per 12–72 ore, ematoma profondo, ecchimosi cutanea)
- i limiti della FNA (possibilità di falsi positivi o falsi negativi citologici, frequenza presso il Centro di prelievi inadeguati che rendono necessaria la ripetizione dell’ago-aspirato) (7-8)
- la necessità comunque di un follow-up successivo (2-3).
Dopo aver eseguito un’attenta palpazione della ghiandola, il paziente deve togliere gli indumenti che limitano l’esposizione del collo e deve essere posto in posizione supina, con un sottile cuscino sotto le spalle e con il collo iperesteso e ben esposto (figura 1).
La cute deve essere disinfettata con un preparato non irritante, che possa svolgere funzione accoppiante per la sonda ecografica (per esempio, una soluzione di benzalconio cloruro e alcool al 95%). Utile posizionare un telino di carta sterile sul torace ed intorno al collo.
2. Materiali necessari
L’ambiente deve essere tranquillo, con una illuminazione del collo che lasci in penombra lo schermo dell’ecografo e uno spazio adeguato per l’apparecchio ecografico, per l’operatore che esegue la manovra e per un’infermiera. Quest’ultima dovrà preparare in anticipo i vetrini, con annotati i dati anagrafici del paziente, la data e la sede del prelievo.
Necessari un tavolino per l’allestimento dei preparati e il materiale d’uso, un lettino da visita, contenitori separati per materiali comuni, materiali contaminati da sangue ed aghi o oggetti taglienti. L’ecografo real-time deve essere dotato di una risoluzione adeguata, di color-doppler e di una sonda lineare ad alta frequenza (7.5 – 15 MHz).
Devono essere a disposizione (1, 12) (figura 2)  :
:
- aghi monouso da prelievo sanguigno 23 – 19 gauge (G)
- aghi da insulina 27 – 25 gauge
- aghi spinali con mandrino
- siringhe monouso da 10 e 20 cc
- impugnatura per siringhe tipo Cameco
- vetrini con una estremità smerigliata
- porta vetrini
- provette con 1 mL di soluzione fisiologica per determinazioni sul liquido di lavaggio dell’ago (Tireoglobulina, Calcitonina o Paratormone, secondo necessità clinica)
- etichette adesive con il nome del paziente
- garze sterili
- cerotti
- disinfettante per cute
- bustine di gel accoppiante sterile
- copri-sonda in plastica (per evitare la contaminazione della sonda con materiale ematico)
- telini sterili
- guanti monouso
- farmaci e carrello per le emergenze.
3. Modalità di esecuzione della procedura
Quando la procedura è eseguita da due operatori, chi esegue la biopsia si colloca sul lato sinistro e al di dietro del paziente mentre l’operatore che impugna la sonda ed esegue la scansione ecografica è collocato alla sua destra (2).
E’ necessaria una accurata valutazione ecografica iniziale della tiroide e dei linfonodi cervicali, selezionando la lesione di maggior interesse clinico ed individuando il percorso dell’ago che meglio consente di evitare vasi e strutture vitali del collo.
E’ stata proposta l’esecuzione di anestesia locale con xylocaina o l’applicazione di compresse gelate nel punto da sottoporre a biopsia (11). Tali provvedimenti non forniscono, nel caso della FNA, sostanziali vantaggi e rendono la procedura più lunga. Ove sia ritenuta opportuna la anestesia, questa deve giungere in profondità fino ai muscoli del collo e alla capsula tiroidea (12).
Dopo una accurata disinfezione e preavvisato il paziente, l’ago viene inse rito attraverso la cute per circa 1 - 2 cm con un movimento gentile ma deciso. Per il prelievo iniziale è consigliabile l’impiego di aghi di calibro 23–25 G connessi a una siringa di plastica monouso da 10 o 20 mL. L’impiego di un’impugnatura (tipo Cameco) in cui alloggiare la siringa è di aiuto nella esecuzione della manovra (figura 3), ma deve essere evitata una suzione eccessiva, causa di contaminazione ematica.
rito attraverso la cute per circa 1 - 2 cm con un movimento gentile ma deciso. Per il prelievo iniziale è consigliabile l’impiego di aghi di calibro 23–25 G connessi a una siringa di plastica monouso da 10 o 20 mL. L’impiego di un’impugnatura (tipo Cameco) in cui alloggiare la siringa è di aiuto nella esecuzione della manovra (figura 3), ma deve essere evitata una suzione eccessiva, causa di contaminazione ematica.
- In caso di noduli vascolarizzati al color-doppler, con componente fluida all’esame ecografico o dopo un prelievo iniziale caratterizzato da contaminazione ematica, è opportuno eseguire il prelievo con ago da 27 G.
- In caso di pseudo-cisti tiroidee a contenuto fortemente vischioso, per ottenere il drenaggio del fluido possono essere utilizzati aghi di maggior diametro, fino a un calibro di 19 G. L’impiego di aghi non sottili richiede tuttavia cautela ed esperienza.
La procedura è eseguita con l’ausilio dell’ecografo secondo due modalità (12):
- procedura eco-guidata: un dispositivo di guida viene connesso alla s
 onda ecografica e la traiettoria dell’ago all’interno del collo può essere prestabilita sullo schermo ecografico. E’ necessario l’uso di un ago spinale 21-23 G di 75–90 mm di lunghezza (figura 4). Questa procedura consente di seguire costantemente il progresso dell’ago e di raggiungere con sicurezza sedi a rischio o molto profonde (ad esempio, sospette paratiroidi iperplastiche). Ha lo svantaggio, tuttavia, di richiedere un punto di ingresso dell’ago non sempre ottimale e di non consentire movimenti della sonda indipendenti dall’ago.
onda ecografica e la traiettoria dell’ago all’interno del collo può essere prestabilita sullo schermo ecografico. E’ necessario l’uso di un ago spinale 21-23 G di 75–90 mm di lunghezza (figura 4). Questa procedura consente di seguire costantemente il progresso dell’ago e di raggiungere con sicurezza sedi a rischio o molto profonde (ad esempio, sospette paratiroidi iperplastiche). Ha lo svantaggio, tuttavia, di richiedere un punto di ingresso dell’ago non sempre ottimale e di non consentire movimenti della sonda indipendenti dall’ago.
- procedura eco-assistita: l’ago (indifferentemente da prelievo o dotato di mandrino) è inserito nel collo in modo indipendente dalla sonda ecografica e la sua progressione è seguita e corretta in itinere sulla base della scansione ecografica. L’inserimento dell’ago può essere effettuato:
- con approccio parallelo (figura 5):
 il nodulo è visualizzato nel campo di scansione in modo leggermente decentrato e l’ago è inserito in corrispondenza del margine breve della sonda più prossimo al bersaglio con una inclinazione di circa 45°. Il tragitto è seguito sullo schermo in tutto il suo percorso, dal punto di ingresso cutaneo fino alla penetrazione nella lesione bersaglio, in modo analogo a quanto accade per la procedura ecoguidata. Lo svantaggio è rappresentato dal fatto che la deviazione dell’ago di alcuni gradi rispetto al piano azimutale di scansione ne determina la scomparsa dallo schermo. La tecnica è utile per raggiungere lesioni piccole in sedi difficoltose (ad esempio, sospette recidive neoplastiche dopo intervento chirurgico), ma richiede una specifica esperienza.
il nodulo è visualizzato nel campo di scansione in modo leggermente decentrato e l’ago è inserito in corrispondenza del margine breve della sonda più prossimo al bersaglio con una inclinazione di circa 45°. Il tragitto è seguito sullo schermo in tutto il suo percorso, dal punto di ingresso cutaneo fino alla penetrazione nella lesione bersaglio, in modo analogo a quanto accade per la procedura ecoguidata. Lo svantaggio è rappresentato dal fatto che la deviazione dell’ago di alcuni gradi rispetto al piano azimutale di scansione ne determina la scomparsa dallo schermo. La tecnica è utile per raggiungere lesioni piccole in sedi difficoltose (ad esempio, sospette recidive neoplastiche dopo intervento chirurgico), ma richiede una specifica esperienza. - con approccio perpendicolare (figura 6):
 il nodulo è visualizzato nel punto centrale del piano di scansione, in modo che sia il nodulo da raggiungere sia il punto di ingresso dell’ago siano allineati verticalmente con il punto centrale del lato maggiore della sonda ecografica. L’ago viene inserito pressoché verticalmente pochi millimetri cranialmente alla sonda. Il suo tragitto iniziale non può essere seguito e la sua punta appare come un punto eco-riflettente soltanto nel momento in cui essa intercetta il piano azimutale di scansione. E’ necessario quindi prevedere, sulla base dell’immagine ecografica e della inclinazione della sonda, l’inclinazione e la direzione più opportuna da fornire all’ago. La manovra ha il vantaggio di consentire un movimento autonomo della sonda con piena libertà di scansione, ma richiede, soprattutto se eseguita da due operatori, buona esperienza ed affiatamento.
il nodulo è visualizzato nel punto centrale del piano di scansione, in modo che sia il nodulo da raggiungere sia il punto di ingresso dell’ago siano allineati verticalmente con il punto centrale del lato maggiore della sonda ecografica. L’ago viene inserito pressoché verticalmente pochi millimetri cranialmente alla sonda. Il suo tragitto iniziale non può essere seguito e la sua punta appare come un punto eco-riflettente soltanto nel momento in cui essa intercetta il piano azimutale di scansione. E’ necessario quindi prevedere, sulla base dell’immagine ecografica e della inclinazione della sonda, l’inclinazione e la direzione più opportuna da fornire all’ago. La manovra ha il vantaggio di consentire un movimento autonomo della sonda con piena libertà di scansione, ma richiede, soprattutto se eseguita da due operatori, buona esperienza ed affiatamento.
- con approccio parallelo (figura 5):
4. Modalità di prelievo
Il prelievo può essere eseguito (13-14):
- per capillarità: l’operatore impugna l’ago per il suo cono come una matita o, in alternativa, impugna la siringa cui viene collegato senza esercitare alcuna suzione (figura 7). Vengono effettuati una serie di rapidi e netti movimenti di va e vieni e di rotazione della punta dell’ago all’interno della lesione per alcuni secondi. Questo metodo deve essere preferito in caso di lesioni molto vascolarizzate o cribrate per la presenza di componente colloidea.
- mediante suzione: dopo che la punta dell’ago è stata inserita all’interno della lesione viene esercitata una decompressione all’interno della siringa.
Questo metodo deve essere preferito in caso di lesioni solide o con componente fibrosa.
Esecuzione del prelievo per aspirazione (filmato 1)
- Accertare il posizionamento della punta dell’ago nella lesione bersaglio.
- Eseguire rapidi movimenti di va e vieni all’interno del nodulo, mentre si esercita una aspirazione retraendo parzialmente il pistone della siringa (il monitoraggio ecografico deve verificare che i movimenti non facciano fuoriuscire la punta dell’ago dal bersaglio).
- Alla comparsa, dopo alcuni secondi, del materiale aspirato all’interno del cono dell’ago, cessare immediatamente la suzione e retrarre l’ago.
- Rimuovere l’ago dalla siringa.
- Riempire parzialmente la siringa di aria.
- Ricollegare l’ago alla siringa.
- Spingere gentilmente il pistone in maniera che una piccola goccia dell’ago-aspirato venga appoggiata su 2 - 3 vetrini.
In genere vengono eseguiti da 2 a 4 prelievi su aree diverse di ciascun nodulo, in rapporto alla qualità e quantità del materiale prelevato (8 – 10).
Nell’ambito della lesione bersaglio il campionamento deve essere eseguito:
- nei noduli voluminosi: sulla parte periferica della lesione piuttosto che su quella centrale, a causa delle modificazioni degenerative e delle raccolte liquide frequentemente presenti in quest’ultima;
- nelle lesioni interamente cistiche: nella parte centrale della cavità, con aggiustamento progressivo della punta dell’ago durante il drenaggio, al fine di ottenere uno svuotamento completo (filmato 2)
- nei noduli misti con notevole componente fluida: sulle porzioni solide (parete spessa e aggetti vascolarizzati) per un accurato campionamento prima del drenaggio del liquido (filmato 3).
5. Allestimento dei preparati (vedi: Citologia tiroidea) (2, 9, 12)
 I campioni vengono allestiti strisciando la goccia di materiale fra due vetrini porta-oggetti con un movimento orizzontale continuo (figura 8 a, b,c).
I campioni vengono allestiti strisciando la goccia di materiale fra due vetrini porta-oggetti con un movimento orizzontale continuo (figura 8 a, b,c).
Lo striscio deve essere uniforme e non troppo spesso, senza che il materiale raggiunga la periferia del vetrino per evitare la dispersione delle cellule lungo i bordi fFigura 9).

Subito dopo lo striscio, parte dei vetrini viene fissata in alcool (per immersione o con preparato alcoolico spray spruzzato da circa 10 cm di distanza) per la colorazione di Papanicolaou (figura 8), mentre parte viene lasciata essiccare all’aria per la colorazione di Giemsa.
In alternativa, è possibile spruzzare direttamente con la siringa il materiale prelevato in un recipiente contenente una soluzione per sistemi automatizzati di esame citologico (Thin Prep). Questi campioni sono successivamente allestiti dal laboratorio in preparati monostrato su un unico vetrino, dopo l’eliminazione degli elementi di contaminazione ematica (figura 10a,b,c).
Questa procedura minimizza le imperfezioni nella tecnica di prelievo e nell’allestimento del campione, ma non consente la valutazione della colloide e delle aggregazioni cellulari.
Nelle cisti o lesioni complesse la componente fluida deve essere inviata al laboratorio analisi, all’interno della siringa con cui è stata aspirata, per citocentrifugazione e successivo allestimento dei preparati citologici (figura 11).

6. Gestione post-procedura
Al termine di ciascun prelievo, applicare per alcuni secondi una gentile pressione con una garza sterile sulla sede della puntura, in modo da evitare il formarsi di ecchimosi o di ematoma intra-capsulare. Previa copertura con cerotto del punto di iniezione, il paziente viene dapprima posto lentamente a sedere e quindi aiutato ad assumere la stazione eretta.
In assenza di dolore o di ematomi di rilievo ecografico, è possibile l’immediato ritorno a casa o al lavoro, con l’istruzione ad assumere un blando analgesico (paracetamolo o ketoprofene per bocca) in caso di persistenza del fastidio cervicale. Nei rari casi in cui venga documentato un ematoma intra-capsulare, il paziente dovrà essere rassicurato, istruito ad esercitare una ferma compressione locale per 15-30 minuti e quindi riesaminato ecograficamente per documentare l’iniziale riassorbimento dello spandimento emorragico.
7. Richiesta di esame citologico
Il modulo per la richiesta di esame citologico da allegare al campione deve specificare (vedi: Citologia tiroidea) (2, 15):
- sede e dimensioni del nodulo;
- elementi anamnestici, clinici o ecografici di sospetto per malignità;
- presenza, entità e caratteri di eventuale componente fluida;
- stato funzionale e autoimmunitario della tiroide;
- eventuale trattamento farmacologico o radiante, in atto o pregresso.
8. Determinazioni ormonali su liquido di lavaggio dell’ago
La FNA sotto guida ecografica è una manovra dotata di buona accuratezza diagnostica per le recidive locali o le secondarietà linfonodali da carcinoma tiroideo e, in minor misura, per la diagnosi di adenoma paratiroideo in lesioni di dubbia interpretazione. La combinazione dell’esame citologico sull’ago-aspirato con la determinazione di Tireoglobulina, Calcitonina (vedi: Gestione dei Tumori tiroidei avanzati e delle recidive locali) o Paratormone (vedi: Diagnosi dell’Iperparatiroidismo primitivo), in rapporto al quesito diagnostico, sul liquido di lavaggio dell’ago consente tuttavia di accrescere sensibilità e specificità della procedura (2-3).
 Subito dopo l’espulsione del materiale sui vetrini per l’esame citologico, si aspira attraverso l’ago con cui è stata effettuata la biopsia 1 mL di soluzione fisiologica 0.9%. Quest’ultimo è espulso e riaspirato una seconda volta in maniera da rimuovere il materiale presente nel lume dell’ago (figura 12).
Subito dopo l’espulsione del materiale sui vetrini per l’esame citologico, si aspira attraverso l’ago con cui è stata effettuata la biopsia 1 mL di soluzione fisiologica 0.9%. Quest’ultimo è espulso e riaspirato una seconda volta in maniera da rimuovere il materiale presente nel lume dell’ago (figura 12).
Su tale campione verrà effettuata, con le usuali procedure di laboratorio, la determinazione dell’analita di interesse clinico.
Nelle adenopatie secondarie da Carcinoma Differenziato tiroideo (vedi: Gestione dei Tumori tiroidei avanzati e delle recidive locali.) i livelli di Tg sono marcatamente elevati e comunque nettamente superiori rispetto ai valori circolanti (in genere nell’ambito di 100–10.000 ng/mL). Il riscontro di valori elevati di Tg sul liquido di lavaggio dell’ago è fortemente predittivo di secondarietà, anche in presenza di un preparato citologico inadeguato ai fini diagnostici. Nei pazienti trattati con dosi ablative di radioiodio i valori possono essere meno elevati a causa della parziale atrofia linfonodale, ma sono comunque nettamente superiori rispetto ai livelli ematici di Tg. La coesistenza di anticorpi anti-Tireoglobulina nel siero non appare invalidare l’esame (16).
Nel sospetto clinico o ecografico di Carcinoma Midollare, la determinazione della Calcitonina sul liquido di lavaggio dell’ago deve essere eseguita non solo sui linfonodi sospetti, ma anche sulla lesione tiroidea primitiva. Infatti, in caso di diagnosi citologica dubbia, il riscontro di livelli elevati di Calcitonina (usualmente > 100 pg/mL) è fortemente suggestivo di Carcinoma Midollare (vedi: Carcinoma Midollare: Clinica e Diagnosi).
Bibliografia
- Soderstrom N. Puncture of goiters for aspiration biopsy. Acta Med Scand 1952, 144: 237.
- Gharib H, Papini E, Paschke R, and the AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Italian Association of Clinical Endocrinologists and European Thyroid Association. Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest 2010, 33 (suppl 5): 1-56.
- American Thyroid Association Guidelines Taskforce on thyroid nodules and differentiated thyroid cancer, Cooper DS, Doherty GM et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167-214.
- Zhang S, Ivanovic M, Nemcek AA Jr, et al. Thin core needle biopsy crush preparations in conjunction with fine needle aspiration for the evaluation of thyroid nodules: a complementary approach. Cancer 2008, 114: 512-8.
- Danese D, Sciacchitano S, Farsetti A, et al. Diagnostic accuracy of conventional versus sonography guided fine-needle aspiration biopsy of thyroid nodules. Thyroid 1998, 8: 15-21.
- Deandrea M, Mormile A, Veglio M, et al. Fine needle aspiration biopsy of the thyroid: comparison between thyroid palpation and ultrasonography. Endocr Pract 2002, 8: 282-6.
- Yang J, Schnadig V, Logrono R, et al. Fine-needle aspiration of thyroid nodules: a study of 4703 patients with histologic and clinical correlations. Cancer Cytopathol 2007, 111: 306-15.
- Redman R, Zalaznick H, Mazzaferri EL, et al. The impact of assessing specimen adequacy and number of needle passes for fine-needle aspiration biopsy of thyroid nodules. Thyroid 2006, 16: 55-60.
- Goellner JR, Gharib H, Grant CS, et al. Fine needle aspiration cytology of the thyroid, 1980 to 1986. Acta Cytol 1987, 31: 587-90.
- Caruso D, Mazzaferri EL. Fine needle aspiration biopsy in the management of thyroid nodules. Endocrinologist 1991, 1: 194-202.
- Gursoy A, Ertugrul DT, Sahin M, et al. Needle-free delivery of lidocaine for reducing the pain associated with the fine-needle aspiration biopsy of thyroid nodules: time saving and efficacious procedure. Thyroid 2007, 17: 317.
- Duick DS, Mandel SJ. Ultrasound-guided fine-needle aspiration of thyroid nodules. In: Baskin HJ, Duick D, Levine RA eds, Thyroid ultrasound and ultrasound-guided FNA. Springer Science, New York, 2008: 97–110.
- Mair S, Dunbar F, Becker PJ, et al. Fine-needle cytology: is aspiration suction necessary? A study of 100 masses at various sites. Acta Cytol 1989, 33: 809.
- Romitelli F, Di Stasio E, Santoro C, et al. Comparative study of fine-needle aspiration and fine-needle non-aspiration biopsy on suspected thyroid nodules. Endocr Pathol 2009, 20: 108.
- Baloch Z, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a sinopsis of the National Cancer Institute Thyroid Fine-needle Aspiration state of the science conference. Diagn Cytopathol 2008, 36: 425.
- Boi F, Baghino G, Atzeni, et al. The diagnostic value for differentiated thyroid carcinoma metastases of thyroglobulin measurement in wash-out fluid from fine-neeedle aaspiration biopsy of neck lymph nodes is maintained in the presence of circulating anti-Tg antibodies. J Clin Endocrinol Metab 2006, 91: 1364.
Biopsia tiroidea
Andrea Frasoldati*, Bernardo Olivares*, Simonetta Piana°, Roberto Valcavi*
*UO Endocrinologia, e °Anatomia Patologica, Arcispedale S. Maria Nuova, Reggio Emilia
Premesse
La biopsia tiroidea, anche indicata nella letteratura anglosassone più recente come core needle biopsy (CNB), corrisponde al campionamento di un microfrustolo di tessuto tiroideo mediante impiego di aghi di 18-21 G, solitamente muniti di dispositivo a molla del tipo tru-cut. La procedura è oggi condotta pressoché esclusivamente sotto guida ecografica (1-4).
La grande diffusione della citologia tiroidea da agoaspirazione (fine needle aspiration = FNA) e la sua affermazione come gold standard nella diagnostica del nodulo tiroideo (5-9) hanno determinato nel corso degli ultimi decenni una progressiva riduzione dell’impiego dell’agobiopsia tiroidea, il cui potenziale ruolo ha finito con l’essere disconosciuto o comunque sottovalutato. Non sorprende pertanto che le casistiche disponibili in letteratura siano nel complesso limitate per numero e per consistenza, e che lo spazio dedicato alla CNB dalle principali linee guida sul nodulo tiroideo sia piuttosto limitato (7-9). Ciò a dispetto del fatto che tale metodica, negli studi pubblicati così come nella pratica clinica quotidiana, si sia dimostrata sicura, efficace e ben tollerata (1-4, 10-20). Viene infatti riportata una morbilità trascurabile, per lo più caratterizzata da un aumentato rischio di ematomi rispetto all’agoaspirazione; la manovra non viene solitamente percepita come maggiormente invasiva rispetto alla FNA da parte dei pazienti e non è sempre necessario l’impiego dell'anestesia locale. Inoltre, la disponibilità di dispositivi con escursioni dell'ago più limitate (es. 11 mm) consente di estendere la CNB a lesioni di piccole dimensioni. Per tali ragioni, negli ultimi anni si sta assistendo ad un incremento di interesse nei confronti della CNB, testimoniata da numerosi lavori (15-19), ed è lecito attendersi che nel medio termine indicazioni, vantaggi e limiti di questa metodica possano conoscere una adeguata sistematizzazione.
Nei paragrafi seguenti verrà discussa l’applicazione della CNB nelle seguenti situazioni cliniche:
- noduli con citologia non diagnostica (Thy-1)
- noduli con citologia indeterminata (Thy-3)
- neoplasie di incerta caratterizzazione del distretto cervicale
Noduli con citologia non diagnostica (Thy-1)
L’agoaspirazione tiroidea fornisce risultati non diagnostici in una quota compresa nelle varie casistiche tra il 5 e il 20% (20-21); in tali casi viene solitamente raccomandata la ripetizione dell’esame citologico e nei casi più incerti sul piano clinico-ecografico, l’exeresi chirurgica (8,9,22). Nei noduli con citologia non diagnostica, la CNB offre la possibilità di ottenere un campione più ampio di materiale, solitamente caratterizzato dalla conservazione dell’architettura follicolare (19). Nondimeno, le principali linee guida tendono a limitare l’impiego della CNB nei noduli con citologia non diagnostica: in particolare, le linee guida ATA non prendono neppure in considerazione la CNB (8), mentre le raccomandazioni AACE/AME/ETA riconoscono un possibile ruolo della metodica solo in casi selezionati (9).
Uno studio retrospettivo recentemente pubblicato dal gruppo di Harvard su 90 casi, caratterizzati da uno o più esami citologici non diagnostici, dimostra che la CNB ottiene un risultato diagnostico nel 77% e che l’associazione di CNB e FNA raggiunge un esito diagnostico nell’87% dei casi. Nello stesso studio, la sempice ripetizione dell’agoaspirazione ottiene un risultato diagnostico in appena il 47% dei casi (23).
Risultati simili provengono da un ampio studio coreano focalizzato sul ruolo della CNB nei noduli Thy-1 (n = 64) o Thy-3 (n = 161): solo l’1.6% delle CNB fornisce un risultato non diagnostico contro il 28.1% della ripetizione citologica (24).
Nella serie di 225 noduli tiroidei valutati con FNA e CNB pubblicata dal gruppo del Northwestern University di Chicago, la percentuale di esiti non diagnostici corrisponde al 3.4%, inferiore all'8.7% osservato con il solo FNA (25). Secondo gli autori di questo studio, esempi di lesioni che possono beneficiare della valutazione mediante CNB sono i noduli molto vascolarizzati e quindi a rischio di esito citologico ematico, i noduli iperplastici con fibrosi pericapsulare, le aree fibrotiche nel contesto di tiroiditi linfocitarie e i carcinomi papillari con sclerosi estesa.
Noduli con citologia indeterminata (Thy-3)
Il contributo della CNB nella valutazione di questo tipo di noduli costituisce un capitolo controverso.
Nel già citato recente studio coreano, la performance della CNB in un gruppo di lesioni (n = 161) con citologia Thy-3 corrispondenti alla categoria AUS/FLUS (atipie e lesioni follicolari di significato indefinito) della classificazione Bethesda risulta superiore a quella della ripetizione della citologia (24). In questo studio, la CNB consente di riclassificare correttamente il 24.8% delle lesioni come iperplastiche e il 43.4% delle lesioni come presumibilmente o certamente maligne. Dopo la CNB, solo un quarto dei casi (23.6%) resta nella categoria AUS/FLUS, una quota significativamente inferiore al 39.8% osservato dopo ripetizione della citologia mediante FNA. Risultati ancor più promettenti provengono da uno studio retrospettivo su un gruppo complessivo di 258 noduli con citologia indeterminata corrispondente alla categoria AUS/FLUS del Bethesda (anche in questo studio le neoformazioni follicolari erano escluse) (26). La CNB eseguita in 54 di queste lesioni consentie di caratterizzarne il 77.8% come benigne, il 20.3% come carcinomi papillari, mantenendo la diagnosi indeterminata in un unico caso (1.8%), corrispondente a una lesione a cellule di Hürtle.
Per quanto riguarda l'ambito delle neoformazioni follicolari, il punto di vista prevalente è che l’impiego della CNB possa fornire una rassicurante interpretazione in chiave iperplastica di una quota di lesioni follicolari non sufficientemente caratterizzate dalla citologia, ma non fornisca elementi utili aggiuntivi a definire la malignità o benignità delle neoformazioni follicolari propriamente dette (24-26). In tali casi, infatti il campione istologico ottenuto mediante CNB è comunque inadeguato per fornire una rappresentazione accurata dei possibili aspetti di infiltrazione capsulare e/o vascolare tipici del carcinoma follicolare.
Neoplasie del distretto cervicale
Una riconosciuta area di impiego della CNB è rappresentata dalla caratterizzazione di lesioni di certa o sospetta natura neoplastica del distretto cervicale, e quindi anche della tiroide, non sufficientemente caratterizzate sotto il profilo citologico (3,18,26,27). Rientrano in tale ambito il carcinoma anaplastico della tiroide e le altre neoplasie primitive della tiroide scarsamente differenziate, come i sarcomi, i linfomi a localizzazione tiroidea, le metastasi a sede tiroidea di altre neoplasie (carcinoma mammario, carcinoma renale, melanoma, ecc.). In particolare, è riportata un'accuratezza diagnostica del 92.3% nella caratterizzazione del tipo istologico dei linfomi a localizzazione cervicale (28); l’importanza di tale dato risiede nella capacità della CNB di evitare un numero rilevante di biopsie chirurgiche dei linfonodi.
Conclusioni
In sintesi, dati di letteratura ed esperienza clinica consentono di affermare che l'impiego della CNB è di potenziale utilità in queste condizioni:
- diagnostica differenziale di lesioni di sospetta natura eteroplastica, son sufficientemente caratterizzate sul piano citologico (es. carcinomi primitivi scarsamente differenziati, linfomi, sarcomi, metastasi tiroidee di altri tumori primitivi etc.)
- caratterizzazioni di noduli con citologia ripetutamente non diagnostica (Thy-1), candidati all'exeresi chirurgica
Non possono dirsi ancora sufficientemente definite le indicazioni della CNB nelle lesioni indeterminate (Thy-3), anche per l'eterogeneità dei quadri clinici che rientrano in tale categoria. E' possibile che la CNB possa fornire elementi diagnostici nel caso di lesioni Thy-3 con atipia di incerto significato, come suggeriscono alcune serie della letteratura, o che possa contribuire alla stratificazione del rischio di malignità associato alle lesioni follicolari. Allo stato attuale, tali aspetti necessitano di ulteriori approfondimenti.
Bibliografia
- Quinn SF, Nelson HA, Demlow TA. Thyroid biopsies: fine-needle aspiration biopsy versus spring-activated core biopsy needle in 102 patients. J Vasc Interv Radiol 199, 45: 619–23.
- Taki S, Kakuda K, Kakuma K, et al. Thyroid nodules: evaluation with US-guided core biopsy with an automated biopsy gun. Radiology 1997, 202: 874-7.
- Screaton NJ, Berman LH, Grant JW. US-guided core-needle biopsy of the thyroid gland. Radiology 2003, 226: 827-32.
- Harvey JN, Parker D, De P, et al. Sonographically guided core biopsy in the assessment of thyroid nodules. J Clin Ultrasound 2005, 33: 57-62.
- Gharib H, Goellner JR. Fine-needle aspiration biopsy of the thyroid. Ann Intern Med 1993, 118: 282-9.
- Layfield LJ, Cibas ES, Gharib H, Mandel SJ. Thyroid aspiration cytology: current status. CA Cancer J Clin 2009, 59: 99–110.
- Frates MC, Benson CB, Charboneau JW, et al. Society of Radiologists in Ultrasound Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology 2005, 237: 794–800.
- Cooper DS, Doherty GM, Haugen BR et al, American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167–1214.
- Gharib H, Papini E, Paschke R, et al. AACE/AME/ETA Task Force on Thyroid Nodules. AACE, AME and ETA medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. Endocr Pract 2010, 16: 468–75.
- Liu Q, Castelli M, Gattuso P, et al. Simultaneous fine-needle aspiration and core needle biopsy of thyroid nodules. Am Surg 1995, 61: 628-32.
- Pisani T, Bononi M, Nagar C, et al. Fine needle aspiration and core needle biopsy techniques in the diagnosis of nodular thyroid pathologies. Anticancer Res 2000, 20: 3843-7.
- Karstrup S, Balslev E, Juul N, et al. US-guided fine needle aspiration versus corse needle biopsy of thyroid nodules. Eur J Ultrasound 2001, 13: 1-5.
- Renshaw AA, Pinnar N. Comparison of Thyroid Fine-Needle Aspiration and Core Needle Biopsy. Am J Clin Pathol 2007, 128: 370-4.
- Jordan CD. Synchronous Fine-Needle Aspiration Cytology and Core Biopsy of Thyroid Nodules. Am J Clin Pathol 2007, 128: 365-6.
- Strauss EB, Lovino A, Upender S. Simultaneous fine-needle aspiration and core biopsy of thyroid nodules and other superficial head and neck masses using sonographic guidance. Am J Roentgenol 2008, 190: 1697–9.
- Khoo TK, Baker CH, Hallanger-Johnson J, et al. Comparison of ultrasound-guided fine-needle aspiration biopsy with core-needle biopsy in the evaluation of thyroid nodules. Endocr Pract 2008, 14: 426–31.
- Lieu D. Cytopathologist-performed ultrasound-guided fine-needle aspiration and core-needle biopsy: a prospective study of 500 consecutive cases. Diagn Cytopathol 2008, 36: 317–24.
- Novoa E, Gürtler N, Arnoux A, Kraft M. Role of ultrasound-guided core-needle biopsy in the assessment of head and neck lesions: A meta-analysis and systematic review of the literature. Head Neck 2012, 34: 1497-503.
- Sung JY, Na DG, Kim KS, et al. Diagnostic accuracy of fine-needle aspiration versus core-needle biopsy for the diagnosis of thyroid malignancy in a clinical cohort. Eur Radiol 2012, 22: 1564-72.
- Alexander EK, Heering JP, Benson CB, et al. Assessment of nondiagnostic ultrasound-guided fine needle aspirations of thyroid nodules. J Clin Endocrinol Metab 2002, 87: 4924–7.
- Chow LS, Gharib H, Goellner JR, van Heerden JA. Nondiagnostic thyroid fine-needle aspiration cytology: management dilemmas. Thyroid 2001, 11: 1147–51.
- Orija IB, Pineyro M, Biscotti C, et al. Value of repeating a nondiagnostic thyroid fine-needle aspiration biopsy. Endocr Pract 2007, 13: 735–42.
- Samir AE, Vij A, Seale MK et al. Ultrasound-guided percutaneous thyroid nodule core biopsy: clinical utility in patients wioth priori non diagnostic fine needle aspirate. Thyroid 2012, 22: 461-7.
- Gyu Na D, Kim J-H, Sung J-H, et al. Core needle biopsy is more useful than repeat fine-needle aspiration in thyroid nodules read as non diagnostic or atypia of undetermined significance by the Bethesda system for reporting thyroid cytopathology. Thyroid 2012, 22: 468-75.
- Zhang S, Ivanovic M, Nemcek AA, et al. Thin core needle biopsy crush preparations in conjunction with fine-needle aspiration for the evaluation of thyroid nodules: a complementary approach. Cancer 2008, 114:512–8.
- Oppenheimer JD, Kasuganti D, Nayar R, et al. How to Interpret Thyroid Biopsy Results: A Three-Year Retrospective. Cardiovasc Intervent Radiol 2010, 33: 800-5.
- Pfeiffer J, Kayser L, Ridder GJ. Minimal-invasive core needle biopsy of head and neck malignancies: clinical evaluation for radiation oncology. Radiother Oncol 2009, 90: 202-7.
- Pfeiffer J, Kayser G, Ridder GJ. Sonography-assisted cutting needle biopsy in the head and neck for the diagnosis of lymphoma: can it replace lymph node extirpation? Laryngoscope 2009, 119: 689-95.
Introduzione alla classificazione della citologia tiroidea
Enrico Papini1 (Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.), Andrea Frasoldati2, Anna Crescenzi3 & Francesco Nardi4
1Endocrinologia & 3Patologia, Ospedale Regina Apostolorum, Albano Laziale (RM); 2Endocrinologia, Arcispedale S. Maria Nuova IRCCS, Reggio Emilia; 4Università di Roma Sapienza, Roma
L’agoaspirato con ago sottile (FNA) è lo strumento diagnostico più efficace per la valutazione della natura della patologia nodulare tiroidea e consente di selezionare i pazienti da seguire preferibilmente in modo conservativo rispetto a quelli da avviare alla exeresi chirurgica. L’impiego di una terminologia condivisa per l’inquadramento del nodulo in categorie diagnostiche a rischio crescente di malignità consente, considerati anche tutti gli altri criteri clinici e strumentali, di orientare nel modo più appropriato la gestione del paziente (1).
La nuova classificazione italiana della citologia tiroidea è stata ufficialmente pubblicata nel maggio 2014 sul Journal of Endocrinological Investigation (1). Il documento, messo a punto da un gruppo di esperti su mandato delle Società Italiane di Endocrinologia (AIT, AME e SIE) e di Anatomia Patologica e Citologia (SIAPEC-IAP), aggiorna la precedente classificazione del 2007 in base ai dati della letteratura, rendendola confrontabile con le altre classificazioni più utilizzate, quella americana, nota come “Bethesda” (2,3), e quella inglese, del Royal College of Pathologists of United Kingdom (UKRCP) (4), e fornisce a endocrinologi e citopatologi uno strumento di immediata utilità per la pratica clinica.
La tabella 1 riporta il confronto tra la classificazione italiana del 2014 e la precedente del 2007: è mantenuto lo schema con cinque categorie, associate al relativo atteso rischio di malignità e al suggerimento di un’azione clinica, ma sono presenti importanti modificazioni nelle categorie TIR 1 e TIR 3.
CONFRONTO FRA VECCHIA E NUOVA CLASSIFICAZIONE
Nella TIR 1 (“non diagnostico”) sono introdotte tre modifiche:
- in presenza di atipie citologiche significative, il campione viene incluso in una categoria di sospetto, indipendentemente dal numero delle cellule che lo compongono, come nelle classificazioni americana e inglese (2-4);
- i campioni ottenuti da lesioni cistiche nei quali non si raggiungono i limiti minimi di adeguatezza cellulare sono classificati come TIR 1C (cistico). Sono escluse le cisti colloidee, che sono incluse nella categoria TIR2;
- in caso di agoaspirati (FNA) ripetutamente non diagnostici, può essere eseguita una biopsia eco-guidata (‘core needle biopsy’) con ago 20-22 G per esame micro-istologico. La procedura si è dimostrata efficace nel ridurre il numero di casi “inadeguati” (5).
La TIR 3 (“indeterminato/proliferazione follicolare”) prevedeva nella classificazione 2007 l'intervento chirurgico come suggerimento terapeutico. È stata ora suddivisa in due sottoclassi:
- TIR 3A, che prevede follow-up con ripetizione di FNA;
- TIR 3B, che ha come opzione prioritaria l'exeresi chirurgica.
Questa suddivisione (presente, con terminologia diversa, anche nelle classificazioni americana e inglese) ha lo scopo di ridurre il numero di pazienti inclusi nella categoria TIR 3 sottoposti a intervento chirurgico per patologia benigna.
Sono considerati “neoplasia follicolare” (TIR 3B) solo i campioni con elevata cellularità, scarsa o assente colloide e assoluta prevalenza di strutture microfollicolari/trabecolari.
Nei casi in cui, pur in presenza di elevata cellularità e scarsa colloide, non vi è un'assoluta prevalenza di strutture microfollicolari/trabecolari, la lesione è inclusa nella sottocategoria TIR 3A, con rischio atteso di malignità < 10% e suggerimento clinico conservativo.
Sono inclusi nella sottocategoria TIR 3B anche i campioni con alterazioni nucleari suggestive di carcinoma papillifero, troppo lievi o focali per includerli nella categoria TIR 4. Nelle classificazioni Bethesda (2,3) e UKRCP (4) queste lesioni sono incluse in categorie a rischio più basso che prevedono il follow-up con ripetizione della FNA. Casistiche recenti, tuttavia, riportano in queste lesioni un rischio di malignità > 25% (6), per cui questo gruppo è stato da noi incluso nella sottocategoria TIR 3B.
Non vi sono differenze sostanziali nelle altre categorie rispetto alla classificazione del 2007.
| Tabella 1 Confronto tra classificazione del 2007 e del 2014 |
|
| SIAPEC 2007 | SIAPEC-AIT-AME-SIE 2014 |
| Tir 1: non diagnostico |
TIR1: non diagnostico
|
| Tir 2: negatico per cellule maligne |
TIR 2: non maligno/benigno |
|
Tir 3: indeterminato (proliferazione follicolare |
TIR 3: indeterminato
|
|
Tir 4: sospetto di malignità |
TIR 4:sospetto di malignità |
| Tir 5: positivo per cellule maligne |
TIR 5: maligno |
CATEGORIE DI REFERTAZIONE CITOLOGICA 2014
Sono raccomandate cinque categorie diagnostiche principali. La tabella 2 sintetizza le categorie diagnostiche, il rischio di malignità atteso e le azioni cliniche suggerite.
TIR 1 (non diagnostica)
Comprende prelievi “inadeguati” (per contaminazione ematica o per artefatti) e “non rappresentativi” (assenza di almeno 6 gruppi di 10 tireociti ciascuno). In presenza di atipie citologiche significative, il campione viene incluso in una categoria di sospetto indipendentemente dal numero di cellule.
Se nei prelievi da lesioni cistiche sono presenti solo eritrociti, detriti e macrofagi con emosiderina, in assenza di colloide, la lesione è sottoclassificata come TIR 1C (cistica).

Azioni cliniche:
- TIR 1: non consente una diagnosi ed è quindi raccomandata la ripetizione di FNA eco-guidata, di regola dopo almeno un mese dalla precedente. In caso di FNA ripetutamente non diagnostiche, può essere eseguita una core-needle biopsy per esame micro-istologico;
- TIR 1C: in assenza di reperti clinici ed ecografici di sospetto, queste lesioni sono in genere benigne. In caso di sospetto clinico, ripetere la FNA per escludere un carcinoma papillifero cistico.
TIR 2 (non maligna/benigna)
Comprende la citologia da noduli colloidi o iperplastici, da tiroiditi autoimmuni o granulomatose e da altre, meno frequenti, condizioni non neoplastiche.

Azioni cliniche: follow-up clinico ed ecografico. Ripetere la FNA solo in caso di crescita o modificazioni ecografiche del nodulo e nei pazienti avviati a trattamenti ablativi non chirurgici.
TIR 3 (citologia indeterminata)
La maggioranza di questi casi è rappresentata da quadri microfollicolari, che corrispondono, sul piano istologico, a noduli adenomatosi iperplastici, adenomi o carcinomi follicolari o varianti follicolari del carcinoma papillifero. Sono distinte due sottoclassi a diverso rischio di malignità, caratterizzate in modo leggermente diverso rispetto al Bethesda System, per una prevista migliore definizione della probabilità di malignità (3):
- TIR 3A (lesione indeterminata a basso rischio di malignità): caratterizzata da accentuata cellularità, colloide scarsa e strutture microfollicolari numerose ma non sufficienti a far porre diagnosi di “neoplasia follicolare”. Sono inclusi in questa categoria anche strisci con alterazioni citologiche o architetturali, ma gravati da artefatti che ne limitano l’interpretazione;

- TIR 3B (lesione indeterminata a elevato rischio di malignità): elevata cellularità a disposizione monotona in strutture microfollicolari/trabecolari, con colloide scarsa/assente (quadro suggestivo di “neoplasia follicolare”). Questa categoria include anche campioni con alterazioni nucleari lievemente sospette per carcinoma papillifero.

Azioni cliniche:
- TIR 3A: stretto follow-up clinico ed ecografico. È raccomandata la ripetizione di FNA nel corso dei controlli successivi;
- TIR 3B: l’opzione prioritaria è l’exeresi chirurgica.
TIR 4 (sospetta per malignità)
Comprende campioni in cui la malignità è fortemente sospetta ma non certa. La maggioranza di questi casi corrisponde a un carcinoma papillifero, ma altre neoplasie sono occasionalmente incluse in questa categoria.

Azioni cliniche: exeresi chirurgica con eventuale esame intra-operatorio. Ripetizione di FNA nei soli casi pauci-cellulari o che richiedano una caratterizzazione pre-operatoria addizionale.
TIR 5 (maligna)
Comprende campioni con diagnosi citologica conclusiva di neoplasia maligna (papillifera, midollare, scarsamente differenziata, anaplastica, linfoma, tumore non epiteliale o metastatico). Ove possibile, deve essere formulata la diagnosi del tipo di tumore.


Azioni cliniche: resezione chirurgica con estensione basata su reperto citologico e quadro clinico. In caso di carcinoma anaplastico, linfoma o tumore metastatico, sono necessarie ulteriori procedure diagnostiche per definire la condotta terapeutica più appropriata.
| Tabella 2 Consenso Italiano 2014 |
|||
| Codice | Categoria diagnostica |
Rischio atteso di malignità (%) |
Azioni suggerite |
| TIR 1 |
Non diagnostico |
Non definito | Ripeti FNA eco-guidata dopo almeno 1 mese |
| TIR 1C | Non diagnostico-cistico |
Basso (variabile in base al quadro clinico) |
Valutare nel contesto clinico, eventualmente ripetere l'FNA |
| TIR 2 | Non maligno/benigno | < 3 |
Follow-up |
| TIR 3A |
Lesione indeterminata a basso rischio |
< 10 | Ripeti FNA/follow-up |
| TIR 3B |
Lesione indeterminata ad alto rischio |
15-30 | Exeresi chirurgica |
| TIR 4 | Sospetto per malignità | 60-80 |
Exeresi chirurgica con eventuale esame intraoperatorio |
| TIR 5 | Maligno | > 95 |
Exeresi chirurgica |
BIBLIOGRAFIA Essenziale
- Nardi F, Basolo F, Crescenzi A, et al. Italian Consensus for the classification and reporting of thyroid cytology. J Endocrinol Invest 2014, 37: 593-9.
- Baloch ZW, Livolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol 2008, 36: 425-37.
- Ali SZ, Cibas ES. The Bethesda system for reporting thyroid cytopathology: definitions, criteria and explanatory notes. Springer, New York 2010.
- Cross PA, Chandra A, Giles T, et al. Guidance on the reporting of thyroid cytology specimens. 2009.
- Samir AE, Vij A, Seale MK, et al. Ultrasound-guided percutaneous thyroid nodule core biopsy: clinical utility in patients with prior non diagnostic fine-needle aspirate. Thyroid 2012, 22: 461-7.
- Renshaw AA. Should ”atypical follicular cells” in thyroid fine-needle aspirates be subclassified? Cancer Cytopathol 2010, 118: 186-9.
Atlante di citopatologia tiroidea
Anna Crescenzi1 & Simonetta Piana2
1UO Anatomia Patologica, Ospedale Regina Apostolorum, Albano Laziale (RM)
2UO Anatomia Patologica, Arcispedale S. Maria Nuova, Reggio Emilia

Figura 1: Prelievo inadeguato TIR 1; striscio ematico con scarsi elementi non valutabili per artefatti da ritarda fissazione







Marcatori immunocitochimici tiroidei
Anna Crescenzi1 & Simonetta Piana2
1UOC Anatomia Patologica, Policlinico Universitario Campus Bio-Medico di Roma
2UO Anatomia Patologica, Arcispedale S. Maria Nuova, Azienda USL-IRCC di Reggio Emilia, Reggio Emilia
(aggiornato al 20 gennaio 2021)
Con il termine di marcatori immuno-citochimici si intende un gruppo di anticorpi utilizzabili su preparati citologici per evidenziare in modo specifico alcune proteine. Questi anticorpi riconoscono come epitopo specifiche proteine cellulari e, laddove tali proteine siano presenti, permettono di localizzarle e visualizzarle mediante un cromogeno che produce una reazione colorata. Il meccanismo di colorazione della immunocitochimica è analogo a quello utilizzato sulle sezioni di tessuto dei campioni istologici, che in questo caso prende il nome di immunoistochimica.
Gli anticorpi, essendo specifici per singole proteine, sono scelti in base a ciò che si vuole cercare. Possono essere marcatori:
- di caratterizzazione se cerchiamo proteine tipiche di una linea cellulare (es. calcitonina per riconoscere le cellule C della tiroide);
- predittivi di malignità se cerchiamo proteine generalmente non presenti in condizioni di benignità e che vengono espresse nella trasformazione neoplastica (es. galectina 3 nel carcinoma papillifero e follicolare) o in alternativa proteine normalmente presenti e che vengono perse nella trasformazione tumorale (es. CD56 nei carcinomi papillifero e follicolare);
- predittivi di progressione neoplastica se cerchiamo proteine espresse prevalentemente in neoplasie di alto grado (es p53 nel carcinoma anaplastico);
- di stato mutazionale se andiamo a identificare proteine che vengono espresse nelle cellule neoplastiche a seguito di una mutazione genica (es. BRAF V600E).
Un problema pratico nell’applicazione dei marcatori immuno-citochimici è rappresentato dalla disponibilità del materiale da esaminare: poiché lo striscio convenzionale è la metodica citologica più diffusa, il metodo utilizzato è la decolorazione dei preparati, che però fornisce reazioni immuno-citochimiche non sempre ottimali (1). Un buon risultato richiede talora che venga ripetuto il prelievo per agoaspirato e che il materiale sia incluso in cell block (le cellule vengono inglobate in un blocchetto di paraffina), per ottenerne sezioni da trattare per l’immuno-istochimica. È stato inoltre proposto di effettuare il prelievo dedicato alla tipizzazione immuno-istochimica mediante agobiopsie, oggi praticabili anche con ago sottile (thin core biopsy, con aghi 21-22 G), che hanno il vantaggio di fornire un piccolo frustolo di tessuto sul quale si può valutare contestualmente l’espressione dei marcatori e l’organizzazione del tessuto. L'utilità dell'impiego su larga scala della core biopsy tradizionale e con ago sottile è ancora oggetto di discussione (2-5) e trova impiego soprattutto nel sospetto di una metastasi alla tiroide (vedi oltre). In tempi più recenti sono state commercializzate matrici polimeriche che catturano le cellule al momento dell’agoaspirato e le trattengono durante il processo di fissazione in formalina e inclusione in paraffina. In questo modo è possibile ottenere un cito-incluso direttamente dal prelievo, senza passaggi intermedi di laboratorio che potrebbero causare perdita di materiale diagnostico (Cytofoam, Biooptica, Milano; Cytomatrix, UCS Diagnostic, Roma).
Marcatori di caratterizzazione
Vengono utilizzati principalmente per il riconoscimento del tipo istologico neoplastico da cui lo striscio proviene, sia esso primitivo tiroideo o metastatico.
Fra i marcatori di caratterizzazione più importanti, vi sono:
- TTF1, PAX8 e tireoglobulina per il riconoscimento delle cellule follicolari e la diagnosi dei carcinomi da queste derivati (carcinoma papillare - PTC - e carcinoma follicolare - FTC). I primi due, marcatori nucleari, hanno ormai soppiantato la tireoglobulina, storicamente importante ma meno precisa nella marcatura;
- calcitonina, CEA e cromogranina per il riconoscimento delle cellule C e quindi la diagnosi di carcinoma midollare (MTC);
- pancitocheratina per la dimostrazione di una neoplasia epiteliale, anche poco differenziata, ad esempio nell’eventualità di una carcinoma anaplastico;
- CD31, ERG per confermare la diagnosi di angio-sarcoma:
- marcatori linfoidi (CD20, CD3, bcl2, bcl6, ecc) per la dimostrazione di un linfoma;
- anticorpi specifici per la dimostrazione di una localizzazione metastatica da altro sito di origine (es. CD10 in caso di carcinoma renale a cellule chiare, HMB-45 in caso di melanoma, CDX2 in caso di adenocarcinoma di origine gastro-enterica, GATA3 e recettori per estrogeni e progesterone per origine mammaria, ecc).
L’applicazione di questi anticorpi è possibile direttamente su citologico, ma, soprattutto in caso di linfomi e metastasi, è preferibile verificarli su frammenti agobioptici ottenuti con ago sottile (si veda sopra).
La tecnica immunocitochimica impiegata deve essere con elevati standard qualitativi e i risultati devono essere interpretati nel contesto clinico e citologico adeguato.
Marcatori predittivi di malignità
Sono utilizzati in citologia nell’ambito delle proliferazioni follicolari (TIR 3) (6), con l’intento di riconoscere le lesioni da indirizzare alla chirurgia rispetto a quelle da sottoporre a follow-up. Il razionale si basa sul fatto che tali marcatori riconoscono alcune proteine normalmente non espresse dai tireociti, la cui espressione è un evento legato alla trasformazione neoplastica.
Le proteine più note correlate all’oncogenesi tiroidea sono la galectina 3 (Gal3), l’HBME1 e la citocheratina 19 (CK19) (7). Pur essendo vera questa premessa, la letteratura scientifica ha riportato l’espressione di questi marcatori in alcune condizioni non neoplastiche o non maligne, dimostrando pertanto che la specificità dei singoli marcatori non è elevata come si riteneva nei primi studi (8-13). Le linee guida della American Thyroid Association (ATA), tenuto conto della necessità di lavorare con pannelli di anticorpi la cui combinazione risulta più accurata rispetto al singolo marcatore, indicano che l’immunocitochimica venga eseguita su cito-incluso, in modo da avere a disposizione multiple sezioni seriate dello stesso campione (14).
Le raccomandazioni delle attuali linee guida sono che i marcatori predittivi di malignità vengano utilizzati in casi selezionati e utilizzando protocolli di lavoro rigorosi per evitare artefatti tecnici (15).
Marcatori predittivi di progressione neoplastica
Si tratta di proteine normalmente non espresse né in patologie benigne né in neoplasie differenziate, ma la cui comparsa nelle cellule si verifica in fase di progressione verso neoplasie scarsamente differenziate o indifferenziate. Non si tratta di espressioni esclusive, ma di aumento della quota di cellule positive, il che comporta una certa discrezionalità di giudizio. Ne consegue che i reperti citologici sono prioritari ai fine della diagnosi, rispetto ai risultati immuno-istochimici, da considerarsi quindi più che altro una conferma. Infatti, i due principali marcatori sono la proteina p53 e la ciclina D1, la cui espressione è nettamente aumentata nelle neoplasie di alto grado (15-17). L’utilizzo in citologia è ristretto a casi positivi (TIR 5) in cui si vuole in sede pre-operatoria avere la prova di una malattia aggressiva già ipotizzata morfologicamente, per pianificare un approccio chirurgico/terapeutico adeguato (16-18). Dal punto di vista pratico valgono le stesse limitazioni degli altri marcatori immuno-citochimici, ossia la disponibilità del materiale, la scelta di casi selezionati e l’uso di rigidi protocolli di lavoro.
Marcatori di stato mutazionale
Di più recente introduzione è la disponibilità commerciale di anticorpi per visualizzare, ove presenti, proteine che risultano espresse nelle cellule in seguito a mutazioni geniche. Per la patologia tiroidea sono di interesse: l’anticorpo VE1, la cui positività è espressione della mutazione V600E del gene BRAF (sensibilità 100%, specificità 94%) (19) e l’anticorpo anti-NRAS Q61R (clone SP174), la cui positività è rappresentativa della mutazione Q61R del gene NRAS (sensibilità 100%, specificità 92%) (20).
Neoplasie tiroidee con reattività immuno-istochimica inusuale
Nell’ambito dei tumori tiroidei ad origine dall’epitelio follicolare o dalle cellule para-follicolari, sono stati identificati alcuni carcinomi che mostrano una reattività immuno-istochimica inusuale, diversa dal profilo caratteristico del carcinoma differenziato della tiroide e che può indurre confusione e possibili errori di interpretazione, specialmente nella diagnosi differenziale tra carcinoma primitivo della tiroide e tumore maligno di altri organi, metastatico nel parenchima tiroideo (21,22).
Carcinoma papillifero negativo per tireoglobulina. È noto che in alcuni PTC la tireoglobulina possa essere espressa solo focalmente: ad esempio nella variante solida e nella variante sclerosante diffusa. Questa situazione deve essere tenuta presente quando si usa questa immuno-istochimica su preparati citologici che possono non contenere la parte di tumore positiva. Esistono tuttavia alcuni PTC in cui l’espressione della tireoglobulina è completamente assente a causa di mutazioni somatiche del gene della tireoglobulina o di geni che codificano proteine coinvolte nella sua produzione. Questi tumori mantengono la positività immuno-istochimica per TTF1, vimentina e PAX8 e sono negativi per calcitonina. L’immuno-fenotipo ne permette quindi la corretta assegnazione diagnostica e il reperto di negatività per tireoglobulina deve essere descritto nella refertazione. L’informazione, infatti, è di grande rilevanza clinica, in quanto la misurazione sierica della tireoglobulina, assente in questi tumori e nelle eventuali recidive, è largamente utilizzata nel follow-up dei pazienti con PTC. Inoltre, risulterà negativa anche la misurazione della tireoglobulina nel liquido di lavaggio da agoaspirato. Trattandosi di una mutazione somatica della neoplasia, il restante parenchima tiroideo mantiene la normale reattività immuno-istochimica e fa da controllo per la colorazione sui preparati istologici, a dimostrazione che la negatività immuno-istochimica per la tireoglobulina non è dovuta a ritardo di fissazione del tessuto o ad altri fattori pre-analitici (21).
Carcinomi papilliferi con espressione aberrante di CDX2. Alcune rare varianti di PTC, come il morulare cribriforme e la variante a cellule colonnari, possono mostrare espressione nucleare di CDX2, una proteina specifica dell’epitelio intestinale. In alcuni di questi rari tumori l’espressione di CDX2 si associa a quella del CA19.9, aumentando la possibilità che vengano confusi con metastasi da carcinomi ad origine intestinale. Questi tumori, tuttavia, mantengono la positività per TTF1 e PAX8, che ne permette la diagnosi corretta. È pertanto importante che il pannello immuno-istochimico sia ampio e completo (23).
Carcinoma morulare cribriforme con espressione dei recettori per estrogeni. La variante morulare cribriforme del PTC si caratterizza spesso per l’espressione nucleare immuno-istochimica del recettore per gli estrogeni, talvolta associata ad espressione del recettore per progesterone. Questo fenomeno, associato alla morfologia cribriforme, si presta facilmente a confusione con una metastasi alla tiroide da carcinoma della mammella. Le cellule neoplastiche, specialmente nella parte cribriforme del tumore, mantengono tuttavia l’espressione di TTF1 e sono costantemente negative per calcitonina, supportando la corretta diagnosi differenziale. Anche qui vale il concetto di utilizzare pannelli immuno-istochimici completi ove sia necessaria la diagnosi differenziale tra carcinoma primitivo e metastatico (24).
Carcinoma a cellule di Hürthle negativo per TTF1 e tireoglobulina. In questi tumori, che possono presentarsi sia ad architettura follicolare che papillare senza le caratteristiche nucleari del PTC, le reazioni immuno-istochimiche per TTF1 e tireoglobulina risultano negative, mentre le cellule si colorano intensamente per marcatori mitocondriali come la sub-unità A della succinico-deidrogenasi. La calcitonina è costantemente negativa. L’attribuzione ad una primitività tiroidea è una diagnosi clinica di esclusione e si basa su una estesa diagnostica per immagini negativa per altre sedi. Di solito si tratta di carcinomi estesamente invasivi, ma il fenomeno è stato riscontrato raramente anche in adenomi a cellule di Hürthle. La negatività per tireoglobulina inoltre condiziona il follow-up, come per i PTC prima descritti (25).
Carcinomi midollari negativi per calcitonina. Sono riportati rari tumori neuroendocrini della tiroide, derivanti dalle cellule C ma negativi all’espressione immuno-istochimica della calcitonina. Questi tumori mostrano positività immuno-istochimica per TTF1 e PAX8, per cromogranina e sinaptofisina e per il peptide correlato al gene della calcitonina (CGRP), ma sono negativi per calcitonina, CEA e tireoglobulina. La positività per CGRP + TTF1 + PAX8 è altamente suggestiva di origine dalle cellule C anche in assenza di calcitonina. In questi tumori non è presente mRNA della calcitonina, pertanto la misurazione sierica della calcitonina non ha valore nel follow-up di questi pazienti, come non è indicativa la misurazione della calcitonina nel liquido di lavaggio dell’agoaspirato (26).
Tumore trabecolare jalinizzante. In questa rara lesione di origine follicolare, che quindi esprime i marcatori di linea follicolare TTF1 e PAX8, si osserva un’insolita positività del Ki-67, una proteina associata alla proliferazione cellulare. Il Ki-67 è normalmente espresso nel nucleo, mentre nel tumore trabecolare ialinizzante è presente sulla membrana cellulare, se il campione viene trattato a una specifica temperatura (27).
Bibliografia
- Filie AC, Asa SL, Geisinger KR, et al. Utilization of ancillary studies in thyroid fine needle aspirates: a synopsis of the National Cancer Institute thyroid fine needle aspiration state of the science conference. Diagn Cytopathol 2008, 36: 438-41.
- Harvey JN, Parker D, De P, et al. Sonographically guided core biopsy in the assessment of thyroid nodules. J Clin Ultrasound 2005, 33: 57-62.
- Oppenheimer JD, Kasuganti D, Nayar R, et al. How to interpret thyroid biopsy results: a three-year retrospective interventional radiology experience. Cardiovasc Intervent Radiol 2010, 33: 800-5.
- Park KT, Ahn SH, Mo JH, et al. Role of core needle biopsy and ultrasonographic finding in management of indeterminate thyroid nodules. Head Neck 2011, 33: 160-5.
- Zhang S, Ivanovic M, Nemcek AA Jr, et al. Thin core needle biopsy crush preparations in conjunction with fine-needle aspiration for the evaluation of thyroid nodules: a complementary approach. Cancer Cytopathol 2008, 114: 512-8.
- Baloch ZW, LiVolsi VA. The quest for a magic tumour marker: continuing saga in the diagnosis of the follicular lesions of thyroid. Am J Clin Pathol 2002, 118: 165-6.
- Saleh HA, Feng J, Tabassum F, et al. Differential expression of galectin-3, CK19, HBME1, and RET oncoprotein in the diagnosis of thyroid neoplasms by fine needle aspiration biopsy. Cytojournal 2009, 6: 18.
- Saggiorato E, De Pompa R, Volante M, et al. Characterization of thyroid “follicular neoplasm” in fine-needle aspiration cytologic specimens using a panel of immunohistochemical markers: a proposal for clinical application. Endocr Relat Cancer 2005, 12: 305-17.
- Schmitt AC, Cohen C, Siddiqui MT. Paired box gene 8, HBME-1, and cytokeratin 19 expression in preoperative fine-needle aspiration of papillary thyroid carcinoma: diagnostic utility. Cancer Cytopathol 2010, 118: 196-202.
- Bartolazzi A, Orlandi F, Saggiorato E, et al. Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study. Lancet Oncol 2008, 9: 543-9.
- Chiu CG, Strugnell SS, Griffith OL, et al. Diagnostic utility of galectin-3 in thyroid cancer. Am J Pathol 2010, 176: 2067-81.
- Bartolazzi A, Bellotti C, Sciacchitano S. Methodology and technical requirements of the galectin-3 test for the preoperative characterization of thyroid nodules. Appl Immunohistochem Mol Morphol 2012, 20: 2-7.
- Fadda G, Rossi ED, Raffaelli M, et al. Follicular thyroid neoplasms can be classified as low- and high-risk according to HBME-1 and Galectin-3 expression on liquid-based fine-needle cytology. Eur J Endocrinol 2011, 165: 447-53.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016, 26: 1-133.
- Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009, 19: 1167-214.
- Pickett CA, Agoff SN, Widman TJ, Bronner MP. Altered expression of cyclins and cell cycle inhibitors in papillary thyroid cancer: prognostic implications. Thyroid 2005, 15: 461-7.
- Morita N, Ikeda Y, Takami H. Clinical significance of p53 protein expression in papillary thyroid carcinoma. World J Surg 2008, 32: 2617-22.
- Balta AZ, Filiz AI, Kurt Y, et al. Prognostic value of oncoprotein expressions in thyroid papillary carcinoma. Med Oncol 2012, 29: 734-41.
- Na JI, Kim JH, Kim HJ, et al. VE1 immunohistochemical detection of the BRAF V600E mutation in thyroid carcinoma: a review of its usefulness and limitations. Virchows Arch 2015, 467: 155-68.
- Crescenzi A, Fulciniti F, Bongiovanni M, et al. Detecting N-RAS Q61R mutated thyroid neoplasias by immunohistochemistry. Endocr Pathol 2017, 28: 71-4.
- Cameselle-Teijeiro JM, Eloy C, Sobrinho-Simões M. Rare tumors of the thyroid gland. Diagnosis and WHO classification. Springer 2018.
- Lloyd RV, Osamura RY, Klöppel G, Rosai J (Eds). World Health Organization classification of tumours of endocrine organs, 4th International Agency for Research on Cancer, France, Lyon, 2017: ISBN 978-92-832-4493-6.
- Cameselle-Teijeiro J, Alberte-Lista L, Peteiro-González D, et al. CDX2 expression in some variants of papillary thyroid carcinoma. Am J Clin Pathol 2012, 138: 907-9.
- Cameselle-Teijeiro JM, Peteiro-González D, Caneiro-Gómez J, et al. Cribriform-morular variant of thyroid carcinoma: a neoplasm with distinctive phenotype associated with the activation of the WNT/β-catenin pathway. Mod Pathol 2018, 31: 1168–79.
- Bejarano PA, Nikiforov YE, Swenson ES, Biddinger PW. Thyroid transcription factor-1, thyroglobulin, cytokeratin 7, and cytokeratin 20 in thyroid neoplasms. Appl Immunohistochem Mol Morphol 2000, 8: 189-94.
- Nakazawa T, Cameselle-Teijeiro J, Vinagre J, et al. C-cell-derived calcitonin-free neuroendocrine carcinoma of the thyroid: the diagnostic importance of CGRP. Immunoreactivity. Int J Surg Pathol 2014, 22: 530-5.
- Leonardo E, Volante M, Barbareschi M, et al. Cell membrane reactivity of MIB-1 antibody to Ki67 in human tumors: fact or artifact? Appl Immunohistochem Mol Morphol 2007, 15: 220–3.
Aggiornamenti diagnostica generale tiroide
In attesa degli aggiornamenti di Endowiki, si possono trovare articoli aggiornati ai seguenti link:










