Sensori glicemici e nuove metriche del compenso glicemico
Giuseppe Papa, Maria PieraAngela Iurato, Carmelo Licciardello, Diletta Moretti, Concetta Finocchiaro
Centro Catanese di Medicina e Chirurgia, Unità Funzionale di Malattie Endocrine e Dismetaboliche, Catania
(aggiornato al dicembre 2022)
L’auto-monitoraggio glicemico domiciliare (Self Monitoring Blood Glucose, SMBG) è da sempre un punto chiave della gestione del diabete, soprattutto quando le fluttuazioni glicemiche inter- e intra- giornaliere sono significative e quando il rischio ipoglicemico non è trascurabile, cosa che si verifica molto frequentemente non solo nel soggetto con diabete tipo 1 (DM1) ma anche nel diabetico tipo 2 (DM2) insulino-trattato.
Dal 1967, epoca della realizzazione del primo strumento per la determinazione della glicemia su goccia di sangue capillare, si è assistito al progressivo miglioramento e alla diffusione ubiquitaria dei glucometri, che consentono di avere in pochi secondi il valore glicemico e quindi identificare prontamente ipoglicemie, iperglicemie e “tendenze” glicemiche (1). Dalla glicemia capillare, riportata spesso a casaccio già da molti anni sui vecchi diari cartacei, siamo passati al cosiddetto monitoraggio “strutturato”, che prevede l’esecuzione del test con la giusta frequenza e al momento giusto, al fine di generare informazioni di supporto alle corrette decisioni terapeutiche, sia da parte del paziente (o dell’eventuale care-giver) che del medico. Già da tempo, grazie al trasferimento dei dati da glucometro a PC o ancora meglio in tempo reale a smartphone (tramite App dedicate) e quindi conservazione su piattaforme “web-cloud”, abbiamo assistito alla digitalizzazione delle informazioni e alla loro organizzazione (tramite software dedicati) in grafici e tabelle complete e di facile consultazione, che hanno aiutato il diabetologo a prendere decisioni terapeutiche realmente in grado di migliorare il compenso, sulla base dell’analisi di tali dati.
Negli ultimi anni, tuttavia, ciò che ha davvero rivoluzionato il monitoraggio glicemico sono stati l’affermazione e la diffusione sempre più capillare dei sistemi di monitoraggio della glicemia sia continuo (CGM, Continuous Glucose Monitoring) che a richiesta (FGM, Flash Glucose Monitoring). Dal 1999, anno di approvazione per utilizzo clinico del primo CGM (Medtronic MiniMed®, Northridge, CA, USA) sono passati più di 20 anni; gli ultimi 7-8 anni sono stati determinanti per lo sviluppo e la diffusione in tutto il mondo di questi sistemi, che oggi rappresentano il gold standard del monitoraggio glicemico nel DM1 ma anche nel DM2 insulino-trattato e non solo.
I sensori glicemici misurano la concentrazione del glucosio nel liquido interstiziale sottocutaneo. Schematicamente si possono dividere in sensori real-time o intermittenti. I sensori real-time (RT) offrono una misurazione continua della glicemia interstiziale e possono essere trans-cutanei, cioè dotati di ago-sensore mono-uso, che attraverso un meccanismo elettro-chimico fornisce il dato della glicemia interstiziale (che correla molto bene con quella plasmatica, anche se patisce di un piccolo ritardo, detto lag-time, più evidente nei periodi di più pronunziata fluttuazione glicemica), o impiantabili, inseriti nel sottocute tramite una piccola incisione con letture fluorimetriche delle glicemie (in questo momento ce n’è un solo modello sul mercato). I sensori intermittenti o flash forniscono la glicemia solo on-demand, cioè il paziente deve eseguire una scansione del sensore con il proprio lettore o smartphone.
Il sistema è composto da tre componenti fondamentali:
- il sensore: è un capillare posizionato nel sottocute a livello dell’addome del paziente, che campiona il glucosio dal liquido interstiziale a intervalli di pochi secondi;
- il trasmettitore: è collegato al sensore, permette di inviare i dati campionati al ricevitore in modalità wireless;
- il ricevitore:è un monitor di piccole dimensioni, che la persona con diabete può facilmente applicare alla cintura o tenere in tasca e consente di visualizzare le informazioni e configurare lo strumento.
Tutti i sensori oggi utilizzati vantano un’accuratezza molto elevata, che si quantifica in termini di MARD (Mean Absolute Relative Difference), che indica lo scostamento medio percentuale tra i valori misurati con lo strumento (CGM, glucometro) e quelli rilevati con il metodo di riferimento (di solito la glicemia di laboratorio). Le MARD aumentano nel range ipoglicemico (cioè il dato può essere meno sicuro in quell’ambito). I migliori sensori oggi sul mercato vantano MARD comprese tra 7 e 11%. Questo ha consentito di ottenere che non sia necessario confermare il dato con una glicemia capillare prima di prendere eventuali decisioni terapeutiche (a meno che il dato del sensore non sia in linea con la clinica del paziente) (2).
Cosa offre in più un sensore glicemico rispetto al monitoraggio capillare?
Il vantaggio è bidirezionale, da una parte per il paziente (e il care-giver) dall’altra per l’operatore sanitario. Dal punto di vista dell’utilizzatore-paziente, innanzitutto non è necessario pungersi il dito per avere il riscontro glicemico: il dato è immediato e prontamente consultabile (sia con CGM che con FGM), tutte le volte che si vuole, in qualsiasi momento del giorno. Il dato della glicemia poi non rimane un elemento isolato, ma si arricchisce di nuovi elementi (fig 1). È come se si ampliasse l’orizzonte temporale, avendo a disposizione il dato attuale (il presente) ma anche il futuro: infatti, il valore glicemico è accompagnato da una freccia di tendenza, che esprime la direzione in cui si sta muovendo la glicemia al momento e la velocità con cui questo sta avvenendo (nelle varie tipologie di sensori cambia l’iconografia con cui questa viene rappresentata).
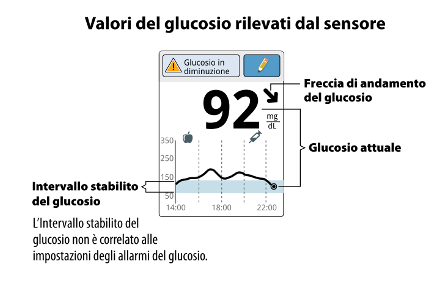
Figura 1
In basso invece si può visualizzare l’andamento glicemico delle ultime ore (il passato), che permette al paziente di capire come è andato il profilo nelle ore immediatamente precedenti e se la glicemia del momento può essere stata determinata da qualcosa che è successo prima. Una corretta gestione delle frecce di tendenza può permettere al paziente, per esempio, di adattare il bolo prandiale all’andamento glicemico del momento, di prevenire un’imminente ipoglicemia attraverso l’introduzione di carboidrati o ancora di pianificare correttamente un’eventuale attività fisica in sicurezza (3,4).
I sensori sono poi forniti di allarmi al raggiungimento di soglie critiche (personalizzabili), sia di ipo che di iperglicemie (fig 2A). Il paziente è sempre avvisato se c’è qualcosa che non va. Le soglie possono essere modificate dal paziente, dal care-giver o dal medico, ma alcune non possono essere né modificate né silenziate (come l’allarme “urgente” di ipoglicemia di 2° livello, di solito impostato al di sotto di 55 mg/dL).
Alcuni strumenti sono provvisti di avvisi predittivi: in questo caso viene visualizzato il messaggio che (seppure la glicemia al momento sia normalissima, per es. 118 mg/dL) al perdurare dell’attuale velocità di decremento della glicemia, il paziente si troverà con un valore al di sotto di 55 mg/dL entro circa 20 minuti (fig 2B). Pensiamo all’utilità di questo avviso se il paziente sta in quel momento svolgendo un’attività potenzialmente pericolosa, come la guida di veicoli, un’attività fisica a rischio come lo sci o il nuoto, oppure attività lavorative che presuppongono un rischio di caduta.
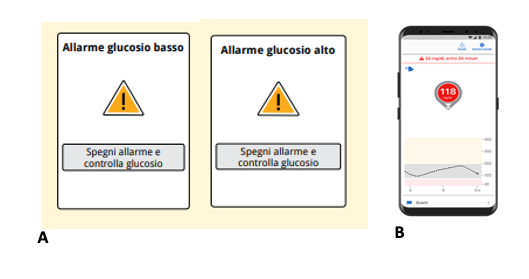
Figura 2
Tramite App dedicate, quasi tutti i sistemi danno la possibilità della condivisione dei dati con i propri caregiver. Questo è un aspetto non secondario, se pensiamo a un bambino o un ragazzino con DM1 a scuola o impegnato in altre attività extra-domestiche (con i genitori terrorizzati dalla possibilità che possa incorrere in ipoglicemie gravi o altre emergenze legate alla glicemia in contesti non familiari) o anche a una persona anziana che vive sola; in questo modo i care-giver possono condividere i dati ed essere aggiornati in tempo reale sulle glicemie del paziente, istante per istante, ricevendo anche le notifiche degli allarmi.
L’altro aspetto rilevante dei sensori è relativo all’analisi retrospettiva dei dati. Questo aspetto riguarda non più il paziente o non solo il paziente ma soprattutto il medico che lo segue. Questa tecnologia permette di analizzare tantissimi parametri per gran parte derivati dall’AGP (Ambulatory Glucose Profile), software che riassume statisticamente dati standardizzati raccolti in un determinato segmento temporale e visualizzati graficamente in pattern glicemici giornalieri di immediata comprensione (5). Nell’AGP la curva mediana (50° percentile) mostra il valore mediano della glicemia per ciascun punto orario; le curve al di sopra e al di sotto stabiliscono il range interquartile (tra 25° e 75° percentile); le curve più esterne rappresentano le escursioni massime della glicemia (tra 95° e 5° percentile); i valori estremi (10% del totale) sono esclusi dall’analisi perché considerati outlier (fig 3).

Figura 3. Profilo glicemico ambulatoriale (AGP)
I dati desunti dall’AGP vengono graficati in una colonna, che permette di visualizzare come si distribuiscono le glicemie nei vari range glicemici. Le nuove metriche nella valutazione del compenso glicemico sono quindi:
- Time in Range (TIR, glicemia 70-180 mg/dL), che deve essere quanto più elevato possibile;
- Time Below Range (TBR), a sua volta distinto in due fasce, quella che comprende le ipoglicemie di livello 1 (55-70 mg/dL) e quella che considera le ipoglicemie di livello 2 (< 55 mg/dL);
- Time Above Range (TAR, anche questo comprendente due fasce, quella delle glicemie > 180 mg/dL e quella delle glicemie > 250 mg/dL).
L’utilità della nuova metrica risiede nel fatto che, diversamente dall’HbA1c, che riflette i cambiamenti del compenso glicemico negli ultimi 2-3 mesi, l’analisi di TIR, TBR e TAR permette di avere subito informazioni sulle escursioni glicemiche in un periodo più breve (2-4 settimane) e di identificare l’ampiezza e la frequenza delle variazioni glicemiche intra- e inter-giornaliere. Il report indica il GMI (Glucose Management Indicator), nuovo termine coniato per esprimere il concetto di HbA1c “stimata”: ha il vantaggio di rappresentare il compenso su intervalli temporali decisamente inferiori a quelli espressione dell’HbA1c di laboratorio e l’ulteriore beneficio di eliminare l’interpretazione errata delle variazioni di HbA1c causate da una serie di fattori indipendenti dal compenso glicemico (malattie renali, carenza di ferro, anemia falciforme, alcuni farmaci e differenze tra gruppi etnici). Il GMI può essere utile per valutare in un arco temporale breve (15-30 giorni) l’impatto di un cambiamento nello stile di vita, di una nuova dieta, di un nuovo regime di esercizio o di un aggiustamento farmacologico (6).
Un ulteriore parametro che arricchisce questa tecnologia è il Coefficiente di Variazione (CV), che deriva dal rapporto tra deviazione standard delle glicemie (DS) e glicemia media e si correla fortemente non solo con il rischio ipoglicemico, ma anche con la mortalità per tutte le cause (è infatti un noto parametro di rischio cardio-vascolare) (7).
Lo studio dell’AGP permette poi di identificare pattern di ipo e iperglicemia e così individuare prontamente la possibile strategia terapeutica da attuare (fig 4).

Figura 4
Nel 2019 il congresso ATTD (Advanced Technologies & Treatments for Diabetes) ha per la prima volta formulato delle raccomandazioni per esplicitare gli obiettivi terapeutici tra diverse tipologie di popolazioni con diabete, per quanto attiene le nuove metriche in questione (8).
- Per i pazienti con DM1 e DM2, si dovrebbe perseguire un TIR > 70%, con TBR < 4% per le ipoglicemie di livello 1 e < 1% per le ipoglicemie di livello 2.
- Per i pazienti più anziani o con comorbilità, l’obiettivo di TIR si abbassa a > 50% (meno stringente), ma soprattutto in questa categoria (dove le ipoglicemie possono essere causa di aumento di morbilità e mortalità, attraverso cadute con conseguenti traumi, alterazioni neurologiche e insorgenza di gravi complicanze cardio-vascolari acute) diventa obbligatorio ridurre il TBR al di sotto dell’1%.
- Nelle donne con DM1 in gravidanza il range del TIR si abbassa all’intervallo compreso tra 63 e 140 mg/dL, con obiettivo al di sopra del 70%. Anche se in questo contesto gli studi clinici che abbiano validato questi parametri sono esigui, due studi hanno dimostrato che un aumento dei TIR del 5-7% durante il II e il III trimestre di gravidanza si associa alla riduzione del rischio di LGA (Large for Gestational Age) e di esiti neonatali sfavorevoli, quali macrosomia, distocia di spalla e ipoglicemia neonatale (9-10). L’obiettivo di TBR in questo sottogruppo rimane uguale a quello visto per la popolazione generale diabetica.
- Nelle donne con DM2 in gravidanza o diabete gestazionale, seppure il TIR è sempre 63-140 mg/dL, non viene specificato un obiettivo, poiché mancano evidenze scientifiche che abbiano validato un singolo cut-off (fig 5).

Figura 5 (estrapolata da 8)
Quali sono le evidenze scientifiche su questa tecnologia?
Oggi abbiamo un-evidenza robusta derivata da tanti RCT di riduzione dell’HbA1c (quindi miglioramento del compenso glicemico) e del rischio ipoglicemico attraverso un utilizzo continuativo dei sistemi di monitoraggio continuo (11-17). Nel corso degli anni gli studi hanno via via riguardato molte tipologie di soggetti, pazienti giovani/adulti con DM1 in terapia multi-iniettiva o con micro-infusore, poi soggetti anziani con DM1 e DM2 (18-19).
Gli RCT con i sistemi rt-CGM in individui con DM2 in terapia multi-iniettiva, con o senza ipoglicemizzanti orali e con sola insulina basale, hanno dimostrato miglioramenti relativi al compenso glicemico (HbA1c) ma sono meno significativi i dati a favore della riduzione del rischio ipoglicemico (20-22).
Gli RCT sui dispositivi FGM sono più limitati: il dato che emerge è che sicuramente riducono il tempo trascorso in ipoglicemia, sia nel DM1 (23-24) che nel DM2 (25-26); in alcuni si registra un miglioramento anche del compenso glicemico (26). Uno studio recente su una popolazione adulta con DM1 scompensato ha documentato la riduzione di HbA1c vs SMBG con allarmi attivati (27). Per la tecnologia FGM, utilizzata ormai da anni in maniera crescente, sono oggi disponibili alcuni studi osservazionali e real-world, su grandi casistiche (anche tramite l’analisi di registri sanitari), che hanno documentato il miglioramento del compenso glicemico e la riduzione di complicanze acute, quali la chetoacidosi diabetica, gli episodi di ipoglicemia grave e le ospedalizzazioni (28-30). Solo uno studio ben disegnato in donne gravide con DM1 in terapia insulinica multi-iniettiva o con micro-infusore ha dimostrato che rispetto a SMBG l’utilizzo del CGM è associato alla riduzione di HbA1c, delle macrosomie fetali, della durata del ricovero e dell’ipoglicemia neonatale (9).
Cosa indicano le ultime linee guida italiane e internazionali relativamente all’uso di questi dispositivi?
Nel marzo 2022 è stata pubblicata congiuntamente da AMD, SID e SIEDP la Linea Guida (LG) per l’Istituto Superiore di Sanità (ISS) (31). Alla domanda “In soggetti con DM1 è preferibile l’utilizzo di rtCGM o di SMBG?” il panel di esperti, con metodo “GRADE”, ha evidenziato che tali strumenti permettono in maniera inconfutabile di ridurre l’HbA1c, il rischio ipoglicemico e la variabilità glicemica; vengono invece rilevati dati eterogenei per quanto concerne gli indicatori di qualità della vita e soddisfazione del trattamento. Sulla base della revisione della letteratura, i sistemi sono giudicati costo-efficaci per l’utilizzo nel DM1. La raccomandazione che ne deriva è: “In soggetti con DM1 scompensato e/o ipoglicemie gravi si raccomanda di utilizzare sistemi di monitoraggio continuo real-time rispetto all’auto-monitoraggio capillare".
Per il secondo quesito “In soggetti con DM1 è preferibile l’utilizzo di monitoraggio intermittente del glucosio (FGM) o di SMBG?” il panel di esperti evidenzia che la tecnologia Flash si accompagna a riduzione del tempo trascorso in ipoglicemia, miglioramento della variabilità glicemica, maggiore soddisfazione del trattamento e aumento del TIR; vengono invece rilevati dati eterogenei e non significativi per quanto concerne la riduzione dell’HbA1c. Anche in questo caso il sistema è giudicato costo-efficace per l’utilizzo nel DM1. La raccomandazione che ne deriva è “In soggetti con DM1 in buon controllo si suggerisce l’uso di sistemi FGM rispetto all’auto-controllo capillare della glicemia”.
Nella LG per l’ISS pubblicata da SID-AMD nel luglio 2021 (32) relativamente alla gestione del DM2 “non si suggerisce il monitoraggio glicemico in continuo o a scansione, al posto del controllo glicemico capillare, per la misurazione della glicemia nei pazienti con DM2 in trattamento insulinico basal-bolus (forza della raccomandazione debole, qualità delle prove molto bassa). Il grado di evidenza degli studi clinici è considerato molto basso per tutti gli esiti clinici considerati (documentata solo marginale riduzione di HbA1c, -0.3% senza peggioramento del rischio ipoglicemico).
Le indicazioni che fornisce l’American Diabetes Association (ADA) negli ultimi standard di cura 2023 (33) sono invece più estensive, poiché viene raccomandato che i sistemi CGM o gli FGM dovrebbero essere offerti a tutti i pazienti (indipendentemente dal tipo di diabete e dall’età) che utilizzino terapia insulinica multi-iniettiva o micro-infusori e che siano in grado di farne uso in sicurezza (da soli o con l’aiuto dei care-giver). Per di più si aggiunge la possibile indicazione per i pazienti con DM2 in terapia insulinica basale. Se ne consiglia l’utilizzo continuativo laddove dovessero essere impiegati. Ne viene indicato l’uso anche nel diabete in gravidanza per raggiungere migliori esiti metabolici.
Nel 2021 anche l’American Association of Clinical Endocrinology (AACE) ha indicato l’utilizzo dei sistemi CGM e FGM nelle seguenti tipologie di soggetti (34):
- con diabete in terapia insulinica intensiva (con ≥ 3 somministrazioni/die) o in terapia con micro-infusore (grado di evidenza A);
- con ipoglicemia “problematica” (ipoglicemie frequenti/gravi, notturne, asintomatiche) (grado di evidenza A);
- bambini e/o adolescenti con DM1 (grado di evidenza A);
- DM1 o DM2 in gravidanza in terapia insulinica intensiva (grado di evidenza A);
- donne con diabete gestazionale in trattamento insulinico (grado di evidenza A);
- donne con diabete gestazionale non in terapia insulinica (grado di evidenza B);
- con DM2 in terapia insulinica non intensiva (insulina basale) (grado di evidenza B).
Il documento fornisce ulteriore indicazione su cosa preferire tra CGM e FGM, sostenendo che il CGM dovrebbe essere utilizzato in soggetti con ipoglicemia problematica (frequente/grave, notturna, asintomatica) che richiede allarmi e avvisi predittivi (grado di evidenza B), mentre l’FGM dovrebbe essere considerato per pazienti con DM2 in neodiagnosi, in trattamento con terapie non a rischio ipoglicemico, motivati ad eseguire la scansione del sensore molte volte al giorno, a basso rischio per ipoglicemia (grado di evidenza D).
Panoramica dei sistemi attualmente più utilizzati
I sensori presenti sul mercato si differenziano per essere real-time o flash, trans-cutanei o impiantabili, ma anche per altre caratteristiche: durata di utilizzo, facilità d’inserzione, dimensioni, necessità di calibrazione e numero di calibrazioni richieste, possibilità di allarmi predittivi e soglia, connettività, condivisione dei dati in tempo reale, MARD, costi, ecc.
Seguono le caratteristiche di 7 dei sistemi più evoluti e maggiormente utilizzati attualmente (o che saranno a breve utilizzati) in Italia (e nel mondo) (35-42). Anche se non sono strumenti “equivalenti”, abbiamo provato a confrontarli, allo scopo di fornire elementi utili al diabetologo moderno per operare una scelta razionale e motivata.
| Tabella comparativa delle caratteristiche dei diversi modelli di sensori glicemici attualmente in commercio in Italia (tutti senza necessità di conferma dei valori con misurazione di glicemia capillare) |
||||||||
| Caratteristiche | Guardian Sensor 4® (35) | Dexcom G6® (36) | Dexcom G7® (37) | Dexcom ONE® (38) | FreeStyle Libre2® (39) | FreeStyle Libre3® (40) | Eversense XL® (41) | GlucomenDay® (42) |
| Azienda produttrice | Medtronic | Dexcom | Dexcom | Dexcom | Abbott | Abbott | Senseonics | Menarini |
| rtCGM | Sì | Sì | Sì | Sì | No | Sì | Sì | Sì |
| Dimensioni | 3.8x6.7x5.2 cm | 24.4 cm2 (area cutanea) | 9.7 cm2 (area cutanea) | 24.4 cm2 (area cutanea) | 30 x 5 mm | 21 x 3 mm | 35x18 mm (S) 48x9 mm (T) | 40 x 10 mm |
| Meccanismo lettura del sensore | Elettro-chimico | Elettro-chimico | Elettro-chimico | Elettro-chimico | Elettro-chimico | Elettro-chimico | Fluorimetrico | Elettro-chimico |
| Intervallo valori glicemici rilevati (mg/dL) |
40-400 | 40-400 | 40-400 | 40-400 | 40-500 | 40-500 | 40-400 | 40-400 |
| Rilevazioni glicemiche | Ogni 5 minuti | Ogni 5 minuti | Ogni 5 minuti | Ogni 5 minuti | Ogni 5 minuti | Ogni singolo minuto | Ogni 5 minuti | Ogni 5 minuti |
| Età di utilizzo | Dai 7 anni | Approvato dai 2 anni | Approvato dai 2 anni | Approvato dai 2 anni | Approvato dai 4 anni | Approvato dai 4 anni | Approvato per > 18 anni |
Approvato dai 6 anni |
| Uso in gravidanza | Sì | Sì | Sì | Sì | Sì | Sì | Sì | Sì |
| Facilità inserzione e rimozione | Sì | Sì | Sì | Sì | Sì | Sì | No (necessita di piccola incisione ambulatoriale da parte del medico) | Sì |
| Durata del sensore (gg) | 7 | 10 | 10 | 10 | 14 | 14 | 180 | 14 |
| Indossabilità/ ingombro | +++ | ++++ | +++++ | ++++ | +++++ | +++++ | ++++++ | +++ |
| Vibrazione del trasmettitore | No | No | No | No | No | No | Sì | No |
| Frecce di tendenza | Sì | Sì | Sì | Sì | Sì | Sì | Sì | Sì |
| Allarmi soglia (ipo-iper) | Sì | Sì | Sì | Sì | Sì | Sì | Sì | Sì |
| Avvisi predittivi (ipo-iper) | Sì | Sì | Sì | No | No | No | Sì | Sì |
| Numero di calibrazioni necessarie |
Non necessarie, possibilità di inserirle |
Non necessarie, possibilità di inserirle |
Non necessarie, possibilità di inserirle |
Non necessarie, non possibile inserirle | Non necessarie, non possibile inserirle | Non necessarie, non possibile inserirle | 1-2 giornaliere | 1 giornaliera |
| Possibilità di interfaccia con micro-infusore |
Sì (fa già parte del sistema AHCL Minimed 780G) |
Sì (con Tandem® t:slim X2 e con Omnipod®5) |
Attualmente no |
No | Attualmente no | Attualmente no | Attualmente no | Attualmente no |
| Analisi dei dati scaricati e piattaforme web |
Sì (CareLink Personal e CareLink Pro System) |
Sì (Dexcom Clarity) |
Sì (Dexcom Clarity |
Sì (Dexcom Clarity | Sì (LibreView) | Sì (LibreView) | Sì (Eversensedms per i pazienti, pro.eversensedms per i medici, SmartPix 3.0) | Sì (Glucologweb) |
| Condivisione dati in remoto |
Sì (CareLink Connect) |
Sì (Dexcom Follow) |
Sì (Dexcom Follow) |
No | Sì (LibreView) | Sì (LibreView) | Sì (Eversense NOW) | No |
| MARD | 10.4% (cumulativo) | 9.9% (cumulativo) | 9.1% (addome) 8.2% (braccia) |
8.8% (cumulativo) 9.8% (adulti) 7.7% (bambini) |
9.5% (cumulativo) 9.2% (adulti) 9.7% (bambini) |
7.8% (cumulativo) | 8.5% (cumulativo) | 11.4% (cumulativo) |
| Costi | ++++ | ++++ | + | + | + | +++ | ++ | |
Conclusioni
Il monitoraggio della glicemia in continuo sta oggi cambiando la gestione del diabete, sia da parte del paziente che da quella del medico. I nuovi strumenti forniscono all’utilizzatore dati completi, che consentono un miglior controllo metabolico e riducono il rischio ipoglicemico: i sistemi CGM e Flash non sono quindi semplici strumenti di monitoraggio, ma sistemi capaci di migliorare molteplici esiti nel paziente diabetico insulino-trattato. Il loro utilizzo su larga scala ha fatto nascere nuove metriche del compenso glicemico, che oggi si affiancano ai parametri metabolici tradizionali. Inoltre, la connettività con i sistemi infusionali insulinici ha permesso negli ultimi anni la commercializzazione di sistemi integrati, che stanno diventando il gold standard della terapia nel DM1.
Bibliografia
- Clarke SF, Foster JR. A history of blood glucose meters and their role in self-monitoring of diabetes mellitus. Br J Biomed Sci 2012, 69: 83-93.
- Papa G, Iurato MP, Licciardello C, et al. Real time continous glucose monitoring, flash glucose monitoring e sensori glicemici impiantabili: caratteristiche e peculiarità. JAMD 2020, 23: 37-48.
- Kudva YC, Ahmann AJ, Bergenstal RM, et al. Approach to using trend arrows in the FreeStyle Libre Flash Glucose Monitoring Systems in adults. J Endocr Soc 2018, 2: 1320-37.
- Ziegler R, Von Sengbusch S, Kroger J, et al. Therapy adjustments based on trend arrows using continuous glucose monitoring systems. J Diabetes Sci Technol 2019, 13: 763-73.
- International Diabetes Center. Ambulatory Glucose Profile: AGP reports. Available from: http://www.agpreport.org/agp/agpreports.
- Gomez-Peralta F, Choudhry P, Cosson E, et al. Understanding the clinical implications of differences between glucose management indicator and glycated haemoglobin. Diab Obes Metab 2022, 24: 599-608.
- Rodbard D. Glucose variability: a review of clinical applications and research developments. Diabetes Technol Ther 2018, 20: S25-215.
- Battellino T, Danne T, M. Bergenstal RM, et al. Clinical targets for CGM data interpretation: recommendations from the International consensus on time in range. Diabetes Care 2019, 42: 1593-603.
- Feig DS, Donovan LE, Corcoy R, et al; CONCEPTT Collaborative Group. CGM in pregnant women with type 1 diabetes (CONCEPTT): a multicentre international randomised controlled trial. Lancet 2017, 390: 2347-59.
- Kristensen K, Ogge LE, Sengpiel V, et al. Continuous glucose monitoring in pregnant women with type 1 diabetes: an observational cohort study of 186 pregnancies. Diabetologia 2019, 62: 1143-53.
- Beck RW, Riddlesworth T, Ruedy K, et al; DIAMOND study group. Effect of continuous glucose monitoring on glycemic control in adults with type 1 diabetes using insulin injections: the DIAMOND randomized clinical trial. JAMA 2017, 317: 371-8.
- Lind M, Polonsky W, Hirsch IB, et al. Continuous glucose monitoring vs conventional therapy for glycemic control in adults with type 1 diabetes treated with multiple daily insulin injections: the GOLD randomized clinical trial. JAMA 2017, 317: 379-87.
- Riddlesworth T, Price D, Cohen N, et al. Hypoglycemic event frequency and the effect of continuous glucose monitoring in adults with type 1 diabetes using multiple daily insulin injections. Diabetes Ther 2017, 8: 947-51.
- Van Beers CAJ, Devires JH, Kleijer SJ, et al. Continuous glucose monitoring for patients with type 1 diabetes and impaired awareness of hypoglycaemia (IN CONTROL): a randomized, open-label, crossover trial. Lancet Diabetes Endocrinol 2016, 4: 893-902.
- Heinemann L, Freckmann G, Ehrmann D, et al. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomized controlled trial. Lancet 2018, 391: 1367-77.
- Laffel LM, Kanapka LG, Beck RW, et al. CGM Intervention in Teens and Young Adults with T1D (CITY) Study Group; CDE10. Effect of continuous glucose monitoring on glycemic control in adolescents and young adults with type 1 diabetes: a randomized clinical trial. JAMA 2020, 323: 2388-96.
- Gubitosi-Klug RA, Braffett BH, Bebu I, et al. Continuous glucose monitoring in adults with type 1 diabetes with 35 years duration from the DCCT/EDIC study. Diabetes Care 2022, 45: 659-65.
- Miller KM, Kanapka LG, Rickels MR, et al. Benefit of continuous glucose monitoring in reducing hypoglycemia is sustained through 12 months of use among older adults with type 1 diabetes. Diabetes Technol Ther 2022, 24: 424-34.
- Bao S, Bailey R, Calhoun P, et al. Effectiveness of continuous glucose monitoring in older adults with type 2 diabetes treated with basal insulin. Diabetes Technol Ther 2022, 24: 299-306.
- Beck RW, Riddlesworth TD, Ruedy K, et al; DIAMOND Study Group. Continuous glucose monitoring versus usual care in patients with type 2 diabetes receiving multiple daily insulin injections: a randomized trial. Ann Intern Med 2017, 167: 365-74.
- Ehrhardt NM, Chellappa M, Walker MS, et al. The effect of real-time continuous glucose monitoring on glycemic control in patients with type 2 diabetes mellitus. J Diabetes Sci Technol 2011, 5: 668-75.
- Martens T, Beck RW, Bailey R, et al; MOBILE Study Group. Effect of continuous glucose monitoring on glycemic control in patients with type 2 diabetes treated with basal insulin: a randomized clinical trial. JAMA 2021, 325: 2262-72.
- Bolinder J, Antuna R, Geelhoed-Duijvestijn P, et al. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomized controlled trial. Lancet 2016, 388: 2254-63.
- Oskarsson P, Antuna R, Geelhoed-Duijvestijn P, et al. Impact of flash glucose monitoring on hypoglycaemia in adults with type 1 diabetes managed with multiple daily injection therapy: a pre-specified subgroup analysis of the IMPACT randomized controlled trial. Diabetologia 2018, 61: 539-50.
- Haak T, Hanaire H, Ajjan R, et al. Flash glucose-sensing technology as a replacement for blood glucose monitoring for the management of insulin-treated type 2 diabetes: a multicenter, open-label randomized controlled trial. Diabetes Ther 2017, 8: 55-73.
- Yaron M, Roitman E, Aharon-Hananel G, et al. Effect of flash glucose monitoring technology on glycemic control and treatment satisfaction in patients with type 2 diabetes. Diabetes Care 2019, 42: 1178-84.
- Leelarathna L, Evans ML, Neupane S, et al; FLASH-UK Trial Study Group. Intermittently scanned continuous glucose monitoring for type 1 diabetes. N Engl J Med 2022, 387: 1477-87.
- Deshmukh H, Wilmot EG, Gregory R, et al. Effect of flash glucose monitoring on glycemic control, hypoglycemia, diabetes-related distress, and resource utilization in the Association of British Clinical Diabetologists (ABCD) nationwide audit. Diabetes Care 2020, 43: 2153-60.
- Nathanson D, Svensson AM, Miftaraj M, et al. Effect of flash glucose monitoring in adults with type 1 diabetes: a nationwide, longitudinal observational study of 14,372 flash users compared with 7691 glucose sensor naïve controls. Diabetologia 2021, 64: 1595-603.
- Roussel R, Riveline JP, Vicaut E, et al. Important drop in rate of acute diabetes complications in people with type 1 or type 2 diabetes after initiation of flash glucose monitoring in France: the RELIEF Study. Diabetes Care 2021, 44: 1368-76.
- Linee Guida AMD-SID-SIEDP. La terapia del diabete tipo 1. Sistema Nazionale delle Linee Guida dell’Istituto Superiore di Sanità. Roma, 16-03-2022. https://snlg.iss.it/wp-content/uploads/2022/04/LG_La-terapia-del-diabete-di-tipo-1_rev.pdf
- Linee Guida SID-AMD. La terapia del diabete tipo 2. Sistema Nazionale delle Linee Guida dell’Istituto Superiore di Sanità. Roma, 26-07-2021. https://snlg.iss.it/wp-content/uploads/2021/07/LG_379_diabete_2.pdf
- Elsayed NA, Aleppo G, Aroda VR, et al. Diabetes Technology: Standards of Care in Diabetes – 2023. Diabetes Care 2023, 46: S111-27.
- Grunberger G, Sherr J, Allende M, et al. American Association of Clinical Endocrinology clinical practice guidelines: the use of advanced technology in the management of persons with diabetes mellitus. Endocr Pract 2021, 27: 505-37.
- GuardianTM 4: sensor user guide (Rev. Date 06-2021)
- Dexcom G6 User Guide (Rev. Date 3-2022)
- Dexcom G7 User Guide (Rev. Date 11-2021)
- Dexcom ONE User Guide (Rev. Date 7-2022)
- FreeStyle Libre 2 User’s Manual (Rev. Date 6-2020)
- FreeStyle Libre 3 User’s Manual (Rev. Date 4-2022)
- Eversense XL User’s Manual (Rev. Date 11-2022)
- GlucoMenDayCGM Guida Utente (Rev. Date 3-2020)
Classificazione del diabete mellito
Lisa Buci
SOD Endocrinologia, AOU Careggi, Firenze
(aggiornato 8 gennaio 2020)
- Diabete mellito di tipo 1
- immuno-mediato:
- ad insorgenza nell'età infantile/adolescenziale;
- variante LADA (latent autoimmune diabetes of the adults)
- idiopatico
- immuno-mediato:
- Diabete mellito di tipo 2
- Diabete gestazionale
- Altri tipi specifici di diabete:
- difetti genetici della funzione della ß-cellula:
- MODY 1 (cromosoma 20, HNF-4alpha)
- MODY 2 (cromosoma 7, glucochinasi)
- MODY 3 (cromosoma 12, HNF-1alpha)
- MODY 4 (cromosoma 13, IPF-1)
- MODY 5 (cromosoma 17, HNF-1beta)
- MODY 6 (cromosoma 2, NeuroD1)
- MODY 7 (cromosoma 2, KLF11)
- MODY 8 (cromosoma 9, CEL)
- MODY 9 (cromosoma 7, PAX4)
- MODY 10 (cromosoma 11, INS)
- MODY 11 (cromosoma 8, BLK)
- DNA mitocondriale
- diabete neonatale permanente
- diabete neonatale transitorio
- difetti genetici dell'azione insulinica:
- leprecaunismo
- diabete lipo-atrofico
- sindrome di Rabson-Mendenhall
- insulino-resistenza tipo A
- patologie del pancreas esocrino:
- fibrosi cistica
- pancreatopatia fibro-calcolosa
- emocromatosi
- tumore pancreatico
- pancreatiti
- trauma/pancreasectomia
- endocrinopatie
- forme indotte da farmaci
- IFN-alfa
- anti-psicotici atipici
- agonisti ß-adrenergici
- diazossido
- dilantina
- glucocorticoidi
- anti-retrovirali
- inibitori HMG CoA-reduttasi (statine)
- acido nicotinico
- pentamidina
- tiazidici
- ormoni tiroidei
- vacor
- infezioni
- rosolia congenita
- citomegalovirus
- sindromi genetiche talora associate a diabete
- sindrome di Down
- atassia di Friederich
- corea di Huntington
- sindrome di Klinefelter
- sindrome di Laurence-Moon-Bardet-Biedl
- distrofia miotonica
- porfiria
- sindrome di Prader-Willi
- sindrome di Turner
- sindrome di Wolfram
- forme immuno-mediate non comuni
- anticorpi anti-recettore insulinico
- sindrome "Stiff-man"
- difetti genetici della funzione della ß-cellula:
Bibliografia
- American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2012, 35 suppl 1: S64-71.
- Clinical Practice Guidelines Committee. Can J Diabetes 2013, 17 supplement 1: S8, S9, S197.
Aggiornamento al 8/1/2020
Ad oggi, non ci sono concettuali modifiche nella classificazione ufficiale del diabete mellito: sia gli standard di cura italiani per il diabete mellito AMD - SID 2018 (1) che gli Standards of Medical Care in Diabetes 2020 dell'ADA (2) continuano a riferirsi alle 4 categorie del "tipo 1", "tipo 2", "gestazionale" e "altri", nonostante tali categorie non appaiano più esaustive.
Da alcuni anni emerge la necessità di una classificazione basata su una nuova visione della patologia diabetica, che per esempio ponga al centro della questione la β-cellula (3). In questo senso è interessante la proposta svedese del 2018 (4) di una nuova classificazione basata su 5 cluster che nascono dall'analisi di 6 variabili alla diagnosi, cluster che si associano a diversa progressione di malattia e diverso rischio di complicanze:
- cluster 1 – SAID: severe autoimmune diabetes
- cluster 2 – SIDD: severe insulin-deficient diabetes
- cluster 3 – SIRD: severe insulin-resistant diabetes
- cluster 4 – MOD: mild obesity-related diabetes
- cluster 5 – MARD: mild age-related diabetes.
Bibliografia
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
- ADA. Classification and diagnosis of diabetes mellitus. Standard of Medical Care in Diabetes - 2020. Diabetes Care 2020, 43 suppl 1: 14-31.
- Schwartz SS, Epstein S, Corkey BE, et al. The time is right for a new classification system for diabetes: rationale and implications of the β-cell-centric classification schema. Diabetes Care 2016, 39: 179-86.
- Ahlqvist E, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol 2018, 6: 361-9.
- Dionisio R. Diabete a insorgenza in età adulta: nuovi sottogruppi associati con esiti diversi. AME News 55/2018.
Epidemiologia del diabete mellito tipo 1
Maria Antonietta Pellegrini, Laura Tonutti, Sandra Agus, Franco Grimaldi
SOC Endocrinologia e Malattie del Metabolismo, AOU Santa Maria della Misericordia, Udine
Il diabete mellito di tipo 1 (DMT1) rappresenta una delle più importanti malattie croniche dell’età evolutiva, costituisce un problema di sanità pubblica che riguarda sia i Paesi “sviluppati” che quelli “in via di sviluppo”, con un alto impatto sociale dal momento che interessa soggetti in giovane età.
L’OMS ha promosso un progetto multinazionale per la sorveglianza dell’incidenza, della mortalità e del livello assistenziale del diabete nell’età infantile, il cosiddetto studio DiaMond (Multinational Project for Childhood Diabetes) (1), che si è proposto di tracciare un quadro della patologia a livello mondiale acquisendo da tutti i registri i dati di incidenza della malattia fino ai 14 anni. I risultati di tale indagine hanno fatto emergere un quadro difforme, con aree ad elevatissima incidenza, come Sardegna e Finlandia (circa 37/100.000 per anno), seguite da aree ad alta incidenza quali Canada (24/100.000 per anno) e Norvegia (21.2/100.000 per anno) ed infine da aree a bassa incidenza, come alcuni Paesi del Sud America (Venezuela 0.19/100.000 per anno).
L’età in cui l’aumento del tasso d’incidenza si è manifestato con più evidenza è stata quella sotto i cinque anni d’età. Secondo le stime della IDF, al 2010 480 mila bambini e ragazzi fra 0 e 14 anni avevano il DMT1 nel mondo e 110 mila in Europa (2).
L’OMS ha incluso di recente l’Italia nell’elenco dei 10 paesi al mondo con maggiore prevalenza di diabete mellito in età adulta, dopo il Brasile e prima del Bangladesh. In Italia, fino alla metà degli anni ‘80 non erano disponibili dati epidemiologici accurati sull’incidenza del DMT1. Nel 1996 è stato istituito il Registro Italiano per il Diabete mellito insulino-dipendente (RIDI) con l’obiettivo generale di coordinare i Registri di Incidenza già esistenti.
Ogni anno in Italia si riscontrano circa 84 casi/milione di abitanti (circa 5000 nuovi casi) e si stima che le persone affette da DMT1 siano circa 250 mila. Nel periodo 2005-2010, in Italia, il valore medio nazionale del tasso di incidenza del DMT1 tra i bambini di 0-4 anni è stato pari a 13.4 per 100.000 (IC95% 12.8-14.0), più elevato tra i maschi (14.1, IC95% 13.3-14.9) rispetto alle femmine (12.7, IC95% 11.9-13.4) (3). L’incidenza della malattia presenta forti differenze geografiche, con le regioni meridionali che presentano nel complesso valori lievemente più elevati rispetto a quelle del Nord. Il primato spetta però alla Sardegna, che mostra il tasso di incidenza più alto rispetto al resto del Paese (55.6 per 100.000) (4).
Bibliografia
- Familial insulin-dependent diabetes mellitus (IDDM) epidemiology: standardization of data for the DIAMOND Project. The WHO Multinational Project for Childhood Diabetes Group.Bull World Health Organ 1991, 69: 767-77.
- IDF. Diabetes Atlas, 4th Edition 2009.
- http://www.epicentro.iss.it/
- Vichi M, et al. An easy, fast, effective tool to monitor the incidence of type 1 diabetes among children aged 0-4 years in Italy: the Italian Hospital Discharge Registry (IHDR). Acta Diabetol 2014, 51: 287-94.
Patogenesi del diabete mellito tipo 1
Maria Antonietta Pellegrini, Laura Tonutti, Sandra Agus, Franco Grimaldi
SOC Endocrinologia e Malattie del Metabolismo, AOU Santa Maria della Misericordia, Udine
Il diabete di tipo 1 (DMT1) è causato dalla distruzione selettiva delle β-cellule pancreatiche producenti l’ormone insulina da parte di linfociti T auto-reattivi.
Il DMT1 può considerarsi una malattia multifattoriale in cui fattori di rischio ambientali, tuttora non ben definiti, scatenerebbero una distruzione immuno-mediata delle β-cellule del pancreas in individui geneticamente predisposti. Resta tuttora irrisolto cosa determini e come si sviluppi l’inizio dell’aggressione auto-immunitaria, che può iniziare anche diversi anni prima della manifestazione clinica della malattia.
La presenza di alcuni geni aumenta il rischio di sviluppare il diabete di tipo 1. All’interno della stessa famiglia possono esserci più persone affette da questa condizione: in presenza di un parente affetto da DMT1, il rischio per un altro familiare di sviluppare questa condizione è del 6% circa, contro lo 0.5% della popolazione generale; tuttavia solo il 15% delle persone affette da DMT1 ha un parente di primo grado affetto da questa condizione) (1). Una forte associazione è stata trovata con alcune varianti alleliche dell’HLA di classe II (2). Fratelli che condividono gli aplotipi HLA-DR3/4 -DQ2/DQ8 hanno un rischio estremamente più elevato di sviluppare auto-anticorpi contro le isole pancreatiche e DM1 nel tempo rispetto a fratelli che condividono un solo o nessun aplotipo (3).
Gli auto-anticorpi predittivi di malattia e capaci di discriminare con una sensibilità del 98.2% il DMT1 autoimmune sono:
- anti-isola pancreatica (ICA, marcatori sierologici predittivi della malattia);
- anti-insulina (IAA);
- anti-GAD (auto-anticorpi anti-glucosaminidasi);
- Ia2 (auto-anticorpi anti-tirosinchinasi);
- ZnT8 (auto-anticorpi contro il trasportatore dello zinco espresso esclusivamente sulle cellule pancreatiche). ZnT8 è il più recente auto-antigene insulare identificato. Sono attualmente in corso studi su ampie casistiche di soggetti diabetici e soggetti di controllo per determinare con accuratezza sensibilità e specificità diagnostiche di questo marcatore e la sua potenziale applicabilità clinica (4).
Dagli studi di genetica su gemelli omozigoti, che hanno evidenziato la comparsa di DMT1 solo nel 50% dei casi, è emersa una componente ambientale nello sviluppo del DMT1. In merito alla relazione fra fattori ambientali e DMT1, sono state considerate molte ipotesi, fra cui l’azione di agenti virali, quali i Coxsakie e il CMV. Tra i possibili agenti inducenti era stata ipotizzata anche la sostituzione precoce del latte materno con il latte vaccino nel lattante. Lo studio DAISY ha dimostrato l’infondatezza di tale ipotesi. Altri studi hanno ipotizzato l’ingestione precoce di cereali o glutine come fattore di rischio di insorgenza di DMT1, ma anche questa ipotesi non ha trovato riscontri certi.
Bibliografia
- Davies JL, et al. A genome-wide search for human type 1 diabetes susceptibility genes. Nature 1994, 371: 130-6.
- Noble JA, et al. Race-specific type 1 diabetes risk of HLA-DR7 haplotypes. Tissue Antigens 2011, 78: 348-51.
- Erlich H, et al. HLA DR-DQ haplotypes and genotypes and type 1 diabetes risk: analysis of the type 1 diabetes genetics consortium families. Diabetes 2008, 57: 1084-92.
- Wenzlau JM, et al. The cation efflux transporter ZnT8 (Slc30A8) is a major autoantigen in human type 1 diabetes. Proc Natl Acad Sci USA 2007, 104: 17040-5.
Clinica e diagnostica del diabete mellito tipo 1
Maria Antonietta Pellegrini, Laura Tonutti, Sandra Agus, Franco Grimaldi
SOC Endocrinologia e Malattie del Metabolismo, AOU Santa Maria della Misericordia, Udine
Nei bambini i sintomi del diabete di tipo 1 (DMT1) possono avere una comparsa improvvisa (e a volte drammatica), perché le ß-cellule pancreatiche, produttrici di insulina, vengono distrutte molto rapidamente. Nel DMT1 dell’adulto i sintomi d’esordio possono essere più graduali, perché la distruzione del pancreas ad opera del sistema immunitario avviene più gradualmente.
I sintomi/segni caratteristici del diabete all’esordio sono: sete intensa e frequente bisogno di urinare, perdita di peso rapida e improvvisa, nonostante la fame aumentata, stanchezza, perdita di zuccheri nelle urine (glicosuria), improvviso offuscamento della vista, alito acetonemico (con odore di mele marce o vinoso), ottundimento fino alla letargia (1).
La diagnosi di diabete è posta con il riscontro di:
- in presenza di sintomi tipici della malattia (poliuria, polidipsia e calo ponderale), glicemia casuale ≥ 200 mg/dL (indipendentemente dall’assunzione di cibo), anche in una sola occasione;
- in assenza dei sintomi tipici della malattia, glicemia a digiuno ≥ 126 mg/dL (per digiuno si intende almeno 8 ore di astensione dal cibo) confermata in almeno due diverse occasioni oppure glicemia ≥ 200 mg/dL 2 ore dopo carico orale di glucosio (eseguito con 75 g).
Il quadro clinico è spesso sufficiente per la classificazione, tuttavia in alcuni casi può essere necessaria la determinazione dei marcatori di autoimmunità (IAA, GADA, ICA, IA-2).
Il 5% dei pazienti inizialmente definiti come diabete tipo 2 è in realtà affetto da una forma di diabete autoimmune a lenta evoluzione verso l’insulino-dipendenza, definito LADA (Latent Autoimmune Diabetes in Adults).
Mentre gli standard per la gestione del diabete nell’adulto rispecchiano la necessita di mantenere il controllo glicemico il più possibile vicino alla normalità, è necessaria una specifica considerazione sui rischi conseguenti all’ipoglicemia nel bambino piccolo. Gli obiettivi glicemici devono essere modificati, considerando che la maggior parte dei bambini di età < 6 anni ha una particolare forma di inconsapevolezza dell’ipoglicemia, dovuta ai meccanismi contro-regolatori ancora immaturi, che li rende privi della capacità cognitiva di riconoscere e rispondere alla sintomatologia ipoglicemica; sono pertanto esposti a un rischio maggiore di ipoglicemia e delle sue conseguenze (tabella) (2).
| Obiettivi di glicemia plasmatica e di HbA1c per fasce di età nel diabete tipo 1 | |||||
| Valori per età | Glicemia (mg/dL) | HbA1c % (mM/M) | Razionale | ||
| Pre-prandiale | Post-prandiale | Bedtime/notte | |||
| Lattante/età prescolare (< 6 anni) | 100-180 | 140-200 | 110-200 | 6.5(48)-8.5(69) | Elevato rischio di vulnerabilità all’ipoglicemia |
| Età scolare (6-12 anni) | 90-180 | 130-180 | 100-180 | < 7.5 (58) | Rischio di ipoglicemia e rischio relativamente basso di complicanze prima della pubertà |
| Adolescenti e giovani adulti (13‑19 anni) | 90-130 | 120-160 | 90-150 | < 7.5 (58) | Rischio grave di ipoglicemia Problemi psicologici e inerenti allo sviluppo Un obiettivo più basso è ragionevolmente proponibile se può essere raggiunto senza eccessivi episodi ipoglicemici |
Concetti chiave nel definire gli obiettivi glicemici:
- gli obiettivi devono essere individualizzati;
- obiettivi glicemici più bassi di quelli consigliati devono essere basati sulla valutazione del rischio di ipoglicemia in relazione al beneficio atteso;
- gli obiettivi glicemici dovrebbero essere più alti rispetto a quelli sopraindicati in bambini con frequenti ipoglicemie o con episodi di ipoglicemia inavvertita;
- la glicemia post-prandiale deve essere misurata qualora vi sia dissociazione tra i valori glicemici pre-prandiali e l’HbA1c.
Screening delle patologie autoimmuni associate (patologia tiroidea e malattia celiaca)
Lo screening della patologia tiroidea e della malattia celiaca è indicato alla diagnosi e nel corso del follow-up, in considerazione dell’elevata frequenza e del possibile effetto sullo sviluppo psicofisico. Nei pazienti con patologia autoimmune multipla e/o familiarità per poliendocrinopatie autoimmuni può essere opportuna la ricerca degli anticorpi anti-surrene e anti-mucosa gastrica.
Bibliografia
- ADA. Standards of Medical Care in Diabetes. Diabetes Care 2014, 37 Suppl 1: S14-80.
- AMD-SID. Standard Italiani per la cura del diabete mellito. 2014.
Epidemiologia del diabete mellito tipo 2
AnnaCarla Babini
UO Medicina 2, Ospedale Infermi di Rimini, Azienda USL di Romagna
L’incidenza e prevalenza del diabete è in costante crescita, come numerosi studi epidemiologici hanno mostrato. Paul Zimmet parlava di “diabesity pandemic”, cioè di una crescente incidenza e prevalenza nel pianeta di diabete nel XXI secolo (1-2).
Diagnosticare tempestivamente la malattia significa migliorare la prognosi: esiste una stretta correlazione tra buon controllo glicemico, ottenuto sin dalle prime fasi della malattia, e comparsa e/o rallentato sviluppo delle complicanze diabetiche tardive (3). Da qui la necessità di attuare interventi terapeutici il più tempestivamente possibile, al fine di raggiungere e mantenere i livelli glicemici target identificati come ottimali in termini di prevenzione (4). Purtroppo, la sintomatologia è spesso assente. La frequenza del diabete non noto rappresenta circa 1/3 della prevalenza totale e questo è uno dei motivi per cui è difficile avere una stima esatta della prevalenza del diabete (5).
I dati ISTAT (6) indicano una prevalenza del 5.5% (5.5% delle donne e 5.4% degli uomini), pari a oltre 3.000.000 di persone. La prevalenza del diabete per anno è stata standardizzata per età e sesso (popolazione di riferimento). La prevalenza è aumentata dal 3.9% nel 2001 al 5.0% nel 2012. Per quanto riguarda la distribuzione geografica, la frequenza è più alta nel Sud e nelle Isole (6.2% al Sud, 5.5% al Centro e 4.9% al Nord). I dati di prevalenza per area geografica e per regione non sono standardizzati, quindi le differenze osservate potrebbero dipendere da una diversa composizione per età della popolazione nelle diverse aree geografiche. Tuttavia, elaborazioni effettuate sui dati del 2011 mostrano che le differenze permangono anche dopo la standardizzazione.
La prevalenza del diabete aumenta con l’età, fino a raggiungere il 20.3% nelle persone con età ≥ 75 anni. I dati del sistema di sorveglianza PASSI (7-8) (relativi al pool di ASL partecipanti nel 2010), mostrano una prevalenza pari al 5% nelle fasce di età 18-69 anni, a conferma dei dati dell’ISTAT. Analisi effettuate sulle persone di età compresa tra 35 e 69 anni relativamente al periodo 2007-2009 (8), hanno mostrato una maggiore prevalenza del diabete fra i maschi, nella fascia di età 50-69 anni, tra le persone con basso livello d’istruzione e molte difficoltà economiche.
Si riducono, invece, i ricoveri, da 120.804 nel 2000 a 96.787 nel 2010. In particolare, diminuiscono i ricoveri potenzialmente inappropriati. Anche il ricorso al regime ordinario è in calo, a favore di trattamenti in day-hospital o in regime ambulatoriale.
Bibliografia
- Pincock S. Paul Zimmet: fighting the “diabesity” pandemic. Lancet 2006, 368: 1643.
- Amos AF, McCarty DJ, Zimmet P. The rising global burden of diabetes and its complications: estimates and projections to the year 2010. Diabetic Med 1997, 14 suppl 5: S7-85.
- Holmann RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2009, 359: 1577-89.
- Adler AI, Shaw EJ, Stokes T, et al, Guideline Development Group. Newer agents for blood glucose control in type 2 diabetes: summary of NICE guidance. BMJ 2009, 338: b1668.
- Documento AMD-SID. La prevenzione del diabete mellito di tipo 2: dalle evidenze alle strategie di implementazione. Idelson–Gnocchi ED 2011.
- Annuario statistico ISTAT 2012: il diabete in Italia (pubblicato 24 settembre 2012).
- Epicentro. Il portale dell'epidemiologia per la sanità pubblica a cura del Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute (Progressi delle Aziende Sanitarie per la Salute in Italia).
- Rapporto Passi. Diseguaglianze sociali e salute 2007-2009, capitolo Diabete 2011: pp 59.
Patogenesi del diabete mellito tipo 2
AnnaCarla Babini
UO Medicina 2, Ospedale Infermi di Rimini, Azienda USL di Romagna
La fondamentale funzione metabolica dell’insulina è incrementare il tasso di trasporto cellulare di glucosio. Il legame insulina-recettore dà il via a una serie di risposte intra-cellulari, tra le quali la sintesi delle proteine e del DNA, l’attivazione delle vie anaboliche e l’inibizione di quelle cataboliche. La normale omeostasi del glucosio è strettamente regolata da tre processi interconnessi: secrezione insulinica, produzione di glucosio nel fegato, captazione e utilizzazione dello stesso da parte dei tessuti periferici.
Il diabete è un disordine multifattoriale, per contemporanea influenza sia di fattori genetici sia di fattori ambientali, i quali coinvolgono sia l’alterato rilascio di insulina, che conduce a un deficit relativo di insulina, sia l’insensibilità degli organi periferici a rispondere alla secrezione insulinica (insulino-resistenza: IR).
È riconosciuto un ruolo genetico nella sua insorgenza e sono stati individuati alcuni geni coinvolti (es PPAR-gamma) (1), ma non sono ancora noti i precisi meccanismi genetici e non esiste correlazione con il sistema HLA. La funzionalità ß-cellulare è ereditabile (1).
Nella patogenesi del DM2 vengono riconosciuti:
- alterato pattern secretorio dell’insulina, per perdita della secrezione pulsatile e della fase precoce di risposta insulinica;
- resistenza insulinica (IR) per ridotto numero dei recettori e difetto post-recettoriale.
L’obesità, soprattutto quella con distribuzione addominale del tessuto adiposo, rappresenta il primum movens (2,3). Inizialmente, le ß-cellule sono capaci di controbilanciare la ridotta risposta dei tessuti all’insulina, aumentando la secrezione: i livelli glicemici rimangono normali, ma all’OGTT vedremo iperinsulinemia.
Gli effetti metabolici dell’insulino-resistenza si esplicano a livello di quattro organi principali: tessuto adiposo, muscolo, fegato e pancreas endocrino, con ruoli ben precisi e interdipendenti nello sviluppo/mantenimento dello stato di IR e nella progressione a diabete mellito (4).
Il tessuto adiposo non ha solo un ruolo di deposito, ma è assimilabile a un organo endocrino, capace di interferire sul metabolismo intermedio e quindi sull’azione dell’insulina (5). Fisiologicamente nel tessuto adiposo l’insulina svolge un ruolo anti-lipolitico, che nei soggetti insulino-resistenti è compromesso, portando a un’esaltata lipolisi, sia a digiuno sia nel periodo post-prandiale, e quindi a un’aumentata immissione in circolo di acidi grassi liberi (FFA), amplificata inoltre dal rallentamento della lipoprotein-lipasi (enzima insulino-dipendente). L’esposizione protratta della ß-cellula a elevate concentrazioni di FFA può contribuire a inibire la secrezione insulinica (6).
Il muscolo è uno dei principali tessuti insulino-dipendenti. A questo livello gli FFA competono con il glucosio, determinando inibizione dell'attivazione insulinica da una parte, e dall'altro bloccano la captazione del glucosio per inibizione dei trasportatori GLUT-1 e GLUT-4. Si ottiene così un aumento di FFA circolanti, che induce minore captazione di glucosio e maggiore ossidazione degli FFA. A questo si deve aggiungere un accumulo di trigliceridi all'interno del muscolo, per deficit dell’ossidazione dei grassi nei periodi di digiuno. FFA e trigliceridi in eccesso determinano poi un incremento di derivati acilati e di diacil-glicerolo, che sono in grado di peggiorare la condizione di insulino-resistenza (7).
A livello epatico l’insulina normalmente inibisce due enzimi chiave del metabolismo glucidico: la fosfo-enolpiruvico-carbossichinasi, enzima limitante della gluconeogenesi, e la glucosio 6-fosfato-fosfatasi, enzima limitante della glicogenolisi. In condizioni di IR questi meccanismi sono alterati, poiché gli FFA provenienti dal tessuto adiposo attraverso la vena porta sono captati dal fegato, dove sono in grado di aumentare l’IR epatica promuovendo la gluconeogenesi e inducendo la soppressione della glicogeno-sintesi. Ne consegue un’aumentata produzione epatica di glucosio e iperglicemia.
Inoltre è stato individuato un meccanismo età-relato che riduce la responsività della ß-cellula ai carboidrati e spiega il declino della tolleranza al glucosio dell'età anziana (7).
Bibliografia
- Kahn SE, Cooper ME, Del Prato S. Pathophysiology and treatment of type 2 diabetes: perspective on the past, present, and future. Lancet 2014, 383: 1068-83.
- Toumilehto J, Knowler WC, Zimmet P. Primary prevention of non insulin dependent diabetes mellitus. Diabetes Metab Rev 1992, 8: 339-53.
- Harris ML. Epidemiologic studies on the pathogenesis of non–insulin-diabetes-mellitus. Clin Invest Med 1995, 18: 430-8.
- DeFronzo RA. Pathogenesis of type 2 diabetes mellitus. Med Clin North Am 2004, 88: 787-835.
- Dei Cas A, Spigoni V, Metra M, Dei Cas L. Insulino-resistenza e rischio cardiovascolare. G Ital Cardiol 2010, 11 (10 Suppl 1): 93S-7.
- Tiengo A, Avogaro A. Dall’obesità al diabete. Arti grafiche Italo Cernia Srl 2008: pp 53-86.
- Warnotte C, Gilon P, Nenquin M, et al. Mechanisms of the stimulation of insulin release by saturated fatty acids. A study of palmitate effects in mouse beta-cells. Diabetes 1994, 43: 703-11.
Clinica e diagnostica del diabete mellito tipo 2
AnnaCarla Babini
UO Medicina 2, Ospedale Infermi di Rimini, Azienda USL di Romagna
Classi di soggetti ad alto rischio per il diabete di tipo 2 (1)
- Pregresso diabete gestazionale
- Soggetto con età > 45 anni specialmente se con BMI > 25
- Soggetto con età < 45 anni, con una o più delle seguenti condizioni
- familiarità (genitori o fratelli con diabete di tipo 2) o etnia afro-caraibica o sud-asiatica
- sovrappeso/obesità (BMI > 25, o circonferenza vita > 80 cm se F e > 94 cm se M)
- IFG (Impaired Fasting Glucose), IGT (Impaired Glucose Tolerance)
- basso colesterolo HDL (< 25 mg/dL)
- donna in sovrappeso, con sindrome dell’ovaio policistico, altre condizioni di insulino-resistenza (acanthosis nigricans), parti di feti macrosomici;
- basso peso alla nascita (< 2.5 kg);
- evidenza di malattia cardiovascolare.
- HbA1c 5.7–6.49% (dosata con metodo standardizzato)
- pressione arteriosa elevata (ipertensione > 140/90 mmHg o terapia anti-ipertensiva).
in assenza dei precedenti criteri, la misurazione della glicemia a digiuno deve iniziare all’età di 45 anni, con ripetizione ogni 3 anni, mentre in presenza di uno o più criteri il monitoraggio deve essere più frequente.
Diagnosi di diabete
Criteri per la diagnosi di diabete (1-3):
- HbA1c ≥ 6.5% (test eseguito con metodo certificato) oppure
- glicemia basale (digiuno da 8 ore) ≥ 126 mg/dL (7.0 mmol/L) oppure
- glicemia ≥ 200 mg/dL al 120’ in corso di OGTT oppure
- glicemia casuale ≥ 200 mg/dL in paziente con i classici sintomi.
È anche vero che accertare la presenza di diabete in un individuo spesso dipende dalle circostanze in essere al momento della diagnosi (4). Gli esempi più classici sono l’iperglicemia da stress da malattia intercorrente grave, intervento chirurgico, oppure l’utilizzo di farmaci quali i cortisonici. Se un singolo test di laboratorio rientra nel criterio diagnostico di diabete, deve essere ricontrollato in altra data, scegliendo possibilmente il medesimo test. Nel caso di glicemia di 200 mg/dL in paziente asintomatico occorre scegliere un test alternativo (3). Se due o tre test sono discordanti, allora si deve ripetere quello alterato e se verrà confermato allora potremo fare diagnosi di diabete.
Clinica
Questa forma di diabete è frequentemente sotto-diagnosticata per molti anni (almeno 7), perchè l’iperglicemia si instaura lentamente e non in maniera severa o comunque tale da determinare i classici sintomi quali poliuria, polidipsia, dimagrimento, astenia, che compaiono a glicemie > 200 mg/dL. Insieme a questi sintomi il paziente potrebbe lamentare deficit visivo, cefalea, stranguria e pollachiuria legati a infezione delle vie urinarie, candidosi orale o gengivite.
Spesso i sintomi di comparsa sono proprio le complicanze diabetiche tardive (3): malattia cardiovascolare, modifiche del visus, sintomi legati a neuropatie sensitiva/motoria/autonomica.
Valutazione iniziale
Il paziente con diabete deve essere valutato da diverse figure professionali che compongono il team diabetologico: medico, infermiere, dietista, ma anche psicologo e podologo (per i servizi /ambulatori più dotati) (1).
Anamnesi. Familiarità, anamnesi patologica remota e prossima, anamnesi diabetologica: età di comparsa e caratteristiche, indagine dello stile di vita, precedenti e attuali trattamenti farmacologici anti-diabetici, storia del controllo glicemico, risultati del monitoraggio glicemico, episodi ipoglicemici e sensibilità all’ipoglicemia, storia delle complicanze.
Esame obiettivo. Antropometria: peso, altezza, circonferenza vita. Inoltre: pressione arteriosa in orto e clinostatismo, frequenza cardiaca, valutazione dei polsi carotidei e agli arti inferiori, ricerca di soffi in sede renale, palpazione epatica e tiroidea, ispezione dei piedi, valutazione della cute.
Laboratorio. Glicemia a digiuno, HbA1c, assetto lipidico, valutazione di creatininemia e calcolo del filtrato glomerulare, albuminuria, assetto epatico, eventuale cortisolo salivare. Non è utile l’insulinemia, perchè potrebbe essere inappropriatamente normale (per deficit secretorio).
Colloquio con dietista: indagine alimentare, educazione alimentare, colloquio con psicologo (se presente e se indicato).
Esami strumentali. Alla diagnosi di diabete, fundus oculi, ECG, ecografia addome superiore (eventuale), ABI (ankle brachial pressure index) e sensibilità al monofilamento. Se sono presenti alterazioni di queste indagini, si approfondirà la diagnosi delle complicanze diabetiche tardive.
Bibliografia essenziale
- AMD – SID. Standard italiani per la cura del diabete mellito. 2014.
- Position statement ADA. Standards of Medical Care in Diabetes 2013. Diabetes Care 2013, 36 suppl 1: S11-4.
- Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Definition, classification and diagnosis of diabetes, prediabetes and metabolic syndrome clinical practice guidelines. Can J Diabetes 2013, 37: S8-S11.
- ADA. Diagnosis and classification of diabetes mellitus. Diabetes Care 2011, 34 suppl 1: S62-9.
Forme monogeniche di diabete
Antonio Paroli
Fondazione Poliambulanza Gruppo EDM, IRCCS FBF, Domus Salutis, Brescia
Il MODY (Maturity onset diabetes of the young) è una forma familiare di diabete, caratterizzato da un disordine monogenico a ereditarietà autosomica dominante, assenza di auto-anticorpi e di caratteristiche di sindrome metabolica (mancanza di insulino-resistenza), variabilità fenotipica, a decorso benigno, non ingravescente, che si presenta in bambini o in giovani adulti (25-40 anni) di solito normopeso o magri.
Il MODY è la forma più frequente di diabete monogenico (1-2%), spesso erroneamente diagnosticato come diabete tipo 1 o diabete tipo 2 e quindi sottostimato.
L’identificazione delle prime mutazioni correlate a MODY risale agli anni ‘90, oggi ne sono note almeno 11. L'80-90% delle mutazioni colpisce i geni correlati alle forme di MODY 1, 2 e 3.
| Genetica delle diverse forme di MODY | |
| Tipo | Gene colpito |
| MODY1 | fattore nucleare epatico 4 alfa (HNF4alfa) |
| MODY2 | glucochinasi (GCK) |
| MODY3 | fattore nucleare epatico 1 alfa (HNF1alfa) |
| MODY4 | insulin promoter factor (IPF-1) |
| MODY5 | fattore epatico nucleare 1 beta (HNF-1beta) |
| MODY6 | fattore di trascrizione Neuro D1 |
| MODY7 | KLF11 |
| MODY8 | CEL |
| MODY9 | PAX4 |
| MODY10 | INS |
| MODY11 | BLK |
La diagnosi va posta per distinguere le forme più frequenti di MODY, che hanno caratteristiche fenotipiche differenti.
In particolare il MODY2 si presenta con iperglicemia a digiuno modesta e ridotta tolleranza a OGTT dopo 120', di solito in soggetti con basso peso alla nascita, scarse o assenti complicanze micro-macrovascolari anche dopo molti anni dalla diagnosi. Il trattamento prevede solo modifiche dello stile di vita (dieta e attività fisica), talvolta insulina nella paziente gravida.
Al contrario, il MODY1 e il MODY3 hanno prognosi meno favorevole, possibili complicanze osmotiche dell'iperglicemia, presenza di complicanze micro-macrovascolari, specie nefropatia, con necessità di terapia farmacologica (sulfoniluree in primis) e talvolta insulina. Non sono note a tal proposito terapie con glitazonici e/o incretine.
Dopo rilievo occasionale di iperglicemia a digiuno e anamnesi di familiarità, la diagnosi pertanto va perfezionata con OGTT, marcatori immunologici (anticorpi ICA, GADA, ecc, negativi) e successive indagini genetiche, attualmente limitate dai costi e dalla scarsità di centri accreditati. Ultimamente la ricerca si è pertanto focalizzata su biomarcatori non genetici come il C-Peptide (presente anche dopo anni di diagnosi clinica nel MODY2) e la PCR ad alta sensibilità come marcatore cardiovascolare nel MODY3.
In conclusione, oggi possiamo affermare che oltre al tipo 1 e al tipo 2 vi sono altre forme di diabete. Anche se costituiscono una scarsa percentuale, richiedono un'attenta anamnesi personale e familiare per un primo orientamento nella diagnosi clinica, mentre per la diagnosi di certezza occorre il supporto del laboratorio, che dovrà essere sempre più attrezzato e mirato, per un opportuno follow-up non solo del paziente ma anche dei suoi familiari.
Bibliografia
- Tattersall RB. Mild familial diabetes with dominant inheritance. Q J Med 1974, 43: 339-57.
- Alberti G, Zimmet P, et al. Type 2 diabetes in the young: the evolving epidemic. The IDF Consensus Workshop. Diabetes Care 2004, 7: 1798-811.
- Lorini R, et al. Il diabete mellito non autoimmune in età pediatrica. G It Diabetol Metab 2010, 30: 172-83.
- Kavvoura FK, Owen KR. Maturity onset diabetes of the young: clinical, diagnosis and management. Pediatr Endocrinol Rev 2012, 10: 234-42.
- McDonald TJ, Ellard S. Maturity onset diabetes of the young: identification and diagnosis. Ann Clin Biochem 2013, 50: 403-15.
- Thanabalasingham G, Owen KR. Diagnosis and management of maturity onset diabetes of the young (MODY). BMJ 2011, 343: d6044.
- Steele AM, et al. Prevalence of vascular complications among patients with glucokinase mutations and prolonged, mild hyperglycemia. JAMA 2014, 311: 279-86.
- McCulloch DK. Classification of diabetes mellitus and genetic diabetic syndromes. UpToDate 2014.
Diabete secondario
Elisabetta Lovati
Ambulatorio Endocrinologia e CAD, Clinica Medica I, Fondazione IRCCS Policlinico San Matteo di Pavia
Si differenzia dal DM1 e DM2 perché conseguente a un’altra patologia in grado di determinare glicemie al di sopra dei valori considerati fisiologici. All’interno della classificazione eziologica del DM rientra nella categoria “altri tipi di diabete mellito”, di cui fanno parte pure le forme correlate a difetti genetici (delle ß-cellule -MODY-, dell’azione dell’insulina e sindromi genetiche - Down, Klinefelter, Turner, ecc) e le forme non comuni di diabete immuno-mediato (Stiff-man syndrome, anticorpi anti-recettore insulinico) (1)
| Cause di diabete mellito secondario | |
| Patologie del pancreas esocrino | Pancreatiti Traumi pancreatici Pancreasectomia chirurgica Neoplasie Emocromatosi Fibrosi cistica Pancreatopatia fibrocalcolosa Altre pancreatopatie |
| Endocrinopatie | Acromegalia S. di Cushing Glucagonoma Feocromocitoma Ipertiroidismo Somatostatinoma Aldosteronoma Iperparatiroidismo Iperprolattinemia |
| Correlato a farmaci/sostanze chimiche | Vacor (topicida) Pentamidina (Pentacarinat – anti-protozoario) Acido nicotinico (niacina) Glucocorticoidi Ormoni tiroidei Diazossido Tiazidici Agonisti β-adrenergici Fenitoina α-interferone Analoghi della somatostatina GH |
| Infezioni | Rosolia congenita CMV |
Le patologie pancreatiche determinano la comparsa del cosiddetto DM di tipo 3, per distruzione delle cellule β-pancreatiche da causa non autoimmune. In questi casi la terapia si basa sugli analoghi dell'insulina, aumentando la percentuale di analogo rapido rispetto alla basale, in quanto i pazienti sono a maggior rischio di ipoglicemie tardive per perdita anche della secrezione di glucagone.
Le endocrinopatie determinano DM mediante vari meccanismi.
Nell'acromegalia possiamo trovare DM in una percentuale variabile dal 19 al 56% dei casi (2). L'eziologia è da ricercarsi in un incremento dell'insulino-resistenza a livello periferico, associato talvolta a una riduzione della secrezione di insulina (in letteratura dati discordanti)(2,3). Inoltre tale condizione può essere precipitata dall'utilizzo degli analoghi della somatostatina, impiegati nella terapia dell'acromegalia. Tali farmaci, infatti, possono inibire la secrezione di insulina e glucagone, peggiorando di fatto una pre-esistente condizione di insulino-resistenza (2). La terapia in questi casi si basa sui farmaci sensibilizzanti l’azione dell’insulina e secretagoghi in associazione, fino ad arrivare eventualmente agli analoghi dell'insulina. È stato però dimostrato che una normalizzazione dei valori di GH e IGF-I determina in genere un netto miglioramento del compenso glico-metabolico, fino a una risoluzione completa del DM (3).
Nella sindrome di Cushing il DM è presente nel 20-50% dei casi (2), a causa dell'insulino-resistenza mediata dall'eccessiva secrezione di cortisolo, non compensata dall'incremento di produzione di insulina da parte del pancreas. A ciò si associa un quadro di dislipidemia sempre cortisolo-relata, che determina un ulteriore incremento del rischio cardio-vascolare (2). I farmaci di prima scelta possono essere metformina e pioglitazone (anche combinati), a cui aggiungere eventualmente gli analoghi dell'insulina (2).
Nei pazienti affetti da feocromocitoma la causa scatenante dell'iperglicemia è da ricondurre a una ridotta secrezione di insulina, peggiorata dall'insulino-resistenza mediata dall'eccessiva produzione di catecolamine. Generalmente questa condizione è reversibile a seguito dell'asportazione della neoplasia (2).
Il somatostatinoma e l’aldosteronoma sono in grado di determinare riduzione del rilascio di insulina, anche per l'ipokaliemia che sono in grado di provocare (1,2). La terapia di scelta in questi casi è l’asportazione chirurgica della neoplasia. Il trattamento con spironolattone determina miglioramento del compenso glicometabolico, ma non equiparabile a quello post-chirurgico (4).
Il glucagonoma determina un incremento della glicemia per azione diretta dell'ormone ipersecreto, non più regolato dai normali meccanismi di contro-regolazione (ipoglicemia secondaria all'azione dell'insulina)(5,6). Nella maggior parte dei casi la patologia viene diagnosticata in stadio avanzato, in presenza di metastasi periferiche e i pazienti affetti solitamente vengono trattati con primo approccio chirurgico, seguito da eventuali ulteriori trattamenti (chemioterapia, somatostatina ed embolizzazione delle lesioni pancreatiche).
L'ipertiroidismo determina un aumento della richiesta energetica dei tessuti, con conseguente maggiore gluconeogenesi da parte del fegato, stimolata anche dall'elevata concentrazione di acido lattico presente in queste situazioni. L'ipertiroidismo, infatti, si associa ad anomala tolleranza insulinica, con aumentata produzione di insulina (segno di sviluppo di insulino-resistenza). A ciò si associa pure un accelerato metabolismo dell'insulina, con sua maggiore degradazione. È stato inoltre evidenziato un incremento dell'assorbimento glucidico dal tratto gastroenterico, determinato da un accelerato svuotamento gastrico, con aumento di flusso sanguigno a livello portale. Una condizione di intolleranza glucidica si riscontra in circa il 45-66% dei pazienti affetti da ipertiroidismo; in questi pazienti la normalizzazione della funzione tiroidea determina un netto miglioramento dei valori glicemici (7-9).
Casi di diabete mellito sono stati inoltre rilevati in pazienti affetti da iperparatiroidismo. La dimostrazione della correlazione con il PTH è stata data dalla normalizzazione dei valori glicemici nei pazienti guariti chirurgicamente. Questa condizione è da ricondurre all'incremento del calcio libero intra-cellulare, in grado di ridurre il trasporto del glucosio insulino-mediato all'interno della cellula. In questi pazienti è stato dimostrata un’aumentata secrezione di insulina conseguente ad aumentata resistenza periferica all'insulina stessa (10,11).
Nei pazienti affetti da iperprolattinemia è stata dimostrata una riduzione dei recettori cellulari per l'insulina, con valori glicemici più elevati rispetto ai pazienti sani. Tale condizione sembra essere correlata all’esposizione a livelli elevati di prolattinemia per lungo periodo (12).
La maggior parte dei farmaci indicati nella tabella si associa alla comparsa di diabete mellito nei pazienti affetti da una pre-esistente condizione di insulino-resistenza (13-16). Vacor e Pentamidina hanno invece azione distruttiva, e quindi permanente, sulle cellule β-pancreatiche (17-18). Gli analoghi della somatostatina inibiscono la secrezione di glucagone ed insulina, condizione che può favorire lo sviluppo di DM ma anche maggior rischio di ipoglicemia (2). La terapia a lungo termine con GH ricombinante umano nei pazienti affetti da deficit di tale ormone è in grado di causare un deterioramento dell'insulino-sensibilità a livello periferico, con possibile slatentizzazione di una pre-esistente intolleranza glucidica fino alla comparsa di DM conclamato (19).
Si è inoltre visto che alcune infezioni da agenti virali (quali CMV e rubeovirus nella sua forma congenita) sono in grado di determinare distruzione delle cellule β-pancreatiche e quindi diabete (20-22).
Bibliografia
- Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the Expert Committee on the Diagnosis and Classification of Diabetes mellitus. Diabetes Care 2000, 23 (suppl 1): S4-19.
- Resmini E, et al. Secondary diabetes associated with principal endocrinopathies: the impact of new treatment modalities. Acta Diabetol 2009, 46: 85-95.
- Cheng S, et al. Metabolic glucose status and pituitary pathology portend therapeutic outcomes in acromegaly. PLoS One 2013, 8: e73543.
- Sindelka G, et al. Insulin action in primary hyperaldosteronism before and after surgical or pharmacological treatment. Exp Clin Endocrinol Diabetes 2000, 108: 21-5.
- Fanelli CG, et al. Glucagon: the effects of its excess and deficiency on insulin action. Nutr Metab Cardiovasc Dis 2006, 16 suppl 1: S28-34.
- Wermers RA, et al. The glucagonoma syndrome: clinical and pathologic features in 21 patients. Medicine (Baltimore) 1996, 75: 53-63.
- Gierach M, Gierach J, Junik R. Insulin resistance and thyroid disorders. Endokrynol Polska 2014, 65: 70-6.
- Doar JW, Stamp TC, Wynn V, Audhya TK. Effects of oral and intravenous glucose loading in thyrotoxicosis. Studies of plasma glucose, free fatty acid, plasma insulin and blood pyruvate levels. Diabetes 1969, 18: 633-9.
- Dimitriadis GD, Raptis SA. Thyroid hormone excess and glucose intolerance. Exp Clin Endocrinol Diabetes 2001, 109 suppl 2: S225-39.
- Taylor WH, et al. Coincident diabetes mellitus and primary hyperparathyroidism. Diabetes Metab Res Rev 2001, 17: 175-80.
- Tassone F, et al. Insulin resistance is not coupled with defective insulin secretion in primary hyperparathyroidism. Diabet Med 2009, 26: 968-73.
- Schernthaner G, et al. Severe hyperprolactinaemia is associated with decreased insulin binding in vitro and insulin resistance in vivo. Diabetologia 1985, 28: 138-42.
- Donckier JE. Endocrine diseases and diabetes. In: Pickup JC, Williams G (eds). Textbook of diabetes. Blackwell Publishing 2003: 27.1–27.15.
- Pandit MK, Burke J, Gustafson AB, et al. Drug-induced disorders of glucose tolerance. Ann Int Med 1993, 118: 529-40.
- O'Byrne S, Feely J. Effects of drugs on glucose tolerance in non-insulin-dependent diabetes (parts I and II). Drugs 1990, 40: 203-19.
- Fabris P, Betterle C, Floreani A, et al. Development of type 1 diabetes mellitus during interferon alpha therapy for chronic HCV hepatitis. Lancet 1992, 340: 548.
- Bouchard P, Sai P, Reach G, et al. Diabetes mellitus following pentamidine-induced hypoglycemia in humans. Diabetes 1982, 31: 40-5.
- Gallanosa AG, Spyker DA, Curnow RT. Diabetes mellitus associated with autonomic and peripheral neuropathy after Vacor poisoning: a review. Clin Toxicol 1981, 18: 441-9.
- Rosenfalck AM, et al. The effect of 30 months of low-dose replacement therapy with recombinant human growth hormone (rhGH) on insulin and C-peptide kinetics, insulin secretion, insulin sensitivity, glucose effectiveness, and body composition in GH-deficient adults. J Clin Endocrinol Metab 2000, 85: 4173-81.
- Forrest, JA, Menser MA, Burgess JA. High frequency of diabetes mellitus in young patients with congenital rubella. Lancet 1971, 298: 332-4.
- King ML, Bidwell D, Shaikh A, et al. Coxsackie-B-virus-specific IgM responses in children with insulin-dependent (juvenile-onset; type I) diabetes mellitus. Lancet 1983, 321: 1397-9.
- Pak CY, Eun H, McArthur RG, Yoon J. Association of cytomegalovirus infection with autoimmune type 1 diabetes. Lancet 1988, 332: 1-4.
Diabete gestazionale
Matteo Bonomo
SSD Diabetologia - Centro Multidisciplinare Diabete e Gravidanza, ASST “Grande Ospedale Metropolitano Niguarda”, Milano
(aggiornato al 28 giugno 2021)
DEFINIZIONE
Diabete che compare durante la gestazione (quindi distinto dal diabete manifesto in gravidanza), causato da difetti funzionali analoghi a quelli del diabete tipo 2, diagnosticato per la prima volta in gravidanza, che in genere regredisce dopo il parto, per poi ripresentarsi, spesso a distanza, preferenzialmente con le caratteristiche del diabete tipo 2.
SCREENING E DIAGNOSI
L’orientamento oggi prevalente si rifà alle Raccomandazioni del Panel internazionale di esperti dell’IADPSG (International Association of Diabetes in Pregnancy Study Group), pubblicate nel 2010 (1), che, basandosi sui risultati dello studio internazionale HAPO (2), ha individuato un unico test diagnostico, consistente in una curva da carico di glucosio 75 g, con prelievi venosi per glicemia plasmatica ai tempi 0’, 60’ e 120’. Viene posta diagnosi di GDM quando anche un solo valore risulta uguale o superiore ai valori riportati nella tabella 1.
| Tabella 1 Cut-off diagnostici per GDM con OGTT 75 g |
|
| Minuto | Glicemia |
| 0 | ≥ 92 mg/dL (5.1 mmol/L) |
| 60 | ≥ 180 mg/dL (10.0 mmol/L) |
| 120 | ≥ 153 mg/dL (8.5 mmol/L) |
L’approccio basato su un singolo test (“one step”) è oggi adottato anche dall’Organizzazione Mondiale della Sanità (3) e dalla FIGO (Federazione Internazionale di Ostetricia e Ginecologia) (4), oltre che dalle Società Scientifiche diabetologiche italiane (5); questa scelta ha portato all’abbandono dell’iter in due fasi in uso precedentemente, che prevedeva uno screening con mini-carico di glucosio seguito da OGTT diagnostico nei soli casi positivi. In alcuni Paesi, fra i quali gli USA, il procedimento “two-step” è però ancora in uso, con buoni risultati sugli esiti a breve termine (6).
È in atto da decenni una discussione a livello internazionale oltre che sulle modalità di esecuzione, anche sull’estensione dello screening per GDM, se vada fatto su tutte le donne gravide (screening universale), o se ci si debba concentrare su alcune categorie a maggior rischio (screening mirato). Anche in Italia esistono posizioni discordanti sull’argomento, con spinte crescenti verso un approccio non selettivo (7); tuttavia, al momento rimane in vigore uno screening per fattori di rischio, per cui sono stati identificati due livelli di rischio:
- elevato (circa il 10% delle gestanti) nelle donne che presentano almeno una di queste condizioni:
- GDM in una gravidanza precedente;
- obesità (BMI ≥ 30 kg/m2);
- riscontro, precedentemente o all’inizio della gravidanza, di alterata glicemia a digiuno (IFG, glicemia compresa fra 100 e 125 mg/dL);
- intermedio, che si identifica con almeno una delle seguenti condizioni:
- età ≥ 35 anni;
- BMI pre-gravidico ≥ 25 kg/m2;
- macrosomia fetale in una gravidanza precedente (≥ 4.5 kg);
- GDM in una gravidanza precedente (questo era già fra i criteri del rischio elevato, ma ritorna qui nel caso che il test sia risultato normale alla 16°-18° settimana);
- parenti di primo grado con diabete tipo 2;
- famiglia originaria di aree ad alta prevalenza di diabete.
Lo screening deve essere eseguito:
- nelle donne con rischio elevato, in fase precoce di gravidanza, fra la 16° e la 18° settimana;
- in quelle a rischio intermedio, fra la 24° e la 28° settimana, quando lo devono ripetere quelle a rischio elevato risultate negative allo screening.
L’iter diagnostico complessivo è schematizzato nella figura 1.

Figura 1
Protocollo diagnostico attualmente utilizzato in Italia per l’iperglicemia in gravidanza
Iter semplificato in tempo di COVID-19
Contrariamente a quanto ritenuto inizialmente, con l’espandersi della pandemia da COVID-19 si è evidenziato che le gestanti che contraggono l’infezione possono, in una minoranza di casi, andare incontro a serie complicanze, comprese gravi polmoniti, malattie cardio-vascolari e trombotiche, disfunzioni multi-organo, eventi ostetrici negativi ed anche morte materna (8). Conseguenze negative possono anche verificarsi sull’esito fetale e neonatale, con frequente parto pre-termine, polmoniti e, raramente, morte (9).
In quest’ottica, è presto apparsa chiara la necessità di porre la massima attenzione nel limitare le occasioni di contagio per le donne in gravidanza, con una sostanziale modifica nelle abituali procedure di accesso ai servizi sanitari, riducendo frequenza e durata di permanenza in ambienti affollati potenzialmente ad elevato rischio di infezione, quali ambulatori ospedalieri e territoriali, laboratori di analisi, sale d’aspetto, ecc. Anche per il GDM, questo ha portato le principali Società Scientifiche del settore (10,11) a riconsiderare temporaneamente le modalità di screening e diagnosi e, nei casi positivi, i metodi di gestione clinica pre-natale, al parto e nell’immediato post-parto. Le criticità individuate e le proposte avanzate conseguono a una valutazione non semplice del rapporto fra l’accertata entità clinica di questa alterazione metabolica, comportante potenziali e seri rischi a carico della madre e del concepito, evitabili con una pronta diagnosi e un’adeguata terapia, e l’esigenza di ridurre al minimo le occasioni di contagio durante l’intero arco della gestazione. Partendo da questi presupposti, in Italia, AMD (Associazione Medici Diabetologi) e SID (Società Italiana di Diabetologia) hanno pubblicato specifiche raccomandazioni sulla gestione clinica (12) e, nel maggio 2020, un “Position Statement” congiunto (13), dove vengono indicate le seguenti possibili modificazioni dell’approccio diagnostico, da attuare “nel caso in cui il team ravveda un rapporto rischio/beneficio sfavorevole relativamente all’esposizione della donna gravida al pericolo di contagio e/o qualora il Sistema Sanitario debba erogare prestazioni in modo limitato”:
- nulla di modificato per la diagnosi di diabete manifesto;
- quando la procedura di screening non può essere eseguita in sicurezza, si ritiene accettabile la diagnosi di GDM se il valore della glicemia plasmatica a digiuno è ≥ 92 mg/dL. Perché il dato sia accettabile come diagnosi, la valutazione deve essere eseguita esclusivamente nelle finestre temporali raccomandate in relazione ai fattori di rischio definiti dalle linee-guida. Tuttavia, è importante sottolineare che questa procedura, limitata alla glicemia basale, sottostima la diagnosi di GDM. Inoltre, l’esecuzione dell’intero test permette di identificare disturbi metabolici che hanno un diverso impatto clinico.
DOPO LA DIAGNOSI DI GDM: CONTROLLO E GESTIONE
Organizzazione dell’assistenza
Una gestione corretta del GDM non richiede solitamente ricoveri ospedalieri (se non per il parto), ma può e deve essere prevalentemente ambulatoriale, limitando il ricorso al ricovero a casi particolari e comunque per il tempo strettamente necessario.
In una gestione ambulatoriale ottimale, gli specialisti di riferimento devono essere almeno due, diabetologo e ginecologo, ambedue esperti nella materia e operanti in stretta collaborazione. Dove possibile, è certamente preferibile la gestione da parte di un centro dedicato interdisciplinare; è in ogni caso fondamentale l’approccio multi-specialistico.
Controllo e auto-controllo
La valutazione del controllo metabolico, e le conseguenti decisioni sulla gestione terapeutica, si basano essenzialmente sui livelli di glicemia materna; considerata la riduzione della soglia renale per il glucosio in gravidanza, la valutazione della glicosuria ha scarso significato clinico, e non deve essere considerata un parametro affidabile.
Anche un indice di controllo retrospettivo a medio termine come la HbA1c, fondamentale nel monitoraggio metabolico fuori dalla gravidanza, risulta di utilità limitata durante la gestazione e non può essere utilizzato per guidare i frequenti adeguamenti terapeutici necessari in questa situazione. Questo vale a maggior ragione nel GDM, dove le rapide variazioni di un’alterazione metabolica solitamente modesta rischiano di non essere evidenziate in modo adeguato. La HbA1c mantiene comunque un suo ruolo, ad integrazione del dato glicemico (14), tenendo però conto che i valori di normalità nella donna gravida sono inferiori rispetto a quelli riscontrati fuori dalla gravidanza: secondo quanto emerso da uno studio multicentrico italiano nelle gestanti non diabetiche, il parametro si situa su un valore mediano di 29 mmol/mol (4.8%), con range 13-39 mmol/mol (3.3-5.7%) (15). L’obiettivo da perseguire deve, pertanto, essere più basso di quello extra-gravidanza, e comunque < 42 mmol/mol (< 6%) (16).
Fondamentale è dunque l’auto-controllo domiciliare della glicemia (SMBG), che deve essere iniziato immediatamente dopo la diagnosi, secondo schemi concordati con l’équipe curante in funzione della forma clinica, della terapia in corso, dell’andamento della crescita fetale. Nelle pazienti in terapia solo dietetica è solitamente sufficiente uno schema a “scacchiera” (tab 2), con controlli quotidiani al mattino al risveglio, e misurazioni effettuate a rotazione dopo uno dei 3 pasti principali, a distanza di 1 ora, con un profilo completo ogni 4 giorni.
| Tabella 2 SMBG nel Diabete Gestazionale in trattamento dietetico |
||||||||
| Giorno | Risveglio a digiuno | Dopo colazione | Pre-pranzo | Dopo pranzo | Pre-cena | Dopo cena | Prima di coricarsi | Durante la notte |
| 1 | √ | √ | ||||||
| 2 | √ | √ | ||||||
| 3 | √ | √ | √ | |||||
| 4 | √ | √ | √ | √ | ||||
| 5 | √ | √ | √ | |||||
| 6 | √ | √ | ||||||
| 7 | √ | √ | ||||||
In tutte le forme trattate con insulina devono invece essere applicati protocolli intensificati, analoghi a quelli indicati per il diabete pre-gestazionale: in questi casi i controlli vanno effettuati quotidianamente al risveglio e 1 ora dopo i 3 pasti principali, aggiungendo, in funzione della complessità del quadro clinico, eventuali misurazioni pre-prandiali, al momento di coricarsi, e anche notturni (tab 3) (17).
| Tabella 3 SMBG nel Diabete Gestazionale in trattamento insulinico |
||||||||
| Giorno | Risveglio a digiuno | Dopo colazione | Pre-pranzo | Dopo pranzo | Pre-cena | Dopo cena | Prima di coricarsi | Durante la notte |
| 1 | √ | √ | ○ | √ | ○ | √ | ○ | ○ |
| 2 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| 3 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| 4 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| 5 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| 6 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| 7 | √ | √ | ○ | √ | ○ | √ | ○ | + |
| ○ da valutare in base alla situazione clinica + in casi di particolare complessità |
||||||||
Gli obiettivi glicemici sono più rigorosi rispetto a quelli ricercati nel diabete fuori dalla gravidanza, sia a digiuno sia dopo i pasti (più significativo il valore dopo 1 ora dal pasto). Attualmente questi sono i valori raccomandati nel nostro Paese (18):
- a digiuno: ≤ 90 mg/dL;
- un’ora dopo i pasti: ≤ 130 mg/dL;
- due ore dopo i pasti: ≤ 120 mg/dL.
Questi livelli vanno perseguiti se compatibili con un adeguato accrescimento fetale e con un rischio non aumentato di ipoglicemia (in alcuni casi, in presenza di scarso accrescimento del feto si preferisce mantenere obiettivi leggermente superiori).
Altro parametro che va monitorato regolarmente nel GDM, come in tutte le forme di diabete in gravidanza, è la produzione di corpi chetonici (19), da dosare quotidianamente sulle urine del mattino o su sangue capillare. La chetosi può essere dannosa per il feto, e va quindi evitata, anche se la sua presenza occasionale non deve essere considerata preoccupante.
TERAPIA
Gestione terapeutica complessiva
È ormai ampiamente dimostrato come nelle gravidanze complicate da GDM sia fondamentale un intervento terapeutico efficace, anche in assenza di alterazioni metaboliche maggiori, per assicurare un esito positivo, riducendo significativamente il rischio di complicazioni perinatali (20,21). A conferma di ciò stanno anche i risultati dello studio HAPO (2), che ha documentato un rapporto lineare fra livelli glicemici ed esiti ostetrici e neonatali.
L’obiettivo del controllo glicemico nella terapia nel GDM, come in qualsiasi forma di diabete in gravidanza, è quindi di permettere regolare sviluppo e crescita del feto e normale decorso della gravidanza per la madre. Nella maggior parte dei casi questo è possibile con una terapia medica nutrizionale personalizzata e con un programma di attività fisica regolare, oltre che con l’auto-controllo glicemico domiciliare. Solo nel caso che gli obiettivi glicemici non vengano raggiunti con questo intervento sullo stile di vita eseguito correttamente, deve essere iniziata una terapia farmacologica, che allo stato attuale, nel nostro Paese può essere solo insulinica. In Italia, infatti, non sono autorizzati in gravidanza metformina e altri farmaci anti-diabetici non insulinici (18). Qualunque terapia in atto prima del concepimento per altre patologie concomitanti (ipertensione, iperlipidemia, tireopatie) deve essere rivalutata da parte dell’équipe curante.
Alimentazione
La donna con GDM deve ricevere un’alimentazione con contenuto calorico adatto ad assicurare un’ottimale nutrizione materna e fetale, tenendo conto dello stato di nutrizione pre-concepimento, indicato dal BMI. Come indicato nella tabella 4, basata sui dati del National Research Council USA (22) e riportata anche negli Standard italiani 2018 (18), l’entità dell’aumento di peso in gravidanza può variare in funzione del BMI pre-gravidanza. L’aumento ponderale nel primo trimestre dovrebbe essere compreso fra 0.5 e 2 kg; al fabbisogno energetico riportato in tabella vanno poi aggiunte circa 340 kcal/die nel secondo trimestre di gravidanza e 450 kcal/die nel terzo trimestre (valori orientativi per le donne normopeso, adattabili anch’essi in funzione del BMI).
| Tabella 4 Fabbisogno energetico e incremento ponderale raccomandato in gravidanza |
||||
| Fenotipo | BMI (kg/m2) | Fabbisogno energetico (kcal/kg/die) | Aumento ponderale a termine (kg) | Aumento ponderale nel II e III trimestre (kg/settimana) |
| Sottopeso | < 18.5 | 40 | 12.5-18 | 0.51 (0.44-0.58) |
| Normopeso | 18.5-24.9 | 30 | 11.5-16 | 0.42 (0.35-0.50) |
| Sovrappeso | 25-29.9 | 24 | 7-11.5 | 0.28 (0.23-0.33) |
| Obesità | ≥ 30 | 12-24 | 5-9 | 0.22 (0.17-0.27) |
L’alimentazione, personalizzata in funzione delle abitudini alimentari, culturali ed etniche, deve avere un apporto calorico, vitaminico e minerale tale da garantire un controllo glicemico ottimale senza determinare chetosi (23). Un rapporto equilibrato fra i diversi macronutrienti prevede circa 50% di carboidrati (complessi, a basso indice glicemico), 20% di proteine, 30% di lipidi (mono- e poli-insaturi) e una quantità di fibre di almeno 28 g/die. Considerando il tempo limitato della gestazione, per ridurre le escursioni glicemiche post-prandiali si può prevedere una riduzione della quota di carboidrati, che comunque non deve essere < 40%.
Attività fisica
L’attività fisica è consigliata durante la gravidanza in tutte le donne, ma in particolar modo in quelle con GDM. È in grado di migliorare la sensibilità insulinica e il controllo della glicemia e di contenere l’incremento ponderale; riduce la necessità di ricorrere alla terapia insulinica e, nel caso, consente di tenerne dosaggi più bassi (24). Inoltre, può ridurre sensibilmente il rischio di macrosomia e parto pre-termine.
In assenza di contro-indicazioni (tab 5), in gravidanza vanno quindi incoraggiati e praticati con regolarità attività fisica nel tempo libero o esercizio secondo programmi stabiliti. La maggior parte delle donne con GDM può effettuare in sicurezza attività aerobiche (ad esempio nuoto, cammino), con intensità da leggera a moderata; sono consentite e utili anche attività di forza. Vanno ovviamente evitate attività con elevato rischio di caduta (equitazione, sci alpino, ecc.) o di trauma addominale.
| Tabella 5 Contro-indicazioni all’attività fisica in gravidanza (modificata da 24) |
|
| Relative | Precedenti aborti spontanei Precedenti parti pre-termine Malattie cardio-respiratorie lievi-moderate (ipertensione, asma, …) Disordini alimentari o malnutrizione Gravidanza gemellare (dalla 28a settimana) Grande obesità (BMI > 40) Anemia (Hb ≥ 10 g/dL) Tireopatie di grado lieve-moderato |
| Assolute | Sanguinamenti vaginali Rottura delle membrane Attività contrattile prematura Placenta previa Incontinenza della cervice, cerchiaggio Ritardo di crescita intra-uterino Pre-eclampsia Gravidanza multipla (> 2) Malattie cardio-respiratorie di grado severo Grave anemia (Hb < 10 g/dL) Tireopatie severe Grave scompenso diabetico |
Terapia insulinica
Anche se in altri Paesi si hanno numeri maggiori, in Italia la percentuale di donne con diabete gestazionale trattate con insulina è modesta, oscillante intorno al 20-30% (25). Salvo casi poco frequenti, questa esigenza è limitata al periodo della gestazione, e la terapia insulinica potrà essere sospesa dopo il parto.
Per l’uso in gravidanza sono autorizzati diversi analoghi dell’insulina, che sono oggi considerati i preparati di scelta, perché presentano diversi vantaggi sulle insuline tradizionali:
- analoghi long-acting: i dati pubblicati indicano che Levemir e Glargine possono essere usate senza problemi, mentre sono ancora insufficienti le evidenze su Degludec; non ci sono problemi con Glargine 300 e con i biosimilari;
- analoghi rapidi: si possono utilizzare in piena sicurezza Lispro, Aspart e Aspart Fast-Acting, mentre continuano a non esserci sufficienti dati per Glulisina.
Gli schemi di somministrazione non sono rigidi, ma personalizzati in funzione dell’andamento glicemico: si può quindi andare da una mono-somministrazione di solo analogo long-acting all’uso di sola insulina rapida prima di 1, 2 o 3 pasti, fino a schemi basal-bolus completi, del tutto sovrapponibili a quelli utilizzati nel diabete pre-gestazionale (26).
L’esigenza di mantenere uno stretto controllo glicemico anche durante il travaglio e il parto (70-120 mg/dL) può richiedere, nelle donne insulino-trattate, il ricorso ad infusione di insulina ev ed eventualmente di glucosio ev, regolata secondo specifici algoritmi (tabella 6).
| Tabella 6 Esempio di algoritmo terapeutico durante il travaglio e il parto di donne con diabete gestazionale (mod da 10) |
|
|
In doppia via d'infusione:
|
|
| Glicemia capillare (mg/dL) | Insulina (U/h) |
| < 80 | stop |
| 81-100 | 0.5 |
| 101-140 | 1.0 |
| 141-180 | 1.5 |
| 181-220 | 2.0 |
| > 220 | 2.5 |
DOPO IL PARTO
Anche se nella maggior parte dei casi il controllo glicemico si normalizza dopo il parto, le donne che hanno avuto un GDM presentano un rischio circa 10 volte più elevato di sviluppare successivamente alterazioni del metabolismo glucidico come pre-diabete e diabete mellito tipo 2 (27). C’è anche un netto aumento del rischio di malattie cardio-vascolari, non necessariamente legato alla comparsa di diabete conclamato (28).
La situazione glico-metabolica della donna va dunque tenuta sotto regolare controllo: è raccomandata l’esecuzione di un primo OGTT dopo 6-12 settimane dal parto e, se il test risulta normale, la sua ripetizione ogni 2-3 anni. C’è inoltre il rischio elevato che il GDM si ripresenti in occasione di una gravidanza successiva: in questa eventualità, la donna dovrà quindi effettuare lo screening in fase precoce.
Infine, in conseguenza dell’esposizione all’iperglicemia in utero, problemi metabolici possono riguardare anche la prole, con aumentata frequenza di obesità già nei primi anni di vita, alterazioni precoci della tolleranza glucidica e successiva comparsa di diabete tipo 2, oltre a patologie cardio-vascolari nella vita adulta (29,30). Sono pertanto essenziali a scopo preventivo il mantenimento di uno stile di vita salutare e l’effettuazione di regolari controlli durante la crescita.
BIBLIOGRAFIA
- International Association of Diabetes Pregnancy Study Groups Consensus Panel, Metzger BE, Gabbe SG, Persson B, et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010, 33: 676-82.
- The HAPO Study Cooperative Research Group. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008, 358: 1991-2002.
- Colagiuri S, Falavigna M, Agarwal MM, et al. Strategies for implementing the WHO diagnostic criteria and classification of hyperglycaemia first detected in pregnancy. Diabetes Res Clin Pract 2014, 103: 364-72.
- Hod M, Kapur A, Sacks DA, et al. The International Federation of Gynecology and Obstetrics (FIGO) Initiative on gestational diabetes mellitus: A pragmatic guide for diagnosis, management, and care. Int J Gynaecol Obstet 2015, 131 suppl 3: S173-211.
- Ministero della Salute. Linea-guida gravidanza fisiologica. 2011 update. Diagnosi del diabete gestazionale, vol 13, pp 169–173.
- Hillier TA, Pedula KL, Ogasawara KK, et al. A pragmatic, randomized clinical trial of gestational diabetes screening. N Engl J Med 2021, 384: 895-904.
- Vitacolonna E, Succurro E, Lapolla A, et al. Guidelines for the screening and diagnosis of gestational diabetes in Italy from 2010 to 2019: critical issues and the potential for improvement. Acta Diabetol 2019, 56: 1159-67.
- La Verde M, Riemma G, Torella M, et al. Maternal death related to COVID-19: A systematic review and meta-analysis focused on maternal co-morbidities and clinical characteristics. Int J Gynaecol Obstet 2021, DOI: 10.1002/ijgo.13726.
- Schwartz DA, Dhaliwal A. Coronavirus diseases in pregnant women, the placenta, fetus, and neonate. Adv Exp Med Biol 2021, 1318: 223-41.
- Royal College of Obstetricians and Gynaecologists. Guidance for maternal medicine in the evolving coronavirus (COVID-19) pandemic - Information for Healthcare Professionals ch. 30/03/2020, RCOG, London, 2020: pp 1-40.
- Poon LC, Yang H, Kapur A, et al. Global interim guidance on coronavirus disease 2019 (COVID-19) during pregnancy and puerperium from FIGO and allied partners: Information for healthcare professionals. Int J Gynaecol Obstet 2020, 149: 273-86.
- Torlone E, Sculli MA, Bonomo M, et al. Recommendations and management of hyperglycaemia in pregnancy during COVID-19 pandemic in Italy. Diabetes Res Clin Pract 2020, 166: 108345.
- Torlone E, Festa C, Formoso G, et al. Italian recommendations for the diagnosis of gestational diabetes during COVID-19 pandemic: Position statement of the Italian Association of Clinical Diabetologists (AMD) and the Italian Diabetes Society (SID), Diabetes and Pregnancy Study Group. Nutr Metab Cardiovasc Dis 2020, 30: 1418-22.
- Jovanovic L, Savas H, Mehta M, et al. Frequent monitoring of A1c during pregnancy as a treatment tool to guide therapy. Diabetes Care 2011, 34: 53-4.
- Mosca A, Paleari R, Dalfrà MG, et al. Reference intervals for hemoglobin A1c in pregnant women: data from an Italian multicenter study. Clin Chem 2006, 2: 1138-43.
- American Diabetes Association. Management of diabetes in pregnancy: Standards of Medical Care in Diabetes – 2021. Diabetes Care 2021: 44 suppl 1: S200-1
- AMD–SID–SIEDP–OSDI–SIBioC–SIMeL. Raccomandazione per l’autocontrollo della glicemia nel paziente diabetico. 2012: 17-19.
- AMD-SID. Cura del diabete prima e durante la gravidanza. Standard di cura AMD-SID 2018: 247-67.
- Jovanovic L. Medical management of pregnancy complicated by diabetes. ADA, Alexandria, Virginia. 4th ed.
- Crowther CA, Hiller JE, Moss JR, et al; for the Australian Carbohydrates Intolerance Study in Pregnant Women (ACHOIS) Trial Group. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med 2005, 352: 2477-86.
- Landon MB, Spong CY, Thom E, et al. A multicenter, randomized trial of treatment for mild gestational diabetes. N Engl J Med 2009, 361: 1339-48.
- The National Academies of Sciences, Engineering, Medicine. Weight gain during pregnancy: reexamining the guidelines. Washington, DC: The National Academies Press 2009.
- Lapolla A, Dalfrà MG, Fatati G, Parillo M. La dieta nel diabete pregravidico e gestazionale. In: SID-AMD-ADI, Alimentazione in gravidanza, 2014: 24-35.
- Di Biase N, Balducci S, Lencioni C, et al. Gruppi di studio interassociativi “SID-AMD” Diabete e Gravidanza ed Attività Fisica. Attività fisica nella gravidanza di donne con diabete. Il Diabete 2017, 29: 209-22.
- Lapolla A, Dalfra MG, Bonomo M, et al. Scientific Committee of GISOGD Group. Gestational diabetes mellitus in Italy: A multicenter study. Eur J Obstet Gynecol Reprod Biol 2009, 145: 149–53.
- Pintaudi B, Bonomo M. Pharmacological treatment of gestational diabetes mellitus: when lifestyle intervention is not enough. In: Lapolla A, Metzger B (eds), Gestational Diabetes A Decade after the HAPO Study. Front Diabetes 2020, 28: 61-75.
- Vounzoulaki E, Khunti K, Abner SC, et al. Progression to type 2 diabetes in women with a known history of gestational diabetes: systematic review and meta-analysis. BMJ 2020, 369: m1361.
- Kramer CK, Campbell S, Retnakaran R. Gestational diabetes and the risk of cardiovascular disease in women: a systematic review and meta-analysis. Diabetologia 2019, 62: 905-14.
- Lowe WL Jr, Scholtens DM, Kuang A, et al. Hyperglycemia and Adverse Pregnancy Outcome Follow-up Study (HAPO FUS): maternal gestational diabetes and childhood glucose metabolism. Diabetes Care 2019, 42: 372-80.
- Leybovitz-Haleluya N, Wainstock T, Landau D, Sheiner E. Maternal gestational diabetes mellitus and the risk of subsequent pediatric cardiovascular diseases of the offspring: a population-based cohort study with up to 18 years of follow up. Acta Diabetol 2018, 55: 1037-42.
LADA (Latent Autoimmune Diabetes in Adults)
Michela Del Prete
ASST Lariana, SC Endocrinologia, Diabetologia, Nutrizione Clinica, Ospedale Sant’Anna, San Fermo della Battaglia (Como)
(aggiornato al gennaio 2026)
Definizione ed epidemiologia
II LADA, acronimo di Latent Autoimmune Diabetes in Adults, è una particolare forma di diabete mellito (DM) autoimmune che colpisce soggetti adulti ed è talvolta chiamato anche DM 1.5. La maggior parte dei pazienti presenta un processo autoimmune indolente e uno scompenso metabolico più lieve alla diagnosi rispetto ai pazienti con DM a esordio giovanile. Il LADA è considerato dall’American Diabetes Association come una forma di DM1, mentre per l’organizzazione mondiale della sanità rappresenta una forma a sè stante.
La diagnosi viene presa in considerazione in pazienti di età > 30 anni; di solito non è necessaria terapia insulinica per almeno 6 mesi dalla diagnosi, nonostante la presenza di positività anticorpale.
La prevalenza del LADA è compresa tra il 2 e il 12% delle diagnosi di DM. In Italia corrisponde circa al 5% delle diagnosi di DM in età adulta.
Fisiopatologia
L'insorgenza sembrerebbe indotta da un’interazione complessa tra background genetico, stile di vita, fattori immunitari e ambientali (1,2).
Recentemente le forme di DM di origine autoimmune sono state classificate in differenti endotipi e il LADA sembrerebbe far parte dell’endotipo 3-5, caratterizzato da distruzione più lenta delle ß-cellule nell'età adulta, che spesso coinvolge diverse cellule del sistema immunitario, come macrofagi, neutrofili, cellule natural killer e cellule dendritiche.
È presente insulite, come dimostrato anche in studi scintigrafici (3,4).
Storia naturale
Può essere suddivisa in periodi di insulino-indipendenza e insulino-dipendenza, a seconda del grado di distruzione delle ß-cellule pancreatiche (3-4). Esiste una grande eterogeneità nella progressione verso l’insulino-dipendenza, che può variare in base all'età di esordio, all'indice di massa corporea e agli altri fattori sovra-riportati coinvolti nella patogenesi (1,2).
Genetica
il rischio maggiore si osserva nei soggetti portatori degli aplotipi HLA-DRB1*04-DQB1*03:02 e HLADRB1*03:01-DQB1*02:01, aplotipi condivisi anche con il DM1.
Sono note ulteriori varianti al di fuori della regione HLA, come ad esempio PTPN22, INS, CTLA4 e SH2B3.
Il rischio di insorgenza può risultare aumentato anche in presenza delle varianti nel gene TCF7L2, presente anche in pazienti con DM2.
In conclusione, le persone con LADA possono condividere caratteristiche genetiche sia con il DM1 che con il DM2.
Diagnostica immunologica
Circa il 90% dei pazienti con LADA presenta positività degli auto-anticorpi anti-GAD. Altri auto-anticorpi hanno come bersaglio diversi epitopi IA-2 (IA-2A), l'insulina (IAA), l'isoforma 8 del trasportatore di zinco specifico per le isole pancreatiche (ZnT8A) e la tetraspanina 7. L'auto-anticorpo che riconosce l'epitopo IA-2IC è il più utilizzato per la diagnosi di DM1 a esordio giovanile e identifica il LADA con sensibilità di circa il 30% e specificità del 100%.
Nel LADA è aumentato il riscontro di altri auto-anticorpi organo-specifici e di malattie autoimmuni. Gli auto-anticorpi anti-GAD correlano più frequentemente con la copresenza di auto-immunità tiroidea, mentre gli auto-anticorpi IA-2 conferiscono un rischio elevato di celiachia (5,6).
Differenze tra DM1, DM2 e LADA
Il LADA comprende un ampio spettro di fenotipi eterogenei. Circa il 10% dei pazienti presenta un esordio simile al classico DM1 diagnosticato in giovane età, mentre il rimanente 90% esordisce con manifestazioni cliniche più lievi.
| Caratteristiche differenziali del LADA (nessuna di queste caratteristiche lo definisce categoricamente) |
|
|
|
|
Rispetto al DM1 (che è più frequente in giovane età, con esordio acuto, con sintomi e segni legati iperglicemia e iperchetonemia, quali poliuria, polidipsia, perdita di peso, cheto-acidosi):
|
Rispetto al DM2:
|
Approccio terapeutico
Spesso i pazienti con LADA ricevono inizialmente una diagnosi errata di DM2 e vengono trattati sin da subito con metformina. Ad oggi non sono disponibili molte evidenze scientifiche sull’uso della metformina in pazienti con LADA, così come sull'utilizzo del pioglitazone, nonostante il noto potenziale effetto protettivo sulla ß-cellula.
Sono invece disponibili diversi studi sull’efficacia dei farmaci incretinici, come le gliptine, da sole o in associazione alla vitamina D, per la sua potenziale azione immuno-modulatrice. Sono inoltre disponibili dati limitati, seppur positivi, per gli agonisti GLP-1 sul controllo glicemico e sul deterioramento delle ß-cellule pancreatiche.
Sono infine disponibili studi recenti promettenti sull’utilizzo di agenti immuno-modulatori.
La terapia del LADA dovrebbe essere impostata sulla base delle caratteristiche cliniche, metaboliche e fisiopatologiche di ogni singolo paziente. Il dosaggio del C-peptide è stato proposto come principale indicatore dell’andamento della funzione ß-cellulare nel tempo. La sua concentrazione può infatti risultare utile per decidere se e quando introdurre la terapia insulinica (2,7):
- concentrazioni < 0.3 nmol/L (< 0.9 ng/mL) dovrebbero indirizzare verso una terapia insulinica multi-iniettiva;
- concentrazioni tra 0.3 e 0.7 nmol/L (0.9-2.1 ng/mL), definite come “zona grigia”, dovrebbero indirizzare verso un algoritmo terapeutico ADA/EASD modificato rispetto a quello raccomandato per il DM2, che possa prevedere l'iniziale utilizzo combinato di insulina basale e metformina e/o l’aggiunta di altri agenti ipoglicemizzanti con comprovati effetti benefici CV e renali, come GLP-1 RA, gliptine, pioglitazone e gliflozine (da utilizzare solo in pazienti con BMI > 27 kg/m2 per evitare il possibile rischio di cheto-acidosi), evitando l'uso di sulfaniluree che potrebbero determinare un ulteriore deterioramento della funzionalità delle ß-cellule pancreatiche;
- concentrazioni > 0.7 nmol/L (> 2.1 ng/mL) dovrebbero indirizzare verso l’uso dell’algoritmo terapeutico consigliato per il DM2.
Conclusioni
Il LADA è una malattia eterogenea, che comprende un ampio spettro di caratteristiche cliniche e metaboliche. Per tali motivi, non esiste ancora una strategia terapeutica univoca per questa tipologia di pazienti.
Il cardine della gestione terapeutica rimane la preservazione della funzione ß-cellulare e il prolungamento dell’indipendenza dall’insulina, offrendo un eccellente controllo metabolico e migliorando la storia naturale della malattia. L’insulina deve essere iniziata non appena necessario sulla base dei livelli di C-peptide (sempre se < 0.3 nmol/L - 0.9 ng/mL). Altri agenti euglicemizzanti sembrano esercitare effetti benefici sul controllo glicemico nel LADA, mentre gli agenti immuno-modulatori, seppur promettenti, richiedono ulteriori studi clinici per dimostrarne efficacia e sicurezza.
Bibliografia
- Yin W, Luo S, Xiao Z, et al. Latent autoimmune diabetes in adults: a focus on ß-cell protection and therapy. Front Endocrinol 2022, 13: 959011.
- Buzzetti R, Tuomi T, Mauricio D, et al. Management of latent autoimmune diabetes in adults: a consensus statement from an international expert panel. Diabetes 2020, 69: 2037–47.
- Jörns A, Wedekind D, Jähne J, Lenzen S. Pancreas pathology of latent autoimmune diabetes in adults (LADA) in patients and in a LADA rat model compared with type 1 diabetes. Diabetes 2020, 69: 624–33.
- Signore A, Capriotti G, Chianelli M, et al. Detection of insulitis by pancreatic scintigraphy with 99mTc-labeled IL-2 and MRI in patients with LADA (Action LADA 10). Diabetes Care 2015, 38: 652–8.
- Agardh CD, Cilio CM, Lethagen A, et al. Clinical evidence for the safety of GAD65 immunomodulation in adult-onset autoimmune diabetes. J Diabetes Complications 2005, 19: 238–46.
- Cousminer DL, Ahlqvist E, Mishra R, et al. First genome-wide association study of latent autoimmune diabetes in adults reveals novel insights linking immune and metabolic diabetes. Diabetes Care 2018, 41: 2396–403.
- Maddaloni E, Buzzetti R. L’eterogeneità del diabete autoimmune. Il Diabete 2023, 35: N. 3, ottobre.
Criteri diagnostici per il diabete
Alberto Blatto
SC Endocrinologia e Malattie Metaboliche, Ospedale Maria Vittoria, Torino
(aggiornato al 31 maggio 2021)
Gli Standards of Medical Care ADA 2021 (1-2), analogamente ai contenuti degli Standard Italiani AMD-SID (ultima versione 2018) (3), chiariscono che la diagnosi di diabete si basa su criteri cosiddetti “glicemici”, in particolare sul valore di glicemia a digiuno e 2 ore dopo OGTT e sul dosaggio di HbA1c:
- glicemia a digiuno (dopo almeno 8 ore di astensione dal cibo): valore diagnostico ≥ 126 mg/dL (≥ 7 mmol/L); esame da ripetere 2 volte in assenza di sintomi suggestivi; (livello della prova III, forza della raccomandazione A);
- glicemia 2 ore dopo OGTT (dettagli sulle modalità di esecuzione): valore diagnostico se ≥ 200 mg/dL (≥ 11.1 mmol/L), in presenza di sintomatologia suggestiva (poliuria, polidipsia e calo ponderale) (livello della prova III, forza della raccomandazione A); se valori compresi fra 140 mg/dL (7 mmol/L) e 199 mg/dL (11 mmol/L) si pone diagnosi di IGT (impaired glucose tolerance);
- glicemia casuale (indipendentemente dall’assunzione di cibo), anche in una singola valutazione, ≥ 200 mg/dL (≥ 11.1 mmol/L), in presenza di sintomatologia suggestiva (poliuria, polidipsia e calo ponderale) (livello della prova III, forza della raccomandazione A);
- HbA1c > 6.5% (≥ 47 mmol/mol), da ripetere due volte in assenza di sintomi suggestivi. L’utilizzo di Hb glicata per la diagnosi di diabete è stato introdotto nel 2009, da parte di un comitato di esperti proposti da ADA (American Diabetes Association), EASD (European Association for the Study of Diabetes) e IDF (International Diabetes Federation). Il cut-off di 6.5% è stato scelto utilizzando l’osservazione della relazione tra valori di Hb glicata e la prevalenza di retinopatia diabetica, marcatore di malattia, praticamente assente al di sotto di 6.5%. Hb glicata deve essere dosata con metodo certificato da NGSP (National Glycohemoglobin Standardization Program) e allineato a IFCC (International Federation of Clinical Chemistry) e stanzardizzata agli assay DCCT (Diabetes Control and Complication trial) (4,5). Sono ancora da definire nei particolari eventuali interferenze dipendenti dalla diversa etnia.
La letteratura scientifica ha lungamente commentato questi criteri diagnostici. Nella tabella vengono presentati i “pro e contro” che caratterizzano i metodi diagnostici citati.
| Valutazione comparata dei parametri diagnostici biochimici | ||
| Pro | Contro | |
| Glicemia a digiuno | Dosaggi del glucosio facilmente automatizzati. Esame poco costoso e largamente disponibile. Necessità di un unico campione ematico. |
Variabilità biologica (inter e intra-individuale). Variabilità pre-analitica: uso di medicinali, stasi venosa, cura del campione, digiuno non corretto (almeno 8 ore prima del prelievo), esercizio fisico, malattie intercorrenti, stress acuto (prelievo!), variazione diurna, diete fortemente ipocaloriche iniziate 7 o più giorni prima dell’esame, glicolisi (utilizzare fluoruro di sodio? ghiaccio? acidificazione del campione?) e natura del campione utilizzato (sangue intero, siero, plasma). Variabilità analitica: accuratezza e precisione (ripetibilità) ridotte da assenza di programmi di standardizzazione dei risultati tra differenti strumenti e differenti laboratori, variazione tra i differenti lotti di calibratori. |
| OGTT | Valuta l’efficienza del pancreas nel metabolizzare il glucosio (e un aumento della glicemia post-prandiale si presenta prima dell’aumento a digiuno). Rivela se un soggetto abbia IGT (impaired glucose tolerance), cioè alto rischio di sviluppare diabete, ma soprattutto malattia CV. Stabilisce se un soggetto sia IFG (impaired fasting glucose) & IGT, a peggior prognosi per duplice alterazione fisiopatologica (secrezione e sensibilità all’insulina). |
Scarsa riproducibilità (coefficiente di variabilità intra-individuale del 16.7%). Necessità di preparazione e modalità precise (vedi). “Time consuming”. Non ben accettata dal paziente. Scarsamente palatabile e costosa. Influenzata da numerosi medicamenti. |
| HbA1c | Minore variabilità biologica e minore instabilità pre-analitica. Meno influenzata dalla variabilità glicemica. Non necessita di prelievo a digiuno. Ampiamente usata per guidare il trattamento farmacologico. |
Risultato forse alterato in varie condizioni: gravidanza (specie nel II e III trimestre e nel post-partum), diabete di tipo 1 in rapida evoluzione, emoglobinopatie (HbS, HbC), anemia emolitica, anemia carenziale, sanguinamenti recenti, trasfusioni, HIV, emodialisi, largo uso di aspirina, grave ipertrigliceridemia, iperbilirubinemia, terapia con eritropoietina e uremia. |
Non sono ammessi per la diagnosi: glicemia post-prandiale, profilo glicemico, insulinemia basale o dopo OGTT, C-peptide (né basale né dopo stimolo; il C peptide rappresenta un indice di funzionalità secretoria insulinica pancreatica), auto-anticorpi (vedi oltre) e glicemia su sangue capillare (livello della prova III, forza della raccomandazione E).
I criteri “glicemici” e di HbA1c hanno permesso di evidenziare altri stadi di alterazione glicemica, riuniti sotto la condizione di “pre-diabete”:
- alterata glicemia a digiuno (IFG, impaired fasting glucose): glicemia a digiuno 100-125 mg/dL (l’OMS indica per IFG valori glicemici compresi tra 110-125 mg/dL e non ha ratificato l’uso dell’HbA1c per la definizione degli stati di disglicemia non diagnostici per diabete) (livello della prova III, forza della raccomandazione E)(1). È spesso associato a obesità (in particolare addominale o viscerale), dislipidemia (alti valori di trigliceridi e bassi di colesterolo HDL) e ipertensione;
- ridotta tolleranza al glucosio (IGT, impaired glucose tolerance): glicemia 2 ore dopo OGTT 140-199 mg/dL;
- HbA1c: 5.7-6.4% (39-45 mmol/mol).
La condizione di “pre-diabete” espone a maggiore rischio di sviluppare diabete e, soprattutto, malattie CV. Per questa categoria di pazienti è indicato un controllo annuale degli esami.
Infine, il ruolo dell’autoimmunità nell’ambito dei criteri diagnostici:
- diabete tipo 1: auto-anticorpi presenti;
- diabete tipo 2: auto-anticorpi assenti;
- LADA (Latent Autoimmune Diabetes in Adult): auto-anticorpi presenti.
Quali auto-anticorpi devono essere dosati?
- GADA (Ab anti-decarbossilasi acido glutamico)
- ICA (Ab anti-cellule isole pancreatiche)
- IAA (Ab anti-insulina)
- IA2A (Ab anti-tirosina fosfatasi).
- ZnT8 (Ab anti-trasportatore 8 dello zinco)
Il LADA è paragonabile al diabete di tipo 1? Alcuni autori lo definiscono diabete di tipo 1 dell’adulto/anziano. Coinvolge il 5% della popolazione diagnosticata come diabete di tipo 2, che più o meno rapidamente evidenzia scarsa risposta alla terapia dietetica e ipoglicemizzante orale, con necessità di passaggio a terapia insulinica.
Bibliografia
- American Diabetes Association. classification and diagnosis of Diabetes Mellitus. Standards of medical care in diabetes - 2021. Diabetes Care 2021, 44 suppl 1: S15-33.
- American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2014, 37 suppl 1: S81-90.
- AMD-SID. Standard italiani per la cura del diabete mellito. 2018.
- International Expert Committee. International Expert Committee Report on the role of HbA1c assay in the diagnosis of diabetes. Diabetes Care 2009, 32: 1327-34.
- Mosca A, Branca MT, Carta M. et al. Raccomandazioni per l'implementazione della standardizzazione internazionale della misura dell'emoglobina glicata in Italia. Biochimica Clinica 2009, 33: 258-61.
Overview sulle terapie disponibili e scelta della terapia per il diabete
Alberto Aglialoro1, Rossella Dionisio2, Emanuele Spreafico3, Alessandra Fusco4
1SC Diabetologia Endocrinologia e Malattie Metaboliche, Ospedale "Villa Scassi", ASL 3 Genova
2UO Diabetologia, Ospedale S Carlo, Milano
3UO Diabetologia, Endocrinologia e Nutrizione Clinica, ASST di Monza - Presidio di Desio
4Centro Diabetologia ASL Avellino
(aggiornato al gennaio 2020) questo capitolo è in attesa di aggiornamento
Negli ultimi anni le possibili terapie farmacologiche del diabete mellito di tipo 2 sono molto aumentate, tanto che al giorno d’oggi il diabetologo ha a disposizione ben 8 categorie diverse di farmaci.
Le diverse linee guida, italiane e straniere, pongono tutte l’attenzione sull’imprescindibilità della personalizzazione della terapia del diabete mellito di tipo 2, tenendo conto sia delle peculiarità del paziente sia di quelle dei singoli farmaci (1-9).
Questa overview si pone l'obiettivo di ripercorrere brevemente il panorama odierno della terapia farmacologica disponibile per la cura del diabete e vagliare le indicazioni delle principali linee guida internazionali per il loro migliore utilizzo.
Tutte le linee guida sono concordi nel consigliare un corretto stile di vita (terapia medica nutrizionale e attività fisica) come prima linea di trattamento.
Quando questo approccio non permette di raggiungere un adeguato compenso, viene indicato l’inizio di una terapia farmacologica in monoterapia o in associazione, in modo dipendente dal grado di compenso e dall’obiettivo terapeutico che si vuole raggiungere. La sfida del buon controllo glicemico è un equilibrismo tra la riduzione dell’emoglobina glicata da una parte e l’ipoglicemia e l’incremento ponderale dall’altra. Esiste una correlazione tra incremento ponderale, aumento delle ipoglicemie e peggioramento della qualità di vita (10).
Il primo passo fondamentale per intraprendere un percorso di cura è quindi stabilire gli obiettivi glicemici da raggiungere, da individualizzare e personalizzare. Rientrano nella valutazione: il potenziale rischio di ipoglicemia (anche in relazione alla professione del paziente), gli anni di malattia, le aspettative di vita, la presenza di rilevanti comorbilità, la presenza o meno di malattie cardio-vascolari e non ultime la motivazione, l’adherence e le capacità di auto-cura del paziente (figura 1) (9).

Figura 1. Target glicemico personalizzato secondo ADA (9)
Indipendentemente dalla terapia farmacologica ipoglicemizzante impiegata, risulta fondamentale, come ha insegnato l’UKPDS, un intervento intensivo (obiettivi glicemici stringenti) e al tempo stesso il più possibile precoce (legacy effect), in termini di protezione dall’insorgenza e dalla progressione delle complicanze croniche della malattia diabetica (1).
Se, tuttavia, lo studio UKPDS ha dimostrato come un trattamento intensivo precoce riduce l’incidenza delle complicanze micro- e macrovascolari, gli studi ACCORD, ADVANCE e VADT ci hanno invece insegnato che obiettivi più stringenti possono incrementare la mortalità cardio-vascolare in soggetti “complicati” (1-4). Un trattamento intensivo con obiettivi glicemici stringenti protegge dal rischio di infarto miocardico (IMA). Gli studi ACCORD, ADVANCE, VADT mostrano una riduzione solo del 9% degli eventi CV maggiori, principalmente per effetto di una riduzione del 15% del rischio di IMA. Tali risultati sono stati interpretati in vario modo: bassa potenza statistica (numerosità insufficiente e/o breve durata degli studi), presenza di danno d’organo (complicanze o comorbilità), ipoglicemie (anche per una troppo rapida riduzione delle glicemie) che potenzialmente possono contribuire ad aumentare la mortalità generale e CV (2-4). Emerge, quindi, forte la necessità di personalizzare la terapia in termini di obiettivi glico-metabolici (più o meno stringenti) (fig 2):
- obiettivi glicemici più stringenti dovrebbero essere perseguiti in pazienti di nuova diagnosi o con diabete di durata < 10 anni, senza precedenti di malattia CV, abitualmente in discreto compenso glicemico e senza comorbilità che li rendano particolarmente fragili;
- obiettivi glicemici meno stringenti dovrebbero essere perseguiti in pazienti con diabete di lunga durata (> 10 anni), soprattutto con precedenti di malattia CV o lunga storia di inadeguato compenso glicemico o fragili per età o comorbilità.

Figura 2
Alla luce di queste considerazioni, gli standard italiani AMD-SID per la cura del diabete mellito del 2016 indicano come prima raccomandazione per la cura del diabete mellito la seguente: “In tutte le persone con diabete le glicemie e l’HbA1c vanno mantenute entro i livelli appropriati per la specifica condizione clinica, al fine di ridurre il rischio di complicanze acute e croniche (Livello della prova I, Forza della raccomandazione A)” (5).
L’attenzione alla specifica condizione clinica del paziente è caratteristica anche delle linee guida AACE/ACE del 2015-2016 e delle più recenti del 2020, nelle quali gli autori hanno cercato di superare la precedente visione glucocentrica del paziente, prediligendo una visione globale dello stesso, nonché la personalizzazione degli obiettivi e del piano di cura per ciascun paziente (6).
In generale quindi, gli standard italiani AMD-SID per la cura del diabete mellito del 2018, in accordo con le linee guida canadesi, indicano quale obiettivo, in pazienti adulti, HbA1c < 7.0% (o 53 mmol/mol) per prevenire l’incidenza o la progressione di complicanze macrovascolari. Le linee guida AACE prevedono, invece, un più ambizioso 6.5% (o 48 mmol/mol) in quei pazienti senza importanti comorbilità e con basso rischio ipoglicemico. Vi è invece uniformità nell’indicare, in pazienti con diabete di lunga durata (> 10 anni) soprattutto con precedenti di CVD o lunga storia di inadeguato compenso glicemico o fragili per età o comorbilità, obiettivi glicemici meno stringenti (secondo gli standard italiani HbA1c 7-8%, 53-64 mmol/mol) (5).
Altri concetti importanti espressi dalle linee guida sono la precocità e la tempestività del trattamento, fondamentali per prevenire l’incidenza e la progressione delle complicanze microvascolari, cercando di evitare l’inerzia terapeutica. Si raccomanda, infatti, di modificare la terapia entro e non oltre i 3 mesi quando non vengono raggiunti gli obiettivi glicemici desiderati per quel paziente (5-9).
Per la selezione del farmaco ipoglicemizzante è fondamentale quindi considerare il paziente nel suo insieme, correlando le necessità del paziente con le peculiarità specifiche dei farmaci a disposizione. Gli Standard di cura internazionali (ADA, EASD, AACE/ACE, CDA, IDF) prevedono che vengano definiti i seguenti obiettivi terapeutici:
- ridurre i livelli di HbA1c (efficacy);
- ridurre i livelli di glicemia a digiuno e post-prandiale;
- controllare i fattori di rischio CV tradizionali (pressione arteriosa, profilo lipidico, fumo) e non tradizionali (PCR, PAI-1, AER);
- ridurre gli eventi CV e la mortalità correlata;
- ridurre il rischio di ipoglicemia (safety);
- ridurre l'incidenza della microangiopatia;
- migliorare la qualità di vita della persona con diabete;
- preservare la ß-cellula (durability);
- ritardare la progressione della malattia diabetica;
- evitare l'incremento ponderale;
- migliorare l'aderenza del paziente alla terapia, cercando nella scelta terapeutica di venire incontro ai bisogni individuali e limitare quanto più possibile gli effetti collaterali (tollerabilità).
Tutte le linee guida indicano come farmaco di prima scelta per il trattamento del diabete mellito di tipo 2 la metformina, se ben tollerata e/o non controindicata. I vantaggi sono: basso rischio di ipoglicemia, sicurezza dal punto di vista CV, effetto neutro/positivo sul peso corporeo, effetti anti-iperglicemici duraturi. Negli standard di cura italiani si fa riferimento ad un suo uso con cautela fino ad un eGFR di 30 mL/min/1.7 m2, purché siano attentamente valutati i fattori di rischio per il deterioramento della funzione renale.
Chiaramente nel caso sia presente chetoacidosi, oppure sindrome iperosmolare non chetosica, è assolutamente necessaria la terapia insulinica (Livello della prova I, Forza della raccomandazione A).
Se il target non è raggiunto con la monoterapia o se il grado di importante scompenso iniziale richiede l’utilizzo di più farmaci, è necessario associare un’altra terapia alla metformina.
La letteratura internazionale degli ultimi anni ci ha mostrato inequivocabilmente come non ci siano differenze significative tra i vari ipoglicemizzanti in monoterapia in termini di efficacy (fatta eccezione per l'insulina) (1-9). Quindi quale farmaco scegliere?
Le linee guida AACE/ACE 2020, analogamente alle precedenti, non si limitano a elencare le varie possibilità terapeutiche, ma identificano una gerarchia di utilizzo delle stesse, tenendo conto, come detto, delle diverse condizioni cliniche e della necessità di ridurre al minimo il rischio di ipoglicemia e di incremento ponderale. In base all’HbA1c di partenza, oltre allo stile di vita, è indicato l’utilizzo di una terapia singola o in associazione, prediligendo i farmaci più sicuri e modificando l’approccio se non si raggiunge il target prefissato entro 3 mesi (9) (figura 3). Tra le caratteristiche dei singoli anti-diabetici, vengono indicati i possibili effetti benefici CV e renali di empagliflozin e liraglutide, come dimostrato, rispettivamente, dagli studi EMPA-REG Outcome e LEADER (11-12). Ancor più recentemente sono stati documentanti analoghi possibili effetti benefici CV della semaglutide nei pazienti con diabete mellito di tipo 2 (13).

Figura 3. Algoritmo AACE-ACE
Le linee guida italiane, al contrario, non identificano una gerarchia di utilizzo degli ipoglicemizzanti orali in aggiunta alla metformina, che si trovano indicati tutti allo stesso livello (figura 4). Vengono però riportate le più importanti proprietà dei singoli farmaci o delle classi, che dovrebbero orientare la scelta del trattamento, individualizzandolo per il singolo paziente (tabelle 1 e 2). Importante sottolineare che, secondo linee guida, non vi sono particolari limiti nell’associazione di più ipoglicemizzanti orali in triplice terapia, esistono tuttavia indicazioni ben precise di prescrivibilità/rimborsabilità previste dall’Agenzia Italiana del Farmaco (figura 4).

Figura 4. Algoritmo AMD-SID
| Tabella 1 Proprietà dei farmaci ipoglicemizzanti (modif da AMD-SID) |
|||||||||
| Metformina | Acarbosio | GLP-1 RA | Gliflozine | Gliptine | Pioglitazone | SU/glinidi | Insulina | ||
| Basale | Basal-bolus | ||||||||
| Riduzione A1c a breve (3-6 m)* | +++ | + | +++ | ++ | ++ | + | +++ | +++ | ++++ |
| Riduzione A1c a medio (1-2 aa)* | ++ | + | +++ | ++ | ++ | ++ | ++ | +++ | ++++ |
| Riduzione A1c a lungo (> 2 aa)* | ++ | + | +++ | ++ | ND | +++ | + | +++ | ++++ |
| Riduzione peso | ± | ± | +++ | ++ | - | - | - | - | - |
| Riduzione pressione | ± | - | + | ++ | - | + | - | - | - |
| Riduzione morbil/mortal CV** | ++ | - | - | +++ | - | ++ | - | - | - |
| * Studi di comparazione con altri farmaci attivi ** A parità di obiettivo glicemico |
|||||||||
In sintesi le sulfaniluree sono i farmaci orali che mostrano la minore persistenza di effetto sulla HbA1c; gli agonisti del recettore di GLP-1 sono in grado di ridurre l’HbA1c come e talora più dell’insulina basale quando aggiunti alla terapia orale.
Nei pazienti obesi, si devono preferire, ove possibile, i farmaci che non determinano aumento di peso, ovvero, oltre alla metformina, agonisti del recettore di GLP-1, inibitori di DPP-4 e inibitori di SGLT-2. I farmaci che sono in grado di conseguire calo ponderale (agonisti del recettore di GLP-1 e inibitori di SGLT-2) sono efficaci nel ridurre la HbA1c anche nei soggetti in normopeso o sovrappeso.
| Tabella 2 Principali effetti collaterali dei farmaci ipoglicemizzanti (modif da AMD-SID) |
|||||||||
| Metformina | Acarbosio | GLP-1 RA | Gliflozine | Gliptine | Pioglitazone | SU/glinidi | Insulina | ||
| Basale | Basal-bolus | ||||||||
| Interazione con altri farmaci | - | - | - | - | - | - | +++ | +++ | ++++ |
| Ipoglicemia | - | - | - | - | - | - | ++ | +++ | ++++ |
| Aumento di peso | - | - | - | - | - | ++ | + | +++ | ++++ |
| Pancreatite | - | - | ± | - | ± | - | - | - | - |
| Fratture | - | - | - | ±* | - | +++ | - | - | - |
| Scompenso cardiaco | - | - | - | - | ±** | ++ | + | - | - |
| Disturbi gastroint | ++ | +++ | ++ | ± | - | - | - | - | - |
| Infezioni genitali | - | - | - | + | - | - | - | - | - |
| * Segnalato per canagliflozin ** Segnalato per saxagliptin e alogliptin |
|||||||||
Le linee guida canadesi, indicano un cut-off di intervento più elevato (glicata 8.5%), con una successiva rivalutazione a breve distanza (2-3 mesi dopo correzione dello stile di vita, 3-6 mesi dopo introduzione o modifica della terapia farmacologica) (7).
La scelta del trattamento oltre la metformina è fortemente personalizzata in base alle caratteristiche riportate in tabella 3. Da sottolineare come queste linee guida (prima di altre) abbiano subito recepito i risultati degli studi EMPA-REG Outcome e LEADER, indicando in tabella la superiorità di tali molecole (empagliflozin e liraglutide) sul rischio CV.
| Tabella 3 Aggiunta personalizzata di un’altra classe farmacologica (elencate in ordine alfabetico) (mod da linee guida canadesi) |
||||||
| Classe | Capacità relativa di diminuire HbA1c | Ipoglicemia | Peso | Effetto sugli esiti CV | Altre considerazioni terapeutiche | Costo |
| Acarbosio | ↓ | Rara | = o ↓ | Miglior controllo post-prand; effetti coll gastroent | ++ | |
| Gliptine | ↓↓ | Rara | = o ↓ | Alo/saxa/sita: neutro | Attenzione a saxa nello scompenso cardiaco | +++ |
| Agonisti GLP-1 | ↓↓ o ↓↓↓ | Rara | ↓↓ | Lira: superiore con CVD clinica Lixi: neutro |
Effetti coll gastroent | ++++ |
| Insulina | ↓↓↓ | Sì | ↑↑ | Glargine: neutro | Non dose max, regimi flessibili | +/++++ |
| Glinidi | ↓↓ | Sì | ↑ | Meno ipoglic se si saltano i pasti, ma richiede plurisomministr | ++ | |
| Pioglitazone | ↓↓ | Rara | ↑↑ | Neutro | Scompenso cardiaco, edema, fratture, raro k vescic, azione lenta (6-12 settim) | ++ |
| Sulfaniluree | ↓↓ | Sì | ↑ | Glicla e glimep meno ipoglic di glibencl | + | |
| SGLT-2 inib | ↓↓ - ↓↓↓ | Rara | ↓↓ | Empa: superiore con CVD clinica | Infez genit e urin, ipotensione, variazioni LDL, attenz con IRC e diuretici ansa, non usare dapa con k vescica, rara DKA (anche senza iperglic) | +++ |
Anche le linee guida ADA, indicano come farmaco di prima scelta la metformina (salvo eccezioni) e successiva rivalutazione a breve (entro 3 mesi) per eventuali modifiche terapeutiche (9). In caso, infatti, di valori elevati di HbA1c (≥ 9%) è da considerare sin da subito l'inizio di una duplice terapia, e in caso di scompenso glicemico sintomatico in atto, una terapia insulinica, associata o meno ad altri ipoglicemizzanti. Analogamente agli standard italiani, non viene indicata una gerarchia nella scelta terapeutica, ma comunque strettamente indicata la personalizzazione della terapia; vengono inoltre dettagliati per ciascun farmaco efficacia, rischio di ipoglicemia, rischio di incremento ponderale, effetti collaterali e costi (figura 5).
 Figura 5. Algoritmo ADA
Figura 5. Algoritmo ADA
Secondo la consensus ADA-EASD 2018 (14) la scelta della terapia farmacologica anti-iperglicemizzante deve essere fondata non solo sull’efficacia nella riduzione della glicemia ma soprattutto sulla sicurezza, sulla prevenzione delle complicanze (anzitutto quelle correlate alla malattia aterosclerotica cardio-vascolare, ASCVD), sulla tollerabilità e quindi sul mantenimento dello stato di benessere e della qualità di vita.
Le evidenze scientifiche sono state ottenute, in massima parte, in soggetti con HbA1c > 7.0%, che in aggiunta alla metformina assumevano inibitori SGLT-2 o GLP-1 RA. È raccomandato pertanto che nei pazienti in cui la sola metformina non sia in grado di ottenere l’obiettivo di HbA1c, la scelta della terapia farmacologica, in aggiunta alla metformina, debba basarsi sull’anamnesi per ASCVD, scompenso cardiaco o insufficienza renale (presenti insieme nel 15-25% dei soggetti con DMT2):
- nei pazienti con ASCVD: raccomandati inibitori SGLT-2 o GLP-1 RA per cui sia stato dimostrato un beneficio CV;
- nei pazienti con ASCVD in cui lo scompenso cardiaco sia un problema peculiare: raccomandati inibitori SGLT-2;
- nei pazienti con DMT2 e IRC, con o senza ASCVD: considerare l’uso di un inibitore SGLT-2 che abbia mostrato di ridurre la progressione della IRC o, se contro-indicato o non preferito, di un GLP-1 RA che abbia mostrato di ridurre la progressione della IRC.
Nei casi indicati in cui l’obiettivo di HbA1c non venga raggiunto con l’associazione metformina + inibitore SGLT-2 o metformina + GLP-1 RA, è raccomandata la tripla associazione metformina + inibitore SGLT-2-I + GLP-1 RA e, soltanto come scelte successive, l’aggiunta di un inibitore di DDP-4 e/o insulina basale e/o sulfoniluree e/o pioglitazone (quest’ultimo se non è presente scompenso).
Ai fini pratici è rilevante sottolineare che nel paziente con ASCVD a target con metformina più altro farmaco diverso da inibitore SGLT-2 o GLP-1 RA, è indicato:
- il passaggio all’associazione di metformina + inibitore SGLT-2-I o metformina + GLP-1 RA;
- la riduzione dell’obiettivo terapeutico al fine di introdurre un inibitore SGLT-2 o un GLP-1 RA;
- il monitoraggio stringente dell’HbA1c con la rapida introduzione di inibitore SGLT-2-I o GLP-1 RA non appena l’HbA1c aumenti oltre il target.
In conclusione, da questa rapida panoramica sul trattamento farmacologico oggi disponibile per la cura del diabete, emerge con forza la necessità di una personalizzazione della terapia, intesa come approccio decisionale clinico che di volta in volta viene svolto verso ciascun paziente e che ha come prerequisito un'accurata identificazione del paziente (fenotipizzazione) e, come metodologia, l'applicazione delle conoscenze e delle evidenze scientifiche alla realtà di ciascun individuo. Il fine ultimo è ovviamente quello di ottimizzare le risposte terapeutiche, mantenendo la migliore tollerabilità e compliance.
Bibliografia principale
- UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998, 352: 837-53.
- The ACCORD Study Group. Effect of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008, 358: 2545-59.
- The ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008, 258: 2560-72.
- Duckworth W, et al, VADT investigators. Glucose control and vascular complication in veterans with type 2 diabetes. N Engl J Med 2009, 260:129-39.
- AMD-SID. Standard Italiani per la cura del Diabete Mellito. 2018.
- Garber AJ, et al. Consensus statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the comprehensive type 2 diabetes management algorithm – 2020 executive summary. Endocr Pract 2020, 26: 107-39.
- Booth G, Lipscombe L, Butalia S, et al. Pharmacologic management of type 2 diabetes: 2016 interim update. Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Can J Diabetes 2016, 40: 484–6.
- American Diabetes Association. Standards of medical care in diabetes 2016. Diabetes Care 2016, 39 suppl 1: 1-108.
- American Diabetes Association. Standard of medical care in diabetes 2020. Diabetes Care 2020, 43 suppl 1: 1-207.
- Mc Ewan P, et al. Understanding the inter-relationship between improved glycaemic control, hypoglycaemia and weight change within a long-term economic model. Diabete Obes Metab 2010, 12: 431-6.
- Zinman B, et al. Empagliflozin, cardiovascular outcomes and mortality in type 2 diabetes. N Engl J Med 2015, 373: 2117-28.
- Marso SP, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016, 375: 311-22.
- Marso SP, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016, 375: 1834-44.
- Davies MJ, et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018, 61: 2461-98.
Principali website
Prevenzione della progressione da pre-diabete a diabete
Olga Eugenia Disoteo1 & Mariluce Barrasso2
1Diabetologia, Ospedale Niguarda, Milano
2Endocrinologia e Malattie del Metabolismo, Policlinico L. Vanvitelli, Napoli
(aggiornato al 1 ottobre 2023)
Ridurre l’insorgenza di diabete mellito, sia di tipo 1 che di tipo 2, alla luce dei dati attuali che indicano l’incremento della prevalenza per il primo e addirittura l’emergenza, con un rischio pandemia, per il secondo, dovrebbe essere obiettivo prioritario di qualsiasi società e governo che abbia tra i suoi obiettivi quelli del benessere della popolazione e la salvaguardia, anche economica, del suo servizio sanitario.
Demandare al singolo individuo la responsabilità di prevenire tali patologie è strada errata; occorrono strategie che coinvolgano non solo il settore sanitario, ma anche quello educativo, alimentare ed economico, attraverso l’attuazione di precisi percorsi informativi/formativi, che portino alla conoscenza di corrette strategie volte precipuamente alla correzione degli errati stili di vita, con ripercussioni non solo sulla prevalenza del diabete mellito ma di tutte le patologie croniche degenerative, anche a carattere neoplastico.
Il diabete mellito tipo 1 (DM1) è una patologia cronica autoimmune caratterizzata dalla distruzione delle ß-cellule. I tentativi di inibirne lo sviluppo agendo sui fattori causali, genetici e ambientali prima dell’esordio o all’esordio, sono stati per ora di scarso impatto e per lo più confinati a stretti ambiti di ricerca e di protocolli sperimentali (1-4). Tuttavia, è una patologia caratterizzata da un lungo periodo pre-clinico (stadio 1), durante il quale la secrezione di insulina endogena rimane relativamente stabile e la glicemia nella norma, seguito da un periodo di progressione asintomatica verso la disglicemia (stadio 2). Negli anni pertanto sono stati sperimentati diversi trattamenti nei soggetti con DM1 pre-clinico (stadio 1 e 2), con l’obiettivo di preservare la funzione ß-cellulare e la secrezione di insulina, così da ritardare l’esordio della malattia (stadio 3), migliorare il compenso glicemico e ridurre il rischio di complicanze.
Il 17 novembre 2022 la Food and Drug Administration (FDA) ha approvato l’utilizzo del teplizumab, primo farmaco in grado di ritardare l’esordio del DM1 in soggetti con malattia pre-clinica. Il teplizumab è un anticorpo monoclonale umanizzato della classe IgG1, che riconosce una parte di un complesso molecolare espresso sui linfociti T (CD3ε chain of the T-cell receptor complex), una classe di globuli bianchi coinvolta nella risposta immunitaria. Negli Stati Uniti l’uso di teplizumab è stato autorizzato in soggetti di età ≥ 8 anni affetti da DM1 allo stadio 2 (≥ 2 auto-anticorpi correlati al diabete e disglicemia). Viene somministrato mediante infusioni endovenose giornaliere, per una durata di 14 giorni consecutivi. L'approvazione di teplizumab negli Stati Uniti si è basata su uno studio di prevenzione (5), a cui hanno partecipato 76 individui (età media 14 anni) con diabete di stadio 2 (≥ 2 autoanticorpi correlati al diabete, ridotta tolleranza al glucosio) e un parente con DM1, randomizzati a un singolo ciclo di 14 giorni di infusioni giornaliere di teplizumab (n = 44) o placebo (n = 32). Nel corso di un follow-up di circa due anni, teplizumab ha ritardato l’insorgenza del DM1 clinico di 24 mesi e 25/44 trattati con teplizumab sono risultati liberi da malattia rispetto a 9/32 trattati con placebo (rispettivamente, 57% vs 28%). In un'analisi di follow-up, con una media di 923 giorni di osservazione, la diagnosi di DM1 è stata ritardata di 32.5 mesi con teplizumab e il 50% dei soggetti trattati è rimasto libero da malattia rispetto al 22% dei trattati con placebo (6). Tra i partecipanti allo studio clinico, gli effetti collaterali primari del trattamento con teplizumab sono stati linfopenia transitoria (auto-risolta in tutti i casi), eruzione cutanea, mal di testa e nausea (7).
Ad oggi sono in corso studi per testare l’efficacia di diversi trattamenti immuno-modulanti (terapie anti-linfociti CD4+ e CD8+), in individui con diabete allo stadio 1 (≥ 2 auto-anticorpi correlati al diabete con normoglicemia) o allo stadio 2 (≥ 2 auto-anticorpi correlati al diabete e disglicemia).
Globulina anti-timocitaria (ATG): comprende anticorpi di derivazione animale che riducono le cellule B e le cellule T. Questo trattamento ha dimostrato di preservare la secrezione di insulina nel DM1 clinicamente evidente (stadio 3), spingendo alla progettazione di un successivo studio di efficacia in soggetti con malattia pre-clinica (8).
Abatacept: è un'immunoglobulina citotossica dell'antigene 4 dei linfociti T(CTLA4), che blocca la costimolazione delle cellule T. Abatacept può preservare la funzione delle ß-cellule nel DM1 clinicamente conclamato (stadio 3) e questa scoperta ha portato a uno studio (9) in soggetti con malattia pre-clinica (stadio 1), in cui abatacept ha migliorato la funzione delle ß-cellule a 12 mesi rispetto al placebo. Tuttavia, 12 mesi dopo la fine del trattamento, la funzione delle ß-cellule era la stessa in entrambi i gruppi. Abatacept inoltre non ha ritardato la progressione verso lo stadio 2 o 3 della malattia.
Insulina orale: è stata testata in numerosi studi in soggetti con malattia pre-clinica o ad alto rischio genetico per DM1, allo scopo di ritardare o prevenire la progressione verso la malattia clinica (stadio 3). Nessuno degli studi ha dimostrato efficacia nella prevenzione o nel ritardo di comparsa del DM1, ma analisi post-hoc indicano che l’insulina orale può apportare benefici a soggetti selezionati con elevati titoli di auto-anticorpi insulinici o a quelli più vicini alla diagnosi clinica. L’insulina orale è inoltre in fase di sperimentazione per la prevenzione primaria dell’auto-immunità delle insule e del DM1 clinico nei bambini geneticamente a rischio. In uno studio su 25 bambini geneticamente a rischio che non avevano ancora sviluppato auto-anticorpi, l’insulina orale (67.5 mg/die) si è rivelata sicura e ha indotto una risposta immunitaria regolatoria (10). Questi dati preliminari hanno dato luogo a un successivo studio in corso (11).
Varie:
- l’utilizzo dell’insulina intra-nasale (12) e dell’idrossi-clorochina (13) è risultato inefficace nel ritardare l’esordio di malattia;
- Sono in corso di sperimentazione ulteriori terapie dirette contro le citochine liberate dai linfociti TCD4+ e TCD8+ (terapie anti-TNF, anti-IL-12, anti-IL-23, anti-IL-17 o inibenti la via Janus chinasi).
Nessuna delle terapie sopra elencate è disponibile per uso clinico.
Terapie cellulari: diversi studi hanno testato l’infusione di cellule progettate per preservare o sostituire la secrezione di insulina endogena.
- Cellule staminali: includono cellule embrionali pluri-potenti, cellule mesenchimali multi-potenti o cellule pluri-potenti indotte. Le cellule staminali mesenchimali (MSC) possiedono proprietà immuno-regolatorie, mancano di immunogenicità e secernono fattori che migliorano la riparazione dei tessuti locali. Piccoli studi hanno valutato la capacità delle MSC di modificare il decorso della malattia nel DM1 (14).
- Trapianto di cellule insulari allogeniche: può conferire l’indipendenza dall’insulina ed è una terapia efficace per i pazienti con ipoglicemia grave. Le limitazioni includono una fornitura limitata di donatori di cellule insulari umane, la necessità di immuno-soppressione permanente e tassi più bassi di indipendenza dall’insulina rispetto al trapianto di pancreas intero (15-16). L’incapsulamento delle cellule delle insule è una promettente strategia sperimentale per proteggere dal rigetto e quindi aggirare la necessità di immuno-soppressione permanente.
Visto l’incremento della prevalenza non apparentemente correlata a un incremento della penetranza nella popolazione dei fattori genetici favorenti l’insorgenza della patologia, nei prossimi anni maggiore attenzione dovrà essere volta all’identificazione delle cause ambientali scatenanti, con progetti di intervento diffusi volti alla loro riduzione.
Maggior spazio di intervento sembra allo stato attuale potersi identificare nella prevenzione del diabete mellito tipo 2 (DM2), ambito che, tuttavia, deve trovare prima di tutto sostegno nei piani di educazione e prevenzione dei governi, senza i quali è destinata a fallire qualsiasi progettualità, non farmacologica o farmacologica, volta alla riduzione della conversione da stato ad alto rischio di diabete a diabete. La strutturazione di un programma volto a prevenire l’insorgenza di DM2 deve prima di tutto essere in grado di identificare gli individui ad alto rischio di sviluppo della patologia, come i soggetti obesi, anziani, con IGT, IFG, pregresso diabete gestazionale, inattivi fisicamente o appartenenti a particolari etnie, sui quali intervenire in maniera più specifica. Bisogna anche organizzare percorsi per la popolazione generale, adulta e pediatrica, in grado di promuovere una sana alimentazione associata a programmi di attività fisica.
L’efficacia di programmi di intervento sullo stile di vita nella riduzione dell’insorgenza di diabete mellito è stata ben evidenziata da vari studi. In particolare, il Diabetes Prevention Program (DPP) e il Finnish Study sono stati in grado di ridurre del 58% a 4 anni l’insorgenza di diabete mellito attraverso la pratica di attività fisica (150 minuti/settimana) e l’adozione di una dieta a basso contenuto calorico, di grassi e di carboidrati semplici. Tali risultati sono stati mantenuti attraverso il prosieguo dell’intervento fino a 10 anni nel DPP (17-18).
Risultati meno brillanti, ma comunque confortanti, sono stati ottenuti con l’impiego di farmaci impiegati per il trattamento del diabete, quali metformina (19), tiazolidinedioni (20), acarbose (21) e liraglutide (22). Sebbene questi farmaci ritardino l'insorgenza della diagnosi di diabete e quindi riducano la durata dell'esposizione all'iperglicemia, è necessario considerare il beneficio o il danno dell'intervento, indipendentemente dall'effetto sull'iperglicemia. I tiazolidinedioni, ad esempio, sono limitati da effetti avversi (ritenzione di liquidi, aumento di peso, insufficienza cardiaca, perdita ossea, possibile infarto miocardico per rosiglitazone e possibile cancro alla vescica per pioglitazone); gli inibitori dell'alfa-glucosidasi da effetti collaterali gastro-intestinali e scarsa compliance a lungo termine. Nessuno di questi ha attualmente riconosciuta l’indicazione per la prevenzione dello sviluppo di DM2 nei pazienti ad alto rischio e ogni loro impiego in tale ambito è da considerarsi off-label.
Al contrario, la metformina è relativamente poco costosa e sicura a lungo termine. Per tale ragione l’American Diabetes Association (ADA) suggerisce di prendere in considerazione la metformina a scopo preventivo nei soggetti a più alto rischio di sviluppare diabete, come quelli con IGT, IFG o HbA1c dal 5.7% al 6.4% e che abbiano meno di 60 anni, BMI ≥ 35 kg/m2 o donne con storia di diabete gestazionale (23). I pazienti trattati con metformina richiederebbero un monitoraggio almeno annuale (HbA1c o glicemia a digiuno) per valutare lo sviluppo di diabete.
Nei soggetti obesi è possibile l’impiego di orlistat, che nello studio Xendos (24) ha dimostrato di ridurre del 37% l’insorgenza di diabete nei soggetti ad elevato rischio quando associato a un programma di attività fisica. È in discussione se tale beneficio fosse ascrivibile esclusivamente all’importante riduzione del peso corporeo o a un reale effetto del farmaco.
Negli individui con pre-diabete e sovrappeso o obesità, semaglutide può aiutare a ritardare o prevenire l'insorgenza del diabete se usato come farmacoterapia dell'obesità. In un'analisi secondaria dello studio STEP-1, gli adulti con pre-diabete (BMI medio circa 39 kg/m2, HbA1c media circa 5.9%) randomizzati a semaglutide 2.4 mg/settimana per 68 settimane hanno avuto minor frequenza di progressione verso il DM2 rispetto a quelli del braccio placebo (0.5% vs 3%, entrambi i gruppi sottoposti a intervento simultaneo sullo stile di vita) (25). La misura in cui questi effetti sulla glicemia fossero attribuibili esclusivamente alla perdita di peso non è chiara e la semaglutide deve essere continuata indefinitamente per prevenire il recupero del peso corporeo (26). Sono pertanto necessari studi a più lungo termine per stabilire la durata sia della perdita di peso che degli effetti glicemici di semaglutide. Inoltre, dovrebbe essere considerato il costo di semaglutide rispetto a quello di metformina.
In conclusione, nei soggetti a rischio di sviluppare DM2 sono fortemente raccomandate le modifiche dello stile di vita (dieta e attività fisica), che allo stato attuale rappresentano l’unica strada ampiamente percorribile. L’impiego di farmaci, nello specifico metformina, può trovare un suo razionale e pertanto essere preso in considerazione nei pazienti ad alto rischio di sviluppare DM2.
Bibliografia
- Gale EA, Bingley PJ, Emmett CL, et al; ENDIT Group. European Nicotinamide Diabetes Intervention Trial (ENDIT): a randomized controlled trial of intervention before the onset of type 1 diabetes. Lancet 2004, 363: 925-31.
- Knip M, Virtanen SM, Seppa K, et al. Dietary intervention in infancy and later signs of betacell autoimmunity. N Engl J Med 2010, 363: 1900-8.
- Diabetes Prevention Trial-Type 1 Diabetes Study Group. Effects of insulin in relatives of patients with type 1 diabetes mellitus. N Engl J Med 2002, 346: 1685-91.
- Skyler JS, Krischer JP, Wolfsdorf J, et al. Effects of oral insulin in relatives of patients with type 1 diabetes: the Diabetes Prevention Trial-Type 1. Diabetes Care 2005, 28: 1068-76.
- Herold KC, Bundy BN, Long SA, et al. An anti-CD3 antibody, teplizumab, in relatives at risk for type 1 diabetes. N Engl J Med 2019, 381: 603-13.
- Sims EK, Bundy BN, Stier K, et al. Teplizumab improves and stabilizes beta cell function in antibody-positive high-risk individuals. Sci Transl Med 2021, 13: eabc8980.
- Russell WE, Bundy BN, Anderson MS, et al. Abatacept for delay of type 1 diabetes progression in stage 1 relatives at risk: a randomized, double-masked, controlled trial. Diabetes Care 2023, 46: 1005-13.
- STOP-T1D Low-Dose (ATG) (TN28). Clinical Trials NCT04291703.
- Bonifacio E, Ziegler AG, Klingensmith G, et al. Effects of high-dose oral insulin on immune responses in children at high risk for type 1 diabetes. The Pre-POINT randomized clinical trial. JAMA 2015, 313: 1541-9.
- Ziegler AG, Achenbach P, Berner R, et al. Oral insulin therapy for primary prevention of type 1 diabetes in infants with high genetic risk: the GPPAD-POInT (global platform for the prevention of autoimmune diabetes primary oral insulin trial) study protocol. BMJ Open 2019, 9: e028578.
- Hydroxychloroquine in individuals at-risk for type 1 diabetes mellitus. (TN28). Clinical Trials NCT03428945.
- Greenbaum CJ, McCulloch-Olson M, Chiu HK, et al. Parenteral insulin suppresses T cell proliferation to islet antigens. Pediatr Diabetes 2011, 12: 150-5.
- Moreira A, Kahlenberg S, Hornsby P. Therapeutic potential of mesenchymal stem cells for diabetes. J Mol Endocrinol 2017, 59: R109-20.
- Izadi M, Sadr Hashemi Nejad A, Moazenchi M, et al. Mesenchymal stem cell transplantation in newly diagnosed type-1 diabetes patients: a phase I/II randomized placebo-controlled clinical trial. Stem Cell Res Ther 2022, 13: 264.
- Wisel SA, Braun HJ, Stock PG. Current outcomes in islet versus solid organ pancreas transplant for β-cell replacement in type 1 diabetes. Curr Opin Organ Transplant 2016, 21: 399-404.
- Tuomilehto J, Lindström J, Eriksson JG, et al, Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001, 344: 1343-50.
- Diabetes Prevention Program Research Group. 10-year follow-up of diabetes incidence and weight loss in the Diabetes Prevention Program Outcomes Study. Lancet 2009, 374: 1677-86.
- Diabetes Prevention Program Research Group. Effects of withdrawal from metformin on the development of diabetes in the Diabetes Prevention Program. Diabetes Care 2003, 26: 977-80.
- DeFronzo RA, Tripathy D, Schwenke DC, et al. Pioglitazone for diabetes prevention in impaired glucose tolerance. N Engl J Med 2011, 364: 1104-15.
- Chiasson JL, Josse RG, Gomis R, et al, STOP-NIDDM Trial Research Group. Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance: the STOP-NIDDM Trial. JAMA 2003, 290: 486-94.
- Chiasson JL, Josse RG, Gomis R, et al, STOP-NIDDM Trial Research Group. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomized trial. Lancet 2002, 359: 2072-7.
- Astrup A, Rossner S, Van Gaal L, et al, NN8022e1807 Study Group. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo controlled study. Lancet 2009, 374: 1606-16.
- El Sayed NA, Aleppo G, Aroda VR, et al. Prevention or delay of type 2 diabetes and associated comorbidities: standards of care in diabetes-2023. Diabetes Care 2023, 46: S41-8.
- Torgerson JS, Hauptman J, Boldrin MN, et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004, 27: 155-61.
- Wilding JPH, Batterham RL, Calanna S, et al. Once‐weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021, 384: 989‐1002.
- Rubino D, Abrahamsson N, Davies M, et al. Effect of continued weekly subcutaneous semaglutide vs placebo on weight loss maintenance in adults with overweight or obesity. The STEP 4 randomized clinical trial. JAMA 2021, 325: 1414-25.
Terapia dietetica del diabete
Paolo Marenco
AO "G. Salvini" di Garbagnate Milanese, PO di Garbagnate Milanese, 1° Divisione di Medicina Generale, Servizio di Diabetologia e Malattie Metaboliche Correlate
La dieta è il cardine della terapia diabetologica (1) e da sola può determinare un calo di 1-2 punti percentuali di HbA1c (2-5). Fino al 30% dei diabetici potrebbero essere controllati con la sola dieta, che associata all’attività fisica e alla farmacoterapia li porta ad obiettivo, migliorando gli esiti clinici e metabolici con correlata riduzione dei ricoveri ospedalieri (3,4,6,7). Frequenti controlli con un dietista determinano una migliore aderenza alla dieta (8,9). Apparentemente incontri individuali sembrano essere più efficaci nei soggetti di basso livello socio-economico (10), mentre incontri di gruppo sono più efficaci se associati a principi di educazione per adulti, quali problem solving, role playing, discussioni di gruppo (11-14). In gruppi di diabetici selezionati, incontri fra pari e programmi di educazione basati sul web migliorano ulteriormente le conoscenze e la gestione della malattia (15-16).
Carboidrati (CHO)
Giacchè il fabbisogno del cervello si aggira intorno a 130 g/die di CHO, nessuna dieta può prevedere una dose inferiore (17).
Una revisione delle diete con contenuto di CHO compreso fra il 4% e il 45% ha evidenziato un miglioramento dei livelli di HbA1c e trigliceridi, ma non del colesterolo totale, LDL e HDL. Inoltre, le diete con bassissimo contenuto di carboidrati non assicurerebbero un sufficiente apporto di fibre, vitamine e minerali, mentre incrementerebbero l’apporto di proteine e grassi, che possono avere effetti dannosi rispettivamente sui reni e sugli esiti cardiovascolari (17-18).
Oggi si tende a collocare il fabbisogno di CHO nella dieta al 50-60%, con un apporto ottimale del 55%. Fra i carboidrati si dovrebbero privilegiare quelli complessi e con basso indice glicemico (legumi, pasta e pane, meglio se integrali, frutti delle aree temperate). Per indice glicemico si intendono i livelli di glicemia raggiunti dopo aver assunto un alimento rispetto ai livelli di glicemia dopo assunzione di una pari quantità di un alimento di riferimento che oggi è il pane (19-20).
Grassi
Il contenuto di grassi nella dieta non dovrebbe superare il 30% delle calorie totali (21) e di questi non più del 7% dovrebbero essere grassi saturi (grassi animali), fino al 20% grassi mono-insaturi (oli vegetali); i grassi poli-insaturi (in particolare gli omega dell’olio di pesce) vanno inclusi nella dieta per la loro azione sul miglioramento del profilo cardiovascolare (22).
I grassi sono una sorgente di corpi chetonici e il loro eccesso è causa predominante di obesità e quindi di resistenza insulinica. Alcuni tipi di lipidi sono corresponsabili della vasculopatia diabetica.
I PUFA sono ancora controversi: lo studio Alpha Omega avrebbe mostrato effetti cardiovascolari nei diabetici, lo studio ORIGIN non avrebbe mostrato effetti cardiovascolari, attualmente è in corso lo studio Ascend (23-25).
Proteine
Attualmente la dose consigliata nella popolazione generale è di 1-1.5 g/kg/die, corrispondente ad un fabbisogno del 15-20% della dieta. Non sembra che queste quantità e proporzioni vadano modificate nel diabetico (26). Nei pazienti con insufficienza renale cronica l’apporto di proteine andrebbe ridotto a 0.8 g/kg/die (27-29).
Come sorgente di proteine andrebbero privilegiate le proteine vegetali, le carni bianche e il pesce (30-33).
Nei pazienti anziani potrebbe essere prevista un’integrazione proteica, sempre tenendo d’occhio la funzionalità renale (34).
Fibre
L’apporto di fibre solubili nella dieta ha evidenziato un netto miglioramento del profilo glicemico nei pazienti in tutte le fasce di età. In tutti i regimi dietetici è raccomandato un apporto medio di 40 g/die di fibre (35). Le fibre contenute nei cereali integrali o aggiunte mediante integratori riducono il picco glicemico, rallentando l’assorbimento dei glucidi e dei lipidi (36-38).
Alcool
Non sono previste differenze nelle raccomandazioni rispetto alla popolazione generale: si raccomanda l’assunzione massima di 2 dosi/die di alcolici (vino) nella donna e 3 nell’uomo (1 dose = 10 g di alcool) (39-40).
L’alcool può mascherare i sintomi dell’ipoglicemia (41), riduce la produzione epatica di glucosio e incrementa i chetoni (42). Le dosi consigliate di alcool sono associate a una moderata riduzione del rischio cardiovascolare e assunte ai pasti non modificano il rischio di iper o ipoglicemia. Il consumo di vino rosso (ma non di vino bianco) sembra avere effetti benefici sullo stress ossidativo e sull’infiammazione associata all’infarto miocardico nel diabetico e avrebbe effetti protettivi sul rene (43-44).
Vitamine e sali minerali
Se si segue una dieta corretta, non sono raccomandati supplementi di vitamine e sali minerali. Sono raccomandate integrazione con vitamina D nei pazienti > 50 anni e con acido folico nelle donne che desiderino una gravidanza (45).
Può essere necessaria integrazione in casi particolari: squilibri nell’alimentazione, pazienti sottoposti a chirurgia bariatrica.
Zuccheri semplici
È considerata accettabile l’aggiunta di saccarosio fino ad un massimo del 10% dell’introito energetico giornaliero, mentre una quantità superiore incrementa i livelli glicemici e i trigliceridi. Il fruttosio ha un andamento sovrapponibile a quello del saccarosio per quantità ed effetti: ai medesimi dosaggi del saccarosio ha un leggero effetto di riduzione dei livelli di HbA1c, a dosi superiori incrementa i trigliceridi e contribuisce all’incremento ponderale. Il fruttosio contenuto nella frutta e nei vegetali avrebbe un effetto migliore rispetto a quello assunto in sostituzione del saccarosio (46-50).
Messaggi chiave
- La dieta può ridurre dell’1-2% (11-22 mmol/mol) i livelli di HbA1c e (sola o associata ad esercizio fisico e farmaci) consente di raggiungere gli obiettivi terapeutici nella maggioranza dei diabetici.
- Sostituire alimenti ad alto indice glicemico con alimenti a basso indice glicemico ha un significato clinico rilevante.
- La dieta dovrebbe essere prescritta da un dietista esperto.
- Diversi regimi dietetici (in primis la dieta mediterranea) e specifici alimenti hanno dimostrato miglioramento degli effetti della dieta nel diabetico.
- La tipologia dei carboidrati, la quantità e la distribuzione dei pasti nella giornata aiutano nel controllo della glicemia e del peso.
- La dieta va adattata alle esigenze del singolo paziente.
Bibliografia
- Pastors JG, Warshaw H, Daly A, et al. The evidence for the effectiveness of medical nutrition therapy in diabetes management. Diabetes Care 2002, 25: 608-13.
- Pi-Sunyer FX, Maggio CA, McCarron DA, et al. Multicenter randomized trial of a comprehensive prepared meal program in type 2 diabetes. Diabetes Care 1999, 22: 191-7.
- Imai S, Kozai H, Matsuda M, et al. Intervention with delivery of diabetic meals improves glycemic control in patients with type 2 diabetes mellitus. J Clin Biochem Nutr 2008, 42: 59-63.
- Huang MC, Hsu CC, Wang HS, Shin SJ. Prospective randomized controlled trial to evaluate effectiveness of registered dietitian-led diabetes management on glycemic and diet control in a primary care setting in Taiwan. Diabetes Care 2010, 33: 233-9.
- Willaing I, Ladelund S, Jørgensen T, et al. Nutritional counselling in primary health care: a randomized comparison of an intervention by general practitioner or dietician. Eur J Cardiovasc Prev Rehabil 2004, 11: 513-20.
- Franz MJ, Monk A, Barry B, et al. Effectiveness of medical nutrition therapy provided by dietitians in the management of non-insulin-dependent diabetes mellitus: a randomized, controlled clinical trial. J Am Diet Assoc 1995, 95: 1009-17.
- Kulkarni K, Castle G, Gregory R, et al. Nutrition practice guidelines for type 1 diabetes mellitus positively affect dietitian practices and patient outcomes. The Diabetes Care and Education Dietetic Practice Group. J Am Diet Assoc 1998, 98: 62-70.
- Gaetke L, Stuart M, Truszczynska H. A single nutrition counseling session with a registered dietitian improves short-term clinical outcomes for rural Kentucky patients with chronic diseases. J Am Diet Assoc 2006, 106: 109-12.
- Wilson C, Brown T, Acton K, Gilliland S. Effects of clinical nutrition education and educator discipline on glycemic control outcomes in the Indian health service. Diabetes Care 2003, 26: 2500-4.
- Robbins JM, Thatcher GE, Webb DA, Valdmanis VG. Nutritionist visits, diabetes classes, and hospitalization rates and charges: the Urban Diabetes Study. Diabetes Care 2008, 31: 655-60.
- Brekke HK, Jansson PA, Lenner RA. Long-term (1- and 2-year) effects of lifestyle intervention in type 2 diabetes relatives. Diabetes Res Clin Pract 2005, 70: 225-34.
- Lemon CC, Lacey K, Lohse B, et al. Outcomes monitoring of health, behavior, and quality of life after nutrition intervention in adults with type 2 diabetes. J Am Diet Assoc 2004, 104: 1805-15.
- Rickheim PL, Weaver TW, Flader JL, Kendall DM. Assessment of group versus individual diabetes education: a randomized study. Diabetes Care 2002, 25: 269-74.
- Trento M, Basile M, Borgo E, et al. A randomised controlled clinical trial of nurse-, dietitian- and pedagogist-led Group Care for the management of type 2 diabetes. J Endocrinol Invest 2008, 31: 1038-42.
- Pérez-Escamilla R, Hromi-Fiedler A, Vega-López S, et al. Impact of peer nutrition education on dietary behaviors and health outcomes among Latinos: a systematic literature review. J Nutr Educ Behav 2008, 40: 208-25.
- Ralston JD, Hirsch IB, Hoath J. Web-based collaborative care for type 2 diabetes: a pilot randomized trial. Diabetes Care 2009, 32: 234-9.
- Institute of Medicine. Food and nutrition board. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. National Academies Press Washington, DC, 2002.
- Kirk JK, Graves DR, Carven TE, et al. Restricted carbohydrate diet in patients with type 2 diabetes: a meta-analysis. J Am Diet Assoc 2008, 108: 91-100.
- Jenkins DJ, Wolever TM, Taylor RH, et al. Glycemic index of foods: a physiological basis for carbohydrate exchange. Am J Clin Nutr 1981, 34: 362-6.
- Atkinson FS, Foster-Powell K, Brand-Miller JC. International tables of glycemic index and glycemic load values. Diabetes Care 2008, 31: 2281-3.
- Otten J, Hellwig J, Meyer L. Acceptable macronutrient distribution ranges. Dietary Reference Intakes. National Academies Press, Washington, DC, 2006.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001, 285: 2486-97.
- Kromhout D, Giltay EJ, Geleijnse JM; Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med 2010, 363: 2015-26.
- ORIGIN Trial Investigators, Bosch J, Gerstein HC, Dagenais GR, et al. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med 2012, 367: 309-18.
- Rizos EC, Ntzani EE, Bika E, et al. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA 2012, 308: 1024-33.
- Hamdy O, Horton ES. Protein content in diabetes nutrition plan. Curr Diab Rep 2011, 11: 111-9.
- Food and Nutrition Board. Institute of Medicine. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. National Academies Press, Washington, DC, 2005.
- Hansen HP, Tauber-Lassen E, Jensen BR, Parving HH. Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy. Kidney Int 2002, 62: 220-8.
- Pan Y, Guo LL, Jin HM. Low-protein diet for diabetic nephropathy: a meta-analysis of randomized controlled trials. Am J Clin Nutr 2008, 88: 660-6.
- Azadbakht L, A Esmaillzadeh. Soy-protein consumption and kidney-related biomarkers among type 2 diabetics: a crossover, randomized clinical trial. J Ren Nutr 2009, 19: 479-86.
- Azadbakht L, Atabak S, A Esmaillzadeh. Soy protein intake, cardiorenal indices, and C-reactive protein in type 2 diabetes with nephropathy: a longitudinal randomized clinical trial. Diabetes Care 2008, 31: 648-54.
- Teixeira SR, Tappenden KA, L Carson, et al. Isolated soy protein consumption reduces urinary albumin excretion and improves the serum lipid profile in men with type 2 diabetes mellitus and nephropathy. J Nutr 2004, 134: 1874-80.
- de Mello VD, Zelmanovitz T, Perassolo MS, et al. Withdrawal of red meat from the usual diet reduces albuminuria and improves serum fatty acid profile in type 2 diabetes patients with macroalbuminuria. Am J Clin Nutr 2006, 83: 1032-8.
- Brodsky IG, Robbins DC, Hiser E, et al. Effects of low-protein diets on protein metabolism in insulin-dependent diabetes mellitus patients with early nephropathy. J Clin Endocrinol Metab 1992, 75: 351-7.
- Anderson JW, Randles KM, Kendall CW, Jenkins DJ. Carbohydrate and fiber recommendations for individuals with diabetes: a quantitative assessment and meta-analysis of the evidence. J Am Coll Nutr 2004, 23: 5-17.
- Jacobs DR, Meyer KA, Kushi LH, Folsom AR. Whole-grain intake may reduce the risk of ischemic heart disease death in post-menopausal women: the Iowa Women's Health Study. Am J Clin Nutr 1998, 68: 248-57.
- Otten J, Hellwig J, Meyer L. Acceptable macronutrient distribution ranges. Dietary Reference Intakes. National Academies Press, Washington, DC, 2006.
- Chandalia M, Garg A, Lutjohann D, et al. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus. N Engl J Med 2000, 342: 1392-8.
- Stockwell T, Zhao J, Thomas G. Should alcohol policies aim to reduce total alcohol consumption? New analyses of Canadian drinking patterns. Addict Res Theory 2009, 17: 135-51.
- Butt P, Beirness D, Cesa F. Alcohol and health in Canada: a summary of evidence and guidelines for low-risk drinking. Canadian Centre on Substance Abuse Ottawa, ON, 2011.
- Kerr D, MacDonald IA, Heller SR, Tattersall RB. Alcohol causes hypoglycaemic unawareness in healthy volunteers and patients with type 1 (insulin-dependent) diabetes. Diabetologia 1990, 33: 216-21.
- Kerr D, S Penfold, Zouwail S, et al. The influence of liberal alcohol consumption on glucose metabolism in patients with type 1 diabetes: a pilot study. QJM 2009, 102: 169-74.
- Marfella R, Cacciapuoti F, Siniscalchi M, et al. Effect of moderate red wine intake on cardiac prognosis after recent acute myocardial infarction of subjects with Type 2 diabetes mellitus. Diabet Med 2006, 23: 974-81.
- Nakamura T, Fujiwara N, Sugaya T, et al. Effect of red wine on urinary protein, 8-hydroxydeoxyguanosine, and liver-type fatty acid–binding protein excretion in patients with diabetic nephropathy. Metabolism 2009, 58: 1185-90.
- Health Canada Eating Well with Canada's Food Guide. Publication H39e166/1990E 2007 Health Products and Food Branch, Office of Nutrition and Promotion Ottawa, ON.
- Chantelau EA, Gösseringer G, Sonnenberg GE, Berger M. Moderate intake of sucrose does not impair metabolic control in pump-treated diabetic out-patients. Diabetologia 1985, 28: 204-7.
- Colagiuri S, Miller JJ, Edwards RA. Metabolic effects of adding sucrose and aspartame to the diet of subjects with non-insulin-dependent diabetes mellitus. Am J Clin Nutr 1989, 50: 474-8.
- Sievenpiper JL, de Souza RJ, Mirrahimi A, et al. Effect of fructose on body weight in controlled feeding trials: a systematic review and meta-analysis. Ann Intern Med 2012, 156: 291-304.
- Cozma AI, Sievenpiper JL, de Souza RJ, et al. Effect of fructose on glycemic control in diabetes: a meta-analysis of controlled feeding trials. Diabetes Care 2012, 35: 1611-20.
- Sievenpiper JL, Carleton AJ, Chatha S, et al. Heterogeneous effects of fructose on blood lipids in individuals with type 2 diabetes: systematic review and meta-analysis of experimental trials in humans. Diabetes Care 2009, 32: 1930-7.

