Inquadramento generale diagnostico-terapeutico dei NET
Classificazione dei NET
Franco Grimaldi & Elda Kara
SOC Endocrinologia, Malattie del Metabolismo e Nutrizione Clinica, ASU Friuli Centrale, PO S. Maria della Misericordia, Udine
(aggiornato al 3 luglio 2020)
La classificazione OMS 2019 delle neoplasie neuroendocrine (NEN) gastro-entero-pancreatiche (GEP) si basa su sede, grado di differenziazione, grado di malignità, stadio di malattia e caratterizzazione in base all’eventuale produzione ormonale (1-6) (tabella).
Le classificazioni WHO sono specificamente intese per neoplasie asportate chirurgicamente (7,8) e la loro applicazione in campioni citologici o istologici bioptici è possibile con maggiore riproducibilità e sensibilità nei NEC (9). Nelle NEN è opportuno specificare nel referto anatomo-patologico il limite intrinseco al tipo di materiale per la definizione del valore percentuale di Ki67, dell’indice mitotico e conseguentemente del grading della neoplasia (10,11).
| Classificazione OMS 2019 delle GEP NEN | ||||
| Diagnosi | Grado | Indice mitotico | Ki67 (%) | Differenziazione |
| 1. Tumore neuroendocrino (NET) | 1 | < 2/10 HPF | ≤ 3% | Ben differenziato |
| 2. Tumore neuroendocrino (NET) | 2 | 2-20/10 HPF | 3-20% | Ben differenziato |
| 3. Tumore neuroendocrino (NET) | 3 | > 20/10 HPF | > 20% | Ben differenziato |
| 3. Carcinoma neuroendocrino (NEC) | - | > 20/10 HPF | > 20% | Poco differenziato |
| 4. Neoplasie miste non neuroendocrine-neuroendocrine (MINEN) | - | - | - | Poco differenziato Ben differenziato |
| 5. Lesioni iperplastiche e pre-neoplastiche | - | - | - | - |
Grading
L’ultima classificazione OMS 2019 distingue le GEP NEN in base agli aspetti morfologici, istopatologici e dell’attività cito-proliferativa del tumore, espressa come grading (G). Il grading si basa sull’indice proliferativo del tumore (numero di mitosi su 10 campi ad alto ingrandimento - HPF, High Power Field, con ingrandimento minimo 40X) o come valore di Ki67 (parametro immmuno-istochimico che si ottiene misurando la percentuale di cellule positive all’anticorpo MIB-1 su 500-2.000 cellule, valutato nell’area di maggiore marcatura nucleare). In base alla valutazione della conta mitotica e dell’indice di proliferazione con Ki67 viene definito il grading della NEN: NET G1, NET G2, NET G3 e NEC.
Il cut-off proposto per distinguere NET G1 rispetto a NET G2 è di 2 mitosi /10 HPF e 3% di indice Ki67. Una conta mitotica > 20/10 HPF e un indice Ki67 > 20% definiscono i NEC (7,8).
I suddetti principi, proposti inizialmente nella classificazione OMS 2010, sono stati parzialmente modificati nella classificazione del 2017 che riguardava solo la sede pancreatica (9). Il risultato delle modifiche apportate alla classificazione OMS 2010 nella versione 2017 per la sola sede pancreatica è stato condensato, recepito ed esteso a tutto l’apparato GEP nella classificazione OMS 2019 (6).
Riassunto delle principali modifiche tra la classificazione OMS 2019 e la precedente del 2010
- Valore di cut-off di Ki67 tra NET G1 e G2: dal 2% al 3%.
- Categoria NET G3: caratterizzata da neoplasie ben differenziate ma ad indice proliferativo Ki67 > 20%. La categoria dei NET G3 include NEN caratterizzate da elevata attività proliferativa, ma morfologia ben differenziata, tipica delle NEN. La necessità di riconoscere questo nuovo sottogruppo è nata dall’osservazione di un andamento clinico più favorevole e una differente risposta alle terapie mediche di questo sottogruppo di pazienti rispetto a quella di pazienti con neoplasia scarsamente differenziata. Lo studio di Milione et al (12) ha dimostrato che una morfologia ben differenziata costituisce un fattore prognostico indipendente per le GEP NEN con Ki67 compreso fra 20 e 55% (NET G3 e NEC con Ki67 20-55%), mentre il cut-off di Ki67 del 55% è un fattore prognostico indipendente per le GEP NEN scarsamente differenziate. Il Ki67 della componente neuroendocrina sembra essere il fattore prognostico principale anche per i MANEC (13).
- Neoplasie miste MiNEN (mixed neuroendocrine-non neuroendocrine neoplasm). Vengono considerate tali le neoplasie nelle quali le due componenti, neuroendocrina e non-neuroendocrina, siano rappresentate entrambe in almeno il 30% delle cellule tumorali (14). Il termine MiNEN nasce dalla necessità di considerare la rara eventualità in cui la componente neuroendocrina sia di tipo ben differenziato. È tuttavia consigliabile, nei casi di gran lunga più frequenti in cui la neoplasia mista si presenti con NEC, associare al nuovo termine il precedente MANEC, in considerazione del rilevante valore predittivo sull’outcome clinico esercitato dalla componente NEC; a questo proposito sarebbe opportuno esplicitare anche il valore di Ki-67 della componente NEC, risultato il più potente predittore indipendente di sopravvivenza nei pazienti affetti da MANEC (13).
Morfologia
Le GEP NEN si distinguono in “tumori” e “carcinomi” (tabella).
I NET vengono distinti in due categorie prognostiche:
- NET (G1, G2 e G3) in base alla conta mitotica e/o alla valutazione quantitativa dell’espressione immuno-istochimica del Ki67;
- NEC, che presentano crescita diffusa, solida, con estesa necrosi e numerose atipie citologiche e sono distinti in due sottogruppi morfologici, a piccole e a grandi cellule (15-19).
Le definizioni derivanti dalla classificazione OMS 2019 devono essere necessariamente integrate e completate dalla definizione dello stadio TNM (estensione dell’invasione neoplastica) (6,7,20-23).
Ulteriori parametri non sono obbligatori per tutti i referti, ma possono risultare utili in specifici casi di GEP-NEN: dimensioni del tumore, multi-centricità, presenza di invasione vascolare e/o peri-neurale, stato dei margini di resezione chirurgica, distanza del tumore dai margini stessi. Ad esempio, nelle NEN appendicolari è necessario avere la dimensione macroscopica del tumore, lo stato dei margini e dell’infiltrazione del meso; nello stomaco è consigliata la valutazione quantitativa e qualitativa delle lesioni iperplastiche e/o displastiche delle cellule enterochromaffin-like (ECL) nel contesto di gastrite cronica atrofica del corpo gastrico (24,25).
Profilo immuno-istochimico
L’identificazione del fenotipo neuroendocrino prevede l’utilizzo di marcatori immuno-istochimici capaci di definire la natura neuroendocrina della neoplasia: Cromogranina A (CgA) e Sinaptofisina (SIN). I restanti marcatori neuroendocrini generali CD56 (N-CAM), PGP 9.5, NSE (enolasi neurono-specifica) sono poco affidabili e riproducibili: nelle condizioni in cui la natura neuroendocrina della neoplasia è sostenuta solo da uno di questi, in assenza di convincente positività almeno per SIN è opportuno discutere il caso nell’ambito di un tavolo multi-disciplinare.
I NEC preservano la positività per SIN ma possono mostrare espressione ridotta di CgA. Per le NEN scarsamente differenziate è opportuno in casi dubbi ricorrere anche a tecniche FISH e PCR per la definizione del corretto fenotipo tumorale (26). Ancorché la secrezione ormonale non sia sinonimo di sindrome ormono-correlata e non rappresenti pertanto prova di funzionalità della NEN, la definizione del profilo di produzione ormonale (insulina, glucagone, somatostatina, polipeptide intestinale vasoattivo, gastrina, serotonina, calcitonina) è un utile complemento alla diagnosi (soprattutto per NEN pancreatiche e duodenali).
Per definire l’origine di una NEN a primitività occulta possono essere utili fattori trascrizionali, quali TTF-1 (che depone per origine polmonare) (27), CDX-2 (origine GEP, con espressione più intensa ed estesa per le sedi intestinali) (28), Islet-1 (origine pancreatica) (29). Le informazioni ottenute dall’uso di questi marcatori vanno comunque interpretate in un contesto clinico appropriato, in considerazione del fatto che l’affidabilità dell’espressione di questi fattori di trascrizione è inversamente proporzionale al grado di differenziazione della NEN.
La ricerca immuno-istochimica dei recettori per la somatostatina (SSTR) è considerata opzionale, ristretta al sottotipo 2 ed eventualmente al 3 e 5, che sono i recettori bersaglio di octreotide e lanreotide, con l’uso di anticorpi monoclonali: viene interpretata come positiva in presenza di una reattività di membrana, per la cui valutazione è consigliabile l’uso di punteggi, secondo proposte pubblicate e validate (30).
Conclusioni
I requisiti minimi indispensabili in un esame istologico possono essere riassunti come segue:
- morfologia tumorale (tumore ben differenziato o scarsamente differenziato);
- immuno-istochimica positiva per CgA e SIN;
- proliferazione tumorale valutata con Ki-67 e indice mitotico.
In caso di materiale operatorio, è necessario integrare il referto anatomo-patologico con la valutazione di:
- angio-invasione;
- invasione peri-neurale;
- invasione locale: profondità d’invasione per i visceri e infiltrazione del parenchima esocrino nel pancreas;
- stadio secondo TNM.
Bibliografia
- Bosman FT. World Health Organization Classification of Tumours. Pathology and Genetics. Tumors of the Digestive System. 4th Edition. International Agency for Research on Cancer, Lyon (France): 2010.
- Boudreaux JP, Klimstra DS, Hassan MM, et al. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the jejunum, ileum, appendix, and cecum. Pancreas 2010, 39: 753-66.
- Panzuto F, Boninsegna L, Fazio N, et al. Metastatic and locally advanced pancreatic endocrine carcinomas: analysis of factors associated with disease progression. J Clin Oncol 2011, 29: 2372–7.
- Vinik AI, Woltering EA, Warner RR, et al. NANETS consensus guidelines for the diagnosis of neuroendocrine tumor. Pancreas 2010, 39: 713-34.
- La Rosa S, Sessa F, Uccella S. Mixed Neuroendocrine-Nonneuroendocrine Neoplasms (MiNENs): unifying the concept of a heterogeneous group of neoplasms. Endocr Pathol 2016, 27: 284-311.
- WHO Classification of Tumours Editorial Board. Digestive system tumours. 5th Edition. International Agency for Research on Cancer, Lyon (France), 2019.
- Rindi G, Kloppel G, Alhman H, et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006, 449: 395-401.
- Carlinfante G, Baccarini P, Berretti D, et al. Ki-67 cytological index can distinguish well-differentiated from poorly differentiated pancreatic neuroendocrine tumors: a comparative cytohistological study of 53 cases. Virchows Arch 2014, 465: 49-55.
- Neoplasms of the neuroendocrine pancreas. In: Lloyd RV, Osamura RY, Klöppel G, Rosai J (Eds). WHO Classification of Tumours of Endocrine Organs. WHO/IARC Classification of Tumours, 4th Edition, 2017, volume 10: page 209–39.
- Grillo F, Albertelli M, Brisigotti MP, et al. Grade increases in gastro-entero-pancreatic neuroendocrine tumor metastases compared to the primary tumor. Neuroendocrinology 2016, 103: 452-9.
- Tatsumoto S KY, Sakurai Y, Shinohara T, et al. Pancreatic neuroendocrine neoplasm: correlation between computed tomography enhancement patterns and prognostic factors of surgical and endoscopic ultrasound-guided fine-needle aspiration biopsy specimens. Abdom Imaging 2013, 38: 358-66.
- Milione M, Maisonneuve P, Spada F, et al. The clinicopathologic heterogeneity of grade 3 gastroenteropancreatic neoplasms: morphological differentiation and proliferation identify different prognostic categories. Neuroendocrinology 2017, 104: 85-93.
- Milione M, Maisonneuve P, Pellegrinelli A, et al. Ki67 proliferative index of the neuroendocrine component drives MANEC prognosis. Endocr Relat Cancer 2018, 25: 583-93.
- La Rosa S, Adsay V, Albarello L, et al. Clinicopathologic study of 62 acinar cell carcinomas of the pancreas: insights into the morphology and immunophenotype and search for prognostic markers. Amer J Surg Pathol 2012, 36: 1782-95.
- Bettini R, Boninsegna L, Mantovani W, et al. Prognostic factors at diagnosis and value of WHO classification in a mono-institutional series of 180 non-functioning pancreatic endocrine tumours. Ann Oncol 2008, 19: 903-8.
- Ekeblad S, Skogseid B, Dunder K, et al. Prognostic factors and survival in 324 patients with pancreatic endocrine tumor treated at a single institution. Clin Cancer Res 2008, 14: 7798-803.
- Franko J, Feng W, Yip L, et al. Non-functional neuroendocrine carcinoma of the pancreas: incidence, tumor biology, and outcomes in 2,158 patients. J Gastrointest Surg 2010, 14: 541-8.
- Panzuto F, Nasoni S, Falconi M, et al. Prognostic factors and survival in endocrine tumor patients: comparison between gastrointestinal and pancreatic localization. Endocr Relat Cancer 2005, 12: 1083-92.
- Kloppel G, Rindi G, Perren A, et al. The ENETS and AJCC/UICC TNM classifications of the neuroendocrine tumors of the gastrointestinal tract and the pancreas: a statement. Virchows Archiv 2010, 456: 595-7.
- Pape UF, Perren A, Niederle B, et al. ENETS Consensus guidelines for the management of patients with neuroendocrine neoplasms from the jejuno-ileum and the appendix including goblet cell carcinomas. Neuroendocrinology 2012, 95: 135-56.
- Pavel M, Baudin E, Couvelard A, et al. ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology 2012, 95: 157-76.
- Scarpa A, Mantovani W, Capelli P, et al. Pancreatic endocrine tumors: improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients. Mod Pathol 2010, 23: 824-33.
- Sobin LH, Gosporadowicz MK, Wittekind K. TNM classification of malignant tumors, 7th edition. Wiley 2011.
- Peghini PL, Annibale B, Azzoni C, et al. Effect of chronic hypergastrinemia on human enterochromaffin-like cells: insights from patients with sporadic gastrinomas. Gastroenterology 2002, 123: 68-85.
- Vanoli A, La Rosa S, Luinetti O, et al. Histologic changes in type A chronic atrophic gastritis indicating increased risk of neuroendocrine tumor development: the predictive role of dysplastic and severely hyperplastic enterochromaffin-like cell lesions. Hum Pathol 2013, 44: 1827-37.
- Milione M, Gasparini P, Sozzi G, et al. Ewing sarcoma of the small bowel: a study of seven cases, including one with the uncommonly reported EWSR1-FEV translocation. Histopathology 2014, 64: 1014-26.
- Zhang C, Schmidt LA, Hatanaka K, et al. Evaluation of napsin A, TTF-1, p63, p40, and CK5/6 immunohistochemical stains in pulmonary neuroendocrine tumors. Amer J Clin Pathol 2014, 142: 320-4.
- Zimmermann N, Lazar-Karsten P, Keck T, et al. Expression pattern of CDX2, estrogen and progesterone receptors in primary gastroenteropancreatic neuroendocrine tumors and metastases. Anticancer Res 2016, 36: 921-4.
- Schmitt AM, Riniker F, Anlauf M, et al. Islet 1 (Isl1) expression is a reliable marker for pancreatic endocrine tumors and their metastases. Amer J Surg Pathol 2008, 32: 420-5.
- Volante M, Brizzi MP, Faggiano A, et al. Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy. Mod Pathol 2007, 20: 1172-82.
Diagnostica di laboratorio dei NET
La determinazione dei marcatori serici non deve essere usata come prima linea per la diagnosi di NET, mentre il suo uso è appropriato per monitorare la risposta al trattamento e per il follow-up.
In fase diagnostica i marcatori devono quindi essere usati solo dopo:
- aver fatto la diagnosi di NET o in presenza di sospetto clinico molto forte
- avere escluso le possibili condizioni fisiologiche e patologiche di confondimento.
NETest (biopsia liquida multigenica dei tumori neuroendocrini)
Bibliografia
- Ardill JE, Eriksson B. The importance of the measurement of circulating markers in patients with neuroendocrine tumours of the pancreas and gut. Endocr Relat Cancer 2003, 10: 459–62.
- Ardill JES, O’Dorisio TM. Circulating biomarkers in neuroendocrine tumors of the enteropancreatic tract: application to diagnosis, monitoring disease, and as prognostic indicators. Endocrinol Metab Clin North Am 2010, 40: 777-90.
Cromogranina
Marco Caputo
Dipartimento Servizi di Diagnosi e Cura, AUSL 22 Regione Veneto, Bussolengo (VR)
La cromogranina A (CgA) è un marcatore serico di ampio uso per i NET, ma con alcuni limiti (1).
La CgA circola in differenti forme antigeniche e non è disponibile uno standard di calibrazione universale (2). I risultati ottenuti con metodiche RIA e IRMA sono grosso modo equivalenti (3), ma gli intervalli di riferimento sono variabili e i risultati ottenuti con dosaggi diversi non sono confrontabili.
I livelli di CgA possono aumentare in alcune condizioni patologiche (tabella) e nei soggetti sani dopo il pasto o dopo esercizio fisico. I livelli sono molto variabili nella popolazione generale (4) e possono mostrare un certo grado di sovrapposizione fra I pazienti con NET e I controlli. Di conseguenza il valore della CgA è scarso come prima linea diagnostica (2,4,5-9).
| Cause di aumento di CgA (oltre ai NET) | |
| Neoplastiche (differenti dai NET) | K mammario K prostatico K ovarico Epatocarcinoma Adenocarcinoma pancreatico K colon |
| Non neoplastiche | Insufficienza renale Insufficienza cardiaca Ipertiroidismo Iperparatiroidismo Malattie infiammatorie locali o sistemiche BPCO Patologie gastro-enteriche: gastrite cronica atrofica, pancreatite, malattia infiammatoria intestinale, cirrosi, epatite cronica |
Gli inibitori di pompa protonica (PPI) aumentano I livelli di CgA (fino a 7 volte). L’effetto persiste per parecchi giorni dopo la sospensione dei PPI. Perciò il dosaggio di CgA dovrebbe essere eseguito dopo una sospensione di almeno 2 settimane (4,10). L’effetto degli anti-H2 è ancora controverso (11).
L’accuratezza diagnostica di CgA dipende da alcune variabili:
- estensione del tumore: la sensibilità è stata riportata del 60-100% nei metastatici e del 29-50% nei localizzati (4,7,12);
- tipo e localizzazione del tumore: sensibilità del 96% nei NET funzionanti e del 75% nei non funzionanti (6,13).
Bibliografia
- Stridsberg M, Öberg K, Li Q, et al. Measurements of chromogranin A, chromogranin B (secretogranin I), chromogranin C (secretogranin II) and pancreastatin in plasma and urine from patients with carcinoid tumours and endocrine pancreatic tumours. J Endocrinol 1995, 144: 49-59.
- Stridsberg M, Eriksson B, Öberg K, Janson ET. A comparison between three commercial kits for chromogranin A measurements. J Endocrinol 2003, 177: 337-41.
- Zatelli MC, Torta M, Leon A, et al; Italian CromaNet Working Group. Chromogranin A as a marker of neuroendocrine neoplasia: an Italian Multicenter Study. Endocr Relat Cancer 2007, 14: 473–82.
- Granberg D, Stridsberg M, Seensalu R, et al. Plasma chromogranin A in patients with multiple endocrine neoplasia type 1. J Clin Endocrinol Metan 1999, 84: 2712-7.
- Lawrence B, Gustafsson BJ, Kidd M, et al. The clinical relevance of chromogranin A as a biomarker for gastroenteropancreatic neuroendocrine tumors. Endocrinol Metab Clin North Am 2011, 40: 111-34.
- Campana D, Nori F, Piscitelli L, et al. Chromogranin A: is it a useful marker of neuroendocrine tumors? J Clin Oncol 2007, 25: 1967-73.
- Modlin IM, Gustafsson BI, Moss SF, et al. Chromogranin A--biological function and clinical utility in neuro endocrine tumor disease. Ann Surg Oncol 2010, 17: 2427-43.
- Singh S, Law C. Chromogranin A: a sensitive biomarker for the detection and post-treatment monitoring of gastroenteropancreatic neuroendocrine tumors. Expert Rev Gastroenterol Hepatol 2012, 6: 313-34.
- Marotta V, Nuzzo V, Ferrara T, et al. Limitations of Chromogranin A in clinical practice. Biomarkers 2012, 17: 186-91.
- Mosli HH, Dennis A, Kocha W, et al. Effect of short-term proton pump inhibitor treatment and its discontinuation on chromogranin A in healthy subjects. J Clin Endocrinol Metab 2012, 97: E1731-5.
- Korse CM, Muller M, Taal BG. Discontinuation of proton pump inhibitors during assessment of chromogranin A levels in patients with neuroendocrine tumours. Br J Cancer 2011, 105: 1173-5.
- Nikou GC, Marinou K, Thomakos P, et al. Chromogranin A levels in diagnosis, treatment and follow-up of 42 patients with non-functioning pancreatic endocrine tumours. Pancreatology 2008, 8: 510-9.
- Panzuto F, Severi C, Cannizzaro R, et al. Utility of combined use of plasma levels of chromogranin A and pancreatic polypeptide in the diagnosis of gastrointestinal and pancreatic endocrine tumors. J Endocrinol Invest 2004, 27: 6-11.
Altri marcatori generali per i NET
Marco Caputo
Dipartimento Servizi di Diagnosi e Cura, AUSL 22 Regione Veneto, Bussolengo (VR)
Nel complesso questi marcatori hanno uso clinico limitato.
L’enolasi neurone-specifica (NSE) è un enzima presente nelle cellule di derivazione neuroectodermica. La sua presenza è stata riportata in carcinomi tiroidei e prostatici, neuroblastomi, microcitomi polmonari e feocromocitomi. L’utilità clinica di questo marcatore è scarsa, vista la bassa specificità (1). Si trovano livelli elevati di NSE nel 30-50% dei pazienti con NET, in particolare in quelli scarsamente differenziati. La sensibilità nella diagnostica dei NET può essere aumentata dalla combinazione di NSE con CgA (2).
Il polipeptide pancreatico (PP) è secreto da cellule insulari specializzate; inibisce la motilità intestinale e la secrezione pancreatica esocrina. Il dosaggio di PP è stato proposto nella diagnosi e monitoraggio dei NET pancreatici non funzionanti: in combinazione con CgA ha sensibilità fino al 93% (3). I livelli di PP possono aumentare nell’anziano, e in seguito a diarrea, abuso di lassativi, processi infiammatori intestinali e nefropatie croniche.
La subunità beta della gonadotropina corionica (ßhCG), glicoproteina sintetizzata dal sinciziotrofoblasto in gravidanza, può essere aumentata nei pazienti con NET pancreatico (4), ma è priva di utilità per questo uso clinico.
Bibliografia
- Seregni E, Ferrari L, Stivanello M, Dogliotti L. Laboratory tests for neuroendocrine tumours. Q J Nucl Med 2000, 44: 22-41.
- Korse CM, Taal BG, Vincent A, et al. Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade. A marker study of chromogranin A, neuron specific enolase, progastrin-releasing peptide and cytokeratin fragments. Eur J Cancer 2012, 48 (5): 662–71.
- Panzuto F, Severi C, Cannizzaro R, et al. Utility of combined use of plasma levels of chromogranin A and pancreatic polypeptide in the diagnosis of gastrointestinal and pancreatic endocrine tumors. J Endocrinol Invest 2004, 27: 6-11.
- Shah T, Srirajaskanthan R, Bhogal M, et al. Alpha-fetoprotein and human chorionic gonadotrophin-beta as prognostic markers in neuroendocrine tumour patients. Br J Cancer 2008, 99: 72-7.
Marcatori specifici per i NET
Marco Caputo
Dipartimento dei Servizi di Diagnosi e Cura, Ospedale G. Fracastoro, Azienda ULSS20, Verona
Acido 5-idrossi-indolacetico
L’acido 5-idrossi-indolacetico (5-HIAA), iI principale metabolita urinario della serotonina, viene dosato sulle urine delle 24 ore con metodica HPLC. I risultati possono essere espressi in valori assoluti o come rapporto con l’escrezione di creatinina.
Alcune variabili pre-analitiche, soprattutto alimenti ricchi di serotonina o triptofano e farmaci, possono interferire con il metabolismo della serotonina (tabella 1). Questi prodotti devono essere evitati prima della raccolta urinaria (1): gli alimenti per almeno 72 ore, i farmaci per almeno 24 ore.
| Tabella 1 (2) Farmaci e alimenti che interferiscono con il dosaggio di 5-HIAA |
|
| Falsi negativi | Acido acetilsalicilico Fenotiazine: clorpromazina, prometazina Imipramina e MAO-inibitori ACTH Etanolo MetilDOPA e derivati dell’idrazina Chetoacidi LevoDOPA Isoniazide, metenamina, acido gentisico e omogentisico Streptozotocina Eparina |
| Falsi positivi | Acetaminofene, Naproxene, Fenacetina Caffeina, Nicotina Acido coumarico Diazepam Efedrina Fluorouracile, Melfalan Fenobarbitale Fentolamina, Reserpina,Guaifenesina, Mefenisina Metamfetamina, Fenmetrazina Metocarbamolo Mesalamina Alimenti: banane, avocado, kiwi, ananas, noccioline, pomodori, prugne, zucchine, melanzane, noci, caffè, tè, cacao/cioccolata, vaniglia, dolci e torte (consentiti zucchero e marmellata d’arance) |
I valori normali di 5-HIAA variano da 2 a 8 mg/die, ma si possono trovare aumenti aspecifici (fino a 30 mg/die) in sindromi da malassorbimento come la celiachia e il morbo di Whipple (3-5).
Il dosaggio dell’escrezione urinaria di 5-HIAA ha sensibilità > 90% e specificità del 90% nei casi di sindrome carcinoide conclamata, in cui è solitamente > 90 mg/die (fino a 2000 mg/die). La sensibilità è però minore in assenza di sintomatologia (6,7).
Sono stati proposti dosaggi ematici della serotonina, di cui non è ben nota l’effettiva accuratezza. In realtà, si possono evidenziare falsi positivi dovuti a interferenze: liberazione di serotonina dalle piastrine o ingestione di cibi ricchi di serotonina o triptofano (7). Di conseguenza il dosaggio ematico della serotonina non è raccomandato nella pratica clinica.
Gastrina
La determinazione della gastrina riveste un ruolo chiave nella valutazione dei pazienti con clinica suggestiva per sindrome di Zollinger-Ellison (ZES).
Esistono diverse forme antigeniche circolanti di gastrina e alcun dosaggi del commercio rilevano solo la gastrina-17 (8).
Per ipergastrinemia si intende solitamente un valore di gastrina a digiuno > 100 pg/mL. Sarebbe necessario un dosaggio contemporaneo del pH gastrico su singolo campione per escludere una forma di ipergastrinemia secondaria: nella gastrite atrofica, anemia perniciosa o acloridria gli alti livelli di gastrina si associano a pH > 4. Invece una gastrinemia > 1000 pg/mL in presenza di pH gastrico < 2 è virtualmente diagnostica di ZES (tabella 2).
| Tabella 2 Cause di ipergastrinemia |
|
| Ipergastrinemia inappropriata (pH gastrico acido, ≤ 2) |
Ipergastrinemia appropriata (pH gastrico elevato, > 2) |
| Gastrinoma | Gastrite cronica atrofica: autoimmune o HP-associata |
| Gastrite antrale HP-positiva | Iatrogena: inibitori di pompa, anti-H2, pregressa vagotomia |
| Ostruzione pilorica | |
| Insufficienza renale | |
| Iatrogena: pregresso intervento Billroth II | |
Alcuni farmaci (tabella 3) danno ipergastrinemia e dovrebbero essere sospesi per almeno 2 settimane prima del dosaggio (5, 9-13).
| Tabella 3 Principali interferenti alimentari e iatrogeni su dosaggio di gastrina |
|
| Falsi negativi | Acido acetilsalicilico LevoDOPA |
| Falsi positivi | Ipocloridria/acloridria da uso cronico di PPI e anti-H2 o gastrite cronica atrofica (spesso associata ad anemia perniciosa) Infezione daHelicobacter pylori Ostruzione pilorica Insufficienza renale Sindrome delle cellule G antrali Sindrome dell’intestino corto Antro ritenuto |
In generale, i livelli di gastrina sono maggiori nei NET pancreatici rispetto ai duodenali e sono proporzionali all’estensione tumorale (nei pazienti metastatici si possono osservare livelli estremamente alti). Però, nella maggior parte dei pazienti con ZES si trovano livelli di gastrina nell’ambito dei 150-1000 pg/mL, in parziale sovrapposizione con i livelli riscontrati nell’insufficienza renale, resezioni del piccolo intestino, antro ritenuto e durante trattamento con potenti anti-secretori gastrici (14). Nel caso di dubbio diagnostico, può essere utile il test alla secretina.
Insulina
Nei non diabetici il riscontro ripetuto di ipoglicemia sintomatica (< 60 mg/dL) deve far sorgere il sospetto di insulinoma. La diagnosi è confermata dalla presenza di insulinemia non soppressa in presenza di ipoglicemia.
Per escludere ipoglicemie spurie, la determinazione di laboratorio deve essere espletata entro breve tempo dal prelievo. Nei soggetti con leucocitosi è opportuno ripeterla aggiungendo prima del prelievo alla provetta un inibitore della glicolisi.
In presenza di episodi spontanei di grave ipoglicemia iperinsulinemica, è appropriata la determinazione contemporanea di peptide-C e ß-idrossibutirrato. Nel sospetto di ipoglicemia factizia, bisogna eseguire una ricerca urinaria delle sulfaniluree. Il dosaggio della proinsulina può completare il pannello (15): non è ampiamente disponibile, ma può portare alla diagnosi di insulinoma secernente forme immature di insulina.
In pazienti selezionati con iperinsulinismo endogeno, in cui si sospetti un’ipoglicemia autoimmune sulla base della coesistenza di disordini autoimmuni e della negatività dei test di diagnostica per immagini, si possono dosare gli anticorpi anti-insulina (16).
Se il paziente non è ipoglicemico al momento dell’osservazione, si deve eseguire il test del digiuno (32).
Altri marcatori specifici
Glucagone
Il glucagone subisce una rapida degradazione in vitro e quindi i campioni devono essere raccolti in provette contenenti aprotinina come anti-proteolitico e consegnati rapidamente al laboratorio. I risultati ottenuti in diversi laboratori possono essere molto diversi, per problemi di calibrazone e diversa cross-reazione con le differenti forme antigeniche della molecola.
Concentrazioni di glucagone > 1000 pg/mL sono virtualmente diagnostiche di glucagonoma (17). Alcuni pazienti affetti possono avere concentrazioni solo modicamente elevate, come si osservano in alcune condizioni: digiuno protratto in soggetti normali; insufficienza epatica, insufficienza renale, trauma, sepsi, pancreatite, chirurgia addominale, sindrome di Cushing.
Peptide intestinale vasoattivo (VIP)
Le concentrazioni di VIP sono molto basse nei soggetti sani. Un risultato > 75 pg/mL (da confermare con una seconda determinazione) associato a un quadro clinico suggestivo (sindrome di Verner-Morrison) consente la diagnosi di VIPoma (18,19).
Il dosaggio è disponibile solo in alcuni centri di terzo livello.
Bibliografia
- Modlin IM, Gustafsson BI, Moss SF, et al. Chromogranin A--biological function and clinical utility in neuro endocrine tumor disease. Ann Surg Oncol 2010, 17: 2427-43.
- Pape UF, Perren A, Niederle B, et al; Barcelona Consensus Conference participants. ENETS Consensus Guidelines for the management of patients with neuroendocrine neoplasms from the jejuno-ileum and the appendix including goblet cell carcinomas. Neuroendocrinology 2012, 95: 135-56.
- Kema IP, de Vries EG, Muskiet FA. Measurement of 5-HIAA in urine. Ann Clin Biochem 1995, 32: 102–4.
- Kema IP, de Vries EG, Muskiet FA. Clinical chemistry of serotonin and metabolites. J Chromatogr B Biomed Sci Appl 2000, 747: 33–48.
- O’Toole D, Grossman A, Gross D, et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: biochemical markers. Neuroendocrinology 2009, 90: 194–202.
- Sjoblom SM. Clinical presentation and prognosis of gastrointestinal carcinoid tumours. Scand J Gastroenterol 1988, 23: 779-87.
- Allen KR, Degg TJ, Anthoney DA, Fitzroy-Smith D. Monitoring the treatment of carcinoid disease using blood serotonin and plasma 5-hydroxyindoleacetic acid: three case examples. Ann Clin Biochem 2007, 44: 300-7.
- Rehfeld JF, Gingras MH, Bardram L, et al. The Zollinger-Ellison syndrome and mismeasurement of gastrin. Gastroenterology 2011, 140: 1444-53.
- Dhillo WS, Jayasena CN, Lewis CJ, et al. Plasma gastrin measurement cannot be used to diagnose a gastrinoma in patients on either proton pump inhibitors or histamine type-2 receptor antagonists. Ann Clin Biochem 2006, 43 (Pt 2): 153-5.
- Arnold R. Diagnosis and differential diagnosis of hypergastrinemia. Wien Klin Wochenschr 2007, 119: 564–9.
- Banasch M, Schmitz F. Diagnosis and treatment of gastrinoma in the era of proton pump inhibitors. Wien Klin Wochenschr 2007, 119: 573–8.
- Osefo N, Ito T, Jensen RT. Gastric acid hypersecretory states: recent insights and advances. Curr Gastroenterol Rep 2009, 11: 433–41.
- Rehfeld JF, Bardram L, Hilsted L, et al. Pitfalls in diagnostic gastrin measurements. Clin Chem 2012, 58: 831-6.
- Berna MJ, Hoffmann KM, Serrano J, et al. Serum gastrin in Zollinger-Ellison syndrome. Prospective study of fasting serum gastrin in 309 patients from the National Institutes of Health and comparison with 2,229 cases from the literature. Medicine (Baltimore) 2006, 85: 295–330.
- Service F. Diagnostic approach to adults with hypoglycaemic disorders. Endocrinol Metab Clin North Amer 1999, 28: 519–32.
- Vezzosi D, Bennet A, Fauvel J, et al. Insulin levels measured with an insulin-specific assay in patients with fasting hypoglycaemia related to endogenous hyperinsulinism. Eur J Endocrinol 2003, 149: 413–9.
- Wermers RA, Fatourechi V, Kvols LK. Clinical spectrum of hyperglucagonemia associated with malignant neuroendocrine tumors. Mayo Clin Proc 1996, 71: 1030-8.
- Krejs GJ. Vipoma syndrome. Am J Med 1987, 82: 37-48.
- Grier JF. WDHA (watery diarrhea, hypokalemia, achlorhydria) syndrome: clinical features, diagnosis, and treatment. South Med J 1995, 88: 22-4.
Test dinamici
Maria Vittoria Davì1 & Chiara Martini2
1UOC Medicina Interna D, Policlinico GB Rossi, AOUI Verona
2Clinica Medica 3^, Azienda Ospedaliera-Università di Padova
I test dinamici utilizzati nella diagnostica della sindrome di Zollinger-Ellison hanno lo scopo di confermare il sospetto clinico, laddove (in circa 2/3 dei casi) la determinazione della gastrinemia a digiuno (FSG) ricada in un range di elevazione lieve-moderata, che non è in grado di discriminare fra le molte altre cause non neoplastiche di ipergastrinemia, e la cui prognosi è sostanzialmente differente. Di frequente, infatti, vi è una sovrapposizione fra la FSG presente in tali condizioni e quella che si rinviene in corso di ZES. Solo un'ipergastrinemia severa (FSG > 10 volte il limite superiore di normalità = 100 pg/mL), in associazione ad un pH acido del succo gastrico (≤ 2), in presenza ovviamente di una clinica suggestiva, può supportare la diagnosi di ZES senza che sia necessario ricorrere a test dinamici e dopo aver escluso una sindrome dell'antro ritenuto (post-gastrectomia parziale). I test dinamici che sono stati proposti per la diagnosi di ZES sono il test alla secretina, il test al calcio, il pasto misto e il test al glucagone, ma solo per i primi 2 è stato raggiunto un livello di standardizzazione dei criteri diagnostici che ne consente l'utilizzo nella pratica clinica (1,2).
Per la diagnosi differenziale delle ipoglicemie, si utilizza il test del digiuno protratto.
Bibliografia
- Metz DC. Diagnosis of Zollinger-Ellison syndrome. Clin Gastroenterol Hepatol 2012, 10: 126-30.
- Ito T, Cadiot G, Jensen RT. Diagnosis of Zollinger-Ellison syndrome: increasingly difficult. World J Gastroenterol 2012, 18: 5495-503.
Test alla secretina
Maria Vittoria Davì1 & Chiara Martini2
1UOC Medicina Interna D, Policlinico GB Rossi, AOUI Verona
2Clinica Medica 3^, Azienda Ospedaliera-Università di Padova
| Test con secretina | |
| Indicazioni | Conferma del sospetto clinico di sindrome di Zollinger-Ellison nei casi dubbi, cioè quando in presenza di elevato sospetto clinico i valori di gastrinemia a digiuno (in assenza di interferenze) sono aumentati ma senza arrivare alla soglia diagnostica (10 x il limite superiore di normalità) e il pH gastrico è < 2. |
| Meccanismo d’azione | Fisiologicamente la secretina, prodotta a livello duodenale in risposta all'abbassamento del pH, stimola la secrezione di succo pancreatico ricco di bicarbonato, con la funzione di tamponare il succo acido proveniente dallo stomaco. La secretina, inoltre, stimola la secrezione di somatostatina da parte delle cellule D gastriche che, con azione paracrina, inibisce la secrezione di gastrina da parte delle cellule G dell'antro gastrico. Le cellule D rispondono direttamente anche all'abbassamento del pH (1). I recettori per la secretina sono presenti sia sulle cellule G dell'antro gastrico che sulle cellule dei gastrinomi. La risposta delle cellule G allo stimolo secretinico nel soggetto normale è minima o addirittura si verifica una riduzione della gastrina, in quanto contemporaneamente la secretina stimola la secrezione di somatostatina che frena la secrezione di gastrina da parte delle stesse cellule G (figura). Il gastrinoma, localizzato al di fuori dell'antro, non subisce questo controllo paracrino da parte della somatostatina e quindi prevale l'effetto stimolatorio della secretina sulle cellule neoplastiche. |
| Controindicazioni | Gravidanza e allattamento. |
| Materiale necessario per l’esecuzione | Secretina (Secrelux®: 0.029 mg di secretina penta-idrocloride, equivalenti a 100 U Cliniche) |
| Relazione con età, sesso, peso corporeo, gravidanza | No. |
| Condizioni preliminari e precauzioni | Al fine di non incorrere in false positività, è necessaria la sospensione del trattamento in atto con PPI, situazione non sempre percorribile e non scevra da rischi nei pazienti con ZES. Viene quindi attualmente suggerita l'esecuzione del test una volta ottenuti il controllo clinico ed endoscopico della sindrome; solo allora è ipotizzabile la sospensione del PPI 5-7 giorni prima, sostituendolo con un anti-H2 a dosaggio elevato (450-600 mg ogni 6 h) da assumere sino a 24 ore prima del test; da questo momento sono concessi solo anti-acidi al bisogno, che tuttavia devono essere sospesi dalla mezzanotte precedente il test. Per il rischio legato al rebound dell'ipersecrezione acida alla sospensione del trattamento con PPI, durante questo periodo il paziente deve essere informato circa la necessità di recarsi in ospedale nel momento in cui dovessero comparire sintomi quali diarrea, nausea, vomito e dolori addominali. La decisione di eseguire il test deve quindi scaturire da una valutazione accorta del bilancio fra il rischio che l'esecuzione corretta del test comporta e quello di una mancata diagnosi di ZES. |
| Esecuzione | Dopo determinazione della gastrina al tempo -5' e 0', viene somministrata Secretina in bolo endovenoso (2 U/Kg di peso corporeo in 10 mL di NaCl 0.9%), con successive determinazioni della gastrina ai tempi 2', 5', 10', 15', 20'. |
| Possibili effetti collaterali | Occasionalmente crampi addominali, nausea, vomito e diarrea. Possibile flushing. |
| Valutazione risultati |
Sin dalla prima dimostrazione della peculiare risposta dei gastrinomi allo stimolo secretinico (5), lo sforzo dei ricercatori è stato quello di stabilire il cut-off migliore in termini di sensibilità e specificità, in grado di differenziare i gastrinomi dalle altre forme di ipergastrinemia (delta in pg/mL o percentuale). Per anni è stato accettato un cut-off di risposta ≥ 200 pg/mL rispetto ai valori basali (6), ma dal 2006 è stato suggerito un incremento della gastrina sierica ≥ 120 pg/mL rispetto ai valori basali. Tale criterio appare ottenere una migliore combinazione fra sensibilità e specificità (94% e 100% rispettivamente), massimizzando la sensibilità del test e annullando i falsi positivi (4). |
| Attendibilità e ripetibilità dei risultati |
L'entità di risposta allo stimolo secretinico appare correlata al grado di espressione dei recettori per la secretina a livello delle cellule neoplastiche (2). Poichè in corso di ipocloridria, condizione comune nella gastrite cronica atrofica (autoimmune o HP-associata) e durante il trattamento con PPI, l'iperplasia delle cellule G antrali può provocare una falsa positività del test alla secretina (4), la validità diagnostica di questo test non può prescindere dalla valutazione dello stato di acidità gastrica (4). |
| Giudizio complessivo costo beneficio e costo-efficacia | Ha una buona sensibilità, fattore importante nell'arrivare alla diagnosi tempestiva di un tumore potenzialmente maligno, che può essere guarito dalla chirurgia. |
| Bibliografia |
|

Test al calcio per gastrina
Maria Vittoria Davì1 & Chiara Martini2
1UOC Medicina Interna D, Policlinico GB Rossi, AOUI Verona
2Clinica Medica 3^, Azienda Ospedaliera-Università di Padova
| Test con calcio per gastrina | |
| Indicazioni | Conferma del sospetto clinico di sindrome di Zollinger-Ellison |
| Meccanismo d’azione | I livelli di calcio hanno grande influenza sulla gastrinemia nei pazienti con ZES, sia sporadica che inserita in una MEN-1, verosimilmente per un'azione diretta del calcio sulle cellule neoplastiche. |
| Controindicazioni | Ipercalcemia, cardiopatie aritmogene. |
| Materiale necessario per l’esecuzione | Calcio gluconato al 10% |
| Relazione con età, sesso, peso corporeo, gravidanza | No |
| Esecuzione | Somministrazione ev di calcio gluconato (al 10%, 5 mg/kg di peso corporeo/h, infusione continua per 3 ore), con prelievi ai tempi 0', 30', 60', 90', 120', 150', 180'. |
| Dosaggio | Gastrinemia |
| Possibili effetti collaterali | Nausea, dolore addominale, cefalea, flebite nella sede di infusione, parestesie, cardiopalmo, alterazioni ECGrafiche (intervallo Q-T), aumento della pressione con possibile necessità di interrompere il test |
| Parametri da monitorare durante l’esecuzione | ECG, PA |
| Manovre da eseguire dopo la fine del test | Misurazione calcemia e PA, esecuzione ECG |
| Valutazione risultati |
Il cut-off accettato di positività del test è un delta ≥ 395 pg/mL dei livelli di gastrina dopo stimolo (sensibilità 63%, specificità 100%). |
| Attendibilità e ripetibilità dei risultati |
È un test specifico; non correla con il quadro clinico o con le caratteristiche del tumore. |
| Giudizio complessivo costo beneficio e costo-efficacia | Attualmente il test al calcio viene considerato di seconda linea, meno maneggevole, da eseguirsi nei pazienti in cui il test alla secretina sia risultato negativo e permanga il forte sospetto clinico di ZES. Il test risulta positivo nel 38-50% dei pazienti con un test alla secretina negativo (3). |
| Bibliografia |
|
Altri test dinamici per gastrina
Maria Vittoria Davì1 & Chiara Martini2
1UOC Medicina Interna D, Policlinico GB Rossi, AOUI Verona
2Clinica Medica 3^, Azienda Ospedaliera-Università di Padova
Pasto standard
L'incremento fisiologico della gastrina in risposta a un pasto standard ricco di proteine (2 uova e toast) è ridotta nei pazienti affetti da gastrinoma. Tuttavia il test non appare in grado di discriminare fra la risposta tipica delle sindromi da ipergastrinemia di origine antrale e quella dei gastrinomi e per tale motivo non viene considerato clinicamente utile nella diagnostica della ZES (1).
Test al glucagone
Nei pazienti affetti da gastrinoma è stato dimostrato l'incremento paradosso della gastrina in risposta alla somministrazione ev di glucagone (20 µg ev in bolo, seguito da 20 µg/kg/h per 30' con prelievi ai tempi -3', -1', 3', 5', 7', 10', 15', 20', 30'). I criteri diagnostici di positività per questo test provocativo tuttavia non sono al momento attuale stabiliti, per la ridotta casistica sui cui è stato applicato e saranno necessari ulteriori studi per determinarne la reale efficacia diagnostica (2,3).
Bibliografia
- Berna MJ, Hoffmann KM, Long SH, et al. Plasma gastrin in Zollinger-Ellison syndrome: II. Prospective study on gastrin provocative testing in 293 patients from the National Institute of Health and comparison with 537 cases from the literature. Evaluation of diagnostic criteria, proposal of new criteria, and correlation with clinical and tumoral features. Medicine (Baltimore) 2006, 85: 331–64.
- Hansky J, Soveny C, Korman MG. The effect of glucagon on plasma gastrin. I: studies in normal subjects. Gut 1973, 14: 457–61.
- Shibata C, Funayama Y, Fukushima K, et al. The glucagon provocative test for the diagnosis and treatment of Zollinger-Ellison syndrome. J Gastrointest Surg 2008, 12: 344–9.
Test del digiuno protratto
Maria Vittoria Davì1 & Chiara Martini2
1UOC Medicina Interna D, Policlinico GB Rossi, AOUI Verona
2Clinica Medica 3^, Azienda Ospedaliera-Università di Padova
| Test del digiuno | |
| Premessa | Secondo le linee guida 2009 dell'Endocrine Society riguardanti la gestione dei disordini ipoglicemici, la diagnosi di ipoglicemia iperinsulinemica viene posta sulla base dei seguenti criteri:
|
| Indicazioni |
L'indicazione al test al digiuno è la diagnosi differenziale delle ipoglicemie iperinsulinemiche. Il sospetto clinico di insulinoma non può prescindere dalla conferma della “triade di Whipple”: sintomi e segni compatibili con ipoglicemia; concentrazione di glucosio < 45 mg/dL; regressione dei sintomi e segni dopo somministrazione di glucosio. |
| Meccanismo d’azione | Nel soggetto normale l’ipoglicemia si associa di regola a valori di insulina inibita. Il riscontro di livelli di insulina dosabili o lievemente aumentati deve fare sospettare una produzione autonoma di insulina svincolata dal controllo glicemico. Alcuni autori consigliano al termine del test al digiuno l'esecuzione del test al glucagone: poiché l’insulina ipersecreta determina accumulo di glicogeno nel fegato, i pazienti con ipoglicemia mediata dall’insulina rispondono al glucagone, che è un potente glicogeno-litico, con liberazione di glucosio. |
| Controindicazioni |
Nessuna (il test al glucagone è controindicato nei pazienti con feocromocitoma) |
| Relazione con età, sesso, peso corporeo, gravidanza | Donne giovani magre e sane possono presentare valori di ipoglicemia (anche intorno a 40 mg/dL) durante il test, asintomatiche |
| Precauzioni |
Il test va sempre eseguito in regime di ricovero ospedaliero, con stretto monitoraggio clinico e laboratoristico. |
| Procedure abbinabili | Test al glucagone al termine |
| Esecuzione |
Reperire accesso venoso e porre il paziente a digiuno dalla mezzanotte, consentendo la sola assunzione di acqua. Ogni 6 ore a partire dal digiuno eseguire un prelievo per glicemia, insulina, C-peptide.
|
| Valutazione risultati |
Test al digiuno positivo se: glicemia < 55 mg/dL (3 mmol/L), insulina ≥ 3 μU/mL (18 pmol/L), C-peptide ≥ 0.6 ng/mL (0.2 nmol/L). |
| Interpretazione |
Con i cut-off sovrariportati, sensibilità > 90% e specificità > 70%. Dovrebbe essere abbandonato come criterio diagnostico il rapporto insulina/glicemia, in quanto sono da preferire i valori assoluti d’insulina.
|
| Attendibilità e ripetibilità dei risultati |
Il test è positivo entro 48h nel 95% dei casi di insulinoma. |
| Giudizio complessivo costo beneficio e costo-efficacia | In caso di sospetto di insulinoma, il test al digiuno prolungato per 72 ore è considerato attualmente il "gold standard" per la conferma diagnostica. Il test al glucagone non presenta una standardizzazione diffusamente accettata e non sembra migliorare la performance diagnostica del test al digiuno "semplice". |
| Bibliografia |
|
Valutazione genetica nella diagnostica dei NET
Angela Valentina D'Elia
Servizio di Genetica, Azienda Ospedaliero-Universitaria Santa Maria della Misericordia di Udine
Circa il 5-10% dei GEP-NET ha una base ereditaria nell’ambito di una sindrome: MEN-1, malattia di von Hippel-Lindau (VHL), neurofibromatosi di tipo 1 (malattia di von Recklinghausen, NF1) e sclerosi tuberosa. Sono tutte patologie a trasmissione autosomica dominante (1).
MEN-1
I GEP-NET sono la seconda manifestazione più comune della MEN-1, riportata nel 30-70% dei casi nelle diverse casistiche (2,3). Si tratta soprattutto di forme non funzionanti.
Nell’80-90% delle forme familiari (4) e in circa il 42% delle sporadiche (5) si può identificare una mutazione germinale di MEN-1. La mutazione insorge denovo senza positività familiare in circa il 10% dei casi (6).
La valutazione genetica (con counseling consigliato) deve essere proposta al paziente indice e ai familiari di primo grado, anche se asintomatici (3). I familiari portatori della mutazione richiedono una sorveglianza per la diagnosi precoce dei tumori endocrini, mentre quelli che non sono portatori possono essere tranquillizzati.
Se non è possibile eseguire la valutazione genetica, gli individui a rischio devono essere sottoposti a valutazione periodica: vista la penetranza del ~100% e l’insorgenza precoce dell’iperparatiroidismo primario (7), i test di prima linea sono rappresentati dalla determinazione dei livelli serici di calcio e PTH.
Nella MEN-1 non è stata dimostrata correlazione fra genotipo e fenotipo (8,9), cioè individui con la stessa mutazione possono avere quadri clinici diversi.
Sindrome di von Hippel-Lindau
Nell’11-17% dei pazienti con VHL si riscontrano tumori endocrini pancreatici non funzionanti (10).
La penetranza della mutazione di VHL è quasi completa a 65 anni (11).
L’esame genetico rileva mutazioni virtualmente in tutti gli individui affetti (12) e deve essere proposto a tutti i pazienti con evidenza clinica di malattia e ai parenti di primo grado. Poiché lo screening oculistico per i soggetti a rischio inizia prima dei 5 anni, è suggerito lo studio molecolare anche nei bambini asintomatici (13,14).
Neurofibromatosi di tipo 1
Nell’1% dei pazienti con NF1 si rilevano GEP-NET (15).
NF1 dipende da una mutazione denovo in metà degli individui colpiti. La progenie di un individuo colpito ha il 50% di rischio di ereditare il gene NF1 alterato e le manifestazioni cliniche sono estremamente variabili anche all’interno della singola famiglia (16).
Nella pratica clinica non viene raccomandato lo studio molecolare: lo screening è utile solo negli individui che non corrispondono del tutto ai criteri diagnostici stabiliti dall’NIH.
Sclerosi tuberosa
In questi pazienti sono stati descritti alcuni casi di NET pancreatico (17-19).
La diagnosi è solitamente clinica e si rilevano mutazioni in circa l’85% degli individui che soddisfano i criteri per la diagnosi (20). In due terzi dei casi si tratta di una mutazione denovo.
Bibliografia
- Anlauf M, Garbrecht N, Bauersfeld J, et al. Hereditary neuroendocrine tumors of the gastroenteropancreatic system. Virchows Arch 2007, 451 Suppl 1: S29-38.
- Starker LF, Carling T. Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Curr Opin Oncol 2008, 21: 29-33.
- Thakker RV, Newey PJ, Walls GV, et al; Endocrine Society. Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1). J Clin Endocrinol Metab 2012, 97: 2990-3011.
- Brandi ML, Gagel RF, Angeli A, et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab 2001, 86: 5658–71.
- Ellard S, Hattersley AT, Brewer CM, Vaidya B. Detection of an MEN1 gene mutation depends on clinicalfeatures and supports current referral criteria for diagnostic molecular genetic testing. Clin Endocrinol 2005, 62: 169–75.
- Bassett JHD, Forbes SA, Pannett AAJ, et al. Characterization of mutations in patients with multiple endocrine neoplasia type I. Am J Hum Genet 1998, 62: 232–44.
- Machens A, Schaaf L, Karges W, et al. Age-related penetrance of endocrine tumours in multiple endocrine neoplasia type 1 (MEN1): a multicentre study of 258 gene carriers. Clin Endocrinol (Oxf) 2007, 67: 613–22.
- Lemos MC, Thakker RV. Multiple endocrine neoplasia type 1 (MEN1): analysis of 1336 mutations reported in the first decade following identification of the gene. Hum Mutat 2008, 29: 22–32.
- Wautot V, Vercherat C, Lespinasse J, et al. Germline mutation profile of MEN1 in multiple endocrine neoplasia type 1: search for correlation between phenotype and the functional domains of the MEN1 protein. Hum Mutat 2002, 20: 35–47.
- Corcos O, Couvelard A, Giraud S, et al. Endocrine pancreatic tumors in von Hippel-Lindau disease: clinical, histological, and genetic features. Pancreas 2008, 37: 85–93.
- Maher ER, Iselius L, Yates JR, et al. Von Hippel-Lindau disease: a genetic study. J Med Genet 1991, 28: 443–7.
- Lonser RR, Glenn GM, Walther M, et al. von Hippel-Lindau disease. Lancet 2003, 361: 2059–67.
- Rasmussen A, Nava-Salazar S, Yescas P, et al. Von Hippel-Lindau disease germline mutations in Mexican patients with cerebellar hemangioblastoma. J Neurosurg 2006, 104: 389–94.
- American Society of Clinical Oncology. Policy statement update: genetic testing for cancer susceptibility. J Clin Oncol 2003, 21: 2397-406.
- Dayal Y, Tallberg KA, Nunnemacher G, et al. Duodenal carcinoids in patients with and without neurofibromatosis. A comparative study. Am J Surg Pathol 1986, 10: 348–57.
- Williams VC, Lucas J, Babcock MA, et al. Neurofibromatosis type 1 revisited. Pediatrics 2009, 123: 124–33.
- Davoren PM, Epstein MT. Insulinoma complicating tuberous sclerosis. J Neurol Neurosurg Psychiatry 1992, 55: 1209.
- Francalanci P, Diomedi-Camassei F, Purificato C, et al. Malignant pancreatic endocrine tumor in a child with tuberous sclerosis. Am J Surg Pathol 2003, 27: 1386-9.
- van Slegtenhorst M, de Hoogt R, Hermans C, et al. Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34. Science 1997, 277: 805–8.
- Sancak O, Nellist M, Goedbloed M, et al. Mutational analysis of the TSC1 and TSC2 genes in a diagnostic setting: genotype–phenotype correlations and comparison of diagnostic DNA techniques in tuberous sclerosis complex. Eur J Hum Genet 2005, 13: 731–41.
NETest (biopsia liquida multigenica dei tumori neuroendocrini)
Elda Kara
SOC Endocrinologia e Malattie del Metabolismo, AOU S. Maria della Misericordia, Udine
(aggiornato al 30/4/2021)
INTRODUZIONE
Nonostante i progressi nella classificazione, nelle indagini di diagnostica per immagini (morfologiche e funzionali) e nelle strategie terapeutiche innovative, il progresso nel campo del trattamento dei tumori neuroendocrini (NET) è stato limitato e condizionato dalla mancanza di conoscenze sulla biologia molecolare della malattia (1). Il carico di malattia, sia microscopico che macroscopico, è spesso sottostimato dalla diagnostica per immagini (2-4). Fondamentale per i clinici è riuscire a identificare tempestivamente la cosiddetta quota di “malattia invisibile” e identificare i tumori che saranno responsivi o meno a un determinato trattamento. Per soddisfare queste esigenze, è necessario sviluppare metodiche di imaging nuove ed accurate oppure marcatori biochimici più sensibili e specifici rispetto a quelli attualmente in uso.
Per questi motivi, l’attenzione in precedenza posta sull’istologia tumorale si è spostata anche sull’identificazione e quantificazione di prodotti tumorali circolanti, come ad esempio DNA tumorale, cellule tumorali, RNA messaggeri (mRNA) (1). Il NETest è la prima biopsia liquida per i NET, paragonabile a un’impronta trascrittomica, che racchiude in sè informazioni essenziali sulla biologia e sull’attività della malattia tumorale. Consiste nella ricerca in un campione di sangue periferico di mRNA circolanti importanti per la diagnosi e la gestione dei NET, mediante QT-PCR (quantitative polymerase chain reaction) e criteri REMARK (REporting of tumor MARKer studies) (5). La ricerca e la quantificazione dell’espressione di geni NET-relati nel sangue periferico fornisce una cosiddetta firma biologica (“biological signature”) della neoplasia, che può essere rivalutata ad intervalli temporali regolari, permettendo di definire lo status di malattia (ad esempio stabile o in progressione) e come la biologia tumorale può cambiare nel corso del follow-up (6-8).
L’analisi viene eseguita su sangue periferico trattato con EDTA e i risultati vengono espressi come un indice di attività (NETest score), che va da 0 a 100 (9-14).
| Come interpretare i valori | |
| ≤ 20% | Normalità |
| 21-40% | Malattia stabile |
| 41-100% | Malattia in progressione |
In termini diagnostici questa firma biologica presenta una sensibilità/specificità del 90-97% (11), con risultati (espressi come Area Under Curve, AUC = 0.95-0.98) superiori a quelli di altri marcatori come cromogranina A (AUC = 0.64) e neurokinina A (AUC = 0.63) (11,15).
Il NETest può essere usato anche per determinare il grado di attività biologica tumorale che viene suddivisa in tre categorie (6,11,13,16):
- bassa attività ≤ 40%;
- attività intermedia 41-79%;
- alta attività (tumore biologicamente aggressivo) 80-100%.
Le ultime due categorie sono state associate con scarsa sopravvivenza libera da malattia (progression-free survival, PFS) e non responsività ai trattamenti eseguiti (12).
Alimentazione, età, sesso, etnia e trattamenti anti-acidi non interferiscono con i risultati del test (17,18), che hanno dimostrato alta riproducibilità (11).
Purtroppo il NETest non ha ancora ampia applicazione al di fuori di un ambito di ricerca.
CAMPI D’APPLICAZIONE DEL NETEST
Diagnostica (NET del piccolo intestino, del pancreas, bronco-polmonari, feocromocitoma e paragangliomi)
Localizzazione della malattia macroscopica e correlazione con l’imaging
In letteratura è stata già valutata e validata la concordanza tra la biopsia liquida NETest e le indagini di diagnostica per immagini (19): la concordanza è del 92% per TC/RM, del 94% per l’imaging funzionale e del 96% considerando tutte le metodiche (12,19,20). In caso di malattia macroscopicamente visibile il risultato del NETest è stato 100%, in accordo con le indagini di radiologia e paragonato al 98% con la PET-TC con Gallio (19). Alla luce di tali dati, l’utilità clinica della biopsia liquida riguarda non solo il riconoscimento accurato della malattia macroscopica, ma anche la riduzione dell’esposizione del paziente a radiazioni ionizzanti.
Localizzazione della malattia microscopica o occulta
Il mancato riconoscimento per tempo della micro-malattia metastatica (occulta) comporta un ritardo nel trattamento, che, soprattutto nel caso delle micro-metastasi epatiche, può influenzare negativamente l’esito del paziente. A differenza delle metodiche di diagnostica per immagini, che hanno limiti di risoluzione spaziale (< 2-4 mm per TC/RM, 5 mm per PET-TC con Gallio), i trascritti circolanti dei geni NET-relati possono identificare anche una malattia “invisibile” (11). I dati in letteratura confermano che il NETest può identificare la malattia metastatica occulta epatica non riconosciuta con l’imaging e con i marcatori biochimici (21) e può monitorare la progressione di malattia e la risposta alle terapie (radiorecettoriale – PRRT – e con analoghi della somatostatina – SSA) (21). Inoltre, il NETest può riconoscere la malattia 6-24 mesi prima della positivizzazione dell’imaging, permettendo così un adeguamento tempestivo della strategia terapeutica.
Monitoraggio dell’efficacia delle terapie e del follow-up (GEP NET e NET bronco-polmonari)
Valutazione della radicalità chirurgica e localizzazione della malattia residua
La valutazione del NETest prima e dopo la chirurgia toracica per NET bronco-polmonari fornisce informazioni sulla radicalità chirurgica, sulla persistenza e sulla recidiva di malattia (22).
Analogamente la valutazione del NETest prima e dopo la chirurgia dei GEP NET aiuta il riconoscimento precoce della malattia residua o della recidiva. In uno studio prospettico di 35 pazienti la cromogranina A non ha dimostrato correlazione con lo stato di malattia dopo chirurgia R0, mentre il NETest è risultato compatibile con persistenza di malattia già a un mese dalla chirurgia, con un quadro di imaging che si è positivizzato a 6 mesi dalla chirurgia (23).
Valutazione della PRRT
I pazienti con imaging funzionale positivo per la presenza dei recettori della somatostatina rispondono solo in parte alla PRRT (24). I livelli del NETest nei pazienti sottoposti a PRRT correlano con alta accuratezza (94%) con la risposta al trattamento: diminuiscono dell’88% nei responder e aumentano del 90% nei non responder (10). Le variazioni del NETest score durante PRRT erano in accordo con la valutazione della risposta mediante i criteri RECIST, mentre i livelli di cromogranina A sono risultati concordanti solo nel 24% dei casi (10).
Dato che l’espressione dei recettori della somatostatina si basa su una valutazione molto soggettiva e non particolarmente accurata nel predire l’efficacia della PRRT, per stratificare questi pazienti è stato sviluppato un quoziente genomico predittivo positivo su sangue (PPQ). Il PPQ si basa sui livelli di Ki67 e sui livelli circolanti periferici di geni del metaboloma NET e di fattori di crescita (10). Geni e fattori di crescita selezionati sono inerenti allo stress ossidativo, al metabolismo e all’ipossia cellulare (25-27). L’alta espressione di questi geni nel sangue probabilmente identifica tumori radio-sensibili, visto il ruolo di ipossia, stress ossidativo e mancata riparazione dei danni al DNA che caratterizzano la risposta alle radiazioni (28). I livelli del NETest e la valutazione del PPQ hanno dimostrato alta accuratezza (> 90%) nel predire l’effetto della PRRT e nel monitoraggio del trattamento (10).
Valutazione della terapia con SSA
Il NETest valuta accuratamente l’efficacia della terapia con SSA, a prescindere dal tipo di analogo usato, octreotide o lanreotide (1). In uno studio prospettico in cieco il NETest è stato messo a confronto con cromogranina A come predittore di progressione di malattia in corso di SSA: è emerso che solo il NETest poteva predire tale progressione (p < 0.0002), mentre la cromogranina A non aveva valore predittivo (16). Da notare che le variazioni dei livelli ematici dei trascritti precedevano la variazione del quadro radiologico.
Follow-up a lungo termine
Uno studio retrospettivo di coorte ha documentato l’utilità del NETest in termini prognostici e di predittività per i GEP-NET; di fatto, la progressione di malattia è stata documentata radiologicamente dopo un anno dall’incremento dei valori del NETest (13). Valori di NETest > 40% in soggetti considerati stazionari avevano un valore predittivo del 100% per progressione di malattia, mentre un valore basale di NETest < 40% si è dimostrato un accurato indice di stabilità di malattia a 5 anni (100%). Ai fini del follow-up, i livelli di cromogranina A non sono stati di alcuna utilità in termini prognostici e di predittività.
L’utilità del NETest nella gestione dei NET è stata valutata anche in uno studio prospettico (12). In caso di atteggiamento watch-and-wait, un NETest score basso indirizzava verso un atteggiamento conservativo e tutti i pazienti hanno dimostrato stabilità al follow-up a 12 mesi. Nel gruppo dei pazienti con alto NETest score si è optato per interventi terapeutici e al follow-up a 12 mesi tutti i pazienti hanno dimostrato una malattia stabile (documentata radiologicamente oppure con riduzione dei sintomi). Quest’ultimo gruppo ha avuto una PFS di 3 mesi, statisticamente inferiore rispetto a quella del gruppo con NETest score basso (p < 0.0001). I livelli di cromogranina A non sono risultati dirimenti nel processo decisionale sulla strategia terapeutica dei pazienti. Infine, si è osservata una riduzione di circa il 40% nell’utilizzo dell’imaging nei pazienti con basso NETest score.
CONCLUSIONI
La strategia gestionale dei NET basata sulle informazioni della biopsia tissutale e sui livelli sierici di cromogranina A va oggi rivista. La biopsia è un prelievo random in un tumore spesso molto eterogeneo, è invasiva e le sue informazioni possono perdere rilevanza nel corso del tempo, con l’evoluzione della malattia tumorale e con i trattamenti eseguiti. Informazioni sulla complessità e l’evoluzione della biologia molecolare del tumore ottenute in tempo reale da un semplice prelievo di sangue periferico renderebbero possibile un approccio personalizzato, appropriato e tempestivo per ogni paziente. Probabilmente le future strategie diagnostiche e di gestione dei NET si baseranno soprattutto sull’associazione delle metodiche di imaging funzionale con l’analisi del trascrittoma tumorale eseguito su sangue periferico.
BIBLIOGRAFIA
- Malczewska A, Kos-Kudla B, Kidd M, et al. The clinical applications of a multigene liquid biopsy (NETest) in neuroendocrine tumors. Adv Med Sci 2020, 65: 18-29.
- Clift AK, Faiz O, Al-Nahhas A, et al. Role of staging in patients with small intestinal neuroendocrine tumours. J Gastrointest Surg 2016, 20: 180–8.
- Elias D, Lefevre JH, Duvillard P, et al. Hepatic metastases from neuroendocrine tumors with a “thin slice” pathological examination: they are many more than you think. Ann Surg 2010, 251: 307–10.
- Gibson WE, Gonzalez RS, Cates JMM, et al. Hepatic micrometastases are associated with poor prognosis in patients with liver metastases from neuroendocrine tumors of the digestive tract. Hum Pathol 2018, 79: 109–15.
- Modlin IM, Drozdov I, Kidd M. The identification of gut neuroendocrine tumor disease by multiple synchronous transcript analysis in blood. PLoS One 2013, 8: e63364.
- Kidd M, Drozdov I, Modlin I. Blood and tissue neuroendocrine tumor gene cluster analysis correlate, define hallmarks and predict disease status. Endocr Relat Cancer 2015, 22: 561–75.
- Kidd M, Modlin IM, Drozdov I. Gene network-based analysis identifies two potential subtypes of small intestinal neuroendocrine tumors. BMC Genomics 2014, 15: 595.
- Drozdov I, Kidd M, Nadler B, et al. Predicting neuroendocrine tumor (carcinoid) neoplasia using gene expression profiling and supervised machine learning. Cancer 2009, 115: 1638–50.
- Bodei L, Kidd MS, Singh A, et al. PRRT genomic signature in blood for prediction of 177Lu-octreotate efficacy. Eur J Nucl Med Mol Imaging 2018, 45: 1155–69.
- Bodei L, Kidd M, Modlin IM, et al. Measurement of circulating transcripts and gene cluster analysis predicts and defines therapeutic efficacy of peptide receptor radionuclide therapy (PRRT) in neuroendocrine tumors. Eur J Nucl Med Mol Imaging 2016, 43: 839–51.
- Modlin IM, Kidd M, Malczewska A, et al. The NETest: the clinical utility of multigene blood analysis in the diagnosis and management of neuroendocrine tumors. Endocrinol Metab Clin N Am 2018, 47: 485–504.
- Liu E, Paulson S, Gulati A, et al. Assessment of NETest clinical utility in a U.S. registry-based study. The Oncologist 2019, 24: 783–90.
- Pavel M, Jann H, Prasad V, et al. NET blood transcript analysis defines the crossing of the clinical Rubicon: when stable disease becomes progressive. Neuroendocrinology 2017, 104: 170–82.
- Modlin I, Drozdov I, Kidd M. A multitranscript blood neuroendocrine tumor molecular signature to identify treatment efficacy and disease progress. J Clin Oncol 2013, 31 suppl: A4137.
- Modlin IM, Drozdov I, Alaimo D, et al. A multianalyte PCR blood test outperforms single analyte ELISAs (chromogranin A, pancreastatin, neurokinin A) for neuroendocrine tumor detection. Endocr Relat Cancer 2014, 21: 615–28.
- Cwikla JB, Bodei L, Kolasinska-Cwikla A, et al. Circulating transcript analysis (NETest) in GEP-NETs treated with somatostatin analogues defines therapy. J Clin Endocrinol Metab 2015, 100: E1437–45.
- Modlin I, Drozdov I, Kidd M. Gut neuroendocrine tumor blood qPCR fingerprint assay: characteristics and reproducibility. Clin Chem 2014, 52: 419–29.
- Modlin IM, Aslanian H, Bodei L, et al. A PCR blood test outperforms chromogranin A in carcinoid detection and is unaffected by proton pump inhibitors. Endocr Connect 2014, 3: 215-23.
- Malczewska A, Witkowska M, Makulik K, et al. NETest liquid biopsy is diagnostic of small intestine and pancreatic neuroendocrine tumors and correlates with imaging. Endocr Connect 2019, 8: 442-53.
- Malczewska A, Oberg K, Bodei L, et al. NETest liquid biopsy is diagnostic of lung neuroendocrine tumors and identifies progressive disease. Neuroendocrinology 2019, 108: 219–31.
- Malczewska A, Bodei L, Kidd M, Modlin IM. Blood mRNA measurement (NETest) for neuroendocrine tumor diagnosis of image-negative liver metastatic disease. J Clin Endocrinol Metab 2019, 104: 867–72.
- Filosso PL, Kidd M, Roffinella M, et al. The utility of blood neuroendocrine gene transcript measurement in the diagnosis of bronchopulmonary neuroendocrine tumours and as a tool to evaluate surgical resection and disease progression. Eur J Cardiothorac Surg 2018, 53: 631–9.
- Modlin IM, Frilling A, Salem RR, et al. Blood measurement of neuroendocrine gene transcripts defines the effectiveness of operative resection and ablation strategies. Surgery 2016, 159: 336–47.
- Strosberg J, El-Haddad G, Wolin E, et al. Phase 3 trial of 177Lu-Dotatate for midgut neuroendocrine tumors. N Engl J Med 2017, 376: 125–35.
- Valli A, Rodriguez M, Moutsianas L, et al. Hypoxia induces a lipogenic cancer cell phenotype via HIF1alpha-dependent and -independent pathways. Oncotarget 2015, 6: 1920–41.
- Olsson AH, Yang BT, Hall E, et al. Decreased expression of genes involved in oxidative phosphorylation in human pancreatic islets from patients with type 2 diabetes. Eur J Endocrinol 2011, 165: 589–95.
- Day TF, Mewani RR, Starr J, et al. Transcriptome and proteome analyses of TNFAIP8 knockdown cancer cells reveal new insights into molecular determinants of cell survival and tumor progression. Methods Mol Biol 2017, 1513: 83–100.
- Hill RP. The changing paradigm of tumour response to irradiation. Br J Radiol 2017, 90: 20160474.
Valutazione anatomo-patologica dei NET
Anna Crescenzi
Anatomia Patologica, Ospedale Regina Apostolorum, Albano Laziale (RM)
Per la diagnosi, classificazione e stadiazione dei NET è indispensabile la valutazione del patologo.
CRITERI MORFOLOGICI
I NET presentano un’ampia variabilità morfologica (1). I tumori ben differenziati mostrano aspetto organoide, che va da nidi solidi a un aspetto micro o macrotrabecolare giriforme. Si osserva solitamente una ricca vascolarizzazione sinusoidale. Possono essere presenti fibrosi stromale, depositi amiloidi e calcificazioni. Si possono visualizzare aree di necrosi come grosse aree simil-infartuali o foci puntiformi nel centro di nidi neoplastici.
Indipendentemente dalle modalità di crescita, le cellule dei NET hanno aspetto citologico simile: sono di piccole o di medie dimensioni, di forma tondeggiante o ovalare, con citoplasma eosinofilo, lievemente granulare. I nuclei sono solitamente centrali, abbastanza uniformi, con cromatina finemente dispersa (aspetto a sale e pepe). Raramente le cellule neoplastiche hanno aspetto plasmacitoide per la localizzazione eccentrica del nucleo. I nucleoli sono solitamente poco visualizzabili o assenti. Si possono evidenziare globuli ialini intra-citoplasmatici e pseudo-inclusi nucleari.
I carcinomi poco differenziati sono costituiti da cellule piccole o medio-grandi con aspetti di alta sdifferenziazione (marcate atipie nucleari, necrosi multifocale, alto indice mitotico) e crescita diffusa, talvolta con aspetti organoidi.
I campioni citologici, che talvolta sono l’unico materiale diagnostico disponibile, possono lasciare dei dubbi per la gestione clinica. La citologia è in grado di distinguere efficacemente i NET ben differenziati dai carcinomi neuroendocrini (NEC) scarsamente differenziati, ma la distinzione fra i tumori di grado basso e intermedio può essere impossibile. L’accuratezza diagnostica delle tecniche di aspirazione può essere limitata per le piccole dimensioni dei campioni, la riproducibilità subottimale e il rischio di possibile contaminazione da parte dei tessuti adiacenti. La citologia sta comunque conquistando un ruolo sempre maggiore nella diagnosi dei tumori duodeno-pancreatici. La tecnica di campionamento con ago sottile in eco-endoscopia è attendibile, con specificità di circa il 75%, sensibilità dell’87%, accuratezza dell’89%, valore predittivo positivo del 93% e valore predittivo negativo del 60% (2-4).
IMMUNO-ISTOCHIMICA E TECNICHE DI BIOLOGIA MOLECOLARE
Possono essere impiegate con diversi obiettivi.
Differentiazione neuroendocrina
Nella diagnosi dei NET i marcatori immunoistochimici utili sono la sinaptofisina (marcatore associato alle piccole vescicole) e la cromogranina A (CgA, marcatore associato ai grossi granuli secretori). Per confermare la diagnosi di NEC è richiesta la colorazione con entrambi questi marcatori, perché la CgA può essere negativa (5). Non è raccomandata l’immunoistochimica di routine per gli ormoni peptidici e le bioamine. La specificità e l’utilità clinica di altri marcatori (PGP.9.5, NSE, CD56, NSP-55) è assai dubbia.
Marcatori di prognosi
Oltre al Ki-67 ne sono stati proposti numerosi altri (CK19, CD117, CD99, p53, Her/2, CEACAM1, E-cadherin, β-catenin, hHAS-1, FGF13, PLGF, PAX-8, PTEN) ma nessuno è attualmente raccomandato per la pratica clinica. Neanche la ricerca delle cellule tumorali circolanti o l’uso dei microRNA è indicato per l’uso routinario (6,7).
Marcatori di primitività
Possono essere utili nel capire l’origine di lesioni metastatiche a primitività ignota. I più utili sono (8):
- TTF-1, indicativo di origine polmonare o tiroidea;
- serotonina e CDX-2, indicativi di origine intestinale;
- PAX-8 e istidina-decarbossilasi, indicativi di origine pancreatica;
- xenina, indicativa di origine duodenale.
Marcatori predittivi di risposta a trattamenti specifici
Non sono indicati per la pratica routinaria. Comprendono (8):
- recettore 2A per la somatostatina (SSTR2A, determinazione immunoistochimica a livello della membrana cellulare): per la pianificazione di un trattamento con analoghi della somatostatina. Il patologo può eseguire tale ricerca su mRNA estratto da campioni freschi o congelati di neoplasie o da materiale di archivio fissato ed incluso in paraffina. La determinazione si può effettuare con tre metodiche:
- autoradiografia con tracciante radiomarcato che viene cimentato direttamente con una sezione di tessuto fresco (metodica sofisticata e costosa);
- identificazione dell’mRNA specifico per i sottotipi recettoriali a mezzo di reazione polimerasica a catena (RT-PCR, tecnica sofisticata e dispendiosa);
- identificazione del recettore con anticorpi specifici, utilizzando tecniche standard di immuno-istochimica che si propongono come la migliore metodica di scelta per l’impiego clinico;
- molecole della via di segnale Akt/mTOR (PIK3, PTEN, TSC2): per il trattamento con everolimus;
- timidilato-sintetasi: per il trattamento con anti-folati;
- ERCC-1: per il trattamento con platino;
- topoisomerasi IIα: per il trattamento con etoposide;
- eventi epigenetici, come la metilazione del promotore di MGMT: per il trattamento con alchilanti.
IL REFERTO PATOLOGICO
Modalità e tempistica dei prelievi bioptici o citologici devono essere pianificati da un team multidisciplinare.
Al patologo devono essere fornite informazioni accurate, che comprendono dati clinici, risultati degli esami biochimici e strumentali (9).
Il referto patologico ideale dovrebbe comprendere:
- descrizione macroscopica del campione;
- misurazione del tumore nelle 3 dimensioni;
- descrizione degli aspetti cellulari e dell’architettura istologica;
- differenziazione: ben differenziato o scarsamente differenziato;
- risultati immunoistochimici: CgA e sinaptofisina sempre, SSTR2A se appropriato;
- Ki-67 e conta mitotica;
- radicalità della resezione, distanza del margine tumorale dal margine di resezione, profondità di invasione tumorale;
- segni di malignità: invasione angio-linfatica e/o peri-neurale, necrosi, infiltrazione della capsula e/p della parete gastrointestinale e/o dei tessuti circostanti;
- numero di linfonodi esaminati e di metastasi linfonodali; presenza di micrometastasi; dimensione della metastasi maggiore;
- eventuale presenza di metastasi a distanza;
- attività funzionale (se appropriata).
Il referto dovrebbe concludersi con la diagnosi e la classificazione della lesione (come NET G1-G2 o NEC G3) in relazione agli indici proliferativi (Ki-67 e conta mitotica) secondo i criteri WHO e la stadiazione (specificando il sistema di stadiazione adottato).
Il referto minimo relativo a un campione (sia di tumore primitivo che metastatico) dovrebbe comprendere (10):
- sito;
- diagnosi (p.e. neoplasia neuroendocrina pura);
- differenziazione: buona o scarsa;
- proliferazione: G1, G2 o G3.
BIBLIOGRAFIA
- Chetty R. An overwiew of practical issues in the diagnosis of gastroenteropancreatic neuroendocrine pathology. Arch Pathol Lab Med 2008, 132: 1285-9.
- Petrone M, Testoni SGG, Carrara S, et al. EUS-Guided FNA for proliferative rate in pancreatic neuroendocrine tumors: a single center experience over a 11-year period. JOP 2012, 13 (5 Suppl): 569.
- Larghi A, Capurso G, Carnuccio A, et al. KI-67 grading of nonfunctioning pancreatic neuroendocrine tumors on histologic samples obtaining by EUS-guide fine-needle tissue acquisition: a prospective study. Gastrointest Endosc 2011, 76: 570-7.
- Iqbal S, Friedel D, Gupta M, et al. Endoscopic-ultrasound-guided fine needle aspiration and the role of the cytopathologist in solid pancreatic lesion diagnosis. Pathol Res Intern 2012, 2012: 1-17.
- Klimstra DS, Modlin IR, Coppola D, et al. The pathologic classification of neuroendocrine tumors. A review of nomenclature, grading, and staging systems. Pancreas 2010, 39: 707-12.
- Ramage J, Ahmed A, Ardill J, et al; UK and Ireland Neuroendocrine Tumour Society. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs). Gut 2012, 61: 6-32.
- Salazar R, Wiedenmann B, Rindi G, Ruszniewskj P. ENETS 2011 consensus guidelines for the management of patients with digestive neuroendocrine tumours: an update. Neuroendocrinology 2012, 95: 71-3.
- Bellizzi A. Assigning site of origin in metastatic neuroendocrine neoplasms: a clinically significant application of diagnostic immunohistochemistry. Adv Anat Pathol 2013, 20: 285-314.
- Metz DC, Choi J, Strasberg J, et al. A rationale for multidisciplinary care in treating neuroendocrine tumors. Curr Opin Endocrinol Diabetes Obes 2012, 19: 306-13.
- Klimstra DS, Modlin I, Adsay NV, et al. Pathology reporting of neuroendocrine tumors: application of the Delphic consensus process to the development of a minimun pathology data set. Am J Surg Pathol 2010, 34: 300-13.
Ecografia, TC e RM nella diagnostica dei NET
Giancarlo Bizzarri
UOC di diagnostica per immagini, Ospedale Regina Apostolorum, Albano Laziale (RM)
Ecografia
L’ecografia transaddominale è una metodica non invasiva, poco costosa, rapida e sicura. L’accuratezza è però operatore-dipendente è la sensibilità è bassa (13-27%), soprattutto in confronto alle migliori prestazioni di TC e RM (1), anche se è stata riportata una capacità diagnostica del 39% per i NET pancreatici (2,3).
L’ecografia con contrasto (CEUS) permette l’identificazione di lesioni ipervascolarizzate, anche in caso di circolazione intra-tumorale a basso flusso, come nei NET pancreatici non funzionanti. Perciò la CEUS è significativamente superiore all’ecografia B-mode, sia nel rilevare NET pancreatici non funzionanti che nell’evidenziare metastasi epatiche, visualizzate come lesioni disomogenee che prendono il contrasto (3-5), con sensibilità dell’82% (6,7).
L’ecografia può infine rilevare complicanze della malattia avanzata (come la stenosi biliare) e guidare l’impiego di procedure diagnostiche o terapeutiche (8).
L’eco-endoscopia sarà oggetto di un altro capitolo.
TC multislice
È considerata la modalità di diagnostica per immagini di prima scelta per la diagnosi, stadiazione e follow-up dei NET. In confronto alla TC convenzionale, permette miglior risoluzione spaziale e tempi di esecuzione più rapidi. Sensibilità e specificità sono aumentate dallo scanning multifase. Le immagini devono essere acquisite sia in condizioni basali che dopo la somministrazione di mezzo di contrasto, nelle fasi arteriosa, portale e di equilibrio.
I NET pancreatici non funzionanti e le metastasi epatiche da NET appaiono come lesioni ipervascolarizzate. Nella valutazione dei NET pancreatici non funzionanti, la combinazione delle immagini acquisite in fase arteriosa dominante e in fase venosa portale migliora la rilevazione del tumore primitivo e delle metastasi epatiche (3).
La tecnica ha dimostrato sensibilità media del 73% (63-82%) e specificità media del 96% (83-100%) per i NET pancreatici, mentre i valori per le metastasi epatiche sono stati rispettivamente 82% (78–100%) e 92% (83–100%)(9-11).
Nel caso si sospetti una piccola lesione ileale, si può eseguire un’enterografia TC, distendendo il viscere con un’abbondante quantità di mezzo di contrasto orale neutro o a bassa attenuazione (12-14). Sensibilità e specificità della metodica variano rispettivamente fra 50 e 85% e fra 25 e 97%.
Vista l’esposizione a radiazioni ionizzanti, l’uso della TC deve essere individualizzato, specialmente nei giovani.
RM
Anche questa metodica permette ottima risoluzione spaziale con la possibilità di acquisizioni e ricostruzioni multiplanari e di esami multifase dopo somministrazione di mezzo di contrasto.
Oltre all’assenza di radiazioni ionizzanti, un vantaggio della RM rispetto alla TC è la differenza intrinseca di segnale fra la neoplasia e il parenchima sano. Questa caratteristica viene ulteriormente accentuata nelle sequenze in diffusione protonica. Al contrario, gli svantaggi della RM sono il costo maggiore, la minore disponibilità delle apparecchiature e i tempi di acquisizione più lunghi; inoltre la maggior necessità di cooperazione da parte del paziente.
Anche alla RM, i NET mostrano le stesse caratteristiche contrastografiche della TC. Anche i mezzi di contrasto con Gadolinio così come i mezzi di contrasto iodati, non possono essere utiilizzati nei pazienti con insufficienza renale avanzata.
La RM ha una particola sensibilità nel rilevare lesioni metastatiche a livello di fegato, tessuti molli e sistema nervoso centrale (1,2). TC multifase e RM hanno efficacia simile nella rilevazione di tumori insulari, se si usano sequenze in T1 con saturazione del grasso e ritardate.
Nella pratica clinica, la RM deve essere usata quando i risultati della TC non sono dirimenti o c’è controindicazione all’uso del contrasto iodato (2). Vista l’assenza di esposizione a radiazioni, la RM viene utilizzata, in associazione all’ecografia, come modalità di screening nei giovani o nella sorveglianza a lungo termine (15).
Bibliografia
- Sahani DV, Bonaffini PA, Fernandez-Del Castillo C, Blake MA. Gastroenteropancreatic neuroendocrine tumors: role of imaging in diagnosis and management. Radiology 2013, 266: 38-61.
- Sundin A, Vullierme MP, Kaltsas G Plöckinger U; Mallorca Consensus Conference participants; European Neuroendocrine Tumor Society. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: radiological examinations. Neuroendocrinology 2009, 90: 167–83.
- Falconi M, Bartsch DK, Eriksson B, et al; Barcelona Consensus Conference participants. ENETS consensus guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors. Neuroendocrinology 2012, 95: 120–34.
- Malagò R, D’Onofrio M, Zamboni GA, et al. Contrast-enhanced sonography of non-functioning pancreatic neuroendocrine tumors. AJR Am J Roentgenol 2009, 192: 424–30.
- Quaia E, Stacul F, Gaiani S, et al. Comparison of diagnostic performance of unenhanced vs. SonoVue-enhanced ultrasonography in focal liver lesions characterization. The experience of three Italian centers. Radiol Med 2004, 108: 71–81.
- Mork H, Ignee A, Schuessler G, et al. Analysis of neuroendocrine tumour metastases in the liver using contrast-enhanced ultrasonography. Scand J Gastroenterol 2007, 42: 652–62.
- Hoeffel C, Job L, Ladam-Marcus V, et al. Detection of hepatic metastases from carcinoid tumor: prospective evaluation of contrast-enhanced ultrasonography. Dig Dis Sci 2009, 54: 2040-6.
- Wu W, Chen MH, Yin SS, et al. The role of contrast enhanced sonography of focal liver lesions before percutaneous biopsy. AJR Am J Roentgenol 2006, 187: 752–61.
- Fidler JL, Fletcher JG, Reading CC, et al. Preoperative detection of pancreatic insulinomas on multiphasic helical CT. AJR Am J Roentgenol 2003, 181: 775–80.
- Cwikła JB, Buscombe JR, Caplin ME, et al. Diagnostic imaging of carcinoid metastases to the abdomen and pelvis. Med Sci Monit 2004, 10 (suppl 3): 9–16.
- Kumbasar B, Kamel IR, Tekes A, et al. Imaging of neuroendocrine tumors: accuracy of helical CT versus SRS. Abdom Imaging 2004, 29: 696–702.
- Johanssen S, Boivin M, Lochs H, Voderholzer W. The yield of wireless capsule endoscopy in the detection of NET in comparison with CT enteroclysis. Gastrointest Endosc 2006: 63: 660-5.
- Pilleul F, Penigaud M, Milot L, et al. Possible small bowel neoplasms: contrast-enhanced and water-enhanced multidetector CT enteroclysis. Radiology 2006, 241: 796–801.
- Kamaoui I, De Luca V, Ficarelli S, et al. Value of CT enteroclysis in suspected small-bowel carcinoid tumors. Am J Roentgenol 2010, 194: 629-33.
- Waldmann J, Fendrich V, Habbe N, et al. Screening of patients with multiple endocrine neoplasia type 1 (MEN-1): a critical analysis of its value. World J Surg 2009, 33: 1208–18.
Metodiche medico-nucleari basate sugli analoghi della somatostatina nello studio dei NET
Annibale Versari
Servizio di Medicina Nucleare, Arcispedale Santa Maria Nuova, Reggio Emilia
Fino all’80% dei NET esprime i recettori SSTR2 e SSTR5, rendendo possibile la diagnostica per immagini con analoghi radiomarcati della somatostatina.
Il più comune analogo è 111In-pentetreotide (disponibile commercialmente con il nome di Octreoscan®), usato per immagini scintigrafiche, SPECT e SPECT/TC (1,2). Si somministra per via ev (attività 120-220 MBq), con successiva acquisizione di immagini planari o SPECT a 4 e 24 ore. I moderni sistemi ibridi di acquisizione come la SPECT/TC consentono una registrazione contemporanea di immagini morfologiche e funzionali, che migliora la localizzazione delle lesioni (3).
Vista l’alta affinità per SSTR2, l’Octreoscan® permette una maggiore percentuale di visualizzazione delle lesioni NET in confronto alla diagnostica per immagini convenzionale, con una sensibilità che varia dal 67% a quasi il 100% (4-9) (fig 1).

Figura 1. NET ileale visualizzato all'Octreoscan
Tra gli altri analoghi radiomarcati della somatostatina, il 68Ga-DOTA-D-Phe1-Tyr3-octreotide (DOTATOC) lega SSTR2 e 5 con affinità maggiore rispetto all’Octreoscan (10). Vista la migliore risoluzione spaziale (3-5 mm) e la migliore quantificazione della captazione del tracciante offerta dalla PET in confronto alla scintigrafia, PET e soprattutto PET/TC con 68Ga-DOTATOC danno significativi vantaggi soprattutto negli organi con alta captazione fisiologica (come il fegato) e in caso di lesioni piccole (< 15 mm)(11-13)(fig 2-4). Inoltre il 68Ga-DOTATOC si è dimostrato superiore a TC e scintigrafia ossea nella rilevazione di metastasi ossee da NET (14). Risultati simili sono stati ottenuti con l’imaging PET usando altri peptidi marcati con 68Ga, come 68Ga-DOTATATE e 68Ga-DOTANOC)(15-20).
La PET/TC con analoghi marcati con 68Ga dà ottimi risultati, sia in termini di accuratezza diagnostica che di impatto sulla clinica (21-24). Di conseguenza questa procedura è raccomandata per l’uso routinario. Anche se la PET/TC con 68Ga è ancora disponibile solo in un numero limitato di centri, è auspicabile che il suo uso si diffonda maggiormente.

Figura 2. NET dello stomaco. In alto a sinistra immagine TC assiale, a destra immagini PET con 68Ga-DOTATOC (assiale in alto e sagittale in basso), in basso a sinistra immagine di composizione PET/TC

Figura 3. NET del cieco. In alto a sinistra immagine TC assiale, a destra immagini PET con 68Ga-DOTATOC (assiale in alto e sagittale in basso), in basso a sinistra immagine di composizione PET/TC

Figura 4. PET con 68Ga-DOTATOC che dimostra NET ileo metastatico
| Confronto fra le caratteristiche dei traccianti | |||||
| Disponibilità | Durata | Accuratezza | Valore predittivo | ||
| negativo | positivo | ||||
| 111In-pentetreotide (Octreoscan®) | Ampia | 2 giorni | ++ | ++ | +++ |
| 68Ga-peptidi-coniugati con DOTA | Limitata | 2 ore | +++ | +++ | +++ |
Le indicazioni cliniche per le metodiche medico-nucleari basate sugli analoghi della somatostatina nei NET sono (25):
- localizzazione del tumore primitivo;
- stadiazione;
- ristadiazione (rilievo della malattia residua, recidiva o in progressione);
- valutazione dello stato funzionale dei recettori SSTR2 (i pazienti con intensa positività hanno maggiore probabilità di rispondere alla terapia con analoghi);
- monitoraggio della risposta alla terapia;
- selezione dei pazienti per la terapia radiorecettoriale.
Poiché la terapia con analoghi della somatostatina può teoricamente interferire con la captazione dell’analogo radiomarcato, alcuni raccomandano una sospensione della terapia con gli analoghi long-acting per 1-2 mesi o il passaggio intermedio a un analogo a breve durata d’azione (octreotide sc) (25).
Bibliografia
- van der Lely AJ, de Herder WW, Krenning EP, Kwekkeboom DJ. Octreoscan radioreceptor imaging. Endocrine 2003, 20: 307-11.
- Kwekkeboom DJ, Krenning EP, Scheidhauer K, et al; Mallorca Consensus Conference participants; European Neuroendocrine Tumor Society. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: somatostatin receptor imaging with 111In-pentetreotide. Neuroendocrinology 2009, 90: 184-9.
- Perri M, Erba P, Volterrani D, et al. Octreo-SPECT/CT imaging for accurate detection and localization of suspected neuroendocrine tumors. Q J Nucl Med Mol Imaging 2008, 52: 323-33.
- Gibril F, Reynolds JC, Doppmann JL, et al. Somatostatin receptor scintigraphy: its sensitivity compared with that of other imaging methods in detecting primary and metastatic gastrinomas: a prospective study. Ann Int Med 1996, 125: 26–34.
- Shi W, Johnston CF, Buchanan KD, et al. Localization of neuroendocrine tumours with [111In]-DTPA-octreotide scintigraphy (Octreoscan): a comparative study with CT and MRI imaging. QJM 1998, 91: 295–301.
- Kaltsas G, Mukherjee JJ, Grossman AB. The value of radiolabelled MIBG and octreotide in the diagnosis and management of neuroendocrine tumours. Ann Oncol 2001, 12 Suppl 2: S47-50.
- Kaltsas G, Rockall A, Papadogias D, et al. Recent advances in radiological and radionuclide imaging and therapy of neuroendocrine tumours. Eur J Endocrinol 2004, 151: 15-27.
- de Herder WW, Kwekkeboom DJ, Feelders RA, et al. Somatostatin receptor imaging for neuroendocrine tumors. Pituitary 2006, 9: 243-8.
- Krenning EP, Kwekkeboom DJ, Bakker WH, et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1]- and [123I-Tyr3]- octreotide: the Rotterdam experience with more than 1,000 patients. Eur J Nucl Med 1993, 20: 716–31.
- Reubi JC, Schär JC, Waser B, et al. Affinity profiles for human somatostatin receptor subtypes SST1–SST5 of somatostatin radiotracers selected for scintigraphic and radiotherapeutic use. Eur J Nucl Med Mol Imaging 2000, 27: 273–82.
- Hofmann M, Maecke H, Borner R, et al. Biokinetics and imaging with the somatostatin receptor PET radioligand 68Ga-DOTATOC: preliminary data. Eur J Nucl Med Mol Imaging 2001, 28: 1751–7.
- Kowalski J, Henze M, Schumacher J, et al. Evaluation of positron emission tomography imaging using 68Ga-DOTA-Phe1-Tyr3-octreotide in comparison to 111In-DTPAOC SPECT. First results in patients with neuroendocrine tumors. Mol Imag Biol 2003, 5: 42–8.
- Buchmann I, Henze M, Engelbrecht S, et al. Comparison of 68Ga-DOTATOC PET and 111In-DTPAOC (Octreoscan) SPECT in patients with neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2007, 34: 1617–26.
- Putzer D, Gabriel M, Henninger B, et al. Bone metastases in patients with neuroendocrine tumor: 68Ga-DOTA-Tyr3-octreotide PET in comparison to CT and bone scintigraphy. J Nucl Med 2009, 50: 1214-21.
- Kayani I, Bomanji JB, Groves A, et al. Functional imaging of neuroendocrine tumors with combined PET/CT using 68Ga-DOTATATE (DOTA-DPhe1,Tyr3-octreotate) and 18F-FDG. Cancer 2008, 112: 2447-55.
- Prasad V, Ambrosini V, Hommann M, et al. Detection of unknown primary neuroendocrine tumours (CUP-NET) using 68Ga-DOTANOC receptor PET/CT. Eur J Nucl Med Mol Imaging 2010, 37: 67–77.
- Srirajaskanthan R, Kayani I, Quigley AM, et al. The role of 68Ga-DOTATATE PET in patients with neuroendocrine tumors and negative or equivocal findings on 111In-DTPA-octreotide scintigraphy. J Nucl Med 2010, 51: 875-8.
- Poeppel TD, Binse I, Petersenn S, et al. 68Ga-DOTATOC versus 68Ga-DOTATATE PET/CT in functional imaging of neuroendocrine tumors. J Nucl Med 2011, 52: 1864–70.
- Kabasakal L, Demirci E, Ocak M, et al. Comparison of 68Ga-DOTATATE and 68Ga-DOTANOC PET/CT imaging in the same patient group with neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2012, 39: 1271–7.
- Haug AR, Cindea-Drimus R, Auernhammer CJ, et al. The Role of 68Ga-DOTATATE PET/CT in suspected neuroendocrine tumors. J Nucl Med 2012, 53: 1686-92.
- Gabriel M, Oberauer A, Dobrozemsky G, et al. 68Ga-DOTA-Tyr3-octreotide PET for assessing response to somatostatin-receptor-mediated radionuclide therapy. J Nucl Med 2009, 50: 1427-34.
- Frilling A, Sotiropoulos GC, Radtke A, et al. The impact of 68Ga-DOTATOC positron emission tomography/computed tomography on the multimodal management of patients with neuroendocrine tumors. Ann Surg 2010, 252: 850-6.
- Ruf J, Heuck F, Schiefer J, et al. Impact of multiphase 68Ga-DOTATOC-PET/CT on therapy management in patients with neuroendocrine tumors. Neuroendocrinology 2010, 91: 101-9.
- Kumar R, Sharma P, Garg P, et al. Role of 68Ga-DOTATOC PET-CT in the diagnosis and staging of pancreatic neuroendocrine tumours. Eur Radiol 2011, 21: 2408-16.
- Bombardieri E, Ambrosini V, Aktolun C, et al; Oncology Committee of the EANM. 111In-pentetreotide scintigraphy: procedure guidelines for tumour imaging. Eur J Nucl Med Mol Imaging 2010, 37: 1441-8.
PET/TC con altri marcatori: oltre i traccianti recettoriali
Angelina Filice & Annibale Versari
Struttura Complessa di Medicina Nucleare, Azienda USL-IRCCS di Reggio Emilia
(aggiornato al 14 giugno 2021)
Introduzione
La medicina nucleare ha un ruolo centrale nella gestione dei pazienti con neoplasie neuroendocrine (NEN), sia in diagnostica che in terapia. Il meccanismo che viene storicamente utilizzato in queste neoplasie è quello ben noto del legame con i recettori della somatostatina (SSTR). Mentre è chiaro nelle NEN il ruolo dell’imaging recettoriale, 111In-Octreoscan e 68Ga-DOTA-peptide PET/TC, nelle diverse fasi di stadiazione, valutazione dell’espressione recettoriale, ristadiazione, selezione dei pazienti per la terapia radio-recettoriale (PRRT) ecc, più controverso e dibattuto è il ruolo di altri traccianti impiegati in questo ambito in medicina nucleare.
Ruolo del 18F-Fluorodesossiglucosio (18F-FDG) nelle NEN
Negli studi iniziali, la 18F-FDG PET/TC veniva tradizionalmente ritenuta di minore utilità nella gestione dei pazienti con NEN, a causa di una bassa captazione nei tumori neuroendocrini (NET) ben differenziati di basso grado (1). Parallelamente emergeva però anche il concetto che la captazione del 18F-FDG è più alta nei NET di alto grado, per cui è stato proposto l’utilizzo della 18F-FDG PET/TC nei pazienti con NET metastatici (2,3). Nel corso degli anni l’interesse per la 18F-FDG PET/TC è progressivamente aumentato, ed essa riveste attualmente un ruolo fondamentale in diagnostica, in particolare nella fase di stadiazione (vedremo successivamente in quali casi), ristadiazione e scelta del trattamento più appropriato. Come noto, inoltre, le NEN sono eterogenee, per cui la combinazione delle immagini recettoriali ottenute con 68Ga-DOTA-peptide e metaboliche con 18F-FDG in PET/TC è risultata utile per valutare la complessità di tali neoplasie, in particolare per una migliore valutazione nei tumori di grado intermedio e alto (figura 1-2) (4).
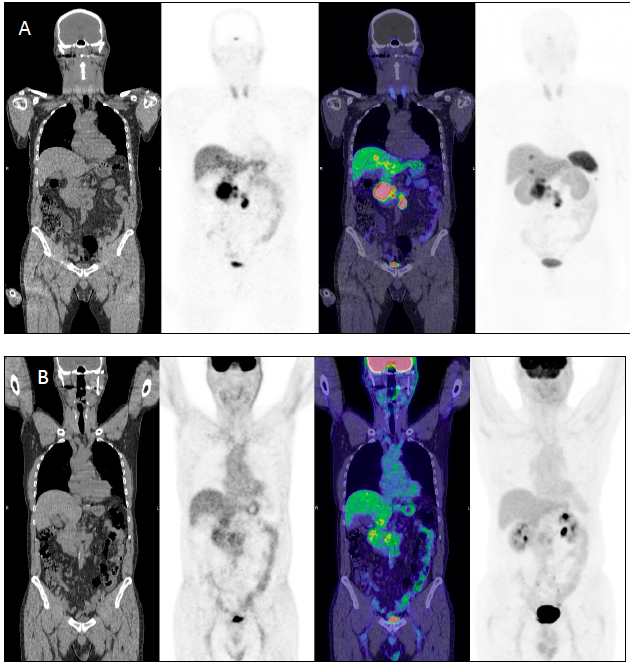
Figura 1
A: Paziente con duplice localizzazione di NET pancreatico (Ki67, rispettivamente 10% e 3%, G2 sec. WHO 2010). 68Ga-DOTATOC PET/TC Ipercaptazione a carico della regione cefalo-pancreatica, di alcuni linfonodi addominali peri-pancreatici e di 2 aree epatiche.
B: 18F-FDG PET/TC. Modesta e disomogenea ipercaptazione cefalo-pancreatica e linfonodale peri-pancreatica.
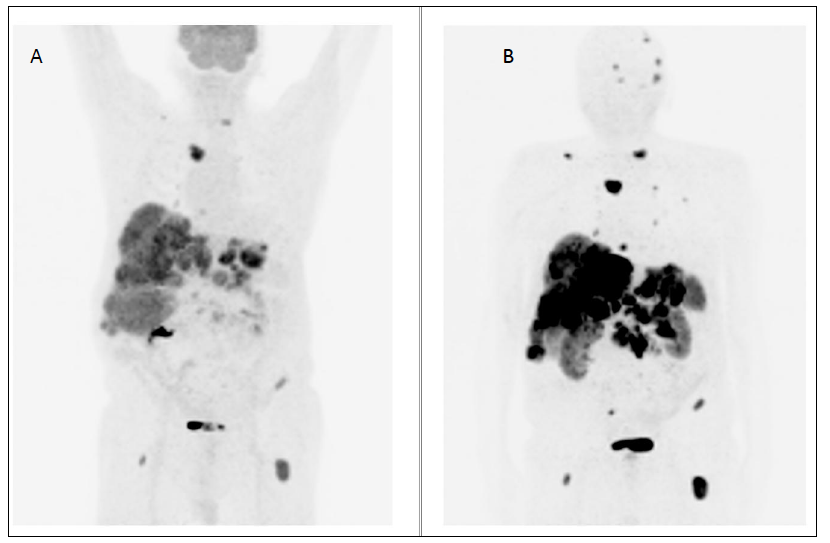
Figura 2
GEP-NET (Ki67 20%). Captazione diffusa di entrambi i traccianti (A 18F-FDG PET/TC; B 68Ga-DOTATOC PET/TC), con estesa metastatizzazione epatica e scheletrica.
Diversi studi hanno confermato che la 18F-FDG PET/TC è una tecnica accurata per la stadiazione dei NET di alto grado (Ki-67 ≥ 10-15%) (5,6). Come riportato nelle più recenti linee guida dell’European Neuroendocrine Tumor Society (ENETS), con l'aumento dell’indice di proliferazione e quindi dell’aggressività tumorale, le lesioni generalmente diventano più avide di 18F-FDG. La 18F-FDG PET/TC ha quindi un ruolo importante in particolare per lo studio dei NET G3 e dei NET G2 con indice di proliferazione più alto, che rispetto ai NET di basso grado generalmente hanno un metabolismo del glucosio più elevato e una minore espressione dei SSTR (7). Diversi studi hanno inoltre evidenziato un significato prognostico di questo esame nelle NEN: i pazienti con 18F-FDG PET/TC positiva hanno prognosi peggiore (5,7-9). Un lavoro riporta i dati di 60 pazienti con NET pancreatico sottoposti a 177Lu-PRRT, in cui la 18F-FDG PET/TC, positiva al basale in 55 pazienti, è risultata essere un fattore prognostico indipendente (PFS mediana 21.1 mesi nei pazienti con 18F-FDG PET/TC positiva e 68.7 mesi nel gruppo con 18F-FDG PET/TC negativa) (10).
Recentemente sono stati pubblicati i risultati del meeting EANM Focus 3. In questo incontro è stato raggiunto un consenso sull'utilizzo della 18F-FDG PET/TC nel carcinoma neuroendocrino, nei G3 NET e nei G1-G2 NET con lesioni non corrispondenti (ovvero esame radiologico positivo/68Ga-DOTA-peptidi PET/TC negativo) o con rapida progressione. Inoltre, per i pazienti con NET non resecabile o disseminato candidati a PRRT, i partecipanti al panel hanno raccomandato la 18F-FDG PET/TC prima del trattamento nei pazienti con NET G2 e G3, complementare all'imaging SSTR, per escludere pazienti con lesioni non corrispondenti e come fattore prognostico (11).
18F-Diidrossifenilalanina (18F-DOPA) PET/TC
Diversi studi hanno riportato risultati promettenti sull’impiego in PET/TC dei precursori delle amine, come la 18F-DOPA (12-16). La 18F-DOPA PET/TC viene però utilizzata ancora poco nella pratica clinica, visti difficoltà di sintesi, costi e accuratezza diagnostica inferiore rispetto ai traccianti recettoriali. Trova il suo impiego soprattutto nelle NEN ben differenziate con espressione di SSTR bassa/variabile (feocromocitoma, neuroblastoma, carcinoma midollare della tiroide) o per caratterizzare lesioni che si localizzano nella sede di fisiologica captazione del 68Ga-DOTA-peptide. Infine, anche se la 18F-DOPA non ha un ruolo nella teragnostica, durante la valutazione prima della PRRT può identificare lesioni che non esprimono o esprimono solo debolmente gli SSTR e predire una risposta al trattamento scarsa o assente. Allo stesso modo, nel contesto post-terapeutico, 18F-DOPA può essere utile nell'identificazione della comparsa di nuove lesioni o nell’identificare progressione di malattia (17).
Nuovi radio-farmaci promettenti
Il successo dei traccianti radio-recettoriali ha spianato la strada agli studi su altri radio-farmaci, per lo più a impiego sperimentale, a base di peptidi che hanno come bersaglio, ad esempio, i recettori della colecistochinina 2, il peptide di rilascio della gastrina, la neurochinina-1 e la chemochina-4 della famiglia C-X-C. Sono stati inoltre pubblicati studi interessanti sull’impiego in PET/TC nei NET di altri precursori delle amine, quali 5-idrossi-L-triptofano (14,18,19), marcati con 18F e 11C.
Sono ancora sperimentali radio-farmaci che legano il recettore di GLP-1 per la localizzazione degli insulinomi (20).
Un ulteriore interessante sviluppo è avvenuto, infine, negli ultimi anni sugli antagonisti dei SSTR. Questi composti non sono internalizzati nelle cellule bersaglio dopo il legame ai recettori di superficie e si legano a un numero maggiore di siti. Rispetto agli agonisti, i primi studi hanno dimostrato una maggiore captazione del tumore, una ritenzione più prolungata e una ridotta radioattività negli organi sani (21). Il principale vantaggio dell'utilizzo di antagonisti sembra quindi la possibilità di ottenere una maggiore captazione del tumore rispetto al fondo, soprattutto nel fegato, con conseguente più facile individuazione delle lesioni secondarie. In particolare, in uno studio di fase 2 con l'antagonista 68Ga-OPS202 su 12 NEN pancreatiche, è stato osservato un aumento significativo del rapporto tumore /fegato rispetto a 68Ga-DOTATOC (22).
Bibliografia
- Adams S, Baum R, Rink T, et al. Limited value of fluorine-18 fluorodeoxyglucose positron emission tomography for the imaging of neuroendocrine tumours. Eur J Nucl Med 1998, 25: 79-83.
- Pasquali C, Rubello D, Sperti C, et al. Neuroendocrine tumor imaging: can 18F-fluorodeoxyglucose positron emission tomography detect tumors with poor prognosis and aggressive behavior? World J Surg 1998, 22: 588-92.
- Giammarile F, Billotei C, Lombard-Bohas C, et al. 18F-FLT and 18F-FDG positron emission tomography for the imaging of advanced well-differentiated gastro-entero-pancreatic endocrine tumours. Nucl Med Commun 2011, 32: 91-7.
- Kayani I, Bomanji JB, Groves A, et al. Functional imaging of neuroendocrine tumors with combined PET/CT using 68Ga-DOTATATE (DOTA-DPhe1,Tyr3-octreotate) and 18F-FDG. Cancer 2008, 112: 2447-55.
- Binderup T, Knigge U, Loft A, et al. Functional imaging of neuroendocrine tumors: a head-to-head comparison of somatostatin receptor scintigraphy, 123I-MIBG scintigraphy, and 18F-FDG PET. J Nucl Med 2010, 51: 704-12.
- Abgral R, Leboullex S, Deandreis D, et al. Performance of 18Fluorodeoxyglucose-positron emission tomography and somatostatin receptor scintigraphy for high Ki67 (≥10%) well-differentiated endocrine carcinoma staging. J Clin Endocrinol Metab 2011, 96: 665-71.
- Sundin A, Arnold R, Baudin E, et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: radiological, nuclear medicine & hybrid imaging. Neuroendocrinology 2017, 105: 212-44.
- Garin E, Le Jeune F, Devillers A, et al. Predictive value of 18F-FDG PET and somatostatin receptor scintigraphy in patients with metastatic endocrine tumors. J Nucl Med 2009, 50: 858-64.
- Fuccio C, Musto A, Cambioli S, et al. When should F-18 FDG PET/CT be used instead of 68Ga-DOTA-peptides to investigate metastatic neuroendocrine tumors? Clin Nucl Med 2011, 36: 1109-11.
- Sansovini M, Severi S, Ianniello A, et al. Long-term follow-up and role of FDG PET in advanced pancreatic neuroendocrine patients treated with 177Lu-D OTATATE. Eur J Nucl Med Mol Imaging 2017, 44: 490-9.
- Ambrosini V, Kunikowska J, Baudin E, et al. Consensus on molecular imaging and theranostics in neuroendocrine neoplasms. Eur J Cancer 2021, 146: 56-73.
- Becherer A, Szabo M, Karanikas G, et al. Imaging of advanced neuroendocrine tumors with 18F-FDOPA PET. J Nucl Med 2004, 45: 1161-7.
- Haug A, Auernhammer CJ, Wangler B, et al. Intraindividual comparison of 68Ga-DOTA-TATE and 18F-DOPA PET in patients with well-differentiated metastatic neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2009, 36: 765-70.
- Koopmans KP, Neels OC, Kema IP, et al. Improved staging of patients with carcinoid and islet cell tumors with 18F-dihydroxy-phenyl-alanine and 11C-5-hydroxy-tryptophan positron emission tomography. J Clin Oncol 2008, 26: 1489-95.
- Jager PL, Chirakal R, Marriott CJ, et al. 6-L-18F-fluorodihydroxyphenylalanine PET in neuroendocrine tumors: basic aspects and emerging clinical applications. J Nucl Med 2008, 49: 573-86.
- Kauhanen S, Seppanen M, Ovaska J, et al. The clinical value of [18F]fluoro-dihydroxyphenylalanine positron emission tomography in primary diagnosis, staging, and restaging of neuroendocrine tumors. Endocr Relat Cancer 2009, 16: 255-65.
- Bozkurt MF, Virgolini I, Balogova S, et al. Erratum to: Guideline for PET/CT imaging of neuroendocrine neoplasms with 68Ga-DOTA-conjugated somatostatin receptor targeting peptides and 18F-DOPA. Eur J Nucl Med Mol Imaging 2017, 44: 2150-1.
- Orlefors H, Sundin A, Garske U, et al. Whole-body 11C-5-hydroxytryptophan positron emission tomography as a universal imaging technique for neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and computed tomography. J Clin Endocrinol Metab 2005, 90: 3392-400.
- Sundin A, Garske U, Orlefors H. Nuclear imaging of neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab 2007, 21: 69-85.
- Christ E, Wild D, Forrer F, et al. Glucagon-like peptide-1 receptor imaging for localization of insulinomas. J Clin Endocrinol Metab 2009, 94: 4398-405.
- Ginj M, Zhang H, Waser B, et al. Radiolabeled somatostatin receptor antagonists are preferable to agonists for in vivo peptide receptor targeting of tumors. Proc Natl Acad Sci USA 2006, 103: 16436-41.
- Nicolas GP, Morgenstern A, Schottelius M, et al. New developments in peptide receptor radionuclide therapy. J Nucl Med 2019, 60: 167-71.
Eco-endoscopia e FNA
Debora Berretti
Gastroenterologia, Azienda Ospedaliero - Universitaria "S. Maria della Misericordia", Udine
L’ecoendoscopia (EUS) permette di effettuare un’ecografia ad alta risoluzione della parete del tubo digerente (esofago, stomaco, duodeno, retto) e delle strutture adiacenti ad esso (mediastino, pancreas, vie biliari), mediante l’utilizzo di un endoscopio digestivo (simile al gastroscopio), alla cui estremità è stato applicato un piccolo trasduttore ecografico. Gli strumenti di ultima generazione, a scansione settoriale, permettono anche di effettuare agoaspirazioni eco-guidate (FNA) per eseguire un esame citologico, biochimico o immunoistochimico delle lesioni visualizzate.
L’esame richiede come preparazione il digiuno di 8 ore e ha durata variabile da 15 a 30 minuti; è ben tollerato grazie alla sedo-analgesia somministrata ed è sicuro. Infatti, è basso (0.5-1.5%) il rischio di complicanze legate principalmente alla EUS-FNA (emorragia, infezione, perforazione, pancreatite, seeding).
Le principali indicazioni a eseguire l’EUS sono:
- stadiazione loco-regionale delle neoplasie del tubo digerente;
- diagnosi differenziale delle lesioni sotto-epiteliali del tubo digerente;
- diagnosi differenziale delle lesioni solide pancreatiche;
- diagnosi differenziale delle lesioni cistiche pancreatiche;
- ricerca delle precoci alterazioni associate alla pancreatite cronica;
- ricerca di calcoli nel coledoco;
- diagnosi e stadiazione loco-regionale delle neoplasie della via biliare extra-epatica;
- stadiazione del carcinoma polmonare non a piccole cellule;
- eco-endoscopia operativa.
Controindicazione relativa è la gastro-resezione.
L’ecoendoscopia può essere utile nel determinare la profondità di invasione del tumore nella parete gastrica ed è raccomandata prima della resezione endoscopica di NET gastrici di tipo 1 e 2 se di dimensioni > 1-2 cm e anche per escludere eventuali metastasi linfonodali tramite conferma tissutale tramite agoaspirato (1). Il suo ruolo è invece ancora controverso nella diagnosi dei piccoli NET duodenali.
L’EUS è molto utile nella valutazione pre-trattamento dei NET rettali; infatti, tramite la determinazione del T e la presenza o meno di metastasi linfonodali ci fornisce informazioni importanti per quanto riguarda la scelta del trattamento più corretto (endoscopico vs chirurgico) (2,3).
L’EUS è una metodica molto efficace per l’identificazione e la stadiazione dei NET pancreatici funzionanti e non, soprattutto se piccoli o multipli come nella MEN-1 o nella VHL. I NET pancreatici appaiono di solito come lesioni ipoecogene, ben definite, ipervascolarizzate. Nei tumori di maggiori dimensioni sono frequenti alterazioni cistiche, calcificazioni e necrosi. Nel caso di sospetto insulinoma, l’approccio diagnostico migliore si è dimostrato l’utilizzo combinato dell’EUS e della TC multidetector (4). Inoltre, è utile la possibilità di ottenere campioni tissutali con l’agoaspirato per la conferma diagnostica prima della chirurgia.
L’EUS-FNA, pur essendo una metodica invasiva, operatore-dipendente e non disponibile in tutti i centri, presenta una sensibilità elevata (79-100%) con un PPV vicino al 100% (5,6). In uno studio caso-controllo l’EUS si è dimostrata accurata e costo-efficace se utilizzata precocemente nel work-up pre-operatorio, riducendo la necessità di ulteriori indagini invasive e il consumo di risorse (7), con un basso tasso di complicanze (< 1%). Inoltre, è dimostrata una buona correlazione tra la citologia ottenuta con FNA e l’istologia finale dopo chirurgia (8). Anche in caso di NET identificato chiaramente da altre tecniche di imaging, la EUS può fornire informazioni estremamente utili ai fini della pianificazione del tipo di intervento chirurgico, precisando il rapporto tra il tumore, le strutture vascolari adiacenti e il dotto di Wirsung (9).

Eco-endoscopia radiale: piccola formazione ipoecogena di 5.5 mm contenuta all’interno della sottomucosa (III strato iperecogeno) (gastrinoma)

Metastasi linfonodale peri-pancreatica di 15.7 mm dal gastrinoma del'immagine precedente

Eco-endoscopia settoriale: formazione ipoecogena della coda (insulinoma)

Eco-endoscopia radiale: formazione ipoecogena vascolarizzata a livello della coda pancreatica (insulinoma)

EUS-FNA di insulinoma

EUS settoriale di NET avanzato: formazione del corpo-coda di 12 cm ad eco struttura disomogenea, debolmente ipoecogenacon aree anecogene interne come da necrosi, non dissociabile dalla parete gastrica


EUS settoriale: NET cistico di 28 mm della testa pancreatica (notare la vascolarizzazione dei setti nell'immagine di destra)


EUS settoriale: NET del corpo pancreatico di 10.3 mm (a destra l'immagine con color-doppler)

EUS-FNA del NET del corpo pancreatico (dell'immagine sovrastante)


EUS settoriale: NET del corpo pancreatico di 31 mm (a destra immagine power-doppler)
Donna di 69 anni affetta da sospetto pNET in m di Addison + m. celiaca. L'ecografia endo-cavitaria evidenzia la presenza di formazione solida, tondeggiante, ipoecogena, lobulata, di 13 mm, molto vascolarizzata al color-doppler. La lesione è a livello della testa pancreatica, lateralmente e posteriormente alla papilla (in sede comunque anteriore), adiacente al Wirsung (distanza circa 2 mm); subito posteriormente alla lesione, è visibile minuta struttura anecogena tubulare di 3-4 mm, riferibile in primis a dotto secondario lievemente ectasico. Pancreas per il resto regolare per dimensioni, ad ecostruttura solo più iperecogena che di norma, come da involuzione fibro-adiposa. Wirsung regolare lungo tutto il suo decorso.
Dopo profilassi antibiotica ev (Ciproxin 200 mg), si effettua puntura (dal duodeno) della lesione della testa pancreatica, mediante ago 25 G effettuando 3 passaggi (senza aspirazione). Il materiale prelevato, la cui rappresentatività viene valutata dal citologo on site, viene suddiviso in 4 vetrini fissati + 1 lysis buffer per cito-incluso.
La EUS-FNA è una metodica sensibile, sicura, accurata e costo-efficace per l’identificazione pre-operatoria dei NET pancreatici e deve essere considerata il test di scelta soprattutto nei casi di lesioni piccole non identificate dalla TC o da altre tecniche di imaging.
Bibliografia
- Merola E, Sbrozzi-Vanni A, Panzuto F, et al. Type I gastric carcinoids: a prospective study on endoscopic management and recurrence rate. Neuroendocrinology 2012, 95: 207-13.
- Scherubl H. Rectal carcinoids are on the rise: early detection by screening endoscopy. Endoscopy 2009, 41: 162-5.
- Ramage JK, et al; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumors: well differentiated colon and rectum tumor/carcinoma. Neuroendocrinology 2008, 87: 31-9.
- Gouya H, Palazzo L, et al. CT, endoscopic sonography, and a combined protocol for preoperative evaluation of pancreatic insulinomas. AJR Am J Roentgenol 2003, 181: 987-92.
- Atiq M, Bhutani MS, Bektas M, et al. EUS-FNA for pancreatic neuroendocrine tumors: a tertiary cancer center experience. Dig Dis Sci 2012, 57: 791–800.
- Pais SA, Al-Haddad M, Mohamadnejad M, et al. EUS for pancreatic neuroendocrine tumors: a single-center, 11-year experience. Gastrointest Endosc 2010, 71: 1185-93.
- Bansal R, Tierney W, Carpenter S, et al. Cost effectiveness of EUS for preoperative localization of pancreatic endocrine tumors. Gastrointest Endosc 1999, 49: 19–25.
- Yao J, Raju GS, Wang X, et al. Cytologic diagnosis of pancreatic endocrine tumors by endoscopic ultrasound-guided fine-needle aspiration: a review. Diagn Cytopathol 2006, 34: 649-58.
- Alsohaibani F, Bigam D, Kneteman N, et al. The impact of preoperative endoscopic ultrasound on the surgical management of pancreatic neuroendocrine tumours. Can J Gastroenterol 2008, 22: 817-20.
- Puli SR, Bechtold ML, Buxbaum JL, Eloubeidi MA. How good is endoscopic ultrasound-guided fine-needle aspiration in diagnosing the correct etiology for a solid pancreatic mass? A meta-analysis and systematic review. Pancreas 2013, 42: 20-6.
- Puli SR, Kalva N, Bechtold ML, et al. Diagnostic accuracy of endoscopic ultrasound in pancreatic neuroendocrine tumors: A systematic reviewand metaanalysis. World J Gastroenterol 2013, 19: 3678-84.
- Shumacher B, Lubke HJ, Frieling T, et al. Prospective study on the detection of insulinomas by endoscopic ultrasonography. Endoscopy 1996, 28: 273–6.
- Hooper K, Mukhtar F, Li S, Eltoum IA. Diagnostic error assessment and associated harm of endoscopic ultrasound-guided fine-needle aspiration of neuroendocrine neoplasms of the pancreas. Cancer Cytopathol DOI: 10.1002/cncy.21332.
- Chang F, Chandra A, Culora G, et al. Cytologic diagnosis of pancreatic endocrine tumors by endoscopic ultrasound-guided fine-needle aspiration: a review. Diagn Cytopathol 2006, 34: 649-58.

