Clinica e terapia del diabete insipido
Marco Faustini Fustini
Endocrinologia, Ospedale Bellaria, Bologna
Diabete insipido (DI) centrale e DI nefrogenico condividono la sindrome poliurico/polidipsica con urine ipotoniche quale cardine del quadro clinico, fatte salve alcune rare eccezioni in cui questa classica sintomatologia può risultare sfumata o assente per un danno primitivo o secondario del centro ipotalamico della sete. Se il senso della sete è conservato e il paziente ha libero accesso all'acqua, difficilmente si avranno alterazioni elettrolitiche rilevanti e il paziente rimarrà paucisintomatico. In particolare, la sodiemia e l'osmolalità plasmatiche rimarranno a lungo normali o ai limiti superiori di norma, nonostante la persistente ipostenuria. In alcune circostanze, tuttavia, questo equilibrio può interrompersi, per la severità del DI o per la concomitanza di fattori esterni che concorrono a questo evento (mancato accesso all'acqua, errata convinzione che la poliuria si corregga introducendo meno liquidi, stato di coma, ecc). In questi casi, può comparire disidratazione anche grave, accompagnata da incremento dell'osmolalità plasmatica e della sodiemia. Il sistema nervono centrale è il primo a risentire della disidratazione intracellulare. Irritabilità, riduzione dello stato di coscienza, crisi epilettiche e coma possono esitare in una emergenza medica severa. A fronte di queste innegabili analogie, esistono, comunque, differenze sostanziali che separano le due forme di DI, che saranno pertanto trattate in sezioni distinte.
Clinica e terapia del diabete insipido centrale
Marco Faustini Fustini
Endocrinologia, Ospedale Bellaria, Bologna
Il DI centrale è la conseguenza della mancata sintesi e/o secrezione di AVP da parte dei neuroni magnocellulari ipotalamici del nucleo sopraottico e paraventricolare. Un danno limitato alla neuroipofisi non sempre conduce a DI conclamato; tuttavia, forme parziali di DI centrale possono avere questa patogenesi. Forme ereditarie e forme acquisite di DI possono aversi sia nel DI centrale sia nel DI nefrogenico (cfr classificazione).
DI CENTRALE EREDITARIO
Notoriamente più rare delle forme acquisite, quelle ereditarie solitamente non compaiono alla nascita, bensì mesi o anche anni dopo. Questa latenza si spiega con il fatto che le mutazioni che sottendono al difetto genetico (nella maggior parte dei casi trasmesse con modalità autosomica dominante) sono localizzate nella regione che codifica il peptide del pre-pro-ormone, più spesso a livello dell'estremità carbossi-terminale del sito di clivaggio della neurofisina dall'ormone. Si ritiene che l'accumulo intra-neuronale (nel reticolo endoplasmatico) di questo precursore anomalo possa causare apoptosi e ciò spiegherebbe la latenza e la lenta progressione della malattia (1). In realtà, il meccanismo che porta a morte cellulare non è del tutto chiaro; d’altra parte, la ridotta disponibilità di vasopressina non è sempre la conseguenza di morte cellulare.
I rarissimi casi di DI centrale ereditario trasmesso con modalità autosomica recessiva, similmente alle forme autosomiche dominanti, non si manifestano alla nascita, bensì nella prima infanzia. In alcune famiglie il difetto genetico riguarda il gene della vasopressina e produce una molecola con ridotta attività biologica e, quindi, non completamente inefficace. In altri casi, la trasmissione autosomica recessiva s'inserisce nel più ampio quadro sindromico conosciuto come sindrome di Wolfram (2), nota anche con l'acronimo DIDMOAD (diabetes insipidus, diabetes mellitus, optic atrophy, deafness). Mediamente, il diabete mellito compare come prima manifestazione di malattia attorno ai 6 anni di età, mentre il DI si manifesta per lo più nella seconda decade, in oltre il 70% dei casi. Si tratta di una malattia ereditaria neurodegenerativa progressiva alquanto rara, che porta solitamente a morte precoce (età media della morte: 30 anni), con una prevalenza variabile da un massimo di 1:68.000 (stimata su una popolazione libanese con alto tasso di consanguineità) a un minimo di 1:770.000 (stimata su un'ampia popolazione del Regno Unito). Inizialmente interpretata come possibile malattia mitocondriale, la patogenesi è stata in seguito chiarita. La mutazione riguarda il gene WFS1, che codifica per la wolframina, una proteina trans-membrana del reticolo endoplasmatico (3). Recentemente, è stato identificato un altro gene (CISD1), responsabile di una forma particolare di sindrome di Wolfram, in cui manca il diabete insipido, ma sono presenti altre alterazioni (insufficienza renale, ipogonadismo, ulcere gastrointestinali, ecc.).
DI CENTRALE ACQUISITO
Eziopatogenesi
Alcune neoplasie primitive della regione sovrasellare (soprattutto craniofaringioma, germinoma, pinealoma) presentano non raramente sin dall’esordio di malattia il diabete insipido, spesso associato a segni e sintomi d’ipopituitarismo anteriore e/o a deficit visivo (4). Molti casi compaiono nei bambini. Tuttavia, non è raro che, ad esempio, il craniofaringioma possa esordire con il DI anche nell’adulto.
Le metastasi ipofisarie, in generale alquanto rare, coinvolgono preferibilmente l’ipofisi posteriore e il peduncolo ipofisario, più raramente l’ipofisi anteriore. Pertanto, la poliuria e la polidipsia ne rappresentano spesso i sintomi d’esordio, troppe volte a lungo dimenticati. Duole, infatti, riconoscere la scarsa importanza riservata, nel paziente neoplastico, alla sindrome poliurica/polidipsica, raramente indagata anche semplicemente con indagini di primo livello (raccolta urine delle 24 ore, osmolarità urinaria).
Linfomi (soprattutto le forme primitive del SNC) e leucemie (soprattutto le forme non-linfocitiche) possono associarsi a DI. Il meccanismo responsabile del deficit di AVP non è sempre l’infiltrazione dell’ipotalamo da parte di tessuto patologico. Infatti, a volte la RM non mostra un danno diretto; in questi casi, è stato ipotizzato un meccanismo mediato dalla vasculite.
Le ipofisiti si associano spesso a DI, poiché coinvolgono solitamente la regione infundibolare. Qualche volta il DI insipido può essere transitorio e regredire spontaneamente dopo qualche settimana dall’esordio.
Le malattie granulomatose (istiocitosi a cellule di Langerhans, granulomatosi di Wegener, sarcoidosi, tubercolosi, sifilide) si associano a DI con frequenza variabile. In qualche caso, la diagnosi di DI precede quella della malattia granulomatosa sistemica.
La chirurgia trans-sfenoidale costituisce una causa importante di DI centrale, probabilmente la principale (4). In particolare, la chirurgia del craniofaringioma e di altri tumori della regione sovrasellare (astrocitoma, glioma, germinoma, pinealoma, cordoma, ecc) non raramente si complica con DI centrale permanente. Ancora più frequenti sono le forme transitorie di DI post-operatorio, che solitamente regrediscono spontaneamente in qualche giorno o settimana. La chirurgia tradizionale per via craniotomica dei tumori della regione sellare/sovrasellare e la chirurgia vascolare del SNC (soprattutto quella degli aneurismi dell’arteria comunicante anteriore) possono talvolta complicarsi con DI.
I traumi cranici, soprattutto quelli di una certa entità, possono associarsi a DI centrale e/o a ipopituitarismo anteriore. Nonostante la reale prevalenza del DI post-traumatico non sia completamente nota, non v’è dubbio che il paziente con trauma cranico debba essere attentamente valutato anche sotto il profilo dell’equilibrio idro-salino.
In qualche caso, la diagnosi di DI centrale rimane senza una causa evidente (DI centrale idiopatico); l’origine autoimmunitaria è stata più volte suggerita, e appare effettivamente verosimile in questi casi. Tuttavia, si tratta di un gruppo di pazienti eterogeneo e tuttora manca una spiegazione unitaria.
Quadro clinico e terapia
In generale, a parte la classica sintomatologia d’esordio caratterizzata da poliuria (> 2L/m2/die) e polidipsia, il maggior rischio per il paziente con DI è la severa disidratazione con encefalopatia ipernatremica (ottundimento del sensorio, crisi epilettiche, coma, emorragie cerebrali), secondaria alla disidratazione del tessuto cerebrale, evenienza fortunatamente alquanto rara se il paziente conserva il senso della sete e ha libero accesso all’acqua. Un adeguato apporto d’acqua è pertanto essenziale per la salute del paziente. Quest’affermazione può sembrare superflua, ma non è raro, ad esempio, che i genitori di bambini affetti da DI tendano a limitare l’apporto d’acqua, nell’erroneo convincimento di evitare così la poliuria. Ciò detto, occorre aggiungere che, almeno nel caso del DI centrale, disponiamo fortunatamente anche di una terapia sostitutiva efficace, la desmopressina, oggi disponibile anche in capsule sublinguali da 30 e 60 µg oltre che nella classica formulazione in spray nasale. In pazienti ospedalizzati, può essere utilizzata, in casi particolari, la formulazione in fiale somministrabili per via parenterale (im, sc, in bolo ev), da 5 a 20 volte più potente della formulazione per spray nasale. La terapia domiciliare con desmopressina per via sublinguale va strettamente personalizzata e il compenso (diuresi < 2 L/die) può richiedere dosi molto diverse (da 30 a 180-240 µg/die).
Follow-up
L’esame urine, il volume urinario e la sodiemia sono indagini biochimiche utili per il follow-up e possono essere richieste con cadenza variabile (6-12 mesi nel paziente compensato; 2-4 settimane nel paziente ambulatoriale che ha appena iniziato la terapia). L’osmolalità urinaria, non disponibile in tutti i centri, può essere di ausilio qualora si abbia la percezione, per la contrazione del volume urinario o il riscontro d’iponatremia, che la dose di desmopressina sia eccessiva. Se la diagnosi di DI centrale è corretta, il rischio d’iponatremia grave è modesto. Tuttavia, nelle fasi iniziali del trattamento tale rischio è reale, soprattutto nei pazienti sottoposti di recente a chirurgia trans-sfenoidale con sezione chirurgica del peduncolo ipofisario. Questa rara eventualità realizza un quadro clinico particolare, noto come diabete insipido trifasico, caratterizzato da una prima fase (di solito della durata di 7-8 giorni) di evidente diabete insipido centrale, seguito da una seconda fase (anch’essa generalmente di una settimana) in cui viene dismessa AVP precedentemente accumulata dalle terminazioni assonali beanti e la diuresi tende a contrarsi, e infine da una terza fase di DI permanente. Nella seconda fase, la liberazione endogena di AVP si aggiunge alla desmopressina esogena e il paziente rischia di sviluppare iponatremia ipotonica, se il medico non è a conoscenza di questa rara condizione.
BIBLIOGRAFIA
- Siggaard C, Rittig S, Corydon TJ, et al. Clinical and molecular evidence of abnormal processing and trafficking of the vasopressin preprohormone in a large kindred with familial neurohypophyseal diabetes insipidus due to a signal peptide mutation. J Clin Endocrinol Metab 1999, 84: 2933-41.
- Barrett TG, Bundey SE, Macleod AF. Neurodegeneration and diabetes: UK nationwide study of Wolfram (DIDMOAD) syndrome. Lancet 1995, 346: 1458-63.
- Inoue H. Tanizawa Y, Wasson J, et al. A gene encoding a transmembrane protein is mutated in patients with diabetes mellitus and optic atrophy (Wolfram syndrome). Nat Genet 1998, 20: 143-8.
- Faustini-Fustini M, Frank G. Diabetes insipidus. In Laws ER Jr, Ezzat S, SL Asa, Rio LM, et al (eds). Pituitary Disorders: Diagnosis and Management. Wiley-Blackwell, Oxford, UK, 2012: 281.
Clinica e terapia del diabete insipido nefrogenico
Marco Faustini Fustini
Endocrinologia, Ospedale Bellaria, Bologna
L’inadeguata risposta renale all’arginin-vasopressina (AVP) caratterizza il DI nefrogenico.
DI nefrogenico congenito
Le forme genetiche realizzano certamente i quadri clinici più gravi di DI nefrogenico e si presentano fin dalla nascita, diversamente dalle forme ereditarie di DI centrale. I casi severi si accompagnano a ipernatremia nei primi giorni di vita se l’apporto di acqua non è adeguato. La diagnosi di DI nefrogenico ereditario non è, tuttavia, esclusivo appannaggio del pediatra. Recentemente, e non si tratta di un evento isolato, è stato riportato un caso diagnosticato all’età di 57 anni con una poliuria di 12 litri al giorno (1).
Le mutazioni del gene che codifica il recettore V2 di AVP (VR2), trasmesse con modalità recessiva legata al cromosoma X, sono la causa più frequente (circa 90%). Le oltre 200 mutazioni del gene VR2 finora riportate realizzano differenti aspetti fenotipici:
- ridotta affinità di legame con AVP;
- difettoso ripiegamento nello spazio della proteina nel versante di membrana rivolto all’interno della cellula, con alterazione del traffico intra-cellulare;
- ridotta o assente trascrizione del recettore (per delezione del gene o complessi riarrangiamenti genomici);
- improprio splicing dell’RNA messaggero (2).
Nel restante 10% dei casi le mutazioni riguardano il gene AQP2, che codifica il canale dell’acqua acquaporina-2 (situato sulle cellule principali del dotto collettore renale , similmente al recettore V2 di AVP) e si trasmettono con modalità autosomica recessiva. Tutte le mutazioni del gene AQP2 riguardano la codifica della regione citosolica carbossi-terminale di AQP2, essenziale per il corretto funzionamento meccanico del canale verso la membrana apicale (2).
DI nefrogenico acquisito
Meno severo, ma certamente più frequente, della forma congenita, il DI nefrogenico acquisito si caratterizza per la capacità di mantenere, seppure solo parzialmente, la capacità a concentrare le urine, così che la diuresi giornaliera generalmente non supera i 3-4 litri.
Le condizioni che possono portare allo sviluppo di DI nefrogenico acquisito possono essere diverse:
- malattie renali in grado di alterare l’architettura renale (rene policistico, malattie infiltrative, infarto renale, ecc);
- condizioni che portano alla perdita del gradiente midollare (eccessivo introito d’acqua, uso prolungato di diuretici) o alla ridotta concentrazione di urea nella midollare (dieta gravemente ipoproteica);
- ridotta espressione di acquaporina-2 nelle cellule principali del dotto collettore (deplezione di potassio, ipercalcemia, ostruzione bilaterale delle vie escretrici renali, dieta ipoproteica, acidosi metabolica, ecc);
- farmaci (sali di litio, demeclociclina, ecc…).
Il litio, causa frequente di DI nefrogenico, entra nelle cellule principali del dotto collettore attraverso i canali epiteliali del sodio nella membrana apicale, accumulandosi nel citoplasma, dove favorisce indirettamente l’escrezione locale di prostaglandina E2, che a sua volta favorisce l’endocitosi dei canali acquaporina-2 dalla membrana plasmatica. L’ovvia conseguenza è la ridotta capacità della cellula principale del dotto collettore a concentrare le urine.
Terapia del DI nefrogenico
Non esiste tuttora una terapia specifica per il DI nefrogenico.
Assicurare un adeguato apporto d’acqua è ovviamente un punto fermo nella terapia del DI nefrogenico. L’uso combinato di una dieta povera di sodio e di diuretici tiazidici, che bloccano l’assorbimento di sodio nella corticale renale, può essere di una certa utilità, poiché il risultato complessivo è una modesta ipovolemia, che stimola il riassorbimento prossimale isotonico di soluti a livello del tubulo prossimale e diminuisce l’arrivo di soluti alla parte distale del nefrone. Nel complesso, questi eventi diminuiscono la clearance dell’acqua libera indipendentemente dall’azione di AVP, riducendo così la poliuria (3).
Un adeguato apporto di potassio è necessario in caso d’ipopotassiemia.
Un’attenzione particolare deve essere posta nei pazienti in terapia con sali di litio in cui si propone la terapia con tiazidici, poichè la riduzione della volemia, aumentando il riassorbimento prossimale tubulare, può determinare un aumento delle concentrazioni di litio a livelli potenzialmente tossici. In questo caso, può essere preferibile l’uso di amiloride.
Come farmaci adiuvanti nella terapia del DI nefrogenico sono stati proposti anche gli agenti anti-infiammatori non steroidei, i quali, bloccando la sintesi renale di prostaglandine (che aumentano il flusso midollare renale e riducono la concentrazione di soluti nella midollare), possono aumentare il riassorbimento di acqua non mediato da AVP e ridurre la diluizione delle urine attraverso la riduzione della clearance di acqua libera.
Bibliografia
- Boselt I, Tramma D, Kalamitsou S, et al. Functional characterization of novel loss-of-function mutations in the vasopressin type 2 receptor gene causing nephrogenic diabetes insipidus. Nephrol Dial Transplant 2012, 27: 1521-8.
- Fujiwara TM, Bichet DG. Molecular biology of hereditary diabetes insipidus. J Am Soc Nephrol 2005, 16: 2836-46.
- Magaldi AJ. New insights into the paradoxical effect of thiazides in diabete insipidus therapy. Nephrol Dial Transplant 2000, 15: 1903-5.
Scheda desmopressina
Marco Faustini Fustini
Endocrinologia, Ospedale Bellaria, Bologna
Meccanismo d’azione
Analogo sintetico dell'arginin-vasopressina (AVP), agisce mediante il recettore V2 di AVP. Possiede un'attività antidiuretica prolungata, ma scarsi effetti pressori. Modula anche i livelli circolanti del fattore VIII e del fattore di von Willebrand.
Indicazioni
Diabete insipido centrale. Enuresi notturna (con cautela). In campo ematologico, l'impiego della desmopressina è stato proposto nella malattia di von Willebrand tipo I e nella sindrome di von Willebrand acquisita.
Contro-indicazioni e precauzioni
Nel paziente con diabete insipido di diagnosi recente, in cui non sia stata ancora stabilita la dose terapeutica ottimale, va tenuto ben presente il rischio di sovradosaggio (contrazione della diuresi con espansione del volume del compartimento fluido extra-cellulare e conseguente sviluppo d'iponatremia ipotonica). Va posta estrema cautela anche nel bambino con enuresi notturna, in cui il rischio d'indurre iponatremia iatrogena è elevato.
La contemporanea assunzione di alcuni farmaci (carbamazepina, oxcarbazepina, indometacina) può potenziare l'effetto della desmopressina, favorendo il rischio di iponatremia. Con meccanismo differente (effetto natriuretico), anche l'impiego di tiazidici e amiloride può favorire l'iponatremia nei pazienti in trattamento con desmopressina.
Preparazioni, via di somministrazione, posologia
La desmopressina è disponibile sotto forma di spray nasale (Minirin), fiale (da 4 µg/mL, per uso sottocutaneo, intramuscolare, endovenoso, Emosint, Minirin) e compresse sublinguali (da 60 µg e 120 µg, Minirin, desmopressina TEVA, desmopressina Zentiva; da 0.1 e 0.2 mg Pseurin).
Con l'introduzione delle compresse, l'impiego dello spray nasale (10 µg per ogni singolo puff, dose media giornaliera variabile da 10 a 60 µg) è divenuto sempre più raro. La dose giornaliera delle compresse sublinguali varia da 60 a 420 µg/die. Le fiale (4 µg/mL) vengono utilizzate assai di rado, per lo più in pazienti ricoverati in terapia intensiva o, in alcuni casi, nel periodo perioperatorio, utilizzando dosi variabili tra 0.5 e 2 µg per singola iniezione (solitamente si preferisce la via sottocutanea). Le fiale trovano anche indicazione in alcuni test diagnostici (test della sete, sindrome di Cushing).
Effetti collaterali
L'iponatremia può talora manifestarsi in pazienti con diabete insipido che assumono dosi eccessive di desmopressina e che al contempo assumono una quantità di acqua sufficiente a espandere il volume del fluido extracellulare. Particolare cautela occorre anche nel trattare con desmopressina bambini con enuresi.
Limitazioni prescrittive
Prescrivibile in classe A senza limitazioni.
Ascessi ipofisari
Claudia Battista
Ospedale “Casa Sollievo della Sofferenza”, Unità Operativa Complessa di Endocrinologia, San Giovanni Rotondo (FG)
Clinica e diagnostica
In letteratura sono stati descritti circa 200 casi di ascesso ipofisario, una patologia infettiva rara ma grave, con un tasso di mortalità del 30-50% quando il decorso è complicato da meningite (1). Rappresenta meno dell’1% della patologia ipofisaria (2).
L’ascesso può essere causato da un’infezione arrivata per via ematogena o da un’infezione sviluppatasi nelle adiacenze della ghiandola ipofisaria, come ad esempio una sinusite dello sfenoide, una meningite o, più raramente, una tromboflebite del seno cavernoso. Altri fattori di rischio includono una condizione sottostante di immunodeficienza, un pregresso intervento chirurgico sull’ipofisi o l’irradiazione della ghiandola ipofisaria. Nel 60% dei casi, tuttavia, non sono stati individuati fattori predisponenti (2). L’ascesso può svilupparsi sia nell’ambito di una ghiandola ipofisaria normale (2/3 dei casi) che in una ghiandola con una pre-esistente lesione quale adenoma, craniofaringioma o cisti di Rathke.
I più comuni agenti patogeni sono i batteri Gram positivi (50%), ma sono stati trovati anche batteri Gram negativi, funghi, amebe e lieviti. L’esame colturale del materiale drenato dall’ascesso identifica l’agente patogeno solo nel 50% dei casi (1). Alcuni autori ritengono che un ascesso sterile possa essere in realtà l’evoluzione di un processo necrotico nell’ambito di una ghiandola ipofisaria infarcita o il contenuto di una cisti ipofisaria atipica (3). Tra le infezioni fungine sono stati descritti casi di aspergillosi (4).
Come tutte le lesioni infiammatorie dell’ipofisi, l’ascesso non è responsabile di un’iperfunzione della ghiandola, se si eccettua un’iperprolattinemia secondaria all’interessamento del peduncolo ipofisario, mentre sono prevalenti i disturbi legati all’effetto massa.
La diagnosi pre-operatoria è spesso difficoltosa a causa della assenza di segni e/o sintomi specifici. Anche le comuni manifestazioni infiammatorie, quali febbre, leucocitosi, meningismo, possono essere di entità modesta o addirittura assenti, ad eccezione che nelle forme ad esordio acuto o sub-acuto. Il decorso della patologia, infatti, è solitamente cronico, indolente, rendendo difficile distinguere, per tale motivo, un ascesso da un adenoma ipofisario.
Pertanto, anche in assenza di segni di infiammazione, l’ascesso dovrebbe essere sempre tenuto in considerazione nella diagnosi differenziale delle masse sellari.
Frequentemente, in presenza di un ascesso, viene descritta una triade caratterizzata dall’associazione di diabete insipido (40% dei casi), ipopituitarismo e, radiologicamente, all’esame RM, di una formazione cistica, delimitata da un orletto iperintenso dopo somministrazione di mezzo di contrasto. La presenza di questa triade permette la diagnosi con elevata probabilità (2).
A differenza dell’ascesso, nell’adenoma ipofisario il diabete insipido non è comune, soprattutto alla diagnosi, e la modalità di presentazione dell’ipopituitarismo risulta differente. Infatti, nell’adenoma la sintomatologia dell’ipopituitarismo è modesta, essendo cronica l’evoluzione dell’insufficienza ipofisaria. Questo potrebbe essere ascritto alla capacità di resistenza della ghiandola ipofisaria ai fenomeni compressivi, anche di lunga durata, determinati dall’adenoma. Nell’ipopituitarismo associato all’ascesso i sintomi sono spesso precoci, poiché la patologia infettiva tende a distruggere la ghiandola ipofisaria. Una sintomatologia eclatante correlata all’ipopituitarismo è invece tipica dell’apoplessia ipofisaria acuta.
Pertanto, per la diagnosi differenziale, è importante anche considerare la modalità di presentazione dell’ipopituitarismo oltre alla presenza del diabete insipido.
Altro sintomo comune all’ascesso è la cefalea (90% dei casi) che, tuttavia, non è specifico (2), né è stata descritta una particolare tipologia di presentazione della cefalea.
Anche i disturbi visivi, normalmente correlabili con la presenza di una massa sellare, non sono tipici dell’ascesso. L’oftalmoplegia può essere considerata, invece, una manifestazione distintiva dell'ascesso che non di altre lesioni sellari, in particolare dell’adenoma ipofisario (2).
L’esame RM può essere utile per la diagnosi. L’aspetto neuroradiologico dell’ascesso è quello di una lesione cistica sellare, di forma rotonda, ipo- o iso-intenso nelle immagini T1 senza mdc e iper- o iso-intenso nelle immagini T2 dopo mdc, con un orletto iperintenso che lo delimita. Queste caratteristiche radiologiche non sono, tuttavia, specifiche solo dell’ascesso, ma anche di altre lesioni ipofisarie come la cisti della tasca di Rathke, l’adenoma cistico e il craniofaringioma cistico. Nel caso dell’ascesso, può essere dirimente per la diagnosi la presenza delle tipiche caratteristiche radiologiche in associazione con quelle cliniche.
Mediante esame RM è possibile, inoltre, evidenziare un ispessimento del peduncolo ipofisario, che è presente nell’ascesso così come nelle patologie granulomatose, nei linfomi, nei germinomi. Ma la coesistenza di una lesione cistica intrasellare deve sempre fare sospettare un ascesso.
L’esame RM “con diffusione” può permettere di differenziare l’ascesso ipofisario da una formazione sellare in evoluzione necrotica. Infatti, l’ascesso presenta un segnale ad elevata intensità durante la diffusione, unitamente ad una riduzione del coefficiente di diffusione apparente (ADC), mentre la formazione in evoluzione necrotica si caratterizza per un’ipointensità durante la diffusione ed un alto valore di ADC.
Sono stati descritti casi di lesioni sellari diagnosticati inizialmente come adenomi ipofisari che, in corso di follow-up, hanno modificato le proprie caratteristiche radiologiche, permettendo la diagnosi di ascesso. In tale situazione l’esame TC ha messo in evidenza la distruzione del pavimento sellare, determinata dall’espansione di un processo infiammatorio a partenza dal seno sfenoidale (5).

Ascesso ipofisario in paziente con sepsi stafilococcica.
Le immagini coronale in T1 (sinistra) e sagitale in T1 con mdc (centro) mostrano una lesione cistica intra e sovra-sellare, isointensa al cervello, con una sottile rima contrastata. La TC coronale con mdc (destra) mostra una lesione omogeneamente ipodensa, con presa di contrasto al margine, che risparmia i seni cavernosi (il seno sfenoidale non è pneumatizzato).
Terapia
Il trattamento dell’ascesso ipofisario prevede il drenaggio e la terapia antibiotica per 4-6 settimane dopo l’intervento. Se la diagnosi è pre-operatoria la terapia antibiotica deve essere effettuata anche prima dell’intervento.
La chirurgia trans-sfenoidale è ritenuta l’approccio più appropriato, in quanto permette il drenaggio dell’area infetta e, se presenti, la decompressione del chiasma ottico e il trattamento di una sinusite associata. Non sono state riportate in letteratura complicanze legate all’intervento di svuotamento dell’ascesso per via transfenoidale.
La craniotomia, aumentando la probabilità di contaminazione e, conseguentemente, di meningoencefalite risulta rischiosa.
Per le infezioni fungine la terapia antibiotica consigliata è con voriconazole e caspofungin (4).
Sono stati descritti anche casi di risoluzione completa dell’ascesso con sola terapia antibiotica. Una tale favorevole evoluzione è più probabile nelle situazioni di diagnosi precoce e in quelle ad evoluzione acuta, in cui viene iniziata precocemente la terapia antibiotica.
Successivamente al trattamento chirurgico, la possibilità di recupero della funzione ipofisaria è variabile, mentre risulta più frequente la persistenza dell’ipopituitarismo.
In molte casistiche descritte in letteratura le recidive risultavano inferiori al 20% ed erano più frequenti nei pazienti di sesso femminile, di media età, con disturbi del sistema immunitario o in pazienti sottoposti a pregresso intervento neurochirurgico.
Per il rischio di recidiva i pazienti devono effettuare uno stretto follow-up.
Conclusioni
L’ascesso ipofisario è una patologia infettiva rara, ma grave che dovrebbe essere sempre tenuta in considerazione nella diagnosi differenziale delle lesioni espansive ipofisarie.
La diagnosi pre-operatoria è spesso difficoltosa, mancando specifici sintomi e/o segni anche di tipo infiammatorio. L’ascesso può essere sospettato in pazienti che presentano una lesione espansiva ipofisaria con segni compressivi, ai quali era stata di recente diagnosticata una meningite, una sinusite o una condizione di immunodeficienza.
Il trattamento di scelta è il drenaggio dell’ascesso mediante chirurgia trans-sfenoidale, associato ad una appropriata terapia antibiotica. In caso di diagnosi pre-operatoria la terapia antibiotica deve essere instaurata anche prima dell’intervento.
A causa della frequenza di recidive e della persistenza di ipofunzione ipofisaria post-intervento questi pazienti necessitano di stretti controlli neuroradiologici ed endocrinologici.
Bibliografia
- Carpinteri R, Patelli I, Casanueva FF, et al. Inflammatory and granulomatous expansive lesions of the pituitary. Best Pract Res Clin Endocrinol Metab 2009, 23: 639–50.
- Liu F, Li G, Yao Y, et al. Diagnosis and management of pituitary abscess: experiences from 33 cases. Clin Endocrinol (Oxf) 2011, 74: 79-88.
- Vates GE, Berger MS, Wilson CB. Diagnosis and management of pituitary abscess: a review of twenty-four cases. J Neurosurg 2001, 95: 233–41.
- Liu W, Chen H, Cai B, et al. Successful treatment of sellar aspergillus abscess. J Clin Neurosci 2010, 17: 1587-9.
- Kuge A, Sato S, Takemura S, et al. Abscess formation associated with pituitary adenoma: A case report. Changes in the MRI appearance of pituitary adenoma before and after abscess formation. Surg Neurol Int 2011, 2: 3.
Classificazione delle ipofisiti
Sabrina Chiloiro, Antonella Giampietro, Laura De Marinis
UOS Patologie Ipotalamo-Ipofisarie, Università Cattolica del Sacro Cuore, Roma
L’ipofisite è una patologia infiammatoria rara, che può coinvolgere l’adeno-ipofisi, la neuro-ipofisi e/o il peduncolo ipofisario.
La storia naturale dell’ipofisite è difficilmente prevedibile e può manifestarsi con un andamento ciclico, con l’alternarsi di fasi di remissione e recidiva. Sono stati descritti anche casi di regressione spontanea, casi di progressiva fibrosi dell’adeno-ipofisi con conseguente sella vuota secondaria e ipopituitarismo, casi con coinvolgimento delle strutture cerebrali limitrofe, come il chiasma ottico, l’ipotalamo, le meningi, con conseguente sintomatologia neurologica, e casi di morte per insufficienza cortico-surrenalica acuta (1,2).
CLASSIFICAZIONE EZIOPATOGENETICA
Dal punto di vista eziopatogenetico, le ipofisiti si distinguono in forme primarie e forme secondarie e farmaco-indotte.
Ipofisiti primarie
Le ipofisiti primarie sono classificate isto-patologicamente in ipofisiti linfocitiche o autoimmuni, granulomatose, xantomatose, necrotizzanti, IgG4-plasmocitiche e forme miste (tabella 1) (3).
Le forme linfocitiche rappresentano le forme più comuni, seguite dalle granulomatose; ben più rare risultano le ipofisiti xantomatose e le IgG4-relate (4-5).
La variante linfocitica si distingue dalla variante granulomatosa per l’assenza di aggregati cellulari di istiociti epitelioidi e cellule giganti mononucleate. Tuttavia, le due varianti condividono caratteristiche ultra-strutturali analoghe. Ciò ha indotto alcuni autori a ipotizzare che le due forme rappresentino due stadi diversi della stessa ipofisite, con la forma granulomatosa che rappresenterebbe uno stadio più tardivo (6).
Le ipofisiti linfocitiche sono classificate morfologicamente in (7):
- adeno-ipofisite linfocitica (LAH), caratterizzata da infiltrazione linfocitica del lobo anteriore dell’ipofisi o sintomi e segni radiologici riferibili a ipopituitarismo anteriore;
- infundibolo-neuro-ipofisite linfocitica (LINH), caratterizzata da infiltrazione linfocitica dell’infundibulo ipofisario e della neuro-ipofisi o sintomi e segni radiologici di coinvolgimento della neuro-ipofisi;
- panipofisite linfocitica (LPH), caratterizzata dall’infiltrazione linfocitica di entrambi i lobi ipofisari e dell’infundibolo e relativi sintomi e segni radiologici.
L’ipofisite xantomatosa è invece istologicamente caratterizzata da infiltrazione di istiociti schiumosi ricchi di lipidi e linfociti (8).
L’ipofisite IgG4-plasmocitica è caratterizzata da infiltrato di cellule mononucleate, linfociti e plasmacellule IgG4-positive (4).
Infine, la forma necrotizzante è stata raramente descritta ed è caratterizzata da necrosi diffusa dell’ipofisi.
| Tabella 1 Classificazione isto-patologica delle ipofisiti primarie |
| Linfocitica (autoimmune) Granulomatosa Xantomatosa IgG4-plasmocitica Necrotizzante Forme miste |
Ipofisiti secondarie
Sono condizioni in cui il danno infiammatorio sull’ipofisi è secondario alla concomitante presenza di lesioni tumorali e cistiche della regione diencefalo-ipofisaria o a malattie sistemiche con localizzazione ipofisaria, come in particolare la IgG4-related disease, una patologia autoimmune caratterizzata da significativo incremento delle IgG4 circolanti, con interessamento clinico multi-organo, in particolare a carico di pancreas, tiroide, ghiandole salivari, linfonodi, polmoni e fegato (9).
Nei pazienti immuno-depressi devono inoltre essere prese in considerazione ipofisiti secondarie a infezioni batteriche, fungine o virali sistemiche (tabella 2) (10).
| Tabella 2 Ipofisiti secondarie |
|
| Lesioni cistiche e tumorali della regione | Germinoma Cisti della tasca di Rathke Craniofaringioma Adenomi ipofisari |
| Malattie sistemiche | Sarcoidosi Malattia di Crohn Malattia di Erdheim-Chester Malattia di Rosai-Dorfman Granulomatosi di Wegener Istiocitosi a cellule di Langerhans |
| Malattie Infettive | Sifilide Tubercolosi Infezioni batteriche, fungine o virali sistemiche in pazienti immuno-depressi |
Ipofisiti farmaco-indotte
Sono state descritte ipofisiti dopo la somministrazione di interferone-alfa, ribavirina e anticorpi monoclonali anti-CTLA-4, come tremelimumab e ipilimumab (10), nei pazienti affetti da melanoma.
EPIDEMIOLOGIA
Sebbene riportata con sempre maggior frequenza negli ultimi anni, l’ipofisite è una patologia rara, la cui prevalenza e incidenza non sono note con precisione. Alcuni studi fanno pensare a un’incidenza annuale di un caso per 9 milioni (12).
L’ipofisite auto-immune interessa più frequentemente il genere femminile, con un rapporto femmine/maschi di 8.5/1 (13). Tuttavia, negli ultimi anni sono riportati sempre più frequentemente casi di ipofisiti auto-immuni in individui di sesso maschile (14). L’associazione tra le adeno-ipofisiti linfocitiche e il genere femminile è particolarmente evidente nel periodo della gravidanza e del puerperio.
L’infundibulo-neuro-ipofisite sembra interessare più frequentemente gli uomini (con un picco di insorgenza intorno ai 50 anni) e i bambini (1,15).
BIBLIOGRAFIA
- Dow A, Russell RV, Bonert V, et al. A protracted and aggressive variant of lymphocytic hypophysitis with mammillary body involvement and cognitive disfunction. Endocrine Pract 2014, 20: 225-9.
- Bianchi A, Mormando M, Doglietto F, et al. Hypothalamitis: a diagnostic and therapeutic challenge. Pituitary 2014, 17: 197-202.
- Fukuoka H. Hypophysitis. Endocrinol Metab Clin N Am 2015, 44: 143–9.
- Gutenberg A, Caturegli P, Metz I, et al. Necrotizing infundibulo-hypophysitis: an entity too rare to be true? Pituitary 2012, 15: 202-8.
- Hunn BH, Martin WG, Simpson S Jr, et al. Idiopathic granulomatous hypophysitis: a systematic review of 82 cases in the literature. Pituitary 2014, 17: 357-65.
- Chung CH, Song MS, Cho HD, et al. A case of idiopathic granulomatous hypophysitis. Korean J Intern Med 2012, 27: 346-9.
- Khare S, Jagtap VS, Budyal SR, et al. Primary (autoimmune) hypophysitis: a single centre experience. Pituitary 2015, 18: 16-22.
- Su SB, Zhang DJ, Yue SY, et al. Primary granulomatous hypophysitis: a case report and literature review. Endocr J 2011, 58: 467-73.
- Caputo C, Bazargan A, McKelvie PA, et al. Hypophysitis due to IgG4-related disease responding to treatment with azathioprine: an alternative to corticosteroid therapy. Pituitary 2014,17: 251-6.
- Kleinschmidt-DeMasters BK, Lopes MB, et al. Update on hypophysitis and TTF-1 expressing sellar region masses. Brain Pathol 2013, 23: 495-514.
- Torino F, Barnabei A, Paragliola RM, et al. Endocrine side-effects of anti-cancer drugs: mAbs and pituitary dysfunction: clinical evidence and pathogenic hypotheses. Eur J Endocrinol 2013, 169: R153-64.
- Buxton N, Robertson I. Lymphocytic and granulocytic hypophysitis: a single centre experience. Br J Neurosurg 2001, 15: 242-5.
- Tsagarakis S, Vassiliadi D, Malagari K, et al. Lymphocytic hypophysitis. Late recurrence following successful transsphenoidal surgery. Endocrine 2004, 25: 85–90.
- Caturegli P, Lupi I, Landek-Salgado M, et al. Pituitary autoimmunity: 30 years later. Autoimmun Rev 2008, 7: 631–7.
- Falorni A, Minarelli V, Bartoloni E, et al. Diagnosis and classification of autoimmune hypophysitis. Autoimmun Rev 2014, 12: 412-6.
Clinica e diagnostica delle ipofisiti
Sabrina Chiloiro, Antonella Giampietro, Laura De Marinis
UOS Patologie Ipotalamo-Ipofisarie, Università Cattolica del Sacro Cuore, Roma
Presentazione clinica
L’ipofisite autoimmune è una patologia insidiosa, spesso misconosciuta o diagnosticata tardivamente a causa della classica insorgenza caratterizzata da sintomi aspecifici (1).
I sintomi dell’ipofisite possono essere riferiti all’effetto massa esercitato dall’infiltrato infiammatorio sull’ipofisi e sulle strutture anatomiche limitrofe. I sintomi più frequenti delle ipofisiti sono la cefalea e i deficit visivi, seguiti da ipopituitarismo, diabete insipido e iperprolattinemia (2).
La cefalea e i deficit visivi sono riferibili all’effetto massa e, in particolare, alla distensione della dura madre e del diaframma sellare. I deficit campimetrici, i deficit dell’acuità visiva e la diplopia sono invece riferibili alla compressione del chiasma ottico o dei rami del III, IV e VI nervi cranici, passanti per il seno cavernoso. Cefalea e disturbi visivi sono riportati con una frequenza compresa tra 40 e 60% (2).
L’ipopituitarismo è considerato come risultato del danno infiammatorio autoimmune sulle cellule ipofisarie acinari ed è descritto con una frequenza compresa tra 44 e 100% dei casi riportati (3,4). I deficit ipofisari più frequentemente riportati nella adeno-ipofisite linfocitica (LAH) sono l’iposurrenalismo, l’ipotiroidismo e l’ipogonadismo secondari [3,4,5]. In termini di timing di perdita di funzionalità ipofisaria, alcuni autori hanno riportato una progressiva compromissione delle cellule acinari ACTH-secernenti, FSH/LH-secernenti e TSH-secernenti (6). Nei casi di infundibulo-neuro-ipofisite linfocitica (LINH), l’adeno-ipofisi non è generalmente compromessa e un eventuale ipopituitarismo è generalmente raro e transitorio (7).
Il diabete insipido è considerato effetto del danno infiammatorio autoimmune sui neuroni ipotalamici secernenti arginina-vasopressina ed è riportato con una frequenza del 20-60% nei pazienti con LINH. Sono stati descritti casi di diabete insipido anche nelle LAH, riferibili alla potenziale estensione del processo infiammatorio dal lobo anteriore dell’ipofisi a quello posteriore e alla compressione del peduncolo ipofisario (8).
L’iperprolattinemia è generalmente di grado moderato e i sintomi ad essa correlati (calo della libido, impotenza, galattorrea e oligo-amenorrea) sono riconducibili alla compressione peduncolare oppure all’inibizione del rilascio della dopamina, secondario al processo infiammatorio (9). La frequenza di iperprolattinemia varia dal 20 al 40% dei casi (4,5).
In rari casi, il sintomo d’esordio dell’ipofisite può essere l’apoplessia ipofisaria (10).
In oltre il 30% dei casi le ipofisiti sono associate ad altre patologie autoimmuni, quali diabete mellito I, tiroidite autoimmune, morbo di Addison, ipoparatiroidismo autoimmune, gastrite atrofica cronica autoimmune, LES, epatite autoimmune, cirrosi biliare primitiva, psoriasi, polimiosite (11,12). In particolare, la coesistenza in un paziente di due o più patologie autoimmuni organo-specifiche e non può suggerire la presenza della sindrome poliendocrina autoimmune (APS). Per questo nei pazienti con ipofisite linfocitica dovrebbe essere eseguito uno screening autoimmunitario con dosaggio degli anticorpi organo-specifici e non organo-specifici (11).
Diagnosi
Ad oggi, il gold-standard diagnostico è rappresentato dall’esame istologico su tessuto bioptico, una procedura invasiva e non esente da complicanze peri- e post-operatorie (1). La grande sfida attuale nella gestione delle ipofisiti è rappresentata dallo stabilire la diagnosi con metodi minimamente invasivi, come l’integrazione di segni e sintomi clinici, test laboratoristici e riscontri neuroradiologici.
La valutazione della capacità secretoria dell’ipofisi anteriore e posteriore è imprescindibile in pazienti con segni e sintomi suggestivi di ipofisite (come astenia, poliuria e polidipsia e oligo-amenorrea o calo della libido e impotenza). I pazienti con ipofisite presentano spesso ipopituitarismo anteriore con iposurrenalismo, ipogonadismo e ipotiroidismo secondario o diabete insipido.
Tra i marcatori immunologici di ipofisite rimane ad oggi controverso il ruolo degli anticorpi contro gli antigeni ipofisari. Recenti studi suggeriscono che ad alto titolo possono essere considerati predittivi di coinvolgimento infiammatorio ipofisario (11). Tuttavia, la loro specificità è scarsa, poiché sono stati ritrovati anche in patologie ipofisarie non autoimmuni, come ad esempio la malattia di Cushing, gli adenomi ipofisari, la sindrome della sella vuota e la sindrome di Sheehan.
Gli anticorpi anti-ipofisi vengono attualmente misurati con metodiche non antigene-specifiche e antigene-specifiche. Le prime comprendono immuno-fluorescenza, immuno-blotting ed ELISA, le seconde comprendono invece dosaggi in vitro basati su auto-antigeni ipofisari specifici e sembrano rappresentare meglio l’orientamento futuro in questo ambito. L’immuno-fluorescenza è una delle metodiche più semplici e più utilizzate. Per esempio, nei casi di diabete insipido centrale idiopatico alcuni autori hanno suggerito l’importanza del dosaggio di anticorpi diretti contro le cellule ipotalamiche secernenti vasopressina, riportando una percentuale di positività anticorpale nel 33% circa dei casi, percentuale che aumenta notevolmente nei casi di diabete insipido insorto prima dei 30 anni e con storia personale di auto-immunità (13). Più recentemente l’attenzione si è spostata sulla ricerca di anticorpi anti-cellule secernenti ormoni ipotalamici e si è osservato che nei pazienti con ipopituitarismo idiopatico può essere utile dosare gli anticorpi anti-cellule secernenti ACTH o CRH per la diagnosi differenziale di un iposurrenalismo secondario o terziario e per caratterizzare meglio la sede ipofisaria o ipotalamica del coinvolgimento autoimmune (14). Pertanto il dosaggio degli anticorpi anti-ipofisi è indicato nei casi di ipopituitarismo idiopatico di ndd (più comunemente deficit di ACTH) e iperprolattinemia, mentre il dosaggio degli anticorpi anti-ipotalamo è indicato soprattutto nei casi di diabete insipido centrale idiopatico o nei casi di ipopituitarismo qualora si sospetti un’origine ipotalamica dello stesso. In realtà questi dosaggi sono disponibili solo presso centri di ricerca e non per la routine.
Imaging
Il ruolo primario dell’imaging, basato sulla RM, consiste nel cercare di effettuare una diagnosi differenziale tra ipofisite e altre patologie ipofisarie che possono mimarla, distinguendola in particolare dal più frequente adenoma ipofisario clinicamente non funzionante, che richiede un trattamento chirurgico, diversamente dall’ipofisite che si giova della terapia farmacologica (15). Sebbene non esistano reperti patognomonici, alcune caratteristiche, soprattutto quando trovate in associazione tra loro, possono essere di aiuto nell’avanzare/sostenere l’ipotesi diagnostica d’ipofisite e, in alcuni casi, anche nel differenziarne le varie forme.
Nella LAH l’ipofisi appare aumentata di volume in maniera simmetrica (con aspetto convesso del suo margine superiore) (fig. 1) e più spesso il segnale è omogeneo sia in condizioni di base (iso-ipointenso in T1, iso-iperintenso in T2), sia dopo somministrazione endovenosa di gadolinio, con enhancement caratteristicamente molto intenso della ghiandola (15); è frequente ma aspecifico il riscontro di una “coda durale” adiacente nelle immagini post-contrastografiche (ispessimento meningeo con enhancement che progressivamente si assottiglia allontanandosi dalla lesione) (16). Il peduncolo ipofisario è tipicamente ispessito e di aspetto tubulare (perdita del fisiologico assottigliamento cranio-caudale) (15-17), ma quasi mai dislocato lateralmente. In alcuni casi è stata descritta estensione sovrasellare-diencefalica (fig. 2). Il cavo sellare è generalmente normale, con pareti non assottigliate né, soprattutto, erose (17).

Ipofisite linfocitaria in giovane donna alcune settimane dopo il parto. Immagini RM coronali T1-pesata (a) e T2-pesata (b) e sagittale T1-pesata con mdc (c). L’ipofisi e l’infundibolo appaiono ingranditi, con iperintensità di segnale triangolare centrale in T2 (b) ed enhancement omogeneo e intenso dopo mdc (c).

Ipofisite granulomatosa. Giovane donna medio-orientale con TBC polmonare e cerebrale. Immagini RM T1-pesate con mdc nei piani coronale (a) e sagittale (b). Il cavo sellare è ai limiti superiori della norma, occupato da una ghiandola ipofisaria di dimensioni aumentate. L'impregnazione contrastografica è vivace e omogenea e si estende al peduncolo ipofisario, anch’esso di spessore aumentato, nonchè al diencefalo. Si associano segni di meningite fronto-basale, con impregnazione contrastografica leptomeningea lineare, e segni di osteite del clivus.
Nella LINH si rileva, oltre all’ispessimento del peduncolo, l’assenza della normale iperintensità posteriore della ghiandola in T1, espressione della fisiologica elevata concentrazione di vasopressina (15).
L’evoluzione della patologia è verso la regressione dell’aumento sia volumetrico, sia contrastografico della ghiandola dopo instaurazione della terapia, con frequente progressione verso un quadro atrofico, con erniazione intra-sellare della cisterna subaracnoidea ottico-chiasmatica e aspetto di “sella vuota” (15), che potrebbe indicare una fase tardiva della malattia. In ogni caso, per una corretta interpretazione dei reperti RM è necessaria un’attenta correlazione con i dati clinico-laboratoristici ed è opportuna una rivalutazione a distanza.
Ringraziamenti
Gli autori ringraziano il collega dott. Tommaso Tartaglione, specialista in Radiodiagnostica e Neuroradiologia, per l’assistenza fornita nella preparazione del manoscritto nonché per la fruttuosa discussione
Bibliografia
- Caturegli P, Iwama S. From Japan with love: another tessera in the hypophysitis mosaic. J Clin Endocrinol Metab 2013, 98: 1865–8.
- Tang F, Liu H, Zhou S. MRI manifestation of xanthomatous hypophysitis: a case report and review of the literature. Zhong Nan Da Xue Xue Bao Yi Xue Ban 2015, 40: 228-32.
- Caturegli P, Lupi I, Landek-Salgado M, et al. Pituitary autoimmunity: 30 years later. Autoimmun Rev 2008, 7: 631–7.
- Khare S, Jagtap VS, Budyal SR, et al. Primary (autoimmune) hypophysitis: a single centre experience. Pituitary 2015, 18: 16-22.
- Caturegli P. Editorial: Autoimmune hypophysitis: an underestimated disease in search of its autoantigen(s). J Clin Endocrinol Metab 2007, 92: 2038–40.
- Gutenberg A, Hans V, Puchner MJ, et al. Primary hypophysitis: clinical-pathological correlations. Eur J Endocrinol 2006, 155: 101-7.
- Abe T. Lymphocytic infundibulo-neurohypophysitis and infundibulo-panhypophysitis regarded as lymphocytic hypophysitis variant. Brain Tumor Pathol 2008, 25: 59-66.
- De Bellis A, Sinisi A, E. Pane E, et al. Involvement of hypothalamus autoimmunity in patients with autoimmune hypopituitarism: role of antibodies to hypothalamic cells. J Clin Endocrinol Metab 2012, 97: 3684–90.
- Su SB, Zhang DJ, Yue SY, et al. Primary granulomatous hypophysitis: a case report and literature review. Endocr J 2011, 58: 467-73.
- Husain Q, Zouzias A, Kanumuri VV, et al. Idiopathic granulomatous hypophysitis presenting as pituitary apoplexy. J Clin Neurosci 2014, 21: 510-2.
- De Bellis A, Bizzarro A, Bellastella A. Pituitary antibodies and lymphocytic hypophysitis. Best Pract Res Clin Endocrinol Metab 2005, 19: 67-84.
- Akahori H, Sugimoto T. Lymphocytic hypophysitis with a long latent period from onset of central diabetes insipidus to development of pituitary enlargement. Intern Med 2010, 49: 1565-71.
- Pivonello R, De Bellis A, Faggiano AG, et al. Central diabetes insipidus and autoimmunity: relationship between the occurrence of antibodies to arginine vasopressin-secreting cells and clinical, immunological and radiological features in a large cohort of patients with central diabetes insipidus of known and unknown etiology. J Clin Endocrinol Metab 2003, 88: 1629-36.
- De Bellis A, Pane E, Bellastella, et al. Detection of antipituitary and antihypothalamus antibodies to investigate the role of pituitary or hypothalamic autoimmunity in patients with selective idiopathic hypopituitarism. Clin Endocrinol 2011, 75: 361-6.
- Bonneville JF. MRI of hypophysitis. Ann Endocrinol (Paris) 2012, 73: 76-7.
- Chodakiewitz Y, Brown S, Boxerman JL, et al. Ipilimumab treatment associated pituitary hypophysitis: clinical presentation and imaging diagnosis. Clin Neurol Neurosurg 2014, 125: 125-30.
- Gutenberg A, Larsen J, Lupi I, et al. A radiologic score to distinguish autoimmune hypophysitis from nonsecreting pituitary adenoma preoperatively. AJNR Am J Neuroradiol 2009, 30: 1766-72.
Ipofisite da inibitori dei check-point immunitari
Vincenzo Di Donna & Salvatore Maria Corsello
UO Endocrinologia, Università Cattolica del Sacro Cuore, Fondazione Policlinico Universitario “A. Gemelli” IRCCS, Roma
(aggiornato al 16 gennaio 2020)
Introduzione
Negli ultimi anni si è affermata nella pratica clinica l’immuno-terapia oncologica con farmaci inibitori dei checkpoint immunitari (ICI). Questi promuovono la risposta delle cellule T verso i tumori, attraverso l’inibizione di vie metaboliche che bloccano l’azione dell’immunità cellulo-mediata. Tra le principali vi sono le vie CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4) e PD-1/PD-1 ligando (programmed cell death protein-1). Sono oggi disponibili anticorpi monoclonali impiegati per la terapia dei pazienti affetti dalla maggior parte dei tumori solidi:
- anti-CTLA-4: ipilimumab e tremelimumab;
- anti-PD-1: nivolumab e pembrolizumab;
- anti-PD-1 ligando: atezolizumab, durvalumab e avelumab.
L’azione di questi farmaci può favorire l’insorgenza di patologie auto-immuni e un evento avverso comune è l’ipofisite, condizione altrimenti rara nella popolazione generale (1).
Epidemiologia
In letteratura l’ipofisite da ICI è riportata nello 0.5-22% dei casi. È possibile che la frequenza di eventi avversi endocrini in generale, e di ipofisite in particolare, fosse sotto-stimata nei primi studi pubblicati, in considerazione del quadro clinico aspecifico e della mancanza di sistematiche valutazioni ormonali di laboratorio. L’ipofisite è più frequente:
- nei pazienti in terapia con ipilimumab (3.4%) rispetto a quelli in terapia con anticorpi anti-PD-1 (0.4%) e anti-PD-1 ligando (0.1%);
- per dosi maggiori di ipilimumab (frequenza almeno doppia per dosi di 10 mg/kg vs 3 mg/kg);
- in caso di terapia di combinazione (6.4%);
- nei maschi > 60 anni, contrariamente alla forma “classica” di ipofisite linfocitaria più frequente nelle donne; questo dato è tuttavia variabile in base al tipo di cancro considerato.
Tempo di insorgenza:
- ipilimumab: mediana 2-4 mesi (range 4 settimane-19 mesi);
- anticorpi anti-PD-1 o PD-1 ligando: mediana 3-6 mesi;
- terapia di combinazione: media 30 giorni.
Patogenesi
Il meccanismo patogenetico rimane poco chiaro. Sono state suggerite diverse ipotesi:
- attivazione immunologica specifica a livello ipofisario, con infiltrazione di linfociti e macrofagi e attivazione del complemento (reazione di ipersensibilità di tipo II);
- espressione di CTLA-4 in cellule ipofisarie normali (soprattutto lattotrope e tireotrope in modelli murini) e adenomatose, con legame diretto degli anticorpi anti-CTLA-4 e attivazione di una cito-tossicità cellulo-mediata anticorpo-dipendente;
- sviluppo di anticorpi anti-ipofisi diretti principalmente contro le cellule lattotrope e corticotrope.
Clinica e diagnosi
La sintomatologia può essere legata all’aumento volumetrico dell’ipofisi o all’ipopituitarismo anteriore. Il diabete insipido è raro e può essere sia transitorio che permanente; è stato riportato anche nei pazienti in terapia con anticorpi-anti-PD-1 e PD-1 ligando.
La diagnosi può essere inizialmente difficile perché i sintomi sono aspecifici (cefalea, astenia, nausea, vertigini); i disturbi legati all’effetto massa sono moderati e i disturbi visivi sono eccezionali.
Per tale motivo, è utile eseguire dosaggi ormonali seriati per monitorare questi pazienti, specialmente nelle prime 12 settimane di trattamento.
Nei principali studi di coorte longitudinali sono riportate queste percentuali di interessamento dei vari assi:
- ipotiroidismo secondario: 84%;
- iposurrenalismo secondario: 80%;
- ipogonadismo ipogonadotropo: 76%;
- deficit di GH: 29%;
- ipo e iperprolattinemia: 61% e 6%.
L’ipotiroidismo centrale può essere il primo segno biochimico e precedere l’ipofisite di qualche settimana; anche l’iponatremia è comune alla diagnosi, potendo essere legata sia all’ipocortisolismo che all’ipotiroidismo.
Alcuni autori hanno descritto un progressivo ingrandimento dell’ipofisi alla RM come primo segno dell’ipofisite, prima dello sviluppo dei sintomi e delle alterazioni ormonali. I reperti neuroradiologici di più comune riscontro comprendono:
- modesto ingrandimento dell’ipofisi;
- diffusa presa di contrasto con aspetto convesso del margine ipofisario superiore;
- ingrandimento dell’infundibolo (infrequente).
La RM è importante per confermare la diagnosi e nella diagnosi differenziale con ascesso, apoplessia ipofisaria, patologie infiltrative e – soprattutto – metastasi ipofisarie, non rare dato lo specifico contesto clinico.
Essendo l’infiammazione ghiandolare rapidamente reversibile, un aspetto normale alla RM non esclude di principio la diagnosi, che deve basarsi sulla valutazione clinica e biochimica.
Non è richiesta la conferma istologica per la diagnosi.
Terapia
Nel sospetto di ipofisite e iposurrenalismo centrale, va iniziata immediatamente la terapia con idrocortisone, possibilmente dopo aver eseguito un prelievo ematico per il dosaggio di ACTH e cortisolo, indipendentemente dall’ora del giorno e senza aspettare il risultato. Può essere usata la via orale o parenterale, in base alla gravità del quadro clinico e allo specifico contesto clinico.
Non c’è indicazione all’uso sistematico di alte dosi di glucocorticoidi (prednisolone 1 mg/kg/die o dosi equivalenti di altri steroidi), contrariamente a quanto veniva raccomandato in passato. Infatti, le alte dosi di glucocorticoidi non hanno mostrato vantaggi in termini di frequenza e tempo di risoluzione delle anomalie morfologiche e biochimiche dell’ipofisite; al contrario, è possibile un aumento del rischio di intolleranza glucidica e iposurrenalismo acuto dopo diminuzione della dose o sospensione della terapia. Tuttavia, la terapia con glucocorticoidi ad alte dosi trova indicazione in caso di:
- sintomi severi legati all’effetto massa (cefalea refrattaria e disturbi del campo visivo);
- concomitanti eventi avversi immuno-mediati legati alla terapia con ICI per cui sia già indicato un trattamento con steroidi ad alte dosi.
È fondamentale educare il paziente a essere il più possibile autonomo nella gestione della terapia steroidea, soprattutto in condizioni di aumentato stress.
Contrariamente a quanto riportato in passato, non è necessaria la sospensione permanente dell’immuno-terapia, perché i benefici in termini di sopravvivenza superano nettamente i rischi dell’ipofisite trattata con adeguata terapia ormonale sostituiva. Tuttavia, nella fase acuta dell’ipofisite può essere indicata una sospensione transitoria di pochi giorni. L’immuno-terapia può essere ripresa quando il paziente è stabile o in miglioramento e in terapia ormonale sostitutiva.
Prognosi e follow-up
Generalmente, l’ipotiroidismo e l’ipogonadismo secondari migliorano o regrediscono, in circa la metà dei casi entro 2-3 mesi, mentre l’iposurrenalismo è quasi sempre prolungato o permanente. Inoltre, negli stadi più avanzati di malattia possono essere presenti quadri di euthyroid sick syndrome o di ipogonadismo transitorio, legati proprio alla compromissione delle condizioni generali, indistinguibili pertanto da un ipopituitarismo su base organica. Ne deriva che l’inizio della terapia dell’ipotiroidismo e dell’ipogonadismo non è urgente e può essere anche dilazionato dopo uno stretto follow-up clinico e biochimico che consenta di chiarire meglio la diagnosi.
Una consensus ha proposto il monitoraggio clinico, biochimico e morfologico ad ogni infusione di ICI per 6 mesi, poi ogni 3 mesi per 6 mesi e successivamente ogni 6 mesi. Non è necessario monitorare l'asse somatotropo, dal momento che la terapia con GH è contro-indicata in questi pazienti.
L’ipoprolattinemia alla diagnosi può predire la mancanza di recupero della funzione ipofisaria.
Il follow-up morfologico con RM è indicato nei primi tre mesi per documentare la risoluzione dell’ingrandimento ipofisario ed escludere definitivamente la possibilità di metastasi ipofisarie. L’evoluzione tipica del quadro neuroradiologico prevede un’iniziale riduzione volumetrica della ghiandola, il cui margine superiore assume un aspetto concavo, con possibile comparsa di sella vuota.
È stata segnalata migliore risposta oncologica a ipilimumab in caso di sviluppo di eventi avversi auto-immuni, soprattutto in caso di loro maggiore gravità, probabilmente perché una risposta immunitaria più marcata contro il self è efficace anche contro il tessuto neoplastico.
Conclusioni
L’ipofisite è un evento avverso da tenere sempre in considerazione in presenza di contesto clinico adeguato nei pazienti trattati con ICI, soprattutto anticorpi anti-CTLA-4 e terapia di combinazione, ed è dose-dipendente.
È indicata una valutazione clinica e ormonale prima e durante l’immuno-terapia, specialmente nel primo mese di trattamento, allo scopo di eseguire una diagnosi precoce ed evitare il rischio di crisi surrenalica potenzialmente fatale. La riduzione del TSH può precedere l’ipofisite.
La RM deve essere eseguita per confermare la diagnosi ed escludere la presenza di metastasi cerebrali.
Anche solo nel sospetto di ipofisite, è prioritaria la terapia dell’iposurrenalismo. Non sono indicate alte dosi di glucocorticoidi, salvo i casi di cefalea refrattaria e disturbi visivi. Non è necessaria la sospensione dell’immuno-terapia, che può essere tuttavia opportuno ritardare nella fase acuta dell’ipofisite.
L’ipogonadismo e l’ipotiroidismo secondari sono generalmente reversibili, al contrario dell’iposurrenalismo, che è permanente nella maggior parte dei casi.
Sono fondamentali l’educazione del paziente, mirata alla diagnosi precoce e alla gestione dell’iposurrenalismo acuto, e un follow-up multi-disciplinare con oncologo ed endocrinologo. In particolare, la figura dell’endocrinologo è fondamentale per la personalizzazione della gestione diagnostica e terapeutica di questa condizione, che non può essere trattata secondo gli algoritmi comunemente usati in oncologia per classificare gli eventi avversi da chemioterapia anti-neoplastica promossi dal National Cancer Institute. Tali classificazioni, infatti, non sono specifiche per le singole condizioni e, ad esempio, può essere difficile distinguere tra una ipofisite di grado 2 (moderato) e 3 (severo); allo stesso modo la sospensione dell’immuno-terapia per una ipofisite “moderata” e la terapia sistematica con steroidi ad alte dosi nelle forme “severe” sarebbero inappropriate nella maggior parte dei casi.
Bibliografia
- Di Donna V, Corsello SM. Le disfunzioni endocrine da farmaci inibitori dei checkpoint immunitari. AME Flash 1/2017.
- Albarel F, Castinetti F, Brue T. Management of endocrine disease: immune check point inhibitors-induced hypophysitis. Eur J Endocrinol 2019, 181: R107-18.
- Barroso-Sousa R, Ott PA, Hodi FS, et al. Endocrine dysfunction induced by immune checkpoint inhibitors: practical recommendations for diagnosis and clinical management. Cancer 2018, 124: 1111-21.
Terapia delle ipofisiti
Sabrina Chiloiro, Antonella Giampietro, Laura De Marinis
UOS Patologie Ipotalamo-Ipofisarie, Università Cattolica del Sacro Cuore, Roma
Gli obiettivi terapeutici nei pazienti affetti da ipofisite sono rappresentati dalla riduzione/risoluzione dell’effetto massa e della fibrosi secondari al processo infiammatorio e dalla sostituzione con adeguata terapia ormonale dei deficit secretori eventualmente già instaurati al momento della diagnosi.
La prognosi delle ipofisiti è ad oggi non chiara: la maggior parte dei pazienti risponde efficacemente alla terapia immuno-soppressiva con risoluzione/riduzione della massa infiammatoria ipofisaria e miglioramento della capacità secretoria adeno-ipofisaria e neuro-ipofisaria (1). Solo in una piccola percentuale di casi, circa il 4%, è riportata una risoluzione spontanea del processo infiammatorio (2).
I farmaci anti-infiammatori più comunemente utilizzati per il trattamento delle ipofisiti sono costituiti dagli steroidi ad alte dosi: metilprednisolone e desametasone nella maggior parte dei casi, per i quali sono stati proposti schemi in formulazione orale o endovenosa con progressiva riduzione posologica. Si può cominciare con una dose d’attacco di 125 mg/die di metilprednisolone ev per 7-10 giorni, successivamente continuare con prednisone po al dosaggio di 75 mg/die, scalando progressivamente fino ad arrivare ad una dose di mantenimento di 25 mg/die. Diversi report hanno documentato miglioramento della capacità secretoria ipofisaria e del reperto morfologico neuroradiologico. Tuttavia, la risposta alla terapia farmacologica sembra positivamente influenzata dalla minore durata della malattia, ossia dalla tempestività diagnostica e terapeutica (3). L’azatioprina è considerato il farmaco di seconda scelta nel trattamento terapeutico delle ipofisiti, per il cui utilizzo è raccomandato uno stretto monitoraggio della cellularità plasmatica periferica e della funzionalità epatica, per il rischio di pancitopenia ed epatotossicità. Inoltre, in casi isolati è stato descritto il successo di rituximab, methotrexate e ciclosporina (3).
Il debulking neurochirurgico dell’ipofisite è indicato in casi limitati, quali decompressione delle strutture nervose (chiasma ottico e nervi cranici passanti nei seni cavernosi), segni e sintomi di ipertensione endocranica o segni di progressione di malattia nonostante la terapia farmacologica immuno-soppressiva (4). Pertanto, obiettivo dell’approccio neurochirurgico nel paziente con ipofisite è quello di rimuovere il tessuto patologico-infiammatorio, migliorare i sintomi compressivi, preservando la funzionalità secretoria ipofisaria.
Fino ad oggi la radioterapia stereotassica è stata descritta in due casi. Tuttavia, dovrebbe essere limitata a casi selezionati con gravi sintomi compressivi non responsivi o non candidati alla terapia farmacologica con glucocorticoidi e/o immuno-soppressori o all’approccio neurochirurgico (3).
L’ipopituitarismo nei pazienti con ipofisite può essere transitorio o permanente e riconducibile alla compressione sulle cellule ipofisarie dell’infiltrato infiammatorio, all’edema o alla progressiva fibrosi ghiandolare. Diversi studi hanno ad oggi dimostrato che i deficit funzionali più frequenti sono l’iposurrenalismo, l’ipogonadismo e l’ipotiroidismo secondari anche associati al diabete insipido. Pertanto, i pazienti con ipofisite devono essere valutati periodicamente in termini di funzionalità ipofisaria, per sopperire ai deficit secretivi dell’ipofisi anteriore e posteriore con un’adeguata terapia ormonale sostitutiva, e in termini morfologici con studio RM mirato per valutare l’estensione del processo infiammatorio e la risposta terapeutica.
Poiché ad oggi la storia naturale e la prognosi dell’ipofisite non sono note, è consigliabile in questi pazienti un adeguato follow-up clinico, ormonale e morfologico.
Bibliografia
- Kleinschmidt-DeMasters BK, Lopes MB, et al. Update on hypophysitis and TTF-1 expressing sellar region masses. Brain Pathol 2013, 23: 495-514.
- Caturegli P, Lupi I, Landek-Salgado M, et al. Pituitary autoimmunity: 30 years later. Autoimmun Rev 2008, 7: 631–7.
- Abe T. Lymphocytic infundibulo-neurohypophysitis and infundibulo-panhypophysitis regarded as lymphocytic hypophysitis variant. Brain Tumor Pathol 2008, 25: 59-66.
- Husain Q, Zouzias A, Kanumuri VV, et al. Idiopathic granulomatous hypophysitis presenting as pituitary apoplexy. J Clin Neurosci 2014, 21: 510-2.
Empty sella
Laura De Marinis
Endocrinologia, Università Cattolica, Roma
Definizione
Il termine sella vuota, usato per la prima volta da Bush nel 1951 [1], indica una particolare condizione anatomica nella quale la sella turcica risulta aumentata di volume e parzialmente riempita da liquido cerebrospinale, a causa di un’erniazione dello spazio subaracnoideo all’interno della stessa. A tale evento consegue un grado variabile di appiattimento e di compressione dell’ipofisi, tale da far apparire la sella “vuota” alle indagini di imaging.
Classificazione
Ci sono due tipi di sella vuota:
- Primaria, conseguente ad una congenita e incompleta formazione del diaframma sellare e/o a difetti anatomici soprasellari che comportano un aumento della pressione intracranica tale da causare l’erniazione dello spazio subaracnoideo nella sella turcica;
- Secondaria, che può essere causata da: precedente terapia farmacologica, chirurgica o radioterapica della regione sellare; processi infettivi, autoimmuni o traumatici a carico dell’ipofisi; adenomi ipofisari che vanno incontro a infarti ischemici o emorragici subclinici, inducenti un affondamento dello spazio subaracnoideo nella sella turcica.
Epidemiologia e fattori di rischio
È un riscontro abbastanza frequente, con una prevalenza dell’8-35% nella popolazione generale e una prevalenza in casistiche autoptiche che varia dal 5 al 23%.
I pazienti affetti da sindrome della sella vuota primaria sono per la maggior parte donne, di mezza età, obese, ipertese e con storia di gravidanze multiple [2-3]. Sono stati proposti altri fattori di rischio tra cui l’uso di alcuni farmaci, il diabete di tipo II, una storia di pseudotumor cerebri. Sono presenti dati discordanti in letteratura per quanto riguarda l’associazione con alcune malattie endocrine autoimmuni, ed in particolare la sindrome della sella vuota primaria è stata proposta da alcuni come conseguenza dell’ipofisite linfocitaria [4].
Clinica
La presentazione clinica della sella vuota può andare dalla scoperta occasionale fino a manifestazioni piuttosto severe [5]. Quando presenti, i disturbi sono di tipo:
- Neurologico: vanno dalla cefalea che, sebbene spesso presente, può essere solo casuale (essa è principalmente la causa dello studio del soggetto), fino a quadri molto più gravi e più rari come l’ipertensione endocranica e la rinorrea spontanea di liquido cerebrospinale; saltuariamente sono stati descritti anche altri sintomi neurologici.
- Oftalmologico: difetti dell’acuità visiva e disturbi del campo visivo o altre anomalie legate alla dislocazione del nervo ottico o del chiasma ottico.
- Endocrinologico: il disturbo più descritto è l’iperprolattinemia, probabilmente dovuta alla compressione del peduncolo ipofisario; ad esso seguono meno frequentemente l’ipopituitarismo anteriore o il deficit isolato di ormoni ipofisari, soprattutto di GH o di FSH e LH, entrambi legati alla compressione dell’ipofisi; sono stati descritti singoli casi di diabete insipido [3-5]
Pertanto, i pazienti con sella vuota dovrebbero sempre eseguire alla diagnosi una valutazione neurologica, oftalmologica ed endocrinologica. In particolare, si sottolinea l’importanza di quest’ultima non solo per escludere un’insufficienza ormonale ipofisaria, ma anche per la possibilità di una concomitante patologia ipofisaria ipersecernente.
Diagnosi
La RMN cerebrale permette di fare diagnosi di sella vuota e anche di identificarne il grado. Si distinguono infatti una sella vuota:
- Parziale, in cui meno del 50% della sella turcica è occupata da liquido cerebrospinale e l’ipofisi ha dimensioni maggiori di 3 mm;
- Totale, in cui più del 50% della sella turcica è occupata da liquido cerebrospinale e l’ipofisi è minore di 2 mm.
In ogni caso, il grado di sella vuota non sembra essere correlato con la severità e/o la natura del quadro clinico [6].

Empty sella. La RM in T1 con mdc dimostra che lo spazio liquorale protrude inferiormente attraverso il diaframma sellare, comprimendo il parenchima ipofisario e allargando la sella senza dare erosione del pavimento. Il peduncolo è sottile, ben visibile in posizione mediana.
Terapia
Non tutti i pazienti richiedono un trattamento, ma comunque tutti i soggetti affetti sono candidati ad un follow-up clinico e radiologico almeno ogni 2-3 anni (se ci sono indicazioni specifiche anche prima), nonostante il rischio di sviluppare sintomi in pazienti senza anormalità all’esordio sia molto basso.
Quando necessario, il trattamento è sintomatico e di supporto e può essere:
- Medico: l’iperprolattinemia, quando determina disordini mestruali (alterazioni mestruali, ipogonadismo) è trattata con successo con i dopamino-agonisti mentre i deficit endocrini sono trattati con la corrispondente terapia sostitutiva; anche l’ipertensione endocranica di grado medio si giova del trattamento farmacologico (acetazolamide 250-500 mg/die);
- Chirurgico: generalmente sono pazienti con segni e sintomi piuttosto severi di ipertensione endocranica resistente alla terapia medica e/o pazienti con rinorrea; in questi casi è consigliato lo shunt ventricolo-peritoneale.
Bibliografia
- Bush W. Die morphologie der sella turcica und itse beziehungen zue hypophyse. Virchows Arch Path Anat Physiol 1951, 320: 437-58.
- Jordan RM, Kendall JW, Kerber CW. The primary empty sella syndrome: analysis of the clinical characteristic, radiographic features, pituitary function and cerebral fluid adeno-hypophysial concentrations. Am J Med 1977, 62: 569-80.
- Bianconcini G, Bragagni G, Bianconcini M. Primary empty sella syndrome. Observation on 71 cases. Rec Prog Med 1999, 90: 73-80.
- Lupi I, Manetti L, Raffaelli V, et al. Pituitary autoimmunity is associated with hypopituitarism in patients with primary empty sella. J Endocrinol Invest 2011, 34: 240-4.
- De Marinis L, Bonadonna S, Bianchi A, et al. Primary empty sella. J Clin Endocrinol Metab 2005, 90: 5471-7.
- Gallardo E, Schachter D, Caceres E, et al. The empty sella: results of treatment in 76 successive cases and high frequency of endocrine and neurological disturbances. Clin Endocrinol 1992, 37: 529-33.
Altre malattie della regione e diagnosi differenziale
Lesioni granulomatose e infiammatorie
Lesioni malformative
Lesioni neoplastiche
Overview su clinica e diagnosi differenziale
Lesioni malformative ipotalamo-ipofisarie
Roberto Attanasio1, Renato Cozzi2, Giovanni Lasio3 & Regina Barbò4
1Endocrinologia, Istituto Galeazzi, Milano
2Endocrinologia, Ospedale Niguarda, Milano
3Neurochirurgia, Istituto Humanitas, Milano
4Neuroradiologia, Gavazzeni-Humanitas, Bergamo
con aggiornamento novembre 2022 a cura di Alessandro Bozzao, Serena Palizzi, Valentina Frezza, Sara De Giorgi
Sapienza Università di Roma, Facoltà di Medicina e Psicologia, Dipartimento NESMOS (Neuroscienze, Salute Mentale, Organi di Senso)
UOC Neuroradiologia, AO "Sant'Andrea", Roma
CISTI DELLA TASCA DI RATHKE
Si tratta di cisti non neoplastiche che nascono lungo il dotto cranio-faringeo da residui di epitelio squamoso, quando c’è un’obliterazione incompleta della tasca embrionaria centrale che separa l’adeno-ipofisi dalla pars intermedia (1).
Sono composte da un singolo strato di cellule epiteliali cuboidi o colonnari, con componenti intra-cistiche mucoidi, cellulari o sierose (2).
Sono spesso di riscontro incidentale e in una casistica autoptica sono state rilevate nel 22% dei campioni esaminati. Il picco di età alla diagnosi è 40-50 anni, con rapporto M/F = 2 (3).
Possono rimanere piccole e intra-sellari, tra i lobi anteriore e posteriore dell’ipofisi o anteriori al peduncolo, ma nel 60% dei casi hanno estensione sovra-sellare, mentre le forme esclusivamente sovra-sellari sono rare (3-5). In rari casi possono associarsi ad adenomi. Le dimensioni variano da pochi millimetri a oltre 4 cm.
In una minoranza di casi (il 5–9% di tutti i campioni chirurgici, 6, 7), possono diventare sintomatiche (i sintomi sono simili a quelli dell’adenoma), per la lenta crescita dovuta a squilibrio fra formazione e riassorbimento del contenuto cistico o più raramente a infezione o sanguinamento (2, 4, 7, 8). Più di rado possono presentarsi con meningite asettica, ascesso, ipofisite linfocitaria o emorragia intra-cistica e apoplessia (7). Nei bambini possono provocare ritardo di sviluppo somatico o puberale (9).
Allla TC la cisti di Rathke appare come una lesione omogenea ipodensa, isodensa o sfumatamente iperdensa. Nel 10-15% dei casi può essere iso-ipodensa, e può contenere piccole calcificazioni curvilinee nella parete. Tendenzialmente non presenta potenziamenti post-contrastografici, ad eccezione della parete, che talvolta può potenziare. In RM la cisti di Rathke appare come una lesione cistica omogenea e ben delimitata, ovoide o sferica, a localizzazione centrale, con occasionale potenziamento della parete dopo mdc. L'intensità del segnale non varia mai dopo mdc, ma il segnale basale pre-mdc è molto variabile e dipende dal contenuto della cisti, che varia da sieroso a mucinoso (l'alto contenuto proteico si riflette in un segnale iperintenso in T1 e ipointenso in T2):
- una cisti contenente liquido trasparente appare iso-ipointensa in T1 e iperintensa in T2 (fig 18), mentre una cisti contenente materiale mucoide appare iperintensa in T1 e isointensa in T2;
- una cisti contenente sangue presenta segnale iperintenso sia in T1 che in T2 (fig 19).
L’ipofisi normale può essere dislocata in ogni direzione (anche su tutta la periferia della cisti, se questa nasce all’interno della ghiandola). Con il Gd in alcuni casi si può vedere una sottile rima periferica (7); la rima di mdc può anche riferirsi a tessuto ipofisario normale. Talvolta può essere difficile la differenziazione radiologica da un’emorragia acuta.
Nei casi sintomatici si va all’intervento TNS. Una diagnosi pre-operatoria corretta è importante per la pianificazione chirurgica, perché, al contrario degli interventi per altri tipi di lesione, ci si può limitare al drenaggio della cisti con o senza resezione delle pareti (3, 5).
La regressione post-operatoria dei deficit endocrini è rara (4).

Cisti della tasca di Rathke.
In alto la RM (T1 con mdc sagittale in a e coronale in b, T2 in c) dimostra una cisti intra e sovra-sellare, ben delimitata, polilobata, isointensa al liquor, che non prende il mdc e comprime l’ipofisi normale e il chiasma.
In basso RM sagittale T1 senza (a) e con (b) mdc, coronale T1 senza (c) e con (d) mdc, coronale T2 (e). Anche in questo caso si evidenzia una lesione a contorni netti, che non prende il mdc, che si interpone fra la neuroipofisi posteriormente (freccia rossa) e l'adenoipofisi (freccia gialla) dislocata anteriormente

EPIDERMOIDI E DERMOIDI
Sono tumori benigni (grado I WHO) che rappresentano < 2% di tutti i tumori intracranici.
Clinicamente si presentano con effetto massa locale, ma sono più frequenti sintomi irritativi (3).
Gli epidermoidi si trovano comunemente a livello dell'angolo ponto-cerebellare; la seconda localizzazione più comune è la regione para-sellare. Si presentano solitamente nella 4°-5° decade, quando l’accumulo intra-cistico di materiale porta all’effetto massa sulle strutture adiacenti (16, 17). Una presentazione atipica può simulare l’apoplessia. Il contenuto cistico può essere caustico per i tessuti circostanti, portando a ipofisite, meningite o deficit neurologici (9). Alla RM le cisti epidermoidi appaiono isointense/sfumatamente iperintense nelle sequenze T1- e T2-pesate e non mostrano potenziamento dopo mezzo di contrasto (a differenza dei macro-adenomi).

Epidermoide. RM con sezioni T1 (coronali senza (a) e con mdc (c), sagittale con mdc (d)) e T2 (b). Presenza di lesione espansiva extra-assiale con epicentro in corrispondenza delle cisterne sovrasellari e invasione solo parziale del cavo sellare. Nella sua porzione intrasellare la lesione comprime e disloca anteriormente l'ipofisi. Per le caratteristiche di segnale (prevalente ipointensità in T1, disomogenea iperintensità in T2) e l’impregnazione contrastografica periferica irregolare e modesta, la lesione evoca la presenza di craniofaringioma o epidermoide. Questa ultima diagnosi è stata confermata all'intervento e dall'istologia.
I dermoidi sono meno comuni delle cisti epidermoidi e si presentano più precocemente, tra i 20 e i 30 anni soprattutto nei maschi, solitamente sulla linea mediana, a livello della fossa cranica posteriore o nella cisterna para-sellare. (16,17). La rottura, con disseminazione del contenuto nello spazio subaracnoideo, può portare a meningite asettica recidivante (18). Appaiono come lesioni eterogenee ben delimitate, senza presa di contrasto, ipodense alla TAC (occasionalmente iperdense a causa della presenza di micro-emorragie), brillanti in T1 (per il contenuto di grasso) e con aspetto variabile nelle sequenze T2-pesate, in assenza di potenziamento post-contrastografico (2,3,18-20). Il trattamento di scelta è l’asportazione, che non sempre può essere radicale per le aderenze con delicate strutture vascolari e nervose.

Lipoma. RM in T1 sagittale. In corrispondenza del tuber cinereum è presente una lesione rotondeggiante a contorni definiti, francamente iperintensa nell'immagine basale (sin) e ipointensa nell'immagine con soppressione del grasso (a destra), in rapporto a circoscritto lipoma/dermoide della linea mediana. Sella, ipofisi e peduncolo appaiono normali (grazie a Paola Doneda).
AMARTOMI IPOTALAMICI
Sono malformazioni congenite di origine neuronale, caratterizzate da foci disorganizzati di sostanza grigia, che si sviluppano soprattutto vicino al tuber cinereumo ai corpi mamillari e possono crescere lentamente nel tempo (2, 20).
Colpiscono soprattutto i bambini. Per le piccole dimensioni (solitamente < 1-2 cm) raramente danno effetto-massa, ma si presentano con epilessia parziale e ritardo mentale, con anomalie dell’eloquio e del comportamento (21). L’epilessia raramente può presentarsi come riso spamodico (epilessia gelastica) (22). Altra possibile presentazione è la pubertà precoce isosessuale, soprattutto quando l’amartoma coinvolge il III ventricolo (23), per secrezione anomala di LHRH da parte della lesione o stimolazione aberrante dei neuroni LHRH-secernenti (24). Gli amartomi possono essere anche asintomatici.
Alla RM, è caratteristica una lesione tondeggiante peduncolata, che nasce tra il peduncolo ipofisario e i corpi mamillari, non prende il contrasto e si vede meglio nelle sezioni coronali e sagittali. È isointensa in T1 e iso o lievemente ipointensa in T2 o FLAIR (2, 18, 20).
Di solito non c’è indicazione chirurgica, ma solo al controllo dei sintomi (epilessia o pubertà precoce).

Amartomi. RM sagittale in T1. Si evidenzia massa ben delimitata, nodulare (freccia), che non assume contrasto, isointensa alla sostanza grigia, vicino al peduncolo (a e b) e in un altro paziente al tuber cinereum (c). L’ipofisi è di aspetto normale, con presenza del”bright spot” nell’ipofisi posteriore (grazie a Paola Doneda).
DIVERTICOLI ARACNOIDEI
Nascono dall’erniazione di un diverticolo aracnoideo attraverso una soluzione di continuo del diaframma sellare e possono essere sovra-sellari (danno solitamente effetto massa locale nei bambini) o intra-sellari (acquisite, possono diventare sintomatiche in età più adulta), dando luogo al reperto neuroradiologico di sella vuota (20).
I sintomi possono comprendere l’aumento di pressione intra-cranica fino all’idrocefalo, deficit ormonali, atassia e disturbi visivi.
Alla RM appaiono come lesioni lisce, ben delimitate, isointense al liquor in tutte le sequenze, senza calcificazioni, né presa di contrasto (3, 25).Sono solitamente indistinguibili dalle cisti della tasca di Rathke.
Se necessario, possono essere trattate chirurgicamente: derivazione o fenestrazione.

Diverticolo aracnoideo. RM coronali (a, b, d) e sagittale (c), in T1 basale (a) e con mdc (b, c) e T2 (d). Le immagini evidenziano una lesione di intensità simil-liquorale (frecce gialle) che non assume mdc (b e c), espressione di erniazione delle cisterne sovrasellari attraverso l'emidiaframma destro, con completo impegno del cavo sellare, erosione del pavimento ed anche estrinsecazione nel seno sfenoidale (freccia verde). L'ipofisi è dislocata e compressa a sinistra (freccia rossa).
CISTI DELLA PARS INTERMEDIA
La pars intermedia è rudimentale dopo la vita fetale. In vitro si possono osservare una o più cisti (solitamente < 3 mm), che rappresentano residui embrionari, piene di liquido proteico o detriti cellulari. In alcuni casi possono ingrandirsi e diventare visibili all’imaging all’interno dell’ipofisi (2).
Di solito non è necessario alcun trattamento.

Cisti della pars intermedia. RM sagittale (in alto) e coronale (in basso), T1 senza (a) e con mdc (b, c), e T2 (d). Si evidenzia una minuscola lesione (frecce) tondeggiante di intensità simil-liquorale, nel contesto di un'ipofisi normale per morfologia e caratteristiche di segnale.
BIBLIOGRAFIA
- Byun WM, Kim OL, Kim D. MR imaging findings of Rathke’s cleft cysts: significance of intracystic nodules. AJNR Amer J Neuroradiol 2000, 21: 485-8.
- Spampinato MV, Castillo M. Congenital pathology of the pituitary gland and parasellar region. Top Magn Res Imaging 2005, 16: 269-76.
- Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 1999, 28: 81-117.
- Billeci D, Marton E, Tripodi M, et al. Symptomatic Rathke’s cleft cysts: a radiological, surgical and pathological review. Pituitary 2005, 7: 131–7.
- Mukherjee JJ, Islam N, Kaltsas G, et al. Clinical, radiological and pathological features of patients with Rathke’s cleft cysts: tumors that may recur. J Clin Endocrinol Metab 1997, 82: 2357–62.
- Aho CJ, Liu C, Zelman V, et al. Surgical outcomes in 118 patients with Rathke cleft cysts. J Neurosurg 2005, 102: 189–93.
- Kim JE, Kim JH, Kim OL, et al. Surgical treatment of symptomatic Rathke cleft cysts: clinical features and results with special attention to recurrence. J Neurosurg 2004, 100: 33–40.
- Isono M, Kamida T, Kobayashi H, et al. Clinical features of symptomatic Rathke’s cleft cyst. Clin Neurol Neurosurg 2001, 103: 96–100.
- Zada G, Lin N, Ojerholm E, et al. Craniopharyngioma and other cystic epithelial lesions of the sellar region: a review of clinical, imaging, and histopathological relationships. Neurosurg Focus 2010, 28: E4 1-12.
- Huang BY, Castillo M. Nonadenomatous tumors of the pituitary and sella turcica. Top Magn Res Imaging 2005, 16: 289-99.
- Glezer A, Belchior Paraiba D, et al. Rare sellar lesions. Endocrinol Metab Clin North Am 2008, 37: 195-211.
- Nishioka H, Haraoka J, Izawa H, et al. Magnetic resonance imaging, clinical manifestations, and management of Rathke’s cleft cyst. Clin Endocrinol 2006, 64: 184–8.
- Shin JL, Asa SL, Woodhouse LJ, et al. Cystic lesions of the pituitary: clinicopathological features distinguishing craniopharyngioma, Rathke’s cleft cyst, and arachnoid cyst. J Clin Endocrinol Metab 1999, 84: 3972–82.
- Tominaga JY, Higano S, Takahashi S. Characteristics of Rathke’s cleft cyst in MR imaging. Magn Reson Med Sci 2003, 2: 1–8.
- Kaltsas GA, Evanson J, Chrisoulidou A, et al. The diagnosis and management of parasellar tumours of the pituitary. Endocr Related Cancer 2008, 15: 885–903.
- Gelabert-Gonzalez M. Intracranial epidermoid and dermoid cysts. Rev Neurol 1998, 27: 777-82.
- Harrison MJ, Morgello S, Post KD. Epithelial cystic lesions of the sellar and parasellar region: A continuum of ectodermal derivatives? J Neurosurg 1994, 80: 1018-25.
- Smith JK. Parasellar tumors: suprasellar and cavernous sinuses. Top Magn Res Imaging 2005, 16: 307-15.
- Civit T, Marchal JC, Pinelli C, et al. Intrasellar epidermoid cysts. Neurochirurgie 1999, 45: 150–4.
- Rennert J, Doerfler A. Imaging of sellar and parasellar lesions. Clin Neurol Neurosurg 2007, 109: 111–24.
- Freeman JL, Coleman LT, Wellard RM, et al. MR imaging and spectroscopic study of epileptogenic hypothalamic hamartomas: analysis of 72 cases. AJNR Am J Neuroradiol 2004, 25: 450–62.
- Striano S, Striano P, Sarappa C, et al. The clinical spectrum and natural history of gelastic epilepsy-hypothalamic hamartoma syndrome. Seizure 2005, 14: 232-9.
- Debeneix C, Bourgeois M, Trivin C, et al. Hypothalamic hamartoma: comparison of clinical presentation and magnetic resonance images. Hormone Res 2001, 56: 12-8.
- Judge DM, Kulin HE, Page R, et al. Hypothalamic hamartoma: a source of luteinizing hormone-releasing factor in precocious puberty. N Engl J Med 1977, 296: 7–10.
- Nomura M, Tachibana O, Hasegawa M, et al. Contrast-enhanced MRI of intrasellar arachnoid cysts: relationship between the pituitary gland and cyst. Neuroradiology 1996, 38: 566–8.
- Attanasio R, Cozzi R, Lasio G, Barbò R. Diagnostic evaluation of the lesions of the sellar and parasellar region. In "Explicative Cases of Controversial Issues in Neurosurgery, Signorelli F (Ed), ISBN: 978-953-51-0623-4, InTech, http://www.intechopen.com/books/explicative-cases-of-controversial-issues-in-neurosurgery/the-diagnostic-evaluation-of-the-lesions-of-the-sellar-and-parasellar-region.
Malattie ipotalamo-ipofisarie granulomatose e infiammatorie
Roberto Attanasio1, Renato Cozzi2, Giovanni Lasio3 & Regina Barbò4
1Endocrinologia, Istituto Galeazzi, Milano
2Endocrinologia, Ospedale Niguarda, Milano
3Neurochirurgia, Istituto Humanitas, Milano
4Neuroradiologia, Gavazzeni-Humanitas, Bergamo
TUBERCOLOSI
La TBC ipofisaria è rara. Si può presentare con meningite, che provoca un essudato denso al basicranio con coinvolgimento sellare e parasellare, o con tubercoloma intra- o sovra-sellare. Può essere presente un effetto-massa, con possibile deficit della funzione ipofisaria o ipotalamica e coinvolgimento del chiasma ottico (1, 2).
Anche se la maggior parte dei pazienti con TBC ipotalamo-ipofisaria ha segni di attività di malattia in altra sede, questa non è una regola assoluta. Di conseguenza, la diagnosi di tubercoloma viene talvolta posta solo all’istologia (2).
Gli studi di immagine mostrano il coinvolgimento della sella turcica con ispessimento del peduncolo. Il possibile coinvolgimento del clivus è aspecifico. Alla RM si evidenzia una massa ipointensa in T2, con o senza bright spot della neuroipofisi. Gli ascessi tubercolari appaiono iso o ipointensi in T1 (occasionalmente iperintensi per l’alto contenuto proteico e lipidico) e iperintensi in T2. I tubercolomi si impregnano vivacemente con il contrasto e sono spesso accompagnati da ispessimento del peduncolo e della dura che prende il mdc. Queste caratteristiche di segnale sono aspecifiche e non differenti da quelle degli adenomi ipofisari. Gli ascessi tubercolari possono mostrare accumulo di mdc in periferia e nelle meningi adiacenti (3).

Tubercolosi. RM con immagini T1 coronale (a) e sagittale (b) con mdc. Vivace impregnazione contrastografica in corrispondenza delle cisterne della base (freccia rossa), compatibile con meningite, associata a multiple lesioni parenchimali di tipo nodulare con centro necrotico, a sviluppo al passaggio cortico-midollare, a sede temporale sinistra (frecce gialle in a), pontina e cerebellare (frecce gialle in b). L'ipofisi appare di dimensioni aumentate, con vivace impregnazione contrastografica estesa al peduncolo e anche al diencefalo. Paziente noto per TBC.
ALTRE INFEZIONI
Nella regione sellare si possono raramente sviluppare, soprattutto nei pazienti immuno-compromessi, infezioni fungine (da Histoplasma, Coccidioides, Cryptococcus, Candida e Aspergillus), parassitarie (da Cysticercus) e opportunistiche (da Toxoplasma, Pneumocystis Carinii, Mucor), che possono mimare un adenoma ipofisario (2).

Mucormicosi. Uomo con diabete mellito scompensato che lavora in una piantagione di tabacco. RM in T1 con mdc assiale (a) e coronale (b). Lesione con epicentro in corrispondenza dell'orbita sinistra, che condiziona esoftalmo, estesa posteriormente allo sfenoide, con interessamento del cavo sellare e del seno cavernoso sinistro, osteite del basicranio e interessamento delle meningi e del parenchima del lobo temporale, con focolaio encefalitico (freccia gialla), e miosite dei muscoli della fossa infra-temporale (freccia rossa). L'invasione delle pareti del tratto intracavernoso del sifone carotideo sinistro provoca significativa riduzione di calibro (freccia verde) e poi occlusione della carotide interna sinistra.
L’aspergillosi è una micosi dei seni paranasali, che frequentemente si estende alla regione orbitaria o invade il basicranio. L’aspergillo ha un tropismo per l’intima-media, che consente quindi la disseminazione ematogena ai nuclei della base, in alcuni casi fino alla vasculite emorragica. Le forme invasive sono tipiche dei pazienti immuno-compromessi (4). È estremamente rara (ma riportata anche nel paziente immuno-competente) l’estensione dell’aspergillosi dal seno sfenoidale alla regione sellare a simulare un tumore ipofisario. Gli studi neuroradiologici mostrano lesioni moderatamente iperintense in T1, ipointense in T2, che assumono vivacemente il mdc. La diagnosi può essere fatta solo con l’esplorazione chirurgica delle aree coinvolte (5).

Aspergillosi. RM coronale T1 senza (a) e con mdc (b), sagittale T1 con mdc (c), assiale T2 (d). Obliterazione del seno sfenoidale (freccia rossa) per la presenza di tessuto disomogeneo ipo/iperintenso. Si associa aumento di dimensioni del seno cavernoso sinistro e della dura del pavimento della fossa cranica media. Irregolare iperintensità di segnale in sede nucleare sinistra nelle immagini basali (freccia gialla), espressione di vasculite emorragica. Le immagini contrastografiche evidenziano vivace impregnazione a livello del seno sfenoidale estesa al cavo sellare e all'adiacente seno cavernoso, alla dura della fossa cranica media, con associato circoscritto focolaio encefalitico in regione basifrontale (freccia verde). L'immagine assiale T2 documenta l'estensione della lesione a livello etmoidale posteriore e all'apice dell'orbita sinistra con esoftalmo. Il tessuto francamente ipointenso (freccia arancio in d) evoca la genesi fungina della localizzazione.
In un paziente con massa ipofisaria e oftalmoplegia bisogna prendere in considerazione un’altra rara micosi, la coccidioidomicosi, con comparsa acuta di oftalmoplegia monolaterale e massa che invade l’ipofisi e il seno cavernoso (6).
SARCOIDOSI
Coinvolge il SNC nel 5-15% dei casi. La neurosarcoidosi è di solito associata alla forma sistemica, mentre solo nel 5% dei casi è isolata, ma in rari casi può essere il segno iniziale o unico di malattia (2).
La localizzazione preferenziale è nella regione ipotalamo-ipofisaria: sono comuni cefalea e diabete insipido, mentre possono essere presenti iperPRL e deficit dei nervi cranici.
Alla RM, le lesioni intra-parenchimali, meningee o sellari della sarcoidosi appaiono isointense in T1 e variabili in T2, e prendono il mdc. Il peduncolo può essere ispessito e impregnato di contrasto. È molto raro un aspetto cistico. Il coinvolgimento leptomeningeo dell’ipotalamo e del peduncolo può essere isolato o associato a coinvolgimento delle leptomeningi del basicranio (3).
Nel sospetto di neurosarcoidosi, è indicato l’esame del liquor con valutazione di citologia e ACE. In alcuni pazienti si arriva alla diagnosi solo con la biopsia delle lesioni granulomatose (7).
La terapia di scelta è steroidea, ma sono stati utilizzati anche vari schemi con l’impiego di immuno-soppressori (7).

Sarcoidosi. RM sagittali prima (a) e dopo mdc (b). L'ipofisi presenta morfologia e dimensioni nei limiti della norma, ma assenza del bright spot della neuroipofisi. L'immagine basale evidenzia aumento di spessore del tratto terminale del peduncolo ipofisario con estensione all'ipotalamo (freccia rossa). L'immagine post-mdc conferma ed evidenzia interessamento del peduncolo e del diencefalo, con associata omogenea impregnazione meningea diffusa, caratterizzata dalla presenza di micronoduli e placche (frecce gialle). Il quadro è patognomonico di neurosarcoidosi.
ALTRE MALATTIE SISTEMICHE
In casi isolati è stato decritto un coinvolgimento granulomatoso ipofisario (5).
- Granulomatosi di Wegener: in meno dell’1% degli affetti si può avere diabete insipido centrale (solitamente dopo le lesioni renali e polmonari) (8).
- Malattia di Erdheim–Chester: diabete insipido, ipopituitarismo e iperPRL, sindromi cerebellari, lesioni orbitarie e masse extra-assiali con coinvolgimento della dura (9).
- Malattia di Crohn: ipopituitarismo, emianopsia bitemporale progressiva e massa intra-sellare (10).
- Malattia di Takayasu: massa ipofisaria, ipopituitarismo e diabete insipido (11).
- Sindrome di Cogan: ingrandimento ipofisario, diabete insipido e ipotiroidismo centrale (12).
MUCOCELE SFENOIDALE
Il mucocele primario è una cisti congenita con ritenzione di muco, mentre il mucocele secondario, molto più comune, deriva dall’ostruzione cronica del seno, che porta ad accumulo e disidratazione delle secrezioni. Condizioni infiammatorie, tumori, traumi e pregressa chirurgia intra-sfenoidale rappresentano fattori predisponenti.
Non esiste una preferenza per l’età di comparsa.
Il mucocele in rari casi può estendersi alla sella turcica, alle regioni para e sovra-sellari, al nasofaringe, alle orbite, al clivus o alle cellette etmoidee. L’accumulo intra-cistico delle secrezioni espande ed erode le pareti del seno, portando infine alla compressione delle strutture circostanti, come i seni cavernosi, l’ipofisi, i nervi cranici (dal I al VI) e le carotidi.
Il mucocele sfenoidale solitamente evolve in tempi lunghi, anche di anni, con cefalea aspecifica, solitamente intensa, e dolore facciale atipico, con parestesie secondarie a irritazione trigeminale. Un deficit visivo da compressione nervosa diretta da parte della massa o da reazione infiammatoria cicatriziale è di solito lentamente progressivo, ma può essere peggiorato improvvisamente per compromissione vascolare del nervo ottico. La neuropatia ottica è più frequentemente unilaterale, tipicamente senza deficit campimetrico. In circa metà dei pazienti può esserci esoftalmo. È comune la diplopia per disfunzione del III (e più raramente del IV) nervo cranico (2). Non è comune l’ipopituitarismo.
Alla TC si può vedere una massa non destruente che causa assottigliamento e rigonfiamento delle pareti sinusali, con contenuto sellare che può simulare una massa para o sovra-sellare. L’aspetto RM è variabile. Nella maggior parte dei casi è presente un’espansione del seno sfenoidale, con pareti solitamente intatte ma talvolta erose ed evidente opacamento del contenuto, quasi sempre iperintenso in T2 e omogeneamente iperintenso in T1 per l’alto contenuto proteico. Il mdc si dispone in strato sottile e regolare alla periferia (7, 13, 14).
Il drenaggio chirurgico è indicato solo se la lesione è molto sintomatica o erode l’osso.

Mucocele. La RM sagittale in T1 (a) e assiale in T2 (c) mostra una massa cistica, che riempie e dilata il recesso sfenoidale sinistro. La lesione appare omogeneamente iperintensa in T1 (a) con contrasto periferico (b). Nel recesso sfenoidale destro è evidente sinusite cronica.
BIBLIOGRAFIA
- Domingues FS, de Souza JM, Chagas H, et al. Pituitary tuberculoma: an unusual lesion of sellar region. Pituitary 2002, 5: 149-53.
- Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 1999, 28: 81-117.
- Lury KM. Inflammatory and infectious processes involving the pituitary gland. Top Magn Res Imaging 2005, 16: 301-6.
- Pinzer T, Reiss M, Bourquain H, et al. Primary aspergillosis of the sphenoid sinus with pituitary invasion - a rare differential diagnosis of sellar lesions. Acta Neurochir 2006, 148: 1085–90.
- Carpinteri R, Patelli I, Casanueva FF, et al. Inflammatory and granulomatous expansive lesions of the pituitary. Best Pract Res Clin Endocrinol Metab 2009, 23: 639–50.
- Scanarini M, Rotilio A, Rigobello L, et al. Primary intrasellar coccidioidomycosis simulating a pituitary adenoma. Neurosurgery 1991, 28: 748–51.
- Glezer A, Belchior Paraiba D, et al. Rare sellar lesions. Endocrinol Metab Clin North Am 2008, 37: 195-211.
- Goyal M, Kucharczyk W, & Keystone E. Granulomatosis hypophysitis due to Wegener’s granulomatosis. AJNR Amer J Neuroradiol 2000, 21: 1466–9.
- Kovacs K, Bilbao JM, Fornasier VL, et al. Pituitary pathology in Erdheim-Chester disease. Endocr Pathol 2004, 15: 159–66.
- de Bruin WI, van’t Verlaat JW, Graamans K, et al. Sellar granulomatous mass in a pregnant woman with active Crohn’s disease. Neth J Med 1991, 39: 136–41.
- Toth M, Szabo P, Racz K, et al. Granulomatous hypophysitis associated with Takayasu’s disease. Clin Endocrinol 1996, 45: 499–503.
- Kanatani M, Nakamura R, Kurokawa K, et al. Hypopituitarism associated with Cogan’s syndrome; high-dose glucocorticoid therapy reverses pituitary swelling. Jap J Med 1991, 30: 164–9.
- Akan H, Cihan B, Celenk C. Sphenoid sinus mucocele causing third nerve paralysis: CT and MR findings. Dentomaxillofac Radiol 2004, 33: 342–4.
- Rennert J, Doerfler A. Imaging of sellar and parasellar lesions. Clin Neurol Neurosurg 2007, 109: 111–24.
- Attanasio R, Cozzi R, Lasio G, Barbò R. Diagnostic evaluation of the lesions of the sellar and parasellar region. In "Explicative Cases of Controversial Issues in Neurosurgery, Signorelli F (Ed), ISBN: 978-953-51-0623-4, InTech, http://www.intechopen.com/books/explicative-cases-of-controversial-issues-in-neurosurgery/the-diagnostic-evaluation-of-the-lesions-of-the-sellar-and-parasellar-region.
Altre neoplasie della regione ipotalamo-ipofisaria
Roberto Attanasio1, Renato Cozzi2, Giovanni Lasio3 & Regina Barbò4
1Endocrinologia, Istituto Galeazzi, Milano
2Endocrinologia, Ospedale Niguarda, Milano
3Neurochirurgia, Istituto Humanitas, Milano
4Neuroradiologia, Gavazzeni-Humanitas, Bergamo
Con aggiornamento novembre 2022 a cura di Alessandro Bozzao, Serena Palizzi, Valentina Frezza, Sara De Giorgi
Sapienza Università di Roma, Facoltà di Medicina e Psicologia, Dipartimento NESMOS (Neuroscienze, Salute Mentale, Organi di Senso)
UOC Neuroradiologia, AO "Sant'Andrea", Roma
LESIONI DI DERIVAZIONE DALL’ADENOIPOFISI
LESIONI DI DERIVAZIONE DALLA NEUROIPOFISI
Pituicitoma
I pituiciti sono cellule gliali specializzate, collocate nel peduncolo e nella neuro-ipofisi. Possono trasformarsi in pituicitoma, raro tumore gliale neuroipofisario di basso grado, noto anche come astrocitoma ipofisario (1,2).
Questo colpisce di solito donne giovani o di mezza età. È ubiquitario nell’asse ipotalamo-ipofisario e può essere interamente intra- o sovra-sellare o coinvolgere entrambi i compartimenti.
La presentazione clinica è simile a quella delle altre masse della regione: cefalea e ipopituitarismo sono frequenti, mentre, nonostante l’origine dalla neuroipofisi, il diabete insipido non è comune.
La diagnosi è istologica, poiché la diagnostica per immagini non è dirimente: la RM mostra una massa sellare o sovra-sellare solida, ben demarcata, solitamente isointensa alla sostanza grigia in T1, iperintensa in T2, che prende il mdc e talvolta disloca anteriormente l’adeno-ipofisi normale.
Anche se dal punto di vista istologico è un tumore benigno, la localizzazione e la ricca vascolarizzazione ne rendono difficile la resezione radicale (3,4).

Pituicitoma in giovane uomo che lamentava cefalea, calo della libido e diabete insipido. Alla RM si vede una massa nodulare sovra-sellare, che deriva dal peduncolo e comprime il chiasma, isointensa in T1 (a) e T2 (c), con intenso effetto contrastografico (b).
Tumore a cellule granulari (o coristoma)
È un tumore benigno che deriva dai pituiciti granulari, noto anche come coristoma, mioblastoma o infundiboloma, che rappresenta il tumore primitivo più comune (fino al 17% delle autopsie di adulti non selezionati) a origine dalla neuro-ipofisi o dall’infundibolo (2,5-7).
Solitamente è asintomatico, ma può presentarsi (soprattutto nella 5° decade) con effetto massa: è comune la cefalea, il 90% dei pazienti sintomatici lamenta disturbi visivi e il 50% iperPRL e ipopituitarismo. Nonostante l’origine dalla neuro-ipofisi o dall’infundibolo, il diabete insipido non è comune.
Nella maggior parte dei pazienti sintomatici il tumore ha localizzazione sia intra che sovra-sellare, ma nell’11% dei casi è solo intra-sellare. L’aspetto neuroradiologico non è specifico (8,9): isointenso alla sostanza grigia in T1 e T2, con intenso effetto contrastografico correlato alla ricca vascolarizzazione. Possono essere presenti calcificazioni e perdita del bright spot posteriore.
Il trattamento chirurgico è indicato nei casi sintomatici.
TUMORI MALIGNI PARASELLARI
Glioma
Può svilupparsi nell’ipotalamo e nelle vie ottiche.
I gliomi del nervo ottico sono rari: 3.5% dei tumori intra-cranici nel bambino e 1% nell’adulto (in cui hanno comportamento maligno) (5,6,10-12).
La varietà infantile compare nella prima decade ed è tipicamente un astrocitoma pilocitico, lesione benigna e a lenta crescita (grado I WHO). Solitamente infiltra chiasma e nervi ottici. Circa il 30% dei pazienti con glioma delle vie ottiche sono affetti da neurofibromatosi di tipo 1 (NF-1), mentre circa 1/3 dei pazienti con NF-1 sviluppa gliomi multicentrici delle vie ottiche, gliomi di basso grado del tronco encefalico e amartomi non neoplastici dei nuclei della base (13). I sintomi di presentazione più frequenti nel bambino sono calo della vista, cefalea e proptosi. Spesso il danno visivo non viene notato fino ad una fase avanzata di sviluppo del tumore. La RM dimostra una lesione nel chiasma o nel nervo ottico, ipointensa in T1 che prende il mdc. Nel caso di glioma limitato a un nervo ottico, la migliore opzione terapeutica è la resezione chirurgica. In tutti gli altri casi alla chirurgia si possono associare radio- e chemioterapia, ma per il momento non c’è una regola precisa.
Il glioma del giovane adulto può svilupparsi nel tronco encefalico ed estendersi alla regione para-sellare. Il tipo più frequente è il glioma intrinseco diffuso di basso grado (grado II WHO), ma nel 31% dei casi si tratta di un glioma maligno del tronco (grado III e IV WHO). La presentazione iniziale è spesso un offuscamento visivo monoculare con dolore retro-bulbare, che può rapidamente arrivare alla cecità (3). I difetti campimetrici sono estremamente variabili senza un quadro specifico. È estremamente rara la presentazione come massa cistica intra-sellare. Alla RM queste lesioni possono essere localizzate nel chiasma, mentre nella maggior parte dei casi la sella è normale. Sono tipicamente da iso a ipointensi in T1 e iperintensi in T2, con infiltrazione lungo i nervi e tratti ottici, che prende omogeneamente il mdc. La radioterapia rappresenta la miglior terapia palliativa.
I gliomi ipotalamici si presentano quasi sempre nell’infanzia, con alterazione delle funzioni ipotalamiche, mancato accrescimento ponderale, diabete insipido e calo della vista con atrofia ottica. Alla RM questi tumori non si diffondono lungo le vie ottiche, ma sono grosse masse della regione sovra-sellare, invasive nell’ipotalamo, infiltranti cervello e III ventricolo. Sono da ipo a isointensi in T1 e da iso a iperintensi in T2, con impregnazione contrastografica omogenea. Il tumore può estendersi nella cisterna sovra-sellare o nel parenchima cerebrale circostante, solitamente senza necrosi, emorragia o calcificazioni. Può inglobare i vasi del circolo di Willis ed è comune l’idrocefalo (14). La diagnosi può essere posta con biopsia (a cielo aperto o stereotassica).

Glioma ipotalamico in una bambina di 10 anni affetta da NF1, che lamentava calo della vista senza endocrinopatie. La RM in coronale (a) e sagittale (c) dimostra una massa infiltrante che coinvolge il chiasma ottico, isointensa al cervello, con componenti nodulari e cistiche. La porzione nodulare si contrasta vivacemente (b) e disloca il peduncolo ipofisario verso sinistra
I gliomi delle vie ottiche sono solitamente tumori a crescita molto lenta, mentre quelli del chiasma-ipotalamo possono essere maggiormente aggressivi (sopravvivenza del 50% a 5 anni).
Il miglior approccio terapeutico è fonte di discussione: sono stati proposti (con grado variabile di successo) la neurochirurgia, l’osservazione, gli steroidi, l’irradiazione, la chemioterapia con temozolomide o altri agenti.
Tumori a cellule germinali
Sono rari tumori maligni che rappresentano lo 0.1-2% di tutte le neoplasie intra-craniche. Nascono da cellule germinali totipotenti. I germinomi rappresentano i 2/3 delle forme intra-craniche (2).
La localizzazione è solitamente mediana, più frequentemente nella regione pineale (80%). Vengono descritte 3 tipologie:
- la localizzazione doppia nell’ipotalamo ventrale e nella regione pineale;
- la localizzazione nella porzione anteriore del III ventricolo che può estendersi alla sella turcica;
- la localizzazione intra-sellare pura che può confondersi con un adenoma (15).
Tutte le varietà possono diffondere fino a coinvolgere chiasma e nervi ottici e provocare deficit della funzione ipofisaria.
I germinomi hanno il picco di incidenza nell’infanzia e nell’adolescenza. La localizzazione pineale è più frequente nei maschi e quella intra-sellare nelle femmine. Presentano una tendenza infiltrante, con disseminazione per via liquorale.
La presentazione più comune è con anomalie endocrine. Il diabete insipido è il sintomo più comune (80%) e può precedere di anni la diagnosi. Vi sono poi ipopituitarismo nei bambini e adolescenti e ipogonadismo negli adulti, più raramente iperPRL e pubertà precoce. I tumori di maggiori dimensioni e quelli primitivamente sovra-sellari possono presentarsi con deficit campimetrici, atrofia ottica, paralisi oculomotoria, idrocefalo e segni di ipertensione endocranica (3,5,6,16).
La diagnosi di certezza è istologica, ma in un sottogruppo vi sono aspetti radiologici indicativi o un aumento di marcatori specifici (17): l’aumento nel liquor dei livelli di alfa-fetoproteina è patognomonico per tumore del sacco vitellino e quello di hCG per coriocarcinoma (17,18).
La TC dimostra masse iso o iperdense, talvolta multi-centriche, con intenso contrasto. La presenza simultanea di lesioni simili nelle regioni sovra-sellare e pineale è patognomonica (3,5,6,14).
Alla RM un segno precoce ma aspecifico è la scomparsa del bright spot nell’ipofisi posteriore. In seguito si possono evidenziare ispessimento del peduncolo e poi la comparsa di una massa che può dislocare anteriormente l’ipofisi. Infine il germinoma appare come lesione solida iso/ipointensa in T1 e iperintensa in T2. Il potenziamento dopo somministrazione di mdc è massivo e omogeneo. Non si associa alla presenza di calcificazioni (19) (3,5,6,14,19,20).

Germinoma in un ragazzo presentatosi con diabete insipido. La RM coronale mostra una lesione sellare e sovrasellare, isointensa in T2 (a) e con presa di contrasto omogenea (b). In proiezione sagittale (c) si evidenzia una lesione concomitante in regione pineale (freccia) che intrappola l’epifisi.
| Caratteristiche del germinoma | |
| Sede | Lungo le strutture della linea mediana |
| Età | Infantile/giovanile |
| Calcificazioni | No |
| Sequenze T1-pesate | Isointenso/ipointenso |
| Sequenze T2-pesate | Iperintenso |
| Potenziamento con mdc | Massivo ed omogeneo |
Il gold standard diagnostico è l’evidenza istologica di infiltrato granulomatoso intorno a cellule germinali su un campione bioptico ottenuto in stereotassi o neuro-endoscopia. La biopsia può essere evitata in presenza di dati patognomonici ottenuti dalla neuroradiologia o dal dosaggio dei marcatori biochimici (17).
Raramente c’è l’indicazione a un approccio chirurgico diretto. L’unica procedura chirurgica necessaria può essere una derivazione ventricolare (16), mentre solitamente c’è buona risposta a chemio e radioterapia. Il follow-up di queste forme è per sempre.
Linfoma para-sellare primitivo
I linfomi del SNC vengono definiti primitivi quando la localizzazione è limitata all’asse cranio-spinale senza malattia sistemica, situazione ben distinta da quella del linfoma sistemico con secondaria metastatizzazione al SNC. I linfomi primitivi del SNC rappresentano l’1-2% del linfomi non-Hodgkin (la maggior parte origina dai linfociti B) e circa il 3% di tutte le neoplasie intra-craniche (21); la metastatizzazione secondaria si verifica invece in circa il 30% dei casi.
La localizzazione primitiva all’ipofisi è estremamente rara (< 1% nei pazienti sottoposti a NCH TNS per massa sellare) (5,22) ed è descritta inizialmente in pazienti immuno-compromessi ma recentemente anche negli immuno-competenti (21).
Il picco di incidenza è nella 6°-7° decade negli immuno-competenti e più precoce negli immuno-depressi, con preponderanza maschile (23).
Alla presentazione clinica sono insoliti sintomi sistemici (come febbre di origine sconosciuta), mentre sono più frequenti sintomi compressivi locali (cefalea nel 56%, diplopia nel 39% e difetti campimetrici nel 28%), ipopituitarismo (72%) e diabete insipido (39%) (24).
I linfomi appaiono solitamente iso o iperdensi alla TC, mentre è più variabile l’aspetto alla RM, anche in relazione all’assetto immunitario (2,25,26). L’aspetto neuroradiologico di una localizzazione sellare è in gran parte aspecifico, con ingrandimento ipofisario diffuso (94%), estensione sovra-sellare (44%), nel seno cavernoso (39%) e ispessimento del peduncolo (22%). La maggior parte dei casi appare isointensa in T1, con presa di contrasto omogenea o eterogenea, solitamente senza emorragia o calcificazioni, ma iso o ipointensa rispetto alla sostanza grigia in T2 (27).
La diagnosi di linfoma primitivo è istologica su biopsia stereotassica, ma oggi si possono usare con buon grado di attendibilità indagini non invasive, come la SPECT o la PET. L’identificazione nel liquor del DNA per il virus di Epstein-Barr è sensibile e unica per questa malattia (28).
Le opzioni terapeutiche comprendono la neurochirurgia, la chemioterapia e la radioterapia (3).
Metastasi alla regione sellare e para-sellare
Sono solitamente considerate rare, riscontrate in meno dell’1% dei pazienti sottoposti a NCH TNS per lesioni della regione (29). In realtà casistiche autoptiche riportano che fino a un quarto dei pazienti con metastatizzazione intra-cranica mostra un coinvolgimento della regione. Questa diagnosi è sempre più frequente per i progressi della diagnostica per immagini e a causa del miglioramento della sopravvivenza dei pazienti oncologici.
Sebbene le metastasi regionali si evidenzino solitamente nel quadro di una disseminazione generalizzata (in pazienti anziani indipendentemente dal sesso), possono comparire anche in pazienti giovani ed essere talvolta la prima manifestazione di una neoplasia occulta o l’unico sito ripetitivo.
I tumori di partenza più frequenti sono la mammella nella femmina e il polmone nel maschio, che rappresentano complessivamente i 2/3 dei casi. Qualunque tumore può però metastatizzare a questa regione e il primitivo rimane occulto in circa il 3% dei casi nonostante le indagini più accurate.
Le cellule metastatiche possono arrivare per diverse vie: attraverso i vasi portali, dalla cisterna sovra-sellare, per estensione diretta dal basicranio e direttamente attraverso il circolo arterioso.
Il più comune sintomo di presentazione, riportato nel 28-70% ma anche fino al 100% in alcune casistiche è il diabete insipido, che può essere l’unica manifestazione della neoplasia. Questo è giustificato da motivi anatomici: il lobo posteriore dell’ipofisi è irrorato direttamente dai vasi arteriosi e ha un’ampia area di contatto con la dura adiacente (in contrasto con l’adeno-ipofisi irrorata dal circolo portale). Il diabete insipido può essere transitorio o intermittente, perché si può avere rigenerazione delle fibre neuro-ipofisarie. Inoltre il diabete insipido può essere mascherato dall’iposurrenalismo centrale fino all’inizio del trattamento steroideo (5,6).
Meno frequente è l’ipopituitarismo, sia per le ragioni anatomiche sovra-descritte, sia perché può essere clinicamente mascherato da sintomi aspecifici attribuiti alla neoplasia (astenia, vomito, calo ponderale). Nel 12-43% dei casi si osserva paralisi dei nervi cranici (soprattutto del VI).
È opportuno sottolineare che la maggioranza delle metastasi ipofisarie è clinicamente silente e quando sintomatiche non possono essere distinte con sicurezza dai tumori sellari primitivi sulla base della clinica e delle immagini, specialmente se non c’è evidenza clinica di un tumore primitivo. Spesso assomigliano a un adenoma ipofisario o ad altre lesioni benigne o maligne della regione. Inoltre, anche nei pazienti con neoplasia nota non sempre una lesione sellare è una metastasi. Nell’1.8-16% dei pazienti con neoplasia nota può apparire all’orizzonte clinico una lesione benigna come un adenoma ipofisario. Una diagnosi corretta è quindi essenziale per l’appropriata pianificazione dei successivi interventi terapeutici.
La TC mostra solitamente una massa da iper a isodensa, che prende il contrasto in modo omogeneo o eterogeneo (nel caso di degenerazione cistica, emorragia o necrosi).
Alla RM le lesioni metastatiche ipofisarie appaiono come masse sellari o sovra-sellari che si contrastano, iso o ipointense in T1 e solitamente iperintense in T2. La massa può talvolta superare il diaframma sellare, assumendo un aspetto a clessidra, meglio visibile in sagittale, in contrasto con gli adenomi che di solito spingono il diaframma verso l’alto. Sono rilievi aspecifici le erosioni ossee, la perdita del bright spot posteriore e l’ispessimento del peduncolo (5,6).

Metastasi da K rinofaringeo. RM coronale T1 senza (a) e con (c) mdc, coronale T2 (d) e sagittale T1 con mdc (b). L'immagine sagittale documenta un irregolare aumento dello spessore dei tessuti molli del rinofaringe, per la presenza di un carcinoma infiltrante l'adiacente seno sfenoidale e il clivus. Si associa modico aumento delle dimensioni dell'ipofisi e più evidente del peduncolo, con uniforme moderato potenziamento contrastografico. Le immagini sono simili a quelle dell'ipofisite granulomatosa ma il contesto clinico e radiologico porta alla diagnosi corretta.

Metastasi da K mammario. La RM sagittale (a) e coronale (b) mostra una massa solida sovrasellare che infiltra il clivus e lo sfenoide. La lesione è moderatamente ipointensa in T1 e si contrasta in modo eterogeneo. La TC assiale con finestra ossea (c) mostra una grossa erosione del basicranio centrale.
Può essere importante eseguire una rachicentesi, perché l’esame citologico può dimostrare una disseminazione meningea.
Nella maggior parte dei casi, in assenza di lesioni primitive note o di altre metastasi, la diagnosi dipende dall’istologia. È obbligatoria l’immuno-istochimica, perché la diagnosi differenziale con l’adenoma non è attendibile solo sulla base di infiltrazione locale e aspetti citologici (pleiomorfismo nucleare, cellule multi-nucleate e mitosi).
Il trattamento delle metastasi è di solito conservativo e dipende dall'estensione e dalla condizione del tumore primitivo. Nei pazienti con danno visivo può essere indicata l'asportazione chirurgica, seguita da radioterapia e/o chemioterapia. Nei pazienti con ipopituitarismo va impostato il trattamento sostitutivo adeguato.
La prognosi è complessivamente scarsa, in relazione all’aggressività della neoplasia primitiva, con sopravvivenza mediana < 2 anni (30).
TUMORI PARASELLARI POTENZIALMENTE MALIGNI (TUMORI MALIGNI DI BASSO GRADO)
Tumori di origine cartilaginea
Circa il 10% delle lesioni para-sellari non ipofisarie è di origine cartilaginea: cordomi, condromi e condro-sarcomi. Queste derivano dalla notocorda primitiva del basicranio e sono localizzate nel clivus in circa il 40% dei casi (6).
I cordomi sono rari, lo 0.1-0.2% di tutte le neoplasie intra-craniche. Possono insorgere sulla linea mediana, alle estremità della notocorda, tra il sacro e il clivus. Nel 35% dei casi insorgono nel basicranio, intorno alla sincondrosi sfeno-occipitale e raramente all’interno della sella turcica, nel qual caso è difficile la distinzione dagli adenomi (31). Sono tumori a lenta crescita, localmente invasivi, che compaiono negli adulti di tutte le età, soprattutto fra 30 e 50 anni. In tutti i pazienti con diagnosi radiologica di cordoma va eseguito il dosaggio della PRL, perchè talvolta sono adenomi ipofisari PRL-secernenti con sviluppo prevalentemente infra-sellare.
I sintomi dipendono dalla direzione di crescita, solitamente posteriore con estensione nella cisterna pre-pontina (19). I più comuni sintomi di presentazione sono la cefalea (precoce in un terzo dei pazienti), che può essere atipica e presentarsi solo durante il movimento o gli sforzi fisici. I disturbi visivi, soprattutto la diplopia per il coinvolgimento asimmetrico dei nervi oculomotori, sono meno frequenti. I difetti campimetrici, se ci sono, non sono diversi da quelli degli adenomi ipofisari. Al momento della diagnosi, i cordomi possono aver già raggiunto notevoli dimensioni, tanto da dare dolore cervicale, ostruzione naso-faringea e disfagia (19). Non sono comuni le disfunzioni endocrine, ma possono svilupparsi lieve iperPRL e ipopituitarismo. Presentazioni più rare comprendono vertigini, acufeni, deficit sensoriali facciali, atassia ed emiparesi.
I cordomi possono essere aggressivi, provocando infiltrazione locale ed estesa distruzione ossea del basicranio. Possono recidivare e andare incontro a trasformazione maligna (32,33).
TC e RM sono le metodiche standard per la diagnosi iniziale del tumore, la pianificazione del trattamento e il follow-up post-trattamento.
Alla TC senza mezzo di contrasto il cordoma appare come lesione eterogenea, generalmente iso-iperdensa, ben circoscritta, con associata erosione ossea. Alla RM nelle sequenze T1-pesate può presentare segnale eterogeneo, generalmente iso-ipointenso con alcune aree iperintense (legate alla presenza di materiale mucoide o emorragie), setti e aree di necrosi. Nelle sequenze T2-pesate appare generalmente iperintenso. È comune la presenza di calcificazioni. Dopo somministrazione endovena di gadolinio, il cordoma mostra moderato/marcato potenziamento con aspetto a favo d’ape, con alcune aree lineari di non captazione. L’ipofisi normale può essere talvolta distinta dal tumore, dato utile per distinguere il cordoma dall’adenoma invasivo, che può anch’esso causare estesa distruzione ossea, ma di solito provoca espansione e non distruzione della sella turcica (3).

Cordoma del clivus. RM, sequenze SE, immagini T1, sezioni coronale senza (a), con mdc (b), sagittale (c), con mdc ed assiale T2 (d). Voluminosa lesione espansiva con epicentro in corrispondenza dello sfenoide, che risulta totalmente invaso e distrutto ed estensione inferiore al rino- e oro-faringe, superiore endocranica al seno cavernoso destro e cavo sellare, supero-laterale alla fossa cranica media e posteriore alle cisterne peri-bulbari. La lesione in particolare presenta segnale finemente disomogeneo in tutte le sequenze, ipointenso in T1 e spiccatamente iperintenso in T2, con in particolare presenza di puntiformi cadute di segnale di significato sia vascolare, sia di presenza di componenti ossee. Anche l’impregnazione contrastografica risulta vivace, ma finemente disomogenea (C).
Il condroma è un altro tumore nodulare/lobulare osteo-destruente, che nasce dai residui cartilaginei nell’area del forame lacero e va incontro a regressione cistica e mucinosa e a calcificazioni. Le immagini sono simili al cordoma (19).

Condroma. RM, sezione sagittale T1 senza mdc (A) e sezione coronale T 2 (B). Lesione espansiva con epicentro in corrispondenza della sincondrosi sfeno-petrosa sinistra, a sviluppo in corrispondenza del seno sfenoidale ed apice della piramide petrosa sinistra, ipointensa in T1 e francamente iperintensa in T2. La TC (C) ben evidenzia la grossolana destrutturazione ossea, a margini definiti, frastagliati, evocatrice di lesione espansiva a lenta crescita e medio grado di malignità (grazie a Cristina Agostinis).
Il condro-sarcoma è un tumore maligno (grado II-III WHO) associato anch’esso a estesa distruzione ossea e compressione delle strutture adiacenti (34,35).
La TC mostra una lesione solida tendenzialmente iso-iperdensa, con erosione ossea ed una matrice condroide calcifica, con il classico aspetto “ring and archs” ed alcune calcificazioni (13).
Alla RM i condrosarcomi appaiono iso-ipointensi in T1, iperintensi in T2 e mostrano disomogeneo potenziamento (14,15).

Condrosarcoma. Immagine RM coronale T1 con mdc che dimostra lesione espansiva parasellare extra-parenchimale destra, con epicentro in corrispondenza del seno cavernoso, che appare completamente invaso. La lesione, di morfologia ovalare a contorni definiti, appare caratterizzata da potenziamento contrastografico moderato e disomogeneo. La lesione determina erosione della parete laterale destra della sella, con lieve impronta sull'adenoipofisi.
Condromi e condro-sarcomi insorgono lontano dalla linea mediana, lungo il margine laterale del clivus nella fessura petro-occipitale, e mostrano calcificazioni condroidi in oltre metà dei casi.
L’immuno-istoichimica permette la diagnosi differenziale: tutti i 3 tipi sono positivi per la proteina S-100, ma i condro-sarcomi sono negativi per citocheratina e antigeni epiteliali di membrana (6).
Anche se la chirurgia è il trattamento di scelta, solitamente non è possibile una resezione radicale per l’invasione dell’osso (3). È quindi obbligatoria una radioterapia adiuvante, con i risultati migliori ottenuti dal Proton Beam.
La prognosi a lungo termine è comunque scarsa.
Istiocitosi a cellule di Langerhans
L’istiocitosi a cellule di Langerhans (o istiocitosi di classe I) è un raro disordine multi-sistemico. Nella classificazione dei tumori para-sellari è tradizionalmente descritta fra i disordini granulomatosi, ma poiché è stata dimostrata derivare dalla proliferazione clonale di specifiche cellule dendritiche del sistema monociti-macrofagi, le cosiddette cellule di Langerhans, è più appropriato considerarla una vera e propria neoplasia.
La proliferazione istiocitaria forma granulomi, che infiltrano e distruggono molti organi, tra cui ossa, polmoni, cute, asse ipotalamo-ipofisario e meno frequentemente fegato, milza, linfonodi e midollo osseo (6).
L’incidenza è di 3-4 casi/milione/anno nei ragazzi sotto i 15 anni (solo 1/3 dei casi colpisce gli adulti), con i maschi colpiti 2 volte più delle femmine (3).
La malattia ha un particolare tropismo per il sistema ipotalamo-ipofisario. In metà dei pazienti c’è diabete insipido, che spesso è il sintomo di presentazione e può anche rimanere isolato. Nell’infanzia questa patologia rappresenta la seconda causa di diabete insipido, motivo per cui la diagnosi va attentamente ricercata nei casi di diabete insipido a insorgenza infantile (36). Il coinvolgimento ipotalamico o del peduncolo può portare ad arresto di crescita, frequente nei bambini, o deficit visivo. È comune un aspetto tarlato delle ossa, soprattutto nel cranio, nella mandibola o nelle ossa lunghe (6, 37-39).
Alla RM non ci sono segni specifici, ma nei pazienti con diabete insipido scompare il bright spot dell’ipofisi posteriore. Inoltre è comune il riscontro di massa sovra-sellare, lesioni ipotalamiche e ispessimento del peduncolo (6). Le lesioni sono ipo o isointense in T1 e iperintense in T2, con vivace presa di mdc (40). Le alterazioni ossee possono oggi essere studiate con la RM whole-body, che si è dimostrata superiore all’esame radiografico e alla scintigrafia, risultando peraltro molto meno invasiva dal punto di vista biologico.

Istiocitosi a cellule di Langerhans in giovane donna. La RM mostra una lesione del basisfenoide, che infiltra la sella e condiziona un "imbottimento" del rinofaringe, isointensa in T1 (a) e lievemente iperintensa in T2 (d). La TC sagittale con finestra ossea (c) meglio evidenzia erosione della sella (freccia gialla) e del clivus (freccia verde). L'ipofisi è dislocata (freccia rossa)
È importante porre la diagnosi precocemente e in modo accurato, vista l’alta mortalità (20%) e le sequele permanenti (50%) associate alla malattia multi-sistemica (39). La diagnosi può essere posta sulla base dei sintomi, della diagnostica per immagini e della biopsia dei siti colpiti, con caratterizzazione immuno-istochimica delle cellule di Langerhans (con la proteina S-100, antigene delle CD1a) (3, 6). La biopsia del peduncolo non è raccomandata di routine se la lesione è < 7 mm.
Data la natura sistemica della malattia, c’è indicazione alla chemioterapia, con eventuale radioterapia sulla regione para-sellare (39).
Altri tumori
Nella regione para-sellare sono stati descritti casi isolati di molti altri tumori: emangio-blastomi (41), emangio-pericitomi (42), fibro-sarcomi (43), rabdomio-sarcomi del seno sfenoidale (44), tumori fibrosi solitari (45), estesio-neuroblastomi (46), blastomi ipofisari (47), tumori neuroectodermici primitivi sopratentoriali (48), ependimomi (49), plasmocitomi (50), tumori melanocitici (51) e carcinomi epidermoidi (caso personale).
TUMORI BENIGNI PARASELLARI
Meningiomi
Sono tumori benigni a lenta crescita derivanti dalle cellule aracnoidee. Possono localizzarsi nella regione sellare o sovra-sellare e raggiungere notevoli dimensioni al momento della diagnosi.
Sono il più frequente tumore cerebrale primitivo di origine non gliale: rappresentano il 20% di tutte le neoplasie intra-craniche, con incidenza di 6/100.000/anno, e il più comune tumore della regione dopo gli adenomi ipofisari. Il picco di comparsa è doppio: il primo si osserva intorno all'età puberale, il secondo è intorno ai 60-70 anni, con frequenza doppia nelle femmine rispetto ai maschi (52). Esiste una forte associazione fra i meningiomi, la neurofibromatosi (con tumori multipli) e la pregressa esposizione a radiazioni ionizzanti (53).
Secondo la classificazione WHO, nel 90% dei casi sono tumori di grado I, nel 5-7% sono atipici (grado II) e nell’1-3% sono varianti anaplastiche (grado III) (53, 54). Qualunque tipo di meningioma, però, può avere un comportamento maligno, anche se questo è molto raro (55).
I meningiomi possono nascere da qualunque porzione della dura, più comunemente dove questa fa delle pieghe, sulla volta cranica e sul basicranio (14, 54). Nel 15-30% dei casi i meningiomi possono insorgere nella regione para-sellare (tubercolo sellare, seno cavernoso, planum sfenoidale, diaframma sellare, processi clinoidei). Raramente crescono completamente all’interno della sella, partendo dalla superficie inferiore del diaframma sellare o dal dorso sellare, ma anche dal pavimento o dalle pareti della sella turcica (2). I meningiomi intra e sovra-sellari possono assomigliare agli NFPA, con cefalea (sia frontale che orbitaria), disturbi visivi e anomalie endocrine (ipopituitarismo e iperPRL). Il sintomo più comune è la perdita della vista anche in assenza di disturbi endocrini, ma sono stati riportati casi di meningioma intra-sellare con presentazione simile all’apoplessia ipofisaria (56). Il deficit visivo può esordire con un offuscamento monoculare e progredire fino all’amaurosi bilaterale. Sono stati riportati diversi tipi di difetto campimetrico: dalla perdita della visione centrale o periferica fino a una variante asimmetrica dell’emianopsia bitemporale. Il calo della vista è più facilmente graduale che improvviso e si può osservare atrofia ottica senza dolore all’oculomozione, in contrasto con quanto osservato nella neurite retro-bulbare. Al contrario di quanto di osserva negli adenomi ipofisari, si può avere paralisi dei muscoli oculomotori estrinseci, con diplopia e parestesie urenti a carico delle branche trigeminali.
È stato riportato che i meningiomi possono crescere durante la gravidanza fino a diventare sintomatici (5).
Gli aspetti neuroradiologici sono spesso caratteristici, consentendo la diagnosi differenziale con gli altri tumori para-sellari (14).
Alla RM i meningiomi sono tipicamente isointensi in T1 e T2, con vivace impregnazione omogenea di mdc, talvolta estesa alla dura madre con il tipico segno della “coda durale” (ispessimento lineare della dura che prende il mdc e si allontana dalla convessità della lesione, in passato ritenuto patognomonico) (58). In alcuni casi i meningiomi possono presentare calcificazioni intra-lesionali e iperostosi adiacente alla base di impianto, reperti meglio evidenti all’esame TC. Nel 40% dei casi sono iperintensi in T2 (57). Meno comunemente possono evidenziarsi aree cistiche o di grasso (14).
Alla TC appaiono come lesioni iperdense a partenza dalla dura, con ampia base di impianto, margini ben definiti ed effetto contrastografico omogeneo. Possono riempire e dilatare i seni cavernosi. La calcificazione densa è suggestiva di meningioma, in particolare a livello del tubercolo sellare.
La sella è solitamente di dimensioni normali e l’ipofisi viene ben visualizzata. In caso di invasione del seno cavernoso da parte di un meningioma, il lume carotideo viene ridotto in modo maggiore rispetto ad altre lesioni della stessa regione, come l'adenoma ipofisario (59).
La diagnosi differenziale si pone principalmente con l’adenoma, che al contrario del meningioma presenta potenziamento meno intenso ed eterogeneo, con un time-to-peak più lungo. La ghiandola ipofisaria inoltre non è separata dalla lesione.
Riassumendo le principali caratteristiche del meningioma:
- epicentro: para-sellare/sovra-sellare;
- ipofisi distinguibile dalla lesione;
- sella turcica di normali dimensioni;
- segnale T1/T2 isointenso;
- potenziamento contrastografico rapido, netto, omogeneo, con “coda durale”;
- calcificazioni intra-lesionali evidenziabili in TC;
- “encasement” dell’arteria carotide interna.

Meningioma del piano etmoido-sfenoidale. RM, sequenze SE, immagini T1, sezione sagittale (A) e coronale (B), con mdc (B). L’immagine A evidenzia una voluminosa lesione a larga base d’impianto sul piano etmoido-sfenoidale, a contorni definiti e caratterizzata da vivace impregnazione contrastografica. La TC, senza mdc (C), evidenzia sia un’iperostosi in corrispondenza della base d’impianto, sia una grossolana calcificazione intra-lesionale, reperti questi patognomonici per meningioma. Solo il polo posteriore dell’espanso invade (A) parzialmente il cavo sellare, che mantiene morfologia e dimensioni ai limiti nella norma. L’ipofisi risulta compressa, ma non inglobata.

Meningioma del diaframma sellare. RM, sequenze SE, sezioni coronali T1, senza (A) e con (B) mdc e T2 (C). In A lesione espansiva a base d’impianto sul diaframma sellare e a sviluppo prevalente sovra-sellare, con estensione al seno cavernoso destro e modesta invasione del cavo sellare, condizionante una compressione dell’ipofisi che permane dissociabile dalla lesione. L’immagine T2 coronale (C) ben evidenzia il parenchima ipofisario compresso inferiormente ed il chiasma ottico armonicamente dislocato superiormente. In B la caratteristica vivace impregnazione contrastografica del meningioma

Meningioma: RM assiale T2 (in alto a sinistra), coronale T1 (in basso a sinistra) e assiale e coronale T1 con Gd (al centro):
Sequenza RM con mdc con ricostruzione MIP (a destra): coinvolgimento carotide interna con stenosi vascolare (frecce)
Queste lesioni possono rimanere stabili a lungo. In tal caso è opportuno limitarsi al solo monitoraggio con RM seriate. In presenza di sintomi o di crescita, il trattamento di scelta è chirurgico. Nella maggior pare dei casi l’approccio è trans-cranico, ma negli ultimi anni sta guadagnando consensi l’approccio TNS endoscopico extended (60) e quello radiochirurgico. In ambiente NCH è quindi vivace il dibattito sull’approccio più adeguato. Anche se si tratta di lesioni benigne, i meningiomi possono essere localmente aggressivi fino a inglobare e talvolta occludere la carotide. Inoltre possono recidivare dopo resezione incompleta: nel 7–20% dei tumori di grado I, nel 39–40% degli atipici e nel 50–78% degli anaplastici (55). L’istologia maligna si associa a scarsa prognosi (sopravvivenza < 2 anni) (53).
Viene impiegata anche la radiochirurgia, o come trattamento primario di piccoli tumori (< 3 cm) o come terapia del residuo o della recidiva post-NCH (5). Al giorno d’oggi viene considerata il trattamento di prima scelta nella prevenzione della crescita dei piccoli tumori asintomatici, di frequente riscontro in epoca RM.
Vista la presenza di recettori intra-tumorali specifici (61), è in valutazione il trattamento radio-metabolico con analoghi marcati della somatostatina (62).
La presenza di recettori per estrogeni e progesterone sulle cellule tumorali costituisce infine motivo di controversia sull’opportunità di un trattamento estro-progestinico nelle giovani donne con ipogonadismo iatrogeno post-radiochirurgia (63).
Paragangliomi (64)
Detti anche glomangiomi, sono rari tumori benigni capsulati (grado I WHO), derivanti da cellule specializzate della cresta neurale, associate ai gangli del sistema nervoso autonomo, dimostrate anche nell’ipofisi (65). Il 5% dei paragangliomi del SNC metastatizza. I sintomi di presentazione sono aspecifici (effetto massa e ipopituitarismo).
La RM dimostra una lesione altamente vascolarizzata con un caratteristico aspetto “sale e pepe” in T1: il sale corrisponde alle aree intra-parenchimali di intenso segnale secondarie ad emorragia subacuta; il pepe è in zone di basso segnale per flusso ad alta velocità. La TC con finestra ossea mostra un aspetto tarlato delle pareti sellari. Prima della resezione di un tumore così altamente vascolarizzato, è necessario eseguire sempre sia TC che RM che angiografia, alla ricerca di altre possibili localizzazioni di un tumore multi-centrico.
Lipoma
I lipomi sono tumori grassosi benigni, che possono comparire anche nella regione sellare, come lesioni adese alla superficie dell’infundibolo, al pavimento del III ventricolo o ai nervi cranici adiacenti (14). Sono solitamente di riscontro incidentale.
Alla neuroradiologia appaiono come lesioni non contrastate omogenee e ben delimitate, con possibile rima calcificata, che scompaiono nelle sequenze con soppressione del grasso (14).
Non hanno bisogno di nessun tipo di trattamento.

Lipoma del tuber cinereum, che si evidenzia come lesione ovoidale, iperintensa in T1 (a), che scompare nelle sequenze T1 con soppressione del grasso (b)(grazie a Paola Doneda, MI).
Schwannomi/neurinomi
Sono tumori a lenta crescita (grado I WHO) che derivano dalle cellule di Schwann delle guaine nervose. Sono molto rari nella regione para-sellare, solitamente di derivazione dalla 1° o 2° branca del trigemino o dai nervi oculomotori (19,66). Sono associati nel 60% dei casi alla neurofibromatosi 2.

Schwannoma del 5° nc. RM con immagine coronale T1 con mdc. Lesione espansiva parasellare destra intra-cavernosa ovalare a contorni definiti, caratterizzata da impregnazione contrastografica disomogenea per la presenza di diffuse componenti cistico-necrotiche. La lesione determina iniziale invasione del cavo sellare con lieve dislocazione a sinistra dell'ipofisi e del peduncolo, che hanno caratteristiche comunque normal per morfologia e segnale. Le caratteristiche morfologiche e di segnale della lesione, ma soprattutto il contesto clinico (nevralgia trigeminale) orientano sulla diagnosi.
Gangliocitomi
I gangliocitomi o tumori a cellule ganglionari sono rari tumori benigni della regione sellare o sovra-sellare. Possono essere a composizione neuronale pura o più frequentemente misti con tessuto neuronale e adenomatoso (67).
Compaiono negli adulti, più frequentemente nelle femmine. Circa il 75% dei pazienti con gangliocitomi ipofisari hanno ipersecrezione di ormoni ipotalamici: GHRH con conseguente ipersecrezione di GH e acromegalia, o più raramente CRH con ipersecrezione di ACTH e sindrome di Cushing. Possono anche provocare effetto massa locale.
Alla RM non sono distinguibili dai macroadenomi ipofisari (5).
BIBLIOGRAFIA
- Brat DJ, Scheithauer BW, Staugaitis SM, et al. Pituicytoma: a distinctive low-grade glioma of the neurohypophysis. Am J Surg Pathol 2000, 24: 362-8.
- Huang BY, Castillo M. Nonadenomatous tumors of the pituitary and sella turcica. Top Magn Res Imaging 2005, 16: 289-99.
- Glezer A, Belchior Paraiba D, et al. Rare sellar lesions. Endocrinol Metab Clin North Am 2008, 37: 195-211.
- Kowalski RJ, Pravson RA, Mayberg MR. Pituicytoma. Ann Diagn Pathol 2004, 8: 290–4.
- Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 1999, 28: 81-117.
- Kaltsas GA, Evanson J, Chrisoulidou A, et al. The diagnosis and management of parasellar tumours of the pituitary. Endocr Related Cancer 2008, 15: 885–903.
- Cohen-Gadol AA, Pichelmann MA, Link MJ, et al. Granular cell tumor of the sellar and suprasellar region: clinicopathologic study of 11 cases and literature review. Mayo Clin Proc 2003, 78: 567–73.
- Bubl R, Hugo HH, Hempelmann RG, et al. Granular-cell tumour: a rare suprasellar mass. Neuroradiology 2001, 43: 309-12.
- Iglesias A, Arias M, Brasa J, et al. MR imaging findings in granular cell tumor of the neurohypophysis: a difficult preoperative diagnosis. Eur Radiol 2000, 10: 1871-3.
- Black KL, Pikul BK. Gliomas-past, present, and future. Clin Neurosurg 1999, 45: 160–3.
- Guillamo JS, Doz F, Delattre JY. Brain stem gliomas. Curr Opin Neurol 2001, 14: 711–5.
- Kitange GJ, Templeton KL, Jenkins RB. Recent advances in the molecular genetics of primary gliomas. Curr Opin Oncol 2003, 15: 197–203.
- Kornreich L, Blaser S, Schwarz M, et al. Optic pathway glioma: correlation of imaging findings with the presence of neurofibromatosis. AJNR Amer J Neuroradiol 2001, 22: 1963-9.
- Smith JK. Parasellar tumors: suprasellar and cavernous sinuses. Top Magn Res Imaging 2005, 16: 307-15.
- Packer RJ, Cohen BH, Cooney K. Intracranial germ cell tumors. The Oncologist 2000, 5: 312-20.
- Janmohamed S, Grossman AB, Metcalfe K, et al. Suprasellar germ cell tumours: specific problems and the evolution of optimal management with a combined chemoradiotherapy regimen. Clin Endocrinol 2002, 57: 487–500.
- Calaminus G, Bamberg M, Harms D, et al. AFP/β-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics 2005, 36: 71–7.
- Matsutani M, Sano K, Takakura K, et al. Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases. J Neurosurg 1997, 86: 446–55.
- Rennert J, Doerfler A. Imaging of sellar and parasellar lesions. Clin Neurol Neurosurg 2007, 109: 111–24.
- Sumida M, Uozumi T, Kiya K, et al. MRI of intracranial germ cell tumours. Neuroradiology 1995, 37: 32-7.
- Giustina A, Gola M, Doga M, et al. Primary lymphoma of the pituitary: an emerging clinical entity. J Clin Endocrinol Metab 2001, 86: 4567–75.
- Moshkin O, Muller P, Scheithauer BW, et al. Primary pituitary lymphoma: a histological, immunohistochemical, and ultrastructural study with literature review. Endocr Pathol 2009, 20: 46-9.
- Pels H, Deckert-Schluter M, Glasmacher A, et al. Primary central nervous system lymphoma: a clinicopathological study of 28 cases. Hematol Oncol 2000, 18: 21–32.
- Liu JK, Sayama C, Chin SS, et al. Extranodal NK/T-cell lymphoma presenting as a pituitary mass. Case report and review of the literature. J Neurosurg 2007, 107: 660–5.
- Erdag N, Bhorade RM, Alberico RA, et al. Primary lymphoma of the central nervous system: typical and atypical CT and MRI appearances. AJR Amer J Roentgenol 2001, 176: 1319-26.
- Johnson BA, Fram EK, Johnson PC, et al. The variable MR appearance of primary lymphoma of the central nervous system: comparison with histopathologic features. AJNR Amer J Neuroradiol 1997, 18: 563-72.
- Buhring U, Herrlinger U, Krings T, et al. MRI features of primary central nervous system lymphomas at presentation. Neurology 2001, 57: 393–6.
- Castagna A, Cinque P, d’Amico A, et al. Evaluation of contrast-enhancing brain lesions in AIDS patients by means of Epstein-Barr virus detection in cerebrospinal fluid and 201 thallium single photon emission tomography. AIDS 1997, 11: 1522–3.
- Komninos J, Vlassopoulou V, Protopapa D, et al. Tumors metastatic to the pituitary gland: case report and literature review. J Clin Endocrinol Metab 2004, 89: 574–80.
- Laigle-Donadey F, Taillibert S, Martin-Duverneuil N, et al. Skull-base metastases. J Neurooncol 2005, 75: 63–9.
- Thodou E, Kontogeorgos G, Scheithauer BW, et al. Intrasellar chordomas mimicking pituitary adenoma. J Neurosurg 2000, 92: 976–82.
- Erdem E, Angtuaco EC, Van Hemert R, et al. Comprehensive review of intracranial chordoma. Radiographics 2003, 23: 995-1009.
- Gehanne C, Delpierre I, Damry N, et al. Skull base chordoma: CT and MRI features. JBR-BTR 2005, 88: 325-37.
- Korten AG, Berg HJ, Spincemaille GH, et al. Intracranial chondrosarcoma: review of the literature and report of 15 cases. J Neurol Neurosurg Psychiatry 1998, 65: 88–92.
- Meyers SP, Hirsch WL Jr, Curtin HD, et al. Chondrosarcomas of the skull base: MR imaging features. Radiology 1992, 184: 103–8.
- Prosch H, Grois N, Bokkerink J, et al. Central diabetes insipidus: is it Langerhans cell histiocytosis of the pituitary stalk? A diagnostic pitfall. Pediatr Blood Cancer 2006, 46: 363–6.
- Grois N, Prayer D, Prosch H, et al. Course and clinical impact of magnetic resonance imaging findings in diabetes insipidus associated with Langerhans cell histiocytosis. Pediatr Blood Cancer 2004, 43: 59–65.
- Horn E, Coons SW, Spetzler RF, et al. Isolated Langerhans cell histiocytosis of the infundibulum presenting with fulminant diabetes insipidus. Childs Nerv Syst 2006, 22: 542–4.
- Kim JR, Yoon HM, Jung AY, et al. Comparison of whole-body MRI, bone scan, and radiographic skeletal survey for lesion detection and risk stratification of Langerhans cell histiocytosis. Sci Rep 2019, 9: 317.
- Lury KM. Inflammatory and infectious processes involving the pituitary gland. Top Magn Res Imaging 2005, 16: 301-6.
- Rumboldt Z, Gnjidic Z, Talan-Hranilovic J, et al. Intrasellar hemangioblastoma: characteristic prominent vessels on MR imaging. AJR Amer J Roentgenol 2003, 180: 1480-1.
- Jalali R, Srinivas C, Nadkarni TD, et al. Suprasellar haemangiopericytoma – challenges in diagnosis and treatment. Acta Neurochir 2008, 150: 67–71.
- Lopes MB, Lanzino G, Cloft HJ, et al. Primary fibrosarcoma of the sella unrelated to previous radiation therapy. Modern Pathol 1998, 11: 579–84.
- Jalalah S, Kovacs K, Horvath E, et al. Rhabdomyosarcoma in the region of the sella turcica. Acta Neurochir 1987, 88: 142-6.
- Furlanetto TW, Faria Pitta Pinheiro C, Oppitz PP, et al. Solitary fibrous tumor of the sella mimicking pituitary adenoma: an uncommon tumor in a rare location—a case report. Endocr Pathol 2009, 20: 56-61.
- Sajko T, Rumboldt Z, Talan-Hranilovic J, et al. Primary sellar esthesioneuroblastoma. Acta Neurochir 2005, 147: 447-8.
- Scheithauer BW, Kovacs K, Horvath E, et al. Pituitary blastoma. Acta Neuropathol 2008, 116: 657–66.
- Ohba S, Yoshida K, Hirose Y, et al. A supratentorial primitive neuroectodermal tumor in an adult: a case report and review of the literature. J Neurooncol 2008, 86: 217–24.
- Mukhida K, Asa A, Gentili F, et al. Ependymoma of the pituitary fossa. Case report and review of the literature. J Neurosurg 2006, 105: 616–20.
- Sinnott BP, Hatipoglu B, & Sarne DH. Intrasellar plasmacytoma presenting as a non-functional invasive pituitary macro-adenoma: case report & literature review. Pituitary 2006, 9: 65–72.
- Rousseau A, Bernier M, Kujas M, et al. Primary intracranial melanocytic tumor simulating pituitary macroadenoma: case report and review of the literature. Neurosurgery 2005, 57: E369.
- Bondy M, Ligon BL. Epidemiology and etiology of intracranial meningiomas: a review. J Neurooncol 1996, 29: 197-205.
- Hartmann C, Bostrom J, Simon M. Diagnostic and molecular pathology of meningiomas. Expert Rev Neurother 2006, 6: 1671–83.
- Whittle IR, Smith C, Navoo P, et al. Meningiomas. Lancet 2004, 363: 1535–43.
- Ko KW, Nam DH, Kong DS, et al. Relationship between malignant subtypes of meningioma and clinical outcome. J Clin Neurosci 2007, 14: 747–53.
- Orakdogeny M, Karadereler S, Berkman Z, et al. Intra-suprasellar meningioma mimicking pituitary apoplexy. Acta Neurochir 2004, 146: 511-5.
- Karavitaki N, Wass JAH. Non-adenomatous pituitary tumours. Best Pract Res Clin Endocrinol Metab 2009, 23: 651–65.
- Guermazi A, Lafitte F, Miaux Y, et al. The dural tail sign-beyond meningioma. Clin Radiol 2005, 60: 171–88.
- Young SC, Grossman RI, Goldberg HI, et al. MR of vascular encasement in parasellar masses: comparison with angiography and CT. AJNR Amer J Neuroradiol 1988, 9: 35–8.
- Cappabianca P, Cirillo S, Alfieri A, et al. Pituitary macroadenoma and diaphragma sellae meningioma: differential diagnosis on MRI. Neuroradiology 1999, 41: 22-6.
- Arena S, Barbieri F, Thellung S, et al. Expression of somatostatin receptor mRNA in human meningiomas and their implication in in vitro antiproliferative activity. J Neurooncol 2004, 66: 155-66.
- Bartolomei M, Bodei L, De Cicco C, et al. Peptide receptor radionuclide therapy with 90Y-DOTATOC in recurrent meningioma. Eur J Nucl Med Molec Imaging 2009, 36: 1407-16.
- Pravdenkova S, Al-Mefty O, Sawyer J, et al. Progesterone and estrogen receptors: opposing prognostic indicators in meningiomas. J Neurosurg 2006, 105: 163-73.
- Naggara O, Varlet P, Page P, et al. Suprasellar paraganglioma: a case report and review of the literature. Neuroradiology 2005, 47: 753–7.
- Boari N, Losa M, Mortini P, et al. Intrasellar paraganglioma: a case report and review of the literature. Acta Neurochir 2006, 148: 1311–4.
- Sarma S, Sekhar LN, Schessel DA. Nonvestibular schwannomas of the brain: A 7-year experience. Neurosurgery 2002, 50: 437-48.
- Geddes JF, Jansen GH, Robinson SF, et al. “Gangliocytomas” of the pituitary: a heterogeneous group of lesions with differing histogenesis. Am J Surg Pathol 2000, 24: 607-13.
- Attanasio R, Cozzi R, Lasio G, Barbò R. Diagnostic evaluation of the lesions of the sellar and parasellar region. In "Explicative Cases of Controversial Issues in Neurosurgery, Signorelli F (Ed), ISBN: 978-953-51-0623-4, InTech, http://www.intechopen.com/books/explicative-cases-of-controversial-issues-in-neurosurgery/the-diagnostic-evaluation-of-the-lesions-of-the-sellar-and-parasellar-region.
Altre lesioni della regione ipotalamo-ipofisaria
Roberto Attanasio1, Renato Cozzi2, Giovanni Lasio3 & Regina Barbò4
1Endocrinologia, Istituto Galeazzi, Milano
2Endocrinologia, Ospedale Niguarda, Milano
3Neurochirurgia, Istituto Humanitas, Milano
4Neuroradiologia, Gavazzeni-Humanitas, Bergamo
LESIONI VASCOLARI
Aneurismi
Gli aneurismi della regione sellare rappresentano circa il 10% di tutti quelli intra-cranici. Hanno origine di solito dalle carotidi intra-cavernose, infra o sovra-clinoidee, ma anche dalle arterie comunicanti anteriori o posteriori o dalle arterie oftalmiche.
Gli aneurismi della regione para e sovra-sellare possono talvolta essere di grandi dimensioni e comprimere il nervo ottico e/o il chiasma, determinando calo visivo. Possono anche estendersi nella sella, provocando modesta iperPRL e ipopituitarismo per compressione diretta (1).
Gli aneurismi intra-sellari hanno solitamente localizzazione eccentrica e possono assomigliare a masse parenchimali. La diagnostica per immagini è essenziale per una diagnosi differenziale prima di andare alla chirurgia. L’aspetto dipende dalla quantità di calcificazione e trombosi intra-luminale. Un aneurisma gigante può provocare allargamento e distruzione della sella. Anche se la TC non può distinguere con sicurezza un aneurisma da altri tipi di lesione, è suggestiva una presa di contrasto molto omogenea ed intensa(2). Alla RM l’aneurisma si vede contiguo ai vasi, con margini ben definiti e aspetto eterogeneo (3). La sacca aneurismatica può apparire, a seconda della velocità del flusso vascolare, come vuoto di flusso oppure come uno spot intensamente contrastato che corrisponde al lume vero residuo. Il lume può essere in parte trombizzato, con strati ad anello o semiluna di prodotti ematici o fibrosi di età differente, che appaiono eterogenei in T1 e soprattutto ipointensi in T2. Possono evidenziarsi calcificazioni ad arco o ad anello, soprattutto alla periferia. La rima parietale calcifica è caratteristica, ma può ricordare anche il craniofaringioma. In alcuni casi gli aneurismi si associano ad adenomi ipofisari (4).
Ogni volta che si sospetta un aneurisma, bisogna fare uno studio angiografico, con TC, MR o angiografia digitale a sottrazione di immagine. Quest’ultima rappresenta il gold standard, perché consente anche l’embolizzazione nella stessa seduta in caso di necessità.

Aneurisma carotideo. TC encefalo senza mdc con sezioni assiali a livello del cavo sellare, con finestra per i tessuti molli (a) e in algoritmo osseo (b). Presenza di lesione espansiva (freccia rossa) con epicentro in regione sellare-parasellare sinistra di morfologia ovalare, condizionante armonico rimodellamento osseo con ampliamento del cavo sellare e slivellamento del pavimento. C e D immagini in RM con sezioni coronali T1 con mdc (c) e T2 (d). In C la lesione risulta a sede extra-parenchimale, a partenza dal tratto intra-cavernoso del sifone carotideo. La lesione ha eroso la parete laterale sinistra della sella, che risulta parzialmente invasa con compressione e dislocazione destra di adenoipofisi e peduncolo (freccia gialla). Entrambe le immagini RM documentano il flow-void del sifone carotideo marcatamente ipointenso (assenza segnale, freccia verde), mentre la sacca aneurismatica risulta disomogeneamente ipo-iperintensa per flusso nettamente rallentato disomogeneo (freccia rossa). L'angiografia digitale (e) conferma un voluminoso aneurisma sacciforme (freccia rossa) a origine dal tratto intra-cavernoso del sifone carotideo sinistro.

Fistola carotido-cavernosa. Angiografia digitale con proiezione laterale (a, b) e frontale (c, d). Nelle immagini di partenza (a, c) lo studio selettivo della carotide interna destra evidenzia nella fase arteriosa un aumento del blush in corrispondenza del seno cavernoso, con opacizzazione anche della vena oftalmica superiore e del plesso venoso orbitario e cavernoso. Questa immagine è patognomonica. Nelle immagini post-trattamento endovascolare (b, d) è scomparso il blush patologico nel seno cavernoso con ripristino della normale morfologia del sifone carotideo e dell'arteria oftalmica, senza patologica visualizzione precoce dei seni cavernosi e petrosi.
Trombosi del seno cavernoso
È molto rara, spesso di origine iatrogena o settica.
Agli esami neuroradiologici si evidenzia ingrandimento del seno cavernoso, con difetti di riempimento e impregnazione contrastografica incompleta. Il segnale intra-cavernoso del trombo è intenso alla RM. Inoltre possono esserci edema peri-orbitario, esoftalmo o dilatazione della vena oftalmica superiore (2).

Emangioma. RM, sezioni sagittale (A), coronale (B) e assiale (C), sequenza T1 con mdc. Voluminosa lesione espansiva polilobata, con epicentro a sede parasellare destra, sviluppo prevalente in fossa cranica media, espansione intra-cavernosa, endo- e sovra-sellare, con invasione dell’orbita. La vivace impregnazione contrastografica e la presenza di “flow void” intra-lesionali testimoniano la natura altamente vascolarizzata della lesione (grazie a Cristina Agostinis).
LESIONI DOPPIE
Il termine (in inglese “collision lesions”) si riferisce alla presenza contemporanea di 2 diversi tumori o per estensione anche di 2 lesioni di diversa natura (neoplastica, vascolare, congenita, flogistico/infiammatoria).
Nella maggior parte dei casi si tratta della coesistenza di un adenoma ipofisario con una seconda lesione (craniofaringioma, cisti aracnoidea, cisti epidermoide, ipofisite) oppure di una lesione sarcoidosica all’interno di un adenoma ipofisario o di una metastasi all’interno di un adenoma ipofisario (5).
Si tratta comunque di evenienze molto rare. In una grossa casistica chirurgica (oltre 3000 adenomi ipofisari) gli adenomi doppi rappresentavano lo 0.37% (6). Gli stessi autori, nella maggiore casistica autoptica riportata, hanno identificato 20 casi di adenomi multipli su oltre 9300 ipofisi esaminate (7).
Gli adenomi doppi possono essere distinti in contigui e separati. Nel primo caso la diagnosi viene fatta all’immuno-istochimica e alla microscopia elettronica solo dopo l’asportazione di quello che veniva ritenuto essere un tumore unico (8). I più frequenti fra gli adenomi doppi (nell’ambito della rarità) sono i GH-secernenti, poi gli ACTH-secernenti.

Lesione doppia. Le immagini RM in T1 mostrano una lesione nodulare intra-sellare destra relativamente ipointensa (microadenoma, freccia rossa), adiacente a una massa sovrasellare (meningioma del diaframma sellare, freccia gialla).
BIBLIOGRAFIA
- Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 1999, 28: 81-117.
- Rennert J, Doerfler A. Imaging of sellar and parasellar lesions. Clin Neurol Neurosurg 2007, 109: 111–24.
- Glezer A, Belchior Paraiba D, et al. Rare sellar lesions. Endocrinol Metab Clin North Am 2008, 37: 195-211.
- Smith JK. Parasellar tumors: suprasellar and cavernous sinuses. Top Magn Res Imaging 2005, 16: 307-15.
- Koutourousiou M, Kontogeorgos G, Wesseling P, et al. Collision sellar lesions: experience with eight cases and review of the literature. Pituitary 2010, 13: 8-17.
- Kontogeorgos G, Scheithauer BW, Horvath E, et al. Double adenomas of the pituitary: a clinicopathological study of 11 tumors. Neurosurgery 1992, 31: 840–9.
- Kontogeorgos G, Kovacs K, Horvath E, et al. Multiple adenomas of the human pituitary. A retrospective autopsy study with clinical implications. J Neurosurg 1991, 74: 243–7.
- Kim K, Yamada S, Usui M, et al. Preoperative identification of clearly separated double pituitary adenomas. Clin Endocrinol 2004, 61: 26–30.
- Attanasio R, Cozzi R, Lasio G, Barbò R. Diagnostic evaluation of the lesions of the sellar and parasellar region. In "Explicative Cases of Controversial Issues in Neurosurgery, Signorelli F (Ed), ISBN: 978-953-51-0623-4, InTech, http://www.intechopen.com/books/explicative-cases-of-controversial-issues-in-neurosurgery/the-diagnostic-evaluation-of-the-lesions-of-the-sellar-and-parasellar-region.
Overview su clinica e diagnosi differenziale delle lesioni della regione ipotalamo-ipofisaria
Roberto Attanasio1, Renato Cozzi2, Giovanni Lasio3 & Regina Barbò4
1Endocrinologia, Istituto Galeazzi, Milano
2Endocrinologia, Ospedale Niguarda, Milano
3Neurochirurgia, Istituto Humanitas, Milano
4Neuroradiologia, Gavazzeni-Humanitas, Bergamo
con aggiornamento dicembre 2022 a cura di Alessandro Bozzao, Serena Palizzi, Valentina Frezza, Sara De Giorgi
Sapienza Università di Roma, Facoltà di Medicina e Psicologia, Dipartimento NESMOS (Neuroscienze, Salute Mentale, Organi di Senso)
UOC Neuroradiologia, AO "Sant'Andrea", Roma
La diagnosi differenziale tra le varie patologie, neoplastiche e non, potenzialmente in grado di colpire la regione para-sellare è fondamentale. Dovrebbe essere fatta insieme dall’endocrinologo, dal neurochirurgo e dal neuroradiologo.
Il rilievo neuroradiologico di una massa sellare non è sempre equivalente a una diagnosi di adenoma ipofisario, anche se questa è la patologia più frequente. La valutazione corretta delle possibili alternative è quindi fondamentale nel pianificare la strategia terapeutica più appropriata. Alcune lesioni, anche neoplastiche, non necessitano di intervento NCH, a meno che non vi sia la necessità di una decompressione urgente. La diagnosi pre-operatoria consente la scelta del trattamento necessario, compresa la strategia chirurgica, dall’approccio (TNS o transcranico) al tipo di intervento (di minima o demolitivo). La combinazione di dati epidemiologici, clinici e di immagine consente di restringere progressivamente la lista delle possibili diagnosi.
DATI CLINICI
La presenza di cefalea e disfunzioni ormonali non è di grande aiuto nella diagnosi differenziale, a meno che non via qualche tipo di ipersecrezione (1).
L’esame neuro-oftalmologico è il primo che evidenzia il sospetto di una lesione, ma non ha nessun valore nella diagnosi differenziale. Alcuni classici difetti campimetrici sono correlati alla localizzazione della lesione rispetto alle vie ottiche (2):
- lesioni ad estensione sovra-sellare, come gli adenomi e le cisti della tasca di Rathke, causano la tipica emianopsia bitemporale per compressione dal basso del chiasma;
- lesioni che nascono nella zona sovra-sellare, come i meningiomi, possono presentarsi con incisure campimetriche bitemporali da compressione chiasmatica superiore;
- lesioni pre-chiasmatiche, come i meningiomi della guaina dell’ottico, possono produrre perdita visiva monolaterale;
- lesioni che comprimono il sistema visivo più posteriormente lungo i tratti ottici, come meningiomi o aneurismi, provocano emianopsia omonima.
Il diabete insipido è molto più raro in un adenoma ipofisario alla presentazione (3%) rispetto a lesioni non adenomatose (11%) (3). Nella nostra esperienza il diabete insipido si associa all’adenoma soprattutto se questo è andato incontro ad apoplessia, completa o parziale. La presenza di diabete insipido deve quindi sempre far pensare a diagnosi alternative, tra cui le più frequenti sono il craniofaringioma, le metastasi e la sarcoidosi. Il deficit di ADH può anche essere parziale o transitorio (per la rigenerazione spontanea delle fibre) o avere un apparente miglioramento in concomitanza allo sviluppo di iposurrenalismo centrale (2).
L’insorgenza acuta di neuropatia a carico dei nervi cranici spesso accompagna l’apoplessia, ma la presenza di oftalmoplegia alla presentazione di una massa sellare o para-sellare deve far pensare a possibili diagnosi alternative (2).
Nei tumori voluminosi si può osservare disfunzione ipotalamica (eccezionalmente rara negli adenomi), con deficit di sviluppo somatico e sessuale nei bambini e alterazione del meccanismo di controllo dell’appetito/sazietà negli adulti (2).
DIAGNOSTICA PER IMMAGINI
Calcificazioni intra-tumorali si osservano soprattutto nei craniofaringiomi, ma possono essere presenti anche in meningiomi, teratomi, gliomi, tumori di origine cartilaginea, e perfino in aneurismi e adenomi ipofisari (2).
Tumori di origine cartilaginea e metastasi danno una tipica distruzione ossea del basicranio.
L’ispessimento del peduncolo può essere rilevato in diverse patologie: ipofisiti, germinomi, linfomi, istiocitosi, TBC, sarcoidosi (4).
Il clivus può essere coinvolto da cordomi, condro-sarcomi, emangio-pericitomi, meningiomi, linfomi, plasmocitomi, paragangliomi e metastasi (5).
Gli aspetti chiave da prendere in considerazione sono però la localizzazione (mediana o eccentrica) e la consistenza (soprattutto solida o cistica).
| Tabella 1 Distribuzione del tipo di lesione secondo consistenza e localizzazione |
|||
| Localizzazione | |||
| Sulla linea mediana | Lontano dalla linea mediana | ||
| Consistenza | Solida | Adenoma Ipofisite Germinoma Linfoma Cordoma Metastasi |
Meningioma Condroma Schwannoma Glioma Istiocitosi di Langerhans (Metastasi) |
| Cistica | Craniofaringioma Cisti di Rathke Cisti aracnoidee Ascesso |
(Ascesso) Micosi |
|
Le tabelle successive evidenziano in modo sinottico gli aspetti chiave delle diverse lesioni parasellari (2,3,5-14):
- dal punto di vista clinico;
| TABELLA 2 ASPETTI CLINICI DELLE DIFFERENTI LESIONI |
||||||||
| LESIONE | LINEA MEDIANA | LOCALIZZAZIONE | ETÀ | SESSO | DI* | IPOPIT° | IPOPRL§ | PARALISI NC# |
| Amartoma | Sì | Para-sellare o intra-ipotalamica, tuber cinereum | Infanzia | |||||
| Aneurisma | No | Seno cavernoso | 30-60 aa | F | Possibile | |||
| Apoplessia ipofisaria | Sì | Centrale sulla sella | 30-50 aa | M | Raro | Frequente | Sì | Frequente oculomotori |
| Ascesso | Sì | Intra-sellare | Frequente | Frequente | Sì (iper) | |||
| Carcinoma ipofisario | Sì | Non diversa dall’adenoma, eccetto per la presenza di metastasi | ||||||
| Cisti aracnoidea | Sì | Sovra-sellare | Infanzia | Comune | ||||
| Cisti della tasca di Rathke | Sì | Intra-sellare (e sovra-sellare) | 40-50 aa | F | Raro | Possibile | ||
| Cisti dermoide | Sì | Sellare/para-sellare/sovra-sellare, regione fronto-nasale, fossa posteriore | 20-30 aa | F | ||||
| Cisti epidermoide | No | Intra- e para-sellare | 30-50 aa | M | Possiblie | |||
| Condrosarcoma | No | Fessura petro-occipitale | ||||||
| Cordoma | Sì | Clivus | 30-50 aa | Insolito | Frequente | |||
| Coristoma | Sì | Intra- e sovra-sellare | 40-50 aa | Raro | Comune | |||
| Craniofaringioma | Sì | Sovra- e/o intra-sellare | 5-14 aa e 50-74 aa | Frequente | Comune | Possiblie | ||
| Gangliocitoma | Sì | Intra- e sovra-sellare | Adulti | F | No (iper+) | |||
| Glioma | No | Nervo ottico/ipotalamo | Infanzia o giovani adulti/ ipotalamico nella prima infanzia |
Possibile |
||||
| Ipofisite | Sì | Intra-sellare e peduncolo | Peri-gravidica se linfocitica, anziano se granulomatosa | F | Comune | Frequente | Possibile | Rara |
| Istiocitosi a cellule di Langerhans | Sì, se ipotalamico | Ipotalamo (anche localizzazioni a livello dei nuclei dentati o masse intra-assiali) | < 15 aa in 2/3 | M | Frequente | Comune | ||
| Linfoma | Sì | Intra- o sovra-sellare, seno cavernoso | 50-70 aa | M | Comune | Frequente | Possiblie | |
| Lipoma | Sì | Superficie dell’infundibolo, pavimento del III ventricolo o nervi cranici adiacenti, cisterna quadrigemina, peri-calloso | Congenita | |||||
| Meningioma | No | Qualunque punto della dura | 50-70 aa | F | Comune | Infrequente | ||
| Metastasi | Sì/no | Lobo posteriore e infundibolo | Solitamente anziani | Frequente | Comune | Iper | Comune | |
| Mucocele | Sì | Seno sfenoidale con estensione para- e sovra-sellare, naso-faringea, orbitale, clivale o etmoidale | Insolito | Comune | ||||
| NFPA | Sì | Centrale sulla sella | 20-50 aa | > F | Molto raro | Possibile | No | Rara |
| Pituicitoma | Sì | Intra- e/o sovra-sellare o peduncolo | 40-60 aa | F | Raro | Frequente | No | |
| Sarcoidosi | Sì | Sovra-sellare | 30-40 aa | F | Comune | Iper | Possibile | |
| Schwannoma | No | Seno cavernoso | Adulti | F | ||||
| Tubercoloma | No | Intra- o sovra-sellare (seni paranasali, clivus) | ||||||
| Tumore a cellule germinali | Sovra-sellare (+ pineale) o intra-sellare, pavimento III ventricolo e peduncolo | Bambini e adolescenti | F se sovra-sellare M se pineale |
Frequente | Frequente | Possibile | ||
| * Diabete insipido; ° Ipopituitarismo; § Deficit di PRL; # Paralisi dei nervi cranici; + Ipersecrezione | ||||||||
- dal punto di vista della diagnostica per immagini.
| TABELLA 3 AIMAGING DELLE DIVERSE LESIONI: PER OGNUNA È RIPORTATO L’ASPETTO PIÙ COMUNEIONI |
||||||||
| LESIONE | CONSISTENZA | TC basale |
CAPTAZIONE MdC TC |
CALCIFICAZIONI | RM T1 |
RM T2 |
RM Gd |
NOTE |
| Amartoma | Solida (sessile o peduncolata) | Isodensa | No | Occasionali | Peduncolo isointenso (ipointenso) | Iperintensa | No | Pubertà precoce, convulsioni Spettroscopia: NAA/Cr ridotto, mioinositolo aumentato, Cho/Cr aumentato rispetto all’amigdala |
| Aneurisma | Mista | Isodensa a iperdensa | Impregnazione intensa e omogenea | Rima | Mista, ipointensa | Mista, ipointensa | Brillante, omogeneo | Vuoto di flusso |
| Apoplessia ipofisaria | Solida (mista) | Possibile ESA, iperdensa se emorragia di grandi dimensioni | Minima o assente | No | Acuta: ipointensa (ischemica); isointensa poi iperintensa (emorragica) | Acuta: iperintensa (ischemica); iso-ipointensa (emorragica) | Rima (spesso periferica con nucleo centrale emorragico, difficile identificare ipersegnale neuro-ipofisi in T1) | DWI: diffusione ristretta (componenti solide) |
| Ascesso | Cistica | Ipodensa, ingrandimento ed erosione sellare | Rima | No | Ipointensa o isointensa | Iperintensa o isointensa | Rima (pareti ispessite) | DWI: diffusione ristretta |
| Carcinoma ipofisario | Non diversa dall’adenoma eccetto per la presenza di metastasi | |||||||
| Cisti aracnoidea | Cistica | Ipodensa | No | No | Isointensa al liquor | Isointensa al liquor | No | |
| Cisti della tasca di Rathke | Cistica | Ipodensa, isodensa, mista | No | Parietali nel 10-15% dei casi | Ipointensa, raramente iso-iperintensa | Iperintensa (isointensa), con piccoli noduli ipointensi | Ad anello solo se infiammata, ipofisi normale di solito schiacciata verso il basso | Meningite Nodulo intra-cistico patognomonico nel 75% dei casi: ipo in T2, iper in T1, senza potenziamento) |
| Cisti dermoide | Cistica | Ipo-isodensa (lobulata) | No | Focali (di parete) | Iperintensa, eterogenea | Iperintensa | No (potenziamento piale in caso di rottura) | Meningite |
| Cisti epidermoide | Cistica | Come il liquor | No | Possibili | Come il liquor | Come il liquor | No | DWI: diffusione ristretta (DD cisti aracnoidea) |
| Condrosarcoma | Solida | Isodensa a iperdensa, distruzione ossea | Variabile | Sì | Da isointensa a ipointensa | Iperintensa | Eterogenea | |
| Cordoma | Solida | Distruzione ossea; da iso a iperdensa | Eterogenea | Comuni, diffuse | Da isointensa a ipointensa con setti e necrosi (foci iper per emorragia intra-tumorale o raccolte di muco) | Iperintensa | Eterogenea (a nido d’ape) | |
| Coristoma | Solida | Iperdensa | Intensa | Rare | Isointensa, eterogeneo | Isointensa | Variabile | |
| Craniofaringioma | Cistica (solida) | Eterogenea (calcifica) (“olio di macchina” se cistica) (isodensa ai tessuti molli se solida) |
Sì (nelle porzioni solide) | Frequenti, nodulari o curvilinee (periferiche) | Papillare solido: isointenso o ipointenso o maculato Cistico: iperintensp senza livelli |
Solido: isointenso o iperintenso (misto) Cistico: iperintenso (80%) o ipointenso |
Intensa nelle pareti delle cisti, eterogenea nelle lesioni nodulari | Ipofisi normale di solito schiacciata verso il basso, rara espansione nel seno cavernoso |
| Gangliocitoma | Solida | Iperdensa | Moderata | Possibili | Come macroadenomi (ipo se solida) | Come macroadenoma (ipo se solida, iper se cistica) | Sì (se solida), ipo se calcifica | Acromegalia, Cushing, epilessia nei bambini |
| Glioma | Solida | Ipodensa-isodensa | Variabile | Rare | Iso-ipointensa; Giovani adulti isointensa o ipointensa; Ipotalamico ipointensa-isointensa |
Iperintensa; Ipotalamico iso-iperintensa |
Variabile (disomogenea) | Proptosi, NF |
| Ipofisite granulomatosa |
Solida e cistica | Ipodensa a isodensa | Ad anello | No | Isointensa (iperintensa se sangue) | Eterogenea | Omogenea, ad anello nelle aree cistiche | Ispessimento del peduncolo |
| Ipofisite linfocitica |
Solida | Ipodensa | Sì | No | Ipointensa (possibile scomparsa ipersegnale neuroipofisi) | Iperintensa Ipointensa (parasellar dark sign) | Sì (potenziamento durale) | Ingrandimento simmetrico, ispessimento del peduncolo |
| Istiocitosi a cellule di Langerhans | Solida | Isodensa | Sì | No | Isointensa (perdita ipersegnale della neuroipofisi) | Iperintensa | Brillante, omogenea del peduncolo | Ispessimento del peduncolo |
| Linfoma | Solida | Isodensa o iperdensa | Intensa | No | Isointensa o lievemente ipointensa | Isointensa o lievemente ipointensa | Intensa | DWI: diffusione ristretta |
| Lipoma | Solida | Ipodensa | No | Rima | Iperintensa | Iperintensa | No | Scompare con la soppressione del grasso |
| Meningioma | Solida | Isodensa o lievemente iperdensa, iperostosi | Omogeneo, intenso | Comuni | Isointensa, molto omogeneo | Isointensa (iperintensa o ipointensa) | Intenso, omogeneo, con coda durale | Stenosi carotidea (encasement), ipofisi normale di solito schiacciata verso il basso, NF, radiazioni ionizzanti, crescita in gravidanza |
| Metastasi | Solida | Iperdensa o isodensa o ipodensa | Sì | Rare | Da ipointensa a iperintensa (simile a macroadenoma) | Iso-iperintensa (simile a macroadenoma) | Sì | Clessidra |
| Mucocele | Cistica | Da ipodensa a isodensa, assottigliamento e rigonfiamento delle pareti ossee del seno | Rima | No | Iperintensa se contenuto proteico, ipointensa se sieroso | Iperintensa se contenuto sieroso, Ipointensa se proteico | Ad anello | Dolore e parestesie facciali |
| NFPA | Solida (cistica) | Isodensa | Moderata | Rare | Isointensa (iperintensa con livelli se emorragica) | Isointensa (ipointensa se fibrotica) | Eterogenea, ipofisi normale solitamente spostata lateralmente e verso l’alto | |
| Pituicitoma | Solida | Iperdensa | Intensa | Rare | Da isointensa a ipointensa (ipersegnale della neuroipofisi non visibile) | Da ipointensa a isointensa | Intensa, omogenea | |
| Sarcoidosi | Solida | Isodensa a iperdensa | Sì (minore rispetto al potenziamento in RM) | No | Iso-ipointensa | Maggior parte iperintenso | Sì, omogenea | Ispessimento del peduncolo |
| Schwannoma | Solida | Isodensa | Sì | No | Ipointensa | Iperintensa | Intenso, omogeneo | |
| Tubercoloma | Solida | Isodensa con edema periferico | Sì (solida o rima) | Possibili, non specifiche (segno del bersaglio) | Caseoso: isointenso-ipointenso + anello periferico Non caseoso: iso-ipointenso Calcifico: iso-ipointenso |
Caseoso: ipointenso (FLAIR non soppressa) Non caseoso: iperintenso (FLAIR non soppressa) Caseoso (liquefazione centrale): centro iperintenso, rima ipointensa (parziale soppressione in FLAIR) Calcifico: ipointenso (soppressione in FLAIR) |
Caseoso: sì omogenea Non caseoso: sì, omogenea o periferica Caseoso (liquefazione centrale): periferica Calcifico: no |
Ispessimento del peduncolo DWI non ristretta (DD con ascesso), con eccezione del caseoso con liquefazione centrale co |
| Tumore a cellule germinali | Solida (mista nel teratoma) | Isodensa o iperdensa | Intensa | Frequenti nei teratomi | Isointensa o ipointensa | Iperintensa | Intensa | Pubertà precoce (alfaFP, hCG) DWI: diffusione ristretta |
| ESA = Emorragia Sub-Aracnoidea; DWI: diffusion weighed images; NF = neurofibromatosi | ||||||||
LESIONI SOLIDE
L’allargamento della sella turcica è tipico ma non esclusivo dei macroadenomi, perché può associarsi anche a metà delle lesioni non adenomatose che colpiscono la regione, come i meningiomi, i craniofaringiomi, l’empty sella e le cisti della tasca di Rathke. Perciò può essere indicativa solo l’assenza di ingrandimento della sella, che deve far pensare a una lesione di origine non ipofisaria (2).
L’erosione o l’invasione dell’osso non è di particolare aiuto nella diagnosi differenziale, perché si può vedere in molte lesioni diverse: adenomi, cordomi, meningiomi della fossa media, aneurismi intra-cavernosi, cisti della tasca di Rathke, diverticoli aracnoidei e ipertensione endocranica di qualunque natura (2).
L’insorgenza improvvisa di grave cefalea e oftalmoplegia dovrebbe sempre far pensare all’apoplessia ipofisaria. Poiché la presenza di un adenoma ipofisario non era precedentemente nota nella maggior parte dei casi, la difficoltà e i ritardi nella diagnosi possono portare a grave morbilità e talvolta anche alla morte. La diagnosi può essere spesso difficile perché i pazienti possono presentarsi in strutture di diverso livello, dove non sempre c’è la possibilità di consultare in tempi brevi un neuroradiologo esperto. Nella maggior parte dei casi la clinica non aiuta. TC e RM evidenzieranno una massa intra-sellare con segni di ischemia o sanguinamento. Bisogna porre attenzione alla possibile coesistenza di adenoma e aneurisma (riportata nel 7% dei casi) che necessita l’esecuzione di uno studio angiografico. Bisogna sottolineare che uno studio neuradiologico (con TC e poi RM) è oggi obbligatorio in tutti i casi di emergenza, perché i dati clinici hanno ben poco valore per dirimere la situazione.
NFPA vs. ipofisite
Alla RM l’ipofisite linfocitaria appare come ingrandimento simmetrico di una ipofisi omogenea, con un peduncolo ispessito ma raramente deviato e con pavimento sellare integro (4, 11). Al contrario i macroadenomi sono lesioni eterogenee, frequentemente asimmetriche, che si espandono verso la cisterna sovra-sellare e i seni cavernosi, spesso deviando il peduncolo, slivellando o erodendo il pavimento sellare (4, 11). Una presa di mdc nell’adeno-ipofisi intensa e omogenea, simile a quella dei seni cavernosi, è suggestiva di ipofisite.
È stato suggerito che in un paziente con disfunzione ipofisaria bisogna sospettare l’ipofisite quando coesistono almeno 3 dei seguenti 9 elementi (15):
- giovane età;
- donna che ha partorito da poco;
- insorgenza acuta di cefalea con oftalmoplegia, difetti campimetrici, nausea o vomito (tutti elementi presenti anche nell’apoplessia, in cui però la presentazione è più catastrofica e la diagnostica per immagini evidenzia ischemia o sanguinamento);
- insorgenza acuta di diabete insipido con cefalea e sintomi da effetto-massa (presenti anche nella sarcoidosi e nell’istiocitosi di Langerhans, dove la presentazione è più insidiosa);
- caratteristici aspetti alla RM;
- deficit di ACTH, isolato (di solito è l’ultimo ad essere coinvolto negli adenomi ipofisari) precoce e sproporzionato o comunque ipopituitarismodi entità sproporzionata rispetto alle modeste alterazioni morfologiche visualizzabili alla RM;
- presenza di altre condizioni autoimmuni e/o auto-anticorpi;
- pleiocitosi liquorale linfo-monocitica, senza meningite clinica né anticorpi anti-virus;
- anticorpi circolanti anti-ipofisi (nella rara evenienza in cui vengano dosati).
Recentemente uno studio caso-controllo su 402 lesioni (all’istologia 304 NFPA e 98 ipofisiti) ha valutato il potere predittivo pre-chirurgico di diversi parametri (4). Gli autori hanno concluso che nessun segno radiologico è in grado da solo di distinguere accuratamente le 2 patologie. Alcuni fattori erano però in grado di contribuire a una corretta classificazione in un modello di regressione logistica multipla: a favore dell’ipofisite stavano la relazione con la gravidanza, la simmetria dell’ipofisi, le dimensioni del peduncolo, l’intensità del segnale e l’omogeneità dopo mdc, mentre a favore dell’adenoma stavano le maggiori dimensioni della lesione e il rigonfiamento della mucosa del seno sfenoidale.
NFPA vs. meningioma
Il primo causa ingrandimento della sella ed erode il pavimento, il secondo (a partenza in questo caso dal planum sfenoidale) invade la sella che appare di normali dimensioni e prende il mdc in modo intenso e omogeneo. In entrambi i casi è evidente la “coda durale” .

Diagnosi differenziale tra adenoma ipofisario e meningioma della sella
RM sagittali T1 con mdc: a sinistra adenoma ipofisario con ingrandimento della sella; a destra meningioma con potenziamento omogeneo e intenso. Nel meningioma è meglio evidente e più esteso il segno della “coda durale” (frecce).
I meningiomi crescono tipicamente nello spazio sovra-sellare, con margini ottusi. Nella maggioranza dei casi la funzione ipofisaria è normale, la sella non è invasa e l’ipofisi normale è ben riconoscibile (anche nella rara evenienza di invasione della sella).
In caso di invasione del seno cavernoso, il meningioma tende a provocare una stenosi carotidea maggiore di qualunque altro tumore (16).
La cosiddetta “coda durale”, è una presa di contrasto tentoriale asimmetrica, che si allontana dalla convessità della lesione. In passato era considerata patognomonica di meningioma, ma è attualmente considerata un dato aspecifico, che può essere rilevato anche in associazione con adenomi, metastasi, linfomie ipofisitilinfocitarie (però il diabete insipidoè frequente in questi ultimi 3 casi ma non nel meningioma). Sembra essere causata da congestione venosa per compressione o invasione del seno cavernoso omolaterale alla lesione, piuttosto che da infiammazione meningea o invasione tumorale (17-19).

Macroadenoma (a) vs. meningioma (b): il primo causa ingrandimento della sella ed erode il pavimento, il secondo (a partenza in questo caso dal planum sfenoidale) invade la sella che appare di normali dimensioni e prende il mdc in modo intenso e omogeneo. In entrambi i casi è evidente la “coda durale” (freccia rossa).
I meningiomi esclusivamente intra-sellari sono estremamente rari e molto difficili da distinguere dagli adenomi (20). L’aspetto RM è simile sia in T1 che in T2, ma dopo mdc il 90% dei meningiomi si contrasta in modo marcato e omogeneo, mentre negli adenomi la presa di contrasto è meno intensa, più eterogenea con un maggior tempo per raggiungere il picco nelle immagini dinamiche (8).Altri aspetti che fanno propendere verso il meningioma quando presenti sono una tasca liquorale fra il tumore e la ghiandola, l’iperostosi del pavimento sellare, i vasi prominenti e le calcificazioni (8).
NFPA vs. metastasi
Nessun segno radiologico è in grado di distinguere con sicurezza le 2 situazioni, ma nelle metastasi è più frequente la presenza di reazioni osteolitiche (21).
NFPA vs. cordoma
A favore del cordoma stanno la localizzazione posteriore, la distruzione ossea con aspetto a favo d’ape, le calcificazioni e le caratteristiche del segnale RM (7).
NFPA vs. craniofaringioma solido
Nel craniofaringioma sono solitamente presenti calcificazioni visibili alla TC. Inoltre il coefficiente di diffusione apparente del craniofaringioma è in media maggiore di quello dell’adenoma (22, 23).
Meningioma vs. craniofaringioma solido
Alla RM in T2 i meningiomi appaiono isointensi mentre i craniofaringiomi sono tipicamente iperintensi (2).
Meningioma vs. neurinoma
I pazienti con neurinoma solitamente si lamentano di dolore o parestesie nel territorio del trigemino e all’esame neurologico sono solitamente presenti deficit. Gli schwannomi seguono il decorso noto dei nervi cranici o dei loro rami, talvolta allargando il forame di uscita del nervo dalla base cranica (ovale o rotondo) (13). Inoltre alla RM dinamica i meningiomi si contrastano precocemente mentre i neurinomi in modo più graduale e intenso (5).
Lipoma vs. altri tumori
I lipomi possono essere distinti da altre lesioni con simile iperintensità in T1 senza mdc (per contenuto proteico o emorragico), usando le sequenze con soppressione del grasso, che li fa scomparire (13).
Dermoidi e teratomi contenenti grasso sono meno omogenei dei lipomi.
Amartomi vs. altri tumori
L’amartoma del tuber cinereum può essere differenziato da altre patologie che coinvolgono la stessa regione (gliomi, istiocitosi di Langerhans, tumori a cellule germinali) per la presentazione clinica, l’assenza di presa del mdc e l’aspetto stabile nel tempo senza crescita o invasione (14).
LESIONI CISTICHE
Lo spettro delle patologie cistiche che coinvolgono la regione sellare comprende craniofaringiomi, cisti della tasca di Rathke, cisti aracnoidee, adenomi ipofisari cistici, cisti epidermoidi, cisti dermoidi e altre ancora (24). Nella maggior parte dei casi si può raggiungere una diagnosi sicura con metodi non invasivi, ma in altri alla diagnosi si può arrivare solo dopo la chirurgia, se c’è indicazione clinica all’intervento (23, 25).
Cisti vs. empty sella
Le cisti aracnoideeo le cisti della tasca di Rathkepossono ricordare l’empty sella, ma in questa il peduncolo rimane solitamente mediano e può essere visualizzato fino al pavimento sellare (26).
NFPA cistico vs. cisti della tasca di Rathke
Le cisti intra e sovra-sellari possono causare sintomi e segni simili agli adenomi, come deficit visivo o ipopituitarismo (2).
In TC l'NFPA si presenta come lesione cistica solida isodensa, a differenza dalla cisti di Rathke che può manifestarsi con caratteristiche sia di isodensità che ipodensità.
La presenza di un livello fluido-fluido nelle immagini assiali o sagittali è altamente indicativa di adenoma, perché corrisponde a degenerazione ed emorragia intra-tumorale, eventi che non capitano quasi mai nelle cisti (19).
In RM, l'NFPA in T1 e in T2 appare, in genere, come lesione isointensa, mentre la cisti di Rathke risulta ipointensa in T1 con caratteristici noduli ipointensi e iperintensa in T2.
Le cisti della tasca di Rathke sono situate al centro della ghiandola, non prendono minimamente il mdc (27).
NFPA cistico vs. craniofaringioma
Gli adenomi cistici sono localizzati nell’adeno-ipofisi, sono circondati da tessuto ipofisario normale e la parete della cisti è costituita da tessuto tumorale che prende il mdc. I craniofaringiomi cistici sono più comunemente sovra-sellari posti al di sopra dell’ipofisi e mostrano componenti solide che prendono il mdc e calcificazioni (14).
NFPA cistico vs. ascesso
In contrasto con gli adenomi, gli ascessi tipicamente mostrano presa di contrasto ad anello e segnale iperintenso nelle sequenze in diffusione, con riduzione del coefficiente apparente di diffusione (ADC), mentre i tumori necrotici sono ipointensi in diffusione e hanno ADC maggiore (28). Inoltre, negli ascessi si può osservare contrasto meningeo per la presenza di meningite secondaria (29).
Cisti della tasca di Rathke vs. craniofaringioma cistico
La presentazione clinica non è dirimente.
Le 2 lesioni possono essere distinte alla RM (3):
- il craniofaringioma solido si manifesta come lesione isointensa in T1 e iperintensa in T2; il craniofaringioma cistico risulta iperintenso sia in T1 e in T2. Il craniofaringioma presenta spesso calcificazioni visibili in TC o con le sequenze di suscettibilità magnetica (SWI);
- la cisti di Rathke invece appare più spesso ipointensa in T1 e iperintensa in T2.
È però vero che la cisti della tasca di Rathke può avere un aspetto variabile in relazione al contenuto cistico, il che rende talvolta ardua la diagnosi differenziale. Alcuni aspetti fanno pendere la bilancia dall’una o dall’altra parte (30):
- a favore del craniofaringioma stanno la presenza di calcificazioni, il maggiore diametro (> 2 cm), la localizzazione sovra-sellare con aspetto lobato superiore e la compressione del III ventricolo;
- a favore della cisti della tasca di Rathke stanno la forma ovoidale, il piccolo volume cistico e la presa di mdc della parete cistica assente o sottile.
Anche se la presenza di calcificazioni sovra-sellari, soprattutto in un bambino, è altamente suggestiva per craniofaringioma, non è tuttavia patognomonica: alla TC calcificazioni sono presenti nel 42-87% dei craniofaringiomi vs solo lo 0-13% delle cisti della tasca di Rathke. Attenzione, comunque, perché sono stati riportati casi di cisti della tasca di Rathke con ossificazione senza evidenza di aspetti neoplastici (23).
Cisti della tasca di Rathke vs. cisti aracnoidea
Le cisti aracnoidee contengono tipicamente liquor, mentre il contenuto delle cisti della tasca di Rathke (e quindi le caratteristiche delle loro immagini) è variabile.
- TC: la cisti aracnoidea appare ipodensa, mentre la cisti di Rathke può essere sia ipo che isodensa;
- RM: sia la cisti aracnoidea che quella di Rathke appaiono ipointense in T1 ed iperintense in T2. In genere, tuttavia, il segnale della cisti aracnoidea appare più simile a quello del liquor rispetto alla cisti di Rathke.
Cisti epidermoide vs. cisti aracnoidea
Entrambe non prendono il mdc, ma gli epidermoidi sono brillanti nelle immagini in diffusione e in FLAIR, mentre le cisti aracnoidee sono scure in entrambe le sequenze. Inoltre gli epidermoidi tendono a insinuarsi tra i vasi e le strutture adiacenti, mentre le cisti aracnoidee le dislocano (14).
Cisti dermoidi/epidermoidi vs cisti di Rathke
All'imaging le cisti epidermoidi presentano caratteristiche simil-liquorali sia in TC che in RM. Le cisti epidermoidi mostrano tuttavia un tipico ipersegnale nelle immagini pesate in diffusione, che appare assolutamente specifico di questa condizione.
Le cisti dermoidi appaiono invece come lesioni iso-ipodense alla TC e iperintense in T2, come la cisti di Rathke. Differiscono da quest’ultima per le caratteristiche di segnale nelle sequenze T1-pesate, poiché le cisti dermoidi appaiono iperintense in T1, mentre la cisti di Rathke sono più spesso ipointense. La diagnosi può essere tuttavia difficile o impossibile in caso di cisti di Rathke iperintense in T1.
CONCLUSIONI
È opportuno ricordare alcuni punti chiave.
- Anche se nella maggior parte dei casi di lesione della regione ci troviamo di fronte ad un adenoma ipofisario, esistono altre possibilità da tenere a mente e prendere in considerazione.
- È obbligatorio fare sempre uno screening delle forme ipersecretorie e dei possibili deficit ipofisari: questo può essere eseguito con pochi esami mirati.
- Nel ragionamento diagnostico valuta i fattori epidemiologici.
- Tieni sempre in considerazione le copatologie: potrebbe trattarsi della manifestazione locale di una patologia sistemica.
- Le immagini vanno sempre riviste attentamente con il neuroradiologo.
- Non trascurare i campanelli d’allarme, anche se niente è realmente patognomonico.
La flow-chart non esaurisce tutti i punti ma può essere d’aiuto nell’arrivare a una diagnosi.
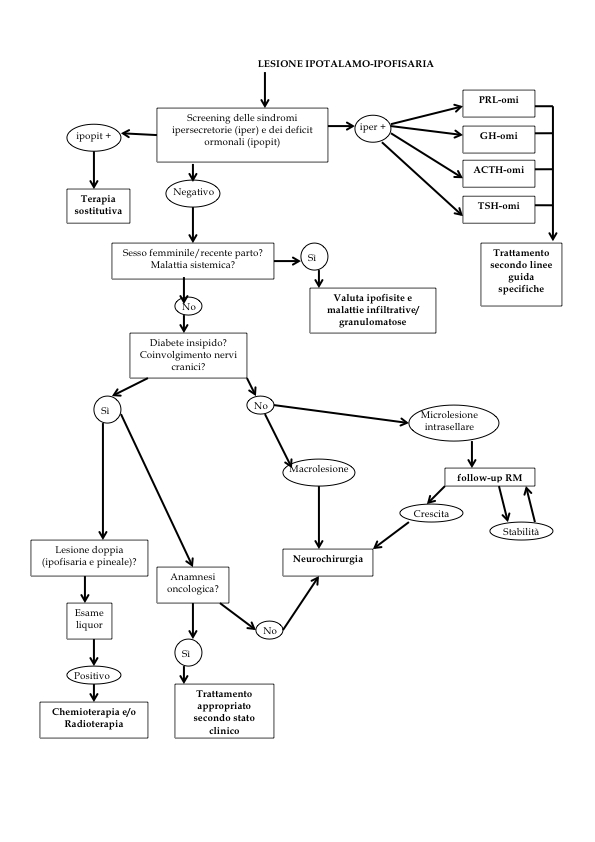
Sulla base degli elementi epidemiologici clinici e neuroradiologici è possibile arrivare a una diagnosi plausibile in molti casi di lesione della regione ipotalamo-ipofisaria. Questo richiede uno sforzo collaborativo multidisciplinare fra endocrinologo, neurochirurgo e neuroradiologo. Il risultato è ottimizzato se individui esperti di queste categorie lavorano abitualmente insieme in modo strutturato in quella che viene definita “Pituitary Unit”.
Nei casi dubbi, può essere ancora richiesta una diagnosi istologica per un orientamento e una pianificazione terapeutica appropriata. Anche se la maggior parte dei tumori di questa regione sono benigni e a lenta crescita, è importante identificare quelli maligni o potenzialmente maligni sulla base del contesto clinico, dei dati di laboratorio e delle immagini seriate.
Anche il trattamento richiede lo sforzo congiunto di diversi specialisti: il neurochirurgo, l’endocrinologo e il radioterapista, a cui si possono talvolta aggiungere in seconda battuta il neuro-oncologo e il medico-nucleare.
BIBLIOGRAFIA
- Valassi E, Biller BMK, Klibanski A, et al. Clinical features of nonpituitary sellar lesions in a large surgical series. Clin Endocrinol 2010, 73: 798–807.
- Freda PU, Post KD. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 1999, 28: 81-117.
- Famini P, Maya MM, Melmed S. Pituitary magnetic resonance imaging for sellar and parasellar masses: ten-year experience in 2598 patients. J Clin Endocrinol Metab 2011, 96: 1633–41.
- Gutenberg A, Larsen J, Lupi I, et al. A radiologic score to distinguish autoimmune hypophysitis from nonsecreting pituitary adenoma preoperatively. AJNR Amer J Neuroradiol 2009, 30: 1766–72.
- Rennert J, Doerfler A. Imaging of sellar and parasellar lesions. Clin Neurol Neurosurg 2007, 109: 111–24.
- Carpinteri R, Patelli I, Casanueva FF, et al. Inflammatory and granulomatous expansive lesions of the pituitary. Best Pract Res Clin Endocrinol Metab 2009, 23: 639–50.
- Glezer A, Belchior Paraiba D, et al. Rare sellar lesions. Endocrinol Metab Clin North Am 2008, 37: 195-211.
- Huang BY, Castillo M. Nonadenomatous tumors of the pituitary and sella turcica. Top Magn Res Imaging 2005, 16: 289-99.
- Kaltsas GA, Evanson J, Chrisoulidou A, et al. The diagnosis and management of parasellar tumours of the pituitary. Endocr Related Cancer 2008, 15: 885–903.
- Karavitaki N, Cudlip S, Adams CB, et al. Craniopharyngiomas. Endocr Rev 2006, 27: 371–97.
- Lury KM. Inflammatory and infectious processes involving the pituitary gland. Top Magn Res Imaging 2005, 16: 301-6.
- Ruscalleda J. Imaging of parasellar lesions. Eur Radiol 2005, 15: 549–59.
- Smith JK. Parasellar tumors: suprasellar and cavernous sinuses. Top Magn Res Imaging 2005, 16: 307-15.
- Spampinato MV, Castillo M. Congenital pathology of the pituitary gland and parasellar region. Top Magn Res Imaging 2005, 16: 269-76.
- Rivera JA. Lymphocytic hypophysitis: Disease spectrum and approach to diagnosis and therapy. Pituitary 2006, 9: 35–45.
- Young SC, Grossman RI, Goldberg HI, et al. MR of vascular encasement in parasellar masses: comparison with angiography and CT. AJNR Amer J Neuroradiol 1988, 9: 35–8.
- Guermazi A, Lafitte F, Miaux Y, et al. The dural tail sign-beyond meningioma. Clin Radiol 2005, 60: 171–88.
- Nakasu Y, Nakasu S, Ito R, et al. Tentorial enhancement on MR images is a sign of cavernous sinus involvement in patients with sellar tumors. AJNR Amer J Neuroradiol 2001, 22: 1528-33.
- Rumboldt Z. Pituitary adenomas. Top Magn Res Imaging 2005, 16: 277-88.
- Cappabianca P, Cirillo S, Alfieri A, et al. Pituitary macroadenoma and diaphragma sellae meningioma: differential diagnosis on MRI. Neuroradiology 1999, 41: 22-6.
- Komninos J, Vlassopoulou V, Protopapa D, et al. Tumors metastatic to the pituitary gland: case report and literature review. J Clin Endocrinol Metab 2004, 89: 574–80.
- Yamasaki F, Kurisu K, Satoh K, et al. Apparent diffusion coefficient of human brain tumors at MRI. Radiology 2005, 235: 985-91.
- Zada G, Lin N, Ojerholm E, et al. Craniopharyngioma and other cystic epithelial lesions of the sellar region: a review of clinical, imaging, and histopathological relationships. Neurosurg Focus 2010, 28: E4 1-12.
- Laws ER. Endoscopic surgery for cystic lesions of the pituitary region. Nature Clin Pract Endocrinol Metab 2008, 4: 662–3.
- Harrison MJ, Morgello S, Post KD. Epithelial cystic lesions of the sellar and parasellar region: A continuum of ectodermal derivatives? J Neurosurg 1994, 80: 1018-25.
- Giustina A, Aimaretti G, Bondanelli M, et al. Primary empty sella: Why and when to investigate hypothalamic-pituitary function. J Endocrinol Invest 2010, 33: 343-6.
- Byun WM, Kim OL, Kim D. MR imaging findings of Rathke’s cleft cysts: significance of intracystic nodules. AJNR Amer J Neuroradiol 2000, 21: 485-8.
- Takao H, Doi I, Watanabe T. Diffusion-weighted magnetic resonance imaging in pituitary abscess. J Comput Assist Tomogr 2006, 30: 514–6.
- Vates GE, Berger MS, Wilson CB. Diagnosis and management of pituitary abscess: a review of twenty-four cases. J Neurosurg 2001, 95: 233–41.
- Choi SH, Kwon BJ, Na DG, et al. Pituitary adenoma, craniopharyngioma, and Rathke cleft cyst involving both intrasellar and suprasellar regions: differentiation using MRI. Clin Radiol 2007, 62: 453–62.
- Attanasio R, Cozzi R, Lasio G, Barbò R. Diagnostic evaluation of the lesions of the sellar and parasellar region. In "Explicative Cases of Controversial Issues in Neurosurgery, Signorelli F (Ed), ISBN: 978-953-51-0623-4, InTech, http://www.intechopen.com/books/explicative-cases-of-controversial-issues-in-neurosurgery/the-diagnostic-evaluation-of-the-lesions-of-the-sellar-and-parasellar-region.
Chirurgia della regione ipotalamo-ipofisaria
Giovanni Battista Lasio, Davide Milani, Martina Revay
Pituitary Unit, UO Neurochirurgia, NeuroCenter, Humanitas Research Hospital, Milano
(aggiornato al 7 settembre 2015)
Approcci e Tecnica Chirurgica
Diversi tipi di tumore possono interessare la sella e la regione sovrasellare. i più frequenti sono certamente gli adenomi ipofisari, ma possiamo trovare anche meningiomi, craniofaringiomi, metastasi, cisti epidermoidi, cisti della tasca di Rathke, lesioni di tipo infiammatorio oltre a tumori gliali del chiasma e nervi ottici o dell'ipotalamo.
Due sono le vie di accesso ai tumori della sella e della regione sovrasellare: la via trans-sfenoidale (TNS, di gran lunga la più praticata) e la via trans-cranica (TC), per ciascuna delle quali esistono numerose varianti.

La scelta della via di aggressione deve tener conto di numerosi fattori: localizzazione e dimensioni della lesione, sua probabile natura e consistenza, rapporti con le strutture nobili circostanti, età e condizioni generali del paziente, stato neurologico pre-operatorio, obiettivo dell'intervento (radicalità dell'asportazione o debulking o biopsia). In linea generale si può dire che la via TNS era considerata la via di scelta in tutti i tumori, anche con estensione sovrasellare, limitati dal diaframma sellare, come la gran parte degli adenomi; la via TC era invece indicata nei tumori primitivamente sovra-diaframmatici. Oggigiorno la diffusione della tecnica endoscopica e la maggior conoscenza dell'anatomia del seno sfenoidale hanno fatto sì che la via TNS possa essere utilizzata in casi selezionati in cui in passato vi sarebbe stata indicazione alla via TC.
Controindicazioni all'approccio TNS:
- assolute: estensione del tumore oltre il III inferiore del III ventricolo e/o al di là dell'asse mediano delle carotidi intra-craniche e/o lateralmente alla biforcazione carotidea nella cisterna silviana;
- relativa: stretto rapporto di vicinanza fra i sifoni carotidei ("kissing carotids").
L’approccio TC veniva anche in passato utilizzato in non più del 4% dei casi di adenoma ipofisario, prevalentemente per via pterionale. In casi limite i due approcci possono essere utilizzati in combinazione, normalmente in due successive sedute operatorie. In questa circostanza lo scrivente ritiene preferibile eseguire in prima istanza l'approccio TC.
Della via TNS, introdotta nella pratica neurochirurgica all'inizio del secolo scorso, esistono parecchie varianti, di cui le due più comunemente usate sono la via sub-labiale trans-settale e la via trans-nasale trans-settale. In entrambe è indispensabile l'utilizzo del microscopio operatorio. Possono essere eseguite sia in posizione supina che semi-seduta, con il capo del paziente di solito girato verso l'operatore. Tranne casi sporadici, è certamente la via di scelta in tutti gli adenomi ipofisari.
Nella variante sub-labiale, si inizia con un'incisione nella gengiva superiore, per portarsi poi verso l'alto ad esporre il rostro del mascellare, la spina nasale ed i recessi laterali. Si disseca poi la mucosa dal pavimento delle cavità nasali e si prosegue verso l'alto lungo il vomere fino al livello della cartilagine quadrangolare, che viene disarticolata dal vomere e dalla parte anteriore del piatto perpendicolare dell'etmoide. La mucosa viene poi dissecata dall'etmoide, esponendo il rostro dello sfenoide che viene aperto più o meno ampiamente, a seconda delle necessità. Si rimuove la mucosa del seno sfenoidale ed eventuali setti intra-sfenoidali, esponendo così la parete anteriore della sella, che viene aperta con un trapano ad alta velocità. La dura viene incisa a croce di Sant'Andrea. A questo punto è di solito facile identificare il tumore, che talvolta tende addirittura ad uscire spontaneamente dalla sella, data la sua consistenza molle. Il tumore viene rimosso con piccoli oncotomi e curettes ed anche aspirato, avendo cura di non rompere il diaframma sellare e di preservare l'ipofisi normale. La sella viene poi chiusa con diversi materiali: osso e colla più comunemente, grasso e colla nei casi in cui vi sia stata una lacerazione del diaframma, con conseguente liquorrea. Per preparare e mantenere aperta la strada fra i due fogli della mucosa nasale si utilizzano speculi nasali di grandezza e lunghezza progressivamente maggiori. Al termine dell'intervento si rimuove lo speculum, si riavvicinano i fogli della mucosa e si pone un tampone per narice. La mucosa della gengiva viene suturata con tre punti riassorbibili.
L’approccio trans-nasale trans-settale viene eseguito tramite una piccola incisione nella columella alla giunzione fra cute e mucosa; quindi, per via smussa si esegue una dissezione sub-pericondrale bilaterale lungo la parte anteriore del setto cartilagineo e quindi posteriormente ed inferiormente lungo il lato sinistro della cartilagine quadrangolare. Si utilizzano speculi nasali progressivamente più grandi e più lunghi fino ad arrivare al piatto perpendicolare dell'etmoide. Da questo momento in poi l'intervento diviene sovrapponibile a quanto descritto in precedenza. Quest'ultimo approccio, come altri approcci microscopici endonasali, riduce il disagio peri-operatorio del paziente. Rispetto però al classico approccio sub-labiale gli approcci endonasali puri sono più stretti e riducono la manovrabilità degli strumenti.
Tutte le vie trans-nasali si basano sul riconoscimento e, nel caso degli accessi alla sella, sul mantenimento della linea mediana: lo sprone sfenoidale è il repere anatomico fondamentale. Allo scopo di controllare la posizione raggiunta con i ferri, si usava in passato l’amplificatore di brillanza, sostituito negli ultimi 15 anni dal neuro-navigatore, apparecchiatura che, previa l'acquisizione pre-operatoria di una TAC o di una RMN o di entrambe, è in grado di mostrare con estrema precisione la posizione nei tre piani dello spazio di uno strumento di riferimento all'interno della testa e del naso del paziente. Comune a tutti gli approcci microchirurgici è il problema della visione tubulare legata al posizionamento dello speculum nasale.

Setting operatorio per chirurgia TNS microscopica
Dal 1997 in poi si è sempre più affermata la tecnica endoscopica, che consente di raggiungere la sella turcica in maniera meno traumatica per il paziente e soprattutto è in grado di offrire una visione dettagliata dell'anatomia, sia del naso che del seno sfenoidale. Solo la tecnica endoscopica consente di esplorare direttamente con ottiche angolate la cavità residua all'asportazione del tumore; inoltre l'endoscopia fornisce un'immagine assai più ampia, ingrandita e ben illuminata del seno sfenoidale, della sella e delle strutture viciniori, può essere minimamente invasiva, ma anche assai invasiva quando necessario, è più rispettosa dell'anatomia nasale, consente di meglio identificare l'ipofisi sana residua, è meglio tollerata dal paziente anche perchè non sono usualmente necessari tamponi nasali nel post-operatorio. D'altra parte la visione è bidimensionale (manca la sensazione diretta della profondità) e la curva di apprendimento è ripida. La recente introduzione tra il 2009 ed il 2011 di apparecchiature endoscopiche tridimensionali ha consentito il superamento di questi svantaggi; l'endoscopio 3D infatti, pur essendo di dimensioni lievemente maggiori quindi meno "agile" nella fase di approccio endonasale, consente nel tempo chirurgico centrale il riconoscimento "reale" di reperi anatomici e una percezione della profondità impossibile anche con le migliori apparecchiature 2D.
In breve, l'approccio viene di solito eseguito dalla narice destra, a paziente supino e capo in posizione neutra; viene spinto lateralmente il turbinato medio e identificato l'ostio naturale del seno sfenoidale, che viene ampliato. A questo punto è già possibile raggiungere la sella, aprirla e rimuovere un adenoma ipofisario, ma, se la lesione è di grosse dimensioni, usualmente si demolisce il rostro dello sfenoide, dopo aver scollato la mucosa bilateralmente, in modo da poter entrare nel seno da entrambe le narici ed utilizzare una tecnica a tre o quattro mani insieme con il secondo operatore. Nella fase di approccio è eventualmente possibile correggere deviazioni del setto, ipertrofia dei turbinati, ecc. Una volta aperta la sella, l'intervento procede al solito modo, ma solo con l'endoscopio è possibile esplorare la cavità residua dopo l'asportazione del tumore e verificare direttamente se vi è qualche residuo di malattia. Inoltre, risulta più agevole l’identificazione di un residuo di ipofisi normale. La visione diretta, ingrandita ed ampia del seno sfenoidale e delle strutture che vi passano, sia lateralmente che superiormente, può consentire anche di rimuovere la componente intra-cavernosa di adenomi invasivi, allargando l'accesso lateralmente. E' dibattuta la reale utilità di intervenire direttamente sul seno cavernoso, poichè i rischi chirurgici aumentano in maniera significativa a fronte di una radicalità di resezione che rimane aleatoria. Utile in questi casi l' utilizzo di un microdoppler per identificare la carotide. Nei casi di approcci estesi e nei re-interventi è estremamente utile il neuro-navigatore, che noi non utilizziamo nei primi interventi. È prudente acquisire in fase pre-operatoria una TAC del massiccio facciale per meglio studiare l'anatomia a volte complessa delle settazioni intra-sfenoidali. Il tamponamento nasale non è di solito necessario e i pazienti possono subito respirare normalmente. La degenza in ospedale è generalmente limitata a 48-72 ore. Le complicanze nasali, quali sinechie e disventilazione, condizionanti colonizzazioni micetiche (fungus balls), sono assai rare.

Equipe chirurgica in azione durante procedura TNS endoscopica
Qualora si sia scelto l'approccio TNS per una lesione non adenomatosa primitivamente sovra-diaframmatica (meningioma del tubercolo sellare o del diaframma sellare, craniofaringioma) è necessario un approccio più ampio (cosiddetto extended), in modo da permettere al neurochirurgo di poter lavorare a due mani con tecnica microchirurgica. I turbinati medio e superiore dal lato dell'approccio vengono rimossi, viene eseguita una sfenoidotomia molto ampia, ampiamente aperto l'etmoide posteriore e preparato un lembo settale vascolarizzato che servirà per la chiusura. Con l'apposita fresa diamantata si rimuove il tubercolo sellare, fra i recessi ottico-carotidei, mentre l'apertura della sella è di solito limitata. A questo punto l'endoscopio viene sostenuto dal secondo operatore. Si apre il piano sfeno-etmoidale e quindi si coagula il seno inter-cavernoso superiore per poi aprire la dura. Il tumore viene rimosso con tecnica microchirurgica, svuotandolo inizialmente, e cercando di rispettare il piano aracnoideo ed i vasi che irrorano gli ottici e il chiasma. La preservazione del peduncolo ipofisario è talvolta possibile. Sono necessari strumenti chirurgici appositi, assai lunghi. Anche la chiusura è di non facile esecuzione. Noi, come altri, utilizziamo un lembo di fascia lata, prelevata dalla coscia, posizionato all'interno della breccia e colla di fibrina, un secondo lembo di fascia all'esterno della breccia, su cui viene posizionato e incollato il lembo settale preparato in precedenza. Si posiziona poi un catetere vescicale con il palloncino gonfiato in modo da sostenere la chiusura. All'inizio dell'intervento si era posizionato un drenaggio spinale esterno lombare, che viene mantenuto per 4-5 giorni. In questo modo la percentuale di fistole liquorali è scesa al di sotto del 10%. In questo tipo di chirurgia si riscontrano i maggiori vantaggi dell'endoscopio 3D, in quanto sono meglio apprezzabili i rapporti anatomici tra il tumore e le delicate strutture neurovascolari (chiasma ottico, pareti del terzo ventricolo, complesso arterioso del circolo di Willis). Il maggior vantaggio di questo tipo di approccio sta nel fatto che il tumore nasce al di sotto dei nervi ottici e del chiasma, per cui si ha direttamente in luce il piano fra lesione e strutture sovrastanti, strutture che invece, nel caso di un approccio TC, fungono almeno parzialmente da tetto nei confronti del tumore, nascondendolo. I limiti e i rischi sono legati fondamentalmente all'estensione laterale del tumore.
Comune all'approccio TNS, con qualunque tecnica venga eseguito, è il rischio di provocare un danno alla carotide, danno che nella pratica è praticamente impossibile riparare direttamente, poichè lo spazio di manovra, limitato, impedisce di agire efficacemente. In questa circostanza ci si limita ad ottenere l'emostasi, per tamponamento, mentre per una soluzione definitiva è necessario l'intervento del neuroradiologo, con metodiche endovascolari. A questa complicanza è dovuta la mortalità, bassa, legata all'approccio.


Immagini endoscopiche durante (sinistra) e al termine (destra) di exeresi TNS extended di craniofaringioma
La via TC, utilizzata solo occasionalmente per aggredire adenomi ipofisari, è tuttora la più utilizzata per rimuovere i tumori sovra-diaframmatici. Nel corso degli anni sono stati sviluppati diversi approcci, ma ancora oggi la via di uso più frequente è la via pterionale, con diverse varianti, allo scopo da una parte di aumentare la rimozione dell'osso in modo da avere una via di accesso più ampia con minor spatolamento del cervello, dall'altra di diminuire l'ampiezza dell'accesso "esterno", con un risultato estetico migliore a parità di traumaticità nei confronti del parenchima cerebrale. Il paziente viene posizionato supino, con il capo ruotato verso il lato controlaterale all'approccio di circa 30° ed esteso in modo da portare l'eminenza malare sul punto più alto del campo operatorio. Si esegue un'incisione arcuata dietro l'attaccatura dei capelli, da davanti al trago fin poco meno della linea mediana. Aperta la pelle, il muscolo temporale viene inciso posteriormente e superiormente, lasciandone una porzione adesa trasversalmente all'osso, in modo da poterlo suturare alla fine in maniera esteticamete soddisfacente. Si esegue quindi un foro di trapano ("keyhole") appena posteriormente alla giunzione fra linea temporale e processo zigomatico dell'osso frontale, alcuni centimetri anteriormente allo pterion, in modo da esporre contemporaneamente l'orbita al suo margine inferiore e la dura che ricopre il lobo frontale al suo margine superiore. Rimosso l'opercolo osseo, con un trapano ad alta velocità e con l'aiuto del microscopio, che da ora in poi è indispensabile, si fresa l'ala dello sfenoide in modo da appiattire l'accesso. Si apre la dura e si apre la scissura silviana fino ad esporre ottico e carotide e si fa defluire abbondante liquor, in modo che il cervello si detenda e che sia necessario solo un minimo spatolamento del lobo frontale per esporre la regione di interesse. Di fondamentale importanza a questo punto identificare chiaramente ottico, carotide e suoi rami. Il primo passo consiste nello svuotamento del tumore, nella coagulazione di un eventuale impianto durale e nel progressivo isolamento della lesione dalle strutture nervose e vascolari, rispettando, quando e se possibile, il piano aracnoideo. Una volta rimosso il tumore e ottenuta l'emostasi, la chiusura avviene per strati: dura, osso, fascia del muscolo temporale, galea e cute. Per questa via vi è maggiore, se pur limitato, spazio rispetto all'approccio TNS e maggior possibilità di controllare eventuali danni vascolari, ma, come detto, chiasma e ottici sono spesso di ostacolo alla visualizzazione del tumore e il piano di dissezione fra queste strutture e tumore non è visibile. Inoltre la vascolarizzazione delle strutture ottiche viene dal basso ed è più facilmente interrotta durante un approccio TC. D'altra parte, dalla via TNS è più difficile identificare e preservare il piano aracnoideo e dominare le strutture vascolari maggiori in maniera adeguata.

Visuale del campo operatorio attraverso la via di accesso pterionale
La scelta della via di accesso alle lesioni sovrasellari è di pertinenza del chirurgo operatore. La nostra esperienza ci induce a ritenere che ogniqualvolta possibile la "via bassa" sia preferibile alla "via alta" nei craniofaringiomi, mentre la "via alta" resta per noi la via di scelta in tutte le altre patologie della regione, a meno che ci si trovi davanti ad un caso con chiasma antefisso (ossia con nervi ottici corti), in cui con un approccio pterionale non vi è spazio per lavorare al davanti del chiasma, fra i nervi ottici, e si è costretti ad utilizzare corridoi molto limitati, come ad esempio il triangolo fra ottico e carotide.
Intervento TNS: il filmato mostra l'esplorazione trans-sfenoidale endoscopica dopo rimozione dell'adenoma e la chiusura della breccia
Limiti, effetti collaterali e risultati
Gli avanzamenti della tecnica e della tecnologia neurochirurgica, la stretta collaborazione con specialisti di altre branche (in particolare con i chirurghi otorinolaringoiatri) hanno fatto sì che non esistano più limiti di indicazione al trattamento chirurgico degli adenomi. Restano limiti nei risultati del trattamento chirurgico, legati alle caratteristiche biologiche del tumore e alla sua invasività, microscopica (infiltrazione durale o di tutta la ghiandola ipofisaria) o macroscopica (invasione del seno cavernoso e delle strutture ossee circostanti la sella). Va però tenuto presente che, quando vi sono piccoli residui tumorali dopo intervento, esiste la possibilità di un trattamento radiochirurgico, che sicuramente contribuisce alla guarigione del paziente.
Trattandosi di un intervento del tutto particolare, è stato ampiamente dimostrato che i risultati sono strettamente legati all’esperienza e all’abilità del chirurgo operatore: per questa ragione è indispensabile indirizzare i pazienti a centri di riferimento in cui, oltre al neurochirurgo, sia disponibile una collaborazione pluri-disciplinare fra i diversi specialisti coinvolti nel trattamento di questa patologia.
L’asportazione dei macroadenomi non invasivi è radicale fin nell’85% dei casi. Nel 98% dei pazienti si ottiene un miglioramento più o meno evidente o una stabilizzazione dei pre-esistenti disturbi visivi; percentuali sostanzialmente analoghe di guarigione si ottengono negli adenomi GH- e ACTH-secernenti, sempre a condizione che ci si trovi davanti a lesioni anatomicamente ben definite e non invasive, nè macro- nè microscopicamente.
La mortalità è minima (0.1% nelle casistiche più recenti), ma permane intorno all’1% nei casi di macroadenomi con marcata estensione sovra-sellare.
Per quanto riguarda le complicanze, l’ipopituitarismo è la più frequente (10% circa), seguito dal diabete insipido permanente (2% dei casi). Altre possibili complicanze (rino-liquorrea, danno dei nervi cranici, infezione, complicanze vascolari, perforazione del setto nasale, ecc.) compaiono in meno dell’1% dei casi. L’insorgenza di tali problemi è ovviamente più frequente quanto maggiori sono le dimensioni del tumore.
Bibliografia
- Barker FG, Klibanski A, Swearingen B. Transsphenoidal surgery for pituitary tumors in the United States, 1996-2000: mortality, morbidity, and the effects of hospital and surgeon volume. J Clin Endocrinol Metab 2003, 88: 4709-19.
- Cappabianca P, Alfieri A, De Divitiis E. Endoscopic endonasal transsphenoidal approach to the sella: towards Functional Endoscopic Pituitary Surgery (FEPS). Mini Invas Neurosurg 1998, 41: 66-73.
- Felisati G, Lenzi C, Pipolo C, et al. Endoscopic expanded endonasal approach: preliminary experience with 3D endoscope. Acta Otor Ital 2013, 33:102-6.
- Frank G, Pasquini E. Approach to the cavernous sinus. In “Endoscopic Endonasal Transsphenoidal Surgery”, De Divitiis E, Cappabianca P, eds. Springer, Wien-New York, 2003: 159-75.
- Hardy J, Wigser SM. Transsphenoidal surgery of pituitary fossa tumors with televised radiofluoroscopic control. J Neurosurg 1965, 23: 612-9.
- Jho HD, Carrau RL. Endoscopic endonasal transsphenoidal surgery: experience with 50 patients. J Neurosurg 1997, 87: 44-51.
- Laws ER Jr. Transsphenoidal approach to pituitary tumors. In “Operative Neurosurgical Techniques”, Schmiedek HH, Sweet WH, eds. WB Saunders, Philadelphia 1996: 283.
- Mortini P, Losa M, Barzaghi R, Boari N, Giovanelli M. Results of transphenoidal surgery in a large series of patients with pituitary adenoma. Neurosurgery 2005, 56: 1222-33.
- Nomikos P, Ladar C, Fahlbusch R, Buchfelder M. Impact of primary surgery on pituitary function in patients with non functioning pituitary adenoma. A study on 721 patients. Acta Neurochir 2004, 146: 27-35.
- Patterson RH. The role of transcranial surgery in the management of pituitary adenoma. Acta Neurochir 1996, 65 Suppl: 16-7.
Radioterapia per le lesioni ipotalamo-ipofisarie
Claudia Scaringi e Giuseppe Minniti
Cattedra di Radioterapia Oncologica, Università di Roma “Sapienza”, II Facoltà di Medicina e Chirurgia, Ospedale Sant’Andrea, Via di Grottarossa 1035-1039, 00189, Roma
Introduzione
La radioterapia a fasci esterni è parte integrante nel trattamento di pazienti con tumori della regione ipotalamo-ipofisaria, quali adenomi ipofisari, craniofaringiomi e meningiomi. E’ generalmente indicata in presenza di residuo o recidiva tumorale dopo chirurgia, con l’obiettivo di prevenire la ricrescita tumorale, di preservare le funzioni neurologiche e di ottenere la normalizzazione dei livelli ormonali nel caso di adenomi ipofisari secernenti. Negli ultimi decenni si è assistito a un notevole miglioramento di tutti gli aspetti della radioterapia, che ha portato allo sviluppo di tecniche sempre più precise di irradiazione, capaci di somministrare alte dosi di radiazioni al tumore, minimizzando contemporaneamente l’irradiazione ai tessuti sani circostanti e riducendo il rischio potenziale di tossicità a lungo termine [1].
Aspetti tecnici della radioterapia
Nell’era della “moderna radioterapia” si è assistito al passaggio dalle tecniche convenzionali in 2D a tecniche di irradiazione sempre più sofisticate. Questo è stato possibile grazie al notevole miglioramento nel campo dell’imaging radiologico, dell’immobilizzazione del paziente, della pianificazione del trattamento in 3D e della somministrazione della dose. L’evoluzione tecnologica ha visto lo svilupparsi di tecniche conformazionali e stereotassiche di alta precisione che sono usate abitualmente nei tumori benigni della regione ipotalamo-ipofisaria (tabella 1).
| Tabella 1 Caratteristiche delle tecniche radianti usate per il trattamento dei tumori del basicranio |
|||||
| Tecnica radiante | Sorgente di radiazioni | Sistema di immobilizzazione | Frazionamento (numero di frazioni) | Accuratezza | |
| RT Convenzionale | Acceleratore con fotoni | maschera | convenzionale (25-30) | 3-5 mm | |
| IMRT (radioterapia ad intensità modulata) | Testo della cella | maschera | convenzionale (25-30) | 3-5 mm | |
|
Radiochirurgia |
LINAC | acceleratore con fotoni | casco fisso/riposizionabile stereotassico | singola | < 1 mm |
| GammaKnife | sorgente di cobalto-60 | casco fisso stereotassico | singola | < 1 mm | |
| CyberKnife | acceleratore con fotoni | maschera stereotassica | singola sessione/ ipofrazionato | < 1 mm | |
| FSRT (radioterapia stereotassica frazionata) | acceleratore con fotoni | casco/maschera stereotassica riposizionabile | ipofrazionato (3-5)/ convenzionale (25-30) | 1-3 mm | |
La radioterapia conformazionale
La radioterapia conformazionale (CRT) utilizza fotoni prodotti da un acceleratore lineare, costituito da un tubo in cui viene fatto passare un fascio di elettroni accelerato da campi elettromagnetici. Il fascio così generato, in seguito all’urto contro un blocco di tungsteno, genera fasci di fotoni X a diversa energia (generalmente compresa tra 6 e 18 MeV), che fuoriescono dalla testata dell’acceleratore per essere diretti contro il bersaglio prescelto.
I pazienti sono generalmente immobilizzati in una maschera personalizzata di materiale termoplastico, capace di garantire un’accuratezza del riposizionamento di 2-5 mm [2,3]. Le immagini utilizzate per la pianificazione del trattamento, ottenute con il paziente in posizione supina e immobilizzato nella maschera, sono generalmente ottenute con la tomografia computerizzata (TC) e la risonanza magnetica nucleare (RMN). Le immagini TC/RMN sono fuse utilizzando appositi software, che permettono di ottenere una ricostruzione tridimensionale (3D) del volume da irradiare e degli organi a rischio. La lesione tumorale visibile alla RMN/TC rappresenta il gross target volume (GTV), a cui viene aggiunto un margine in 3D di 4-8 mm. Il nuovo volume, definito planning treatment volume (PTV), rappresenta il bersaglio finale dell’irradiazione e tiene conto delle incertezze dovute ai possibili errori di riposizionamento del paziente. La pianificazione del trattamento in 3D ha lo scopo di ottenere una distribuzione di dose uniforme all’interno del target e nello stesso tempo di somministrare una dose che sia al di sotto dei limiti di tolleranza di strutture cerebrali circostanti, quali il chiasma ottico, i nervi cranici ed il tronco encefalico (figura 1). Una migliore uniformità di distribuzione della dose è in genere ottenuta con l’uso di 3-6 fasci di irradiazione, conformati in modo da riprodurre esattamente la forma del tumore (radioterapia conformazionale). Questo avviene attraverso l’uso di collimatori multilamellari presenti nella testata dell’acceleratore e costituiti da lamelle di 4-8 mm di spessore, e la cui posizione è determinata automaticamente sulla base di informazioni trasferite direttamente dal computer.

Figura 1. Durante la pianificazione del trattamento radioterapico vengono disegnati il volume bersaglio (adenoma ipofisario) e gli organi a rischio (A). La successiva visualizzazione in 3D permette di scegliere i campi di irradiazione più appropriati per ottenere la migliore distribuzione della dose all’interno del volume bersaglio, limitandola agli organi a rischio (B) .
Per garantire una buona qualità di cura, durante il trattamento la verifica del posizionamento del paziente viene effettuata con controlli radiologici. A tale scopo si utilizzano film portali, che sono immagini radiografiche acquisite mediante apposite pellicole ad alta definizione alloggiate nel lettino di trattamento o su strutture mobili dell’unità radioterapica. Queste immagini sono confrontate con immagini radiografiche digitali ricostruite (DRR) a partire dalle immagini TC ed acquisite in corso di pianificazione.
La radioterapia ad intensità modulata (IMRT) rappresenta una forma avanzata di radioterapia conformazionale 3D, rispetto alla quale presenta il vantaggio di ottenere una modulazione dell’intensità dei fasci di radiazione attraverso il movimento continuo (tecnica “sliding window”) o intermittente (tecnica “step-and-shoot”) delle lamelle dei collimatori. Questo permette una maggior conformazione geometrica del target, con conseguente risparmio di dose dei tessuti sani circostanti. L’IMRT è particolarmente utile in caso di tumori con forme complesse o di tipo concavo posti in prossimità di organi a rischio, come nel caso dei meningiomi della base del cranio. I trattamenti in IMRT sono generati usando un sistema detto di “planning inverso”, che elabora il piano di trattamento sulla base di una specifica prescrizione di dose, generata sulla base della tolleranza degli organi a rischio circostanti il tumore. La possibilità di avere immagini di alta definizione durante il trattamento per verificare in tempo reale la posizione del paziente caratterizza la radioterapia guidata dalle immagini (IGRT). Questa metodica si ottiene grazie a moderne apparecchiature di radioterapia che hanno incorporati dei sistemi tecnologici per la visualizzazione delle immagini, come la TC.
La Tomoterapia è un’apparecchiatura per radioterapia a fasci esterni, in cui la sorgente radiogena ruota in sincronia con un detettore TC attorno al lettino in un movimento longitudinale continuo. La sorgente radiogena dell'apparecchiatura è costituita da un acceleratore lineare, generalmente da 6 MV. Sull'uscita radiante dell’acceleratore è posto un collimatore a lamelle, che con il loro rapido movimento provvedono a modulare e scomporre il fascio di radiazione (IMRT). Dal lato opposto un sistema di rivelazione allo Xeno provvede a raccogliere le radiazioni che attraversano il paziente e a ricostruire, durante l'effettuazione del trattamento, un’immagine in 3D ad alta energia della regione irradiata (IGRT). La Tomoterapia si configura quindi come una tecnica di tipo IMRT/IGRT.
Tecniche stereotassiche
Le tecniche stereotassiche rappresentano un’evoluzione della radioterapia conformazionale ed offrono il vantaggio di poter ottenere una migliore accuratezza del posizionamento, grazie alla precisa immobilizzazione del paziente tramite l’utilizzo di un casco fisso o riposizionabile che sfrutta un sistema di markers fiduciali esterni. L’irradiazione stereotassica può essere effettuata in singola frazione (radiochirurgia) o come radioterapia stereotassica frazionata (SRT). La radiochirurgia (SRS) può essere somministrata utilizzando una sorgente di Cobalto-60 (Gamma Knife) o un acceleratore lineare (LINAC). L’immobilizzazione del paziente è generalmente effettuata con un casco stereotassico fissato al cranio con delle viti in anestesia locale, con un’accuratezza del posizionamento inferiore al millimetro. Nella SRT il paziente viene immobilizzato con un casco riposizionabile o una maschera termoplastica con un’accuratezza della metodica di 1-1.5 millimetri (Tabella 1) [4].
Il GammaKnife è un apparecchio costituito da 201 sorgenti di Cobalto-60, che generano un fascio di fotoni gamma convergente su un unico punto detto isocentro. Il paziente viene immobilizzato con un casco emisferico fissato con viti. L’utilizzo di collimatori con diametri di diverse grandezze, variabili tra i 4 ed i 18 mm, permette di modificare le dimensioni del fascio radiante. Nel trattamento di tumori di grandi dimensioni o di forma non sferica, come nel caso di alcuni tumori della base del cranio, viene usata una combinazione di diversi fasci sferici diretti verso differenti isocentri, il cui numero e la distribuzione viene scelta durante la pianificazione del trattamento in modo da adattarsi meglio al volume da irradiare (tecnica multi-isocentrica). Una simile distribuzione di dose può essere ottenuta con un acceleratore lineare con l’impiego di 10-20 campi fissi o con l’uso di 6-10 archi di rotazione.
Un’ulteriore evoluzione tecnologica è rappresentata dal CyberKnife, un sistema radiochirurgico costituito da un acceleratore lineare miniaturizzato montato su un braccio robotico, in grado di muoversi attorno al paziente in ogni direzione. La verifica del posizionamento è ottenuta attraverso l’acquisizione di immagini radiografiche con due camere a raggi X disposte attorno al paziente che è immobilizzato con una maschera termoplastica. Il sistema permette di ottenere lo stesso livello di precisione della SRS con casco fisso ed offre il vantaggio di poter trattare in poche frazioni (radiochirurgia multifrazionata) pazienti con tumori per i quali non vi è indicazione al trattamento radiochirurgico per la vicinanza con strutture critiche quali l’apparato ottico.
Nella SRT il paziente viene posizionato in un casco stereotassico riposizionabile, tuttavia il frazionamento utilizzato è quello convenzionale (45-55 Gy in frazioni giornaliere di 1.8-2 Gy). Vengono generalmente utilizzati 6-10 campi fissi multipli non coplanari, che vengono conformati alla forma del volume bersaglio con collimatori micromultilamellari con ampiezza di 2-4 mm. La SRT unisce così il vantaggio tecnologico del posizionamento stereotassico con il vantaggio radiobiologico del frazionamento convenzionale. Più di recente la SRT è stata utilizzata per trattamenti ipofrazionati (3-5 frazioni per un totale di 25-30 Gy), tuttavia rimane da dimostrare il vantaggio dell’ipofrazionamento in termini di controllo e minore tossicita rispetto alla radiochirurgia ed al frazionamento convenzionale.
Le differenti tecniche stereotassiche consentono di ottenere una maggiore precisione nell’irradiazione del tumore rispetto alla radioterapia conformazionale. Nonostante la supposta superiorità in termini di conformazione e di distribuzione della dose al target ottenuta con l’uso delle differenti apparecchiature radianti, i risultati clinici in termini di controllo della crescita tumorale e tossicità riportati in letteratura per i tumori della base del cranio sono simili [5-7]. La SRS rappresenta una tecnica di maggiore precisione rispetto alla SRT; tuttavia, alte dosi di radiazioni somministrate in singola frazione sono generalmente più tossiche per il tessuto cerebrale normale che dosi equivalenti somministrate in regime di frazionamento.
Nella pratica clinica la radiochirurgia viene in genere impiegata in lesioni con diametro massimo di 2.5-3 cm e distanti almeno 2-4 mm da strutture critiche. Al contrario, la SRT può essere utilizzata con sicurezza anche in tumori di dimensioni maggiori e posti in vicinanza di strutture critiche, in quanto la dose totale somministrata è nei limiti di tolleranza previsti per le normali strutture cerebrali, compreso l’apparato ottico.
Protoni
I protoni depositano la loro energia solo al termine della loro traiettoria attraverso i tessuti (picco di Bragg) e questo permette di modulare l’energia del protone in modo che coincida esattamente con la profondità del bersaglio tumorale. Queste caratteristiche fisiche dell’irradiazione protonica permettono di offrire, rispetto alle tecniche radianti 3D e stereotassiche con fotoni, una maggiore conformazione della dose radiante. L’irradiazione protonica può essere effettuata in singola frazione o come radioterapia stereotassica frazionata utilizzando gli stessi sistemi di immobilizzazione delle tecniche stereotassiche con fotoni (tabella 1).
Il controllo locale ottenuto con i protoni nei tumori benigni della base del cranio, quali adenomi e craniofaringiomi, è comparabile ai risultati offerti dalla SRT con fotoni, tuttavia con una riduzione della dose ai tessuti sani ed il conseguente rischio di tossicità a lungo termine [8]. Il vantaggio clinico dell’irradiazione protonica rimane tuttavia da confermare definitivamente in più ampie casistiche con lunghi follow-up.
Tossicità della radioterapia sull’encefalo
Gli effetti avversi da radiazioni dipendono da diversi fattori tra cui la dose erogata, il frazionamento, il volume irradiato ed il tipo di tecnica utilizzata. La tolleranza del tessuto cerebrale sano alle diverse dosi erogate e frazionamenti utilizzati può essere calcolata utilizzando il modello lineare quadratico dell’effetto delle radiazioni. Attraverso questo modello (che tiene in considerazione la dose totale erogata, la dose per frazione e il rapporto α/β dei tessuti irradiati - componenti del danno riparabile (α) e non riparabile (β) costanti per ogni tessuto), è possibile valutare l’equivalenza dell’efficacia biologica (BED) dei diversi schemi di trattamento e il danno potenziale alle strutture normali circostanti [9]. Tale modello, pur continuando a mantenere il suo valore nella pratica clinica, deve tuttavia essere applicato con cautela, in quanto non considera il tempo intercorrente tra le frazioni e le variazioni dei volumi irradiati.
Gli effetti avversi da radiazioni vengono classificati in acuti e cronici in relazione al periodo di insorgenza dall’irradiazione [10].
Gli effetti acuti compaiono durante o nelle settimane immediatamente successive al trattamento radiante e sono generalmente transitori. La manifestazione principale è rappresentata dalla sindrome da sonnolenza, caratterizzata da letargia, astenia, sonnolenza ed altri sintomi aspecifici che possono persistere fino a 6 settimane dopo il termine del trattamento. Lo sviluppo della sindrome sembra correlato ad un transitorio processo di demielinizzazione.
Gli effetti tardivi invece insorgono mesi o anni dopo il termine del trattamento radiante e la loro manifestazione più severa è rappresentata dalla necrosi del tessuto cerebrale.
Le manifestazioni cliniche dei danni da irradiazione dipendono dalla sede di trattamento. Nel caso di tumori sellari o parasellari i volumi irradiati possono comprendere anche strutture critiche come i nervi ottici, il chiasma, i tratti ottici, i nervi cranici presenti nel seno cavernoso, con possibile danno della funzione visiva e/o dell’oculomozione. In pazienti irradiati per tumori dell’ipofisi, craniofaringiomi o meningiomi con dosi di 45-50 Gy somministrate con frazionamento di 1.8-2.0 Gy per frazione, il rischio di deficit visivi conseguenti a danno del chiasma ottico è pari all’1-3%, tuttavia può essere superiore in presenza di un pre-esistente danno neurologico [11,12].
L’irradiazione di ampi volumi cerebrali è associata con lo sviluppo di deficit neurocognitivi in assenza di evidenti segni di danno al parenchima cerebrale, soprattutto in bambini sottoposti a trattamento radioterapico per tumori primitivi cerebrali [13-15]. Nei pazienti adulti il rischio di sviluppare deficit cognitivi dopo irradiazione parziale o dell’intero l’encefalo aumenta con la dose totale di radiazione, la dose per frazione (superiore a 2 Gy) e il volume di trattamento [16,17]. Tuttavia anche altri fattori, come la presenza di epilessia, l’estensione dell’intervento chirurgico e trattamenti chemioterapici, possono contribuire allo sviluppo del danno. L’introduzione delle moderne tecniche di radioterapia conformazionale ha portato ad una riduzione del rischio di sviluppare deterioramento cognitivo anche per volumi di irradiazione ampi e per dosi totali di 50-60 Gy con dosi singole inferiori a 2 Gy [18,19].
Il principale effetto collaterale tardivo della radioterapia convenzionale di tumori sellari è rappresentato dall’ipopituitarismo, che si manifesta nel 30-60% dei pazienti con adenomi ipofisari dopo circa 5-10 anni dall’irradiazione con dosi di 40-45 Gy. Il rischio di sviluppare deficit degli ormoni ipofisari inoltre aumenta con gli anni trascorsi dal trattamento radiante. Non è chiaro se la comparsa di ipopituitarismo sia da imputare ad un danno all’ipotalamo o all’ipofisi, ma è probabile che entrambe le strutture siano coinvolte.
La radioterapia può anche indurre danno vascolare. Pazienti con adenomi ipofisari e craniofaringiomi trattati con radioterapia convenzionale presentano un’aumentata incidenza di accidenti cerebrovascolari [20-22], anche se non si può escludere il contributo all’induzione del danno da parte di altri fattori come la presenza di comorbilità (ipertensione, diabete mellito, ipercolesterolemia) ed eventuali trattamenti farmacologici.
L’irradiazione cerebrale è associata ad un aumentato rischio di sviluppare un secondo tumore, generalmente un meningioma, con una prevalenza riportata del 2% a 20 anni in pazienti irradiati per tumori ipofisari [23,24]. Il rischio di tumori radio-indotti è correlato con il volume irradiato e con la dose somministrata.
La radioterapia stereotassica frazionata, rispetto alla radioterapia convenzionale, offre il vantaggio di una irradiazione localizzata con maggior risparmio del tessuto cerebrale sano e potenziale riduzione del rischio di complicanze tardive. Le alte dosi utilizzate nella radiochirurgia sono più tossiche per le strutture cerebrali normali rispetto a dosi equivalenti somministrate con un frazionamento convenzionale. Dosi singole di 15-18 Gy sono associate con un’incidenza di necrosi o deficit dei nervi cranici pari al 2-10% [25]. Dosi singole al chiasma ottico superiori a 10 Gy aumentano il rischio di sviluppare una neuropatia ottica [26]. Quindi in presenza di tumori di grandi dimensioni o posti in prossimità di strutture critiche, quali l’apparato ottico o il tronco encefalico, l’indicazione alla radiochirurgia dovrebbe essere valutata con attenzione.
Conclusioni
La radioterapia rimane parte integrante nel trattamento multidisciplinare dei tumori della base del cranio; le tecniche moderne hanno aumentato la precisione dei trattamenti radianti e consentono una significativa riduzione dei volumi di tessuto normale che ricevono elevate dosi di radiazioni, con una potenziale riduzione di tossicità a lungo termine. La radiochirurgia rappresenta una valida opzione in pazienti con tumori benigni di piccole dimensioni localizzati in sedi di difficile accesso chirurgico. Per tumori voluminosi o in stretta vicinanza di strutture cerebrali eloquenti, sono da preferire trattamenti frazionati in forma di SRT o IMRT.
Bibliografia
- Minniti G, Goldsmith C, Brada M. Radiotherapy. Handb Clin Neurol 2012, 104: 215-28.
- Gildersleve J, Dearnaley DP, Evans PM, Swindell W. Reproducibility of patient positioning during routine radiotherapy, as assessed by an integrated megavoltage imaging system. Radiother Oncol 1995, 35: 151-60.
- Karger CP, Jäkel O, Debus J, et al. Three-dimensional accuracy and interfractional reproducibility of patient fixation and positioning using a stereotactic head mask system. Int J Radiat Oncol Biol Phys 2001, 49: 1493-504.
- Kumar S, Burke K, Nalder C, et al. Treatment accuracy of fractionated stereotactic radiotherapy. Radiother Oncol 2005, 74: 53-9.
- Brada M, Ajithkumar TV, Minniti G. Radiosurgery for pituitary adenomas. Clin Endocrinol (Oxf) 2004, 61: 531-43.
- Minniti G, Esposito V, Amichetti M, et al. The role of fractionated radiotherapy and radiosurgery in the management of patients with craniopharyngioma. Neurosurg Rev 2009, 32: 125-32.
- Minniti G, Amichetti M, Enrici RM. Radiotherapy and radiosurgery for benign skull base meningiomas. Radiat Oncol 2009, 4: 42.
- Brada M, Pijls-Johannesma M, De Ruysscher D. Proton therapy in clinical practice: current clinical evidence. J Clin Oncol 2007, 25: 965-70.
- Fowler JF. The linear-quadratic formula and progress in fractionated radiotherapy. Br J Radiol 1989, 62: 679-94.
- Gutin PH, Leibel SA, Sheline GE. Radiation injury to the nervous system. New York: Raven Press; 1991.
- Flickinger JC, Nelson PB, Martinez AJ, et al. Radiotherapy of nonfunctional adenomas of the pituitary gland. Results with long-term follow-up. Cancer 1989, 63: 2409-14.
- Brada M, Rajan B, Traish D, et al. The long-term efficacy of conservative surgery and radiotherapy in the control of pituitary adenomas. Clin Endocrinol (Oxf) 1993, 38: 571-8.
- Grill J, Renaux VK, Bulteau C, et al. Long-term intellectual outcome in children with posterior fossa tumors according to radiation doses and volumes. Int J Radiat Oncol Biol Phys 1999, 45: 137-45.
- Massimo LM, Wiley TJ, Bonassi S, et al. Longitudinal psychosocial outcomes in two cohorts of adult survivors from childhood acute leukemia treated with or without cranial radiation. Minerva Pediatr 2006, 58: 1-7.
- Nagel BJ, Delis DC, Palmer SL, et al. Early patterns of verbal memory impairment in children treated for medulloblastoma. Neuropsychology 2006, 20: 105-12.
- Taphoorn MJ, Klein M. Cognitive deficits in adult patients with brain tumours. Lancet Neurol 2004, 3: 159-68.
- Laack NN, Brown PD. Cognitive sequelae of brain radiation in adults. Semin Oncol 2004, 31: 702-13.
- Klein M, Heimans JJ, Aaronson NK, et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet 2002, 360: 1361-8. Erratum in: Lancet 2011, 377: 1654.
- Klein M, Heimans JJ. The measurement of cognitive functioning in low-grade glioma patients after radiotherapy. J Clin Oncol 2004, 22: 966-7.
- Brada M, Burchell L, Ashley S, Traish D. The incidence of cerebrovascular accidents in patients with pituitary adenoma. Int J Radiat Oncol Biol Phys 1999, 45: 693-68.
- Tomlinson JW, Holden N, Hills RK, et al. Association between premature mortality and hypopituitarism. West Midlands Prospective Hypopituitary Study Group. Lancet 2001, 357: 425-31.
- Brada M, Ashley S, Ford D, et al. Cerebrovascular mortality in patients with pituitary adenoma. Clin Endocrinol (Oxf) 2002, 57: 713-7.
- Brada M, Rajan B, Traish D, et al. The long-term efficacy of conservative surgery and radiotherapy in the control of pituitary adenomas. Clin Endocrinol (Oxf) 1993, 38: 571-8.
- Minniti G, Traish D, Ashley S, et al. Risk of second brain tumor after conservative surgery and radiotherapy for pituitary adenoma: update after an additional 10 years. J Clin Endocrinol Metab 2005, 90: 800-4.
- Cho KH, Hall WA, Gerbi BJ, et al. Single dose versus fractionated stereotactic radiotherapy for recurrent high-grade gliomas. Int J Radiat Oncol Biol Phys 1999, 45: 1133-41.
- Leber KA, Berglöff J, Pendl G. Dose-response tolerance of the visual pathways and cranial nerves of the cavernous sinus to stereotactic radiosurgery. J Neurosurg 1998, 88: 43-50.
Terapia radiorecettoriale per adenomi ipofisari
Monica Finessi1, Desireè Deandreis1,2
1SCU Medicina Nucleare U, Dipartimento di Diagnostica per Immagini, AOU Città della Salute e della Scienza di Torino
2SCU Medicina Nucleare U, Dipartimento di Scienze Mediche, Università degli Studi di Torino
(aggiornato al 14 novembre 2020)
I tumori adeno-ipofisari sono nella maggior parte dei casi indolenti, ben controllati dalla terapia medica a lungo termine specifica per la secrezione, non invasivi e spesso risolvibili chirurgicamente. Tuttavia, alcune forme possono essere resistenti ai trattamenti disponibili e sono considerate clinicamente "aggressive".
Alla luce della loro origine embrionale, è stato dimostrato dal punto di vista anatomo-patologico come molti adenomi ipofisari possano esprimere i recettori selettivi per la somatostatina (SSTR) (1-3), che costituiscono la base fisiopatologica per il trattamento con analoghi della somatostatina. La valutazione in vivo dell’espressione dei SSTR per guidare la scelta terapeutica è possibile grazie a tecniche di imaging medico-nucleari, quali la scintigrafia con 111In-DTPA-octreotide (Octreoscan) o recentemente attraverso la PET/TC con DOTA peptidi marcati con 68Gallio (DOTA-TOC, DOTA-NOC, DOTA-TATE); tali radiofarmaci presentano maggiore affinità per i recettori di tipo 2 e 5.
Dal punto di vista medico-nucleare, lo stesso 111In-DTPA-octreotide, somministrato ad attività maggiori rispetto a quelle normalmente impiegate a scopo diagnostico, e gli analoghi della somatostatina marcati con radionuclidi quali 90Y o più recentemente 177Lu, definita come Peptide Receptor Radionuclide Therapy (PRRT), potrebbero essere utilizzati a scopi terapeutici attraverso l'irradiazione del tessuto attraverso l’emissione di particelle beta.
La PRRT con 90Y-DOTATOC e 177Lu-DOTATATE è una terapia attualmente autorizzata per la cura dei tumori neuroendocrini del tratto gastro-entero-pancreatico.
Un case report (4) ha dimostrato efficacia e sicurezza della PRRT in un paziente con una metastasi ipofisaria da tumore neuroendocrino trattata con 3 cicli di 90Y-DOTATOC (attività cumulativa 6.5 Gbq) e un ciclo di 177Lu-DOTATATE (attività cumulativa 4.44 Gbq), somministrati a intervalli di 4 mesi.
L’ipofisi normale presenta una fisiologica, seppur modesta, captazione all’Octreoscan e alla PET con 68Ga-DOTA peptidi, principalmente mediata dal recettore SSTR-2, ma alcuni studi in passato suggerivano come la PRRT non potesse essere un trattamento idoneo in caso di adenomi ipofisari (5-7). Nel 2012 è comparsa la prima segnalazione (8) di beneficio della PRRT in una paziente affetta da prolattinoma gigante resistente a cabergolina e octreotide, già sottoposta a multiple precedenti terapie fra cui la radioterapia a fasci esterni, precocemente sospesa per tossicità e con persistenza di importanti sequele neurologiche per coinvolgimento del seno cavernoso di sinistra, compressione ippocampale e dislocazione del III ventricolo e del mesencefalo. Dopo verifica dell’espressione dei SSTR, tramite la scintigrafia con Octreoscan, nell’ambito di un uso off-label, la paziente è stata sottoposta a 2 cicli di PRRT con 111In-DTPA-octreotide ad alte attività (7.4 GBq/ciclo), con beneficio sia sulle dimensioni della massa sia sulle condizioni cliniche. Ulteriori 2 cicli (7.0 GBq/ciclo) eseguiti a 6 mesi di distanza hanno favorito un’ulteriore riduzione della massa ipofisaria e stabilizzazione della malattia.
Nel 2014 è stato pubblicato un case report (9) di un paziente affetto da macroadenoma ipofisario non funzionante con infiltrazione nel seno cavernoso destro ed estensione al chiasma ottico, con espressione omogenea di SSTR-2 all’auto-radiografia del recettore con 125I-Tyr3-octreotide. In seguito a recidiva/progressione dell’adenoma dopo chirurgia transfenoidale, radioterapia per fasci esterni e radiochirurgia con gamma-knife (dose 50 Gy), per la nota alta espressione di SSTR-2 da parte dell’adenoma confermata in vivo tramite Octreoscan, il paziente è stato sottoposto a una terapia sperimentale con 1 ciclo di PPRT con 177Lu-DOTATOC (7.4 GBq), con successivo miglioramento della paralisi del nervo oculo-motore, stabilità radiologica dell’adenoma e funzione ipofisaria conservata.
Per quanto la letteratura disponibile a riguardo sia assai limitata, i due case report citati dimostrano come nel caso di adenomi ipofisari resistenti ai trattamenti convenzionali ed esprimenti i recettori SSTR-2 e 5, possa essere proposta, ove disponibile, una terapia sperimentale con analoghi della somatostatina marcati con 90Y o 177Lu. Per confermare queste evidenze sono necessari studi prospettici, ma le poche evidenze disponibili sono incoraggianti su un possibile utilizzo di questa strategia come valida opzione terapeutica.
Bibliografia
- Jaquet P, Ouafik L, Saveanu A, et al. Quantitative and functional expression of somatostatin receptor subtypes in human prolactinomas. J Clin Endocrinol Metab 1999, 84: 3268–76.
- Greenman Y, Melmed S. Expression of three somatostatin receptor subtypes in pituitary adenomas: evidence for preferential SSTR5 expression in the mammosomatotroph lineage. J Clin Endocrinol Metab 1994, 79: 724–9.
- Thodou E, Kontogeorgos G, Theodossiou D, Pateraki M. Mapping of somatostatin receptor types in GH or/and PRL producing pituitary adenomas. J Clin Pathol 2006, 59: 274–9.
- Goglia U, Ferone D, Sidoti M, et al. Treatment of a pituitary metastasis from a neuroendocrine tumour: case report and literature review. Pituitary 2008, 11: 93–102.
- De Herder WW, Ferone D, Kwekkeboom D, Lamberts SWJ. Scintigraphy of pituitary tumors. In: de Herder WW (ed). Functional and morphological imaging of the endocrine system. Endocrine Updates Series. Kluwer, Boston, 2000: 47–58.
- De Herder WW, Lamberts SWJ. Somatostatin analogs as radiodiagnostic tools. Rev Endocr Metab Disord 2005, 6: 23–7.
- De Herder WW, Kwekkeboom DJ, Feelders RA, et al. Somatostatin receptor imaging for neuroendocrine tumors. Pituitary 2006, 9: 243-8.
- Baldari S, Ferraù F, Alafaci C, et al. First demonstration of the effectiveness of peptide receptor radionuclide therapy (PRRT) with 111In-DTPA-octreotide in a giant PRL-secreting pituitary adenoma resistant to conventional treatment. Pituitary 2012, 15: 57–60.
- Komor J, Reubi JC, Christ ER. Peptide receptor radionuclide therapy in a patient with disabling non-functioning pituitary adenoma. Pituitary 2014, 17: 227–31.
- Giuffrida G, Ferraù F, Laudicella R, et al. Peptide receptor radionuclide therapy for aggressive pituitary tumors: a monocentric experience. Endocr Connect 2019, 8: 528-35.
- Maclean J, Aldridge M, Bomanji J, et al. Peptide receptor radionuclide therapy for aggressive atypical pituitary adenoma/carcinoma: variable clinical response in preliminary evaluation. Pituitary 2014, 17: 530-8.

