Classificazione ed epidemiologia
Pagina per i pazienti: l'incidentaloma surrenalico
Maria Elena Aloini1, Pina Lardo2, Antonio Stigliano1
1Dipartimento di Medicina Clinica e Molecolare, Ospedale Sant'Andrea, Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
2Ambulatorio Endocrinologia, Azienda Sanitaria Potenza
Si definisce “incidentaloma” una massa del surrene, che non dà sintomi, scoperta per caso facendo esami radiologici sull’addome per altri motivi. Trovarla è una cosa frequente, perché si fanno sempre più frequentemente esami radiologici.
Nella maggior parte dei casi si tratta di lesioni che interessano un solo surrene, ma entrambi possono essere interessati in un caso su 6.
In oltre tre quarti dei casi gli incidentalomi sono adenomi che prendono origine dalla corticale surrenalica senza dare eccesso di ormoni, ma in un sesto dei casi possono provocare una secrezione ormonale eccessiva, soprattutto di cortisolo. Una minoranza di casi (meno di 1 su 10) sono di origine maligna.
Al momento in cui vengono trovati per la prima volta, bisogna rispondere a due domande principali:
- c’è la possibilità che siano maligni?
- c’è una secrezione eccessiva di ormoni?
Le linee guida raccomandano che tutti gli incidentalomi surrenalici vengano sottoposti a un esame radiologico per verificare che abbiano caratteristiche di benignità. La TAC senza mezzo di contrasto è attualmente la metodica più affidabile per distinguere le lesioni surrenaliche benigne (aspetto omogeneo, margini regolari e contenuto ricco di grassi) da quelle maligne: se le caratteristiche della massa surrenalica ne indicano la natura benigna, non serve fare altri esami radiologici; se la natura non è chiara, è invece necessario approfondire con altri esami.
Per quanto riguarda la valutazione della secrezione, tutti devono essere sottoposti a un test in cui si prende per bocca 1 mg di desametasone la sera alle h 23 e si fa un prelievo di sangue per il dosaggio della cortisolemia la mattina successiva fra le 8 e le 9 (gli orari sono importanti, come pure il fatto di dormire regolarmente nel corso di quella notte). Se il livello di cortisolemia dopo questo test è inferiore a 1.8 μg/dL (50 nmol/L), si può escludere la secrezione autonoma di cortisolo. Se il livello è maggiore, potrebbero essere utili altri test. È importante definire la presenza di secrezione autonoma di cortisolo, perché è associata a maggiore presenza di fattori di rischio cardio-vascolare (obesità, diabete, ipertensione arteriosa, dislipidemia) e ad aumentato rischio di sviluppare malattie cardio-vascolari e metaboliche, osteoporosi e fratture, rischio trombotico. L’eccesso di cortisolo aumenta di 4-5 volte la mortalità, soprattutto per eventi cardio-vascolari (infarto e ictus) e per infezioni.
Si può poi eseguire il dosaggio delle metanefrine (nel sangue o nelle urine delle 24 ore) per escludere un particolare tipo di lesione surrenalica, il feocromocitoma, nel caso di dubbio ai risultati della TAC o comunque sempre prima di eseguire una biopsia surrenalica o andare all’intervento chirurgico (se si decide di asportare la lesione).
In presenza di ipertensione e/o bassi livelli di potassio nel sangue, è raccomandata l’esecuzione di un altro test, il rapporto aldosterone/renina nel sangue, per escludere un’altra forma di eccessiva secrezione ormonale, l’iperaldosteronismo primitivo.
Infine, nei pazienti con aspetti radiologici o clinici che facciano sospettare iperandrogenismo o carcinoma cortico-surrenalico, va eseguito anche il dosaggio degli ormoni sessuali e dei loro precursori.
Fatto l’inquadramento diagnostico (lesione benigna/maligna, eccesso di ormoni sì/no), bisogna decidere la terapia.
C’è accordo sul fatto che vadano asportate chirurgicamente le lesioni maligne e quelle che producono eccesso di ormoni. Negli altri casi non esistono al momento sufficienti evidenze per definire quale sia la terapia migliore (chirurgia, farmaci o semplici controlli nel tempo). Le linee guida lasciano scegliere, sulla base delle caratteristiche della singola lesione e del singolo paziente, tenendo conto anche delle sue preferenze.
È stato dimostrato che l’asportazione del surrene che contiene il nodulo con secrezione autonoma di cortisolo porta a risultati migliori per quanto riguarda la diminuzione della mortalità e delle patologie prima descritte. La chirurgia deve quindi essere presa in considerazione in presenza di patologie correlate all’eccesso di cortisolo (ipertensione, diabete, dislipidemia, osteoporosi) multiple, progressive, che non rispondono ai trattamenti specifici, associate a danno d’organo. Ma il paziente deve essere in condizioni tali da poter affrontare l’intervento ed essere preparato alla possibilità di dover fare (anche per un tempo molto lungo) una terapia sostitutiva con cortisone, finché il surrene rimasto non è in grado di produrre abbastanza cortisolo per le necessità dell’organismo.
Se l’intervento chirurgico non è indicato o si decide di non operare per una qualsiasi ragione, bisogna comunque fare dei controlli clinici nel tempo per valutare lo sviluppo/peggioramento di patologie potenzialmente associate all’eccesso ormonale (pressione arteriosa, metabolismo glucidico e lipidico, elettroliti, …). Inoltre, poichè gli adenomi con chiare caratteristiche radiologiche di benignità generalmente non crescono di dimensioni, mentre le masse maligne hanno una rapida crescita, le LG indicano che:
- se alla prima valutazione le caratteristiche radiologiche sono senza dubbio benigne, indipendentemente dalle dimensioni, non è necessario ripetere esami radiologici;
- negli altri casi è meglio ripetere nel tempo gli esami radiologici per verificare se le dimensioni rimangono stabili o se crescono (e in tal caso prendere gli opportuni prtovvedimenti).
Bibliografia
- Bourdeau I, El Ghorayeb N, Gagnon N, Lacroix A. Differential diagnosis, investigation and therapy of bilateral adrenal incidentalomas. Eur J Endocrinol 2018, 179: R57–67.
- Elhassan YS, Alahdab F, Prete A, et al. Natural history of adrenal incidentalomas with and without mild autonomous cortisol excess: a systematic review and meta-analysis. Ann Intern Med 2019, 171: 107-16.
- Fassnacht M, Tsagarakis S, Terzolo M, et al. European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol 2023, 189: G1–42.
- Aresta C, Favero V, Morelli V, et al. Cardiovascular complications of mild autonomous cortisol secretion. Best Pract Res Clin Endocrinol Metab 2021, 35: 101494.
Pagina per pazienti: cosa è la tiroide e a cosa serve
Dominique Van Doorne
La tiroide è una ghiandola a forma di farfalla, collocata nella parte più bassa e anteriore del collo, al di sotto del cosiddetto “pomo di Adamo” (cartilagine tiroidea) e al di sopra della “fossetta del giugulo” e dello sterno. È costituita da due lobi, ciascuno di circa 5 cm di diametro (le dimensioni di una piccola prugna), uniti fra loro per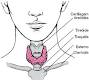 mezzo di una giunzione di tessuto chiamata “istmo”.
mezzo di una giunzione di tessuto chiamata “istmo”.
La tiroide è quindi un organo piuttosto piccolo, ma è comunque importante perché regola lo sviluppo e la crescita, i processi metabolici ed il consumo di energia dell’intero organismo attraverso la produzione di due ormoni: la tiroxina (T4) e la tri-iodotironina (T3). Per la sintesi di questi ormoni è indispensabile lo iodio ed è questo il motivo per cui un insufficiente apporto alimentare di iodio può essere seguito da conseguenze sfavorevoli.
In gravidanza il fabbisogno di iodio e di ormone tiroideo aumenta sensibilmente, con una tendenza all’incremento delle dimensioni della tiroide. Questo fenomeno è tanto più evidente quanto maggiore è la carenza di iodio nella gestante. Nella donna che pianifica una gravidanza è opportuno un supplemento di iodio nella dieta, che dovrebbe costituire un'integrazione corrente, in modo analogo a quella di ferro e folati.
Gli ormoni tiroidei T4 e T3 circolano nel sangue legati a proteine di trasporto e solo una piccola parte di essi che rimane libera (definite come FT3 e FT4, dove F sta per Free in inglese) è in grado di svolgere la propria attività ormonale. Il TSH, ormone prodotto dall'ipofisi (una piccola ma importante ghiandola posta alla base del cranio), ha il compito di regolare accuratamente il livello di funzione della tiroide.
Quando la tiroide funziona meno del necessario (condizione chiamata “ipotiroidismo”), gli ormoni tiroidei FT3 e FT4 diminuiscono, mentre il TSH nel sangue è solitamente elevato (vedi ipotiroidismo); al contrario, quando la funzione tiroidea è eccessiva (condizione chiamata “ipertiroidismo”) i livelli del TSH si abbassano e gli ormoni tiroidei aumentano (vedi ipertiroidismo).
Pagina per i pazienti sull'osteoporosi
Giorgio Borretta, Endocrinologo, Ospedale S. Croce e Carle, Cuneo
Giusi Beretta Anguissola, Endocrinologo, Campus Biomedico, Roma
Daniela Bosco, Endocrinologo, Ospedale S. Giovanni, Roma
Roberto Cesareo, Endocrinologo, Ospedale S. Maria Goretti, Latina
Vincenzo Fiore, Endocrinologo, Ospedale Civile di Tivoli
G. Mancini, Endocrinologo, Ospedale Civile di Palestrina
Laura Mallardo, Endocrinologo, Ospedale S. Pertini, Roma
Sergio Mariani, Endocrinologo, Ospedale S. Spirito, Roma
Giuseppe Monti, Endocrinologo, Ospedale Sant’Andrea, Roma
Andrea Palermo, Endocrinologo, Campus Biomedico, Roma
Gregorio Reda, Endocrinologo, Ospedale S. Pertini, Roma
R. Tozzi, Fisiatra, Ospedale S. Maria Goretti, Latina
Michele Zini, Endocrinologo, Arcispedale A. Maria Nuova, Reggio Emilia
COSA È L’OSTEOPOROSI?
L’osteoporosi è una malattia dello scheletro caratterizzata da alterazioni qualitative e quantitative della massa ossea, che predispongono l’osso stesso a un aumentato rischio di fratture. Questa malattia interessa soprattutto le ossa sottoposte a maggior carico, cioè le vertebre, il femore, le ossa del polso e le coste.
Sono considerate primitive le forme di osteoporosi che compaiono dopo la menopausa e con l’avanzare della età, secondarie quelle determinate da un ampio numero di patologie e farmaci.
L’osteoporosi è una malattia di rilevanza sociale. La sua incidenza aumenta con l’età e interessa la maggior parte della popolazione oltre l’ottava decade di vita.
Le fratture osteoporotiche rappresentano una delle maggiori cause di mortalità tra gli anziani.
COME SI MANIFESTA L’OSTEOPOROSI?
L’osteoporosi è una malattia insidiosa, perchè decorre per lungo tempo senza che ci siano segni clinici o sintomi rilevanti.
Tra le manifestazioni cliniche più importanti ricordiamo:
- dolore osseo acuto, che può essere la spia di una frattura ossea (soprattutto vertebrale);
- dolore cronico persistente, che tende a peggiorare con la stazione eretta prolungata o con l’attività fisica;
- riduzione della statura (quando superiore a 4 cm è indice di osteoporosi di grado severo);
- modificazioni della postura e atteggiamento cifotico della colonna.
QUALI SONO I FATTORI DI RISCHIO PER L’OSTEOPOROSI?
Il 30% del rischio di osteoporosi è rappresentato da fattori genetici, il rimanente 70% è riconducibile a fattori ambientali, sui quali si può intervenire tramite opera di prevenzione e informazione.
Tra i più importanti fattori di rischio ricordiamo:
- età
- sesso femminile
- menopausa precoce
- inadeguata assunzione di calcio e vitamina D
- familiarità per fratture osteoporotiche
- immobilizzazione prolungata a letto
- malattia della tiroide o delle paratiroidi
- insufficienza renale
- malassorbimento
- magrezza (BMI < 19)
- fumo
- abuso di alcool
- farmaci (soprattutto cortisone)
OSTEOPOROSI SECONDARIA
L’osteoporosi secondaria va sempre distinta da quella post-menopausale o senile.
Le cause di osteoporosi secondaria più comuni sono:
- endocrine: ipogonadismo, ipertiroidismo, ipercortisolismo, iperparatiroidismo, diabete mellito
- nutrizionali: malattia celiaca, carenza di vitamina D, sindromi da malassorbimento
- farmaci: cortisone, ormoni tiroidei, eparina, anti-epilettici, GnRH-agonisti, diuretici dell’ansa, ciclosporina, inibitori dell’aromatasi, chemioterapici
- malattie renali
- altre: artrite reumatoide e altre patologie reumatiche, trapianti d’organo, mieloma, anoressia.
DIAGNOSI DIFFERENZIALE
L’esclusione di forme secondarie può essere fatta con pochi esami di primo livello: emocromo, VES, protidemia frazionata, calcio, fosforo, fosfatasi alcalina totale, creatinina, calciuria nelle 24 h.
Le forme di osteoporosi secondaria comportano percorsi diagnostici specifici, con esami di II livello: calcio ionizzato, TSH, PTH, 25OH-vitamina D, cortisolo libero urinario, testosterone, immunofissazione sierica e/o urinaria, anticorpi anti-transglutaminasi, esami specifici per patologie associate.
Almeno nei soggetti anziani, visto l'alto tasso di carenza di vitamina D, il dosaggio della vitamina D andrebbe inserito tra gli esami di primo livello.
COME SI FA LA DIAGNOSI DI OSTEOPOROSI?
Oltre all’esame clinico e agli esami di laboratorio, il miglior modo di identificare i pazienti a rischio elevato di osteoporosi è la valutazione qualitativa e quantitativa della densità ossea tramite i seguenti esami strumentali.
Densitometria ossea (DEXA)
È a tutt’oggi l’esame di riferimento per la diagnosi di osteoporosi, in quanto in grado di quantificare la riduzione della massa ossea e valutare nel tempo l’efficacia del trattamento.
Il parametro di elezione per la diagnosi di osteoporosi secondo i criteri OMS è una Bone Mineral Density (BMD) con valore di T-score < - 2.5 misurata con tecnica DEXA.
L’esame è rapido, indolore e comporta una irrilevante esposizione radiante. La DEXA va eseguita in tutte le donne dopo i 65 anni di età, ma in presenza di fattori di rischio va anticipata nelle donne e eseguita anche nei maschi. L’esame è eseguito a livello della colonna lombare e del femore, e in casi particolari a livello dell’avambraccio. La sua ripetizione è raramente giustificata a intervalli inferiori ai 2 anni. Densitometri di ultima generazione sono anche in grado di rilevare parametri dell'osso di tipo qualitativo, finalizzati alla valutazione della microarchitettura dell'osso e che pertanto forniscono dati aggiuntivi alla valutazione del rischio di frattura.
Ultrasonografia ossea (QUS)
Fornisce parametri che sono indici indiretti di massa e integrità strutturale dell’osso, misurati a livello del calcagno e delle falangi. Il suo utilizzo è complementare alla densitometria ossea (DEXA).
Rx colonna vertebrale
Permette lo studio morfometrico delle vertebre. Tale esame, inutile per porre diagnosi di osteoporosi, è fondamentale quando abbiamo il sospetto che il paziente possa avere una frattura vertebrale. Il tratto della colonna vertebrale che deve essere valutato è quello dorso-lombo-sacrale.
COME SI PREVIENE L’OSTEOPOROSI?
La prevenzione è possibile e si effettua correggendo i fattori di rischio.
Astensione dal fumo e dall’alcool.
Attività fisica continuativa, al fine di prevenire il rischio di cadute e fratture: camminare per più di 30 minuti al giorno oppure attività fisica personalizzata, tesa al rinforzo muscolare e alla rieducazione all’equilibrio e alla deambulazione.
Adeguato apporto di calcio: il fabbisogno di calcio quotidiano varia a seconda delle varie età della vita come si vede nella tabella.
| Necessità di calcio |
|
| 1-5 anni | 800 mg/die |
| 6-10 anni | 800-1200 mg/die |
| 11-24 anni | 1200-1500 mg/die |
| 25-50 anni | 1000 mg/die |
| Gravidanza e allattamento | 1200-1500 mg/die |
| Donne post-menopausa in trattamento estrogenico Uomini di 50-65 anni |
1000 mg/die |
| Donne post-menopausa senza trattamento estrogenico Uomini oltre i 65 anni |
1500 mg/die |
| Contenuto medio di calcio in alcuni alimenti | |
| Alimento | mg Ca/100 g alimento |
| Formaggi a lunga stagionatura (grana, emmenthal) | 900-1100 |
| Formaggi a media stagionatura (taleggio, fontina, provolone) | 600-900 |
| Formaggi frechi (ricotta, mozzarella, robiola) | 400-600 |
| Pesce azzurro | 350 |
| Rucola | 300 |
| Mandorle, noci, nocciole | 250-300 |
| Cavoli, rape, verze, fagioli | 250 |
| Gamberetti | 120 |
| Latte e yogurth (intero e magro) | 100-120 |
| Spinaci, broccoli | 80-100 |
Adeguato apporto di vitamina D (indispensabile all’ assorbimento del calcio). La vitamina D è prodotta dal nostro organismo dopo sufficiente esposizione alla luce solare (almeno mezz’ora ogni giorno) ed è assunta in minor misura con gli alimenti.
| Contenuto medio di vitamina D in alcuni alimenti | |
| Alimento | UI di vitamina D/porzione |
| Olio di fegato di merluzzo | 1360/cucchiaio |
| Salmone grigliato | 360/100 g |
| Sgombro grigliato | 345/100 g |
| Sardine in scatola | 250/50 g |
| Tonno in olio | 200/85 g |
| Uovo | 20/tuorlo |
| Formaggio svizzero | 12/30 g |
Qualora l’apporto di calcio e vitamina D sia insufficiente, è necessaria una supplementazione farmacologica. Le dosi di calcio vanno commisurate al grado di carenza alimentare e in genere oscillano tra i 500-1000 mg al giorno. È sempre utile una supplementazione con 800-1000 UI/die di vitamina D.
Un adeguato apporto di calcio e vitamina D rappresenta la premessa per qualsiasi trattamento farmacologico specifico. La carenza di calcio e vitamina D è la causa più comune di mancata risposta alla terapia farmacologica dell’osteoporosi.
QUALE ATTIVITÀ FISICA?
Nelle persone anziane la forza muscolare si riduce dal 2 al 4% ogni anno, a partire dalla sesta decade. Questo è dovuto alla riduzione sia della massa muscolare che delle dimensioni e del numero di fibre e di cellule nervose nel midollo spinale. Dopo gli 80 anni la riduzione della forza muscolare è inoltre associata a un graduale aumento delle limitazioni funzionali e della frequenza di cadute.
L'attività fisica, migliorando la forza muscolare, è efficace nella prevenzione dell'osteoporosi e delle cadute.
Negli anziani è controindicata un'attività fisica a elevato impatto, come la corsa o i salti, perché può provocare dolore articolare, fratture da stress e danni della cartilagine articolare. È consigliabile quindi praticare attività con basso o moderato impatto di carico come il cammino e gli esercizi di resistenza (sollevare e abbassare un carico leggero per più ripetizioni). Le continue contrazioni muscolari e le sollecitazioni dei tendini stimolano l’aumento della densità dell’osso. Negli anziani anche un’attività moderata, come una passeggiata, viene attualmente considerata valida nella prevenzione dell’osteoporosi e delle fratture. Camminare per più di 30 minuti al dì svolge un’azione positiva, aumentando la destrezza e riducendo il rischio di cadute.
È opportuno sottolineare che, con caratteristiche e obiettivi diversi, l’attività fisica è indispensabile in ogni età al fine di prevenire l’insorgenza dell’osteoporosi.
Attività fisica adattata all’età
Nei bambini e in età giovanile, dove è necessario il raggiungimento del massimo picco di massa ossea, è consigliabile un’attività sportiva regolare, preferibilmente in carico e con un impatto importante (calcio, basket, atletica leggera, pallavolo, …).
Nella prima età post-menopausale e nelle donne in pre-menopausa si devono creare i presupposti per un mantenimento o una minore riduzione possibile della massa ossea, incoraggiando una regolare attività fisica, personalizzando la tipologia degli esercizi.
Nelle persone anziane l'attività fisica ha come obiettivi la prevenzione delle cadute, il miglioramento dell’agilità, dell’equilibrio e della coordinazione.A volte l’anziano può trovare beneficio da attività collettive come la danza che, oltre a migliorare la forza muscolare e la capacità aerobica, può svolgere un ruolo determinante nel migliorare l’equilibrio e la coordinazione, prevenendo le cadute, costituendo anche un’alternativa per quei soggetti non adatti a praticare esercizi di rinforzo muscolare.
TERAPIA FARMACOLOGICA
A tutt’oggi sono in commercio numerosi farmaci in grado di arrestare l’evoluzione della malattia e di ridurre, in particolare, il rischio di fratture vertebrali, non vertebrali e di femore.
Esula tuttavia dallo scopo di questa trattazione la descrizione di tali farmaci e per essi si rimanda ad un confronto con lo specialista di fiducia esperto in patologie osteometaboliche.
CONCLUSIONI
L’approccio moderno al paziente con osteoporosi, accanto alla valutazione dei valori densitometrici, pone particolare attenzione alla valutazione dei fattori di rischio. Il peso di tali fattori, valutato singolarmente e/o in associazione, può aumentare considerevolmente il rischio fratturativo a 10 anni e rendere giustificabile una terapia farmacologica prescindendo, in alcuni casi, dalla valutazione densitometrica.
Pagina per i pazienti: ipotiroidismo
Dominique Van Doorne
L'ipotiroidismo è un quadro clinico dovuto alla riduzione degli ormoni tiroidei in circolo. E' una patologia molto frequente, in particolare nel sesso femminile e negli anziani.
Quali sono le cause?
Le principali sono rappresentate da:
- tiroidite cronica autoimmune, nota anche come tiroidite di Hashimoto;
- pregressi interventi chirurgici di asportazione, totale o parziale, della tiroide;
- pregressa somministrazione di iodio radioattivo per il trattamento dell’ipertiroidismo;
- impiego di farmaci anti-tiroidei (propiltiouracile, metimazolo), o di farmaci in grado di interferire con la funzione tiroidea (es. amiodarone e litio);
- carente introduzione di iodio con gli alimenti;
Molte delle cause indicate nell'elenco sopra riportato sono iatrogene, cioè riconducibili a trattamenti chirurgici o medici che comportanto l'asportazione totale o parziale della tiroide o il blocco funzionale della ghiandola: in tutti questi casi l'ipotiroidismo costituisce un risultato atteso ed è facilmente prevenibile qualora il paziente si sottoponga ai controlli medici stabiliti.
La tiroidite autoimmune è una condizione oggi estremamente frequente nella popolazione generale, in particolare nel sesso femminile: si calcola che tale problema arrivi a interessare il 10-20% delle donne di età superiore ai 50-60 anni. Fortunatamente, in molti casi l'ipotiroidismo si sviluppa tardivamente e in modo estremamente lento e graduale: per molti anni la tiroidite determina infatti minime alterazioni della funzionalità tiroidea, che nella maggior parte dei pazienti non si associano a sintomi di rilievo (ipotiroidismo subclinico). Il riconoscimento precoce di tale condizione è tuttavia importante per anticipare l'evoluzione alla fase sintomatica della malattia e perché può provocare negli anni un aterosclerosi precoce.
La grave carenza alimentare di iodio, in grado di causare ipotiroidismo, è un'eventualità rara; tuttavia va sottolineato che nella popolazione italiana in genere l'apporto iodico è tendenzialmente insufficiente. Di qui l'avvio di programmi di prevenzione, stabiliti da un apposita legge sulla iodoprofilassi del 2005, basati sull'impiego di sale iodato. Si tratta di sale fortificato con iodio, facilmente reperibile in tutti i punti di vendita, il cui impiego non presenta sostanziali controindicazioni. Il consumo di sale iodato assicura l'introduzione giornaliera di una dose fisiologica di iodio, equivalente al contenuto di iodio in 150-200 grammi di pesce di mare. In gravidanza il fabbisogno di iodio deve essere incrementato (250-300 µg al giorno), per garantire una corretta funzione della tiroide fetale. E' opportuno usare un integratore con iodio, perché l'assunzione di 250 µg di iodio alimentare è possibile solo con un consumo quasi quotidiano di pesce di mare.
Quali sono i sintomi dell'ipotiroidismo?
L’ipotiroidismo si associa in modo caratteristico ad un rallentamento generalizzato delle funzioni corporee. Si osserva un rallentamento dell’attività fisica e di quella mentale, della funzione cardiovascolare, di quella gastrointestinale e di quella neuromuscolare.
I sintomi tendono ad apparire gradualmente, nell'arco di un lungo periodo di tempo. Il rallentamento del metabolismo negli anziani viene considerato un cambiamento naturale dovuto all'età; pertanto, una condizione di ipotiroidismo senile risulta spesso misconosciuta.
I sintomi tipici dell’ipotiroidismo sono:
- sensazione di freddo
- stanchezza a carattere ingravescente
- depressione, apatia
- sonnolenza diurna, anche dopo aver dormito tutta la notte
- difficoltà di concentrazione e di memoria
- aumento di peso in genere di grado modesto
- stipsi
- cute secca
- gonfiore del viso
- voce rauca
- capelli secchi e fragili
Come si fa la diagnosi?
La diagnosi di ipotiroidismo si fa effettuando un prelievo di sangue per misurare la concentrazione di TSH, che risulta elevato, e di FT4 che è spesso al limite inferiore della norma nelle forme lievi oppure francamente ridotto nelle forme conclamate. Nel caso di un lieve aumento del TSH (tra 2.5 e 5.5), associato ad FT4 nei limiti, si parla di ipotiroidismo subclinico. Questa condizione necessita di essere trattata farmacologicamente soprattutto nella donna in età fertile al fine di evitare un ipotiroidismo in gravidanza, condizione quest'ultima in grado di compromettere lo sviluppo neuropsichico del bambino.
La diagnosi di Tiroidite Cronica Autoimmune è possibile grazie al riscontro di anticorpi positivi anti-TPO e/o anti-tireoglobulina; il dosaggio di tali anticorpi è necessario nella fase di inquadramento clinico iniziale, mentre la ripetizione del dosaggio nel tempo non fornisce in genere informazioni di utilità clinica.
Come si cura l'ipotiroidismo?
L’ipotiroidismo viene curato con la somministrazione di ormone tiroideo (principalmente tiroxina). Si tratta pertanto di un trattamento sostitutivo, perché il paziente assume la quantità di ormone che la tiroide non è più in grado di produrre autonomamente.
L'assunzione della tiroxina avviene per bocca, al mattino a digiuno, almeno 30 minuti prima della colazione. Si inizia con una piccola dose, destinata ad essere gradualmente aumentata finché non si ottiene una normalizzazione del TSH (prova che è stata raggiunta la dose appropriata).
L'assunzione di tiroxina in compresse o in soluzione è praticamente priva di effetti collaterali. Gli effetti collaterali descritti nel foglietto illustrativo sono riconducibili all'eventuale sovradosaggio della tiroxina.
Stabilita la dose necessaria, è sufficiente controllare la funzionalità tiroidea una volta all'anno. Il semplice dosaggio del TSH è in genere sufficiente per tale valutazione.
La comparsa di malattie acute o croniche intercorrenti, in particolare a carico del tratto gastrointestinale, o variazioni rilevanti del peso corporeo possono rendere necessari aggiustamenti del dosaggio. In questi casi è suggeribile ricontrollare il livello di TSH e, se necessario, modificare il dosaggio della tiroxina.

