Inquadramento generale diagnostico della gonade maschile
In collaborazione con SIAMS
Anatomia dell'apparato genitale maschile
Antonio Agostino Sinisi
UOSD di Andrologia, AOU-SUN, Dipartimento di Scienze Cardiologiche e Respiratorie, Seconda Università di Napoli
Le strutture anatomiche che compongono l’apparato genitale maschile svolgono funzioni differenti, che si integrano tra di loro per permettere l’attività riproduttiva e sessuale:
- i testicoli producono gli ormoni sessuali e gli spermatozoi;
- l’epididimo ha funzione di deposito e maturazione dei gameti;
- i dotti deferenti e i dotti eiaculatori permettono il loro trasporto all’uretra peniena;
- le ghiandole accessorie (prostata, vescicole seminali e ghiandole bulbo-uretrali) producono il liquido in cui vengono veicolati (eiaculato);
- il pene permette, durante il rapporto sessuale, la penetrazione in vagina e l’emissione dell’eiaculato nelle vie genitali interni femminili.
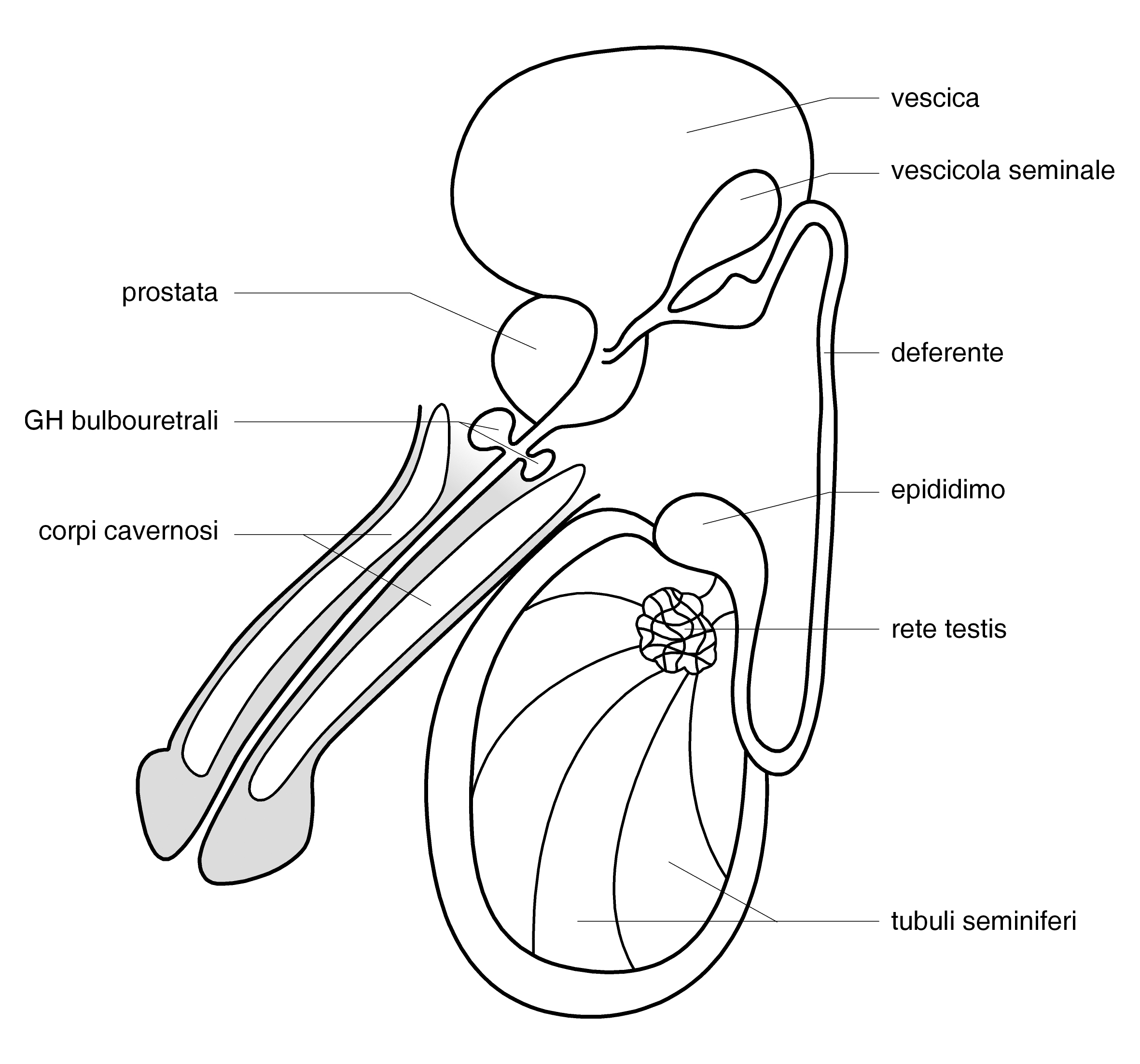
I GENITALI ESTERNI
Lo scroto
È una formazione sacciforme con doppia concamerazione contenente le gonadi, collocata posteriormente alla base del pene nel perineo anteriore. La sacca scrotale è costituita dalla cute, da una fascia membranosa, il dartos, una fascia cremasterica, il muscolo cremastere e la tunica vaginale. Sulla linea mediana corre una rilevatura lineare, il rafe, che continua sulla faccia ventrale del pene.
Il pene
Può essere diviso in tre parti: base, corpo e glande.
La base o radice del pene è costituita dalle crura e dal bulbo. Le crura sono formazioni cilindriche pari, che prossimalmente sono ancorate alle branche ischio-pubiche e distalmente si uniscono sulla linea mediana a formare i corpi cavernosi. Il bulbo contiene l’uretra e si prolunga in avanti a formare il corpo spongioso. Le crura e il bulbo sono avvolti dai muscoli ischio- e bulbo-cavernosi, che, insieme al legamento fundiforme, ancorano il pene alla parete ischio-pubica. Un altro legamento, detto sospensore, mantiene sospeso il pene in posizione perpendicolare alla parete addominale nella fase di erezione.
Il prolungamento anteriore del bulbo o corpo spongioso si situa ventralmente ai corpi cavernosi, dando così origine alla struttura a tre cilindri, due dorsali ed uno ventrale, del corpo del pene o asta.
La parte distale del corpo spongioso, adagiata ventralmente e anteriormente ai corpi cavernosi, si dilata a formare il glande. Questo ha un aspetto conico arrotondato, con la parte prossimale al corpo più larga (corona del glande) e con l’apice smusso forato dal meato uretrale. L’uretra maschile, infatti, nasce dalla base della vescica, attraversa la prostata e il trigono urogenitale e si affonda nel corpo spongioso per aprirsi all’apice del glande. La cute che riveste il pene si ripiega nel solco balano-prepuziale, a formare una plica mucocutanea, il prepuzio, che ricopre il glande quando è flaccido ed è molto elastica, ritraendosi durante l’erezione. Sia a livello della cute basale del pene che all’interno del solco balanico vi sono delle ghiandole esocrine.
Oltre che dalla cute, il pene è avvolto da una fascia superficiale, detta dartos, che è in contiguità con la fascia inguinale e perineale di Colles, e da due fasce più interne: la fascia profonda o di Buck e la tunica albuginea. La prima è molto rigida e avvolge i corpi cavernosi e ventralmente in un comparto separato il corpo spongioso dell’uretra. La fascia più interna, l’albuginea, aderisce ai corpi cavernosi, forma medialmente uno spesso setto tra i due corpi e ventralmente una doccia, nella quale poggia il corpo spongioso dell’uretra. L’albuginea è fatta da due strati di fibre: uno longitudinale più esterno e uno circolare più interno, che sono in continuità con il tessuto spongioso dei corpi cavernosi. Questo tessuto ha una peculiare struttura vascolare fatta da sinusoidi o lacune endoteliali, separati da trabecole ricche di fibre elastiche e muscolari lisce (1). Dalle lacune partono venule post-cavernose che drenano il sangue verso i plessi venosi sub-albuginei. Il corpo spongioso ha una struttura simile. Il rilasciamento delle fibre muscolo-elastiche delle trabecole fa affluire sangue nelle lacune sinusoidali, drenandolo dalle arterie elicine, che sono rami terminali delle arterie cavernose del pene, che, a loro volta, fanno parte del sistema arterioso profondo del pene. Il riempimento di sangue degli spazi sinusoidali fa dilatare la struttura spongiosa, che va a comprimere i plessi venosi contro la membrana rigida dell’albuginea, impedendo il drenaggio venoso. Questi cambiamenti emodinamici sono alla base della tumescenza e dell’irrigidimento del pene durante l’erezione.
La vascolarizzazione arteriosa profonda del pene è data dal sistema dell’iliaca interna, da cui deriva l’arteria pudenda che, a sua volta, dà origine all’arteria peniena. Quest’ultima si divide in tre rami: l’arteria dorsale del pene, l’arteria cavernosa e l’arteria bulbare, che sono ampiamente anastomizzate tra di loro. Vi è un sistema arterioso superficiale del pene, che deriva dalla pudenda esterna, ramo della femorale, deputato all’irrorazione della cute e della fascia superficiale.
Il sistema venoso profondo del pene comprende la vena dorsale, le vene cavernose, le vene crurali e le bulbari. Il sangue dei sinusoidi si raccoglie in plessi venosi sub-albuginei, dai quali viene drenato da vene emissarie che perforano l’albuginea e inviato nei 2/3 distali dei corpi cavernosi verso le vene circonflesse e le vene spongiose, emissarie della vena dorsale profonda, la quale decorre sulla linea mediana e si innesta nel plesso venoso peri-prostatico del Santorini. Anche il sangue refluo dal bulbo uretrale confluisce in questo plesso. Il sangue venoso della parte prossimale dei corpi e della parte dorso-laterale delle radici viene drenato dalle emissarie direttamente nelle vene cavernose e crurali, che confluiscono nella vena pudenda interna e, quindi, nel sistema dell’iliaca interna. Il drenaggio venoso superficiale della cute e della fascia superficiale è assicurato da vene affluenti al sistema della safena.
Il pene è innervato da fibre somatiche, che garantiscono la sensibilità e derivano dai nervi spinali S2-S4 attraverso il pudendo, dal quale origina il nervo dorsale del pene, che decorre nel fascio vasculo-nervoso dorsale avvolto nella fascia di Buck. Nel pudendo corrono anche fibre motorie che originano dal nucleo di Onuf, situato nel corno anteriore del midollo sacrale. L’innervazione autonomica, sia simpatica che parasimpatica, è assicurata dai nervi cavernosi, che originano dal plesso pelvico, situato nello spazio alla base della vescica tra la prostata e le vescicole seminali. A questo plesso arrivano fibre simpatiche che originano dalle radici toraco-lombari (T1-L2), mentre i nervi erigendi convogliano le fibre parasimpatiche che originano dalle radici S2-S4.
I TESTICOLI
Sono organi pari di forma ovale, di dimensioni variabili con l’età (nell’adulto il diametro longitudinale è 4-4.5 cm, il volume 15-20 mL), situati in sede extra-addominale nella borsa scrotale e sospesi al funicolo, che li collega alla parete addominale attraverso il canale inguinale. Sul polo posteriore si trova l’ilo testicolare, attraverso il quale passano i dotti efferenti e le strutture vasculo-nervose convogliate poi dal funicolo (2). Il polo inferiore è ancorato in basso da un legamento fibroso, che è il residuo del gubernaculum, mentre sul polo superiore si adagia la testa dell’epididimo.
Il testicolo è avvolto da una capsula, fatta da uno strato vascolare aderente all’organo, uno fibromuscolare, la tunica albuginea, e dalla tunica vaginale, costituita dal peritoneo vaginale che tappezza la cavità virtuale scrotale. Da un ispessimento dell’albuginea, situato sul margine posteriore o mediastino del testicolo, si dipartono setti fibrosi, che dividono il parenchima testicolare in circa 300 lobuli, contenenti ciascuno 1-4 tubuli seminiferi, dove ha luogo la spermatogenesi.
La matrice connettivale e vascolare interposta tra i tubuli seminiferi costituisce il tessuto interstiziale, nel quale si collocano le cellule di Leydig, deputate alla produzione degli steroidi sessuali (testosterone, estradiolo) e dell’insulin-like factor 3 (INSL3).
I tubuli sono rivestiti all’interno dalle cellule di Sertoli e dalle cellule germinali, in maniera variabile a seconda dell’età. I tubuli seminiferi pre-puberali contengono solo cellule goniali e citi immaturi, situati nella parte basale. Dopo la pubertà, il tubulo seminifero è rivestito da strati di cellule germinali in diverso stadio maturativo, che vanno dalla base alla parte adluminale (goni, spermatociti, spermatidi e spermatozoi maturi), collegate tra di loro e con le cellule di Sertoli. Queste ultime producono AMH e inibina B e hanno una funzione di supporto alla maturazione delle cellule germinali (3). Sia la funzione endocrina che quella gametogenetica del testicolo sono sotto il controllo delle gonadotropine, la cui sintesi e rilascio sono regolati dall’asse GnRH-Gn.
IL SISTEMA DEI DOTTI ESCRETORI
Comprende i dotti intra-testicolari, l’epididimo, i deferenti e i dotti eiaculatori.
I tubuli seminiferi, avvolti in anse, si fanno rettilinei in prossimità del mediastino, dove sfociano attraverso i tubuli retti nella rete testis, costituita da anastomosi tubulari, che a loro volta si aprono in circa 20 duttuli efferenti rettilinei, diretti alla testa dell’epididimo.
L’epididimo è una struttura arcuata, che si estende dal polo superiore a quello inferiore del testicolo lungo il suo margine posteriore, nella quale si distingue la testa, una parte intermedia o corpo e una terminale o coda, che prosegue nel dotto deferente. L’epididimo contiene un unico tubulo circonvoluto, con un lume tappezzato da epitelio colonnare ciliato, e ha diverse funzioni: trasporto e maturazione degli spermatozoi, riassorbimento del liquido testicolare e eliminazione dei detriti cellulari (4).
La coda dell’epididimo è in contiguità con il dotto deferente, un tubulo con caratteristiche simili con una parete fibromuscolare capace di spingere gli spermatozoi conservati nella coda dell’epididimo in direzione dell’uretra al momento dell’eiaculazione. Il deferente è lungo circa 40 cm e, risalendo nel funicolo, attraversa il canale inguinale, percorre la parete addominale laterale, incrocia l’uretere e raggiunge la base della vescica dietro la prostata, dove si dilata nell’ampolla deferenziale, che accoglie anche il dotto delle vescicole seminali.
La fusione del dotto delle vescichette con l’ampolla deferenziale dà origine ai dotti eiaculatori, che penetrano nella prostata per un centimetro e si aprono nella porzione terminale dell’uretra prostatica.
Nel funicolo decorrono tre arterie che assicurano l’irrorazione arteriosa del testicolo:
- l’arteria testicolare, che origina dall’aorta;
- l’arteria deferenziale, ramo della vescico-deferenziale, che origina dall’arteria iliaca interna;
- l’arteria cremasterica, ramo dell’epigastrica inferiore, derivante dall’iliaca esterna.
Il drenaggio venoso avviene attraverso i plessi pampiniforme anteriore e posteriore dello scroto, che confluiscono nelle vene spermatiche:
- la vena spermatica interna drena nella vena epigastrica omolaterale;
- la vena spermatica esterna drena a destra direttamente nella cava e, a sinistra, nella vena renale omolaterale.
Nel funicolo corrono anche le fibre somatiche del nervo genito-femorale e le fibre simpatiche derivanti dai plessi aortici.
LE GHIANDOLE SESSUALI ACCESSORIE
Le vescicole seminali, situate nello spazio tra il retto e la vescica al di sopra della prostata, sono strutture tubulo-spirali, che terminano fondendosi all’ampolla deferenziale. Il lume vescicolare è rivestito da epitelio colonnare, la cui secrezione rappresenta il 70% del volume dell’eiaculato e contiene fruttosio e le proteine responsabili della formazione del coagulo spermatico.
La prostata è una ghiandola a forma di castagna, situata alla base della vescica, che avvolge l’uretra nella sua prima parte. Ha una struttura ghiandolare e fibromuscolare e secerne un liquido che nell’uretra prostatica si mescola, al momento dell’eiaculazione, alla secrezione vescicolare e agli spermatozoi epididimari. Il secreto prostatico è ricco di bicarbonati per neutralizzare l’acidità vaginale e contiene enzimi fibrinolitici che degradano il coagulo spermatico.
Subito dopo la prostata, nella porzione di uretra cosiddetta membranosa si aprono i dotti delle ghiandole di Cowper, che secernono un liquido mucinoso ricco di zuccheri, che viene emesso nella fase di eccitazione pre-eiaculatoria con funzione lubrificante per l’uretra.
BIBLIOGRAFIA
- Christ GJ. The penis as vascular organ. The importance of corporal smooth muscle tone in the control of erection. Urol Clin North Am 1995, 22: 727-45.
- Kerr JB, de Kretser D. Functional morphology of the testis. In: Endocrinology 5th ed. De Groot LJ, Jameson JL Eds. Elsevier Saunders, Philadelphia 2006, vol 3: 3089-120.
- Luetjens CM, Weinbauer GF, Witsuba J. Primate spermatogenesis: new insights into comparative testicular organization, spermatogenetic efficiency and endocrine control. Biol Rev Camb Philos Soc 2005, 80: 475-88.
- Turner TT. De Graaf’s thread: the human epididymis. J Androl 2008, 29: 237–50.
Azioni degli ormoni testicolari
Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
I testicoli, oltre alla produzione di spermatozoi, sono preposti alla secrezione degli ormoni sessuali maschili, in particolare di testosterone (T). La produzione degli ormoni da parte dei testicoli è evidente fin dalla nascita, aumenta intorno alla pubertà e si mantiene per tutta l'età adulta, fino a manifestare un declino in età avanzata (fig 1).
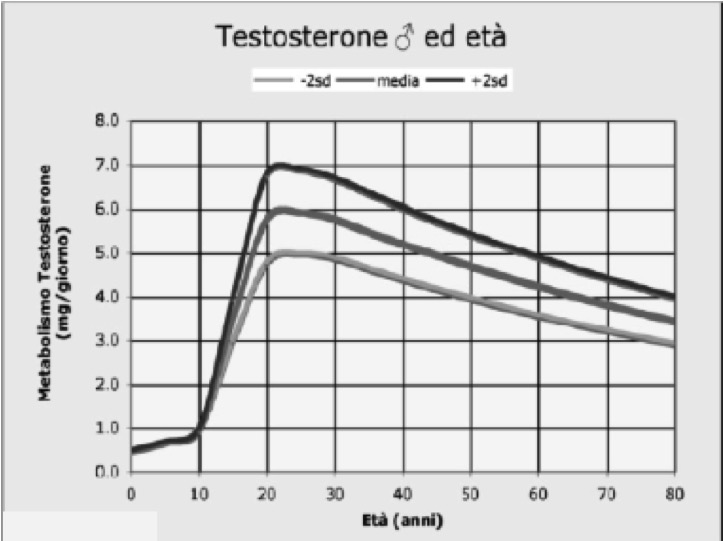
Figura 1. Produzione di testosterone nelle diverse età della vita (modificato da: Williams Textbook of Endocrinology 10° edizione)
Le cellule del Sertoli, oltre a interagire con le cellule della spermatogenesi, svolgono una funzione endocrina attraverso la produzione di ABP (androgen-binding protein), che concentra il testosterone favorendo la spermatogenesi, e di inibina, che agisce con meccanismo di feed-back negativo a livello ipotalamo-ipofisario, inibendo rispettivamente la produzione di GnRH e FSH.
Le cellule di Leydig, poste nell’interstizio, producono ormoni androgeni, in particolare il testosterone, e l’insulin-like factor 3 (INSL3), un ormone peptidico coinvolto nella discesa testicolare, i cui livelli aumentano marcatamente alla pubertà.
Le cellule di Sertoli e le cellule di Leydig producono anche una piccola quantità di estrogeni, che svolgono varie azioni: feed-back negativo a livello centrale, modulazione della spermatogenesi e chiusura delle epifisi ossee.
Infine, il testicolo esercita un ruolo chiave nella produzione della forma attiva della vitamina D (25-OH vitamina D), fondamentale per il normale processo di formazione e omeostasi ossea.
Il T viene sintetizzato dal testicolo (5-6 mg/24 ore) attraverso i processi enzimatici della steroidogenesi a partire dal colesterolo. Il T circola nel plasma per il 2% circa libero, per il 48% legato alle albumine e per il restante 50% legato alla sex hormone-binding globulin (SHBG).
La maggior parte del T plasmatico viene captata e metabolizzata a livello epatico, con formazione di numerosi metaboliti inattivi che vengono escreti nelle urine.
Il testicolo produce inoltre, in minor quantità, androstenedione, deidroepiandrosterone (DHEA), diidrotestosterone (DHT) ed estradiolo (E2). Il 95% della produzione giornaliera di T proviene dal testicolo, mentre la produzione giornaliera di DHT ed E2 deriva per l’80% dalla conversione periferica dei precursori di origine testicolare e surrenale e solo per il 20% dal testicolo. Una piccola frazione del T circolante (circa lo 0.3%) è convertita in E2 attraverso l’enzima aromatasi localizzato nel tessuto adiposo, nel fegato, nel muscolo, nei follicoli piliferi, nelle cellule di Leydig e di Sertoli e nel SNC. In molti tessuti bersaglio il T viene convertito nel più potente androgeno DHT dall’isoenzima microsomiale 5α-reduttasi.
Gli ormoni testicolari hanno come effetto principale quello di determinare, nell’organismo maschile, alla pubertà, lo sviluppo dell’apparato genitale e dei caratteri sessuali secondari. Gli ormoni testicolari agiscono, infatti, a livello dell’apparato genitale maschile determinando l’accrescimento del pene, della prostata e delle vescicole seminali e il mantenimento del processo di maturazione cellulare nell’epitelio seminale. Al di fuori dell’apparato genitale gli ormoni testicolari promuovono lo sviluppo e il mantenimento di quel complesso di tratti somatici e comportamentali (caratteri sessuali secondari) che sono propri del maschio, come tono della voce, distribuzione dei peli e del pannicolo adiposo, sviluppo delle masse muscolari, sviluppo dello scheletro, aggressività, interesse nei confronti dell’altro sesso. Gli ormoni testicolari hanno inoltre un importante effetto anabolizzante, in quanto stimolano in tutti i tessuti (particolarmente nel tessuto muscolare) la sintesi di nuove proteine e nel tessuto osseo facilitano i processi di ossificazione.
Il T e i suoi metaboliti attivi agiscono su diversi tessuti bersaglio, legandosi a uno specifico recettore nucleare, il recettore degli androgeni (fig 2), con diversi effetti (modulati dalla loro rispettiva affinità per il recettore e/o dalle loro concentrazioni a livello dei tessuti sensibili):
- DHT agisce inducendo la differenziazione sessuale, stimolando la peluria secondaria, inducendo la produzione di sebo e mantenendo il trofismo della ghiandola prostatica;
- T induce la differenziazione sessuale e la spermatogenesi, stimola lo sviluppo e il trofismo della muscolatura e della massa ossea, stimola l’eritropoiesi, mantiene il tono dell’umore e stimola la libido;
- E2, derivato da T per aromatizzazione, contribuisce, tramite il suo recettore specifico, a formazione e maturazione dell’osso, svolge azione psicotropa, controlla il metabolismo lipidico e il trofismo della prostata (fig 3).
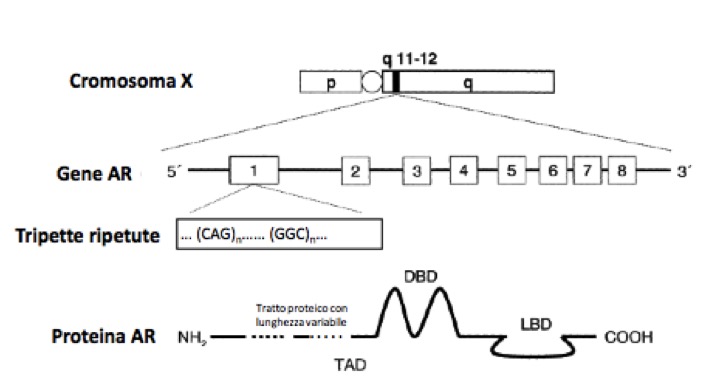
Figura 2. Il recettore degli androgeni (modificato da Ceccato F, Zuccarello D, Selice R, Foresta C. Nuove prospettive sulla sindrome di Klinefelter. GIMSeR 2006, 13: 127-39).
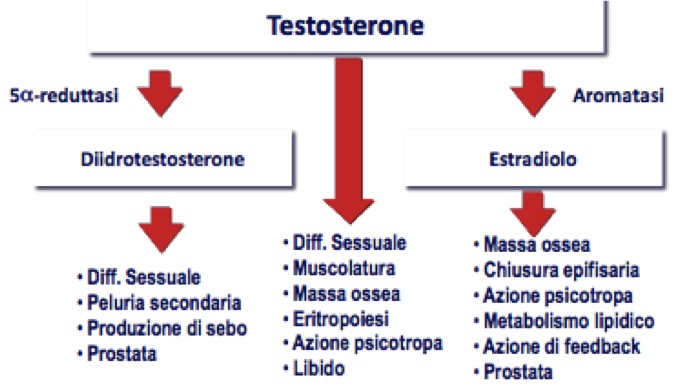
Figura 3. Effetti del testosterone (modificato da: Endocrinology Male Hypogonadism, Cleveland Clinic)
In generale, una significativa riduzione della produzione di ormoni testicolari determina la condizione di ipogonadismo. Se questo si instaura prima della pubertà, il soggetto non sviluppa i caratteri sessuali secondari (eunucoidismo) e presenta ipotrofia testicolare, ginecomastia, riduzione dei peli corporei con distribuzione femminile, scarsa libido, disfunzione erettile, infertilità, osteoporosi, ridotta muscolatura, astenia, ridotta forza fisica, ridotta massa magra, obesità addominale e anemia.
Bibliografia
- Traish AM, Miner MM, Morgentaler A, Zitzmann M. Testosterone deficiency. Am J Med 2011, 124: 578-87.
- Bhasin S, Cunningham GR, Hayes FJ, et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010, 95: 2536-59.
- Foresta C, Selice R, De Toni L, et al. Altered bone status in unilateral testicular cancer survivors: role of CYP2R1 and its luteinizing hormone-dependency. J Endocrinol Invest 2013, 36: 379-84.
Asse GnRH-Gn-testicolo
Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
Lo sviluppo e il funzionamento dell’apparato genitale maschile, e dei caratteri sessuali secondari, dipendono da complessi meccanismi neuro-endocrini, integrati funzionalmente a livello dell’asse GnRH-gonadotropine-testicolo (GnRH-Gn-T), la cui integrità è necessaria per il normale svolgimento della capacità riproduttiva ed endocrina.
Le patologie che colpiscono la sfera sessuale e riproduttiva nell’uomo derivano da alterazioni anatomiche o funzionali di una o più di queste strutture, la cui conoscenza è quindi necessaria per un corretto inquadramento eziopatogenetico e terapeutico di questi pazienti.
Anatomia dell’asse GnRH-Gn-T
L’ipotalamo costituisce la parte ventrale del diencefalo, situata nella zona centrale interna ai due emisferi cerebrali. Comprende numerosi nuclei, che attivano, controllano e integrano i meccanismi autonomici periferici, l'attività endocrina e molte funzioni somatiche, quali termoregolazione, sonno, bilancio idro-salino e senso della fame. Due nuclei ipotalamici (sopra-ottico e para-ventricolare) sono collegati direttamente alla porzione posteriore dell’ipofisi tramite neuroni che formano il fascio ipotalamo-ipofisario, essenziale per il controllo del sistema endocrino (fig 1).

Figura 1. Anatomia dell’asse GnRH-Gn-T (modificato da Home Fertility Network)
L'ipofisi è una ghiandola endocrina posta alla base del cranio, nella fossa della sella turcica dell’osso sfenoide, in prossimità del chiasma ottico. Consta di due lobi, il lobo anteriore (ipofisi anteriore o adeno-ipofisi) e il lobo posteriore (ipofisi posteriore o neuro-ipofisi), strutturalmente e funzionalmente diversi, che controllano, attraverso la secrezione di numerosi ormoni, l'attività endocrina e metabolica di tutto l'organismo. I differenti processi vengono modulati da diversi segnali, che intervengono in sequenza:
- per la fase di differenziazione: FGF-R1/FGF-8 (fibroblast growth factor receptor 1 e fibroblast growth factor 8), NELF (Nasal Embryonic LH-releasing hormone Factor) e HS6ST1 (heparan sulphate 6-O-sulphotransferase);
- per la fase di migrazione dei neuroni GnRH-secernenti verso l’ipotalamo: Kal 1, il complesso PORPK2/PROKR2 (Prokinecitina 2 e il suo recettore) e CHD7 (chromodomain helicase DNA-binding protein 7);
- nella regolazione stimolante nei neuroni GnRH-secernenti: TAC3/TACR3 (tachichinina 3 e il suo recettore) e KISS1/KISSR1 (kisspeptina 1 con il suo recettore). Quest’ultimo gene è indispensabile per l’attivazione della pubertà.
I testicoli, o didimi, costituiscono le gonadi maschili. Hanno la funzione principale di produrre gli spermatozoi e alcuni ormoni, fra i quali il testosterone. Sono organi di forma ovale, misurano 3.5-5.5 centimetri di lunghezza, 3 centimetri circa di larghezza e 3 centimetri circa trasversalmente. Il peso del testicolo dell’adulto è di circa 30 grammi (fig 2). Il testicolo è avvolto dalla tunica albuginea, dalla cui faccia profonda si dipartono i setti convergenti verso il mediastino testicolare, che delimitano il parenchima testicolare in circa 300 logge di forma piramidale. Il parenchima è costituito dai tubuli seminiferi, deputati alla produzione di spermatozoi, e dallo stroma, che circonda i tubuli e che contiene le cellule di Leydig a funzione endocrina.

Figura 2. Anatomia testicolare (da Gray’s Anatomy. Elsevier, 2009)
Fisiologia dell’asse GnRH-Gn-T
I neuroni che costituiscono l’ipotalamo producono sostanze attive di natura polipeptidica, chiamate ormoni di rilascio (releasing hormones o RH), che agiscono sulle cellule dell'adeno-ipofisi, stimolandole in maniera specifica a produrre i rispettivi ormoni. In particolare, l’ormone di liberazione delle gonadotropine (GnRH), un decapetide codificato da un gene localizzato sul braccio corto del cromosoma 8, agisce sulle cellule gonadotrope ipofisarie, stimolandole alla secrezione dell'ormone luteinizzante (luteinizing hormone, LH) e dell'ormone follicolo-stimolante (follicle-stimulating hormone, FSH). La secrezione del GnRH è di tipo pulsatile, e questo rappresenta un pre-requisito fondamentale per la corretta funzione riproduttiva.
FSH ed LH, prodotti rispettivamente dalle cellule beta e gamma dell’adeno-ipofisi, agiscono sui testicoli. L’FSH agisce promuovendo le prime fasi maturative della spermatogenesi e favorendo la sintesi della proteina che lega il testosterone (ABP), mentre l’LH ha il compito di stimolare le fasi finali della spermatogenesi e la secrezione testicolare di ormoni.
Altri ormoni che nel maschio esercitano un’azione a carico dell'asse sono l'inibina B, l'INSL3, e la prolattina (PRL).
L’inibina B è un ormone gonadotropino-dipendente prodotto dalle cellule di Sertoli e da alcuni tipi di cellule spermatogenetiche, che esercita il feed-back negativo da parte del testicolo sulla produzione di FSH. I valori di inibina B sono direttamente proporzionali alla funzione spermatogenetica e sono bassi o indosabili nei soggetti con ipogonadismo da testicolopatia primaria.
L’insulin-like factor 3 (INSL3) è un membro della famiglia degli ormoni simili alla relaxina, prodotto dalle cellule di Leydig. Oltre a causare la discesa dei testicoli durante lo sviluppo embrionale, INSL3 è coinvolto anche in altre vie di signaling endocrino e paracrino nei maschi adulti. Infatti, INSL-3 agisce come ormone ad azione androgenica in vari distretti corporei e in particolare svolge un ruolo chiave nel metabolismo osseo. Infine esso ha effetto inibitorio simile a quello del testosterone a livello centrale.
La PRL è un ormone polipeptico secreto dall’adenoipofisi ma, a differenza delle gonadotropine, non è chiaro quale sia la funzione fisiologica nel maschio, dove ha esclusivamente attività inibitorie a livello centrale, influenzando negativamente la capacità riproduttiva e la funzione sessuale. La PRL tende a elevarsi anche in condizioni di stress acuto e pertanto queste condizioni vanno distinte da quelle in cui la presenza di un adenoma ipofisario PRL-secernente mantiene costantemente elevati i livelli di questo ormone.
Patologie dell’asse GnRH-Gn-T.
Le patologie dello sviluppo e della funzione dell'asse ipotalamo-ipofisi-testicolo portano ad alterazioni della funzione testicolare e sono pertanto responsabili dell’ipogonadismo, definito come una sindrome clinica che origina dall’insufficiente capacità del testicolo di produrre livelli fisiologici di testosterone e di spermatozoi a causa dell’alterazione a uno o più livelli dell’asse. Tale condizione può avere cause differenti e manifestarsi in diverse forme a seconda del periodo di insorgenza. Dal punto di vista patogenetico, gli ipogonadismi possono essere distinti in tre forme (fig 3):
- primitivi o ipergonadotropi, nei quali l’alterazione a carico delle cellule di Leydig compromette la produzione di androgeni (testosterone) e/o altera i tubuli seminiferi, con conseguente oligospermia o azoospermia. Queste forme sono caratterizzate da elevati livelli di gonadotropine e basse concentrazioni di testosterone;
- secondari o ipogonadotropi, nei quali alterazioni dell'ipotalamo o dell’ipofisi compromettono la secrezione delle gonadotropine e di conseguenza la funzione testicolare. In questi pazienti vengono osservati ridotti livelli di gonadotropine e di testosterone;
- da alterata risposta agli androgeni, nei quali, a causa di un’alterazione della proteina recettore o per difetti enzimatici, la risposta agli androgeni prodotti dal testicolo è ridotta o assente. Questi casi sono caratterizzati da normali livelli di FSH con elevate concentrazioni di LH e testosterone normale o elevato.

Figura 3. I diversi tipi di ipogonadismo in reazione alla patogenesi
Bibliografia
- Fraietta R, Zylberstejn DS, Esteves SC. Hypogonadotropic hypogonadism revisited. Clinics (Sao Paulo) 2013, 68 suppl 1: 81-8.
- Foresta C. Infertilità maschile, fisiopatologia, clinica, diagnostica e terapia. CLEUP Padova 2009.
- Faiman C. Male hypogonadism. Cleveland Clinic Continuing Education 2012.
La spermatogenesi
Andrea Garolla
Dipartimento di Medicina, Unità di Andrologia e Medicina Riproduttiva, Università di Padova
Il processo di produzione degli spermatozoi (spermatogenesi) avviene, secondo una precisa organizzazione spaziale, all’interno del parenchima testicolare (fig 1).

Figura 1. Da Purves W, Sadava D. Life: the science of biology. 7th Ed. Sunderland MA: Sinauer Associates, 2003.
Tale struttura è costituita dai tubuli seminiferi e dallo stroma, che circonda i tubuli e contiene le cellule di Leydig a funzione endocrina. I tubuli seminiferi sono strutture organizzate in modo convoluto, dove ha luogo la spermatogenesi, le cui estremità sboccano nella rete testis, posta a livello del mediastino testicolare. Dalla rete testis si dipartono i condotti efferenti che confluiscono a formare l'epididimo.
La parete dei tubuli seminiferi è costituita da epitelio germinativo, che comprende, accanto alle cellule germinali in diverso stato differenziativo, le cellule del Sertoli, cellule di sostegno non spermatogeniche, con importanti funzioni endocrine. Le cellule germinali in stadio precoce di sviluppo si trovano perifericamente, mentre quelle negli stadi tardivi aggettano verso il lume.
Il processo attraverso il quale gli elementi cellulari germinativi passano dalla periferia al lume dura 74 giorni circa (fig 2) e comprende tre fasi (1):
- una fase di proliferazione mitotica, che coinvolge diversi tipi cellulari, detti spermatogoni;
- una fase meiotica, effettuata da cellule dette spermatociti, che consente la ripartizione del genoma in cellule aploidi (spermatidi) e durante la quale avvengono anche tutti i processi collegati alla ricombinazione genetica (crossing-over);
- una fase finale di differenziazione cellulare senza ulteriore divisione, che porta alla formazione dello spermatozoo maturo, attraverso una serie di mutamenti morfologici noti con il termine di spermiogenesi.

Figura 2. La spermatogenesi umana
Gli spermatogoni sono localizzati in corrispondenza della lamina basale dell’epitelio, mentre gli stadi successivi della spermatogenesi avvengono in posizioni più distali. Gli spermatozoi si localizzano infine a livello del lume del tubulo, ove vengono rilasciati per raggiungere l’epididimo.
Gli spermatogoni derivano da cellule germinali primordiali, che durante le fasi precoci della embriogenesi sono migrate a livello delle creste germinali; la spermatogenesi inizia però solamente durante la pubertà, quando avviene la canalizzazione dei cordoni sessuali, con formazione dei tubuli seminiferi. In base alle loro caratteristiche morfologiche e ultrastrutturali, nell’uomo si possono distinguere diversi tipi di spermatogoni: di tipo A, a loro volta distinti in A dark (Ad) e A pale (Ap), e di tipo B. Con la loro attività proliferativa gli spermatogoni eseguono un duplice compito: mantenere un pool di cellule indifferenziate e avviare il processo differenziativo, che consiste nella produzione dei diversi tipi di spermatogoni e che proseguirà poi con la fase meiotica e la spermiogenesi. Tale duplice funzione garantisce che un adeguato numero di gameti funzionali sia prodotto in modo continuativo nel corso della vita adulta di un individuo. Il meccanismo della spermatogenesi prende quindi inizio a partire dagli spermatogoni Ad, che rappresentano le cellule che in seguito a divisione mitotica producono sia nuove cellule staminali Ad, sia spermatogoni più differenziati Ap. Dalla divisione mitotica di questi ultimi, derivano gli spermatogoni di tipo B, che, attraverso una successiva divisione mitotica, danno origine agli spermatociti primari. A questo punto prende il via il processo meiotico, che implica due successive divisioni cellulari precedute da una sola duplicazione del DNA, con formazione finale di 4 cellule dotate di corredo cromosomico aploide. Durante la prima divisione meiotica, che coinvolge gli spermatociti primari, i cromosomi omologhi, che appaiono costituiti ognuno da due cromatidi appaiati, dopo il crossing-over si separano in due cellule figlie, gli spermatociti secondari, che pertanto presentano un numero dimezzato di cromosomi (numero aploide). Tuttavia, poiché ogni cromosoma è composto da due cromatidi appaiati, il contenuto di DNA totale è ancora equivalente a quello delle cellule somatiche. La seconda divisione meiotica ha luogo dopo una fase relativamente breve e durante questa i cromatidi si separano senza che avvenga replicazione del DNA, e si distribuiscono alle cellule figlie con un meccanismo simile a quello della divisione mitotica. Le cellule figlie vengono chiamate spermatidi e contengono un corredo aploide di cromosomi, quindi dimezzato rispetto a quello delle cellule somatiche.
Vediamo però quali sono in dettaglio le tappe che caratterizzano tale processo. Il processo meiotico inizia quando lo spermatogonio di tipo B perde il suo contatto con la membrana basale per andare a costituire lo spermatocita primario allo stadio di pre-leptotene. Quest’ultimo va incontro a sintesi e condensazione del DNA dei singoli cromosomi, che assumono l’aspetto di esili filamenti nel nucleo (stadio di leptotene). A questo punto ciascun cromosoma presenta una coppia di cromatidi. Durante lo stadio di zigotene ha luogo l’appaiamento dei cromosomi omologhi noto come sinapsi. Questo comporta la formazione di grossolani filamenti di cromatina, che progressivamente si ispessiscono e si accorciano, sino a dare la tipica configurazione dello spermatocita pachitene. In questo stadio il nucleo e il citoplasma si espandono progressivamente in volume, tanto che tali cellule appaiono come le più voluminose tra le cellule germinali. Ogni coppia di cromosomi è costituita da 4 spermatidi. Durante questo stadio vi è scambio di materiale genetico fra i cromosomi di origine materna e quelli di origine paterna, con rotture e riparazioni del DNA. Seguono poi due brevi stadi: lo stadio di diplotene, caratterizzato dalla parziale separazione delle coppie di cromosomi omologhi, e lo stadio di diacinesi, caratterizzato dalla successiva dissoluzione della membrana nucleare. In questa fase i cromosomi si allineano su un fuso e ciascun componente della coppia di cromosomi omologhi si muove verso il polo opposto del fuso, formando cellule figlie, denominate spermatidi rotondi. La trasformazione dello spermatide rotondo, che presenta corredo cromosomico aploide, in spermatozoo maturo è denominata spermiogenesi. Durante questa fase gli spermatidi subiscono una modificazione della forma e della dimensione nucleare, che culmina, al termine della spermiogenesi, con la sostituzione degli istoni con protamine, proteine ricche in arginina e cisteina, che favoriscono l’elevata compattazione del DNA tipica degli spermatozoi (2).
Nell’uomo la spermatogenesi richiede l’azione di una vasta gamma di molecole (essenzialmente di tipo ormonale), ciascuna delle quali svolge un ruolo importante nel normale funzionamento dell’epitelio seminifero. Questi messaggeri ormonali sono critici, non solo per la regolazione dello sviluppo delle cellule germinali, ma anche per la proliferazione e il corretto funzionamento di cellule somatiche, necessarie per un corretto sviluppo del testicolo (3):
- le cellule interstiziali di Leydig, la cui funzione principale è la produzione del testosterone;
- le cellule mioidi, che circondano i tubuli seminiferi e forniscono supporto meccanico a queste strutture;
- le cellule del Sertoli, localizzate a stretto contatto con le cellule spermatogenetiche, che producono numerose molecole che contribuiscono al corretto svolgimento del processo spermatogenetico e forniscono supporto meccanico alle cellule germinali; inoltre, mediante strette giunzioni inter-cellulari, formano la barriera emato-testicolare, che crea un micro-ambiente biochimico specifico, in cui proliferano le cellule germinali (4).
Ciascuno di questi tipi cellulari rappresenta un target diretto di uno o più ormoni, la cui azione è essenziale per il corretto mantenimento della spermatogenesi e, quindi, per la preservazione della fertilità maschile. La spermatogenesi è finemente regolata da fattori ormonali prodotti a livello ipotalamo-ipofisario e a livello testicolare. Da tempo è noto che per la realizzazione della spermatogenesi sono indispensabili le gonadotropine prodotte dall’ipofisi anteriore in risposta a un releasing-hormone ipotalamico: FSH ed LH, ormoni glicoproteici ipofisari, agiscono direttamente sul testicolo e contribuiscono all’induzione e al mantenimento della spermatogenesi. Nell’uomo l’espressione del recettore dell’FSH è limitata alle cellule del Sertoli, mentre i recettori dell’LH sono stati localizzati sia a livello delle cellule di Leydig che a livello delle cellule spermatogenetiche. Anche il testosterone, prodotto dalle cellule interstiziali di Leydig, riveste un ruolo essenziale nel mantenimento della spermatogenesi durante l’immediata fase post-puberale e nell’età adulta (fig 3).

Figura 3. Regolazione ormonale della spermatogenesi
(GnRH = ormone stimolante il rilascio di gonadotropine; FSH = ormone follicolo-stimolante; LH = ormone luteinizzante; T = testosterone)
L’incremento massimo del numero delle cellule germinali avviene fra i 3 e i 6 mesi dopo la nascita, tuttavia l’attività proliferativa si mantiene, anche se molto ridotta, sino alla pubertà. Le cellule germinali vanno incontro a mitosi, ma non alle successive divisioni meiotiche e appaiono dislocate centralmente nei tubuli seminiferi. Durante la pubertà avverrebbe la loro migrazione a ridosso della membrana basale dei tubuli, che coincide con l’inizio della spermatogenesi. Anche le cellule del Sertoli si dividono intensamente nei primi tre mesi dopo la nascita e tale attività proliferativa sembra decrescere progressivamente sino alla pubertà, quando perdono definitivamente la capacità di dividersi e acquisiscono, invece, funzioni specializzate, come ad esempio la formazione della barriera emato-testicolare. L’inizio della spermatogenesi avviene in epoca puberale, quando la produzione di FSH ed LH si eleva, evento che segna l’inizio della pubertà. Perché ciò avvenga, è indispensabile un’interazione tra le due gonadotropine, LH ed FSH. L’FSH è in grado di stimolare direttamente la spermatogenesi, anche in presenza di bassi livelli di LH e testosterone, incrementando la produzione sertoliana di ABP (carrier intra-cellulare di testosterone), aumentando in questo modo la concentrazione intra-testicolare del testosterone stesso. Analogamente, l’LH in presenza di bassi livelli di FSH è in grado di indurre la spermatogenesi, aumentando i livelli intra-testicolari di testosterone. Prima della pubertà, l’epitelio seminifero consiste di elementi germinali e sertoliani entrambi immaturi. L’esposizione cronica del testicolo peri-pubere al testosterone dà inizio alla spermatogenesi e la stimolazione combinata da parte delle due gonadotropine induce la maturazione delle cellule del Sertoli. L’FSH e il testosterone sembrano quindi modulare indirettamente la spermatogenesi, attraverso il loro legame alle cellule del Sertoli. In particolare, l’FSH pare esercitare un’azione soprattutto favorente i processi meiotici, mentre il testosterone avrebbe un ruolo prominente sulla spermiogenesi.
Dopo la pubertà l’epitelio seminifero appare costituito da elementi germinali disposti a strati, che corrispondono a successive generazioni di questi elementi procedendo dalla lamina propria verso il lume del tubulo e da elementi sertoliani maturi che occupano tutta l’altezza dell’epitelio, intercalati tra gruppi di cellule germinali, ove restano come elementi stabili. È però con la fase di mantenimento della spermatogenesi che il processo di spermatogenesi conduce alla produzione di spermatozoi nel testicolo adulto. Il livello a cui la spermatogenesi è mantenuta non è costante, ma è soggetto a regolazioni fisiologiche. Ad esempio, nell’uomo, ci sono fluttuazioni stagionali, con una diminuzione durante il periodo estivo.
Come per l’induzione della spermatogenesi, anche per il suo mantenimento l’FSH agisce in sinergia con l’LH. Studi genetici recenti indicano che il ruolo primario dell’FSH nella spermatogenesi è la stimolazione della proliferazione delle cellule del Sertoli durante la fase pre-puberale e che il numero delle cellule del Sertoli determina in maniera importante il numero delle cellule germinali. Molti studi hanno dimostrato che nell’uomo l’FSH regola la popolazione spermatogoniale, poiché la diminuzione della conta spermatica indotta dalla soppressione dei livelli di gonadotropine risulta in un marcato decremento degli spermatogoni di tipo B, probabilmente dovuta a una mancata progressione da spermatogoni Ap a B: quest’effetto rappresenta il risultato della diminuzione dei livelli di FSH piuttosto che del concomitante declino dei valori sierici del testosterone (5). Se una ridotta disponibilità di FSH porta a una riduzione della spermatogenesi, aumentate concentrazioni di FSH possono amplificare il processo, come dimostrato in scimmie normali trattate con dosi sovra-fisiologiche di FSH e nel testicolo contro-laterale di uomini sottoposti ad emi-orchiectomia. In queste situazioni l’incremento della stimolazione con FSH esercita la sua funzione su strutture testicolari normali. Nei soggetti oligozoospermici trattati con FSH non sempre si determina però un aumento consistente della concentrazione di spermatozoi (6). È stato dimostrato, infatti, che solo soggetti con normale spermatogenesi e assenza di difetti maturativi sono in grado di rispondere al trattamento con FSH con un miglioramento dei parametri seminali e con un aumento della capacità di fertilizzare in vitro (7). Tuttavia, anche dopo selezione dei pazienti con caratteristiche adeguate al trattamento, una parte di loro non mostra miglioramenti dopo la terapia. Pertanto, manca ancora una completa comprensione della fisiopatologia della spermatogenesi, al fine di facilitare l’interpretazione delle correlazioni genotipo/fenotipo e permettere la definizione di nuove categorie diagnostiche e terapeutiche (8).
Bibliografia
- Kierszenbaum AL. Mammalian spermatogenesis in vivo and in vitro: a partnership of spermatogenic and somatic cell lineages. Endocr Rev 1994, 15: 116-34.
- Sofikitis N, et al. Hormonal regulation of spermatogenesis and spermiogenesis. J Ster Biochem Mol Biol 2008, 109: 323-30.
- McLachlan RI, et al. Identification of specific sites of hormonal regulation in spermatogenesis in rats, monkeys and man. Rec Prog Horm Res 2002, 57: 149-79.
- Griswold MD. The central role of Sertoli cells in spermatogenesis. Semin Cell Dev Biol 1998, 9: 411-6.
- McLachlan RI, et al. The hormonal regulation of spermatogenesis in primates and man: insights for the development of the male contraceptive. J Androl 2002, 23: 149-62.
- Foresta C, et al. FSH in the treatment of oligozoospermia. Mol Cell Endocrinol 2000, 161: 89-97.
- Garolla A, et al. FSH treatment in infertile males candidate to assisted reproduction improved sperm DNA fragmentation and pregnancy rate. Endocrine 2016, DOI: 10.1007/s12020-016-1037-z.
- Simoni M, et al. Treatment with human, recombinant FSH improves sperm DNA fragmentation in idiopathic infertile men depending on the FSH receptor polymorphism p.N680S: a pharmacogenetic study. Hum Reprod 2016, 31: 1960-9.
Diagnostica generale della gonade maschile
In collaborazione con SIAMS
Valutazioni ormonali della funzione testicolare
Gonadotropine nella diagnostica della gonade maschile
Vito Angelo Giagulli
Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia”, Conversano AUL/BA
Introduzione
Le gonadotropine, LH e FSH, hanno un ruolo centrale nella regolazione testicolare, sia per quanto riguarda la secrezione di testosterone (T) da parte della cellula di Leydig (LH) che la spermatogenesi (FSH), modulando la funzione della cellula del Sertoli.
Esse vengono secrete in maniera fasica dalle cellule gonadotrope site nell’adeno-ipofisi sotto l’azioni di diversi fattori stimolanti (GnRH) e inibenti (inibina B, prolattina e T) e si legano a specifici recettori ad alta affinità presenti sulla cellula del Sertoli o del Leydig (1).
La gonadotropina corionica (hCG) è una glicoproteina secreta dal trofoblasto durante la gravidanza (prevalentemente durante il primo trimestre), con un ruolo fondamentale nel regolare la secrezione androgenica del testicolo fetale. Nel maschio l’hCG non è mai dosabile nel sangue, con l’eccezione di alcune forme di neoplasia testicolare (corion-carcinoma e seminomi) che sono in grado di secernerla (2).
Differenti patologie testicolari e/o ipotalamo-ipofisarie possono compromettere la secrezione quantitativa e qualitativa delle gonadotropine. Infatti, possono risultare ridotte in caso di patologie primarie ipotalamo-ipofisarie (ipogonadismo ipogonadotropo, adenomi ipofisari, traumi cranici, digiuni prolungati, ecc), mentre sono elevate in caso di grave danno primitivo testicolare (orchiti, azoospermia idiopatica, s. di Klinefelter, criptorchidismo, ecc).
Struttura primaria e secondaria delle gonadotropine dell’uomo
Le gonadotropine condividono caratteristiche comuni, essendo costituite da due subunità proteiche (catena α e β), con carboidrati associati in modo non covalente. All’interno di ogni specie, la subunità α delle due gonadotropine (detta subunità comune) presenta la medesima struttura primaria, costituita da 92 aminoacidi, e i medesimi siti di attacco dei gruppi glicosidici (residui 52 e 78 dell’asparagina). Il gene della subunità α è localizzato nel genere umano sul cromosoma 6q 21.1-23 ed è costituito da 4 esoni e 3 introni.
La subunità β conferisce la specificità biologica alla singola gonadotropina. Il gene per l’LH è sito sul cromosoma umano 19q13.3 e la molecola di 121 aminoacidi presenta un singolo gruppo glicosidico a livello dell’asparagina in posizione 13. Il gene per l’FSH è sito sul cromosoma 11q13 e la molecola di 111 aminoacidi presenta due gruppi glicosidici (residui 13 e 30 dell’asparagina).
Le sequenze aminoacidiche delle subunità β di LH e hCG (145 aminoacidi) sono molto simili, essendo differente solo la parte C terminale, mentre l’FSH mostra un limitato livello di omologia di circa il 40% (3). La struttura secondaria dell’hCG è molto simile a quella dell’LH, da cui, però, si differenza sia per la parte glucidica che per la sequenza di alcuni amminoacidi che costituiscono la catena β (121 aminoacidi per LH e 145 per hCG)(4). La presenza della componente glucidica (30%), in particolare la ricchezza in acido sialico, causano un significativo allungamento dell’emivita plasmatica dell’hCG rispetto a quella dell’LH (5), caratterizzandone la sua attività biologica. Come l'LH, l’hCG per stimolare la secrezione di testosterone (T) deve legarsi a un recettore di membrana (lo stesso su cui si aggancia LH), incrementando l’AMP ciclico intra-plasmatico della cellula di Leydig. Ambedue le catene possiedono molti residui di cisteina, che permettono la formazione di ponti disulfurici. I gruppi glicosidici giocano un ruolo chiave nell’attività biologica e nel metabolismo delle due gonadotropine (6,7). La ricchezza di acido sialico nei residui glicosidici caratterizza l’emivita delle gonadotropine, limitandone l’attività biologica in vivo. Lo stesso fenomeno si ottiene se si rimuovono completamente i residui glicosidici (8).
Le gonadotropine si legano a un recettore di membrana, incrementando l’AMP ciclico intra-plasmatico.
Regolazione della secrezione delle gonadotropine e significato clinico dei livelli plasmatici
L’asse ipotalamo-ipofisi-testicolo nell’uomo è un sistema a feed-back negativo costituito da differenti componenti integrate con un controllo intra-ghiandolare (paracrino/autocrino) che interagisce con le varie parti dell’asse.
Diversi ormoni steroidei e peptidici contribuiscono alla regolazione della secrezione di FSH e LH (feed-back negativo). T e 17β-estradiolo (E2) contribuiscono soprattutto a modulare negativamente la secrezione di LH sia nei giovani che negli anziani (9,10), mentre inibina B e T (ad alte dosi) inibiscono la secrezione di FSH (11). Classicamente i livelli plasmatici di FSH ed LH ci permettono di identificare la sede del danno dell’asse ipotalamo-ipofisi-testicolo:
- se le gonadotropine (specialmente FSH) sono superiori almeno una volta alla deviazione standard del metodo utilizzato, si è in presenza di un danno testicolare primitivo;
- se i livelli sono bassi o meglio indosabili, il danno è da ritenere a livello ipotalamo-ipofisario (testicolopatia secondaria).
Spesso questo dato non è così evidente, soprattutto nelle forme di oligozoospermia idiopatica, essendo le gonadotropine nel range di normalità. In questo caso, tuttavia, i rapporti tra inibina B/FSH e T/LH possono aiutare per comprendere se il sistema di feed-back rispettivamente con la cellula del Sertoli (IB/FSH) e con la cellula di Leydig (T/LH) sono in equilibrio o sotto stress (ipogonadismo compensato)(12-14).
Tra gli altri ormoni che possono avere un ruolo negativo sulla secrezione delle gonadotropine va ricordata la prolattina (PRL). In caso d’eccesso di secrezione, come nei prolattinomi, si ha una riduzione della secrezione di gonadotropine, sia per motivi meccanici (espansione dell’adenoma ipofisario) sia per un incremento di inibina B per azione permissiva della PRL sulla cellula del Sertoli (11). Infine, ipotiroidismo e ipercortisolismo riducono i livelli circolanti delle gonadotropine, mentre l’ipertiroidismo ha un effetto stimolante la secrezione delle gonadotropine. Il meccanismo con cui cortisolo e ormoni tiroidei influenzano la secrezione delle gonadotropine è legato al loro ben noto effetto sulla sex hormone-binding globulin (SHBG) e sulla conseguente variazione della clearance del T (15).
Dosaggio plasmatico delle gonadotropine e suo significato clinico
Considerando che il dosaggio biologico dell’LH abbia un interesse esclusivamente di ricerca, nella pratica clinica i metodi che hanno maggior diffusione sono quello radioimmunologico (RIA), maggiormente utilizzato negli anni ’80 e ’90 del secolo scorso, poi sostituito da quello immunometrico (chemiluminescenza), che ha permesso di superare il problema dello smaltimento del radioattivo, automatizzando la determinazione senza, tuttavia, perdere in specificità ed accuratezza (11-15).
Il RIA all’inizio utilizzava sieri anti-hCG, sia per la determinazione di hCG che di LH, vista l’estrema comunanza della struttura primaria dei due ormoni. In seguito, si sono ottenuti sieri per la subunità β dell’hCG, altamente specifici per la diagnostica accurata di gravidanza.
Le concentrazioni di LH e FSH sono di solito espresse in termini di standard calibrati in unità biologiche (per es. provenienti da NIH o da WHO). L’utilizzo di differenti standard di riferimento, di fatto, può creare differenti valori di riferimento, la qual cosa è possibile vista l’eterogeneità delle gonadotropine. È possibile un parziale superamento del problema, facendo riferimento a calibratori ottenuti mediante tecnica ricombinante dello standard.
Nel maschio l’hCG non è mai dosabile nel sangue, con l’eccezione di alcune forme di neoplasia testicolare (corion-carcinoma e seminomi) che sono in grado di secernerla (16).
| Alterazioni delle concentrazioni di gonadotropine | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Intensa attività atletica Cachessia Ipopituitarismo Ipercortisolismo Iperprolattinemia Ipotiroidismo Depressione |
Ipogonadismo primario Ipertiroidismo |
| Modificazioni farmaco-indotte | Estrogeni Progestinici Androgeni GnRH agonisti Inibina (solo FSH) Corticosteroidi |
Estrogeni a bassa dose Anti-estrogeni e clomifene Inibitori aromatasi GnRH |
Bibliografia
- Pelletier G, Robert F, Hardy J. Identification of human anterior pituitary cells by immunoelectron microscopy. J Clin Endocrinol Metab 1978, 46: 534-42.
- Bahl OP. Human chorionic gonadotropin, its receptor and mechanism of action. Fed Proc 1977, 36: 2119-27.
- Gharib SD, Wierman ME, Shupnik MA, Chin WW. Molecular biology of the pituitary gonadotropins. Endocr Rev 1990, 11: 177-99.
- Canfield ER, Morgan FJ, Kammermann S, et al. Studies on human chorionic gonadotropin. Recent Prog Horm Res 1971, 27: 721-5.
- Chen HC, Shimohigashi Y, Dufau ML, Catt KJ. Characterization and biological properties of chemically deglycosylated human chorionic gonadotropin. Role of carbohydrate moieties in adenylate cyclase activation. J Biol Chem 1982, 257: 14446-52.
- Pierce JG, Parsons TF. Glycoprotein hormones: structure and function. Annu Rev Biochem 1981, 50: 465-95.
- Ryan RJ, Charlesworth MC, McCormick DJ, et al. The glycoprotein hormones: recent studies of structure-function relationship. FASEB J 1988, 2: 2661-9.
- Baenzinger JU. Glycosylation: to what end for glycoprotein hormones? Endocrinology 1996, 137: 1520-2.
- Raven G, de Jong FH, Kaufman JM, de Ronde W. In men, peripheral estradiol levels directly reflect the action of estrogens at the hypothalamo-pituitary level to inhibit gonadotropin secretion. J Clin Endocrinol Metab 2006, 91: 3324-8.
- T'Sjoen GG,Giagulli VA, Delva H, et al. Comparative assessment in young and elderly men of the gonadotropin response to aromatase inhibition. J Clin Endocrinol Metab 2005, 90: 5717-22.
- Giagulli VA, Carbone D. Hormonal control of inhibin B in men. J Endocrinol Invest 2006, 29, 706-13.
- Giagulli VA, Vermeulen A. Leydig cell function in infertile men with idiopathic oligospermic infertility. J Clin Endocrinol Metab 1988, 66: 62-7.
- Giagulli VA, Carbone MD, De Pergola G, et al. Could androgen receptor gene CAG tract polymorphism affect spermatogenesis in men with idiopathic infertility. J Assist Reprod Genet 2014, 31, 689-97.
- Tajar A, Forti G, O'Neill TW, et al; EMAS Group. Characteristics of secondary, primary, andcompensatedhypogonadism in aging men: evidence from the European Male Ageing Study. J Clin Endocrinol Metab 2010, 95: 1810-8.
- Giagulli VA, Vermeulen A. Increased plasma 5 alpha-androstane-3 alpha,17 beta-diol glucuronide concentration in clinically euthyroid women with suppressed plasma thyrotropin levels: further evidence for generalized tissue overexposure to thyroid hormones in these subjects. J Clin Endocrinol Metab 1992, 74: 1465-7.
- Bahl OP. Human chorionic gonadotropin, its receptor and mechanism of action. Fed Proc 1977, 36: 2119-27.
Testosterone nella diagnostica della gonade maschile
Vito Angelo Giagulli
Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia”, Conversano AUL/BA
Esiste una chiara differenza sessuale tra il maschio e la donna sia per i livelli circolanti del testosterone (T) che per la sua secrezione e metabolismo. Nel maschio, la sede principale di secrezione è il testicolo, mentre nella donna il testosterone viene secreto a partire dalla pubertà per il 50% prevalentemente dall’ovaio, mentre il restante 50% è frutto della conversione periferica degli altri androgeni deboli (non attivi) di origine prevalentemente surrenalica [androstenedione, deidroepiandrosterone (DHEA) e suo solfato (DHEAS)].
I livelli di T variano in funzione dell’età e della capacità riproduttiva in ambo i sessi (2,3):
- nella donna prima della pubertà risultano < 30 ng/dL, durante l’età fertile variano tra 30 e 50 ng/dL in base alle fasi del ciclo mestruale; durante la menopausa si riducono solo in parte, visto che l’ovaio, a differenza della sua capacità secretoria estrogenica, mantiene in maniera efficace quella androgenica;
- nel maschio durante i primissimi mesi di vita si possono trovare livelli paragonabili a quelli riscontrabili nei maschi adulti sani (> 350 ng/dL, minipubertà), mentre risultano essere sovrapponibili a quelli delle donne per tutto il periodo dell’infanzia; aumentano in maniera progressiva all’inizio della pubertà (volume testicolare > 4 mL), raggiungendo al termine di tale processo (volume testicolare > 12 mL) i valori ritenuti normali per un adulto sano tra 350-1000 ng/dL (3,4).
Il T circola nel sangue prevalentemente (circa 95%) legato alle proteine: albumina (A) e Sex Hormone Binding Globulin (SHBG). Queste due proteine presentano diversa affinità per il T: SHBG altamente specifico, A aspecifico. Piccole quantità di T circolano libere (FT) in quantità differenti a secondo del sesso: < 1% del totale per le donne fertili e 1-1.5% del totale per l’uomo adulto sano. La quota circolante completamente libera (FT) e quella legata aspecificamente all’A possono superare facilmente le membrane cellulari dei tessuti sensibili ed entrare nel citoplasma cellulare, per legarsi al recettore androgenico che, una volta attivato, può traslocare nel nucleo cellulare per attivare o reprimere specifici geni. Mentre la concentrazione di A circolante non è differente nei due sessi né varia con l’età (circa 4.3 g/dL), quella di SHBG varia sia con l’età che con il sesso: nella donna fertile è intorno a 75 ± 30 nM/L, mentre nel maschio adulto è di 50 ± 20 nM/L. L’età è un fattore importante nel co-regolare i livelli sierici di SHBG, soprattutto per l’uomo, dove risultano significativamente più elevati nell’anziano rispetto al maschio giovane.
Diversi ormoni possono influenzare i livelli circolanti della SHBG:
- incrementati da ipertiroxinemia (ipertiroidismo) e iperestrogenismo (terapia orale con estrogeni);
- ridotti da iperprolattinemia, eccesso di GH (acromegalia) e iperinsulinismo (obesità).
Ci si potrebbe attendere che tutte le situazioni cliniche che comportano una variazione di SHBG circolante si accompagnino a iperandrogenismo o ipoandrogenenismo. In realtà ciò non si verifica, perché i livelli circolanti del FT restano costantemente invariati (euandrogenismo) grazie al compenso del sistema ipotalamo-ipofisario (feed-back negativo), che blocca o incrementa i livelli di LH a seconda dell’aumento o riduzione dei livelli del T totale circolante. Al contrario, quando il sistema di feed-back viene compromesso per alterata sensibilità del recettore androgenico (come nelle forme di resistenza completa o incompleta agli androgeni), i livelli circolanti di T totale e di FT, pur risultando aumentati, non causano iperandrogenismo ma una condizione di ipogonadismo funzionale che porta nei bambini a disturbi della differenziazione sessuale (s. di Morris e Reifeinstein) o negli adulti a ipogonadismo conclamato come nel caso del polimorfismo CAG (s. di Kennedy: atrofia spino-bulbare e ipotrofia testicolare con deficit di T) (4).
Quando i livelli circolanti di T e, soprattutto, di FT sono cronicamente e chiaramente inferiori a quelli misurati in una popolazione sana > 18 anni, cioè rispettivamente < 300 ng/dL (10 nM/L) e < 65 ng/dL (225 pM/L), il soggetto adulto (cioè che ha già completato una normale pubertà) viene considerato ipogonadico (ipogonadismo dell’adulto). Tali cut-off sono validi anche per il maschio adolescente che non ha completato la pubertà dopo i 18 anni, nel qual caso si parla di ipogonadismo pre-puberale (4).
Il catabolismo del T nei due sessi è caratterizzato soprattutto dalla conversione in un metabolita 5α- e 3α-ridotto (androstanediolo), con successiva coniugazione con acido glucuronico (androstanediolo glucuronide) o con formazione di 17-chetosteroidi che, a loro volta, possono essere glucuronati o solfati ed escreti nelle urine (androsterone glucuronide). La sede principale del metabolismo del T nei due sessi è il sistema splancnico (fegato), anche se l’extra-splancnico (cute) può giocare un ruolo importante nella donna, visto che parte dei livelli circolanti dello stesso T derivano dalla conversione degli androgeni deboli (5-8). Tuttavia, è bene sottolineare che la determinazione dei metaboliti terminali (androstanediolo glucuronide e androsterone glucuronide) risulta avere un’importanza clinica inferiore rispetto a quella del FT, che è considerato il parametro più fedele dell’effetto androgenico, sia nell’uomo che nella donna (9,10).
La determinazione plasmatica del T, così come per gli altri steroidi, offre problematiche tecniche legate alla grandezza della molecola, alla struttura molecolare simile ad altri androgeni e alla bassa concentrazione, riscontrata sia in condizioni fisiologiche (infanzia e adolescenza in ambo i sessi, donne adulte e post-menopausa) che patologiche (panipopituitarismo o s. di Addison). Di conseguenza, queste criticità sono più evidenti quando si desidera misurare la quota libera di T che, come già detto, rappresenta solo l’1-2% del T totale (4).
Negli anni ‘70-‘90 del secolo scorso il dosaggio degli steroidi, e in particolare del T, era effettuato grazie a metodi di cromatografia su carta o colonne di Celite o Sephadex, preceduti da estrazione con solventi organici e seguiti da misurazione radio-immunologica (RIA). Quelle metodologie, se pur hanno permesso di superare le difficoltà legate alle piccole concentrazioni plasmatiche (< 30 ng/dL), in realtà sono risultate estremamente indaginose, richiedendo un lungo lasso di tempo (sino a un’intera settimana lavorativa!) e presentando problemi di smaltimento dei residui radioattivi. Pertanto, dopo gli anni ‘90 anche a seguito dell’incremento delle richieste di determinazione del T, i metodi cromatografici sono stati sostituiti da metodiche immunologiche dirette (senza estrazione), che, seppur automatizzati e quindi facili e rapidi da eseguire, hanno perso di sensibilità e accuratezza, soprattutto alle basse concentrazioni (5-9). Tuttavia, questi metodi restano di prima scelta per la pratica clinica nel maschio, essendo in grado di distinguere i soggetti eugonadici da quelli ipogonadici (11). Nell’ultimo decennio, infine, per la determinazione del T alle basse concentrazioni (< 50 ng/dL) sono stati sviluppati metodi di cromatografia liquida con spettrometria di massa (LC-MC), da preferire in caso si voglia misurare lo steroide in bambini o donne normali o affette da iperandrogenismo (per esempio ovaio policistico) (9).
Nessun metodo diretto è da considerarsi accurato e sensibile per quanto riguarda la determinazione plasmatica del FT. Visto che il metodo ritenuto “gold standard” (dialisi all’equilibrio) è molto complesso, costoso e indaginoso, utilizzato solo da pochi laboratori, il calcolo indiretto del FT mediante la formula di Vermeulen (9) applicata alla misurazione della concentrazione sierica della SHBG e del T determinato con il metodo immunologico diretto per gli uomini o con la LC-MS per le donne (9) è sicuramente l’approccio più appropriato per la pratica clinica.
| Alterazioni delle concentrazioni di testosterone | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Età Ipogonadismo Ipopituitarismo Malattie croniche Obesità |
Pubertà Ipercortisolismo ACTH-dipendente Carcinoma surrenalico Sindrome adreno-genitale Resistenza agli androgeni PCOS |
| Modificazioni farmaco-indotte | Androgeni | hCG/LH Auto-somministrazione di androgeni a scopo anabolizzante |
Conclusioni
Appare generalmente accettato che i livelli circolanti di T totale misurato con i metodi diretti sono sufficienti per l'identificazione dello stato di ipogonadismo nel maschio (< 280 ng/dL), mentre si può ricorrere al calcolo del FT (< 65 pg/dL) in tutti quei casi in cui i livelli plasmatici di T sono compresi tra 300 e 280 mg/dL (zona grigia) che permette di identificare i soggetti con ipogogonadismo.
I livelli circolanti del FT sono da considerare il parametro più attendibile dell’effetto androgenico in ambo i sessi, essendo il dosaggio del T totale influenzabile da numerosi fattori, non ultime le concentrazioni ematiche di SHBG.
Il metodo immunologico diretto per il maschio e la LC-MS nella donna sono le metodiche più accurate per misurare il T totale, mentre il calcolo del FT mediante la formula di Vermeulen risulta il metodo pratico per determinare i livelli plasmatici di FT, a patto che per la donna si usi la LC-MS per misurare il T totale.
Bibliografia
- Rommerts FFC. Testosterone: an overview of biosynthesis, transport, metabolism and non-genomic action. In “Nieschlag E, Behere HM, eds. Testosterone action, deficiency, substitutio. Cambridge University Press 3th Edition, 2004: 1-37.
- O’Malley BW, Scott CA. Steroid hormones: metabolism and action. In “Yen SSC, Jaffe RB, Barbieri RL, eds. Reproductive Endocrinology, Saunders 2th Edition, 1999: 119-43.
- Longcope C. Androgen metabolism and clearance. In “Azziz R, Nestler JE, Dewallay D, eds. Androgen excess disorders in women. Lippincott-Raven, 1997: 37-46.
- Vermeulen A, Kaufman JM. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005, 26: 833-76.
- Vermeulen A, Giagulli VA. Physiopathology of plasma androstanediol-glucuronide. J Steroid Biochem Molec Biol 1991, 39: 829-33.
- Giagulli VA, Giorgino R, Vermeulen A. Is plasma 5alpha-androstane 3alpha, 17 beta-diol glucuronide a biochemical marker of hirsutism in women. J Steroid Biochem Mol Biol 1991, 39: 55-61.
- Giagulli VA, Giorgino, Vermeulen A. Origin and significance of plasma androsterone glucuronide levels: a parameter of adrenal androgen and hepatic 5-alpha-reductase activity. J Clin Endocrinol Metab 1993, 76: 918-23.
- Vermeulen A, Kaufman JM, Giagulli VA. Influence of some biological indexes on sex-hormone-binding globulin and androgen levels in aging or obese males. J Clin Endocrinol Metab 1996, 81: 1821-6.
- Tosi F, Fiers T, Kaufmans JM, et al. Implication of androgen assay accuracy in the phenotyping of women with polycystic ovary syndrome. J Clin Endocrinol Metab 2016, 101: 610-8.
- Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 1999, 84: 3666-72.
- Huhtaniemi IT, Tjar A, Lee DM, et al. Comparison of serum testosterone and estradiol measurements in 3174 European men using platform immunoassay and mass spectrometry; relevance for the diagnosis in aging men. Eur J Endocrinol 2012, 166: 983-91.
Androgeni minori
Vito Angelo Giagulli
Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia” Conversano ASL/BA
Definizione e significato clinico
Classicamente si considerano come minori tutti quegli androgeni (androstenedione, deidroepiandrosterone – DHEA – e suo solfato) che non possono legarsi direttamente al recettore specifico e non determinano l’effetto androgenico, ma che potendosi convertire in androgeni forti [testosterone (T) e diidrotestosterone (DHT)] a livello dei tessuti sensibili, possono indirettamente evocare una risposta androgenica. L’altra caratteristica importante di questi steroidi è che circolano nel sangue legandosi in maniera aspecifica all’albumina, ma non sono in grado di legarsi alla SHBG, che specificamente trasporta nel torrente circolatorio gli steroidi sessuali (androgeni forti ed estrogeni).
Alcuni androgeni deboli hanno un’origine prevalentemente surrenalica (DHEA e il suo solfato), mentre altri hanno origine sia testicolare che surrenalica (androstenedione) (1,2). Visto che non possono legarsi all’SHBG, i livelli circolanti e la loro produzione giornaliera risentono molto delle variazioni dell’albuminemia (scompenso cardiaco, cirrosi e insufficienza renale), del peso corporeo (indice di massa corporea) oltre che dell’età del soggetto. Infatti, in caso di obesità i livelli degli androgeni surrenalici possono risultare leggermente ridotti, a causa dell’aumento della clearance, e nell’invecchiamento maschile tutti gli androgeni (soprattutto DHEA e il suo solfato) si riducono significativamente (3).
A differenza della donna, il ruolo degli androgeni minori nel maschio è veramente scarso. Infatti, se nella donna circa il 50% del T circolante deriva dalla conversione periferica degli androgeni minori (specialmente l’androstenedione), nel maschio questo non si verifica e gran parte degli androgeni deboli vengono metabolizzati (soprattutto a livello epatico) in cataboliti, che successivamente sono coniugati con acido solforico o glucuronico (androsterone glucuronide e androstanediolo glucuronide) per essere escreti nelle urine o nelle feci (tramite la bile) (4). Queste evidenze di fisiologia sono confermate dagli studi di intervento intrapresi da diversi gruppi di ricerca, miranti a somministrare androgeni minori (in particolare DHEA) nei soggetti con iposurrenalismo o negli anziani allo scopo di mitigare importanti disturbi dell’invecchiamento quali ipotrofia muscolare, disfunzione erettile, riduzione della libido, incremento della massa grassa, osteoporosi, ecc. In tutti questi studi, di fatto, la terapia sostitutiva con DHEA(S) è risultata fallimentare (5).
Con l’eccezione dei tumori surrenalici che possono secernere grandi quantità di DHEAS, l’androstenedione può risultare aumentato rispetto al T in disturbi estremamente rari, quali il deficit di 17β-idrossisteroido-deidrogenasi che causa riduzione della conversione dell’androstenedione in T a livello della cellula del Leydig. In queste condizioni, dal punto di vista biochimico i livelli circolanti di T sono ridottissimi, mentre risultano essere estremamente elevati quelli dell’androstenedione; dal punto di vista clinico, il fenotipo del soggetto con cariotipo maschile è femminile con virilizzazione, ipotrofia del pene e di solito testicoli criptorchidi che presentano tubuli seminiferi ipotrofici con iperplasia delle cellule di Leydig (6).
| Variazione delle concentrazioni plasmatiche degli androgeni minori | |||
| Androstenedione | DHEA | DHEA-S | |
| Pubertà | ↑↑ | ↑↑ | ++ |
| Invecchiamento | ↓↓ | ↓↓ | ↓↓ |
| Tumori surrenalici | ↑ | ↑ | ↑↑↑ |
| Deficit 17β-OH-deidrogenasi | ↑↑↑ | ↑ | // |
Biblografia
- O’Malley BW, Scott CA. Steroid hormones: metabolism and action. In: Yen SSC, Jaffe RB, Barbieri RL eds. Reproductive Endocrinology. Saunders 2nd Edition 1999: 119-43.
- Longcope C. Androgen metabolism and clearance. In: Azziz R, Nestler JE, Dewallay D eds. Androgen excess disorders in women. Lippincott-Raven 1997: 37-46.
- Vermeulen A, Kaufman JM. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005, 26: 833-76.
- Vermeulen A, Giagulli VA. Physiopathology of plasma androstanediol glucuronide. J Steroid Biochem Molec Biol 1991, 39: 829-33.
- Corona G, Rastrelli G, Giagulli VA, et al. Dehydroepiandrosterone supplementation in elderly men: a meta-analysis study of placebo-controlled trials. J Clin Endocrinol Metab 2013, 98: 3615-26.
- Schaison G, Sitruk LR. Male pseudohermaphroditism due to testicular 17 ketosteroid reductase deficiency. Horm Metab Res 1976, 8: 307-10.
AMH e inibina
Vito A Giagulli
Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia”, Conversano AUL/BA
Ormone antimulleriano (AMH)
AMH è un omo-dimero glicoproteico membro della famiglia Trasforming Growth Factor β (TGF-β).
Nel maschio, viene sintetizzato a livello della cellula di Sertoli come pro-ormone che, in seguito, viene clivato con la formazione di un omo-dimero N-terminale (110 KDa) e C-terminale (25 KDa) associati mediante un legame non covalente e biologicamente attivo. In circolo questo legame si dissocia al momento di legarsi ai due recettori: AMHc e AMHn (1). Il gene SOX9 funge da trigger per l’espressione della secrezione di AMH, mentre il gene di AMH è sito sul braccio corto del cromosoma 19. I difetti del gene di AMH sono trasmessi come autosomici recessivi.
AMH è sintetizzato dalle gonadi in tutti i vertebrati. Regola le cellule germinali, soprattutto nella donna, mentre nel maschio inibisce il dotto di Müller tra l’8° e la 10° settimana di vita fetale (2). Nella donna, infatti, la secrezione e i livelli circolanti di AMH seguono strettamente l’età riproduttiva, mentre nell’uomo i livelli circolanti più significativi si raggiungono durante la vita fetale, per poi ridursi progressivamente dalla pubertà sino all’età adulta.
I livelli circolanti di AMH risultano indosabili nei pazienti orchiectomizzati o ovariectomizzati o in tutte quelle forme di disturbi della differenzazione sessuale in quei pazienti con cromosoma Y positivo che presentano perdita di tessuto testicolare: disgenesia delle gonadi totale o parziale, vanishing testis syndrome e ovotestis, ecc (3).
La secrezione basale rimane per tutta la vita indipendente della gonadotropine, anche se FSH è in grado di stimolare la secrezione di AMH, in quanto induce la proliferazione delle cellule di Sertoli, o può determinare un’aumentata regolazione del gene di AMH (2). Il testosterone (T) regola negativamente la secrezione di AMH dalla pubertà in poi, mentre al momento della mini-pubertà tale effetto non si può verificare, poiché il recettore degli androgeni non è ancora espresso sulla cellula di Sertoli (4-6).
Nella sindrome da resistenza parziale o totale agli androgeni i livelli di AMH sono normali/alti, risultando inappropriatamente elevati rispetto a quelli del T (2). Nel caso della sindrome da persistenza del dotto Mülleriano, invece, i livelli di AMH possono essere indosabili (mutazione del gene AMH) o normali (in caso di mutazione del recettore di AMH) (2).
Nei bambini con testicoli non palpabili, la sola determinazione di AMH (senza bisogno di un test di stimolazione con hCG) è in grado di differenziare l’anorchia (AMH indosabile) dal criptorchidismo bilaterale con testicoli in sede addominale (AMH dosabile) (7).
Infine, ad oggi è risultato deludente il ruolo dei livelli circolanti di AMH come parametro di spermatogenesi efficace nel maschio infertile, nel paziente affetti da s. di Klinefelter e, in particolare, in quei soggetti con azoospermia non ostruttiva (8-10).
L’ormone antimulleriano (AMH) è espresso nelle cellule dei piccoli follicoli pre-antrali, dove svolge un ruolo importante per la follicologenesi, in quanto inibisce il reclutamento e la maturazione dei follicoli, riducendo l’influenza dell’FSH sulla crescita dei follicoli.
L’AMH è quasi indosabile nella femmina alla nascita, comincia ad aumentare lentamente nelle settimane successive alla nascita e raggiunge il picco nel corso della pubertà. Diminuisce progressivamente nel corso della fase fertile, quando la riserva follicolare si esaurisce e ritorna indosabile circa 3-5 anni prima dell’esaurimento completo della riserva dei follicoli primordiali e della menopausa.
La concentrazione di AMH può cambiare in modo significativo in donne della stessa età, in relazione alla variabilità delle dimensioni iniziali e della velocità di deplezione del pool di follicoli (e dell’età della menopausa). L’AMH è oggi il miglior esame per misurare la riserva ovarica nelle diverse situazioni cliniche: l’AMH correla significativamente con il numero di oociti che si ottengono dopo la stimolazione con gonadotropine e guida nella definizione della corretta somministrazione di gonadotropine e nell’evitare l’iperstimolazione.
| Alterazioni delle concentrazioni di AMH | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Età Ipogonadismo ipogonadotropo S. da persistenza mulleriana |
Ritardo di pubertà Mutazione recettore AMH Resistenza agli androgeni |
| Modificazioni farmaco-indotte | Testosterone | |
Inibina B
Anche l’inibina B (IB) come l’AMH viene secreta dalla cellula di Sertoli e appartiene alla superfamiglia del TGF-β. È una glicoproteina costituita da due subunità (α e β), legate tra loro mediante un ponte disulfurico.
La principale funzione è la regolazione negativa dei livelli circolanti di FSH. Questa funzione, tuttavia, è molto evidente a partire della pubertà, mentre nell’infanzia la relazione con FSH è di tipo diretto (11,12).
Nei soggetti con normale spermatogenesi i livelli di IB non si riducono con l’età (13). In ogni caso, i livelli di IB e quelli di FSH possono predire la maggior parte delle condizioni di testicolopatia (14,15). A differenza di quanto avviene per la regolazione della secrezione dell’ormone AMH, il T sembra avere un ruolo stimolante sulla secrezione di IB da parte della cellula di Sertoli, come si riscontra a seguito della terapia sequenziale con le gonadotropine per l’induzione della spermatogenesi in maschi affetti da ipogonadismo ipogonadotropo (16).
Recentemente, misurando con il metodo più sensibile i livelli plasmatici di IB nel siero di soggetti fertili classificati secondo l’ultimo manuale dell’Organizzazione Mondiale della Sanità (17), è stato possibile definirne il range di normalità: 92-316 pg/mL. In particolare, il 2.5° percentile per l’IB era di 92 pg/mL, mentre il 75° percentile per FSH era 7.8 UI/L e la combinazione di questi valori corrispondeva a un elevatissimo rischio di diagnosticare oligozoospermie severe rispetto alla valutazione effettuata tenendo in considerazione i valori dei singoli ormoni (18). I livelli circolanti di IB, inoltre, sono correlati con il volume testicolare e la funzione del recettore androgenico (polimorfismo CAG) in soggetti fertili e in quelli affetti da infertilità idiopatica che mostravano diversi gradi di compromissione della spermatogenesi (19). Tuttavia, l’IB non può essere considerato marcatore predittivo di recupero di spermatogenesi nei soggetti con azoospermia non ostruttiva (8) né in quelli affetti da sindrome di Klinefelter (9) che si sottopongono all’estrazione testicolare di spermatozoi per tecniche di fecondazione in vitro.
| Alterazioni delle concentrazioni di inibina B | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche | Età Ipogonadismo ipogonadotropo |
|
| Modificazioni farmaco-indotte | Testosterone | |
In conclusione, la determinazione dei livelli circolanti di AMH va considerata come strumento importante per le diagnosi dei disturbi della differenziazione sessuale e in tutte le forme di disgenesia testicolare, mentre i livelli sierici di IB (con la contemporanea determinazione dei livelli di FSH) vanno presi in considerazione in tutti quei soggetti che presentano disturbi della spermatogenesi.
Bibliografia
- Cate RL, Mattaliano RJ, Hession C, et al. Isolation of the bovine and human genes for Mullerian inhibiting substance and expression of the human gene in animal cells. Cell 1986, 45: 685–98.
- Morinaga C, Saito D, Nakamura S, et al. The hotei mutation of medaka in the anti-Mullerian hormone receptor causes the dysregulation of germ cell and sexual development. Proc Natl Acad Sci USA 2007, 104: 9691–6.
- Josso N, Rey R, Picard JY. Testicular anti-mullerian hormone: clinical application in DSD. Semin Reprod Med 2012, 30: 364-73.
- Josso N. In vitro synthesis of Mullerian-inhibiting hormone by seminiferous tubules isolated from the calf fetal testis. Endocrinology 1973, 93: 829–34.
- Aksglaede L, Sorensen K, Boas M, et al. Changes in anti-Mullerian Hormone (AMH) throughout the life span: a population-based study of 1027 healthy males from birth (cord blood) to the age of 69 years. J Clin Endocrinol Metab 2010, 95: 5357–64.
- Boukari K, Meduri G, Brailly-Tabard S, et al. Lack of androgen receptor expression in Sertoli cells accounts for the absence of anti-Mullerian hormone repression during early human testis development. J Clin Endocrinol Metab 2009, 94: 1818–25.
- Josso N, Rey R, Picard JY. Anti-Mullerian hormone: a valuable addition to the toolbox of pediatric endocrinologist. Int J Endocrinol 2013, 2013: 674105.
- Toulis KA, Iliadou PK, Venetis CA, et al. Inhibin B and anti-Mullerian hormone as marker of persistent spermatogenesis in men with non-obstructive azoospermia: a meta-analysis of diagnostic accuracy studies. Human Reprod Update 2010, 16: 713-24.
- Rhaven J, Frike R, Czeloth K, et al. Age and markers of Leydig cell function, but not Sertoli cell function predict the success of sperm retrieval in adolescents and adults with Klinefelter’s syndrome. Andrology 2015, 3: 868-75.
- La Marca, A, Sighinolfi G, Radi D, et al. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum Reprod Update 2010, 16: 113-30.
- Andersson AM, Juul A, Pertersen JH, et al. Serum inhibin B in healthy pubertal and adolescent boys: relation to age, stage of puberty, follicle-stimulatinghormone, luteinizing hormone, testosterone,and estradiol levels. J Clin Endocrinol Metab 1997, 82: 3976-81.
- Chada M, Prusa R, Bronsky J, et al. Inhibin B, follicle stimulating hormone, luteinizing hormone and testosterone during childhood and puberty in males: changes in serum concentrationsin relation to age and stage of puberty. Physiol Res 2003, 52: 45-51.
- Grunewald S, Glander HJ, Paasch U, Kratzsch J. Age-dependent inhibin B concentration in relation to FSH and semen sample qualities: a study in 2448 men. Reproduction 2013, 145: 237-44.
- Von Eckardstein S, Simoni M, Bergmann M, et al. Serum inhibin B in combination with serum follicle-stimulating hormone (FSH) is a more sensitive marker than serum FSH alone for impaired spermatogenesis in men, but cannot predict the presence of sperm in testicular tissue samples. J Clin Endocrinol Metab 1999, 84: 2496–501.
- Brugo-Olmedo S, De Vincentiis S, Calamera JC, et al. Serum inhibin B may be a reliable marker of the presence of testicular spermatozoa in patients with non obstructive azoospermia. Fertil Steril 2001, 76: 1124–9.
- Giagulli VA, Carbone MD. Hormonal control of inhibin B in men. J Endocrinol Invest 2006, 29: 706-13.
- World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th Edition. World Health Organization, Geneva, 2010.
- Barbotin AL, Ballot C, Sigala G, et al. Serum inhibin B concentration and reference range in normozoospermia. Eur J Endocrinol 2015, 172: 669-76.
- Giagulli VA, Carbone MD, De Pergola G, et al. Could androgen receptor gene CAG tract polymorphism affect spermatogenesis in men with idiopathic infertility. J Assist Reprod Genet 2014, 31: 689-97.
Test con hCG
Vito Angelo Giagulli
Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia”, Conversano AUL/BA
| Test con hCG | |
| Indicazioni | Da eseguire solo nel maschio. Nell’adulto: diagnosi differenziale tra ipogonadismo primario e secondario, con esplorazione della capacità secretoria di testosterone (ipoplasia leydigiana, varicocele, s. di Klinefelter, ecc). Nel bambino: diagnosi differenziale tra anorchia e criptorchidismo. |
| Meccanismo d’azione | Esplora la capacità secretoria di testosterone da parte della cellula di Leydig. L’attività del recettore è regolata negativamente dai tassi circolanti di LH (desensibilizzazione recettoriale (1). Inoltre la sua risposta allo stimolo dell’hCG (e di LH) risulta differente a secondo dell’età del soggetto (prepubere, pubere, adulto e anziano) (2) e dipendente dalla presenza di una patologia testicolare primitiva o secondaria (3). Nei soggetti puberi (II stadio secondo Tanner), in quelli con ipogonadismo ipogonadotropo e negli anziani l’attività dell’aromatasi è upregolata rispetto a quella dei soggetti adulti fertili e in buona salute, come documentato dall’aumento della secrezione di estradiolo (E2) rispetto a quella di testosterone (rapporto E/T aumentato)(2,4), mentre in quei soggetti che soffrono di forme severe di oligozoospermia idiopatica (5,6) o in quelli affetti da sindrome di Klinefelter (5), la via Δ4 steroidogenetica risulta essere significativamente compromessa (aumento inappropriato dei livelli circolanti di 17α-OH-progesterone e androstenedione rispetto a quelli del T misurato nei soggetti adulti sani). |
| Controindicazioni |
|
| Precauzioni | Nessuna |
| Esecuzione |
Negli anni sono state proposte diverse posologie e differenti protocolli di somministrazione (unica o plurime in sequenza). Oggi, la dose consigliata per l’adulto è di 5000 UI im in una sola somministrazione, mentre per i bambini si preferisce quella di circa 100 UI/kg di peso corporeo. Sebbene recentemente sia stato proposto per il test di stimolo sia l’impiego dei ricombinanti dell’hCG che di LH, il test con hCG estrattivo resta quello validato ed è, quindi, considerato il gold standard per lo studio dinamico della secrezione di T da parte della cellula di Leydig (7).
|
| Dosaggio |
Dosi dipendenti da età e peso del paziente (1,8):
|
| Possibili effetti collaterali | Dosi ripetute di hCG possono indurre ginecomastia vera (sia nell’adulto che nel bambino) e virilizzazione (solo nel bambino). |
| Valutazione risultati | Nel maschio adulto normale si ha un incremento di 2-3 volte del testosterone già al 1° giorno dopo la somministrazione, con ricaduta progressiva dopo il 3° sino al 5°; il 17ß-estradiolo aumenta precocemente in 1° giornata e cade in maniera progressiva già a partire dalla 2°. Nel bambino normale i livelli di testosterone si raddoppiano o triplicano. |
| Interpretazione | L’incremento della risposta del testosterone dipende dal metodo utilizzato e dalla sensibilità della cellula di Leydig. La risposta può ridursi se il test viene effettuato dopo stimolazione continua o con dosi ripetute di hCG. |
| Attendibilità e ripetibilità dei risultati | Può fallire se non effettuato facendo riferimento a un proprio gruppo di controllo e a un metodo validato per la determinazione del testosterone. |
| Giudizio complessivo costo-beneficio e costo-efficacia | Test di facile esecuzione e di costo non eccessivo, molto utile per la diagnosi differenziale tra anorchia e criptorchidismo. |
| Bibliografia |
|
Cariotipo e indagini genetiche nella diagnostica andrologica
Vito Angelo Giagulli1, Matteo Domenico Carbone2 e Vincenzo Triggiani3
1Unità Territoriale di Endocrinologia e Malattie Metaboliche, Presidio di Assistenza Territoriale “F Jaia”, Conversano AUL/BA
2Istituto di Ricerca Clinica e Ormonale, Centro Telesforo, Foggia
3Endocrinologia e Malattie Metaboliche, Dipartimento Interdisciplinare di Medicina, Università degli Studi di Bari “Aldo Moro”
BACKGROUND
Circa il 15% dei casi di infertilità maschile è dovuto a causa genetica, includendo sia alterazioni del numero e della struttura dei cromosomi, sia alterazioni di singoli specifici geni. Cause genetiche possono essere riscontrate nelle forme pre-testicolari di infertilità (8-10%), come l'ipogonadismo ipogonadotropo, nelle forme testicolari (50-70%), come la S. di Klinefelter, e anche nelle forme post-testicolari (15-20%) di infertilità, come nel caso della mutazione del gene della fibrosi cistica.
La ricerca di difetti genetici va riservata ai casi di azoospermia (sia ostruttiva che non) o di severa oligozoospermia (< 5 x 106 di spermatozoi/mL) e/o ai casi di ipogonadismo primitivo o secondario ad insorgenza in età pre-puberale o puberale (ipogonadismo ipogonadotropo e s. di Klinefelter). Infine, vanno considerate anche quelle mutazioni di geni che sono determinanti per la differenziazione sessuale, quali il gene SRY e i geni correlati (SOX9) presenti sugli autosomi (17q25) e quelli presenti sul cromosoma X, il recettore degli androgeni (Xq13) e il gene DAX1 (Xq21).
Nonostante la diffusione delle indagini di genetica, almeno il 40% dei disturbi primitivi del testicolo rimane di origine sconosciuta, costituendo la cosiddetta infertilità idiopatica (1).
PRINCIPALI METODI PER LO STUDIO DEI DIFETTI GENETICI IN ANDROLOGIA
In generale, possiamo suddividere le cause genetiche di infertilità maschile in due grandi categorie: difetti del cariotipo (variazione della struttura e/o del numero) e alterazioni di singoli geni (mutazioni di un singolo gene). Meno note, tuttavia, sono le condizioni multi-fattoriali in cui si ha l'interazione tra l’alterazione di alcuni geni con fattori ambientali e quelle alterazioni della fertilità che originano dalle mutazioni del DNA mitocondriale. Infine, sono stati studiati una serie di fattori genetici di rischio per l’infertilità maschile da causa non nota, in particolare i polimorfismi a singolo nucleotide (SNPs) o le delezioni o duplicazioni che portano al cambiamento del numero di coppie di una specifica regione di un cromosoma, noti come copy numbers variations (CNVs).
I principali test utilizzati in andrologia sono: 1) analisi del cariotipo con tecnica di ibridazione fluorescente in situ (FISH); 2) analisi delle micro-delezioni del cromosoma Y; 3) sequenziamento di geni.
Analisi del cariotipo
È la tecnica in uso da più tempo e richiede grande esperienza dell’operatore che la effettua. Consiste nello studio mediante bandeggio G del numero e della morfologia dei cromosomi ottenuti dai leucociti bloccati in metafase mitotica. Poiché la tecnica prevede diversi passaggi che non possono essere automatizzati (per esempio la coltura dei leucociti), viene considerata “time consuming”.
A integrazione dell'analisi del cariotipo c’è il metodo FISH, che permette di ricercare e identificare, grazie a sonde di DNA marcate con fluorofori, specifici frammenti genomici già noti (50-100 Kb), direttamente sul genoma cellulare del campione senza indurre la moltiplicazione cellulare.
Se la FISH ci permette di studiare la presenza o la delezione di geni noti, con l’Ibridazione Genomica Comparata (CGH) è possibile studiare e identificare geni non ancora noti. Essa consiste nel confrontare il DNA marcato con fluorocromi diversi del campione con un pool di DNA genomico di riferimento. Il vantaggio di tale tecnica è nel fatto che in un’unica ibridazione si possono ottenere informazioni sulla dimensione e sulla localizzazione di tutti gli sbilanciamenti cromosomici, mentre il suo limite è il basso potere di risoluzione (3-10 Mb).
Con l’avvento della tecnologia basata sui microarray, sviluppata nell’ultimo decennio, è possibile esaminare tutto il genoma umano su un singolo chip con alta risoluzione (fino ad un centinaio di coppie di basi). Nell’array-CGH i cromosomi in metafase sono stati sostituiti con sonde di DNA bersaglio roboticamente immobilizzati e distribuiti su un microscopico vetrino (chip): questo metodo fa aumentare significativamente la risoluzione e semplifica la procedura dell’analisi. Le moderne tecnologie di microarray hanno permesso l’identificazione di piccole varianti strutturali dei cromosomi dette copy numbers variants (CNVs). Le CNVs possono essere delezioni o duplicazioni, che portano a un cambiamento del numero di copie di una specifica regione cromosomica. Le CNVs possono avere una dimensione che varia da una kilobase (kb) a diverse megabasi (Mb). Queste varianti strutturali quantitative, spesso, coinvolgono uno o più geni e comprendono, complessivamente, più nucleotidi per genoma rispetto al numero totale di SNPs. L’esempio più noto per i difetti genetici di CNVs è quello delle micro-delezioni del cromosoma Y.
Analisi delle micro-delezioni del cromosoma Y
La diagnosi di micro-delezione del cromosoma Y è effettuata mediante analisi quantitativa della reazione della polimerasi (PCR), che porta, in una sola reazione, all’amplificazione e quantificazione gli acidi nucleici, mediante la misurazione della fluorescenza emessa da un fluorofloro. In accordo con le più recenti linee guida della European Academy of Andrology (EAA) e del European Molecular Genetic Quality Network (EMQN), il metodo usato deve essere basato su 2 reazioni PCR multiplex, che usano un limitato numero di robusti e ben validati primer, che includono nella stessa determinazione sia le tre zone pertinenti alle regioni AZF che numerosi controlli interni. Questo protocollo è ritenuto sufficiente per lo screening di più del 95% dei casi importanti di micro-delezione del cromosoma Y. Tuttavia, si raccomanda di non prendere in considerazione per questo dosaggio kit commerciali che utilizzano un eccessivo numero di marcatori con la speranza di incrementare il potere diagnostico, ma che in realtà determinano solo un aumento significativo del rischio di errori analitici. I vari kit in commercio che seguono tali indicazioni hanno mostrato un’accuratezza diagnostica > 97%, come riscontrato dai controlli di qualità condotti da EAA e EMQN (2).
Sequenziamento diretto del DNA
Si utilizza quando viene sospettata una mutazione di un specifico gene. Classicamente, un campione di sangue decoagulato viene sequenziato secondo il metodo di Ranger, che consiste in 4 separate reazioni che producono frammenti marcati di DNA, che vengono separati grazie a un gel elettroforetico di poliacrilamide e urea. Questo metodo, che risulta complesso e richiede molto tempo, attualmente è stato superato dal “Dey-terminator”, sequenziamento che risulta rapido e automatizzato grazie ad analisi computerizzate. Questi metodi sono indispensabili per lo studio di geni come quelli della mutazione della fibrosi cistica (CFTR) o quelli coinvolti nella genesi dell’ipogonadismo ipogonadotropo (Kal 1, GnRH, GPR54, ecc) (1,3).
PATOLOGIA CROMOSOMICA
Classicamente la patologia cromosomica può essere divisa in anomalie di morfologia e anomalie di numero. Per l’identificazione di queste patologie le tecniche principali sono il cariotipo e/o la FISH.
Le anomalie di struttura hanno origine dalla rottura dei cromosomi. Questi danni vengono di solito riparati da specifici enzimi, senza ottenere però il più delle volte la “restitutio ad integrum” del cromosoma. Queste rotture non avvengono casualmente, ma si realizzano in zone ben precise. La loro frequenza è 100 volte superiore alla mutazione di singoli geni.
I principali tipi di anomalie cromosomiche di struttura sono: duplicazioni e cromosomi ad anello, duplicazioni, inversioni, traslocazioni (frequenza nella popolazione di 1/660), traslocazioni reciproche (frequenza nella popolazione:1/1000) o robertsoniana (frequenza nella popolazione di 1/1000) e isocromosomi. Queste anomalie cromosomiche risultano molto più frequenti nelle coppie sterili (3.95%) rispetto alla popolazione generale e nei maschi con azoospermia e/o oligozoospermia severa (3.5%) rispetto ai soggetti normozoospermici (4).
Le anomalie del numero dei cromosomi, chiamate aneuploidie, consistono in un numero di cromosomi diverso, multiplo del corredo aploide. Quando si ha l’assenza di un cromosoma omologo si parla di monosomie (spesso non compatibili con la vita), mentre in caso di un cromosoma in eccesso di parla di trisomia.
La s di Klinefelter (47XXY) (KS) è la forma più frequente di aneuploidia con ipogonadismo ipergonadotropo. La frequenza di nascita è di circa 1/800 nati maschi, mentre il 10% dei pazienti affetti da azoospermia sono soggetti con KS.
Micro-delezioni del cromosoma Y
Poiché, con l’eccezione dei geni PAR, i maschi sono emizigoti per la gran parte dei geni che si trovano sul cromosoma Y, qualunque mutazione/CNV “de novo” può avere un significativo e immediato impatto sulla spermatogenesi, dato che non si può avere una compensazione per l’assenza di un altro allele normale. Le micro-delezioni della Y avvengono nella regione AZF e sono l’esempio più evidente di CNV con importanza clinica. Lo studio delle delezioni AZF (a,b,c) complete o parziali, infatti, è ormai incluso nella routine dei test genetici per quei pazienti che presentano azoospermia e/o oligozoospermia severa. A proposito dello studio delle delezioni parziali tipo gr/gr, va precisato che non vanno incluse nella routine diagnostica, in quanto, l’incidenza di questo fattore sembra essere popolazione-dipendente. Difatti, solo negli italiani il rischio di alterazione della spermatogenesi nei portatori di questa anomalia è circa 8 volte superiore rispetto ad altre popolazioni (3).
Le delezioni AZF c costituiscono circa l'80% dei casi di questi disturbi del cromosoma Y, mentre le AZF b sono circa il 5%; risultano rare (< 4%) le forme AZF a e rarissime le AZF bc.
La delezione completa AZF a è associata alla sindrome a sole cellule del Sertoli, con azoospermia e con la virtuale impossibilità di ottenere spermatozoi mediante tecniche di estrazione (TESE o micro-TESE) al fine della ICSI (intracytoplasmic sperm injection). Forme AZF c, invece, sono compatibili con la presenza di spermatozoi nell’eiaculato e quindi queste forme possono essere riscontrate anche nei soggetti con oligozoospermia severa. Pertanto, pazienti affetti da oligozoospermia e delezione della zona AZF c possono naturalmente trasmettere alla prole tale difetto.
In almeno il 50% delle forme AZF c con azoospermia è possibile ritrovare sperma mediante estrazione dal testicolo (TESE). Visto che in caso di tecniche di fecondazione non è stata ritrovata una differenza significativa di tasso di gravidanza tra i soggetti affetti da micro-delezione e quelli senza la micro-delezione, è utile consigliare a questi pazienti un consulto dal genetista, che dovrà essere esteso anche ad altri membri della famiglia in caso di forme parziali AZF a, AZF b e AZF c (2).
FATTORI GENETICI DI VULNERABILITÀ NEI MASCHI AFFETTI DA INFERTILITÀ IDIOPATICA
Un SNP è una variazione del materiale genico che interessa un singolo nucleotide, il cui allele interessato risulta presentarsi con una proporzione > 1% nella popolazione generale. Generalmente, tali polimorfismi non hanno effetto sulla salute o sullo sviluppo dell’individuo, ma possono essere coinvolti nella risposta ai farmaci, a fattori ambientali, nei processi del ciclo cellulare (apoptosi) e riparazioni del DNA, tutte funzioni essenziali per la spermatogenesi.
I polimorfismi riportati in letteratura sono numerosissimi (> 200), ma solo per 10 sono state effettuate meta-analisi (CAG-AR, CYP1A1, DAZL, ESR1, ESR2, MTHFR, NOS3, POLG,TP53 e USP26). Queste, tuttavia, presentano spesso dati contrastanti, visto che i polimorfismi sono significativamente influenzati da fattori etnici e geografici delle popolazioni coinvolte nell’analisi.
Tra i più noti polimorfismi che sono stati oggetto di studio, vi è quello riferito all’espansione delle triplette CAG presente sul tratto N–terminale del dominio della trans-attivazione del recettore degli androgeni (CAG-AR) (esone 1). Nella popolazione generale normale il range del numero di triplette varia tra 6 e 39, in relazione alla popolazione studiata: la mediana per gli afro-americani è 19-20, per i bianchi caucasici 21-22, per gli asiatici 22-23, per gli ispanici 23. Valori > 40 sono stati riscontrati in pazienti affetti da s di Kennedy (ipoandrogenismo legato a parziale insensibilità agli androgeni, ipotrofia testicolare e atrofia muscolare spino-bulbare).
La prima ipotesi di relazione inversa tra numero di triplette e attività del recettore, sostenuta da una recente metanalisi (7), sembra superata dall’ipotesi del “range ottimale” di triplette per la popolazione studiata: l’attività trans-attivazionale del recettore degli androgeni è compromessa nei soggetti con un range di triplette minore o maggiore di quello ottimale per quella popolazione (8). Infatti, in un recente studio condotto su una popolazione caucasica costituita da fertili e infertili, i soggetti che presentavano l’espansione delle triplette CAG al di sotto (15-18) o al di sopra (22-28) dell’espansione definita ottimale (19-21), avevano un numero ridotto di spermatozoi con ridotta motilità, un volume testicolare più basso e livelli circolanti più bassi di inibina B, con elevati livelli circolanti di FSH, indicando un AR meno attivo che si associa a importante riduzione della funzione testicolare (9).
DISTURBI DELLA DETERMINAZIONE E DELLA DIFFERENZIAZIONE SESSUALE
Lo sviluppo sessuale dipende da tre importanti processi:
- corredo cromosomico dello zigote;
- differenziazione della gonade in maschile o femminile;
- differenziamento dei genitali interni ed esterni.
Se su quest’ultimo punto grande ruolo hanno gli steroidi sessuali, in particolare il T e il diidro-testosterone (DHT), per la differenziazione delle gonadi grande ruolo hanno alcuni geni presenti sia sui cromosomi sessuali (Y e X) che sugli autosomi. Le alterazioni di questi processi configurano disturbi che rientrano nella categoria dei disturbi della differenziazione sessuale. Anche in questo caso siamo di fronte a delezioni monogeniche (SRY, DAZ1, SOX 9, ecc), a delezioni o inserzioni di pochi nucleotidi o, infine, a mutazioni puntiformi, come per il caso del AR.
Il gene SRY, sito sul braccio corto del cromosoma Y e fisicamente presente vicino alla regione pseudo-autosomica (PRA), a livello della quale avviene durante la meiosi il crossing-over tra il cromosoma X e quello Y, viene espresso nelle creste genitali e in molti tessuti fetali. Le sue mutazioni causano reversione del sesso (sex reversal), che si caratterizza per un fenotipo di tipo femminile incompleto (sterilità) con corredo cromosomico 46 XY. Queste mutazioni, che interessano prevalentemente la regione codificante del gene SRY, sono di solito mutazioni “de novo “ cioè originano durante la gametogenesi paterna oppure durante le prime divisioni post-zigotiche. Tutte le volte che durante la prima divisione meiotica maschile si verifica la traslocazione del gene SRY sul cromosoma X, si determina la sindrome del maschio XX, che si caratterizza per testicoli piccoli e duri, statura normale, azoospermia, e genitali interni ed esterni maschili.
Alcuni geni che codificano per proteine simili al SRY sono i geni della famiglia SOX (17q21). Nel genoma umano ci sono non meno di 20 geni SOX, ma le mutazioni della famiglia SOX-9 causano una rara forma di nanismo (nanismo campomelico) e reversione sessuale.
Il gene DAX1, localizzato sul braccio corto del cromosoma X (Xq21), quando mutato determina ipoplasia congenita delle ghiandole surrenali con ipogonadismo ipogonadotropo, mentre quando è duplicato causa reversione del sesso nei soggetti XY.
Infine, le mutazioni dell'AR nei soggetti con corredo cromosomico maschile (XY) possono causare sia la forma completa dell’insensibilità agli androgeni (s di Morris) che la forma incompleta (s di Reifenstein). Esistono forme minime di resistenza agli androgeni, il cui unico disturbo è l’azoospermia. Ai segni clinici si associano elevati livelli circolanti di T e LH, tanto che il loro prodotto (indice di resistenza) può superare il valore di 300 (10).
GENI COINVOLTI NELL’IPOGONADISMO IPOGONADOTROPO
L’assenza della pubertà con testicoli piccoli e/o criptorchidi, azoospermia con il classico quadro dell’eunucoidismo definiscono l’ipogonadismo ipogonadotropo pre-puberale che, a seconda della presenza o meno di anosmia, viene classificato rispettivamente come sindrome di Kallmann (KaS) o come forma idiopatica. La diagnosi viene confermata dalla presenza di bassi livelli di T (< 200 ng/dL) e di livelli di FSH e LH spesso < 1 U/L, senza il riscontro alla RM di alterazioni importanti a livello dell’ipofisi (per esempio adenomi ipofisari). Questi disturbi si possono presentare sia sporadicamente che in intere famiglie.
La KaS costituisce un 40% dei casi di ipogonadismo centrale idiopatico. La descrizione di gruppi familiari, che includono nella stessa famiglia sia soggetti con la classica KaS (ipogonadismo con anosmia), sia soggetti con anosmia isolata senza ipogonadismo sia pazienti con ipogonadismo centrale idiopatico senza difetti olfattori, sottolinea che questa patologia è molto complessa, con diversa espressività e penetranza spesso influenzata e co-regolata da numerosi fattori ambientali che agiscono sull’espressione fenotipica (epigenetica). L’interazione fra fattori ambientali e genetici è sostenuta dalle seguenti evidenze (11):
- presenza in soggetti sani di rare varianti di geni implicati nel deficit della secrezione del GnRH;
- insorgenza di forme nell’età adulta, dopo che il soggetto ha completato una pubertà normale e avendo una normale vita riproduttiva;
- possibilità di una ripresa spontanea della secrezione del GnRH dopo sospensione della terapia sostitutiva con T.
Per schematizzare possiamo suddividere i geni coinvolti in questa patologia in diverse categorie:
- geni che intervengono nella corretta differenziazione dei neuroni GnRH-secernenti: FGF-R1/FGF-8, NELF e HS6ST1;
- geni che regolano la migrazione di questi neuroni GnRH-secernenti dal placode olfattivo alla sede definitiva, cioè all’area dell’ipotalamo medio-basale: KAL1, PROK2/PROK-R2 e CHD7;
- geni il cui contributo consiste nel regolare il segnale per l’attivazione dei neuroni GnRH-secernenti: TAC3/TAC-R3 (attualmente noto come NKB), NK3, KISS1/KISS1-R (noto in precedenza come GPR54);
- lo stesso gene del GnRH e del suo recettore vengono attualmente reputati come possibili geni candidati.
Nonostante i consistenti progressi della genetica di queste malattie, è opportuno ricordare che, ad oggi, solo nel 30% dei casi di ipogonadismo ipogonadotropo si possono riscontrare difetti genetici, mentre i restanti restano senza causa genetica evidente (12).
CONCLUSIONI
L’infertilità maschile e l’ipogonadismo possono essere causati da fattori genetici che sono diagnosticati grazie alle tecniche di citogenetica o all’analisi molecolare. Le principali indicazioni a eseguire i test genetici in andrologia sono l’azoospermia e l’oligozoospermia severa, mentre la clinica risulta avere un ruolo altrettanto importante per i disturbi della differenziazione sessuale. I test genetici devono essere eseguiti per identificare la diagnosi del difetto, definire il più appropriato approccio terapeutico e valutare il rischio di trasmettere il difetto alla prole.
BIBLIOGRAFIA
- Simoni M, Wieacker P. Cytogenetic and molecular genetic investigation in andrology. Male reproductive health and dysfunction. Springer 3° ed, 2010: 119-248.
- Krausz C, Hoefsloot L, Simoni M, Tuttelmann F; European Academy of Andrology; European Molecular Genetics Quality Network. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: state of the art 2013. Andrology 2013, 2: 5-19.
- Krausz C, Escamilla AR, Chianese C. Genetics of male infertility: from research to clinic. Reproduction 2015, 150: R159-4.
- Clementini E, Palka C, Iezzi I, et al. Prevalence of chromosomal abnormalities in 2078 infertile couples referred for assisted reproductive techniques. Hum Reprod 2005, 20: 437-42.
- Bojesen A, Juul S, Gravholt CH. Prenatal and postnatal prevalence of Klinefelter syndrome: a national registry study. J Clin Endocrinol Metab 2003, 88: 622–6.
- Groth KA, Skakkebaek A, Host C, et al. Klinefelter syndrome - A clinical update. J Clin Endocrinol Metab 2013, 98: 20-30.
- Davis-Dao C, Koh CJ, Hardy BE, et al. Shorter androgen receptor CAG repeat lengths associated with cryptorchidism risk among Hispanic white boys. J Clin Endocrinol Metab 2012, 97: E393–9.
- Nenonen HA, Giwercman A, Hallengren E, Giwercman YL. Non linear association between androgen receptor CAG repeat length and risk of male subfertility—a meta-analysis. Int J Androl 2011, 34: 327–32.
- Giagulli VA, Carbone MD, De Pergola G, et al. Could androgen receptor gene CAG tract polymorphism affect spermatogenesis in men with idiopathic infertility? J Assist Reprod Genet 2014, 31: 689-97.
- Wieaker P, Behne HUM, Nieschlag E. Disorders of androgen target organs. Andrology Male Reproductive Health and Dysfunction, Springer 3° ed, 2010: 323-37.
- Sidhoum VF, Chan YM, Lippincott MF, et al. Reversal and relapse of hypogonadotropic hypogonadism: resilience and fragility of the reproductive neuroendocrine system. J Clin Endocrinol Metab 2014, 99: 861-70.
- Bonomi M,Libri DV, Guizzardi F, et al; Idiopathic Central Hypogonadism Study Group of the Italian Societies of Endocrinology and Pediatric Endocrinology and Diabetes. New understandings of the genetic basis of isolated idiopathic central hypogonadism. Asian J Androl 2012, 14: 49-56.
Esame del liquido seminale
Mauro Schiesaro
Ospedale Classificato Villa Salus, Mestre (VE)
Il liquido seminale è una sospensione, costituita da spermatozoi, immagazzinati nell’epididimo, che al momento dell’eiaculazione vengono miscelati con il prodotto delle ghiandole accessorie, che rappresenta circa il 90% del volume totale. Il numero di spermatozoi riflette la produzione testicolare e la pervietà dei dotti eiaculatori post-testicolari, mentre il volume totale dell’eiaculato riflette l’attività secretoria delle ghiandole accessorie.
I parametri seminali sono riferiti a soggetti di età compresa tra 20 e 40 anni. Infatti, dopo i 40 anni si evidenzia una progressiva alterazione dei parametri seminali, dovuta a quelle modificazioni para-fisiologiche parallele a quelle degli indici anatomo-funzionali di tutto l’organismo. Per motivi diametralmente opposti, ossia per un’ancora difettosa maturazione funzionale del compartimento tubulare e leydigiano, vi può essere una dispermia para-fisiologica nei soggetti con età < 20 anni.
Per l’analisi del liquido seminale risulta di particolare importanza la modalità di raccolta del campione, in quanto, essendo la prima frazione dell’eiaculato la più ricca in spermatozoi, la perdita di questa comporta un risultato più scadente. L’esame fornisce informazioni sullo stato di salute dell’individuo, ma non è in grado di garantire la capacità fecondante degli spermatozoi.
TECNICA DI RACCOLTA
Il campione andrebbe raccolto in una stanza posta vicino al laboratorio, per limitare al minimo le escursioni termiche (ideale la conservazione tra 20 e 37°C) e ottimizzare i tempi di analisi, evitando ritardi.
I campioni devono essere raccolti, tramite masturbazione, dopo un’astinenza sessuale compresa tra 2 e 7 giorni, e posti in un contenitore atossico per gli spermatozoi. In alcuni casi può essere consentita la raccolta del campione al domicilio del paziente, purchè venga poi consegnato entro 60 minuti dall’emissione e purchè, durante il trasporto, sia conservato alla corretta temperatura.
1. PARAMETRI MACROSCOPICI
Fluidificazione
Appena emesso, il liquido seminale appare come un coagulo che, nei 15-60 minuti seguenti, fluidifica divenendo omogeneo e acquoso. Nel caso in cui la fluidificazione non avvenga entro il 60° minuto, va segnalata.
Viscosità
Viene valutata introducendo nel campione una pipetta di vetro e sollevandola; il filamento che si forma non deve superare i 2 cm.
Aspetto
Normalmente omogeneo, grigio opalescente. Se rosso-bruno, può indicare la presenza di emazie; se giallo, ittero o assunzione di farmaci.
| Tabella 1 Aspetto macroscopico del liquido seminale |
||||
| Grigio opalescente, opaco | Trasparente, acquoso | Rosato-rosso | Lattescente, biancastro | Giallastro |
 |
 |
 |
 |
 |
| Normale | Mancata presenza componente cellulare | Presenza emazie | Solo secreto prostatico | Ittero, assunzione vitamine |
Volume
Il metodo migliore consiste nel pre-pesare il contenitore, nel quale il campione viene emesso e successivamente ripesarlo dopo la raccolta. Sottraendo la tara e correggendo il valore ottenuto per la densità, si ottiene il volume. Metodo alternativo, ma più utilizzato, consiste nel trasferire completamente il campione all’interno di una provetta graduata. Il valore minimo considerato normale corrisponde a 1.5 mL. Una riduzione del volume (ipoposia), si osserva nell’ostruzione delle vie eiaculatorie o nell’agenesia dei deferenti.
pH
È generalmente > 7.2. Un pH inferiore, se in associazione con riduzione del volume, può indicare una patologia ostruttiva o agenesia dei deferenti. pH elevati sono invece di scarso rilievo clinico, in quanto questo può aumentare con il tempo (1).
| Tabella 2 Valutazione macroscopica del liquido seminale |
|||
| Parametro | Come si valuta | Normalità | Patologia |
| Volume | In mL | ≥ 2 mL |
|
| pH | Cartine al tornasole con un range molto stretto (fra 6 e 10) | 7.2-7.8 |
|
| Aspetto | Porre la provetta di fronte ad una fonte luminosa | Avorio opalescente |
|
| Fluidificazione | Far percolare il seme da una pipetta lungo le pareti della provetta e osservare il fluido in trasparenza contro una sorgente luminosa | 10-60 minuti | In funzione dei tempi e della completezza viene definita fisiologica, o completa o normale, oppure irregolare, incompleta, finemente irregolare o ritardata se permangono coaguli o filamenti |
| Viscosità | Far gocciolare il liquido seminale da una pipetta | Normale se le gocce si staccano una dopo l’altra |
|
2. PARAMETRI MICROSCOPICI
La seconda fase dell'analisi prevede l'indagine microscopica, per la quale ci si avvale generalmente di un microscopio a contrasto di fase, utilizzando un ingrandimento 100x (che risulta dal prodotto dell'ingrandimento dell'obiettivo, 10x, moltiplicato per l'ingrandimento dell’oculare, 10x). Prima di procedere, il campione di liquido seminale va accuratamente miscelato, in modo da renderlo quanto più omogeneo possibile, e ne va raccolta un'aliquota pari a circa 10 µL, che va posta su di un vetrino e coperta con un copri-oggetti, in modo tale da ottenere un preparato che abbia uno spessore omogeneo, evitando la formazione di bolle d'aria. In tal modo possono successivamente essere evidenziati una serie di parametri.
Aggregazione nemaspermica
Aggregazione non specifica si osserva quando spermatozoi mobili o immobili sono adesi a filamenti di muco, ad altre cellule e vanno comunque segnalate.
Agglutinazioni nemaspermiche
Rappresentate da spermatozoi mobili, che aderiscono tra di loro testa-testa, coda-coda o in forma mista e possono essere distinte in 4 gradi in relazione al numero di spermatozoi coinvolti in ogni agglutinazione:
- isolata: < 10;
- moderata: 10-50;
- ampia: > 50;
- grossolana: tutti gli spermatozoi sono agglutinati.
La presenza di agglutinazioni è suggestiva della presenza di anticorpi anti-spermatozoo, ma non può essere considerata conclusiva per infertilità immunologica.

Figura 1. Agglutinazioni nemaspermiche
Gli anticorpi anti-spermatozoo nel liquido seminale (ASA) appartengono a due classi di immunoglobuline, IgA e IgG, ma solo le IgA rivestono importanza clinica; le IgM, a causa delle dimensioni maggiori, vengono trovati solo raramente. I test di screening per gli ASA sono i seguenti.
Test diretti, ovvero test per la ricerca di anticorpi adesi alla superficie dello spermatozoo: Mixed Antiglobulin Reaction (MAR) test e Immunobead test (IBT) diretto. Nel primo, economico e veloce, si utilizza un anticorpo "ponte ", anti-IgA o anti-IgG, il quale fa in modo che i beads ricoperti di anticorpi vengano in contatto con gli spermatozoi mobili, non lavati e portatori sulla loro superficie di anticorpi. La formazione di agglutinazioni tra spermatozoi mobili e beads indica quindi la presenza di IgG o IgA sullo spermatozoo. Devono essere valutati almeno 200 spermatozoi e si considera positivo il test quando la percentuale di spermatozoi con adesi i beads supera il 50%. Nell'IBT diretto i beads rivestiti di immunoglobuline dirette contro IgA e IgG vengono miscelati con spermatozoi lavati; il loro legame con gli spermatozoi indica quindi la presenza di anticorpi sulla superficie delle cellule nemaspermiche. Anche in questo caso si considera positivo quando la percentuale di spermatozoi supera il 50%.
Test indiretti per la ricerca di anticorpi in liquidi privi di spermatozoi: l'IBT indiretto viene invece utilizzato per identificare gli anticorpi anti-spermatozoo in fluidi privi di spermatozoi inattivati al calore, incubandoli con spermatozoi di donatore privi di anticorpi. Il test viene dato come positivo con percentuali di spermatozoi con beads adesi identiche a quelle dell'IBT diretto (2).


Figura 2 e 3. MAR test
Altre cellule
Nel liquido seminale possono essere presenti altri tipi cellulari diversi dai nemaspermi, ovvero cellule epiteliali di sfaldamento, leucociti e cellule germinali immature; queste ultime 2 classi vengono definite "round cells". Il numero totale dei leucociti, misurato su preparato a fresco, non deve superare il milione/mL.
- Leucociti: prevalentemente polimorfonucleati (PMN), sono presenti nella maggior parte dei liquidi seminali umani. Possono essere differenziati dalle cellule germinali tramite colorazione di Papanicolau, che rende rosati gli spermatidi e bluastri i PMN. Dal punto di vista morfologico, anche la grandezza del nucleo riveste carattere distintivo. Il riconoscimento dei granulociti si basa essenzialmente sul riscontro di attività perossidasica, ottenuta mediante colorazione con Toluidina. Devono essere contate almeno 200 cellule perossidasi-positive, dopo aver diluito 1:10 un quantitativo pari a 0.1 mL di liquido seminale. La concentrazione delle cellule perossidasi-positive è rappresentata dal loro numero (N) diviso per il numero totale di griglie esaminate (n) e il risultato deve poi essere moltiplicato per il fattore di diluizione (es. per diluizione 1/10: Concentrazione = N/n * 0.1 (milione di cellule/mL). Concentrazioni > 1 * 106/mL sono considerate un importante indicatore di flogosi del tratto genitale.

Figura 4. P = Cellula perossidasi positiva; N = Cellula rotonda perossidasi negativa
- Emazie: non dovrebbero essere presenti nell’eiaculato. Se presenti, sono sintomo di microemorragie o patologie flogistiche, molto raramente di patologie prostatiche quali iperplasia o carcinoma della prostata.
- Elementi della linea germinativa: rappresentati prevalentemente da spermatociti e spermatidi, più raramente spermatogoni.
- Cellule epiteliali di sfaldamento: derivano dall'apparato genito-urinario e possono presentarsi isolate o in piccoli ammassi. Vengono indicate come rare, presenti o numerose e solo in questo caso possono essere segno di esfoliazione patologica di tipo infiammatorio.
- Zone di spermio-agglutinazione: possono essere costituite da aggregati cellulari misti (spermatozoi e leucociti o altre cellule) o da soli spermatozoi. Vengono valutate a fresco ed indicate come rare, presenti o numerose.
- Corpuscoli prostatici: sono rappresentati da materiale non cellulare proveniente dalla prostata, quasi mai correlati con patologie prostatiche specifiche.
Concentrazione nemaspermica
Un'aliquota di liquido seminale fluidificato, non diluito, viene valutato dopo essere stato posto su di un vetrino porta-oggetti, allo scopo di poter determinare la diluizione più adatta secondo lo schema seguente:
| Tabella 3 Modalità di trattamento del campione per la valutazione della concentrazione nemaspermica |
||||||
| Spermatozoi per campo | Diluizione necessaria | µL di liquido seminale | µL di fissativo | Camera di conta | Aree da valutare | |
| a 400x | a 200x | |||||
| > 101 | > 404 | 1:20 (1+19) | 50 | 950 | Neubauer modificata | Griglie 5,4,6 |
| 16-100 | 64-400 | 1:5 (1+4) | 50 | 200 | ||
| 2-15 | 8-60 | 1:2 (1+1) | 50 | 50 | ||
| < 2 | < 8 | 1:2 (1+1) | 50 | 50 | Neubauer modificata o grande volume | Tutte le 9 griglie o intero vetrino |

Figura 5. Camera di Neubauer

Figura 6. Emocitometro di Neubauer modificato
La concentrazione degli spermatozoi si calcola sulla base della diluizione utilizzata tramite l'ausilio dell'apposita formula:
se diluizione 1:5 (1+4), C = N/n * 0.25
dove C = concentrazione spermatozoi milioni/mL; N = numero totale di spermatozoi contati; n = numero di righe analizzate.
Il coefficiente di moltiplicazione equivale a 1 per la diluizione 1 : 20 e a 2.5 per diluizione 1 : 50.
Il numero totale degli spermatozoi per eiaculato e la concentrazione degli spermatozoi correlano con la percentuale di gravidanze ma anche con il tempo di attesa delle gravidanze stesse (3) e rivestono un ruolo predittivo del concepimento. La concentrazione di spermatozoi nel liquido seminale è influenzata dal volume delle secrezioni prostatiche e delle vescicole seminali; ciononostante, si correla comunque con la percentuale di fecondazione e di gravidanza. Il numero di spermatozoi nell'eiaculato, invece, correla anche con il volume testicolare. I termini "concentrazione nemaspermica" e "numero totale di spermatozoi" non sono sinonimi, in quanto il primo è indicativo del numero di spermatozoi per unità di volume, mentre il secondo si ottiene moltiplicando il dato relativo alla concentrazione per il volume totale dell'eiaculato. In condizioni normali vi è una notevole oscillazione del numero degli spermatozoi: la concentrazione minima è stabilita a 15 x 106/mL; per valori inferiori si ha una condizione di oligozoospermia. La concentrazione totale per eiaculato (ottenuta moltiplicando la concentrazione/mL per il volume) deve essere ≥ 39 x 106/mL. L’assenza di spermatozoi nell’eiaculato è definita azoospermia. In questi casi, il campione può essere sottoposto a centrifugazione sempre per la ricerca di cellule nemaspermiche: 1 mL di liquido seminale verrà quindi centrifugato a 3000 g per 15 minuti. Una volta isolato il pellet, questo va risospeso in 50 microlitri di plasma seminale, prelevando circa 10 microlitri della nuova sospensione ed apponendolo su un vetrino per l'analisi: la presenza di rari spermatozoi nel pellet è definita criptozoospermia.
| Tabella 4 Valori medi dei parametri seminali relativi al 5°, 50° e 95° centile (WHO 2010) |
|||
| PARAMETRI | Centili | ||
| 5° | 50° | 95° | |
| Volume (mL) | 1.5 | 3.7 | 6.8 |
| Spermatozoi totali eiaculato (x 106) | 39 | 255 | 802 |
| Concentrazione spermatozoi (x 106/mL) | 15 | 73 | 213 |
| Motilità totale (%) [PR + NP] | 40 | 61 | 78 |
| Motilità progressiva (%) [PR] | 32 | 55 | 72 |
| Motilità non progressiva (%) [NP] | 1 | 5 | 18 |
| Forme tipiche (%) | 4 | 15 | 44 |
Motilità spermatica
Deve essere analizzata, sempre su campione a fresco, entro un'ora dall'emissione, preferibilmente dopo 30 minuti. Il movimento dello spermatozoo è di tipo flagellare: consiste in una serie di onde che si originano lungo la base del flagello e si propagano lungo quest’ultimo, per cui la testa viene spinta in avanti passivamente, con oscillazioni ritmiche di ampiezza regolare. È necessario valutare non soltanto la percentuale di forme mobili, ma anche il tipo di motilità (motilità ottimale: progressiva rettilinea con una velocità media > 25 μm/sec). Vanno valutati, tramite microscopio a contrasto di fase a 200x o 400x, 200 spermatozoi in ogni preparato, al fine di ottenere un’adeguata percentuale delle varie forme di motilità. Vanno contati solamente gli spermatozoi intatti e non, ad esempio, le code mobili senza la testa. La motilità di ogni spermatozoo viene classificata nel modo seguente:
- progressiva (PR): spermatozoi che si muovono attivamente e rapidamente, sia con movimento rettilineo sia con movimento circolare ampio, indipendentemente dalla velocità;
- non progressiva (NP): comprende tutte le altre tipologie di motilità, che non danno progressione nello spazio, come ad esempio movimento in piccoli circoli, solo movimento flagellare senza progressione, solo spostamento laterale della testa;
- immobilità: nessun movimento.
Il limite inferiore di riferimento per la motilità totale (PR+NP) è pari al 40%, mentre la quota di spermatozoi con sola motilità progressiva (PR) non deve essere < 32% (1). Risulta anche importante, dal punto di vista biologico, il calcolo del numero totale degli spermatozoi con motilità progressiva. È necessario valutare non soltanto la percentuale di forme mobili, ma anche il tipo di motilità (motilità ottimale: progressiva rettilinea con una velocità media > 25 μm/sec).
Il grado di motilità nemaspermica è correlabile con il tasso di gravidanze (4). È abbastanza comune la sovrastima della motilità degli spermatozoi; ciò può essere evitato utilizzando un reticolo oculare, invertendo l'ordine dell'analisi, ovvero contando prima gli spermatozoi immobili e quelli non progressivi e per ultimi quelli mobili, al contrario di quanto dovrebbe essere fatto normalmente.
Il metodo computerizzato è rappresentato dal Computer-Aided Sperm Analysis (CASA) System. Si tratta di un sistema video-micrografico automatizzato, in grado di valutare la motilità, la velocità e la linearità di un singolo spermatozoo o di una popolazione nemaspermica, impiegando un software di elaborazione di immagini che trasforma la visione microscopica in immagine digitalizzata, analizzabile dal programma. È stato inoltre messo a punto un ulteriore approccio per lo studio della cinetica nemaspermica, il Superimposed Image Analysis System (SIAS), basato su un software in grado di acquisire e memorizzare immagini sequenziali (fino a 21 frames/sec) e di sovrapporle in un’unica immagine finale con effetto-movimento degli spermatozoi mobili (5-6) .

Figura 7. Superimposed Image Analysis System (SIAS): A) modalità single frame; B) modalità superimposed a 21 frames/sec. Freccia gialla: esempio di spermatozoo mobile; freccia verde: esempio di spermatozoo immobile (grazie alla cortesia di Fernando Mazzilli, che ha prodotto e pubblicato i dati originali: Fertil Steril 1995, 64: 653-6).
Alcuni dei parametri relativi alla motilità sembrerebbero correlare con le percentuali di fecondazione e anche con il tempo di attesa per il concepimento.
Le informazioni ottenibili con i metodi CASA sono le seguenti:
- velocità curvilinea (VCL): espressa in µm/sec, rappresenta la velocità media della testa dello spermatozoo lungo la sua traiettoria curvilineare;
- velocità rettilinea (VSL): velocità media dello spermatozoo lungo la linea retta che congiunge il punto di partenza con il punto di arrivo;
- spostamento laterale della testa (ALH): grandezza dello spostamento laterale della testa di uno spermatozoo lungo la sua traiettoria, espresso in µm;
- linearità (LIN): VSL/VCL.

Figura 8.
Morfologia nemaspermica
La valutazione della morfologia nemaspermica consente di differenziare le forme tipiche da quelle atipiche. La valutazione si ottiene dopo aver strisciato e colorato con Papanicolau il campione su vetrino e dopo aver contato almeno 200 spermatozoi con l’elaborazione di uno spermiocitogramma.
- La testa deve essere ovale, liscia e con contorni regolari; deve possedere una regione acrosomiale ben definita, che occupi un volume pari a circa il 40-70% della testa.
- Il tratto intermedio deve essere sottile, regolare e lungo all'incirca come la testa; il suo asse maggiore deve essere in linea con l'asse maggiore della testa e il residuo citoplasmatico viene considerato anomalo quando eccede un terzo delle dimensioni della testa dello spermatozoo.
- La coda, più sottile rispetto al tratto intermedio, deve possedere un calibro uniforme lungo tutta la sua lunghezza, pari a circa 45 micron, ovvero 10 volte quella della testa.
Le atipie possono interessare la testa, il tratto intermedio e il collo e la coda.
Le forme tipiche devono essere ≥ 4%; per percentuali di atipie > 96% si ha una condizione di teratozoospermia (1).

Figura 9. Maturazione progressiva dello spermatozoo normale


Figura 10. Spermatozoi con normale morfologia

Figura 11. Schema delle anomalie morfologiche dello spermatozoo

Figura 12. Anomalie morfologiche spermatiche
Vitalità nemaspermica
Viene valutata tramite l'integrità della membrana cellulare. Può essere determinata su tutti i campioni, ma riveste particolare importanza in quelli con motilità progressiva < 40%. La percentuale di cellule morte non deve superare quella di cellule immobili e quindi questo test può essere anche considerato come controllo della valutazione della motilità. La vitalità dovrebbe essere valutata entro i 30 minuti dalla fluidificazione del campione, per limitare gli effetti negativi sulla vitalità derivanti, ad esempio, dalla disidratazione o dall'esposizione a cambiamenti di temperatura. La percentuale di spermatozoi vitali si valuta tramite l'identificazione delle cellule con membrana cellulare intatta, tramite inclusione di colorante o rigonfiamento ipo-osmotico.
- L'inclusione del colorante si basa sul fatto che le cellule con membrana danneggiata, quali quelle morte, consentono la penetrazione di coloranti che normalmente non vengono inclusi. Il test all'eosina si effettua miscelando su un vetrino 5 µL di liquido seminale con eguale quantità di soluzione già preparata di eosina. Dopo accurata miscelazione con la punta di una pipetta e dopo copertura del vetrino con copri-oggetto, si conta su 200 spermatozoi il numero di cellule colorate (in rosso o rosa scuro, cioè morte) e non colorate (vitali). Tutta la testa deve essere colorata, mentre se la colorazione riguarda solamente una zona dello spermatozoo, ciò non deve essere considerato come segno di morte cellulare. Il limite inferiore di riferimento per la vitalità è pari al 58%.
- Il test del rigonfiamento ipo-osmotico (hypoosmotic swelling test) si basa sul principio che solo le cellule con membrana cellulare competente, quindi integra, ovvero le cellule vitali, sono in grado di rigonfiarsi una volte poste all'interno di una soluzione ipotonica. Una volta immersi in un mezzo ipo-osmotico, gli spermatozoi con membrana cellulare integra si rigonfiano nel giro di cinque minuti e la forma della coda si stabilizza in 30 minuti. 100 µL di liquido seminale vengono aggiunti ad 1 mL di soluzione ipo-osmotica, preparata con citrato di Na, fruttosio e acqua distillata, incubati per 5 e 30 minuti, per poi essere posti su un vetrino. Successivamente si provvederà alla valutazione di 200 cellule, delle quali dovrà essere valutata la presenza di rigonfiamenti del flagello. Il limite inferiore di normalità per la vitalità nello swelling test è pari al 58% (1).

Figura 13. Rigonfiamento osmotico

Figura 14. La freccia verde indica uno spermatozoo vitale e quella rossa uno morto
3. INTERAZIONI TRA SPERMATOZOI E MUCO CERVICALE
Test in vivo: Post-coital test (PCT)
Utile per la determinazione del numero di spermatozoi attivi nel muco cervicale e per valutarne il comportamento e la sopravvivenza alcune ore dopo il coito. Deve essere eseguito appena prima dell'ovulazione.
Con una siringa da insulina si aspira la maggiore quantità possibile di liquido seminale dal fornice vaginale posteriore e con un'altra siringa si aspira muco cervicale dal canale endo-cervicale. Il campione viene poi posto su vetrino ed analizzato a 400x. Vanno valutate sia la concentrazione degli spermatozoi che la loro motilità, indicandola come:
- rapidamente progressiva (RP);
- non progressiva (NP);
- assente (IM).
L'indicatore più accurato di adeguata funzione cervicale è rappresentato dal riscontro di almeno 1 spermatozoo RP. La loro presenza esclude cause cervicali di infertilità ma anche cause immunologiche; quando invece gli spermatozoi NP mostrano motilità agitatoria, può essere ipotizzata la presenza di anticorpi anti-spermatozoo nel muco cervicale o sugli spermatozoi.
Il test viene considerato negativo se non vi sono spermatozoi nel muco, mentre l'identificazione di spermatozoi nel campione proveniente dal fornice vaginale posteriore attesta il fatto che sia avvenuta un'eiaculazione endo-vaginale.
Test in vitro: test del capillare
Misura la capacità dello spermatozoo di penetrare una colonna di muco cervicale posta all'interno di un capillare. Dopo 2 ore di incubazione di 100 μL di liquido seminale con l'estremità aperta di un capillare contenente muco cervicale, si valutano al microscopio i seguenti parametri:
- distanza di migrazione: intesa come il punto più lontano raggiunto dall'ultimo spermatozoo all'interno del capillare durante la migrazione verso l'estremità chiusa dello stesso;
- densità di penetrazione: intesa come numero medio di spermatozoi per campo visivo osservabili a 100x alla distanza di 1 e 4.5 cm dall'orifizio di ingresso del capillare (1).

Figura 15. Test del capillare
| Tabella 5 Terminologia (in relazione al 5° centile) e diagnostica seminologica |
|||
| Parametri | Definizioni | Indicazioni diagnostiche | |
| Normospermia: normalità di tutti i parametri seminali | |||
| Aspetto | Acquoso | Scarsa componente cellulare | |
| Torbido | Flogosi | ||
| Torbido ematico | Emospermia | ||
| Volume | Aspermia (assenza di eiaculato) | Ipogonadismo, fattori psicogeni, eiaculazione retrograda, ostruzione del tratto terminale delle vie seminali | |
| Ipospermia o ipoposia (volume ridotto) | Ostruzione dei dotti eiaculatori (con pH acido per la pressoché esclusiva componente prostatica), ipogonadismo | ||
| Iperspermia o polispermia (> 6 mL) | Flogosi delle ghiandole accessorie del tratto genitale (MAGI) | ||
| pH | Acido | Ostruzione dei dotti eiaculatori (con azoospermia e ipoposia) | |
| Viscosità | Aumentata | MAGI; espressione minima di Fibrosi Cistica | |
| Concentrazione nemaspermica | Normozoospermia (≥ 15 x 106/mL): normale concentrazione nemaspermica | ||
| Oligozoospermia (< 15 x 106/mL) | Di grado lieve-medio (5-15 x 106/mL): lifestyle (fumo, alcol, distress), varicocele, MAGI, criptorchidismo, disordini endocrini e metabolici (diabete mellito), stress ossidativo, presenza di anticorpi anti-spermatozoo Di grado severo (< 5 x 106/mL): oltre alle precedenti, è dovuta a anomalie genetiche, esiti di orchiti, traumi, chemio/radioterapia, ecc |
||
| Criptozoospermia (presenza di spermatozoi solo dopo centrifugazione) | Come nell’oligozoospermia di grado elevato | ||
| Azoospermia (assenza di spermatozoi nell’eiaculato) | Secretoria | Ipogonadismo ipogonadotropo, ipotalamico o ipofisario (con LH e FSH ridotti e ipotestosteronemia): s. di Kallmann, ecc Danno tubulare con FSH elevato e normali LH e testosterone: esiti di traumi, neoplasie, chemio/radioterapie, orchiti, ecc. Ipogonadismo ipergonadotropo (con ipotestosteronemia e con LH e FSH elevati): oltre alle precedenti da danno tubulare: disordini congeniti con o senza alterazione del cariotipo, quali s. di Klinefelter, s. a sole cellule del Sertoli, arresti maturativi, ecc. Insensibilità recettoriale agli androgeni (con testosterone e gonadotropine elevati) |
|
| Escretoria (o ostruttiva) | Ostruzioni delle vie seminali di natura congenita (fibrosi cistica) o acquisita (esiti di infezioni retrograde); il profilo ormonale è nei limiti | ||
| Motilità | Normocinesia (PR ≥ 32% o PR + NP ≥ 40%): normale motilità nemaspermica | ||
| Ipocinesia/discinesia (o astenozoospermia)(PR < 32% o PR + NP < 40%) | Di grado lieve-medio (PR 5-32%): come nell’oligozoospermia di grado lieve-medio Di grado severo (< 5%): come nell’oligozoospermia di grado severo |
||
| Acinesia (assenza di motilità) | Come nell’ipocinesia/discinesia di grado elevato; inoltre presenza di spermatozoi a code mozze o sindrome delle ciglia immobili nell’ambito della s. di Kartagener | ||
| Morfologia | Teratozoospermia (atipie > 96%) | Come nell’oligozoospermia e nell’astenozoospermia di grado severo; inoltre, nelle forme genetiche monosomiche (teste a palla o round head sperm; spermatozoi a code mozze) | |
| Oligoastenoteratozoospermia: alterazione del numero, della motilità e della morfologia nemaspermica | |||
| Necrozoospermia | < 58% di vitalità nemaspermica | ||
| Altro | Globuli bianchi aumentati (> 1 x 106/mL) |
Flogosi/infezioni | |
| Zone di spermio-agglutinazione | Flogosi, presenza di anticorpi anti-spermatozoo | ||
4. BIOCHIMICA SEMINALE (grazie alla collaborazione di Fernando Mazzilli)
Il plasma seminale rappresenta il prodotto di secrezione del testicolo (10-15% dell’eiaculato), delle vescicole seminali (65-70%) e della prostata (20-25%). Alcune sostanze sono filtrate dal sangue a vari livelli del tratto genitale; altre sono invece sintetizzate o filtrate selettivamente in un determinato distretto e quindi rappresentano degli indici specifici per ciascun distretto. Pertanto, le determinazioni dell’alfa-glicosidasi e della L-Carnitina (indici epididimari), del fruttosio (indice vescicolare) e dell’acido citrico (indice prostatico) possono essere utilizzate per la diagnosi differenziale tra azoospermie secretorie ed escretorie e della sede dell’eventuale ostruzione (1).
BIBLIOGRAFIA
- WHO laboratory manual for the examination and processing of human seme. 5th Edition 2010.
- Rose NR, et al. Techniques for detection of iso- and auto-antibodies to human spermatozoa. Clin Exper Immunol 1976, 23: 175-99.
- Jouannet P, et al. Male factors and the likelihood of pregnancy in infertile couples. I. Study of sperm characteristics. Int J Androl 1988, 11: 379-94.
- Zinaman MJ, et al. Semen quality and human fertility: a prospective study with healthy couples. J Androl 2000, 21: 145-53.
- Zinaman MJ, et al. Evaluation of computer assisted semen analysis (CASA) with IDENT stain to determine sperm concentration. J Androl 1996, 17: 288-92.
- European Society for Human Reproduction and Embryology. Guidelines on the application of CASA technology in the analysis of spermatozoa. Hum Reprod 1998, 13: 142-5.
Ecografia dell'apparato genitale maschile
Carlotta Pozza1, Mauro Giovanni Schiesaro2, Agostino Specchio3
1Dipartimento di Fisiopatologia Medica, Università Sapienza di Roma
2UO Medicina Interna, Ospedale classificato Villa Salus, Mestre (VE)
3ASL-FG, Distretto S.S. Cerignola (FG)
(aggiornato al 30 agosto 2021)
TESTICOLO
Premessa
L’ecografia testicolare è ormai considerata come un esame di primo livello per lo studio delle patologie della sfera genitale maschile, al pari di anamnesi, esame obiettivo ed esami di laboratorio. Per l'endocrinologo riuscire ad appropriarsi di queste competenze significa avere la possibilità di gestire in autonomia il paziente con problematiche andrologiche o di fertilità, senza doversi appoggiare alla diagnostica per immagini fatta da altre figure professionali che, prive del background dell'andrologo-endocrinologo, potrebbero sottovalutare alcuni aspetti ecografici di fondamentale importanza per la valutazione del paziente, finendo per fuorviare o rendere difficoltosa l'integrazione delle informazioni fornite da anamnesi, esame obiettivo, laboratorio o imaging stesso.
Tra le tecniche di imaging l'ecografia, corredata dell'eco-color-Doppler (ECD), è la più semplice da eseguire, la più versatile, la meno costosa e la più facilmente ripetibile e priva di effetti collaterali. Nella diagnostica delle patologie scrotali rappresenta il gold standard nella valutazione della struttura testicolare, in riferimento alla sua capacità riproduttiva, nella ricerca della patologia oncologica e di quella infiammatoria; l'ecografia può fornire informazioni sulle dimensioni e caratteristiche delle vie seminali intra-scrotali e, corredata dell'ecografia trans-rettale, anche delle vie seminali nel loro decorso intra-addominale, fornendo utilissime informazioni anche nella diagnosi delle forme di infertilità conseguenti a patologie ostruttive o genetiche/malformative. Non ultimo, si pensi a tutte le informazioni che l'eco-Doppler scrotale può fornire sulla vascolarizzazione degli organi scrotali, permettendo la diagnosi di orchi-epididimite, torsione testicolare con ischemia dell'organo, o una corretta valutazione del grado di varicocele.
Metodologia
L’esame deve prevedere la valutazione degli involucri scrotali, dei testicoli, degli epididimi e dei dotti deferenti.
Per lo studio dei testicoli, che abitualmente sono collocati nel sacco scrotale ma che a volte vanno ricercati al di fuori di esso, come nelle condizioni di criptorchidismo, in cui rimangono confinati nel canale inguinale, o nelle forme di ectopia, in cui possono variamente collocarsi anche fuori dal canale inguinale, viene utilizzata una sonda da 7-15 MHz. Il paziente deve essere in posizione supina, con il pene appoggiato sull’addome e l'ambiente deve essere confortevole, ben riscaldato se in stagione invernale, per evitare che il freddo o il disagio facciano risalire i testicoli verso l'addome, peggiorandone la visualizzazione. La cute va abbondantemente cosparsa di gel, per eliminare quanto più possibile l'aria che si interpone tra la cute corrugata dello scroto e la sonda (a tal fine, se possibile, chiedere al paziente di effettuare la rasatura dei peli pubici e scrotali che possono ridurre non poco la qualità delle immagini, in quanto non permettono una uniforme stratificazione del gel). I testicoli vengono analizzati con scansioni longitudinali, trasversali e oblique. Durante l'esecuzione dell'esame, tuttavia, non bisogna focalizzarsi solo sulle scansioni classiche, ma è necessario ruotare con la sonda a 360° intorno allo scroto, sia per osservare al meglio tutto il testicolo da diverse prospettive, sia per visualizzare l'epididimo che spesso non ha un decorso lineare lungo il margine posteriore del testicolo. L’indagine va completata anche con l’utilizzo del modulo color-Doppler. Le informazioni desumibili dall’ecografia testicolare riguardano sede, forma, volume, ecogenicità, ecostruttura e vascolarizzazione.
Sede
La sede tipica è intra-scrotale. Il polo superiore è individuabile dalla sovrastante presenza del caput dell'epididimo; sotto il polo inferiore si individua il più delle volte la coda e il passaggio ad ansa epididimo-deferenziale. In condizioni normali il testicolo è mantenuto all’interno della borsa scrotale dalla presenza di legamenti la cui lassità può determinare una mobilità più o meno marcata, fino alla predisposizione dell'organo alla rotazione patologica sul suo asse lungo. In alcuni casi il testicolo può apparire orizzontalizzato (trasverso-posto) o in posizione capovolta (inverso-posto). Tale posizionamento può essere permanente o solo temporaneo, data la grande mobilità dell'organo appeso al funicolo spermatico e ancorato alla superficie interna del sacco scrotale dal legamento scrotale inferiore (fig 1 e clip 1), residuo del gubernaculum testis, organo che nella fase embrionale guida la discesa del testicolo dall'addome alla sua sede scrotale definitiva sotto l'influenza del testosterone e di altri fattori.
Figura 1. Legamento scrotale, ben evidenziabile soprattutto se in presenza di modesta falda di idrocele, non patologica se piccola
Clip 1. Legamento scrotale inferiore
La mobilità del testicolo è condizionata anche dalla presenza del muscolo cremastere, ramuscolo proveniente dai muscoli della parete addominale, non visibile all'esame ecografico, che con le sue contrazioni solleva e avvicina il testicolo alla parete addominale in caso di freddo, eventi emotivi, ecc. Il testicolo viene definito:
- ipermobile, se prontamente ridiscende in basso dopo movimento determinato dall’iperreflessia del cremastere;
- retrattile se risale e rimane in canale inguinale;
- ritenuto se non è in grado di scendere nel sacco scrotale.
Forma
La forma tipica del testicolo è quella di un ellissoide, ma non mancano le varianti in cui sussiste poca differenza tra la lunghezza dell'asse lungo e di quello corto, senza che tale conformazione configuri una condizione di anormalità.
Volume
La misurazione del volume testicolare è storicamente eseguita con l'orchidometro di Prader (fig 2), che è costruito a forma di rosario, con i grani costituiti da ellissoidi di forma via via crescente e di volume riportato su ognuno di essi, i quali durante la visita medica vanno comparati con le dimensioni del testicolo del paziente sotto esame.
Figura 2. Orchidometro di Prader
La misurazione eseguita in tal modo è sicuramente efficace e clinicamente utile per ottenere una misurazione attendibile dell'organo e correlabile alla sua funzionalità. È tuttavia meno accurata della misurazione ottenuta con l'ecografia, in quanto con l’orchidometro si includono nel volume oltre al testicolo anche l'epididimo e i tegumenti, sovra-stimando le reali dimensioni del testicolo (circa 3 mL in più delle reali). Inoltre, alcune condizioni, come la presenza di idrocele o di cisti dell'epididimo o del funicolo, o aumenti di dimensione dell'epididimo per fatti ostruttivi, potrebbero farne sovrastimare ulteriormente il volume rispetto a quello reale. Nel criptorchidismo, ovviamente, l'unico modo per misurare il volume del testicolo è quello ecografico.
Le normali dimensioni dei testicoli sono di 35-50 mm in lunghezza, 25-35 mm in larghezza e 15-25 mm in spessore. Il volume viene calcolato ecograficamente in modo molto semplice e ripetibile con la formula dell’ellissoide (lunghezza x larghezza x spessore x 0.52), perchè il software della macchina ecografica lo calcola automaticamente quando vengono inseriti i tre diametri (fig 3). Il testicolo viene considerato di dimensioni:
- normali quando presenta un volume compreso tra 12 e 25 mL;
- ai limiti inferiori della norma con volume compreso tra 10 e 12 mL;
- ipotrofico se il volume è < 10 mL.
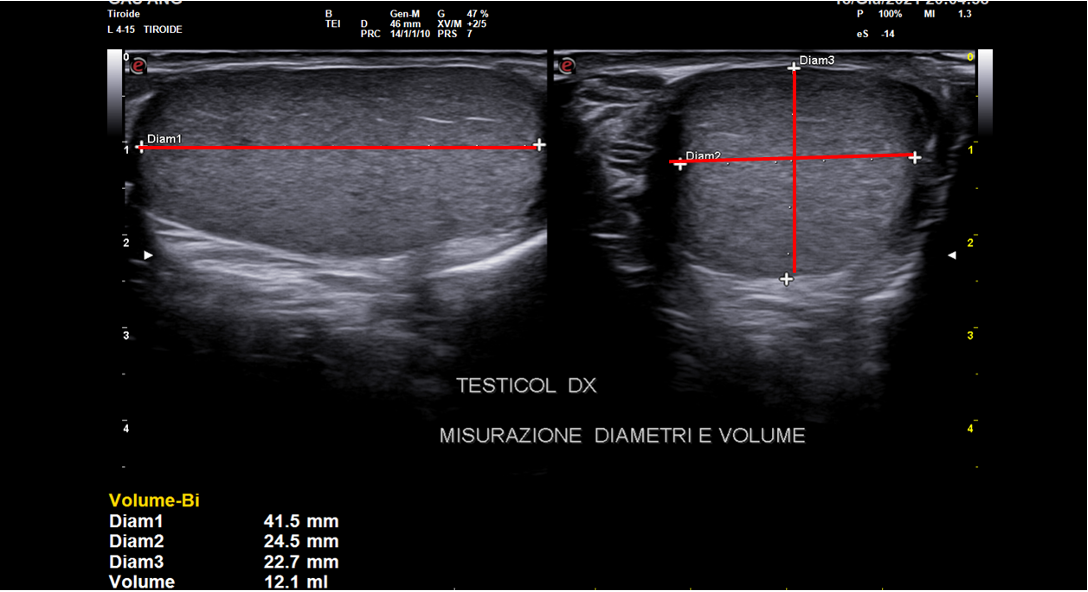
Figura 3. Misurazione del volume testicolare con la formula dell'ellissoide
Con il passare degli anni la tendenza è quella di rilevare nelle nuove generazioni volumi testicolari (e dimensioni peniene) compresi nella parte bassa del range di normalità, fatto da molti attribuito alle conseguenze dell'inquinamento ambientale sullo sviluppo degli organi genitali.
Utilizzando questa formula, il volume testicolare medio in soggetti adulti e sani è risultato pari a 14 mL secondo studi danesi (1), tedeschi (2) e italiani (3). Altri studi hanno dimostrato che il testicolo destro può avere un volume maggiore rispetto al controlaterale, mentre nei soggetti infertili varia da 10 a 13 ± 5 mL (4). Pochi studi hanno valutato ecograficamente il volume testicolare nell'infanzia e nell'adolescenza (5,6), mentre è noto che tale volume inizia a decrescere dalla 6°-7° decade di vita (7).
Come per le misurazioni volumetriche con l’orchidometro di Prader, anche il volume testicolare stimato ecograficamente correla positivamente con il numero totale dei nemaspermi (8) e con la loro morfologia, oltre che con i parametri ormonali.
Ecogenicità ed eco-riflettenza
Normalmente il testicolo è caratterizzato da echi a riflettenza medio-alta, che possono ricordare l'ecogenicità della tiroide (9) (fig 4 e clip 2-3).
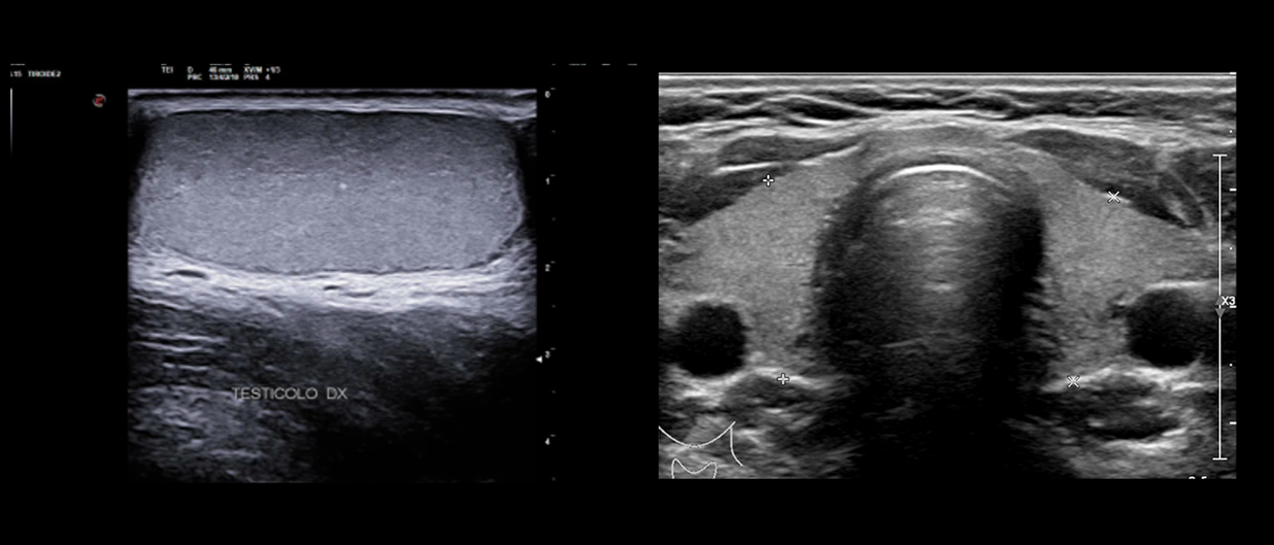
Figura 4. L'ecogenicità del testicolo adulto (a sin) è comparabile a quella della tiroide normale (a dx)
Clip 2. Testicolo normale in B-mode
Clip 3. Testicolo normale in Color
Il testicolo è circondato dall’albuginea che risulta iperecogena. Dall’albuginea prendono origine setti iperecogeni, che confluiscono nel mediastino testicolare, punto di confluenza dei setti con cui l'albuginea divide i lobuli del testicolo e dei tubuli retti in cui confluiscono i tubuli seminiferi di ciascun lobulo. All'indagine ecografica (fig 5) il mediastino testicolare appare come una struttura eccentrica spessa e lineare, iperecogena. Può andare incontro a dilatazione, presentandosi ecograficamente con aspetto a nido d'ape per presenza di micro-areole ipo-anecogene, fenomeno normale con l'invecchiamento ma patologico nel giovane adulto, in quanto probabile espressione di fenomeni ostruttivi a valle (fig 6 e clip 4).
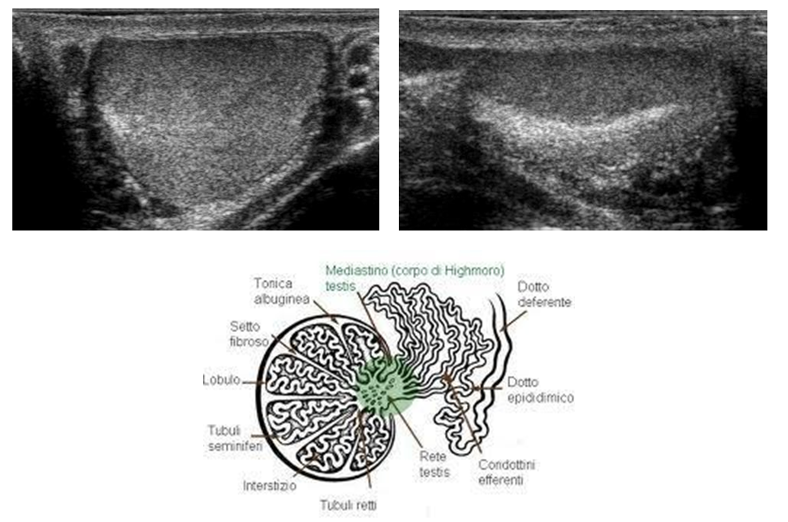
Figura 5. Mediastinum testis
Figura 6. Dilatazione della rete testis
Clip 4. Rete testis
L’ecogenicità risulta ridotta nelle fasi pre-puberali, in quanto dipendente dalla maturazione dei tubuli seminiferi che si dilatano e riempiono di cellule germinali, e si incrementa con la progressione puberale, perché i tubuli seminiferi maturano e si riempiono di cellule della spermatogenesi (10) (fig 7).
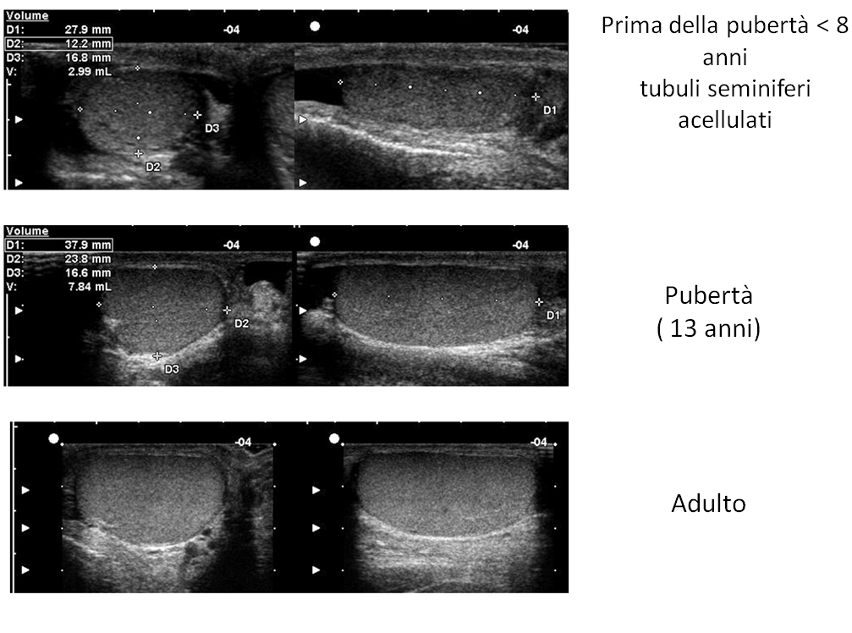
Figura 7
L'ipoecogenicità è tipica del testicolo pre-pubere per la scarsa rappresentazione della quota cellulare intra-tubulare; successivamente, con l'accrescimento e la maturazione tubulare, l’ecogenicità si avvicina sempre più a quella normale del testicolo dell'adulto (fig 8).
Figura 8
La disomogeneità ecostrutturale può suggerire disfunzione testicolare e alterazioni della morfologia nemaspermica, nonostante sia un parametro gravato da scarsa specificità, in quanto osservabile in numerose condizioni patologiche. Un incremento della disomogeneità è osservabile con l'avanzare dell'età e non risulta quindi indicatore di malattia (11). La disomogeneità testicolare è una condizione associata al criptorchidismo, al tumore del testicolo, a varie noxae patogene che possono danneggiare l'organo, come quelle correlate all'ipogonadismo, all'ischemia, alla flogosi, ai traumi, all'esposizione ad agenti chimici, all'abuso di alcool, alla radioterapia, a conseguenze di fenomeni disgenetici, come la sindrome di Klinefelter, e infine alle condizioni correlate alla sindrome metabolica (obesità, diabete, grasso viscerale, dislipidemie, ipertensione, ecc) (12-14) (fig 9). Il riscontro di severa disomogeneità impone un attento follow-up, in quanto può essere espressione di condizioni patogene predisponenti alla patologia neoplastica maligna, soprattutto nei soggetti con storia di criptorchidismo (1) o in associazione con la presenza di micro-calcificazioni (12) (vedi oltre).
Figura 9. Testicolo con ecostruttura disomogenea
Vascolarizzazione
La vascolarizzazione del testicolo è principalmente assicurata dall'arteria spermatica, ad origine diretta dall'aorta, repertabile all'ECD all'interno del funicolo spermatico. L'arteria testicolare attraversa la tonaca albuginea a livello del polo inferiore del testicolo e dà origine all'arteria capsulare, da cui si dipartono le arterie centripete che, seguendo i setti testicolari, raggiungono l'ilo e danno origine alle arterie centrifughe. Nel 50% dei pazienti è inoltre presente, di solito al terzo superiore, l'arteria trans-testicolare (fig 10). Alla valutazione ECD sono ben visibili l'arteria testicolare, la capsulare e la trans-testicolare, mentre le arterie centripete e centrifughe appaiono come spot colorati omogeneamente, distribuiti all'interno del parenchima testicolare (clip 5-7).
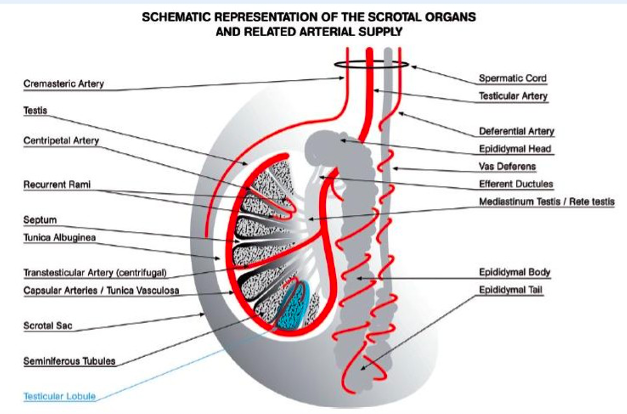
Figura 10. Vascolarizzazione del testicolo (11)
Clip 5. Funicolo arteria spermatica
Clip 6. Arteria capsulare
Clip 7. Arteria trans-testicolare
In condizioni di flogosi testicolare si osserverà un incremento della vascolarizzazione dell'organo, mentre nel caso di lesioni solide l'incremento della vascolarizzazione si concentra all'interno e/o perifericamente alla lesione stessa. Al contrario, in occasione di eventi ischemici, come l'infarto del testicolo, la torsione totale del funicolo o gravi testicolopatie, il parenchima testicolare potrà apparire anche completamente avascolare.
Il drenaggio venoso dello scroto è assicurato dalle vene spermatiche interne ed esterne; le vene del testicolo e della porzione anteriore dell'epididimo confluiscono a formare il plesso spermatico anteriore e danno origine alla vena spermatica interna, che a destra si scarica nella vena cava inferiore e a sinistra direttamente nella vena renale, ad angolo retto. Il drenaggio venoso del corpo e della coda dell'epididimo costituiscono il plesso spermatico posteriore che dà origine alla vena spermatica esterna.
Di norma, all'indagine ECD le vene non sono visibili, divenendolo invece quando si dilatano patologicamente (fig 11-12, clip 8-10).
Figura 11. Varicocele
Figura 12. Varicocele prima (a sinistra) e dopo (a destra) manovra di Valsalva
Clip 8. Varicocele B-mode
Clip 9. Varicocele Color
Clip 10. Varicocele Color in ortostasi
Normalmente il plesso pampiniforme è difficilmente valutabile con il classico esame obiettivo. In condizioni normali appare come una serie di vasi di diametro < 2 mm, che convergono nella vena spermatica, di difficile riconoscimento anche con tecniche ecografiche standard; decisamente più utile risulta l’applicazione del color-Doppler, che non deve dimostrare alcun reflusso. Per varicocele si intende la dilatazione del plesso pampiniforme, caratterizzato da reflusso venoso. Le linee guida EAU (15) riguardanti l’infertilità maschile, suggeriscono di porre diagnosi di varicocele con l’esame clinico, in quanto solo i varicoceli palpabili sono associati con infertilità. In ogni caso la diagnosi va confermata con il color-Doppler, in particolar modo quando l’esame clinico non sia conclusivo. D’altra parte, l’indagine ECD offre una migliore stratificazione dei varicoceli di basso grado.
Dal punto di vista ecografico il varicocele appare come un insieme di strutture tubulari serpiginose di varia taglia, > 2-3 mm, visualizzabili al di sopra o lateralmente al testicolo e, se di grandi dimensioni, con estensione anche posteriore ed inferiore. Sono state proposte varie classificazioni ecografiche della patologia (9) (tabella).
| Classificazioni ecografiche del varicocele | ||
| Tipo | Grado | Descrizione |
| Classificazione integrata (Isidori), fra clinica (Dubin) ed ecografia (Solbiati), basata su sede e dimensioni dei vasi | 1 | Vasi dilatati nella regione inguinale (> 2.5 mm), con reflusso di breve durata solo durante Valsalva (< 3 secondi). |
| 2 | Dilatazione vasale sovra-testicolare (< 3 mm), con reflusso di breve durata solo durante Valsalva (> 3 secondi). | |
| 3 | Dilatazione vasale sovra e peri-testicolare (> 3 mm), con reflusso a riposo e durante Valsalva (> 3 secondi). | |
| 4 | Dilatazione vasale sovra e peri-testicolare (>3 mm), che aumenta in ortostatismo, con reflusso a riposo, che può aumentare o meno durante Valsalva; ipotrofia del testicolo. | |
| 5 | Dilatazione vasale peri-testicolare, che non si modifica con Valsalva, oppure vasi intra-testicolari; ipotrofia del testicolo. | |
| Classificazione di Iosa, basata sul reflusso | 1 | Reflusso di durata < 1 sec, solo durante Valsalva. |
| 2 | Reflusso spontaneo e discontinuo, non modificabile con Valsalva. | |
| 3 | Reflusso spontaneo e discontinuo, aumentato da Valsalva. | |
| 4A | Reflusso spontaneo e continuo, non modificabile con Valsalva. | |
| 4B | Reflusso spontaneo e continuo, aumentato da Valsalva. | |
| Classificazione di Sarteschi | 1 | Non varicosità in B-mode. Prolungato reflusso venoso all’ECD, con sonda posizionata all’emergenza scrotale. |
| 2 | Piccole varicosità posteriori, spesso accompagnate da un tronco venoso rettilineo ventrale, che non scendono sotto il livello del polo superiore testicolare. Le varicosità incrementano di diametro con Valsalva eseguita in B-Mode. Reflusso venoso sovra-testicolare all’ECD. | |
| 3 | Pronta dilatazione venosa con Valsalva in ortostatismo in B-Mode, con i vasi che raggiungono il polo inferiore testicolare. All’ECD non reflusso in condizioni basali, ma reflussi prolungati con Valsalva. | |
| 4 | Vasi venosi funicolari dilatati in B-Mode a livello peri-testicolare; ulteriore allargamento dei calibri venosi con Valsalva. Reflussi patologici già in condizioni basali con ECD, incrementabili con Valsalva. Spesso ipotrofia del testicolo omolaterale. | |
| 5 | Vasi venosi estremamente dilatati in B-Mode a livello funicolare e peri-testicolare, talvolta in maniera abnorme. Aumento del calibro venoso con Valsalva. All’ECD reflusso patologico presente in condizioni basali, che si incrementa poco o niente con le manovre funzionali. Talvolta varici intra-testicolari. Può coesistere ipotrofia del testicolo omolaterale. | |
Calcificazioni
Talora durante l'esecuzione dell'esame ecografico si osserva la presenza di immagini iperecogene, alcune con cono d'ombra posteriore, da attribuire a calcificazioni, visualizzabili a diversi livelli: involucri testicolari, intra-parenchimali o libere e mobili all’interno della falda liquida.
Le macro-calcificazioni (fig 13), così definite quando il loro diametro supera i 3 mm, sono espressione di precipitati di sali di calcio che possono verificarsi per svariate cause. Nella maggior parte dei casi possono essere esiti di fenomeni flogistici o traumatici, ma devono essere messe in diagnosi differenziale con il burn-out tumor, potendo rappresentare l'esito involutivo di fenomeni neoplastici in regressione spontanea (16).
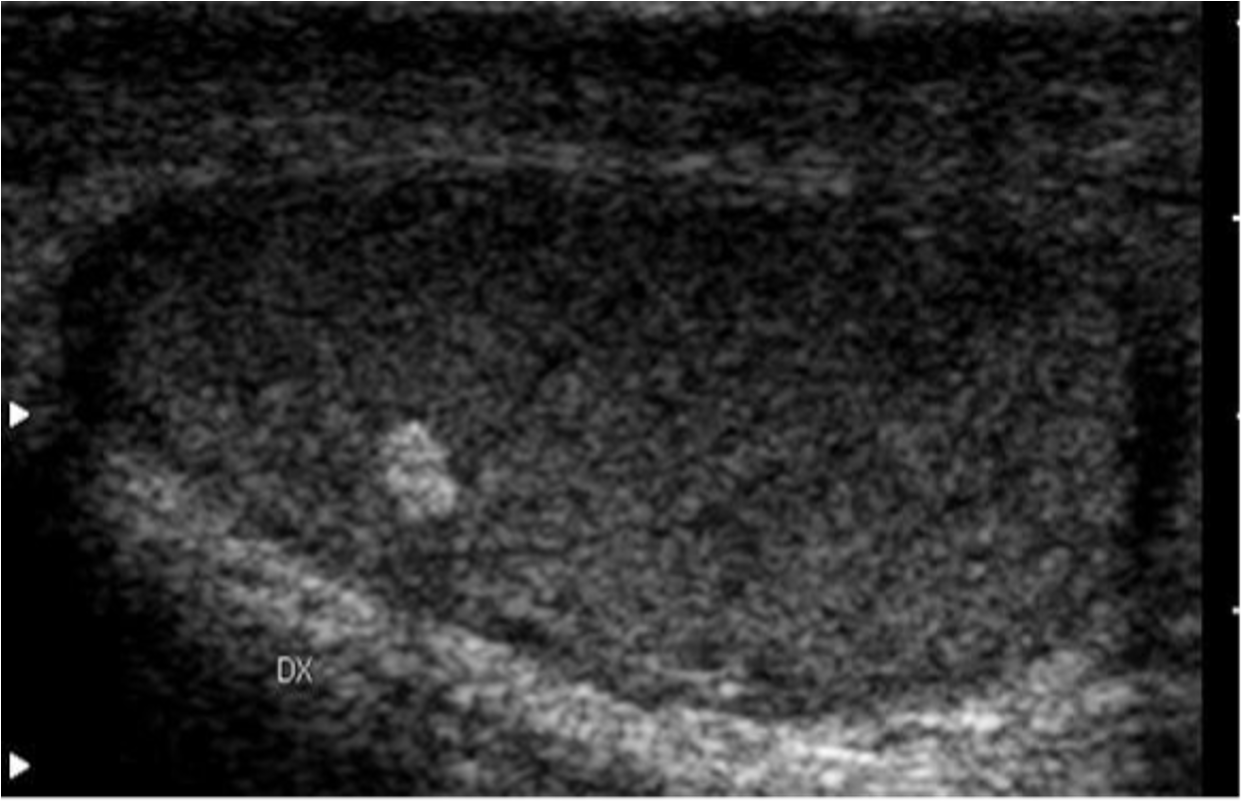
Figura 13. Macro-calcificazione
Diverso il significato delle micro-calcificazioni, cui ci si riferisce allorquando presentano diametro tra 1-3 mm, che appaiono ecograficamente come spot iperecogeni senza cono d'ombra posteriore, a volte individuabili in maniera sparuta nei vari frame ecografici e altre volte invece in numero elevato. In riferimento alla loro numerosità, se ne distingue una forma "limited", se si contano meno di 5 spot per campo ecografico, una forma "classica", se se ne contano più di 5, fino a una forma definita "a cielo stellato” se il testicolo ne appare cosparso (fig 14-16). La loro origine sarebbe consequenziale alla difettosa eliminazione, da parte delle cellule del Sertoli, del materiale di scarto accumulato e aggregato all'interno dei tubuli seminiferi durante le tappe della spermatogenesi. La prevalenza ecografica è segnalata tra 0.6% e 9% dei casi.
Figura 14. Micro-litiasi: forma limited
Figura 15. Micro-litiasi forma classica
Figura 16. Micro-litiasi forma a cielo stellato
Sebbene la micro-litiasi sia considerata un reperto sostanzialmente benigno, in vari lavori è stata trovata una correlazione con patologie non neoplastiche, come il criptorchidismo e l'infertilità, oltre che con una maggior predisposizioni a patologie neoplastiche, individuandola come una pre-cancerosi. Tale correlazione è comunque variabile e controversa e sembra presentarsi più frequentemente nella popolazione maschile infertile (17).
Sebbene, secondo le linee guida EAU (18), la sola micro-litiasi non risulti un criterio meritevole nè di follow-up ecografico nè di indagini bioptiche, se non coesistono altri fattori di rischio per carcinoma testicolare (infertilità, bilateralità, atrofia testicolare, criptorchidismo), è comunque consigliato impostare un follow-up con cadenza regolare nei pazienti che mostrino un quadro di micro-litiasi, specie se nella presentazione “a cielo stellato”.
Appendici testicolari
Le appendici testicolari si visualizzano meglio quando è presente una seppur minima falda liquida peri-testicolare.
L'appendice dell'epididimo, detta anche Idatide del Morgagni, è un residuo embrionale del dotto di Wolff e si presenta come formazione cistica adesa al margine superiore della testa dell'epididimo, di solito con diametro di 3-5 mm (fig 17).
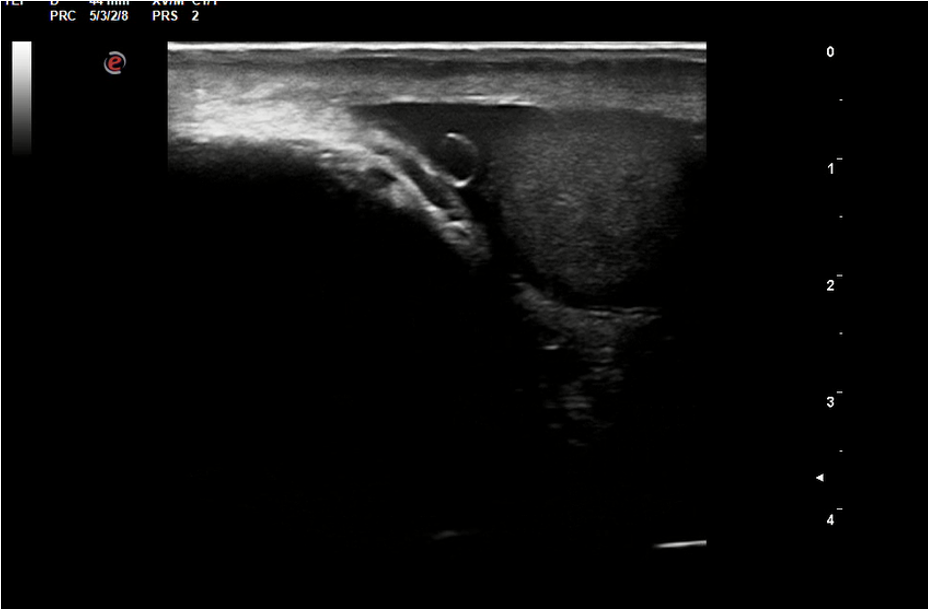
Figura 17. Appendice testicolare, residuo del dotto di Wolff
L'appendice del testicolo, cui esitano i residui embrionali dei dotti di Muller, si presenta come struttura solida iso o ipoecogena, anch'essa di pochi millimetri di lunghezza, rilevabile di solito in corrispondenza del punto di passaggio tra il caput dell'epididimo e il polo superiore del testicolo (fig 18).
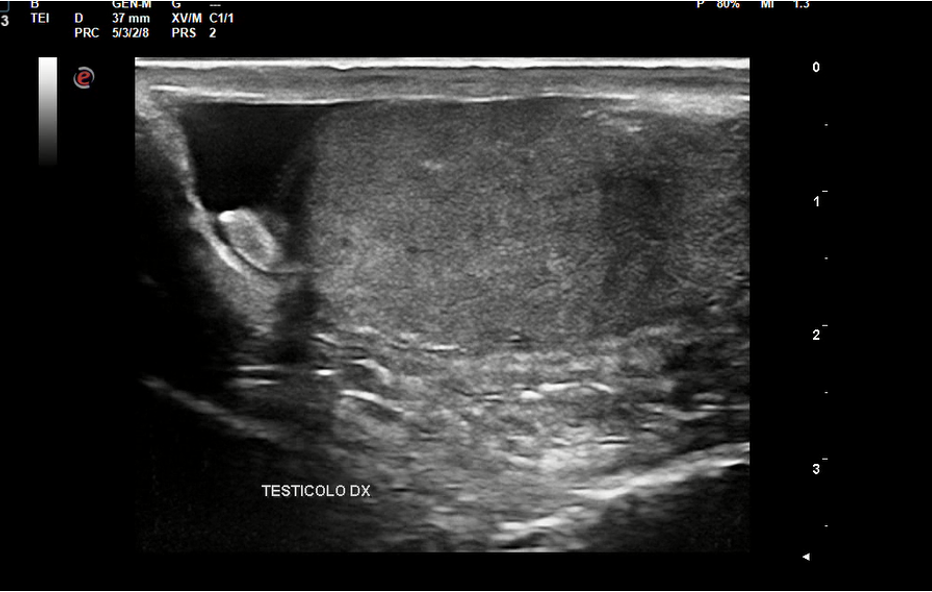
Figura 18. Appendice testicolare residui del dotto di Muller
Involucri
La visualizzazione ecografica degli involucri scrotali si propone di individuare (fig 19 e clip 11):
- la tonaca vaginale, costituita da un foglietto parietale e da uno viscerale, che, ben visibili e distinguibili tra loro, specie se presente una seppur minima falda di idrocele, si presentano come linee iperecogene separate da materiale anecogeno;
- l'albuginea, anch'essa evidenziabile come linea iperecogena che avvolge il testicolo, subito al disotto del foglietto viscerale della tunica vaginale .
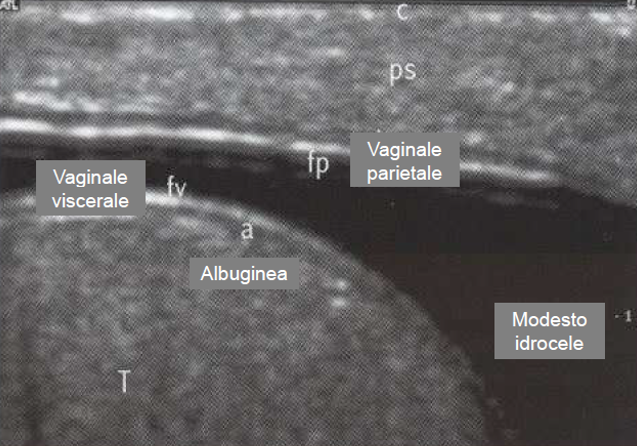
Figura 19. Involucri testicolari
Clip 11. Involucri testicolari
Gli involucri possono andare incontro a processi flogistici o traumatici, cui possono esitare formazioni cistiche o grossolane calcificazioni, che possono interessare sia l'albuginea che la tunica vaginale (fig 20). A volte all'interno di sacche di idrocele si vedono rotolare grossolane calcificazioni chiamate scrotoliti, che possono anche conseguire a torsioni delle appendici, con successivi processi necrotici delle stesse, che si distaccano dal polo superiore del testicolo e precipitano in basso, mobili con i cambi di posizione del paziente o sotto le sollecitazioni della sonda ecografica (fig 21-22).
Figura 20. Calcificazione dell'albuginea
Figura 21. Scrotolita
Figura 22. Scrotolita
EPIDIDIMO
Si localizza in sede postero-laterale rispetto al testicolo e la testa presenta ecogenicità sovrapponibile a quella testicolare, risultando modicamente iperecogena rispetto a corpo e coda (fig 23 e clip 12). Segnale vascolare è riconoscibile in tutti i componenti anatomici. Le dimensioni normali sono:
- testa 5-12 mm;
- corpo 2-4 mm:
- coda 2-6 mm.
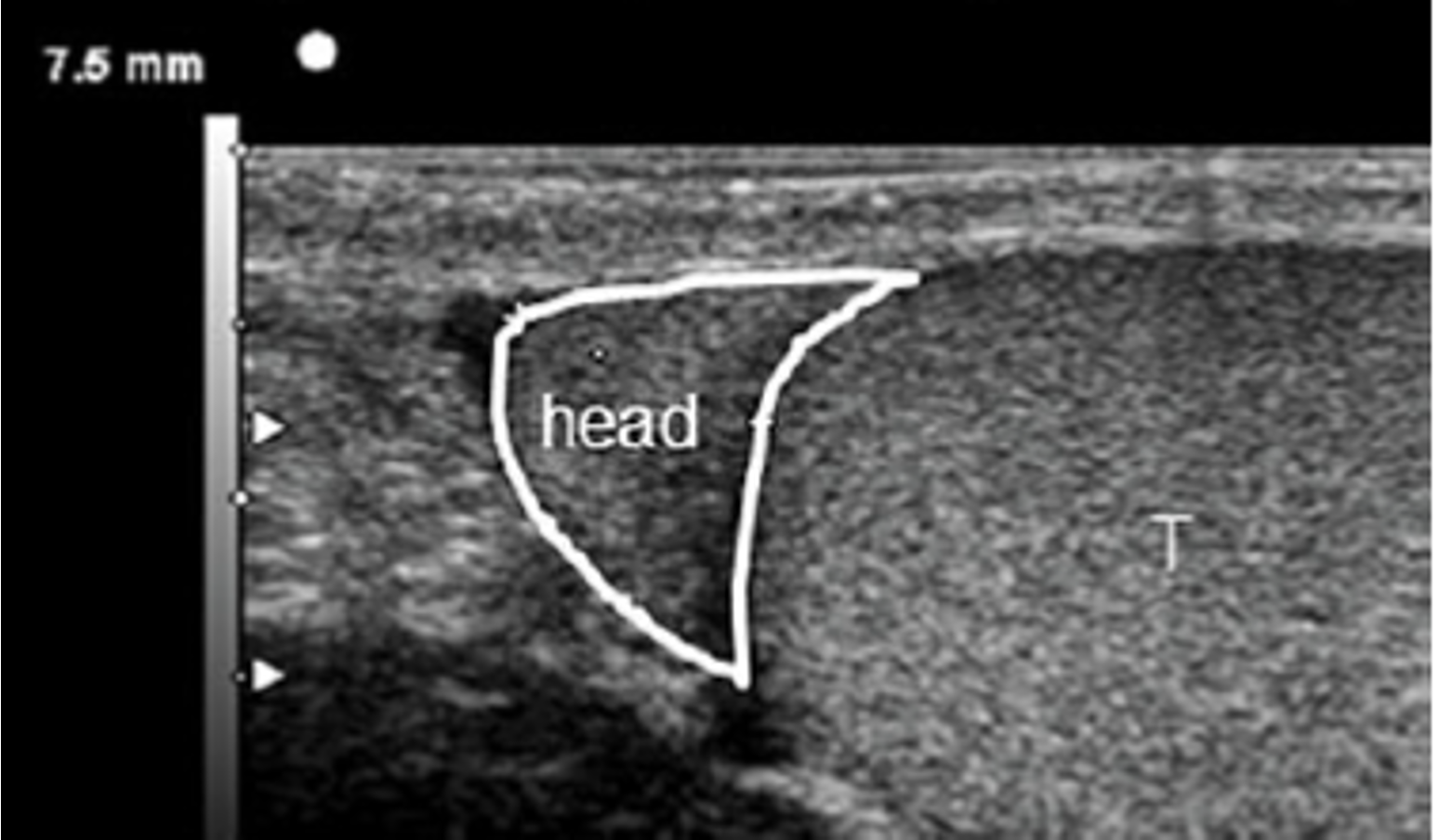
Figura 23. Testa epididimo
Clip 12. Epididimo
Molto frequenti sono le formazioni cistiche (25% dei maschi adulti), per le quali non è stato dimostrato un ruolo patogenetico nell’infertilità ostruttiva (fig 24). Anomalie ecostrutturali sono state associate a fenomeni infiammatori acuti (ipoecogenicità) o cronici (iperecogenicità). Nel caso in cui le dimensioni della coda siano > 6 mm e quelle della testa > 12 mm, può essere ipotizzabile una patologia ostruttiva (19).
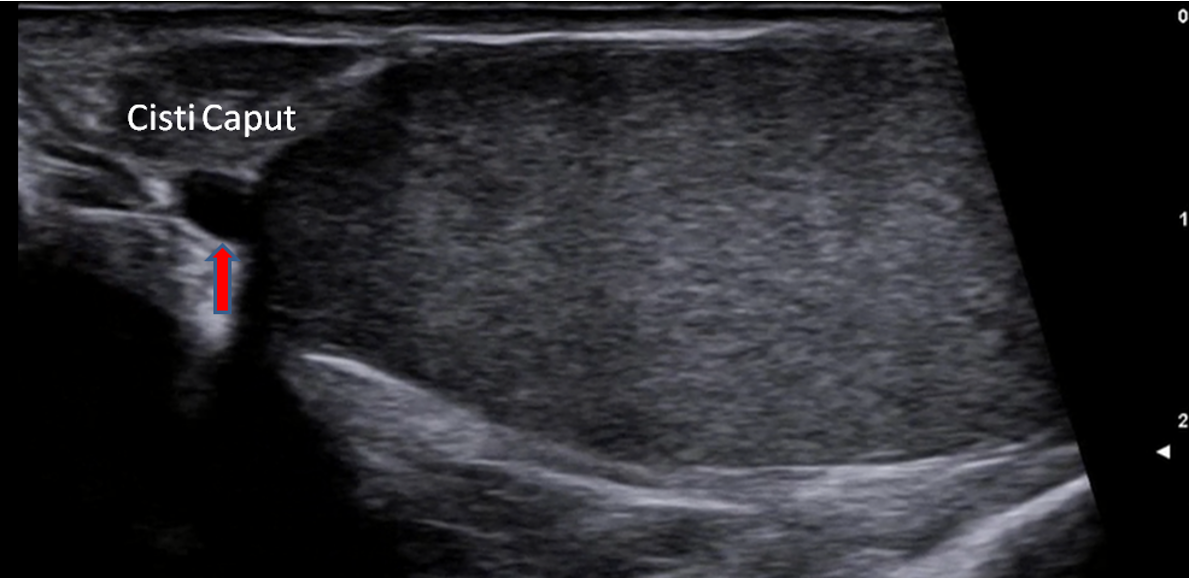
Figura 24. Cisti testa epididimo
DOTTI DEFERENTI
Appaiono come strutture tubuliformi, ipoecogene, subito in continuità con la coda dell'epididimo, con striature iperecogene a conferma della prevalente struttura muscolare della loro parete (clip 13). È possibile seguirne il decorso nel funicolo spermatico. Non esiste ancora consenso riguardo il loro diametro normale che solitamente è intorno ai 4 mm. L’assenza bilaterale o monolaterale dei deferenti è riscontrabile facilmente con l’indagine ecografica e richiama all'effettuazione di test genetici per dimostrarne la correlazione con la fibrosi cistica.
Clip 13. Dotto deferente
PROSTATA
L’ecografia trans-rettale è in grado di identificare una zona periferica, che si estende lateralmente e posteriormente dall’apice alla base, e una zona di transizione, localizzata al centro, che risulta leggermente ipoecogena (fig 25). Nel giovane il rapporto volumetrico tra le 2 zone è 3:1 a favore della porzione periferica (20).
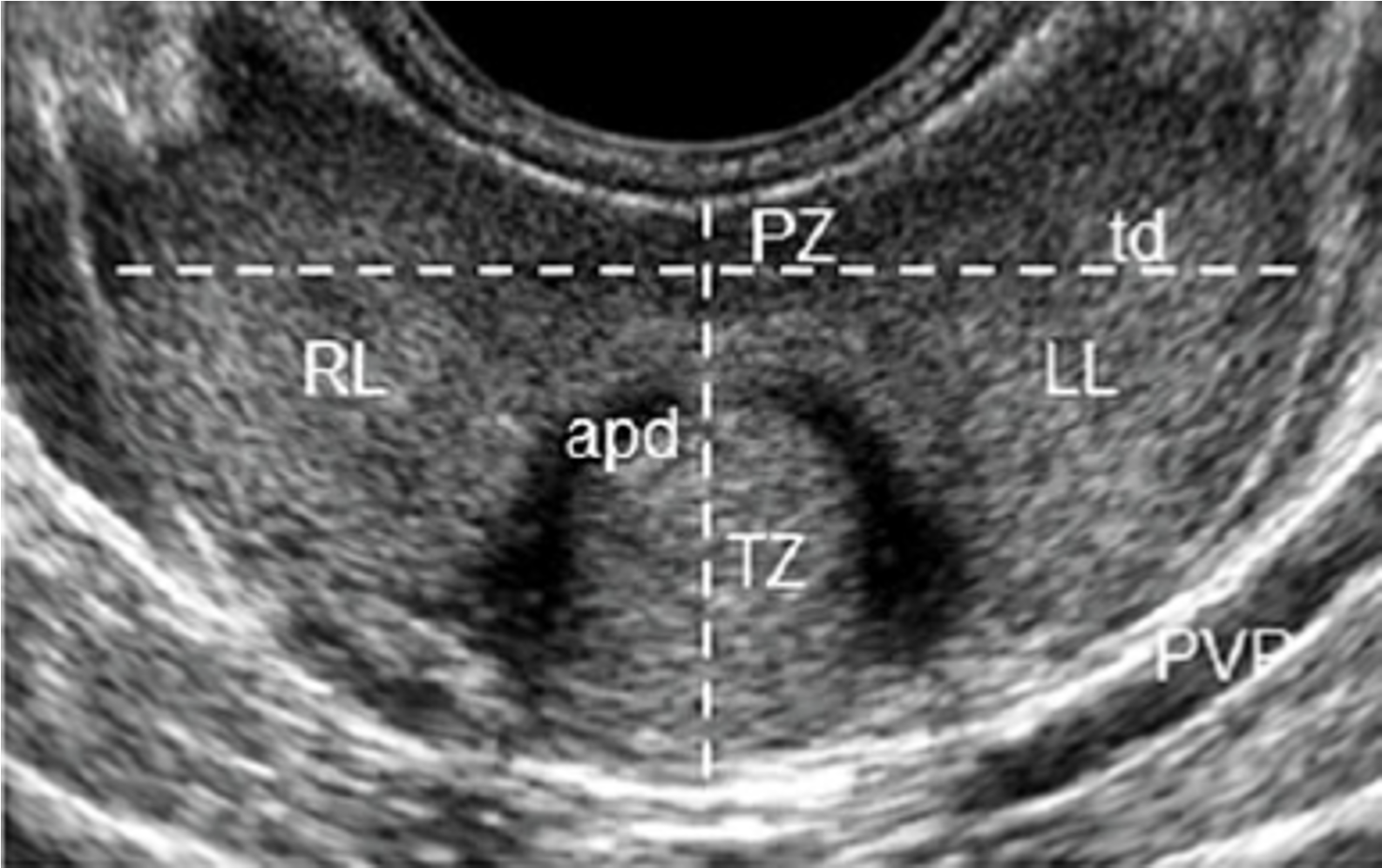
Figura 25. Prostata normale in sezione trasversale: si evidenziano i 2 lobi laterali (RL e LL), la zona di transizione (TZ), i diametri antero-posteriore (apd) e trasverso (td). PZ = Zona periferica, PVP = Plesso venoso peri-prostatico
Il volume prostatico viene calcolato utilizzando la misurazione di tre diametri (antero-posteriore e trasverso in scansione trasversale e longitudinale in scansione sagittale), utilizzando poi la formula dell’elissoide (21). Il volume normale nel giovane adulto è di circa 20-25 mL (20), ma ha scarso impatto nella diagnostica dell’infertilità, nonostante un volume ridotto possa essere indicativo di ipogonadismo, stante il ruolo fondamentale del testosterone sulla crescita della ghiandola. Anche le alterazioni riconoscibili con ECD risultano di difficile utilizzo per la gestione dell’infertilità maschile. Un volume > 30 mL è indicativo di iniziale ipertrofia benigna, mentre se il volume supera i 60 mL si tratta di forma avanzata (22).
Il segnale ecografico della prostata risulta costituito da echi fini addensati, sostanzialmente omogenei. In caso di ipertrofia benigna, possono essere presenti reperti ecografici quali disomogeneità nell’ecostruttura, sporadiche formazioni cistiche, noduli e calcificazioni. Questi reperti patologici possono correlare con lo studio della fertilità maschile (11):
- asimmetria ghiandolare: patologia infettiva;
- disomogeneità ecostrutturale: patologia infettiva, anche cronica, obesità o sindrome metabolica;
- ipoecogenicità: edema, infiammazione acuta e subacuta;
- iperecogenicità: patologia infettiva, prostatite cronica/dolore pelvico cronico;
- calcificazioni: patologia infettiva, obesità o sindrome metabolica, prostatite cronica, colonizzazione batterica.
I tumori testicolari sono neoplasie rare (circa 1-1.5% di tutte le neoplasie maschili), ma rappresentano la neoplasia maligna più frequente tra i 15 e i 40 anni, quindi in piena età riproduttiva. Ai fini della gestione della patologia, è indispensabile un inquadramento diagnostico il più accurato possibile, poiché i tumori stromali sono nella maggior parte dei casi benigni, soprattutto se non palpabili, e quindi richiedono un iter terapeutico differente rispetto ai tumori germinali o misti. L’ecografia testicolare rappresenta il gold standard nell’identificazione e nello studio delle lesioni testicolari.
Un tumore testicolare all’ecografia si presenta come lesione nodulare singola o multipla, ipoecogena rispetto al parenchima circostante e caratterizzata da margini netti, che possono apparire regolari o morulati (fig 26).
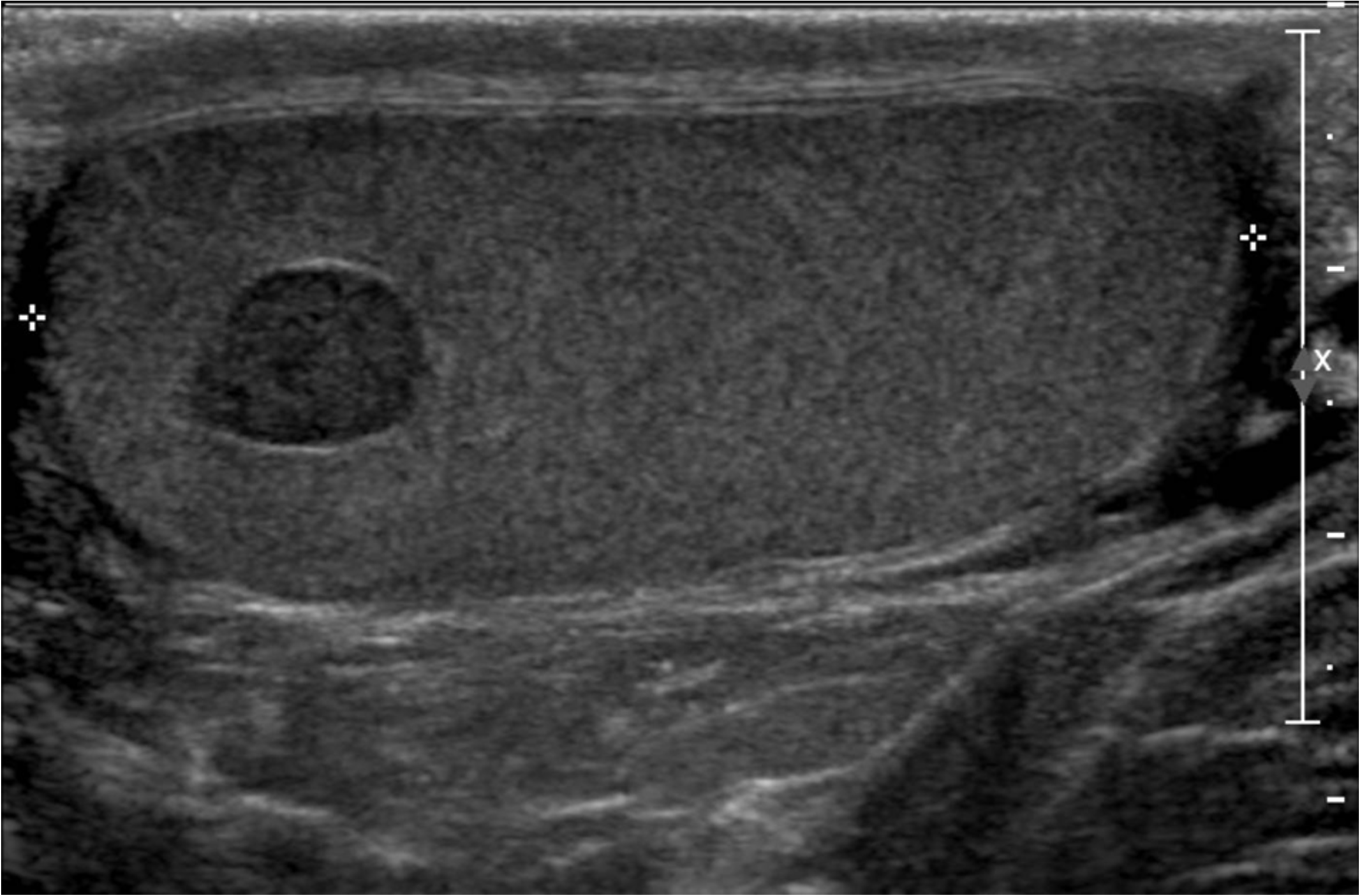
Figura 26. Paziente di 38 anni con lesione ipoecogena, a margini netti, risultata seminoma all’esame istologico.
In alcuni casi l’ecostruttura della lesione appare disomogenea, per la coesistenza di diverse componenti al suo interno (calcificazioni, aree cistiche) e questo aspetto ecografico è caratteristico dei tumori misti (fig 27).
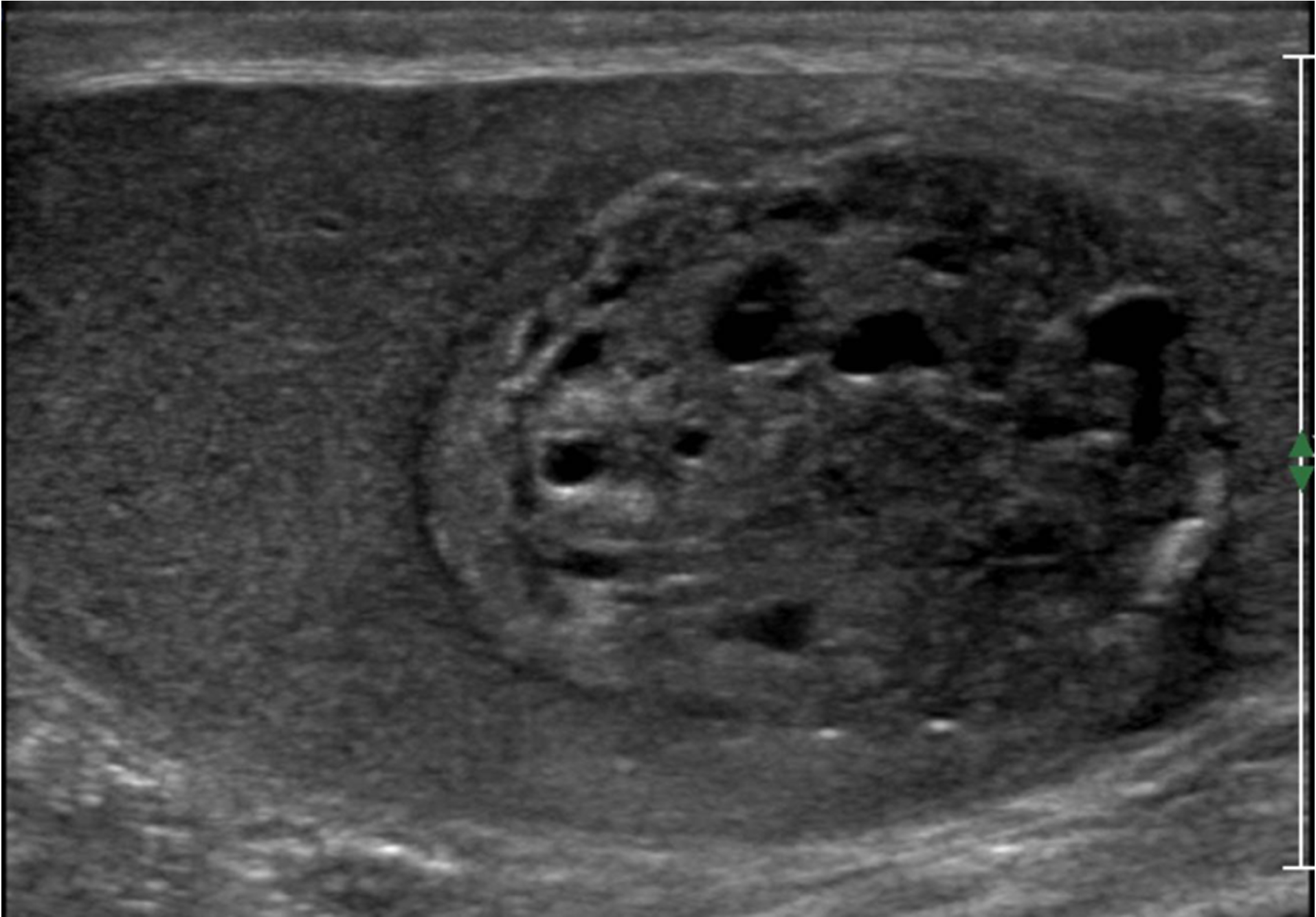
Figura 27. Paziente di 22 anni con lesione disomogenea che occupa i due terzi inferiori del testicolo sinistro. La lesione appare caratterizzata da aree cistiche e alcune calcificazioni interne, ed è risultata tumore misto all’esame istologico definitivo.
Occasionalmente un tumore testicolare, se voluminoso, può interessare l’intero parenchima testicolare. Non è infrequente che il quadro sia confuso, dai meno esperti, con una forma infiammatoria (orchite), ma in quel caso può essere di supporto la clinica, poiché il testicolo infiammato risulta dolorabile e può coesistere un idrocele reattivo o un interessamento epididimario. La vascolarizzazione in corso di orchite, inoltre, è aumentata in toto ma si mantiene organizzata. Diverso è il quadro di un tumore testicolare che interessa tutto il didimo, in cui può essere visualizzata una rima periferica di tessuto testicolare sano, che è d’ausilio nella diagnosi differenziale (fig 28).
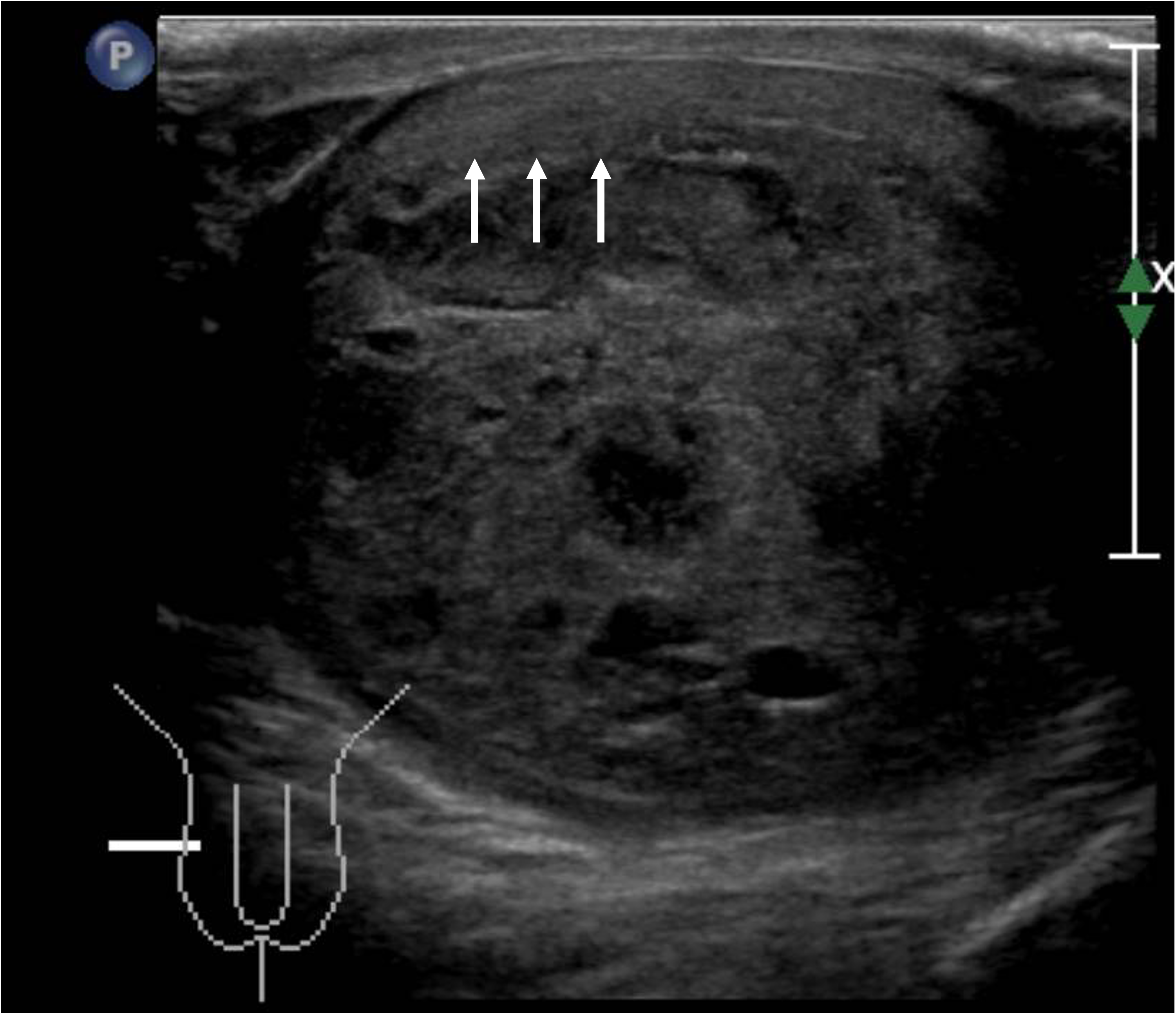
Figura 28. Paziente di 33 anni con tumore misto. Le frecce indicano la rima periferica di tessuto testicolare sano.
Le lesioni testicolari presentano generalmente vascolarizzazione interna (fig 29).
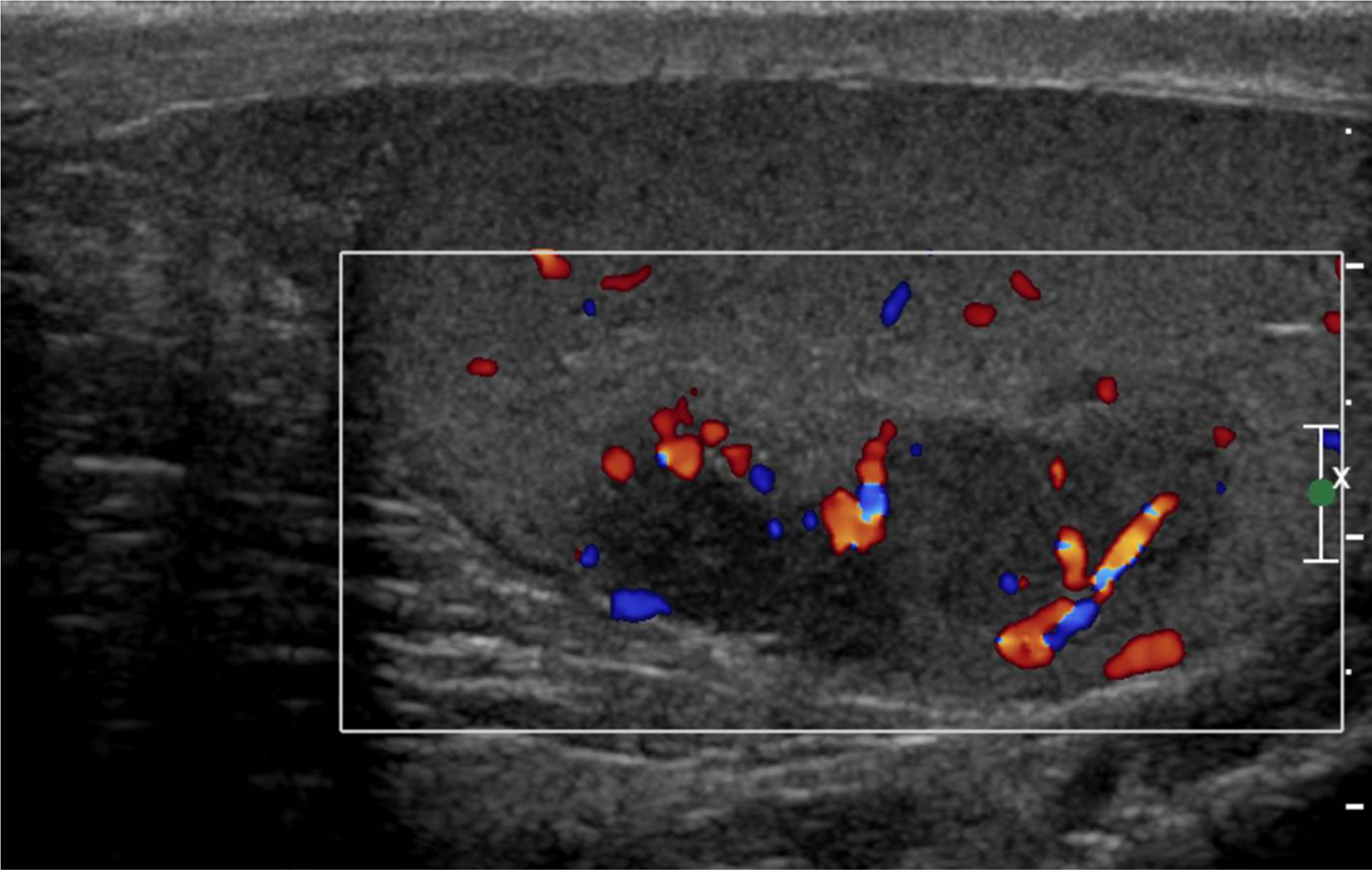
Figura 29. Lesione ipoecogena, a margini irregolari in paziente di 35 anni. La lesione appare vascolarizzata internamente.
Un caso particolare sono i carcinomi embrionari o i burned-out tumor, in cui la vascolarizzazione intra-lesionale può essere assente (fig 30).
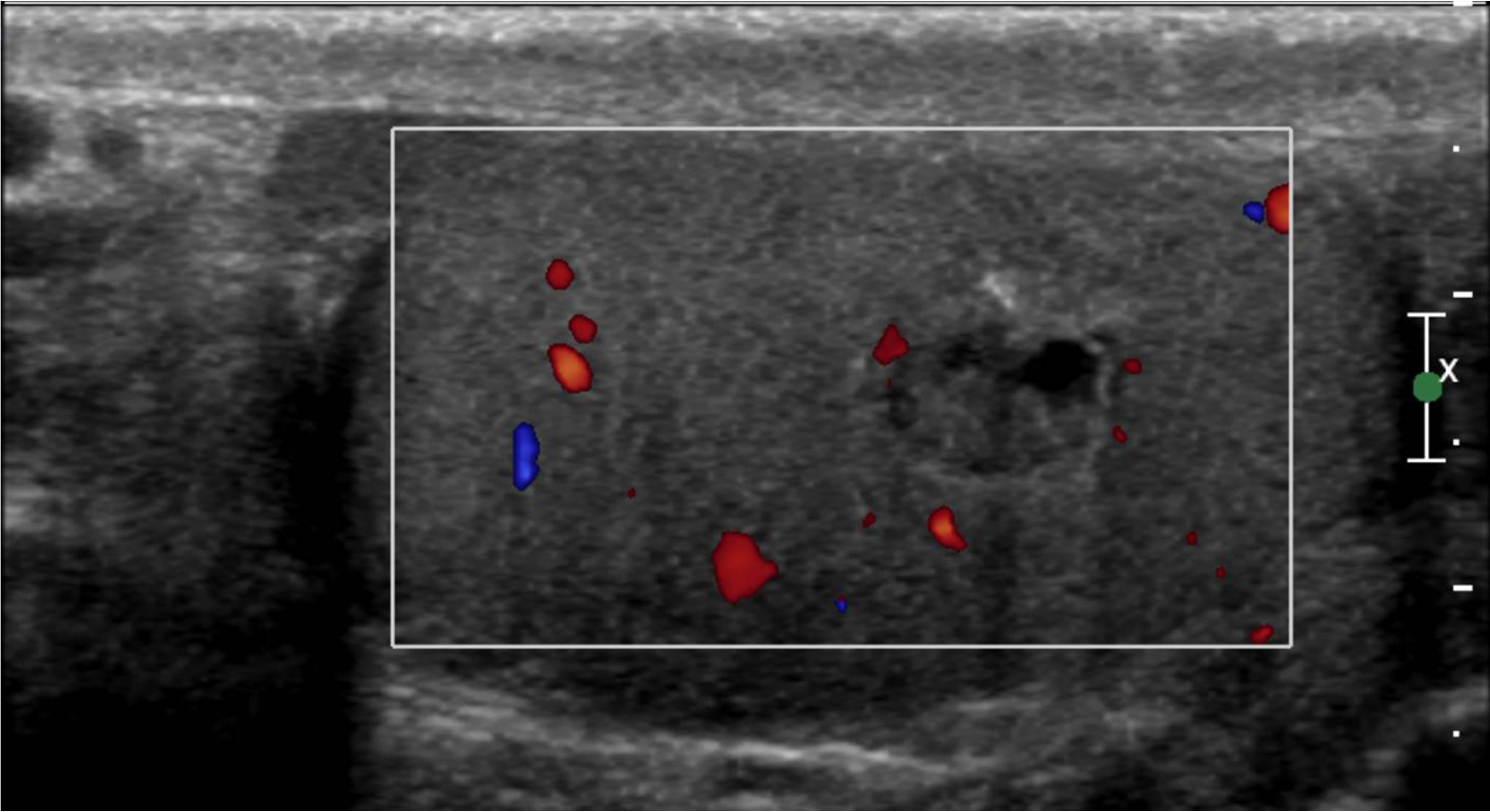
Figura 30. Carcinoma embrionario in paziente di 26 anni. La lesione appare disomogenea, con alcune micro-areole cistiche interne ed è priva di vascolarizzazione interna.
Le lesioni di grandi dimensioni hanno alta probabilità di essere maligne, mentre le lesioni non palpabili, < 1.5 cm, generalmente diagnosticate in maniera incidentale durante screening ecografici eseguiti per vari motivi (varicocele, infertilità, ecc), possono essere benigne in circa il 30% dei casi e avere natura neoplastica o non neoplastica (23).
Le lesioni non neoplastiche (ischemie focali, iperplasie a cellule di Leydig, esiti fibrotici/orchitici) possono apparire ipoecogene o debolmente ipoecogene, presentano forma rotondeggiante o allungata e appaiono scarsamente vascolarizzate. Le lesioni non neoplastiche appaiono più elastiche all’elastosonografia rispetto alle lesioni tumorali.
Le lesioni neoplastiche di natura benigna sono generalmente tumori stromali, tra i quali i più frequenti sono i tumori a cellule di Leydig. Queste lesioni appaiono ipoecogene, a margini netti, con vascolarizzazione interna, e possono essere difficilmente distinguibili da tumori a cellule germinali (seminomi) di piccole dimensioni (fig 31).
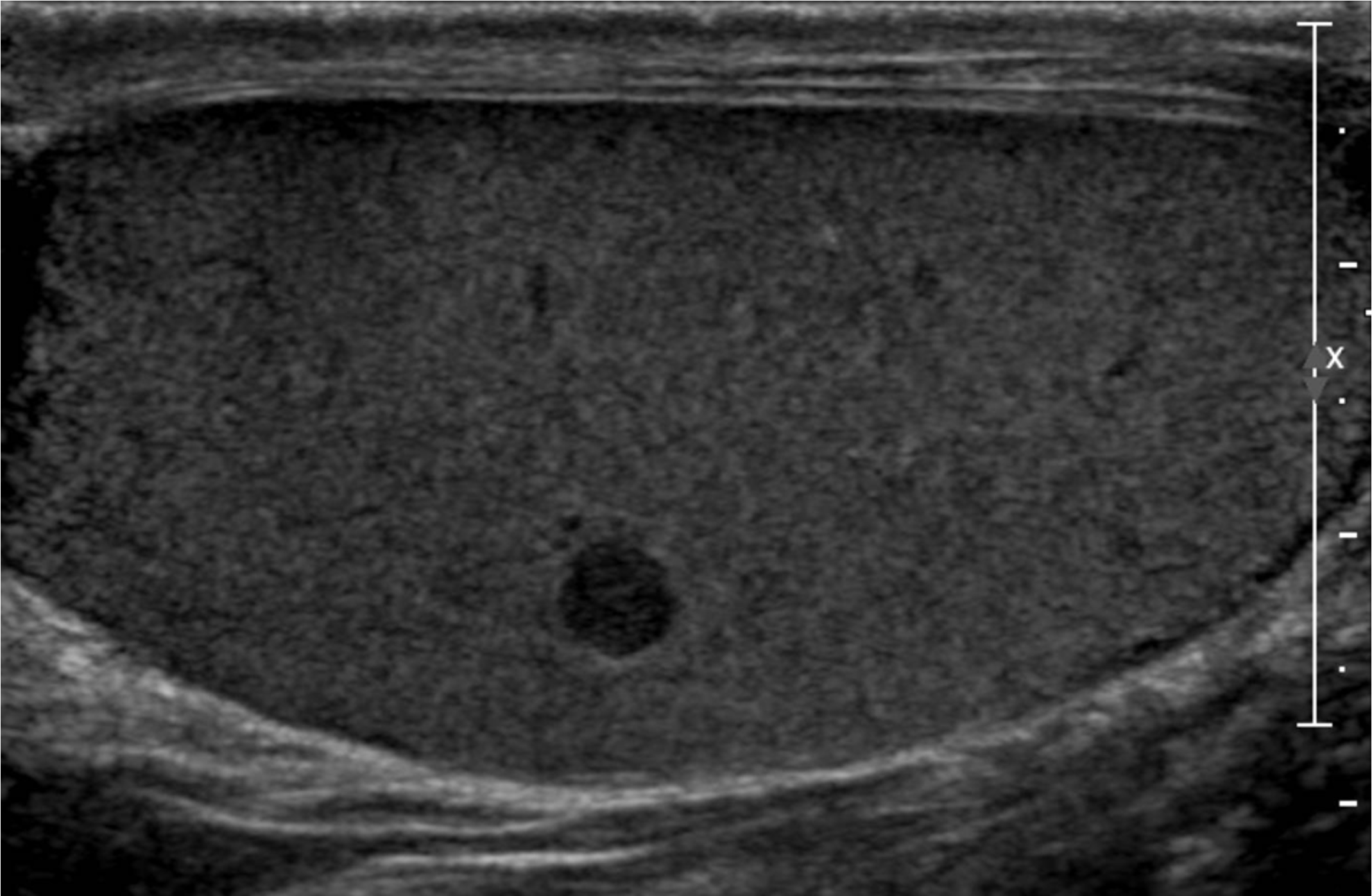
Figura 31. Paziente di 42 anni con lesione ipoecogena, a margini netti, localizzata al terzo medio posteriore del didimo sinistro.
In presenza di marcatori tumorali negativi e se l’anamnesi e la clinica lo permettono, tali lesioni possono essere sottoposte a stretto follow-up ecografico (ogni 2 mesi) per valutarne l’eventuale evoluzione. L’incremento volumetrico e la coesistenza di fattori di rischio per carcinoma (criptorchidismo, micro-litiasi, familiarità, precedente tumore testicolare controlaterale), impongono di indirizzare il paziente a biopsia della lesione con esame istologico estemporaneo. I nuovi strumenti diagnostici, quali l'ecografia con mezzo di contrasto (24) o l'elastosonografia tissutale, sono in grado di migliorare le performance diagnostiche dell'ecografia. L’ecografia con mezzo di contrasto permette di distinguere con elevata accuratezza (93%) una neoplasia maligna da una lesione benigna, in quanto le loro caratteristiche cinetiche appaiono differenti (fig 32). Entrambe le lesioni mostrano impregnazione precoce del mezzo di contrasto all’interno della lesione, ma si comportano differentemente per quanto riguarda il wash-out: il tumore a cellule di Leydig tende a mantenere a lungo il mezzo di contrasto (wash-out ritardato) rispetto al seminoma, che mostra invece un wash-out rapido.
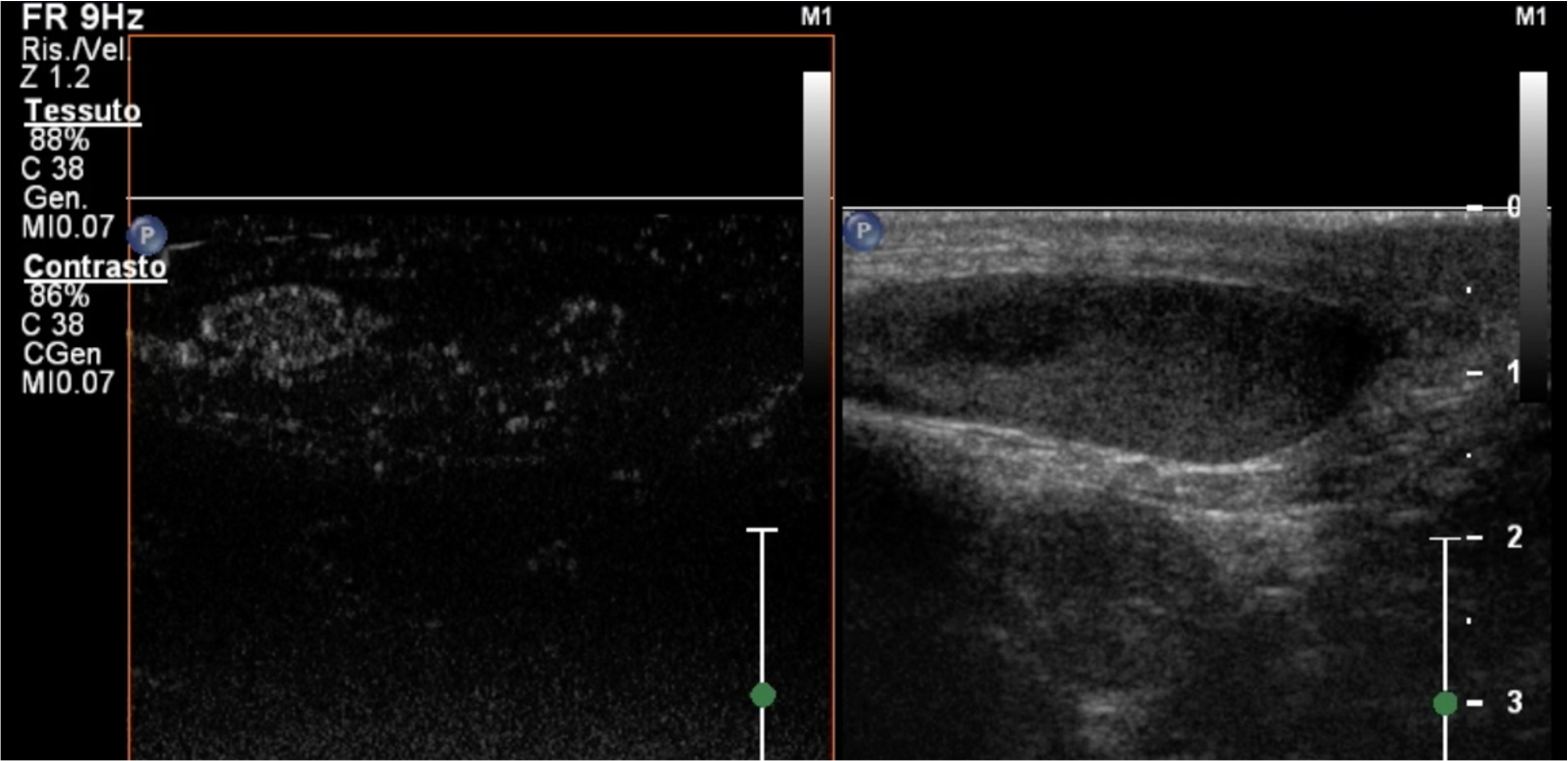
Figura 32. L’ecografia con mezzo di contrasto mostra marcata impregnazione della lesione localizzata al didimo destro, solida ipoecogena, di 1.0 cm di diametro massimo.
BIBLIOGRAFIA
- Lenz S, et al. Ultrasonic testicular texture and size in 444 men from the general population: correlation to semen quality. Eur Urol 1993, 24: 231-8.
- Pilatz A, et al. Reference values for testicular volume, epididymal head size and peak systolic velocity of the testicular artery in adult males measured by ultrasonography. Ultraschall Med 2013, 34: 349-54.
- Foresta C, et al. Anthropometric, penile and testis measures in post-pubertal Italian males. J Endocrinol Invest 2013, 36: 287-92.
- Sakamoto H, et al. Testicular volume measurements using Prader orchidometer versus ultrasonography in patients with infertility. Urology 2007, 69: 158-62.
- Kuijper EAM, et al. Ultrasonographically measured testicular volumes in 0- to 6-year-old boys. Hum Reprod 2008, 23: 792-6.
- Goede J, et al. Normative values for testicular volume measured by ultrasonography in a normal population from infancy to adolescence. Horm Res Paediatr 2011, 76: 56-64.
- Rastrelli G, et al. Relationship of testis size and LH levels with incidence of major adverse cardiovascular events in older men with sexual dysfunction. J Sex Med 2013, 10: 2761-73.
- Sakamoto H, et al. Relationship between testicular volume and testicular function: comparison of the Prader orchidometric and ultrasonographic measurements in patients with infertility. Asian J Androl 2008, 10: 319-24.
- Isidori AM, et al. Scrotal CDU: morphological and functional atlas. Forum Service Editor 2011.
- Hamm B, Fobbe F. Maturation of the testis: ultrasound evaluation. Ultrasound Med Biol 1995, 21: 143-7.
- Lotti F, Maggi M. Ultrasound of the male genital tract in relation to male reproductive health. Hum Reprod Update 2015, 21: 56-83.
- Elzinga-Tinke JE, et al. The predictive value of testicular ultrasound abnormalities for carcinoma in situ of the testis in men at risk for testicular cancer. Int J Androl 2010, 33: 597-603.
- Eckel RH, et al. The metabolic syndrome. Lancet 2005, 365: 1415-28.
- Lotti F, Corona G. Seminal, ultrasound and psychobiological parameters correlate with metabolic syndrome in male members of infertile couples. Andrology 2013, 1: 229-39.
- Jungwirth A, et al. European Association of Urology guidelines on male infertility. 2015.
- Yee WS, et al. Testicular microlithiasis: prevalence and clinical significance in a population referred for scrotal ultrasonography. Korean J Urol 2011, 52: 172-7.
- Richenberg J, Brejt N. Testicular microlithiasis: is there a need for surveillance in the absence of other risk factors? Eur Radiol 2012, 22: 2540-6.
- Laguna MP, et al. European Association of Urology guidelines on testicular cancer. 2019.
- Pezzella A, et al. Ultrasonographic determination of caput epididymis diameter is strongly predictive of obstruction in the genital tract in azoospermic men with normal serum FSH. Andrology 2013, 1: 133-8.
- Jin B, et al. Effects of androgen deficiency and replacement on prostate zonal volumes. Clin Endocrinol (Oxf) 2001, 54: 437-45.
- Lotti F, et al. Ultrasonographic and clinical correlates of seminal plasma interleukin-8 levels in patients attending an andrology clinic for infertility. Int J Androl 2011, 34: 600-13.
- Gacci M, et al. Metabolic syndrome and lower urinary tract symptoms: the role of inflammation. Prostate Cancer Prostatic Dis 2013, 16: 101-6.
- Pozza C, et al. Clinical presentation, management and follow-up of 83 patients with Leydig cell tumors of the testis: a prospective case-cohort study. Hum Reprod 2019, 34: 1389-403.
- Isidori AM, et al. Differential diagnosis of nonpalpable testicular lesions: qualitative and quantitative contrast-enhanced US of benign and malignant testicular tumors. Radiology 2014, 273: 606-18.
Eco-doppler penieno dinamico
Mauro Schiesaro
Ospedale Classificato Villa Salus, Mestre (VE)
ANATOMIA ECOGRAFICA DINAMICA DEL PENE
Le strutture erettili del pene sono rappresentate dai corpi cavernosi, circondati dalla tonaca albuginea. Ventralmente si localizza il corpo spongioso che contiene l’uretra. Sia i corpi cavernosi che il corpo spongioso sono circondati, dall’interno verso l’esterno, dalla tunica albuginea, dalla fascia di Buck e dalla fascia di Colles. Normalmente lo spessore dell’albuginea varia da 2 a 3 mm in condizioni di flaccidità e durante l’erezione scende a 0.5 mm.

Figura 1. Anatomia normale del pene
I corpi cavernosi sono formati da sinusoidi, costituiti da endotelio e muscolatura liscia; il pene viene normalmente rifornito da rami dell’arteria pudenda interna, ramo dell’iliaca interna, dalla quale origina l’arteria peniena; questa si divide ulteriormente in 4 rami terminali:
- l’arteria bulbare rifornisce il bulbo del corpo spongioso;
- l’arteria uretrale irrora corpo spongioso e uretra;
- l’arteria dorsale del pene irrora il glande e decorre tra l’albuginea e la fascia di Buck;
- l’arteria cavernosa rifornisce i corpi cavernosi attraverso numerose arterie elicine, le quali a loro volta confluiscono nei sinusoidi attraverso multiple arteriole.
Il setto inter-cavernoso risulta perforato in modo tale da consentire la comunicazione del flusso sanguigno e le vene emissarie perforano la tonaca albuginea, per poi confluire nella vena dorsale profonda attraverso le vene spongiose, circonflesse e cavernose (1,2).
L’ecografia può essere utilizzata per valutare la struttura del pene e il sistema vascolare grazie all’ecocolor-doppler, proposto nel 1985 da Lue e coll (3), che consente lo studio delle arterie cavernosa e dorsale del pene.

Figura 2
In ecografia i corpi cavernosi presentano ecogenicità mista e l’albuginea risulta iperecogena; il corpo spongioso è invece più riflettente rispetto ai corpi cavernosi; le arterie cavernose vengono evidenziate all’interno dei corpi cavernosi come linee parallele iperecogene. La spongiosa si visualizza lungo la superficie ventrale e presenta una reflettività lievemente maggiore rispetto ai corpi cavernosi.
Per lo studio ecografico, come per quello in ecocolor-doppler, il paziente deve essere posizionato in un ambiente confortevole, in posizione supina, con il pene appoggiato alla parete addominale. Viene utilizzata una sonda lineare ad alta frequenza (7.5-14 MHz) e l’indagine viene eseguita sia su piani trasversali che longitudinali, iniziando a livello del glande e scorrendo fino alla base del pene.
Uno studio preliminare prevede l’esame in condizioni di flaccidità; successivamente si procede alla farmaco-stimolazione ottenuta tramite iniezione intra-cavernosa di 5-20 µg di prostaglandina E1 (PGE1). L’iniezione deve essere praticata lateralmente al fascio vascolo-nervoso, tra 2 e 4 centimetri dorsalmente al solco balano-prepuziale, utilizzando ago sottile (25-27 G) (fig 3). Normalmente sono sufficienti tra 5 e 10 µg di PGE1 per riprodurre una normale erezione, ma in condizioni patologiche, quali il diabete mellito, può essere necessario procedere alla somministrazione di 20 µg del farmaco, come pure nei soggetti che non rispondono al trattamento con inibitori della PDE5. Nei soggetti giovani o nei pazienti con lesioni midollari la dose può essere invece ridotta (4-5). In ogni caso l’indagine deve essere proseguita per almeno 30 minuti, in quanto una discreta percentuale di soggetti presenta erezione tardiva dopo stimolo.

Figura 3. Modalità di iniezione di PGE1 per test di farmaco-erezione
Nei primi minuti dopo farmaco-stimolazione, si osserva in B-mode progressiva dilatazione delle arterie cavernose, con distensione delle lacune dei corpi cavernosi. L’ecogenicità del tessuto cavernoso, ridotta all’inizio dello stimolo, ritorna omogenea nei minuti successivi quando il paziente ottiene l’erezione, per cui è ottenibile un ottimo imaging della vascolarizzazione peniena, difficile invece in caso di flaccidità (fig 4).

Figura 4. Anatomia ecografica dei vasi del pene: a sinistra arterie cavernose e vasi dorsali del pene; a destra la punta di freccia in su indica l’arteria cavernosa, la freccia curva l’arteria uretrale, la freccia volta a sinistra il ramo di comunicazione
Da notare come le arterie elicine divengano scarsamente visibili durante l’erezione.
Una volta completato lo studio morfologico vascolare, si deve passare alle misurazioni velocimetriche dei flussi nelle arterie cavernose, utilizzando il Doppler pulsato. Dallo stato di flaccidità all’erezione, si passa attraverso 4 fasi vascolari successive, correlabili ad un progressivo incremento della pressione intra-cavernosa (fig 5):
- fase 0: in stato di flaccidità i flussi nelle arterie cavernose mostrano bassa velocità e alta resistenza;
- fase 1: subito dopo l’iniezione, nelle arterie cavernose si realizzano flussi ad alta velocità e bassa resistenza, con velocità di picco sistolico > 35 cm/sec e velocità diastoliche < 8 cm/sec;
- fase 2: si osserva in seguito progressiva riduzione della velocità diastolica,
- fino alla fase 3: scomparsa del flusso diastolico,
- e alla sua inversione (fase 4).

Figura 5a: stato di flaccidità (fase 0) caratterizzato da flussi a bassa velocità ed elevata resistenza

Figura 5b: dopo farmaco-stimolazione (fase 2), flussi ad alta velocità e bassa resistenza, con comparsa di incisura ad inizio diastole (freccia curva)

Figura 5c: aumento della turgidità del pene e scomparsa del flusso diastolico (fase 3)

Figura 5d: massima erezione e inversione del flusso diastolico (fase 4)
Ii parametri valutabili per lo studio della DE sono i seguenti :
- velocità di picco sistolico (VPS): viene espressa in cm/sec, indica la massima velocità di flusso durante la sistole;
- tempo di accelerazione (AT): viene espresso in millisecondi (msec) e corrisponde al tempo che intercorre tra la partenza del picco sistolico fino al suo valore massimo. Solitamente rallenta nelle arteriopatie obliteranti;
- velocità di fine diastole (VTD): viene espressa in cm/sec e indica la quantità di flusso ancora presente in un vaso al termine della fase diastolica;
- indice di resistenza (RI): risulta dalla formula (VPS-VTD)/VPS ed esprime il grado di resistenza periferica al flusso.
INTERPRETAZIONE DEI DATI
VPS < 35 cm/sec: sospettare alterazione arteriosa:
- VPS tra 34 e 30 cm/sec: ipoafflusso arterioso lieve;
- VPS tra 25 e 29 cm/sec: ipoafflusso arterioso medio;
- VPS < 25 cm/sec: ipoafflusso arterioso grave.
AT: un valore > 110 msec ha un elevato valore predittivo per arteriopatia.
VTD: un valore di VTD ≥ 5 msec dopo farmacostimolazione, in presenza di normale flusso arterioso, è altamente indicativo di deficit veno-occlusivo
RI:
- > 0.9: normale;
- < 0.75: indicativo di fuga venosa;
- compreso tra 0.75 e 0.9 non diagnostico, in quanto vi è ampia sovrapposizione tra soggetti normali e con difetto veno-occlusivo.
DEFICIT ERETTILE
Le cause vascolari della disfunzione erettile, ben valutabili con ecocolor-doppler, possono essere di tipo arterioso o veno-occlusivo.
Deficit erettile di origine arteriosa
Il deficit arterioso è causato da un ridotto flusso di sangue arterioso al pene ed è caratteristico dei soggetti anziani e/o vasculopatici. L’indagine ecografica orienta verso una diagnosi di forma arteriogenica, potendo verificare la presenza di asimmetria nel calibro delle arterie cavernose, oppure di placche nella parete delle arterie (fig 6).

Figura 6. Placche in arteria cavernosa
Va comunque precisato che il criterio diagnostico principale è rappresentato dal riscontro all’ecocolor-doppler, dopo farmaco-stimolazione, di una velocità di picco sistolico nelle arterie cavernose < 25 cm/sec. Anche l’asimmetria del flusso, con una differenza di velocità di picco sistolico > 10 cm/sec nelle arterie cavernose, può orientare verso questo tipo eziologico della disfunzione erettile (8).
Deficit erettile di origine veno-occlusivo
È caratterizzato da un normale afflusso ematico al pene, ma il sangue non rimane intrappolato nelle lacune dei corpi cavernosi e quindi può defluire rapidamente attraverso le vene e il corpo spongioso. Ad oggi vi sono numerose dimostrazioni secondo le quali il deficit veno-occlusivo, in realtà, non è causato da una mancata chiusura dei vasi di deflusso, quanto piuttosto da alterazione della struttura del tessuto cavernoso, con aumento della componente fibrosa e riduzione di quella muscolare, che impedisce un'adeguata distensione del tessuto erettile e la compressione contro l’albuginea del plesso venoso sotto-albugineo (6,7).
Per poter ipotizzare una cosiddetta “fuga venosa”, quale meccanismo patogenetico della disfunzione erettile, deve essere soddisfatto il criterio secondo il quale la velocità telediastolica deve essere > 5 cm/sec; al contrario, nei soggetti sani, questo parametro è pari a 0. Questo dato è stato comunque oggetto di discussione, in quanto non viene confermato in tutti gli studi (9). Resta comunque accettato che il gold standard per la diagnosi di deficit veno-occlusivo è rappresentato dalla Cavernosografia e dalla Cavernosometria, nonostante queste siano metodiche poco utilizzate (10).


Figura 7. Confronto tra disfunzione erettile di origine arteriosa (a sinistra) e da deficit veno-occlusivo (a destra)
INDURATIO PENIS PLASTICA
Detta anche malattia di Peyronie, generalmente ha il picco di maggiore incidenza sopra i 40 anni, ed è caratterizzata dalla comparsa di placche fibrose a livello della tonaca albuginea, prevalenti a livello dorsale, le quali sono responsabili di progressivo incurvamento del pene, che in taluni casi può essere invalidante, rendendo impossibile la penetrazione.
L’indagine ecografica, preferibilmente dopo farmaco-stimolazione, rappresenta un buon supporto diagnostico all’anamnesi e alla clinica, dal momento che è in grado di identificare le placche come ispessimenti circoscritti dell’albuginea (fig 8).

Figura 8. Esempi di 3 tipi di placche indicate dalle frecce
PRIAPISMO
Si tratta di un’erezione persistente e dolorosa, non legata a nessun genere di stimolazione o desiderio, che non recede dopo l’orgasmo.
Generalmente viene classificato in 2 categorie:
- ad alto flusso (arterioso e non ischemico), generalmente secondario a traumatismi;
- a basso flusso (ischemico), secondario a deficit neuro-trasmettitoriale α-adrenergico, deficit di endotelina o ipossia.
La diagnosi differenziale tra le due forme risulta di fondamentale importanza e deve avvenire entro le 24 ore dall’insorgenza, in quanto il tipo a basso flusso rappresenta una potenziale emergenza medica, la quale, essendo deficitario il drenaggio venoso dai corpi cavernosi, può comportare danni ischemici irreversibili.
L’indagine ecodoppler dimostra:
- nel priapismo a basso flusso o l’assenza di flusso nelle arterie cavernose o un pattern a resistenza molto elevata e bassa velocità (fig 9);
- nella forma ad alto flusso si osserva un flusso normale o addirittura elevato nelle arterie cavernose, con un flusso irregolare tra arterie e corpi cavernosi nella sede del trauma, con formazione di fistola arterio-lacunare (fig 10).

Figura 9. Priapismo a basso flusso

Figura 10. Priapismo ad alto flusso
BIBLIOGRAFIA
- Benson CB, Doubilet PM, Vickers MA Jr. Sonography of the penis. Ultrasound Quart 1991, 9: 89-109.
- Doubilet PM, Benson CB, Silverman SG, Gluck CD. The penis. Semin Ultrasound CT MR 1991, 12: 157-75.
- Lue TF, Hricak H, Marich KW, Tanagho EA. Vasculogenic impotence evaluated by high resolution ultrasonography and pulsed Doppler spectrum analysis. Radiology 1985, 155: 777-81.
- Bertolotto M, Gasparini C, Calderan L, et al. L’ecocolordoppler penieno: stato dell’arte. Giornale Italiano di Ecografia 2005, 8: 113-27.
- Patel DV, Halls J, Patel U. Investigation of erectile dysfunction. Br J Radiol 2012, 85: S69-78.
- Nehra A, Goldstein I, Pabby A, et al. Mechanism of venous leakage: a prospective clinicopathological correlation of corporeal function and structure. J Urol 1996, 156: 1320-9.
- Wespes E, Raviv G, Vanegas JP, et al. Corporeal veno-occlusive dysfunction: a distal arterial pathology? J Urol 1998, 160: 2054-7.
- Golijanin D, Singer E, Davis R, et al. Doppler evaluation of erectile dysfunction – Part 2. Int J Impotence Res 2007, 19: 43-8.
- Cornud F, Amar E, Hamida K, et al. Imaging in male hypofertility and impotence. BJU Int 2000, 86 suppl 1: 153-63.
- Golijanin D, Singer E, Davis R, et al. Doppler evaluation of erectile dysfunction – Part 1. Int J Impotence Res 2007, 19: 37-42.
Agoaspirato testicolare
Mauro Schiesaro
Ospedale Classificato Villa Salus, Mestre (VE)
ANATOMIA E FISIOLOGIA DEL TESTICOLO
La spermatogenesi è il processo di maturazione delle cellule germinali maschili che avviene nei testicoli sotto lo stimolo di FSH e testosterone quando l'individuo ha raggiunto la pubertà, proseguendo per tutta la vita. Affinchè questo processo possa avvenire correttamente, è necessario che durante le fasi dello sviluppo embrionale e fetale una quota di cellule si differenzino verso la linea germinale e migrino nella gonade futura, dove rimarranno quindi quiescenti fino all’epoca puberale.
La spermatogenesi non è da confondere con la spermiogenesi, che è la terza e ultima fase della spermatogenesi stessa, in cui avviene la differenziazione finale che porta allo sviluppo di spermatozoi maturi.
La spermatogenesi avviene all'interno dei testicoli, più precisamente nei tubuli seminiferi, condotti a fondo cieco che confluiscono nei tubuli seminiferi retti. I tubuli retti finiscono poi per anastomizzarsi nella rete testis, da cui partono 15-20 dotti efferenti, che si immettono nell'epididimo, che continua poi nel dotto deferente. La parete di questi tubuli seminiferi è formata da cellule di sostegno, denominate cellule del Sertoli, e svariate cellule germinali rappresentative delle varie tappe della spermatogenesi; gli elementi più immaturi si localizzano verso l’esterno, in prossimità della membrana basale e man mano che ci si sposta verso il lume tubulare, si possono osservare elementi sempre più maturi (fig 1).

Figura 1. Sezione di tubulo seminifero, contenente cellule in diversi stadi maturativi
Durante la spermatogenesi, l’epitelio germinale interviene con una duplice funzione nel produrre gli spermatozoi:
- genera milioni di spermatozoi ogni giorno (nell’uomo ogni testicolo produce 123 ± 18 x 106 spermatozoi/giorno);
- rimpiazza, di continuo, gli spermatogoni, ovvero quella popolazione cellulare che dà inizio al processo.
È quindi necessaria una costante replicazione cellulare, che garantisca sia cellule indifferenziate di riserva, sia una popolazione di cellule destinate a una completa differenziazione verso lo spermatozoo.
La spermatogenesi inizia con gli spermatogoni, tutti a corredo cromosomico diploide, che costituiscono le cellule più indifferenziate, poste verso la lamina basale del tubulo seminifero; hanno diametro pari a circa 12 micron e si dividono in:
- spermatogoni A: costituiscono le cellule staminali in continua mitosi, che non procedono nel processo differenziativo e si suddividono ulteriormente in:
- spermatogoni A dark (AD): sono cellule staminali o spermatogoni di riserva, situati lontano dal lume del tubulo seminifero; le loro divisioni poco frequenti possono portare o alla formazione di altri spermatogoni A dark o alla creazione di spermatogoni A pale;
- spermatogoni A pale (AP): sono quelli che riproducendosi portano alla formazione di spermatogoni più differenziati, fino ad arrivare agli spermatogoni B;
- spermatogoni B: sono quelli successivi, dal punto di vista maturativo, a quelli di tipo A e costituiscono le cellule progenitrici degli spermatociti.
Gli spermatociti sono le cellule che vanno incontro a meiosi e che quindi, partendo da un corredo cromosomico diploide, generano cellule aploidi. Sono di due tipologie:
- spermatociti primari o di primo ordine: cellule diploidi, derivano direttamente dagli spermatogoni B e vanno incontro alla prima divisione meiotica. Durante questa meiosi la profase dura circa 22-24 giorni;
- spermatociti secondari o di secondo ordine: cellule aploidi con doppi cromatidi, sono il risultato della prima divisione meiotica degli spermatociti primari e andranno incontro alla seconda divisione meiotica.
Dalla seconda divisione meiotica degli spermatociti secondari derivano gli spermatidi, cellule tondeggianti con nucleo più piccolo, che posseggono la vescicola acrosomiale. Gli spermatidi andranno incontro alla spermiogenesi per trasformarsi in spermatozoi maturi (fig 2).

Figura 2. Spermatogenesi
AGOASPIRATO TESTICOLARE
L’agoaspirazione testicolare con ago sottile è stata utilizzata per la prima volta nel 1992 (1) e attualmente viene considerata una metodica adatta allo studio del maschio infertile con azoospermia o grave oligozoospermia, in quanto scarsamente invasiva e facilmente riproducibile. Le applicazioni della metodica riguardano sia la diagnosi, che la prognosi che eventuale recupero di spermatozoi adatti a essere utilizzati per tecniche di procreazione medicalmente assistita (PMA), nonostante alcuni lavori ne rimarchino l’inferiorità rispetto alla micro-dissezione testicolare (2). Da notare come, a tale scopo, risulti di estrema utilità il cosiddetto Testicular Mapping, in analogia con quanto applicabile alla patologia prostatica, che consiste nell’eseguire prelievi testicolari multipli (3) (fig 3).

Figura 3. Mappatura testicolare: i punti neri indicano le sedi di inserzione dell’ago per il prelievo
Tecnica di prelievo
L’agoaspirato deve essere eseguito in entrambi i testicoli, utilizzando un ago sottile con calibro pari a 23 Gauge, che deve essere raccordato a una siringa da 50 mL.
Il paziente deve essere in posizione supina, disteso sul lettino ambulatoriale. Viene disinfettata la cute dello scroto e praticata anestesia con cloruro di etile spray; il testicolo da sottoporre ad agoaspirazione viene fermato manualmente, immediatamente al di sotto della superficie scrotale, e l’ago deve essere inserito tra terzo medio e terzo superiore del testicolo (fig 4).

Figura 4
Di seguito, si procede a ripetute aspirazioni tramite la siringa, fino alla fuoriuscita di materiale tubulare; si procede quindi a estrazione dell’ago e accurata emostasi compressiva con garza sterile. Raramente sono stati riportati casi di spandimenti emorragici e di flogosi, per cui, a titolo precauzionale, il paziente viene lasciato disteso sul lettino per alcuni minuti e quindi gli viene suggerito di evitare sforzi per le successive 24 ore. Nei pazienti che dovessero accusare sintomatologia dolorosa è indicata l’esecuzione di indagine ecografica.
Il materiale prelevato va strisciato su due o più vetrini appositamente contrassegnati con le generalità del paziente e con l’indicazione del lato sul quale è stato eseguito il prelievo. Il materiale strisciato viene lasciato essiccare all’aria per 24 ore e successivamente colorato con May-Grunwald-Giemsa. Se dovesse diventare necessaria una lettura pressochè immediata del preparato, questo va fissato in acetone per pochi minuti e poi colorato.
Per leggere il preparato, viene utilizzato il microscopio ottico, inizialmente con ingrandimento 125x, allo scopo di poter identificare le zone con maggiore rappresentazione cellulare, poi 500x e quindi 1250x, con obiettivo a immersione per la caratterizzazione degli elementi cellulari. L’utilizzo del massimo ingrandimento consente di caratterizzare dal punto di vista morfologico i vari tipi cellulari presenti nel preparato, sia per quanto riguarda le caratteristiche nucleari che citoplasmatiche. A tale scopo, devono essere valutate almeno 200 cellule della serie spermatogenetica (spermatogoni, spermatociti primari e secondari, spermatidi rotondi e allungati, spermatozoi) e tutte le cellule del Sertoli visibili negli stessi campi microscopici, calcolandone le relative percentuali e rapporti. I parametri valutati in tal modo risultano i seguenti:
- indice spermatico (SI): percentuale che si ottiene dal rapporto tra numero di spermatozoi rispetto al totale delle cellule spermatogenetiche;
- indice sertoliano (SEI): percentuale che si ottiene del rapporto tra numero delle cellule del Sertoli rispetto al totale delle cellule spermatogenetiche.
Lettura dello striscio
Con la microscopia ottica è possibile distinguere le cellule del Sertoli dalle cellule della linea spermatogenetica (fig 5).
- Spermatogoni: diametro medio pari a 15-18 micron, citoplasma basofilo rotondeggiante, nucleo voluminoso e più allargato rispetto alle cellule del Sertoli:
- A dark (AD): hanno cromatina intensamente colorata (viola scuro con Giemsa), con area semilunare periferica, più densa e colorata;
- A pale (AP): hanno cromatina pallida, con area periferica più colorata e sono maggiormente differenziati;
- B: hanno cromatina colorata alla periferia del nucleo ma a zolle colorate in regione centrale.
- Spermatociti primari: posseggono diametro nucleare non differente da quello degli spermatogoni, il citoplasma è basofilo, il nucleo ovalare con unico nucleolo eccentrico; la cromatina è intensamente colorata, filamentosa o a zolle, a seconda delle fasi della profase meiotica.
- Spermatociti secondari: diametro medio di 13-14 micron, citoplasma debolmente basofilo, nucleo centrale di dimensioni inferiori rispetto a quelle degli spermatociti primari, cromatina finemente granulare e uniforme.
- Spermatidi:
- Spermatidi rotondi (Sab): nucleo centrale solo parzialmente condensato, tondeggianti o quasi triangolariformi, cromatina finemente granulare, citoplasma basofilo;
- Spermatidi allungati (Scd): cromatina condensata e colorabile, nucleo eccentrico, allungato e triangolare, citoplasma più scuro. Una porzione del citoplasma si stacca nel corso del processo di maturazione e si localizza nel cosiddetto middle-piece; inizia a intravedersi la coda.
- Spermatozoi: completa formazione dell’acrosoma e della coda, hanno talvolta residui citoplasmatici e possono essere privi della coda, a causa dello striscio sul vetrino.
- Cellule del Sertoli: la membrana citoplasmatica di queste cellule può essere facilmente danneggiata durante lo striscio, per cui possono anche sembrare prive di citoplasma. Il nucleo è generalmente rotondo, granulare, con unico nucleolo eccentrico; citoplasma abbondante, triangolare o poligonale, vacuolato.




Figura 5. Preparati citologici del testicolo in cui le frecce colorate indicano i vari tipi cellulari: cellule di Sertoli in blu, spermatociti primari in verde, spermatidi in arancio, spermatozoi in rosso.
QUADRI CLINICI
Normozoospermie
Sono presenti tutte le cellule, con prevalenza delle cellule maggiormente mature rispetto a quelle immature e alle cellule del Sertoli; risultano maggiormente rappresentati gli spermatidi Sab e Scd; spermatociti secondari presentano percentuali analoghe. La percentuale degli spermatozoi non è superiore a quella degli spermatidi. Le cellule del Sertoli rappresentano una percentuale pari a circa il 30-50% del totale delle cellule della spermatogenesi.
| Percentuali dei diversi tipi cellulari nel soggetto normale | |
| Tipo cellulare | Media ± DS |
| Spermatogoni | 2.5 ± 2.2 |
| Spermatociti primari | 6.0 ± 3.6 |
| Spermatociti secondari | 3.9 ± 2.3 |
| Spermatidi Sab | 15.2 ± 5.8 |
| Spermatidi Scd | 37.9 ± 12.9 |
| Indice spermatico (SI) | 34.8 ± 13.3 |
| Indice sertoliano (SEI) | 30.0 ± 19.5 |
Azoospermie
L’agoaspirato testicolare è in grado di distinguere le azoospermie secretive da quelle di natura escretoria, da ostruzione delle vie seminali. Nella cosiddetta Only Sertoli Cells Syndrome, mancano completamente le cellule della linea germinale (fig 6).

Figura 6. Sindrome a sole cellule del Sertoli
Ipospermatogenesi
Sono caratterizzate da marcata riduzione delle cellule della linea germinale, con marcato aumento della percentuale delle cellule del Sertoli (indice SEI). Non è infrequente osservare anomalie della maturazione e fenomeni di arresto maturativo, con incremento percentuale dei cosiddetti “progenitori” degli spermatozoi, con assenza di questi ultimi; il dato può essere confermato anche dagli studi eseguiti con citometria di flusso anche nel solo liquido seminale (4), come pure su preparati citologici. In conseguenza dell’assenza degli spermatozoi, l’indice SI è pari a 0. Nelle forme meno gravi è presente una difficile progressione maturativa e, in conseguenza di questo fenomeno, l'indice spermatico (SI) risulta ridotto ma diverso da 0.

Figura 7. Ipospermatogenesi
Arresti maturativi
In tali casi viene conservato il rapporto tra cellule del Sertoli e cellule della linea spermatogenetica, ma coesiste aumento percentuale delle forme meno mature, quali spermatogoni o spermatociti secondari, a seconda della sede del blocco. Anche in questo caso, stante la fisiologica esfoliazione di queste tipologie cellulari verso il liquido seminale, la citologia di flusso può confermare sia l’arresto che la sua sede.
Azoospermie escretorie
Normale maturazione germinale e non infrequente incremento delle forme mature, espresso da SI.
Oligozoospermie
In analogia con le azoospermie, si possono identificare quadri citologici caratterizzati da ipospermatogenesi e/o blocchi maturativi parziali e quadri anche di parziale ostruzione delle vie seminali.
Arresti maturativi
Ovviamente si osserva un aumento delle forme meno mature a monte del blocco, ma presenza anche di forme mature in vario e ridotto grado (5).
BIBLIOGRAFIA
- Foresta C, Varotto A, Scandellari C. Assessment of testicular cytology by fine needle aspiration as a diagnostic parameter in the evaluation of the azoospermic subject. Fertil Steril 1992, 57: 858-65.
- El-Haggar S, Mostafa T, Abdel Nasser T, et al. Fine needle aspiration vs. mTESE in non-obstructive azoospermia. Int J Androl 2008, 31: 595-601.
- Beliveau ME, Turek PJ. The value of testicular “mapping” in men with obstructive azoospermia. Asian J Androl 2011, 13: 225-30.
- Schiesaro M, Bonanni G, Botteon S, et al. Flow cytometric examination of seminal samples. Int J Androl 1997, 20 suppl 1: 62.
- Foresta C. Citologia testicolare per agoaspirazione nella diagnostica dell’infertilità maschile. Piccin Editore 1992.
Biopsia testicolare
Mauro Giovanni Schiesaro
Ospedale Classificato Villa Salus, Mestre (VE)
La biopsia testicolare rappresenta una parte del processo diagnostico del maschio infertile, anche se, comunque, da essa non è possibile ottenere informazioni riguardanti la possibile eziologia, in quanto conferma l’esistenza di un disturbo della spermatogenesi in soggetti con alterazioni seminologiche e FSH elevato. Risulta comunque fondamentale nella diagnosi differenziale tra azoospermie ostruttive e non ostruttive.
Con l’avvento delle tecniche di procreazione medicalmente assistita, in particolare ICSI, la biopsia testicolare ha visto modificare radicalmente il proprio ruolo, in quanto attualmente rappresenta una procedura finalizzata al recupero di spermatozoi da crio-conservare e utilizzare in percorsi di PMA. In circa il 50-60% dei soggetti con azoospermia non ostruttiva è possibile recuperare spermatozoi e tale percentuale sale a circa il 100% dei soggetti con azoospermia ostruttiva.
Indicazioni
Azoospermia ostruttiva: prima di una correzione chirurgica del difetto ostruttivo, deve essere dimostrata la presenza di normale spermatogenesi.
Recupero di spermatozoi testicolari: solitamente sono necessarie biopsie multiple per il recupero di spermatozoi in soggetti con azoospermia non ostruttiva. Una parte dei campioni può essere usata per l’esame istologico, al fine di predire la possibilità di recupero di spermatozoi e la diagnosi di carcinoma in situ (CIS) del testicolo (1). La micro-dissezione, che verrà descritta in seguito, può ulteriormente aumentare la possibilità di successo nel recupero di spermatozoi (2).
Diagnosi di carcinoma in situ (CIS) del testicolo: fattori di rischio per CIS sono rappresentati da infertilità, criptorchidismo, atrofia testicolare. Inoltre, sono potenziali indicatori di CIS alcune anomalie dell’aspetto ecografico del testicolo, quali microlitiasi testicolare, disomogeneità ecostrutturali del parenchima e lesioni solide.
Tecnica
L’indagine può essere eseguita sia in anestesia locale che generale; solitamente la prima viene utilizzata per un singolo prelievo istologico, mentre la seconda è preferibile in caso di biopsie multiple.
Per una biopsia diagnostica è sufficiente praticare un’incisione scrotale di 2-3 cm, che consente l’esposizione della tonaca albuginea. Viene poi praticata una piccola incisione di circa 0.5 cm, che consente di ottenere un campione bioptico di 3 x 3 x 3 mm, nel quale devono trovarsi almeno 100 tubuli seminiferi (3).
Per quanto riguarda invece la TESE (Testicular sperm extraction), nel tempo sono state sviluppate diverse tecniche di campionamento. In alternativa alla TESE classica, sia essa con prelievo singolo o multiplo (fig 1), che si avvale della descritta biopsia testicolare, si può eseguire la mTESE (TESE microchirurgica), tecnica di lunga durata e che quindi si avvale dell’anestesia generale e dell’esame microscopico diretto del testicolo da biopsiare, una volta che questo viene evaginato e aperto “a libro”, al fine di identificare i tubuli di dimensioni maggiori, nei quali è più probabile il reperimento di spermatozoi. Questa sembra consentire un miglior recupero di spermatozoi (tab 1) e minor danno testicolare (4).
| Tabella 1 Confronto tra TESE e microTESE |
||||
| TESE classica | microTESE | |||
| n | SRR% | n | SRR% | |
| Okada et al | 24 | 17 | 74 | 45 |
| Ramasamy et al | 83 | 32 | 460 | 58 |
| Tsujimura et al | 37 | 35 | 56 | 43 |
| Media | 40 (16-63) | 48 (42-58) | ||
| SRR = sperm retrieval rate | ||||

Figura 1: TESE prelievi multipli

Figura 2: TESE prelievo singolo
Processazione
La maggior parte del campione ottenuto verrà utilizzato per il recupero degli spermatozoi e dovrà essere inviato al laboratorio, dopo essere stato posto in apposito terreno di coltura in condizioni di sterilità. Un piccolo frammento verrà utilizzato per l’esame istologico; per evitare artefatti, utilizzare come fissativo liquido di Bouin o glutaraldeide, evitando accuratamente la formalina.
Interpretazione
Per essere attendibile, la valutazione deve essere eseguita su almeno 25 sezioni trasversali di tubulo seminifero per campione.
L’istologia testicolare è spesso eterogenea, per cui nel caso dovessero essere presenti quadri diversi nelle sezioni di tubulo seminifero, dovrebbero essere descritte le proporzioni di ciascun quadro. Il termine di sclero-ialinosi completa va riservato ai tubuli seminiferi che non presentano epitelio e risultano essere costituiti solo da accumulo di collagene. Per quanto riguarda l’interstizio, si dovrà descrivere il numero delle cellule di Leydig e la presenza di loro eventuali anomalie sia qualitative che quantitative (es. ammassi voluminosi in s. di Klinefelter).
Sono state descritte svariate classificazioni, tutte basate su almeno 5 parametri essenziali della spermatogenesi:
- assenza di tubuli seminiferi (sclerosi tubulare);
- assenza di cellule germinali all’interno dei tubuli seminiferi;
- spermatogenesi incompleta;
- presenza di tutte le cellule della spermatogenesi, spermatozoi inclusi, ma con una riduzione del numero delle cellule germinali (ipospermatogenesi);
- spermatogenesi normale.
Tutti questi quadri (fig 3) possono coesistere nello stesso preparato istologico: questo rappresenta un grande limite nell’attribuzione di un significato diagnostico e prognostico alla biopsia testicolare stessa.

Figura 3: quadri istologici. A = spermatogenesi normale; B = arresto maturativo; C = ipospermatogenesi; D = sindrome a sole cellule del Sertoli; E = scleroialinosi
Una delle classificazioni maggiormente quotate è rappresentata dallo score di Johnsen: in almeno 100 tubuli seminiferi, il livello di maturazione viene graduato tra 1 e 10, in accordo con la cellula germinale più matura presente nel tubulo (6). Lo score totale viene poi calcolato dividendo il punteggio totale per il numero dei tubuli che sono stati valutati. I limiti di questa valutazione risiedono nel fatto che non necessariamente riflette il reale stato della spermatogenesi, in quanto, ad esempio, spermatogenesi assolutamente normale può essere rinvenuta in prossimità di tubuli con un pattern simile a quello di “sole cellule del Sertoli”, con conseguente attribuzione di un giudizio di grave disordine della spermatogenesi. Inoltre, può essere estremamente laborioso e può avere una scarsa ricaduta nella valutazione della fertilità; a tal proposito è stato modificato da Holstein (7), con l’attribuzione dei punteggi riportati in tab 2.
| Tabella 2 Punteggio di Holstein per la biopsia testicolare |
|
| Score | Descrizione |
| 10 | Normale spermatogenesi; numerosi spermatidi maturi e zone di spermiazione |
| 9 | Modesta alterazione della spermatogenesi: numero ridotto di spermatidi maturi, numero minore di zone di spermiazione |
| 8 | Discreta alterazione della spermatogenesi: pochi spermatidi maturi, nessuna zona di spermiazione |
| 7 | Spermatogenesi considerevolmente alterata: nessuno spermatide maturo, solo spermatidi immaturi, nessuna zona di spermiazione |
| 6 | Spermatogenesi alterata in modo severo: solo pochi spermatidi immaturi, riduzione in altezza dell’epitelio seminifero |
| 5 | Arresto della spermatogenesi allo stadio di spermatociti primari: numerosi spermatociti circondano il lume del tubulo seminifero |
| 4 | Arresto della spermatogenesi allo stadio di spermatociti primari: pochi spermatociti primari |
| 3 | Arresto della spermatogenesi allo stadio di spermatogoni: gli spermatogoni di tipo A si moltiplicano, ma non danno luogo alla formazione di altre cellule della spermatogenesi |
| 2 | Nessuna cellula germinale, solo cellule del Sertoli |
| 1 | Assenza di cellule germinali e di cellule del Sertoli: il tubulo seminifero è sostituito da tessuto connettivo |
Biopsia testicolare e orchidopessi
Il criptorchidismo rappresenta il disordine congenito più frequente del tratto genitale maschile, con un’incidenza pari all’1% a un anno di età. Si associa con rischio elevato di infertilità, in particolar modo per i casi di bilateralità, e di neoplasie testicolari, il cui rischio aumenta con l’aumentare dell’età alla quale viene praticato l’intervento. Inoltre il CIS è il precursore di tutte le neoplasie germinali del testicolo e sembra essere già presente alla nascita (8). Per tale motivo alcuni autori (9) raccomandano l’esecuzione di una biopsia testicolare durante orchidopessi negli adolescenti. La biopsia testicolare sembrerebbe utile anche come indicatore prognostico per la futura fertilità, in quanto, in un gruppo di pazienti sottoposti a biopsia testicolare durante orchidopessi per criptorchidismo monolaterale, il riscontro all’analisi istologica di spermatogoni AD è indicativo di una migliore spermatogenesi rispetto ai soggetti nei quali questi spermatogoni non vengono repertati. Analoghi risultati si sono osservati anche nei soggetti trattati per criptorchidismo bilaterale (10).
Biopsia testicolare e lesioni non palpabili del testicolo
Mentre per le lesioni apprezzabili palpatoriamente a livello testicolare il rischio di malignità risulta essere particolarmente elevato, il riscontro ecografico di altre anomalie testicolari, quali la microlitiasi o altro tipo di lesione nodulare non palpabile, rappresenta quadri di frequente riscontro in soggetti studiati per infertilità e può essere considerato fattore di rischio per neoplasia testicolare. Vari studi al proposito suggeriscono di seguire periodicamente i pazienti con lesioni inferiori al centimetro e di sottoporre a biopsia le masse che dimostrino tendenza all’aumento volumetrico o in presenza di ulteriori fattori di rischio per neoplasia del testicolo (10-12).
Carcinoma in situ del testicolo
Il tumore a cellule germinali del testicolo rappresenta la neoplasia più frequente nei maschi di razza caucasica in età compresa tra i 20 e i 34 anni; di contro, però, la sopravvivenza media corrisponde al 97% a un anno e al 93% a 5 anni. Il 23% dei pazienti ha lesioni metastatiche già presenti alla diagnosi. Il precursore del tumore a cellule germinali del testicolo è rappresentato dal Carcinoma in situ o CIS (fig 4). Il passaggio da CIS a neoplasia invasiva richiede solitamente un periodo di circa 7 anni nel 70% dei casi. CIS può essere trattato con successo sia con orchiectomia monolaterale che con radioterapia. Inoltre, dal 2 al 5% dei soggetti con neoplasia testicolare monolaterale, può essere portatore di lesione tipo CIS nel testicolo controlaterale, che nel tempo può evolvere in neoplasia invasiva.

Figura 4: CIS
CIS può essere diagnosticato unicamente con la biopsia testicolare, sebbene vi siano esperienze che dimostrino l’utilità del riconoscimento immunocitochimico nel seme delle proteine OCT3/4 o di aneuploidia cellulare con citometria di flusso (13). Secondo quanto suggerito dall’European Germ Cell Cancer Consensus Group (14), a tutti i soggetti con fattori di rischio per la presenza di neoplasia, cioè criptorchidismo e anomalie ecografiche, deve essere garantita la biopsia, anche nel testicolo apparentemente sano, mentre non sembrerebbe indicata una biopsia routinaria per il riscontro di microlitiasi testicolare nelle indagini ecografiche eseguite per lo studio dell’infertilità.
Dal punto di vista pratico, può essere applicato il seguente algoritmo, proposto di recente (15):

Bibliografia
- Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999, 14: 131-5.
- Okada H, Dobashi M, Yamazaki T, et al. Conventional versus microdissection testicular sperm extraction for non obstructive azoospermia. J Urol 2002, 168: 1063-7.
- Berthelsen JG, Skakkebaek NE. Value of testicular biopsy in diagnosing carcinoma in situ testis. Scand J Urol Nephrol 1981, 15: 165-8.
- Dohle GR, Elzanaty S, Van Casteren NJ. Testicular biopsy: clinical practice and interpretation. Asian J Androl 2012, 14: 88-93.
- Ishikawa T, Yamaguchi K, Chiba K, et al. Serum hormones in patients with nonobstructive azoozpermia after microdissection testicular sperm extraction. J Urol 2009, 182: 1495-9.
- Johnsen SG. Testicular biopsy score count - a method for registration of spermatogenesis in human testis: normal values and results in 335 hypogonadal males. Hormones 1970, 1: 2-25.
- Holstein AF, Schulze W, Davidoff M. Understanding spermatogenesis is a prerequisite for treatment. Reprod Biol Endocrinol 2003, 1: 107.
- Honecker F, Stoop H, De Krjger RR, et al. Pathobiological implications of the expression of markers of testicular carcinoma in situ by fetal germ cells. J Pathol 2004, 203: 849-57.
- Dohle GR, Jungwirth A, Colpi G, et al. European Association of Urology Guidelines on Male Infertility. 2010 ed. EAU, Arnhem, 2010: pp 1-70.
- Hadziselimovic F, Hoecht B. Testicular histology related to fertility outcome and postpubertal hormone status in cryptorchidism. Klin Padiatr 2008, 220: 302-7.
- Toren PJ, Roberts M, Lecker I, et al. Small incidentally discovered testicular masses in infertile men – is active surveillance the new standard of care? J Urol 2010, 183: 1373-7.
- Eifler JB, King P, Schlegel PN. Incidental testicular lesions found during infertility evaluation are usually benign and may be managed conservatively. J Urol 2008, 180: 261-4.
- Botteon S, Calcagno A, Motta RG, Schiesaro M. Flow cytometry of seminal plasma in hypogonadotropic hypogonadism at the beginning of therapy. Int J Androl 1996, 19 suppl 1: 37.
- Schmoll HJ, Souchon R, Krege S, et al. European consensus on diagnosis and treatment of germ cell cancer: a report of the European Germ Cell Cancer Consensus Group (EGCCCG). Ann Oncol 2004, 15: 1377-99.
- Van Casteren NJ, Looijenga LH, Dohle GR. Testicular microlithiasis and carcinoma in situ overview and proposed clinical guideline. Int J Androl 2009, 32: 279-87.
Criptorchidismo
Alberto Ferlin
Università di Padova, Dipartimento di Medicina, UOC Andrologia e Medicina della Riproduzione
DEFINIZIONE E CLASSIFICAZIONE
Per criptorchidismo si intende l’assenza di uno o entrambi i testicoli nella borsa scrotale alla nascita, con arresto lungo il fisiologico tragitto di discesa dall’addome. Sebbene il criptorchidismo sia spesso considerato una patologia di lieve entità, in realtà esso rappresenta l’anomalia congenita più frequente dell’apparato urogenitale ed è il più importante fattore di rischio per infertilità e tumore testicolare in età adulta. Una diagnosi precoce e una corretta gestione del testicolo criptorchide sono pertanto necessari, soprattutto per preservare la fertilità, eseguire un corretto counselling e follow-up del paziente e per ridurre il rischio di trasformazione neoplastica dei testicoli e l’eventuale insorgenza di ipogonadismo.
Il criptorchidismo è bilaterale in un terzo dei casi e monolaterale nei due terzi. I testicoli criptorchidi vengono classificati in base alla loro posizione lungo il tragitto di discesa (sede addominale alta/bassa, inguinale, sovra-scrotale, alto-scrotale) e vengono quindi distinti dai testicoli ectopici, che sono localizzati al di fuori della fisiologica via di discesa. Tuttavia, nella pratica clinica e per indirizzare la terapia risulta utile anche una semplice distinzione tra testicoli palpabili e non palpabili e tra forme bilaterali e monolaterali. Una condizione particolare è rappresentata dall’assenza di uno o entrambi i testicoli, condizione nota come anorchia o sindrome del testicolo evanescente.
Il criptorchidismo può essere un’anomalia isolata o più raramente si può associare ad altre malformazioni dell’apparato uro-genitale o può far parte di sindromi genetiche più complesse. Il criptorchidismo va anche distinto dal testicolo retrattile (testicolo normalmente disceso alla nascita, che risale in canale inguinale e può essere riportato manualmente in sede scrotale, da dove risale per riflesso cremasterico), dal criptorchidismo acquisito (testicolo normalmente disceso alla nascita e poi risalito in canale inguinale, da dove non è più riposizionabile manualmente nello scroto) e dal testicolo mobile (testicolo non criptorchide alla nascita, che si muove facilmente per effetto del muscolo cremastere fuori dal sacco scrotale, ma vi ritorna altrettanto facilmente).
| Tabella 1 Classificazione dei difetti di posizione testicolare |
|
| Testicolo in sede | In posizione scrotale, che non risale mai nel canale inguinale, nemmeno per riflesso cremasterico o con manipolazione |
| Criptorchidismo congenito | Assenza di uno o entrambi i testicoli nello scroto, per arresto lungo il fisiologico tragitto di discesa testicolare |
| Testicolo in ascensore (ascending testis o criptorchidismo acquisito) | Testicolo non criptorchide alla nascita o testicolo criptorchide disceso spontaneamente e poi risalito stabilmente in canale inguinale (difficile manipolazione) |
|
Gliding testis |
Appena sotto l’anello inguinale esterno e posizionabile manualmente solo in sede alto-scrotale, da dove risale immediatamente |
| Testicolo retrattile o alto-scrotale | In posizione scrotale alta, posizionabile manualmente in sacca scrotale, dove può rimanere per un certo periodo, e retrattile in sede alta per riflesso cremasterico |
| Testicolo mobile o migrante | In posizione scrotale, risale in canale inguinale spontaneamente (riflesso cremasterico, rapporti sessuali, freddo, ecc) o con manipolazione e ritorna in sacca scrotale spontaneamente o con manipolazione |
| Testicolo ectopico | Assenza di uno o entrambi i testicoli nello scroto, con localizzazione al di fuori del fisiologico tragitto di discesa testicolare |
CENNI DI EMBRIOLOGIA
La discesa del testicolo durante la vita fetale, dalla posizione originaria in prossimità del rene fino alla borsa scrotale, è un meccanismo complesso che richiede l’interazione di fattori anatomici, meccanici e ormonali. Si distinguono due fasi principali:
- trans-addominale (tra la 10° e la 23° settimana gestazionale), che porta il testicolo in prossimità dell’orifizio inguinale interno;
- inguino-scrotale (dalla 26°-28° settimana fino alla nascita), che porta il testicolo nella sua posizione definitiva nella borsa scrotale omolaterale.
La discesa del testicolo è regolata da due ormoni principali, prodotti dalle cellule di Leydig: Il testosterone, oltre a essere il principale ormone per lo sviluppo sessuale in senso maschile del feto e per il corretto sviluppo degli organi genitali esterni, è il maggior attore della fase inguino-scrotale della discesa testicolare; l’INSL3 è il maggior responsabile della fase trans-addominale. È di ausilio in questo processo l’ormone anti-mulleriano (AMH) prodotto dalle cellule di Sertoli, che provoca la regressione dei dotti di Müller.
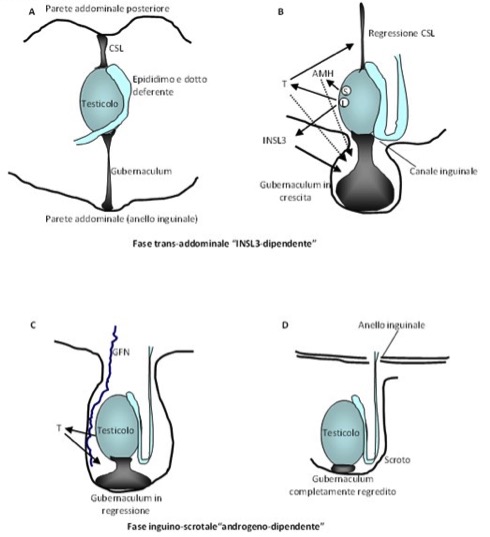
Figura 1. Schema della discesa testicolare.
(A) La differenziazione della gonade indifferenziata in presenza del cromosoma Y porta alla produzione di AMH dalle cellule di Sertoli (S) e di testosterone e INSL3 dalle cellule di Leydig
(B) L’effetto diretto e indiretto (attraverso il nervo genito-femorale – GNF – e il CGRP) di questi 2 ormoni, principalmente sul legamento sospensore craniale (CSL) e sul gubernaculum, è alla base del processo bifasico di discesa testicolare.
(C) La regressione del CSL è soprattutto sotto il controllo del testosterone, mentre INSL3 agisce principalmente sul gubernaculum, sul quale agiscono in misura minore AMH e testosterone, verosimilmente attraverso il GNF.
EPIDEMIOLOGIA
Il criptorchidismo interessa circa il 3-5% dei bambini nati a termine e il 9-30% dei pre-termine. Anche il basso peso alla nascita è un importante fattore di rischio: la prevalenza nei nati con peso < 2.5 kg è di circa il 20-25%. L’incidenza del criptorchidismo sembra essere aumentata negli ultimi decenni, soprattutto in alcuni paesi, probabilmente come conseguenza dell’esposizione a fattori ambientali con attività simil-ormonale, soprattutto di tipo estrogenico e/o anti-androgenico.
Circa la metà dei testicoli criptorchidi alla nascita discende spontaneamente entro i 4-6 mesi di vita, soprattutto nei nati pre-termine, e pertanto la prevalenza del criptorchidismo a un anno di vita è circa l’1-2%. La terapia dei testicoli criptorchidi non dovrebbe pertanto iniziare prima del 4°-6° mese.
EZIOPATOGENESI
Le cause del criptorchidismo sono molteplici (tab 1), ma nella maggior parte dei casi non si riscontrano fattori eziologici certi. I fattori di rischio più importanti sono rappresentati dalla prematurità e dal basso peso alla nascita, ma sembrano avere un ruolo anche il diabete in gravidanza e il fumo.
Il criptorchidismo può anche far parte del corteo sindromico di molte malattie genetiche complesse, la cui incidenza è comunque molto bassa.
| Tabella 2 Cause principali di criptorchidismo |
|||
| Cause | Tipi | Commenti | |
| Idiopatiche | Fattori di rischio maggiori: basso peso alla nascita, prematurità, piccolo per età gestazionale (SGA) | ||
| Endocrine | Ipogonadismo ipogonadotropo (idiopatico, sindrome di Kallmann, altri difetti genetici) Ipogonadismo ipergonadotropo |
Non sono frequenti, ma alcuni autori sostengono che tutti i bambini criptorchidi abbiano un certo grado di ipogonadismo relativo | |
| Genetiche | Monogeniche | Mutazioni del gene INSL3 e del suo recettore (RXFP2) Mutazioni del gene per il recettore degli androgeni |
Circa il 5-10% dei casi non associati ad altre anomalie dell’apparato uro-genitale; più frequenti nei casi di criptorchidismo bilaterale, non si associano a discesa spontanea dei testicoli dopo la nascita |
| Cromosomiche e sindromi genetiche complesse | S. di Klinefelter S. del maschio 46,XX S. da insensibilità periferica agli androgeni S. di Down S. di Noonan S. di Beckwith-Wiedemann S. di Prader-Willi FG syndrome (o s. di Opitz-Kaveggia) Del 22q11.2 Del 1p36 |
||
| Fattori materni | Diabete Fumo Alcool Assunzione in gravidanza di sostanze ad attività estrogenica o anti-androgenica |
||
| Anomalie anatomiche | Impervietà del canale inguinale Ernia inguinale Brevità del funicolo spermatico |
Frequenti | |
DIAGNOSI
La diagnosi è volta soprattutto a differenziare il criptorchidismo dalle altre anomalie di discesa e posizione del testicolo, soprattutto dall’anorchia e dall’ectopia.
L’anamnesi e l’esame obiettivo possono abbastanza facilmente individuare il testicolo mobile, testicolo che discende spontaneamente nello scroto e risale nel canale inguinale per effetto della trazione del muscolo cremastere. Nella maggior parte di questi casi non è necessaria nessuna terapia, ma il bambino potrà essere controllato annualmente per assicurarsi che la situazione si regolarizzi spontaneamente e in maniera definitiva all'epoca dello sviluppo puberale.
L'esame obiettivo è indirizzato all’individuazione della posizione del testicolo, del suo volume e consistenza e della sua mobilità verso il sacco scrotale. Quando non si riesce a palpare il testicolo e quindi bisogna differenziare tra criptorchidismo, ectopia e anorchia congenita, sono necessari ulteriori accertamenti. L’anorchia congenita bilaterale può essere sospettata per la frequente coesistenza di micropene e di marcata ipoplasia dello scroto e va poi confermata con un test con hCG, che documenta un’assente risposta del testosterone.
Utile come esame di primo livello è anche l’ecografia testicolare e solo quando il testicolo non è dimostrabile nemmeno con tale indagine, si può ricorrere alla RMN o, meglio ancora, alla laparoscopia o esplorazione chirurgica. L'esplorazione chirurgica è di regola determinante per distinguere fra l'agenesia di un solo testicolo e un criptorchidismo monolaterale completo.
Solamente in alcuni casi (criptorchidismo bilaterale con testicoli non palpabili, associato o meno a ipospadia, micropene o genitali ambigui) è necessario un approfondimento endocrinologico e genetico, che include cariotipo, dosaggi ormonali (testosterone, LH, FSH, 17-OH-progesterone, o altre indagini ormonali secondo l’indicazione clinica); i test al GnRH e all’hCG sono necessari solo in una minoranza di casi.
L’analisi genetica del gene per il recettore degli androgeni, il gene INSL3 ed il suo recettore (RXFP2) possono essere utili anche nei casi di criptorchidismo monolaterale. In casi selezionati potranno essere utili altre analisi genetiche in base al sospetto clinico (per esempio analisi dei geni dell’ipogonadismo ipogonadotropo).
TERAPIA
La correzione del criptorchidismo ha lo scopo di riportare i testicoli nella loro sede fisiologica, soprattutto per prevenire (o quantomeno ridurre) la degenerazione della funzione testicolare e l’insorgenza di tumori del testicolo o quantomeno renderne più agevole la diagnosi precoce. Inoltre, il trattamento del testicolo criptorchide ha anche risvolti psicologici legati alla presenza di uno scroto vuoto.
La correzione del criptorchidismo è attualmente raccomandata entro il secondo anno di vita, meglio se entro l’anno e mezzo. La terapia ideale del criptorchidismo è chirurgica (orchidopessi), essendo ormai la terapia farmacologica (hCG in associazione o meno con hMG, GnRH in associazione o meno con hMG) considerata priva di evidenze di efficacia e ad alto rischio di recidiva. L’intervento chirurgico ha successo definitivo in più del 95% dei casi, con una bassa incidenza (1%) di complicanze.
FOLLOW-UP
Rischio di infertilità
Uomini con storia di criptorchidismo sono frequentemente infertili e una storia di criptorchidismo si riscontra in circa il 10% dei soggetti infertili e nel 20% di quelli azoospermici. Generalmente i danni alla spermatogenesi sono più gravi nelle forme di criptorchidismo bilaterale e addominale. Tuttavia, anche nei casi di criptorchidismo monolaterale ci può essere un danno spermatogenetico nel testicolo controlaterale. In media, circa il 70-80% dei soggetti con criptorchidismo bilaterale e il 40-50% dei soggetti con criptorchidismo monolaterale presenta oligozoospermia o azoospermia.
L’età all’orchidopessi ha influenza sul successivo deterioramento della spermatogenesi. L’orchidopessi precoce però, seppur in grado di ridurre il rischio di infertilità, non lo annulla.
Secondo queste considerazioni è utile informare i soggetti con criptorchidismo (e i familiari) circa il rischio di infertilità in età adulta ed eseguire controlli periodici del liquido seminale dai 16-18 anni, con eventuale crio-conservazione dello stesso prima che il danno spermatogenetico progressivo sia definitivo.
Rischio di tumore testicolare
Il criptorchidismo rappresenta uno dei principali fattori di rischio per il tumore testicolare, essendo il rischio relativo 4-8 volte superiore rispetto alla popolazione generale e maggiore per i casi di criptorchidismo bilaterale e per i casi di criptorchidismo addominale. Circa il 5-10% dei casi di tumore testicolare (tumori a cellule germinali) insorge in soggetti ex-criptorchidi. Nei casi di criptorchidismo monolaterale, si può sviluppare tumore anche nel testicolo controlaterale (nel 15-20% dei casi).
Pertanto, è opportuno eseguire un follow-up dei soggetti con storia di criptorchidismo, tenendo presente che il tumore del testicolo ha un picco di incidenza tra i 15 e i 40 anni e il rischio di tumore anche nel testicolo controlaterale nei casi di criptorchidismo monolaterale. In tal senso può essere utile informare i ragazzi ex-criptorchidi (e i familiari) circa l’utilità dell’auto-palpazione dei testicoli ed eseguire controlli clinici periodici con cadenza annuale (visita, ecografia testicolare).
Rischio di ipogonadismo
Sia nei casi di criptorchidismo bilaterale (più frequentemente) che monolaterale (più raramente) esiste spesso un danno testicolare bilaterale, progressivo nel tempo, non completamente influenzato anche da un’orchidopessi precoce, che coinvolge sia la componente spermatogenetica che endocrina. I soggetti con criptorchidismo pertanto, indipendentemente dalla sua gravità e timing di correzione, dovrebbero essere considerati soggetti ad alto rischio di ipogonadismo, opportunamente informati di conseguenza e seguiti nel tempo, dallo sviluppo puberale (possibilità di ritardo puberale, ginecomastia) in poi, con monitoraggio della crescita testicolare e dosaggi ormonali.
| Tabella 3 Management e follow-up del criptorchidismo |
||
| Età | Cosa fare |
Persone coinvolte |
| Nascita | Esaminare la posizione dei testicoli, distinguere le diverse forme di anomalie di discesa e posizione, valutare malformazioni associate per possibile DSD Notare età gestazionale, peso alla nascita, SGA Possibili fattori materni (diabete, disruptors/farmaci) Counselling ai genitori |
Pediatra/endocrinologo pediatrico Chirurgo/urologo pediatrico Genetista Genitori |
| 6-12 mesi | Verificare discesa spontanea ed eventuale criptorchidismo acquisito Considerare dosaggio FSH, LH, testosterone, AMH, test con hCG nel caso di testicoli non palpabili Considerare cariotipo, analisi genetica INSL3, RXFP2, AR, geni per ipogonadismo ipogonadotropo o altre analisi genetiche selezionate Considerare esplorazione chirurgica Programmare orchidopessi entro i 2 anni Counselling ai genitori |
Pediatra/endocrinologo pediatrico Chirurgo/urologo pediatrico Genetista Pediatra di libera scelta Genitori |
| Pre-pubertà | Esame obiettivo dei testicoli a ogni visita pediatrica Counselling ai genitori |
Pediatra di libera scelta Genitori |
| Pubertà | Monitorare sviluppo puberale e testicolare + eventuali approfondimenti specifici Counselling al paziente e genitori |
Pediatra/endocrinologo pediatrico Pediatra di libera scelta Paziente e genitori |
| 16-18 anni | Transizione all’endocrinologo dell’adulto/andrologo per valutazione della funzione gonadica (esame del liquido seminale + ev. crio-conservazione e approfondimenti specifici; ecografia testicolare; FSH, LH, testosterone; ecc) Counselling al paziente e genitori: auto-palpazione, rischio di infertilità, tumori e ipogonadismo |
Endocrinologo dell’adulto/andrologo Paziente e genitori |
| > 18 anni | Esame obiettivo dei testicoli alle visite MMG e sportive Presa in carico da parte dell’endocrinologo dell’adulto/andrologo per follow-up annuale |
MMG, medici sportivi Endocrinologo dell’adulto/andrologo Paziente |
BIBLIOGRAFIA
- Abaci A, et al. Epidemiology, classification and management of undescended testes: does medication have value in its treatment? J Clin Res Pediatr Endocrinol 2013, 5: 65-72.
- Bay K, et al. Testicular descent: INSL3, testosterone, genes and the intrauterine milieu. Nat Rev Urol 2011, 8: 187-96.
- Ferlin A, et al. Genetic alterations associated with cryptorchidism. JAMA 2008, 300: 2271-6.
- Foresta C, et al. Role of hormones, genes, and environment in human cryptorchidism. Endocr Rev 2008, 29: 560-80.
- Hutson JM, et al. Cryptorchidism. Semin Pediatr Surg 2010, 19: 215-24.
- Kolon TF, et al. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol 2014, 192: 337-45.
- Lee PA, et al. Cryptorchidism. Curr Opin Endocrinol Diabetes Obes 2013, 20: 210-6.
- Ritzén EM. Undescended testes: a consensus on management. Eur J Endocrinol 2008, 159 suppl 1: S87-90

