Terapia della PCOS in età fertile
Giovanna Spiazzi
Endocrinologia e Malattie Metaboliche, AOU Integrata di Verona
(aggiornato a settembre 2024)
Il trattamento della PCOS dovrebbe tener conto sia delle problematiche di interesse immediato per la paziente che di quelle a lungo termine, non prescindendo mai dal miglioramento dello stile di vita, che viene riconosciuto come elemento strategico nella gestione di questa patologia. Questo approccio è fondamentale, in particolare in presenza di eccesso di peso, meno chiari sono i benefici quando il peso è nella norma.
Il trattamento di sovrappeso/obesità o semplicemente dell’alterata composizione corporea costituisce una strategia chiave in queste donne, per i benefici attesi sulla qualità della vita oltre che sull'insulino-resistenza, con potenziali effetti positivi sugli aspetti psicologici oltre che su quelli metabolici e riproduttivi (1). Le più recenti LG (2) non suggeriscono l’utilizzo di una dieta specifica, dato che mancano adeguate evidenze in questo senso, ma raccomandano genericamente una dieta equilibrata, basata sugli obiettivi personali e sulle preferenze individuali, supportata quando necessario da professionisti sanitari qualificati.
Anche per quanto riguarda il volume e il tipo di attività fisica non vi sono indicazioni specifiche, ma si raccomanda di evitare uno stile di vita sedentario e si rinvia a quanto suggerito nella popolazione generale, anche in questo caso per la mancanza di adeguate evidenze specifiche per la patologia. Se lo scopo è prevenire l’aumento di peso e mantenersi in salute, è raccomandato un minimo settimanale di 150 minuti di attività fisica di moderata intensità o di 75 minuti di attività vigorosa, suddivisi in almeno tre giorni/settimana e con l’inclusione di attività di potenziamento muscolare in due giorni non consecutivi della settimana. Se lo scopo è un moderato calo di peso, è raccomandato un minimo settimanale di 250 minuti di attività fisica di moderata intensità o di 150 minuti di attività vigorosa aerobica o una combinazione delle due tipologie di attività, sempre associate con attività di potenziamento muscolare in due giorni non consecutivi della settimana. L’uso della tecnologia (conta-passi, applicazioni smartphone) può essere di supporto motivazionale. Viene sottolineato che in queste strategie la terapia comportamentale è fondamentale nel conseguire risultati a lungo termine. Deve essere, inoltre, posta attenzione anche in questa ottica alla cura degli aspetti psico-sociali, proponendo, quando necessario, l’utilizzo di psico-terapia e di terapia ansiolitica e anti-depressiva.
Terapia estetica e farmacologica delle manifestazioni fenotipiche
Le procedure estetiche sono uno strumento ampiamente utilizzato, con minimo rischio di effetti avversi in mani esperte. Sono in particolare indispensabili nel trattamento dell’irsutismo. Le tecniche più efficaci appaiono essere la terapia laser e quella con luce pulsata, anche se la letteratura sugli effetti a lungo termine di questi strumenti resta molto limitata (3). Maggiori dettagli su queste procedure sono reperibili in un’altra sezione di Endowiki. Nelle donne con PCOS, rispetto a quelle con altre cause di irsutismo, è spesso necessario un numero di sessioni maggiore per ottenere risultati soddisfacenti e i risultati vengono potenziati dalla combinazione con farmaci.
L’approccio farmacologico alla PCOS è ancora essenzialmente sintomatico e fa spesso ricorso a farmaci non approvati per questo utilizzo. La terapia va in ogni caso sempre discussa con la paziente e “ritagliata” sulle manifestazioni fenotipiche e sulle alterazioni che la paziente avverte e il medico ritiene di maggior rilevanza nel caso specifico.
La prima scelta, in assenza di controindicazioni, è rappresentata da un contraccettivo orale combinato (COCP) (2). La terapia estro-progestinica è in particolare la terapia di scelta, secondo quanto riportato dalle LG, per la gestione dell’irsutismo e/o delle irregolarità mestruali nelle donne con PCOS. Eventuali controindicazioni a tale tipologia di farmaci vanno valutate sulla base delle indicazioni per la popolazione generale (4), dato che anche in questo caso non ci sono adeguate informazioni patologia-specifiche. Va ricordato che gli estro-progestinici possono esercitare un potenziale effetto negativo anche su taluni aspetti metabolici, in particolare la sensibilità insulinica e i livelli di trigliceridi, e sulla base di dati osservazionali ottenuti in ampie popolazioni generali comportano un piccolo ma significativo incremento del rischio cardio-vascolare (CV), soprattutto con i progestinici di seconda generazione (come il levonorgestrel), e in modo particolare di quello trombo-embolico, soprattutto con quelli di terza generazione (come desogestrel e gestodene), drospirenone e ciproterone acetato (5,6). Il fumo, l’età e l’eccesso ponderale incrementano questi rischi, che devono essere tenuti presenti. La COCP è comunque indicata in queste pazienti perché regolarizza (anche se artificialmente) il ciclo mestruale, contrasta il rischio potenziale di iperplasia e neoplasia endometriale, garantisce la contraccezione, spesso opportuna data la difficoltà di prevedere eventuali ovulazioni, in modo particolare quando si associno farmaci anti-androgeni, ed esercita un effetto favorevole sull’acne e, più modesto, sull’irsutismo.
Le recenti LG 2023 suggeriscono di preferire in linea generale formulazioni contenenti estrogeni naturali o etinilestradiolo a basse concentrazioni (20-30 μg/die), valutando il bilancio tra efficacia, profilo di rischio metabolico e CV, effetti collaterali, costo e disponibilità. La combinazione etinilestradiolo 35 μg + ciproterone acetato 2 mg viene indicata come seconda scelta rispetto ad altre formulazioni, in rapporto ai potenziali effetti avversi, in particolare trombo-embolici. La minipillola con solo progestinico viene indicata come soluzione alternativa utilizzabile per la protezione endometriale, pur in assenza, ancora una volta, di adeguati studi nelle donne con PCOS (2). L’utilizzo in questi preparati di progestinici ad azione anti-androgena non riceve specifica attenzione nelle attuali LG, in mancanza di evidenze che ne sostengano l’effettiva utilità. La scelta del drospirenone come progestinico, in particolare, gode attualmente di una certa popolarità, soprattutto per l’azione anti-androgena propria di questa sostanza, ma non vi sono studi controllati che documentino una maggior efficacia delle combinazioni che lo contengono. Inoltre, l’effetto anti-androgeno atteso è in realtà modesto alle dosi presenti nei contraccettivi.
Un approccio terapeutico completamente diverso, in queste pazienti, è quello basato sui farmaci insulino-sensibilizzanti, in particolare la metformina, che è in grado di migliorare non solo le alterazioni metaboliche ma, in molti casi, anche le alterazioni riproduttive tipiche di queste donne. Una frazione significativa delle donne con PCOS riprende, infatti, ad avere cicli regolari e ovulatori durante terapia con metformina (7). Resta ancora oscuro se questo risultato dipenda dall’attenuazione, comunque parziale, dell’insulino-resistenza o da altri meccanismi. Scarsi sono invece i risultati che si possono avere con questo farmaco in termini di miglioramento dell’irsutismo, anche se la letteratura in proposito è di qualità assai modesta (8). Le LG 2023 suggeriscono di considerare la metformina terapia di prima linea nelle donne con BMI > 25 kg/m2 per gli esiti antropometrici e metabolici (2), ma è un’opzione utilizzabile anche nelle donne con valori di BMI inferiori, pur in presenza di evidenze meno chiare. La metformina può essere anche combinata con gli estro-progestinici per la terapia complessiva delle problematiche cliniche di queste pazienti, alterazioni mestruali, irsutismo e problemi metabolici, in particolare nella paziente obesa e/o ad alto rischio di diabete tipo 2 (2). Quando viene prescritta, è sempre consigliabile raccomandare l’assunzione della metformina a stomaco pieno e iniziare con basse dosi, non > 500 mg/die, per ridurre il rischio di effetti collaterali gastro-enterici, incrementando la posologia ogni 1-2 settimane, fino al dosaggio massimo di 2.5 g/die. Va ricordata la possibile insorgenza (specie in pazienti con DM, sottoposte a chirurgia bariatrica, vegane, ecc) di carenza di vitamina B12, che va ricercata e trattata se presente.
Da alcuni anni si discute l’efficacia, in queste pazienti, di integratori alimentari a base di inositolo, in una delle sue isoforme disponibili, da solo o in associazione con acido folico e/o altre sostanze, con l’obiettivo principale di esercitare potenziali effetti favorevoli sulla sensibilità insulinica. I dati relativi alla potenziale efficacia di questa strategia sugli aspetti metabolici e riproduttivi sono però ancora molto limitati ed è in ogni caso da considerarsi uno strumento di minor efficacia clinica rispetto alla metformina, anche se privo di effetti gastro-intestinali avversi. Al momento la letteratura disponibile non permette di suggerire specifici dosaggi, tipologie di preparato o combinazioni nell’utilizzo di questi integratori (2).
Il pioglitazone, farmaco insulino-sensibilizzante della categoria dei tiazolidinedioni, ha pure dimostrato benefici sugli aspetti riproduttivi, ma gli studi sono assai scarsi e limitati e il farmaco presenta un profilo di sicurezza incerto in relazione all’obiettivo di ripristinare la capacità ovulatoria. Le LG attuali non fanno menzione di questa possibilità terapeutica, che deve essere considerata sperimentale.
I farmaci anti-obesità, come gli agonisti GLP-1 (liraglutide, semaglutide) e l’orlistat possono essere utilizzati in queste pazienti, come nella popolazione generale, per trattare l’obesità, sempre in associazione con le azioni di miglioramento dello stile di vita e assicurando ove necessario adeguata copertura contraccettiva, quando si utilizzino i GLP-1R agonisti, dati i rischi potenziali di questi farmaci sul prodotto del concepimento. Vi sono segnalazioni promettenti che gli analoghi del GLP-1 possano portare anche alla regolarizzazione del ciclo mestruale, attraverso il calo ponderale e forse altri meccanismi (9). Il loro utilizzo a fini riproduttivi è però da considerarsi sperimentale. Anche la chirurgia bariatrica può essere presa in considerazione in queste donne, anche in questo caso secondo le LG della popolazione generale.
Una categoria di farmaci ampiamente utilizzata in queste pazienti è quella degli anti-androgeni. Vanno presi in considerazione, secondo le più recenti LG, sempre in combinazione con un'efficace contraccezione, dopo almeno sei mesi di terapia con COCP e/o trattamento estetico con risposta clinica subottimale (2). Nella scelta va in ogni caso privilegiata la sicurezza di utilizzo. Sotto questo profilo è possibile utilizzare con sufficiente tranquillità lo spironolattone, antagonista recettoriale degli androgeni (oltre che dell’aldosterone), alla posologia di 25-100 mg/die.
Il ciproterone acetato può essere prescritto in dosi elevate (> 10 mg/die), superiori a quelle presenti nei COCP che lo contengono, per sfruttare meglio la sua azione anti-androgena. È però un’opzione attualmente sconsigliata in rapporto ai suoi rischi potenziali, che includono l’insorgenza di meningioma. Per la sua potente azione progestinica deve essere in ogni caso sempre combinato, anche a dosaggi inferiori, con gli estrogeni.
Una potenziale alternativa è la finasteride, inibitore della 5 alfa-reduttasi senza effetti collaterali di rilievo. La flutamide e la bicalutamide, antagonisti non-steroidei del recettore androgenico, sono potenzialmente molto efficaci, ma hanno purtroppo un rischio di possibile epato-tossicità, non frequente ma talora assai grave (10), che deve essere tenuto presente.
Va ricordato che la valutazione dell’efficacia di un trattamento anti-androgeno richiede almeno 6 mesi di terapia e che si tratta sempre (in Italia) di trattamenti off-label, fatto salvo l’utilizzo di combinazioni estro-progestiniche pre-formulate contenenti basse dosi di ciproterone acetato.
Terapia dell’infertilità
Va ricordato che nelle donne con PCOS la gravidanza può essere in molti casi ottenuta in modo naturale, anche se con qualche ritardo rispetto a quanto accade nella popolazione generale (11). Spesso è però necessario o conveniente, in rapporto all’età e all’attesa, ricorrere a strumenti farmacologici.
Se il desiderio della paziente è concepire e vi è eccesso ponderale, vanno in primis messe in atto misure di miglioramento dello stile di vita per mitigare gli effetti avversi della sindrome e dell’eccesso di peso sulla fertilità, migliorare l’esito delle terapie pro-fertilità e minimizzare i rischi di complicanze durante la gravidanza.
La terapia farmacologica di prima scelta per l’induzione della gravidanza, secondo le LG internazionali più recenti (2), è quella con letrozolo, inibitore dell'aromatasii. Vi sono buone evidenze che questo farmaco sia superiore al trattamento con clomifene citrato in termini di tasso di ovulazione, tasso di gravidanza clinica e bambini nati vivi (12). Va tenuto presente che al momento questa terapia per l’infertilità della donna con PCOS è off-label nel nostro come in numerosi altri Paesi e che da noi è ancora assai poco impiegata.
In alternativa, può essere considerato l’approccio tradizionale con clomifene citrato, eventualmente associato a metformina (con migliori risultati sull’ovulazione, sulla percentuale di gravidanze e di nati vivi), o anche la metformina da sola, pur con beneficio atteso inferiore. Il clomifene è comunque un farmaco che va incontro ad accumulo tissutale e non dovrebbe essere utilizzato per una terapia pro-ovulatoria cronica. Va ricordato che anche quello della metformina è peraltro un utilizzo off-label nel nostro Paese, in pazienti non diabetiche.
Se questo primo livello di approccio non si dimostra efficace, si passa alla seconda linea di terapia, che prevede l’utilizzo delle gonadotropine associate al monitoraggio US, considerando eventualmente, secondo disponibilità locale di adeguata expertise, la chirurgia ovarica laparoscopica (drilling ovarico).
Infine come terza linea, dopo fallimento delle precedenti, si può ricorrere alla fertilizzazione in vitro (2). Il rischio di gravidanze multiple e di sindrome da iperstimolazione ovarica indotto dalla stimolazione dell’ovulazione è maggiore in queste pazienti e va per quanto possibile mitigato. È utile anche a questo scopo l’utilizzo della metformina, adiuvante nelle procedure di fertilizzazione in vitro e capace di ridurre il rischio della sindrome da iperstimolazione ovarica (13).
Le LG internazionali 2023 concludono che l’utilizzo dell’inositolo, da solo o in combinazione, come terapia dell’infertilità in queste donne va considerato un’opzione puramente sperimentale, perché i benefici sono ancora troppo incerti per poterlo raccomandare (2).
La tabella riassume le possibili strategie terapeutiche attuabili nelle donne con PCOS.
| Principali approcci terapeutici raccomandati dalle LG 2023 sulla PCOS, in rapporto all’obiettivo terapeutico | ||||
| Intervento | Obiettivo | Efficacia (scala arbitraria) |
Uso approvato (in Italia) | |
| Terapia globale | Interventi sullo stile di vita | Eccesso peso/ alterazioni metaboliche | +± | NA |
| Insulino-sensibilizzanti | Alterazioni metaboliche/ anovulazione | +± | No | |
| Inositoli | Alterazioni metaboliche/ anovulazione/ irsutismo (?) | ± | NA | |
| Infertilità | Clomifene citrato | Gravidanza | +± | Sì |
| Gonadotropine | +± | Sì | ||
| Drilling ovarico | ± | Sì | ||
| Fertilizzazione in vitro | ++± | Sì | ||
| Inibitori aromatasi | ++/- | Sì | ||
| Metformina | +± | No | ||
| Anovulazione cronica | Interventi sullo stile di vita | Funzione riproduttiva | ± | NA |
| Metformina | Oligo-anovulazione cronica | +± | No | |
| Rischio endometriale | Estro-progestinici | Protezione | +± | Sì |
| Progestinici | Protezione (in particolare quando uso COCP è indesiderato o controindicato) | +± | Sì | |
| Iperandrogenismo | Misure estetiche | Irsutismo | +± | NA |
| Terapia specifica, per via generale e topica (antibiotici, derivati Vit A, ecc) | Acne | +± | Sì | |
| Estro-progestinici | Irsutismo/acne | ±/+± | Sì | |
| Anti-androgeni | Irsutismo/acne/(FPHL) | +± | No | |
| Alterazioni tolleranza ai carboidrati | Interventi sullo stile di vita | IFG/IGT/Diabete tipo 2 | ++± | NA |
| Metformina | IFG/IGT | +± | No | |
| Diabete tipo 2 | +± | Sì | ||
| Obesità (seguire LG per la popolazione generale) | Interventi sullo stile di vita | Calo di peso | ± | NA |
| Analoghi GLP-1 | ++± | Sì | ||
| Orlistat | +± | Sì | ||
| Chirurgia bariatrica | +++ | Sì | ||
Bibliografia
- Moran LJ, Pasquali R, Teede HJ, et al. Treatment of obesity in polycystic ovary syndrome: a position statement of the Androgen Excess and Polycystic Ovary Syndrome Society. Fertil Steril 2009, 92: 1966-82.
- Teede HJ, Tay CT, Laven JJE, et al. Recommendations from the 2023 International evidence-based guideline for the assessment and management of polycystic ovary syndrome. J Clin Endocrinol Metab 2023, 108: 2447-69.
- Haedersdal M, Gotzsche PC. Laser and photoepilation for unwanted hair growth. Cochrane Database Syst Rev 2006, CD004684.
- Medical eligibility criteria for contraceptive use. Fifth edition, 2015.
- Spitzer WO, Faith JM, MacRae KD. Myocardial infarction and third generation oral contraceptives: aggregation of recent studies. Hum Reprod 2002, 17: 2307-14.
- Lidegaard Ø, Nielsen LH, Skovlund CW, et al. Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001-9. BMJ 2011, 343: 6423-37.
- Sharpe A, Morley LC, Tang T, et al. Metformin for ovulation induction (excluding gonadotrophins) in women with polycystic ovary syndrome. Cochrane Database Syst Rev 2019, 12: CD013505.
- Fraison E, Kostova E, Moran LJ, et al. Metformin versus the combined oral contraceptive pill for hirsutism, acne, and menstrual pattern in polycystic ovary syndrome. Cochrane Database Syst Rev 2020, 8: CD005552.
- Jensterle M, Janez A, Fliers E, et al. The role of glucagon-like peptide-1 in reproduction: from physiology to therapeutic perspective. Hum Reprod Update 2019, 25: 504-17.
- Brahm J, Brahm M, Segovia R, et al. Acute and fulminant hepatitis induced by flutamide: case series report and review of the literature. Ann Hepatol 2011, 10: 93-8.
- Persson S, Elenis E, Turkmen S, et al. Fecundity among women with polycystic ovary syndrome (PCOS) - a population-based study. Hum Reprod 2019, 34: 2052-60.
- Liu Z, Geng Y, Huang Y, et al. Letrozole compared with clomiphene citrate for polycystic ovarian syndrome: a systematic review and meta-analysis. Obstet Gynecol 2023, 141: 523-34.
- Tso LO, Costello MF, Albuquerque LET, et al. Metformin treatment before and during IVF or ICSI in women with polycystic ovary syndrome. Cochrane Database Syst Rev 2020, 12: CD006105.
Terapia della PCOS dopo la menopausa
Paolo Moghetti
Sezione di Endocrinologia e Metabolismo, Dipartimento di Medicina, Università di Verona, e UO di Endocrinologia e Malattie Metaboliche, Azienda Ospedaliera Universitaria Integrata, Verona
Va ricordato che la PCOS tende ad attenuare le sue manifestazioni riproduttive, ecografiche ed endocrine con l’approssimarsi della menopausa. Il trattamento di questa sindrome durante il climaterio resta un tema aleatorio, anche per la mancanza di criteri con cui formulare una diagnosi dopo la menopausa. In questa fase della vita dominano abitualmente i problemi metabolici, frequenti in queste donne. Inoltre, il rischio potenziale associato all’uso degli estro-progestinici è aumentato dall’età e dalla più frequente presenza di eccesso ponderale e dei diversi aspetti della sindrome metabolica. Al momento non vi è comunque ancora prova che le donne che hanno sofferto di PCOS siano a maggior rischio cardiovascolare rispetto a quelle della popolazione generale (1). Le strategie da attuare sono quindi, ragionevolmente, quelle abituali in presenza di specifiche condizioni individuali di rischio cardiovascolare.
Bibliografia
- Fauser BC, Tarlatzis BC, Rebar RW, et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril 2012, 97: 28-38.
Clinica e diagnostica dell'endometriosi
Ricciarda Raffaelli e Michela Carli
UO Ginecologia e Ostetricia, Policlinico GB Rossi, Università di Verona
L'endometriosi è una comune patologia benigna, definita come la presenza di stroma e ghiandole endometriali al di fuori della sede fisiologica. In base alla localizzazione si distinguono la forma uterina, con sviluppo in sede miometriale (adenomiosi) e la forma pelvica, con coinvolgimento intra-peritoneale (ovarico, tubarico, peritoneale viscerale e parietale) o sotto-peritoneale profondo (setto retto-vaginale, vescica, intestino). Il tratto intestinale rappresenta la più comune localizzazione extra-genitale, in particolare gli impianti in sede di retto-sigma ne rappresentano il 70-93%.
La sintomatologia può non riflettere l'estensione della malattia, quanto piuttosto la sua localizzazione. Il sintomo più comunemente lamentato è il dolore pelvico, che può essere ciclico (dismenorrea) o cronico. La presenza di dispareunia e le alterazioni dell'alvo spesso suggeriscono una localizzazione a livello del setto retto-vaginale e del retto-sigma, mentre disuria ed ematuria fanno sospettare un coinvolgimento vescicale. Talora i sintomi sono meno specifici ed una localizzazione vescicale, per esempio, può manifestarsi simulando una cistite. La cadenza, almeno inizialmente, catameniale della sintomatologia lamentata dalla paziente può essere di aiuto nella diagnosi differenziale (1,2).
Spesso la paziente non presenta alcuno dei suddetti sintomi, ma la diagnosi viene posta nel corso di accertamenti eseguiti per indagare una storia di infertilità. L'eziopatogenesi può essere legata alla distorsione architettonica delle tube, ad alterazioni della maturazione follicolare, al microambiente peritoneale alterato.
L'esame obiettivo ginecologico, attraverso l'esplorazione vaginale, può evidenziare dolore alla mobilizzazione dell'utero, alla palpazione bimanuale degli annessi, o alla pressione nel fornice posteriore. L'esame retto-vaginale permette infine di apprezzare eventuali nodularità del legamento utero-sacrale.
Gli esami di laboratorio possono essere utili nella diagnosi differenziale (es. tamponi cervico-vaginali, urinocoltura, esame urine), tuttavia non esistono marcatori caratteristici per questa patologia. Il CA-125, frequentemente elevato in queste pazienti, non risulta sufficientemente sensibile e specifico.
Fondamentale risulta quindi essere la diagnostica per immagini, in particolare l'indagine ecografica che, mediante il più preciso approccio trans-vaginale, permette uno studio accurato dell'apparato genitale. L'osservazione degli annessi può rivelare, nel loro contesto, la presenza di una cisti caratteristica per il contenuto ipoecogeno finemente corpuscolato, le pareti lisce a profilo regolare, e la bassa vascolarizzazione allo studio Color-Doppler. La presenza di un miometrio dall'aspetto disomogeneo, di cripte ghiandolari non vascolarizzate nel suo contesto, o di una giunzione endometrio-miometrio irregolare, è suggestiva di adenomiosi (3) (fig 1, 2A-B).

Figura 1: Immagine ecografica di cisti endometriosica dell'ovaio

Figura 2 A: Immagine ecografica di adenomiosi. Le frecce indicano isole di tessuto endometriale che invadono il miometrio

Figura 2 B: Rappresentazione schematica delle localizzazioni di adenomiosi nel contesto del miometrio.
Un ulteriore aiuto diagnostico può derivare dalla risonanza magnetica (RM), che riconosce le lesioni endometriosiche pelviche grazie alla presenza di prodotti di degradazione del sangue al loro interno (risultando iperintense in T1 e ipointense in T2) (4) (fig 3).

Figura 3: Confronto tra immagini ecografiche (a sinistra) e RMN (a destra) di adenomiosi; si notino gli spot iperintensi in T1 nel contesto del miometrio (D).
Anche le localizzazioni extra-genitali possono essere studiate accuratamente con l'ecografia. L'approccio trans-vaginale a vescica repleta può rivelare lesioni infiltranti il muscolo detrusore, nonché approfondire l’eventuale coinvolgimento del setto utero-vescicale, o un'adiacente infiltrazione miometriale per una frequente concomitante adenomiosi della parete anteriore del corpo uterino. Nella valutazione pre-operatoria della localizzazione vescicale la RM pare essere meno accurata nello stabilire i margini della lesione, poiché la fibrosi circostante è meno chiaramente evidenziabile rispetto alle lesioni contenenti materiale ematico. L’urografia, sebbene aspecifica, è utile per valutare l’integrità dell’apparato urinario superiore e degli ureteri (5,6).
La tecnica ecografica trans-rettale è stata proposta per meglio evidenziare un coinvolgimento del retto-sigma e selezionare le pazienti da sottoporre ad ulteriore approfondimento radiologico (es. clisma opaco) ed endoscopico (7). Tuttavia, il Gruppo di studio della patologia endometriosica della Clinica Ginecologica dell'Università di Verona ha recentemente messo a punto un nuovo metodo ecografico combinato retto-vaginale che, in un singolo step, sfruttando l’approccio con sonda trans-vaginale e la contemporanea instillazione di contrasto acquoso in un palloncino rettale, permette una migliore definizione degli strati della parete intestinale coinvolti dalla lesione e una valutazione dinamica per escludere una stenosi del lume (8).
Nessuna tecnica per immagini attuale si è invece rivelata utile per evidenziare le localizzazioni “nascoste” lungo il decorso del nervo sciatico, lesioni al di sotto del potere di risoluzione della RM, che devono essere sospettate in presenza di sciatalgia ciclica, catameniale. La diagnosi è confermata “ex adiuvantibus” attraverso la risposta clinica al trattamento con analoghi del GnRH e sembra essere più frequente di quanto atteso (9).
Per le localizzazioni peritoneali e della parete addominale, raramente visualizzabili con le tecniche di imaging, si rende invece necessario l'approccio laparoscopico, che permette sia la visualizzazione diretta delle lesioni, sia la loro asportazione per ottenere una diagnosi definitiva con studio anatomo-patologico ed un risultato terapeutico.
Bibliografia
- Schorge JO, Schaffer JI, Halvorson LM, et al. Williams Gynecology - McGraw-Hill Companies 2008.
- Gibbs RS, Karlan BY, Haney AF, et al. Danforth's Obstetrics and Gynecology - 10° edizione - Lippincott Williams & Wilkins, 2008.
- Ardaens Y, Guerin du Masgenet B, Coquel P. Ecografia Pratica in Ginecologia - 4° edizione - Verduci Editore 2007.
- Carbognin G, Guarise A, Minell L, et al. Pelvic endometriosis: US and MRI features. Abdom Imaging 2004, 29: 609-18.
- Fedele L, Bianchi S, Raffaelli R, et al. Pre-operative assessment of bladder endometriosis. Hum Reprod 1997, 12: 2519-52.
- Fedele L, Piazzola E, Raffaelli R, et al. Bladder endometriosis: deep infiltrating endometriosis or adenomyosis? Fertil Steril 1998, 69: 972-5.
- Fedele L, Bianchi S, Portuese A, et al. Transrectal ultrasonography in the assessment of rectovaginal endometriosis. Obstet Gynecol 1998, 91: 444-8.
- Bergamini V, Ghezzi F, Scarperi S, et al. Preoperative assessment of intestinal endometriosis: A comparison of transvaginal sonography with water-contrast in the rectum, transrectal sonography, and barium enema. Abdom Imaging 2010, 35: 732-6.
- Fedele L, Bianchi S, Raffaelli R, et al. Phantom endometriosis of the sciatic nerve. Fertil Steril 1999, 72: 727-9.
Terapia medica dell'endometriosi
Ricciarda Raffaelli e Michela Carli
UO Ginecologia e Ostetricia, Policlinico GB Rossi, Università di Verona
La chirurgia è spesso considerata la migliore opzione terapeutica nelle donne affette da endometriosi sintomatica, poiché il trattamento definitivo è l’eradicazione chirurgica delle lesioni (1). Tuttavia, la durata del beneficio terapeutico è dubbia: il trattamento chirurgico conservativo spesso è associato ad una parziale remissione della sintomatologia algica o una sua recidiva, con un elevato tasso di re-interventi (2).
La terapia medica è dunque un’importante alternativa o un complemento della chirurgia. Il Practice Commitee of The American Society for Reproductive Medicine (2008) ha recentemente stabilito che l’endometriosi dovrebbe essere considerata una patologia infiammatoria cronica, che richiede un piano terapeutico a lungo termine, con l’obiettivo di sfruttare al massimo il trattamento medico ed evitare ripetuti interventi chirurgici che espongono le pazienti a complicanze severe intra- e post-operatorie.
Poichè non è ancora disponibile un farmaco con proprietà selettive verso l’endometrio ectopico, attualmente l’obiettivo realistico della terapia non è la citoriduzione, ma la soppressione degli impianti, il che implica la loro persistenza, indipendentemente dal tipo, dalla dose e durata della terapia (3). Quindi, qualora il trattamento medico sia indicato, può essere necessario per anni, o fino a quando la paziente desidera una gravidanza. In questo senso è più appropriato parlare di “controllo” piuttosto che di “cura” dell’endometriosi.
La terapia farmacologica per l’endometriosi ha due obiettivi: 1) alleviare il dolore per lunghi periodi; 2) ridurre la progressione della malattia nell’intervallo tra chirurgia conservativa e ricerca della prole.
L’unica modalità terapeutica significativa, attualmente, è la soppressione della funzione ovarica e l’induzione di una condizione ormonale stabile ipoestrogenica che provoca l'atrofia dell'endometrio ectopico. Queste modificazioni ormonali possono essere mantenute dalla diagnosi al momento della ricerca di prole, o come alternativa alla chirurgia dopo completamento del programma riproduttivo. Data la potenziale durata del trattamento, dovrebbe essere fatto un bilancio tra benefici, rischi e costi dei farmaci usati.
A questo proposito, il Danazolo e gli Agonisti dell'ormone per il rilascio della gonadotropina (GnRH) bloccano la funzione ovarica e con essa la progressione di malattia, ma sono gravati da importanti effetti collaterali che ne limitano l'utilità. Il Danazolo rappresentava il gold standard della terapia per l'endometriosi negli anni '80. E' un agente androgeno orale che induce amenorrea attraverso la soppressione dell'asse ipotalamo-ipofisi-ovaio, accompagnata da un incremento delle concentrazioni sieriche degli androgeni e una riduzione degli estrogeni. Una recente metanalisi Cochrane ha confermato la sua efficacia nel ridurre il dolore pelvico associato all'endometriosi (4). Tuttavia, gli effetti collaterali androgenici che ne conseguono (aumento di peso, acne, abbassamento della voce, irsutismo, sintomi vasomotori, riduzione di volume delle mammelle, ecc.) non sono trascurabili e tale profilo farmacologico ha un effetto negativo sulla compliance della paziente. Gli Agonisti del GnRH (Nafarelin, Leuprolide, Leuprolide depot), considerati la terapia farmacologica standard di riferimento negli anni '90, legano i recettori ipofisari del GnRH e inizialmente stimolano la sintesi e il rilascio di FSH e LH; tuttavia, la stimolazione prolungata causa un feed-back negativo sull'attività gonadotropa e una conseguente ipoestrogenemia relativa che mima lo stato menopausale. Il trattamento è di solito limitato alla durata di 6 mesi, poichè l'uso a lungo termine è associato soprattutto a una demineralizzazione ossea. Gli effetti collaterali ipoestrogenici degli analoghi sono comunque meglio tollerati rispetto agli effetti anabolici del danazolo (5).
I progestinici ed i contraccettivi orali (CO) permettono una combinazione pratica degli aspetti menzionati, cioè il rapporto rischio/beneficio ed i costi associati (6,7). I CO, usati ciclicamente o ininterrottamente, costituiscono un’adeguata opzione terapeutica di prima linea per l’endometriosi ovarica e peritoneale (8) e rappresentano l’alternativa medica più sicura per il trattamento a lungo termine di questa patologia (9). I derivati progestinici da soli sono stati considerati una valida alternativa, per il basso costo e per il miglior profilo in termini di effetti collaterali. Il razionale biologico per l'uso dei progestinici risiede nelle loro proprietà antinflogistiche e quindi nella capacità di contrastare la condizione di infiammazione generata dall'impianto di endometrio ectopico (10). CO e progestinici sono entrambi efficaci nel ridurre la sintomatologia algica, ben tollerati e non inferiori ad altri regimi ormonali quali il Danazolo, gli agonisti del GnRH e gli inibitori delle aromatasi, proposti come terapia della prossima generazione. In realtà i progestinici, nonostante una chiara dimostrazione di un maggior effetto sul dolore pelvico anche in pazienti con lesioni profonde sotto-peritoneali, sono stati messi in secondo piano a favore di nuove alternative farmacologiche oggetto di studio. I modulatori selettivi del recettore del progesterone, gli inibitori dell'aromatasi, gli antagonisti del GnRH, gli inibitori della ciclossigenasi-2, il disgregatore dell'angiogenesi e gli immunomodulatori sono agenti promettenti. Tuttavia, sono richieste ulteriori conferme di efficacia e sicurezza da parte di studi clinici randomizzati (11).
Come già detto, l’endometriosi ha una particolare tendenza a recidivare dopo chirurgia conservativa: la persistenza dei meccanismi patogenetici e il trend verso la posticipazione del programma riproduttivo risultano in un tasso significativo di recidiva della sintomatologia che peggiora negli anni. Le evidenze scientifiche supportano il ruolo dei CO nella prevenzione terziaria degli endometriomi ovarici, attraverso la soppressione dell’ovulazione, dopo laparoscopia operativa (12).
L’informazione sulla terapia farmacologica dell’endometriosi profonda del setto retto-vaginale sintomatica è scarsa. Tuttavia, i dati a disposizione dimostrano una sua efficacia in termini di riduzione del dolore, riduzione delle dimensioni delle lesioni durante il trattamento, miglioramento della qualità di vita della paziente (13). Le migliori candidate al trattamento a lungo termine sono le donne che non cercano una gravidanza (interferenza della terapia con l’ovulazione) e quelle sottoposte a intervento chirurgico senza successo. Progestinici e combinazioni estro-progestiniche si sono rivelati sicuri, ben tollerati ed efficaci. Anche il dispositivo intrauterino a rilascio di Levonorgestrel (LNG-IUD) è utile per aumentare la compliance della donna durante trattamenti prolungati, grazie all’oligomenorrea secondaria alla terapia (14). Il levonorgestrel è infatti un potente progestinico con attività androgena e anti-estrogenica sull'endometrio che, in seguito a rilascio locale dell'ormone, diviene atrofico e inattivo. Tuttavia, questa opzione terapeutica è gravata dall'alta frequenza di sanguinamento anomalo durante il trattamento e pone alcuni dubbi conseguenti al mancato meccanismo di inibizione della ovulazione.
Riassumendo, danazolo e analoghi del GnRH sono stati usati con successo nelle pazienti affette da endometriosi, ma effetti collaterali e costo ne limitano l’uso prolungato. I derivati progestinici, soli o in combinazione con gli estrogeni, sono sicuri, ben tollerati, economici e candidati a trattamenti prolungati. Quindi, se una donna non sta cercando prole e la valutazione clinica non evidenzia una massa pelvica di natura dubbia, vi è spazio per un tentativo terapeutico con un contraccettivo orale o un progestinico per trattare la sintomatologia dolorosa pelvica suggestiva di endometriosi, senza la preliminare conferma diagnostica mediante laparoscopia (15). Il trattamento a lungo termine con analoghi del GnRH dovrebbe essere considerato come seconda scelta nel caso in cui progestinici e CO si rivelino inefficaci, siano poco tollerati o controindicati.
La terapia medica non ha alcun impatto sulla fertilità, quando somministrata da sola o come misura adiuvante post-operatoria. Infatti, non vi è alcuna evidenza sull'utilità dei farmaci che sopprimono la funzione ovarica nel trattamento dell'infertilità associata all'endometriosi. Tale trattamento potrebbe essere più dannoso che efficace per la prognosi riproduttiva, a causa dei potenziali effetti collaterali dei farmaci e della mancata opportunità di concepimento in sua concomitanza (16).
- Redwine D, Mann CH, Wright JY. Evidence on endometriosis. Elitism about randomized controlled trials is inappropriate. Br Med J 2000, 321: 1077-8.
- Vercellini P, Crosignani PG, Abbiati A, et al. The effect of surgey for symptomatic endometriosis: the other side of the story. Hum Reprod Update 2009, 15: 177-88.
- Evers JL. The second-look laparoscopy for evaluation of the results of medical treatment of endometriosis should not be performed during ovarian suppression. Fertil Steril 1987, 47: 502-4.
- Selak V, Farquhar C, Prentice A, et al. Danazol for pelvic pain associated with endometriosis. Cochrane Database Syst Rev 2001, (4): CD000068.
- Vercellini P, Somigliana E, Viganò P. Endometriosis: current and future medical therapies. Best Pract Res Clin Obstetr Gynecol 2008, 22: 275-306.
- Vercellini P, Cortesi I, Crosignani PG, et al. Progestins for symptomatic endometriosis: a critical analysis of the evidence. Modern Trends Fertil Steril 1997, 68: 393-401.
- Vercellini P, Fedele L, Pietropaolo G, et al. Progestogens for endometriosis: forward to the past. Hum Reprod Update 2003, 9: 387-96.
- Vercellini P , Frontino G, Di Giorgi O. Continuous use of an oral contraceptive for endometriosis-associated recurrent dysmenorrhea that does not respond to a cyclic pill regimen. Fertil Steril 2003, 80: 560-3.
- American College of Obstetrics and Gynecologists. Noncontraceptive use of hormonal contraceptives. Obstet Gynecol 2010, 115: 206-18.
- Vercellini P, Fedele L, Pietropaolo G, et al. Progestogens for endometriosis: forward to the past. Hum Reprod Update 2003, 9: 387-96.
- Ruhland B, Agic A, Krampe J, et al. Innovations in conservative endometriosis treatment: an updated review. Minerva Ginecol 2011, 63: 247-59.
- Seracchioli R, Mabrouk M, Manuzzi L. Postoperative use of an oral contraceptive pill for prevention of anatomical relapse or syntom recurrence after conservative surgey for endometriosis. Hum Reprod 2009, 24: 2729-35.
- Vercellini P, Crosignani PG, Somigliana E, et al. Medical treatment for rectovaginal endometriosis: what is the evidence? Hum Reprod 2009, 10: 2504-14.
- Fedele L, Bianchi S, Zanconato G, et al. Use of a levonorgestrel-releasing intrauterine device in treatment of rectovaginal endometriosis. Fertil Steril 2001, 175: 485-8.
- American College of Obstetrician and Gynecologists Practice Bullettin N. 11, 1999.
- Royal College of Obstetrician and Gynecologistis. The investigation and management of endometriosis. Guideline n.24, 2006.
Classificazione ed epidemiologia dei tumori ovarici
Cecilia Motta e Salvatore Monti
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Facoltà di Medicina e Psicologia, “Sapienza” Università di Roma
(aggiornato al 31 agosto 2015)
I tumori ovarici vengono classificati in istotipi secondo la loro origine cellulare; essi possono insorgere da: epitelio celomatico di superficie (neoplasie epiteliali), cellule germinali o stroma ovarico. Va ricordato inoltre che esistono rare neoplasie che sfuggono a qualsiasi classificazione e che l'ovaio è anche una delle più frequenti sedi di metastasi (6-7% delle masse ovariche).
L'80% di questi tumori origina dall'epitelio celomatico; l'80% di tutti i tumori è benigno ed insorge più frequentemente in donne giovani, fra le quali sono più frequenti le neoplasie germinali, mentre il restante di essi, maligno, insorge più spesso in donne di età più avanzata.
Classificazione delle neoplasie ovariche (WHO 1999) (1)
Neoplasie epiteliali:
- Tumori sierosi (benigno o cisto-adenoma, borderline, maligno o cisto-adenocarcinoma sieroso)
- Tumori mucinosi, di tipo endo-cervicale e intestinale (benigno, borderline, maligno)
- Tumori endometrioidi (benigno, borderline, maligno)
- Epiteliali-stromali (adeno-sarcoma, tumori mesodermici o mulleriani misti)
- Tumori a cellule chiare (benigno, borderline, maligno)
- Tumori a cellule transizionali (tumore di Brenner benigno, borderline e maligno; carcinoma a cellule transizionali-non Brenner)
- Tumore a cellule squamose
- Tumori misti (benigno, borderline, maligno)
- Tumori indifferenziati
Neoplasie dei cordoni sessuali e dello stroma gonadico:
- Tumori a cellule della granulosa (giovanile, adulto)
- Tecomi-fibromi (fibroma cellulato, fibro-sarcoma, tecoma tipico o luteinizzato, tumore stromale sclerosante)
- Tumori a cellule del Sertoli-Leydig (andro-blastomi)
- Tumore dei cordoni sessuali con tubuli anulari
- Ginandro-blastoma
- Tumori a cellule lipidiche (contenenti steroidi)
Neoplasie a cellule germinali:
- Tumori a cellule germinali immature (disgerminoma, carcinoma embrionale, tumore del sacco vitellino-del seno endodermico, corio-carcinoma, teratoma immaturo)
- Tumori a cellule germinali mature (teratoma maturo cistico, teratoma maturo cistico con trasformazione maligna-carcinoma squamoso)
Tumori miscellanei, tumori ad incerta classificazione, metastasi ovariche.
Incidenza ed epidemiologia
L’80-90% dei tumori ovarici si presenta in donne in età compresa fra 20 e 65 anni, e meno del 5% in età pediatrica.
Nella grande maggioranza dei casi (80%) si tratta di tumori benigni: il 60% di questi è diagnosticato in donne di età < 40 anni. Il 15-20% dei tumori ovarici è maligno, e di questi il 90% è diagnosticato in donne di età > 40 anni. L'età media alla diagnosi è più bassa in donne affette da un cancro ovarico di natura ereditaria. Infine, il 5-10% dei tumori ovarici è definito a malignità intermedia (borderline). A differenza dei tumori maligni, che si osservano prevalentemente in età avanzata, i tumori borderline sono più comuni in donne giovani, con picco di incidenza nella quarta e quinta decade (2).
L’incidenza delle neoplasie maligne ovariche varia nelle diverse aree geografiche, con tassi più elevati in Europa e Nord America. Nei paesi africani e nel sud-est asiatico si osservano meno di 2 nuovi casi all’anno per 100.000 donne, mentre in Europa e nel Nord America si registrano 15 nuovi casi/anno per 100.000 donne (2).
Negli Stati Uniti, il carcinoma ovarico è la prima causa di morte per neoplasia ginecologica; esso è inoltre la quarta causa di morte per cancro nel sesso femminile nei paesi industrializzati (3).
Il rischio di ammalarsi nella popolazione generale è pari all’1.3%. Negli ultimi 10 anni l’incidenza di carcinoma ovarico negli Stati Uniti si è progressivamente ridotta, di circa l’1.1% ogni anno, ma la mortalità per questa patologia è rimasta stabile (sopravvivenza a 5 anni: 45.6%) (4).
Neoplasie epiteliali: costituiscono la categoria di gran lunga più frequente: 60% di tutti i tumori ovarici e 90-95% di quelli maligni (1).
Neoplasie dei cordoni sessuali e dello stroma gonadico: rappresentano circa l’8% di tutti i tumori ovarici e il 7% delle forme maligne. Derivano dalla componente stromale e dai cordoni sessuali della gonade in fase di sviluppo (1).
Neoplasie a cellule germinali: la forma benigna è relativamente frequente (circa un quarto dei tumori ovarici); costituiscono invece solo il 3-7% delle forme maligne. Derivano dalle cellule germinali primordiali migrate nell’ovaio dal sacco vitellino (1). Il 95% di essi è costituito da teratomi ovarici maturi.
Fattori di rischio
Familiarità e fattori genetici: nel 5-10% delle neoplasie, il fattore di rischio principale è la familiarità. Una storia familiare di cancro ovarico o della mammella aumenta di circa 2-6 volte il rischio di sviluppare una neoplasia epiteliale ovarica (5). Va comunque distinta la predisposizione familiare a sviluppare questa neoplasia dalla malattia “ereditaria”. In quest’ultimo caso entrano in gioco mutazioni geniche (ad es. onco-soppressori come BRCA1 e BRCA2) e la malattia si manifesta all'incirca 10 anni prima; tali donne hanno un rischio di sviluppare la neoplasia del 25-50% nel corso della loro vita (6). Le sindromi genetiche individuate sono:
- breast-ovarian cancer syndrome e site specific ovarian cancer syndrome (entrambe legate a una mutazione dei geni BRCA1/BRCA2);
- sindrome di Lynch (hereditary nonpolyposis colorectal cancer - HNPCC), che include carcinoma del colon non associato a poliposi, carcinomi endometriali, mammari, ovarici e altri con minore frequenza;
- sindrome di Cowden, legata a una mutazione di PTEN, con associazione tra tumori ovarici e tumori cerebrali;
- sindrome di Gorlin, legata a una mutazione di PTC, con associazione tra tumori ovarici e nevi multipli.
Fattori endocrini: si pensa che la ripetuta ovulazione possa generare micro-traumi a carico dell'epitelio ovarico, il quale può quindi andare incontro alla trasformazione maligna; inoltre, anche l'esposizione persistente dell'ovaio alle gonadotropine e ad elevati livelli di estradiolo può essere carcinogenica. Pertanto la multiparità, l'allattamento al seno e l'assunzione prolungata di contraccettivi orali riducono per tali motivi il rischio di cancro ovarico; in particolare, donne multipare presentano una riduzione del rischio del 30% circa rispetto a donne che non hanno partorito. Invece, il menarca precoce, la menopausa tardiva, la nulliparità, l'infertilità, la prima gravidanza in età > 35 anni e l'endometriosi ne aumentano il rischio (7,8).
Fattori ambientali: è stata descritta un’associazione con l’esposizione ad asbesto e talco, abuso di alcol, obesità e dieta ricca di grassi. Fumo e caffeina non sembrano invece avere evidenti relazioni.
Bibliografia
- Tavassoli FA, Devilee P (Eds): World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. IARC Press, Lyon 2003.
- Jemal A, Siegel R, Ward E, Hao Y, et al. Cancer statistics, 2008. CA Cancer J Clin 2008, 58: 71–96.
- Siegel R, Ward E, Brawley O, et al. Cancer Statistics, 2011: The impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin 2011, 61: 212-36.
- www.seer.cancer.gov
- Bergfeldt K, Rydh B, Granath F, et al. Risk of ovarian cancer in breast-cancer patients with a family history of breast or ovarian cancer: a population-based cohort study. Lancet 2002, 360: 891-4.
- Daly M, Obrams GI. Epidemiology and risk assessment for ovarian cancer. Semin Oncol 1998, 25: 255-64.
- Hinkula M, Pukkala E, Kyyronen P, et al. Incidence of ovarian cancer of grand multiparous women-a population-based study in Finland. Gynecol Oncol 2006, 103: 207-11.
- Orezzoli JP, Russell AH, Oliva E, et al. Prognostic implication of endometriosis in clear cell carcinoma of the ovary. Gynecol Oncol 2008, 110: 336-44.
Clinica e diagnostica dei tumori ovarici
Cecilia Motta e Salvatore Monti
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Facoltà di Medicina e Psicologia, “Sapienza” Università di Roma
(aggiornato al 31 agosto 2015)
Tumori epiteliali
La maggior parte delle pazienti giunge ad una diagnosi fra i 40 ed i 65 anni.
I sintomi iniziali sono vaghi e mal definiti, spesso di scarsa entità, tanto da non essere riferiti al medico; per questi motivi, nella maggior parte dei casi si giunge a una diagnosi in fase tardiva e la neoplasia è ormai allo stadio III o IV.
Una neoplasia ovarica va sempre sospettata in una donna che lamenti sintomi di recente insorgenza e di notevole entità a carico dell'addome o della pelvi (es. gonfiore, aumento di volume dell'addome, urgenza minzionale, difficoltà ad alimentarsi o precoce sensazione di ripienezza, dolore addominale o pelvico). Quando la malattia è ormai in stadio avanzato, i sintomi più frequenti sono: distensione addominale, nausea, anoressia e occasionalmente dispnea. Raramente si manifestano sindromi paraneoplastiche, ad esempio ipercalcemia nei tumori a cellule chiare.
La presenza alla palpazione di una massa in sede annessiale, soprattutto se solida, irregolare e fissa, deve far sospettare la presenza di una neoplasia, soprattutto se la paziente è in post-menopausa (in donne in pre-menopausa solo il 5-18% delle masse annessiali è neoplastico); i tumori in stadio iniziale sono, comunque, difficilmente palpabili (1).
L'iter diagnostico deve comprendere anamnesi, visita ginecologica, esplorazione rettale, ecografia pelvica trans-vaginale, ecografia addominale e dosaggio dei marcatori sierici.
Criteri ecografici di sospetto sono la presenza di una componente solida, non iperecogena, vascolarizzata, la presenza all'interno della massa di setti di spessore > 2-3 mm, la presenza di ascite, di masse peritoneali o di linfonodi aumentati di dimensioni.
Criteri ecografici di sospetto sono la presenza di una componente solida, non iperecogena, vascolarizzata, la presenza all'interno della massa di setti di spessore > 2-3 mm, la presenza di ascite, di masse peritoneali o di linfonodi aumentati di dimensioni.
Il marcatore sierico da valutare è la glicoproteina CA125, che risulta elevata (> 35 U/mL) in più dell'80% delle donne con cancro ovarico in fase avanzata (2). In realtà la sensibilità di tale marcatore è minore nella malattia in fase iniziale, stadio I (50%), e aumenta con la diffusione della neoplasia (90% per lo stadio II). Inoltre, tale marcatore non è specifico per le neoplasie ovariche, in quanto è espresso anche da tumori di origine endometriale e pancreatica, oltre che in una serie di condizioni benigne come endometriosi e malattia infiammatoria pelvica. Nelle donne in pre-menopausa non è quindi un utile marcatore diagnostico, mentre il suo valore predittivo positivo aumenta fino al 97% nelle donne in post-menopausa (3).
Nella diagnosi differenziale vanno considerati: tumori ovarici non epiteliali, metastasi ovariche (più frequentemente dal tratto intestinale, tumore di Krukenberg, o dalla mammella), carcinoma delle tube e malattie non maligne, quali la tubercolosi.
La diagnosi è comunque istologica, la chirurgia è quindi necessaria per la diagnosi, la stadiazione e il trattamento della neoplasia. I tumori borderline (a basso grado di malignità), che sono il 10-20% dei tumori epiteliali, vanno differenziati dagli altri, in quanto tendono a manifestarsi in uno stadio più precoce e a un'età più giovane, con prognosi nettamente più favorevole.
Tumori dei cordoni sessuali e dello stroma gonadico
Si riscontrano più frequentemente in giovani donne e sono spesso voluminosi.
I fibromi sono i tumori più frequenti, sono spesso benigni e si presentano come una massa solida, unilaterale, che non produce marcatori sierici (4).
I tumori a cellule della granulosa sono più frequentemente voluminosi e unilaterali; questi tumori, come anche i tecomi, possono essere maligni e possono produrre estrogeni (i tumori a cellule della granulosa producono anche inibina); la sintomatologia è quindi caratterizzata da segni di iperestrinismo quali: sanguinamento uterino anomalo, iperplasia o carcinoma endometriali, tensione mammaria e pubertà precoce nelle bambine (5).
I tumori a cellule del Sertoli-Leydig, quelli a sole cellule del Leydig e il ginandro-blastoma sono caratterizzati dalla compresenza di tessuto testicolare che produce androgeni (17OH-progesterone, testosterone, androstenedione), causando in almeno un terzo dei casi segni di virilizzazione (oligomenorrea, amenorrea, atrofia mammaria, irsutismo, modificazioni nel tono della voce, alopecia e clitoridomegalia); raramente queste neoplasie producono anche inibina o alfa-fetoproteina (6).
I tumori a sole cellule del Sertoli invece producono estrogeni, e talvolta possono produrre renina, portando quindi a una sintomatologia caratterizzata da ipertensione arteriosa refrattaria alla terapia e ipokaliemia (7).
Il tumore dei cordoni sessuali con tubuli anulari, che può anche essere maligno, può produrre sia estrogeni che progesterone (8).
Tumori a cellule germinali
Sono all'incirca il 20-25% di tutte le neoplasie ovariche, ma sono solo il 5% tra le neoplasie maligne. Si riscontrano più frequentemente in giovani donne, fra i 10 e i 30 anni.
Questi tumori sono spesso voluminosi (mediamente sui 16 cm) e possono produrre ormoni o altri marcatori, più frequentemente ß-hCG, alfa-fetoproteina o LDH. I sintomi più frequenti sono: distensione e dolore addominali (per il volume della massa, la presenza di ascite, la rottura o la torsione della massa), pubertà precoce, sanguinamento uterino anomalo o sintomi di gravidanza (per la produzione di hCG) (9).
| Stadiazione FIGO e TNM del carcinoma ovarico (10) | |||
|
I |
IA | tumore limitato a un ovaio, assenza di ascite e di neoplasia sulla superficie esterna, capsula intatta (T1a-N0-M0) | |
| IB | tumore limitato a entrambe le ovaie, assenza di ascite e di neoplasia sulla superficie esterna, capsula intatta (T1b-N0-M0) | ||
| IC |
tumore limitato a una od entrambe le ovaie con almeno una delle seguenti caratteristiche:
|
||
| II (T2-N0-M0, tumore esteso a una o entrambe le ovaie, con diffusione pelvica) |
IIA | Estensione e/o impianti su utero e/o salpingi (T2a-N0-M0) | |
| IIB | Estensione ad altri tessuti pelvici intra-peritoneali (T2b-N0-M0) | ||
| III (tumore che coinvolge una o entrambe le ovaie, con diffusione peritoneale esterna alla pelvi e/o linfonodi retro-peritoneali positivi) |
IIIA | A1 |
Solo linfonodi retro-peritoneali positivi (T1/T2-N1-M0):
|
| A2 | Diffusione peritoneale microscopica esterna alla pelvi con o senza coinvolgimento linfonodale retro-peritoneale (T3a2-N0/N1-M0) | ||
| IIIB | Diffusione peritoneale macroscopica esterna alla pelvi con diametro massimo < 2 cm, con o senza coinvolgimento linfonodale retro-peritoneale (T3b-N0/N1-M0) | ||
| IIIC | Diffusione peritoneale macroscopica esterna alla pelvi con diametro massimo > 2 cm, con o senza coinvolgimento linfonodale retro-peritoneale (inclusa l’estensione della neoplasia alle capsule epatica e splenica, senza coinvolgimento parenchimale di tali organi) (T3c-N0/N1-M0) | ||
| IV (presenza di metastasi a distanza, escluse quelle peritoneali) (qualsiasi T, qualsiasi N, M1) |
IVA | Versamento pleurico con esame citologico positivo | |
| IVB | Metastasi parenchimali e metastasi in organi extra-addominali (compresi i linfonodi inguinali e i linfonodi esterni alla cavità addominale) | ||
Iter diagnostico
La presenza di una massa annessiale deve far sospettare una neoplasia maligna, indipendentemente dall’età della paziente. La diagnosi differenziale tra carcinoma ovarico e neoplasie benigne del tratto genitale o altre malattie, neoplastiche e non del tratto gastrointestinale o addominale, può però rivelarsi alquanto complessa.
Quando si riscontra occasionalmente una massa ovarica oppure alla visita ginecologica con esplorazione rettale si evidenzia una massa pelvica mono o bilaterale di consistenza solida o solida-cistica (eventualmente fissa nella pelvi), associata o meno a disturbi da compressione sulle strutture pelviche (pollachiuria, stipsi, dolore pelvico) e/o presenza di distensione addominale, si rendono necessarie ulteriori indagini, quali principalmente:
- accurata anamnesi, ponendo attenzione ad alterazioni nel ciclo mestruale, febbre, dolore, sintomi gastrointestinali, storia di endometriosi o di malattia infiammatoria pelvica o altre malattie non ginecologiche;
- ecografia pelvica, se possibile trans-vaginale (eventualmente associata all’ecografia dell’addome superiore);
- emocromo completo (per escludere un processo infiammatorio);
- CA125 (in tutte le donne in post-menopausa, e nelle donne in pre-menopausa solo se la massa è sospetta all'ecografia);
- CEA e CA19.9 (per escludere un'eventuale patologia gastrointestinale);
- l’antigene tumorale sierico HE4, Human epididymal secretory protein, che sembra offrire promettenti risultati nella diagnosi differenziale delle tumefazioni annessiali: esso sembra avere una sensibilità per il carcinoma ovarico superiore a quella del CA125 soprattutto negli stadi iniziali, anche se sono ancora necessari studi prospettici multicentrici che valutino l’utilità del suo dosaggio in aggiunta a quello del CA125 nella diagnostica delle masse pelviche (11);
- alfa-fetoproteina e LDH (prodotti dalle neoplasie a cellule germinali);
- in presenza di amenorrea in assenza di altri sintomi: ß-hCG (per escludere una gravidanza e in quanto alcune neoplasie a cellule germinali la possono produrre);
- in presenza di alterazioni mestruali, dolore mammario, iperplasia endometriale (o nelle bambine pubertà precoce): gonadotropine ed estrogeni (prodotti dalle neoplasie dello stroma);
- in presenza di sintomi e segni di iperandrogenismo (soprattutto se gravi e insorti in modo repentino): ormoni androgeni (testosterone totale, SHBG, delta-4-androstenedione, DHEA-S, 17OH-progesterone).
Se il sospetto clinico è confermato, la paziente deve essere sottoposta ad intervento chirurgico previa esecuzione di Rx torace e TC addomino-pelvica. Quest’ultimo esame fornisce informazioni sulla diffusione peritoneale e retro-peritoneale di malattia, importanti per la programmazione chirurgica.
In alternativa, la PET/TC sembra rappresentare una tecnica di imaging più accurata della TC nella stadiazione pre-chirurgica e nella pianificazione terapeutica del carcinoma ovarico (12).
In caso di dubbio clinico di infiltrazione degli organi contigui o di secondarietà della lesione ovarica, è raccomandata l’esecuzione di esami endoscopici, quali rettoscopia, cistoscopia o gastroscopia.
Bibliografia
- Roman LD, Muderspach LI, Stein SM, et al. Pelvic examination, tumor marker level, and gray-scale and Doppler sonography in the prediction of pelvic cancer. Obstet Gynecol 1997, 89: 493-500.
- Cannistra SA. Cancer of the ovary. N Engl J Med 2004, 351: 2519-29.
- American College of Obstetricians and Gynecologists. ACOG Committee Opinion: number 280, December 2002. The role of the generalist obstetrician-gynecologist in the early detection of ovarian cancer. Obstet Gynecol 2002, 100: 1413-6.
- Chechia A, Attia L, Temime RB, et al. Incidence, clinical analysis, and management of ovarian fibromas and fibrothecomas. Am J Obstet Gynecol 2008, 199: 473.e1-4.
- Young RH. Sex cord-stromal tumors of the ovary and testis: their similarities and differences with consideration of selected problems. Mod Pathol 2005, 18 Suppl 2: S81-98.
- Young RH, Scully RE. Ovarian Sertoli-Leydig cell tumors. A clinicopathological analysis of 207 cases. Am J Surg Pathol 1985, 9: 543-69.
- Oliva E, Alvarez T, Young RH. Sertoli cell tumors of the ovary: a clinicopathologic and immunohistochemical study of 54 cases. Am J Surg Pathol 2005, 29: 143-56.
- Shen K, Wu PC, Lang JH, et al. Ovarian sex cord tumor with annular tubules: a report of six cases. Gynecol Oncol 1993, 48:180-4.
- Tewari K, Cappuccini F, Disaia PJ, et al. Malignant germ cell tumors of the ovary. Obstet Gynecol 2000, 95: 128-33.
- Prat J, FIGO Committee on Gynecologic Oncology. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet 2014, 124: 1-5.
- Huhtinen K, Suvitie P, Hiissa J, et al. Serum HE4 concentration differentiates malignant ovarian tumours from ovarian endometriotic cysts. Br J Cancer 2009, 100: 1315-9.
- Kitajima K, Murakami K, Yamasaki E, et al. Diagnostic accuracy of integrated FDG-PET/contrast-enhanced CT in staging ovarian cancer: comparison with enhanced CT. Eur J Nucl Med Mol Imaging 2008, 35: 1912-20.
Terapia dei tumori ovarici
Marta Vitali e Paola Bianchi
Dipartimento Salute della donna e medicina territoriale, Azienda Ospedaliera Sant'Andrea, Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
Malattia iniziale, stadio I-IIa sec. FIGO
Negli stadi iniziali la chirurgia risulta curativa nella maggior parte delle pazienti (1) e prevede: aspirazione del liquido o lavaggio peritoneale, isterectomia ed annessiectomia bilaterale, omentectomia infracolica, appendicectomia, linfadenectomia pelvica e aortica, biopsie peritoneali multiple (2,3).
La laparoscopia può rappresentare un'alternativa alla laparotomia (4): i vantaggi sono legati alla riduzione dei tempi chirurgici, della perdita ematica intra-operatoria e della degenza; i limiti includono lo staging inadeguato, possibile rottura della cisti, metastasi nei siti di inserzione dei trocar (5).
In caso di neoplasia stromale e dei cordoni sessuali non è obbligatoria la valutazione del retroperitoneo, a causa della bassa incidenza di metastasi in tale sede negli stadi iniziali (6).
Donne di età inferiore ai 40 anni, affette da malattia iniziale (IA-IB, G1-G2) e desiderose di prole, possono beneficiare di chirurgia conservativa: citologia del liquido peritoneale, annessiectomia monolaterale e/o enucleazione del tumore, biopsie peritoneali multiple, omentectomia, appendicectomia, asportazione dei linfonodi pelvici e aortici, biopsie endometriali in caso di carcinoma ovarico di tipo endometrioide (2) o a cellule della granulosa (6), senza peggioramento della prognosi (3).
Il trattamento chirurgico delle neoplasie a cellule germinali prevede l'annessiectomia monolaterale anche in caso di malattia avanzata, data l'elevata sensibilità di questo sottogruppo di pazienti alla chemioterapia (6). In pazienti giovani con neoplasia borderline la chirurgia può essere limitata all’annessiectomia monolaterale o cistectomia mono- o bilaterale, biopsie omentali, resezione di eventuali impianti peritoneali ed appendicectomia in caso di neoplasia mucinosa. La linfadenectomia non è essenziale ai fini prognostici ed il trattamento di eventuali recidive è la citoriduzione chirurgica secondaria.
L'utilità di terapie adiuvanti in questo tipo di neoplasie non è provata (7). Le pazienti cui meno frequentemente viene proposta l’opzione di una chirurgia conservativa sono quelle con diagnosi istologica di carcinoma a cellule chiare o endometrioide, o G3, che al di là dello stadio sono associati a una peggiore prognosi. La scelta di ricorrere ad un successivo intervento chirurgico al termine del periodo riproduttivo per completare la radicalità va individualizzata, considerando che circa il 60-70% delle recidive dopo trattamento conservativo si verifica nell’annesso residuo (8).
Nel post-trattamento può essere raccomandato l’utilizzo di contraccettivi orali a scopo protettivo, qualora non sia immediato il desiderio di gravidanza. Non vi sono dati sufficienti a favore della criopreservazione di tessuto ovarico sano nell’ambito della terapia conservativa in pazienti giovani; il rischio di metastasi occulte, soprattutto nelle forme più avanzate, è di circa il 7-12% in assenza di anomalie macroscopiche. Tuttavia tale procedura sembra essere applicabile nei casi di malattia estesa che implichino l’asportazione di entrambi gli annessi e/o dell’utero (9).
La chemioterapia sistemica a base di carbonplatino +/- paclitaxel, per 3-6 cicli, rappresenta il trattamento adiuvante standard negli stadi precoci ad alto rischio di recidiva: Ia e Ib G3, Ic e II, istotipo a cellule chiare (3, 10); in caso di tumore del seno endodermico è sempre indicata la chemioterapia adiuvante e lo schema più utilizzato comprende bleomicina, etoposide e cisplatino (6). Le pazienti affette da neoplasia maligna in stadio Ia e Ib (sottoposte a stadiazione chirurgica completa/ottimale) e istologia favorevole (istotipo non a cellule chiare, G1-G2) non sembrano beneficiare di alcuna terapia adiuvante (10, 11). La chemioterapia in pazienti giovani non compromette la capacità riproduttiva e non è associata ad un aumento del rischio di anomalie fetali (8).
Malattia avanzata, stadio IIb-IV sec. FIGO e recidive
La chirurgia citoriduttiva primaria è alla base del trattamento del carcinoma ovarico allo stadio avanzato e consiste in laparotomia con: aspirazione del liquido o lavaggio peritoneale, isterectomia totale extra-fasciale, annessiectomia bilaterale, omentectomia totale, appendicectomia, asportazione di tutta la malattia macroscopicamente visibile, inclusi i linfonodi pelvici e aortici aumentati di volume (2, 3). Il fattore prognostico più importante è rappresentato dalle dimensioni del residuo tumorale; attualmente la citoriduzione è definita ottimale per residuo inferiore o uguale ad 1 cm (12).
La chemioterapia sistemica adiuvante contenente in prima linea carbonplatino-paclitaxel è la più utilizzata (13). Recentemente è stata dimostrata la possibilità di somministrare agenti chemioterapici per via intra-peritoneale, con un incremento del tasso di sopravvivenza globale e libera da progressione rispetto alla chemioterapia endovenosa, a fronte però di maggiore tossicità soprattutto in termini di effetti gastrointestinali, dolore, febbre e infezioni del sito di inserzione del catetere (14).
In caso di citoriduzione non ottimale ed in assenza di progressione della malattia dopo i primi 3 cicli di chemioterapia, è proponibile la cosiddetta “chirurgia di intervallo”. Analogamente, la chemioterapia neoadiuvante seguita da “chirurgia di intervallo” rappresenta un’alternativa quando l’estensione della malattia sia tale da rendere impossibile una citoriduzione primaria ottimale, ovvero il rischio di complicanze peri- e post-operatorie, immediate e a lungo termine, sia maggiore dell’effettivo beneficio (3, 15). In casi particolari è proponibile il ricorso ad una laparoscopia esplorativa per meglio valutare la diffusione della malattia e la sua citoriducibilità chirurgica (5).
Indipendentemente dalla risposta alla chemioterapia di prima linea, il cui tasso è circa dell’80%, la maggior parte dei decessi avviene a causa delle recidive (13). Per tale ragione gran parte delle pazienti è candidata ad una terapia di seconda linea per prolungare la sopravvivenza e migliorare la QoL. In pazienti platino-sensibili (recidiva dopo più di 6 mesi dal termine della terapia di prima linea), l’associazione carbonplatino-paclitaxel viene utilizzata anche in seconda linea (3, 13). In pazienti platino-resistenti o –refrattarie (recidiva dopo meno di 6 mesi o in progressione durante chemioterapia di prima linea) la doxorubicina liposomiale peghilata (PLD) in associazione al carbonplatino potrebbe essere considerata un’alternativa alla terapia standard. Gli istotipi meno responsivi al platino sono il mucinoso e quello a cellule chiare; in quest'ultimo la gemcitabina ha mostrato fino ad ora il miglior profilo terapeutico. Altri approcci prevedono l'impiego di docetaxel, topotecano, trabectidina (3, 13).
Esistono dati limitati, ma significativi, sull'efficacia della radioterapia (Whole Abdominal Radiation Therapy-WART, o radioterapia intra-operatoria-IOERT), da sola o in associazione alla chemioterapia (endovenosa o intraperitoneale), somministrata a scopo adiuvante o palliativo (7, 16).
La citoriduzione chirurgica secondaria, in pazienti con malattia persistente o in progressione dopo chemioterapia, può essere considerata a scopo palliativo, per esempio nella risoluzione dell'ostruzione intestinale, oppure in pazienti giovani, con buon Performance Status, con ampio intervallo libero da malattia (> 1-2 anni) e recidive isolate, specie se in sedi addomino-pelviche in cui sia possibile una resezione completa (3, 7). Il ruolo della chirurgia “second look”, successiva a trattamento chirurgico e chemiotrapico di prima linea, sia laparoscopica che laparotomica (5), è attualmente confinato a studi clinici sperimentali per la valutazione di nuovi approcci terapeutici (3).
Alcune risposte derivano dall'utilizzo di agenti ormonali nelle recidive (tamoxifene, LH-RH analoghi, inibitori dell'aromatasi) (17). Una maggiore conoscenza a livello molecolare della patogenesi del carcinoma ovarico ha permesso l’identificazione di targets terapeutici: il Bevacizumab, anticorpo monoclonale specifico per il fattore vascolare di crescita endoteliale (VEGF-A), è tra i farmaci più investigati e promettenti. PARP è un enzima nucleare coinvolto nei meccanismi di riparazione del DNA e di apoptosi; cellule portatrici di mutazioni inattivanti dei geni BRCA1 e BRCA2, si sono dimostrate particolarmente sensibili all'impiego di PARP-inibitori (Olaparib) (13). Prospettive future includono: nuovi agenti citotossici (NX211, epotilone), inibitori del segnale di trasduzione (Iressa, Erlotinib, Trastuzumab), inibitori delle metalloproteinasi, modulatori della farmaco-resistenza (Decitabine, Valspodar, PS341), immunoterapia, terapia genica (17).
Il ruolo della terapia ormonale sostitutiva (HRT) è dibattuto: in alcuni studi il suo impiego non sembra influenzare la prognosi e non è controidicato in maniera assoluta, se non nelle pazienti con neoplasia a cellule della granulosa (18).
Bibliografia
- Vergote I, Trimbos BJ. Treatment of patients with early epithelial ovarian cancer. Curr Opin Oncol 2003, 15: 452-5.
- Angioli R, Benedetti Panici P, Bianchi U, et al. Diagnosi e terapia del carcinoma ovarico. Programma Nazionale per le Linee Guida 2004: 53-55.
- Aebi S, Castiglione M. Newly and relapsed epithelial ovarian carcinoma: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009, 20 (suppl 4): 21-3.
- Dodge J, Covens A, Lacchetti C, et al. Management of a suspicious adnexal mass. Toronto (ON): Cancer Care Ontario; 2011 Jul 07. Program in Evidence-based Care Evidence-Based Series No 4-15: in review.
- Angioli R, Muzii L, Battista C, et al. Il ruolo della laparoscopia nel carcinoma ovarico. Minerva Ginecol 2009, 61: 35-43.
- Colombo N, Peiretti M, Castiglione M, et al. Non-epithelial ovarian cancer: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009, 20 (suppl 4): 24-6.
- Australian Cancer Network and the National Breast Cancer Centre (incorporating the Ovarian Cancer Program): Clinical practice guidelines for the management of women with epithelial ovarian cancer. 2004, last update 2011: 78-9; 84-5; 103-6.
- Wright JD, Shah M, Mathew L, et al. Fertility preservation in young women with epithelial ovarian cancer. Cancer 2009, 115: 4118-26.
- Ng JS, Low JJH, Ilancheran A. Fertility preservation in gynaecological cancer: Epithelial ovarian cancer. Best Pract Res Clin Obstet Gynaecol 2012, 26: 371-7.
- Ovarian cancer: the recognition and initial management of ovarian cancer. National Collaborating Centre for Cancer 2011.
- Winter-Roach BA, Kitchener HC, Dickinson HO. Adiuvant (post-surgery) chemotherapy for early stage epithelial ovarian cancer (Review). Cochrane Database Syst Rev 2009, 2009: CD004706.
- Elattar A, Bryant A, Winter-Roach BA, et al. Optimal primary surgical treatment for advanced epithelial ovarian cancer. Cochrane Database Syst Rev 2011: CD007565.
- Kim A, Ueda Y, Naka T, et al. Review: Therapeutic strategies in epithelial ovarian cancer. J Exp Clin Cancer Res 2012, 31: 4-10.
- Jaaback K, Johnson N, Lawrie TA. Intraperitoneal chemotherapy for the initial management of primary epithelial ovarian cancer. Cochrane Database Syst Rev 2011: CD005340.
- Tangjitgamol S, Manusirivithaya S, Laopaiboon M, et al. Interval debulking surgery for advanced epithelial ovarian cancer. Cochrane Database Syst Rev 2009: CD006014.
- Gao, et al. Intraoperative radiotherapy electron boost in advanced and recurrent epithelial ovarian carcinoma: a retrospective study. BMC Cancer 2011, 11: 439.
- Conte PF, Sabbatini R, Pignata S. Tumori Epiteliali dell'Ovaio. Linee Guida AIOM 2005, 26: 28-30.
- Hinds L, Price J. Menopause, hormone replacement and gynaecological cancers. Menopause Int 2010, 16: 89-93.
Scheda anti-androgeni
Roberto Castello, Medicina/Endocrinologia, AOUI Verona
Francesca Zambotti, Endocrinologia e Malattie del Metabolismo, AOUI Verona
CIPROTERONE ACETATO
Meccanismo d’azione
- compete con il recettore per androgeni, impedendo agli androgeni di legarsi ai recettori;
- effetto antigonadotropo a livello centrale ipotalamo-ipofisario;
- debole attività corticosteroidea;
- effetto progestinico;
- riduce la funzionalità delle ghiandole sebacee.
Preparazioni, via di somministrazione, posologia
Esiste come:
- compresse con ciproterone acetato 2 mg in associazione fissa con etinilestradiolo 0.035 mg (Diane, Visofid), da assumere 1 cp/die per 21 giorni continuativi con le modalità tipiche degli estroprogestinici. Le compresse devono essere assunte con un po' di liquido, ogni giorno approssimativamente alla stessa ora, nell'ordine indicato sulla confezione. Si raccomanda di sospendere il trattamento tre-quattro cicli dopo la risoluzione completa delle condizioni per cui il prodotto è stato prescritto e la successiva ripresa se le condizioni patologiche androgeno-dipendenti dovessero ripresentarsi
- compresse con associazione sequenziale (Climen) estradiolo valerato 2 mg 11 cp e estradiolo valerato 2 mg + ciproterone acetato 1 mg 10 cp
- compresse da 50 mg, 100 mg, fiale im 330 mg (Androcur)
È stato utilizzato a dosaggio fra 12.5-100 mg/die di ciproterone acetato da assumere nei primi 10 giorni di un trattamento con estrogeni o estroprogestinici.
Indicazioni
- Associazione fissa ciproterone acetato 2 mg + etinilestradiolo 0.035 mg: malattie dermatologiche androgeno-dipendenti nella donna, quali forme conclamate di acne di ogni tipo, caduta dei capelli androgeno-dipendente (alopecia androgenetica) e forme modeste di irsutismo.
- Dosaggi maggiori di ciproterone acetato: trattamento anti-androgeno del carcinoma prostatico inoperabile.
Contro-indicazioni
Ipersensibilità nei confronti di uno qualunque dei componenti.
Gravidanza accertata o presunta.
Allattamento.
Giovani donne nelle quali i cicli mestruali non sono ancora stabilizzati.
Precedenti personali o familiari di patologia tromboembolica venosa idiopatica (TEV), quando l'anamnesi familiare si riferisce a TEV in fratelli o genitori in età relativamente giovane, processi tromboembolici venosi o arteriosi in atto o pregressi, presenza di uno o più fattori di rischio di trombosi venosa o arteriosa.
Disturbi cardiovascolari: ipertensione, patologia coronarica, valvulopatie, disturbi del ritmo che possono originare trombi.
Anemia falciforme.
Anamnesi di emicrania con sintomatologia neurologica focale.
Diabete mellito complicato da micro o macroangiopatie.
Patologia oftalmica di origine vascolare.
Disturbi del metabolismo lipidico.
Pancreatite in atto o pregressa se associata a grave ipertrigliceridemia.
Gravi disturbi della funzionalità epatica, finché gli indici di funzionalità epatica non siano tornati alla norma, ittero o intenso prurito gravidico nell'anamnesi, sindrome di Dubin-Johnson, sindrome di Rotor.
Malattie displasiche mammarie accertate con visita medica specialistica.
Patologie maligne ormono-dipendenti, accertate o sospette, degli organi genitali o della mammella.
Emorragia vaginale di natura non accertata.
Herpes gestationis nell'anamnesi.
Peggioramento dell'otosclerosi in corso di gravidanza.
Meningioma o anamnesi di meningioma
Grave depressione cronica
Precauzioni d'uso
Per l’associazione fissa di ciproterone acetato 2 mg + etinilestradiolo 0.035 mg:
- prima di iniziare l'assunzione è opportuno eseguire una visita medica generale e ginecologica completa (compreso la mammella e il Pap-test) e valutare attentamente l'anamnesi familiare e i fattori di rischio di malattia tromboembolica arteriosa e venosa. Se qualche membro della famiglia è stato affetto da malattie tromboemboliche (come trombosi venosa profonda, ictus, infarto miocardico) in giovane età, sarà necessario escludere eventuali disturbi della coagulazione;
- non associare ad altri contraccettivi ormonali;
- il fumo di sigarette aumenta il rischio di gravi effetti collaterali cardiovascolari;
- la terapia deve essere interrotta se si presentano sintomi premonitori di imminenti complicazioni: cefalee intense insolite, disturbi visivi, pressione arteriosa elevata, segni clinici di flebite ed embolia polmonare;
- escludere stato di gravidanza.
Per ciproterone singolo:
- eseguire test di funzionalità epatica prima dell'inizio del trattamento, ad intervalli regolari durante il trattamento ed ogniqualvolta si manifesti una sintomatologia correlabile ad epatotossicità;
- i pazienti con eventi trombotici/tromboembolici pregressi a livello arterioso o venoso (ad es. trombosi venosa profonda, embolia polmonare, infarto del miocardio), oppure anamnesi di ictus o tumori in stadio avanzato, sono soggetti a un maggiore rischio di ulteriori eventi tromboembolici;
- il fabbisogno di insulina o di farmaci antidiabetici orali può modificarsi durante il trattamento con ciproterone;
- ad alti dosaggi controllare regolarmente la funzione corticosurrenale, dal momento che i dati preclinici ne indicano una possibile soppressione, dovuta all'effetto simil-corticoide;
- contiene lattosio: i pazienti affetti da rari problemi ereditari di intolleranza al galattosio, deficit di lattasi o malassorbimento di glucosio-galattosio, non devono assumere questo medicinale;
- questo farmaco è metabolizzato dal CYP3A4:
- potenti inibitori del CYP3A4 (ketoconazolo, itraconazolo, clotrimazolo, ritonavir e altri) possono inibire il metabolismo del ciproterone acetato
- induttori del CYP3A4 (rifampicina, fenitoina e prodotti contenenti Hypericum perforatum - erba di S. Giovanni) possono ridurre i livelli di ciproterone acetato
- statine e ciproterone condividono la stessa via metabolica CYP3A4, per cui può aumentare il rischio di rabdomiolisi o miopatie associate alle statine in caso di cosomministrazione.
Effetti collaterali
Si osservano a volte lievi emorragie (spotting) o emorragie inter-mestruali, in particolare durante i primi tre mesi di impiego, che cessano in genere spontaneamente. L'assunzione irregolare può dare luogo ad emorragie inter-mestruali e può compromettere l'affidabilità terapeutica e contraccettiva.
Disturbi gastrointestinali.
Sono state osservate tossicità epatica diretta con ittero, epatite ed insufficienza epatica. L'epatotossicità è dose–correlata e, in genere, si manifesta diversi mesi dopo l'inizio del trattamento.
Molto raramente tumori epatici benigni e maligni, che possono provocare emorragia intra-addominale pericolosa per la vita.
È stata segnalata la comparsa di meningiomi (singoli e multipli) in associazione con l'uso prolungato (anni) di dosi di ciproterone acetato ≥ 25 mg/die.
È stata riportata la comparsa di eventi tromboembolici. Il fumo di sigarette aumenta il rischio di gravi effetti collaterali cardiovascolari
Noto effetto stimolatorio del progesterone e dei progestinici sintetici sul respiro, che è accompagnato da ipocapnia e alcalosi respiratoria compensata e non è considerato tale da richiedere trattamento.
Limitazioni prescrittive
L’associazione fissa di ciproterone acetato 2 mg + etinilestradiolo 0.035 mg non può essere prescritta al solo scopo contraccettivo in assenza delle patologie androgeno-dipendenti che ne costituiscono la specifica indicazione d’uso.
L’uso del ciproterone nella donna è off-label al di fuori dell’associazione fissa con etinilestradiolo.
SPIRONOLATTONE
Meccanismo d’azione
- antagonista specifico dell'aldosterone, agisce a livello del tubulo distale renale, bloccando perciò l'aumento del riassorbimento del sodio e del cloro e l'aumento dell'escrezione del potassio, normalmente indotti dai mineralcorticoidi;
- compete con il testosterone ed il di-idrotestosterone per il legame al recettore per androgeni anche a livello del follicolo pilifero;
- inibisce l’attività della 5alfa-reduttasi;
- bassa attività progestinica;
- ad alte dosi inibisce la steroidogenesi ovarica e surrenale.
Preparazioni, via di somministrazione, posologia
Compresse per uso orale da 25 (Aldactone, Spirolang), 50 mg (Spirolang) e 100 mg (Aldactone, Spirolang, Uractone) (lo spironolattone si trova anche in preparati di associazione con diuretici). La compressa deve essere inghiottita senza masticare e con una sufficiente quantità di fluidi (circa 1/2 bicchiere). É consigliabile assumere il farmaco con la prima colazione.
La posologia abituale nell’irsutismo è di 50-100 mg/die, ma è utilizzato a dosaggio fra 50 e 200 mg/die.
Indicazioni
Trattamento dell'iperaldosteronismo primario o secondario e dell'ipertensione arteriosa essenziale, laddove altre terapie non sono risultate sufficientemente efficaci o tollerate.
Contro-indicazioni
Lo spironolattone non deve essere usato in pazienti:
- con ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti;
- con compromessa funzionalità renale e clearance della creatinina < 30 mL/min per 1.73 m2 di superficie corporea, insufficienza renale acuta o anuria;
- con iperkaliemia;
- con grave iponatriemia;
- con ipovolemia o disidratazione;
- durante la gravidanza;
- nelle donne durante l'allattamento.
Precauzioni d'uso
Lo spironolattone può causare alterazioni vocali. Ciò richiede attenzione nel determinare se iniziare la terapia con spironolattone nei pazienti per i quali la voce riveste un ruolo importante nell'attività lavorativa (ad es. attori, cantanti, insegnanti).
É necessario un monitoraggio particolarmente attento nei seguenti casi:
- pazienti con grave ipotensione;
- pazienti con ridotta funzionalità renale (per via di un aumento del rischio di iperkaliemia).
La terapia con spironolattone richiede regolari controlli dei livelli sierici di sodio, potassio, creatinina e glucosio. Sono necessari frequenti controlli della potassiemia nei pazienti con compromessa funzionalità renale e clearance della creatinina < 60 mL/min per 1.73 m2 di superficie corporea, così come nei pazienti in cui spironolattone viene somministrato con altri farmaci che possono portare ad aumento della potassiemia.
Durante la terapia con spironolattone evitare la somministrazione di potassio, sia sotto forma di medicamento che di dieta ricca di potassio, a meno che non si pratichi contemporaneamente un trattamento con cortisonici.
Le compresse contengono saccarosio quindi non sono adatte per i soggetti con intolleranza ereditaria al fruttosio, sindrome da malassorbimento di glucosio/galattosio o deficit di saccarasi-isomaltasi.
Effetti collaterali
Poliuria, astenia.
Iposodiema, che si manifesta con secchezza delle fauci, sete, sonnolenza, ecc, specie se il farmaco è associato ad altri diuretici.
Iperkaliemia con frequenza cardiaca irregolare, affaticamento o debolezza muscolare. Il rischio è particolarmente elevato nei pazienti con alterazioni della funzionalità renale.
Acidosi ipercloremica abitualmente con iperpotassiemia, specie in pazienti con cirrosi epatica in fase di scompenso.
Aumento dei valori dell'azotemia, soprattutto in presenza di insufficienza renale.
Ipotensione.
Metrorragia o sanguinamenti uterini disfunzionali.
Tensione mammaria, mastodinia e ingrossamento mammario.
Raucedine e abbassamento del tono di voce che in alcuni pazienti persistono anche dopo la sospensione del farmaco.
Nausea, vomito o diarrea.
In casi isolati aumento degli enzimi epatici o ulcere gastriche (anche con sanguinamento).
Reazioni cutanee allergiche o di tipo allergico (tra cui orticaria) ed alterazioni del quadro ematico (eosinofilia, agranulocitosi).
Limitazioni prescrittive
Off-label l’uso per il trattamento dell’irsutismo.
FLUTAMIDE
Meccanismo d’azione
il suo esatto meccanismo d'azione è tuttora sconosciuto. Si ipotizza che la flutamide e/o i suoi metaboliti inibiscano il legame del testosterone e/o del diidrotestosterone al recettore, impedendo in tal modo agli androgeni di esercitare i loro effetti biologici.
Preparazioni, via di somministrazione, posologia
Compresse per uso orale da 250 mg (Flutamide EG). La compressa deve essere assunta intera con del liquido dopo i pasti.
La posologia abituale nella donna è di 125-250 mg/die, ma è stata utilizzata a dosaggio fra 125 e 500 mg/die.
Indicazioni
Trattamento del carcinoma della prostata in stadio avanzato, in cui è indicata la soppressione dell'effetto del testosterone; trattamento palliativo del carcinoma prostatico-metastatizzato ed inoperabile, in associazione con un agonista LH-RH o con la castrazione chirurgica.
Contro-indicazioni
Ipersensibilità al principio attivo flutamide o a qualsiasi eccipiente delle compresse.
Precauzioni d'uso
Prima di iniziare il trattamento e durante il trattamento stesso con flutamide, è necessario controllare regolarmente la funzionalità epatica, in particolare se sono presenti segni e sintomi di disfunzione epatica (ad esempio, prurito, urine scure, anoressia persistente, ittero, dolore in sede epigastrica destra o sintomi non specifici simil-influenzali). La terapia non deve essere iniziata o deve essere interrotta se i valori di transaminasi sono superiori di due-tre volte il livello normale o se i test di laboratorio indicano un danno epatico. Gli effetti sulla funzionalità epatica sono generalmente reversibili dopo l'interruzione del trattamento, tuttavia sono stati segnalati decessi conseguenti a gravi danni epatici associati all'uso di flutamide.
I pazienti che presentino disturbi della funzionalità renale devono essere tenuti sotto stretta osservazione durante il trattamento con flutamide.
La somministrazione di flutamide tende ad aumentare i livelli plasmatici di testosterone.
Dato che si può manifestare una ritenzione di liquidi, il farmaco deve essere usato con cautela in presenza di malattia cardiaca.
In caso di cianosi, dovrà essere controllata la metaemoglobinemia, che è determinata da un sovradosaggio.
Effetti collaterali
Secchezza cutanea, cefalea, nausea, vomito, diarrea.
Aumento delle transaminasi plasmatiche e talvolta di bilirubina. In alcuni pazienti i valori sono tornati normali senza aggiustare il dosaggio. Sono stati segnalati sporadici casi di grave epatite tossica, necrosi epatica ed encefalopatia epatica, effetti solitamente reversibili una volta terminato il trattamento. Tuttavia sono stati riportati casi isolati di decesso associato ad insufficienza epatica determinata dal trattamento con flutamide.
Incremento reversibile dei livelli plasmatici del testosterone.
Miglioramento delle irregolarità mestruali.
In alcuni pazienti si sono notati sindrome simil-influenzale, disturbi gastrici, pirosi, dolore simil-ulceroso, sete, costipazione, edema, linfoedema, ecchimosi, herpes zoster, sindrome simil-lupoide, prurito, crampi muscolari, dolore toracico, stanchezza, malessere e visione offuscata.
Effetti collaterali rari: confusione, anemia, leucopenia, trombocitopenia, metaemoglobinemia, lieve colorazione verde delle urine e disturbi cardiovascolari.
Limitazioni prescrittive
Off-label nella donna
FINASTERIDE
Meccanismo d’azione
Inibizione competitiva specifica dell'enzima intracellulare 5α-reduttasi di tipo II (prostatico) e tipo I (cutaneo), inibendo così la conversione di testosterone in diidrotestosterone.
Preparazioni, via di somministrazione, posologia
Compresse rivestite con film da 5 mg per uso orale (Asterid, Finedor, Finasteride ABC, Finasteride AHCL, Finasteride Almus, Finasteride Alter, Finasteride DOC, Finasteride EG, Finasteride Ipso, Finasteride Mylan, Finasteride Pensa, Finasteride Sandoz, Finasteride Sun, Finasteride Tecnigen, Finasteride TEVA, Finasteride Zentiva, Finastid, Finestar, Genaprost, Ormicton, Proscar, Prostide, Ridestin, Sitas, Stecur, Terip).
Esiste anche come cp da 1 mg (Carefinast, Filasel, Fendazel, Finacapil, Finasteride AHCL, Finasteride Aurobindo, Finasteride Biorga, Finasteride EG, Finasteride Mylan, Finasteride Pensa, Propecia).
La posologia abituale nella donna è di 5 mg/die, ma è utilizzata a dosaggio fra 2.5 e 7.5 mg/die.
La compressa deve essere assunta intera, con o senza cibo. E’ necessario un trattamento di almeno 6 mesi per stabilire obiettivamente se la risposta ottenuta sia o meno soddisfacente.
Indicazioni
Finasteride 5 mg: trattamento e controllo dell'iperplasia prostatica benigna (IPB), finalizzata alla regressione dell'iperplasia della prostata, al miglioramento del flusso urinario e dei sintomi associati all'IPB, alla riduzione dell'incidenza di ritenzione urinaria acuta e della necessità d'intervento chirurgico.
Finasteride 1 mg: stati precoci di alopecia androgenetica negli uomini di età compresa tra i 18 e i 41 anni. Non è stata stabilita l'efficacia nella recessione bitemporale e nello stadio terminale della perdita dei capelli.
Contro-indicazioni
Ipersensibilità alla finasteride o ad uno qualsiasi degli eccipienti.
Controindicato nelle donne e bambini.
Precauzioni d'uso
Se somministrata in donne gravide in caso di un feto di sesso maschile, può inibire lo sviluppo dei genitali esterni nel feto.
Non sono disponibili dati relativi a pazienti con insufficienza epatica. Si consiglia prudenza in pazienti con ridotta funzionalità epatica, poichè i livelli plasmatici di finasteride possono risultare aumentati.
Non sono necessarie modifiche del dosaggio in pazienti affetti da insufficienza renale di vario grado (a partire da un livello di clearance della creatinina pari a 9 mL/min). La finasteride non è stata studiata in pazienti sottoposti ad emodialisi.
Il medicinale contiene lattosio monoidrato e non deve essere assunto da pazienti con rari disturbi ereditari di intolleranza al galattosio, con sindrome di deficienza di Lapp-lattasi o malassorbimento di glucosio-galattosio.
Effetti collaterali
Sintomi gastrointestinali, cefalea, riduzione della libido.
Non comuni o rari: eruzioni cutanee, prurito, orticaria, reazioni da ipersensibilità, quali edema del viso e delle labbra.
Per la sua modalità d'azione, in corso di terapia si riscontra un aumento dei livelli di testosteronemia.
Limitazioni prescrittive
Off-label nella donna.
| Riassunto comparativo degli anti-androgeni | ||||
| Molecola | Azione | Vantaggi | Svantaggi | Prescrivibilità e costo mensile |
| Ciproterone acetato | Antagonista recettoriale androgeni; effetto antigonadotropo centrale; effetto progestinico; riduce la funzionalità delle ghiandole sebacee; debole attività corticosteroidea | Indicazione d’uso per gli iperandrogenismi nella donna per la formulazione in associazione fissa con etinilestradiolo | Possibile spotting, epatotossicità, patologia tromboembolica venosa, disturbi gastrointestinali; metabolizzato dal CYP3A4 | RNR, classe A; Diane o Visofid, 21 cpr |
| Spironolattone | Antagonista dell'aldosterone; antagonista recettoriale di testosterone e di-idrotestosterone; inibisce la 5α-reduttasi; bassa attività progestinica; ad alte dosi inibisce la steroidogenesi ovarica e surrenale | Indicato in caso di iperaldosteronismo e di ipertensione arteriosa | Non usare in insufficienza renale acuta o cronica (clearance creatinina < 30 mL/min/1.73 m2); poliuria; ipotensione; astenia; iperkaliemia; iponatriemia; alterazioni vocali | Off-label per l’iperandrogenismo nella donna 25 mg, 16 cps 100 mg 10 cpr riv o cps |
| Flutamide | Antagonista recettoriale di testosterone e di-idrotestosterone | Miglioramento delle irregolarità mestruali | Tossicità epatica: controlli regolari della funzionalità epatica; aumenta i livelli plasmatici di testosterone; ritenzione di liquidi; secchezza cutanea, cefalea, nausea, vomito, diarrea, sindrome simil-influenzale | Off-label nella donna
Necessità di consenso informato 250 mg, 21 cpr 250 mg, 30 cpr |
| Finasteride | Inibizione competitiva della 5α-reduttasi e conseguente inibizione della conversione del testosterone in diidrotestosterone | Usabile in insufficienza renale | Non utilizzabile in pazienti con ridotta funzionalità epatica; sintomi gastrointestinali, cefalea; aumenta i livelli plasmatici di testosterone | Off-label nella donna
5 mg, 15 cpr |
Scheda estro-progestinici
Cecilia Motta
Endocrinologia, Ospedale S. Andrea, Roma
(aggiornato al 11 febbraio 2018)
MECCANISMO D’AZIONE
Tendono a riprodurre le modificazioni indotte dalla funzione ovarica sui vari organi e apparati
INDICAZIONI
Contraccezione, terapia ormonale sostitutiva
CONTRO-INDICAZIONI
Trombosi venosa (TVP, embolia polmonare) o arteriosa (ictus, infarto miocardico) in atto o pregresse, o condizioni prodromiche come angina pectoris o attacco ischemico transitorio.
Presenza di fattori di rischio gravi o molteplici per trombosi arteriosa, quali valvulopatia o disturbi del ritmo.
Predisposizione ereditaria o acquisita alla trombosi venosa o arteriosa, come resistenza APC, deficit di anti-trombina III, deficit proteina C, deficit proteina S, iperomocisteinemia, anticorpi anti-fosfolipidi (anticorpi anti-cardiolipina, lupus anti-coagulante).
Diabete mellito con complicanze vascolari.
Patologia oftalmica di origine vascolare.
Grave ipertensione.
Grave dislipoproteinemia.
Gravi patologie epatiche in atto o pregresse, fino al ritorno alla normalità dei valori della funzionalità epatica.
Tumori del fegato (benigni o maligni) in atto o pregressi.
Grave insufficienza renale o danno acuto renale.
Forme maligne accertate o sospette degli organi genitali o della mammella, se ormono-dipendenti.
Perdite ematiche vaginali di natura non accertata.
Anamnesi di emicrania accompagnata da sintomi neurologici focali.
Gravidanza accertata o presunta.
Fumatrici di età superiore a 35 anni.
PRECAUZIONI
Prima di iniziare o di ricominciare la somministrazione di un contraccettivo orale combinato si deve raccogliere una completa anamnesi medica e si deve effettuare un esame fisico. L’esame deve essere ripetuto, durante l’impiego dei contraccettivi orali combinati, almeno una volta l’anno, perché controindicazioni o fattori di rischio possono comparire per la prima volta durante l’impiego di un contraccettivo orale combinato. La frequenza ed il tipo di queste valutazioni debbono essere adattati individualmente alla paziente, ma debbono in genere rivolgere particolare attenzione a pressione arteriosa, mammelle, addome e pelvi, compresi citologia cervicale e i relativi esami di laboratorio. Le donne debbono essere avvisate che i contraccettivi orali non proteggono nei confronti dell’infezione da HIV (AIDS), né di altre malattie a trasmissione sessuale.
EFFETTI COLLATERALI
Complicanze più comuni che non richiedono in genere la sospensione del trattamento, ma per le quali si può considerare l'uso di un'associazione contraccettiva orale alternativa: nausea, cefalee leggere, aumento di peso, irritabilità, pesantezza alle gambe; tensione al seno, emorragie inter-mestruali, variazioni nella secrezione vaginale, modifiche nella frequenza, intensità o durata del sanguinamento vaginale, amenorrea, alterazioni della libido; irritazione oculare con l'uso delle lenti a contatto.
Relativamente rare che però richiedono la sospensione del trattamento: accidenti trombo-embolici arteriosi (in particolare infarto miocardico, accidente cerebro-vascolare); accidenti trombo-embolici venosi (flebite, embolia polmonare); ipertensione, coronaropatia; iperlipidemia (ipertrigliceridemia e/o ipercolesterolemia); mastodinia grave, mastopatia benigna; cefalee intense e insolite, emicrania, vertigini, alterazioni della vista; esacerbazione dell'epilessia; adenoma epatico, ittero colestatico; cloasma.
Raramente: disturbi cutanei (acne, seborrea, ipertricosi, eruzione, eritema nodoso, eritema multiforme); umore depresso; vomito; reazioni di ipersensibilità.
Altri effetti indesiderati: litiasi biliare, ritenzione di fluidi.
Effetti alla sospensione del trattamento: amenorrea post-trattamento, in genere a risoluzione spontanea.
| Frequenza degli effetti collaterali | |||
| Classificazione per sistemi e organi | Comune (da 1/10 a 1/100) |
Non comune (da 1/100 a 1/1.000) |
Raro (da 1/1.000 a 1/10.000) |
| Disturbi del sistema immunitario | Ipersensibilità | ||
| Disturbi del metabolismo e della nutrizione | Ritenzione di liquidi | ||
| Disturbi psichiatrici | Umore depresso, alterazioni dell’umore | Riduzione della libido | Aumento della libido |
| Patologie del sistema nervoso | Mal di testa | Emicrania | |
| Patologie dell’occhio | Intolleranza alle lenti a contatto | ||
| Patologie gastro-intestinali | Nausea, dolori addominali | Vomito, diarrea | |
| Patologie di cute e sottocute | Eruzione, orticaria | Eritema nodoso, eritema multiforme | |
| Patologie dell’apparato riproduttivo e della mammella | Dolore al seno, tensione mammaria | Ipertrofia mammaria | Secrezioni vaginali, secrezioni mammarie |
| Peso corporeo | Aumento di peso | Perdita di peso | |
PREPARAZIONI, VIA DI SOMMINISTRAZIONE, POSOLOGIA E LIMITAZIONI PRESCRITTIVE
Monofasici
- Ciproterone Acetato 2 mg + Etinilestradiolo 35 µg, 21 cp, classe A (Diane, Visofid)
- Clormadinone 2 mg + Etinilestradiolo 30 µg, 21 cp, classe C (Belara, Eve, Lybella, Mytulip)
- Desogestrel 150 µg + Etinilestradiolo 20 µg, 21 cp, classe C (Mercilon, Novynette, Securgin)
- Desogestrel 150 µg + Etinilestradiolo 30 µg, 21 cp, classe C (Planum, Practil)
- Dienogest 2 mg + Etinilestradiolo 30 µg, 21 cp, classe C (Dienogest e Etinilestradiolo DOC, Effiprev, Sibilla, Novadien) o 28 cp (Aglae, Cemisiana, Dailyprev, Dienogest e Etinilestradiolo DOC, Serisima, Sibillette)
- Dienogest 2 mg + 17ß-estradiolo 1 mg, 28 cp, classe C (Paudien)
- Diidrogesterone 5 mg + 17ß-estradiolo 1 mg, 28 cp, classe A (Femoston 1/5)
- Drospirenone 3 mg + Etinilestradiolo 30 µg, 21 cp, classe C (Bellverene, Calindir, Drosure, Etinilestradiolo e Drospirenone DOCgen, Lusine, Midiana, Myviolet, Yasmin)
- Drospirenone 3 mg + Etinilestradiolo 20 µg, 21 cp, classe C (Chrystelle, Drosurelle, Etinilestradiolo e Drospirenone DOC, Liladros, Lusinelle, Rubira, Yasminelle) o 28 cp, classe C (Daylette, Drospil, Lerna, Lutiz, Mycyclamen, Mywy, Rubidelle, Yaz)
- Drospirenone 2 mg + estradiolo emiidrato 1 mg, 28 cp, classe A (Angeliq, Paosonelle)
- Gestodene 60 µg + Etinilestradiolo 15 µg, 28 cp, classe C (Arianna, Minesse, Yvette)
- Gestodene 75 µg + Etinilestradiolo 20 µg, 21 cp, classe C (Brilleve, Estinette, Fedra, Gestodiol, Harmonet)
- Gestodene 75 µg + Etinilestradiolo 30 µg, 21 cp, classe C (Brilleve, Gestodiol, Ginoden, Kipling, Minulet, Mymarigold)
- Levonorgestrel 100 µg + Etinilestradiolo 20 µg, 21 cp, classe C (Jadiza, Lasca, Lestronette, Loette, Miranova, Myfreesia, Naomi)
- Levonorgestrel 150 µg + Etinilestradiolo 30 µg, 21 cp, classe C (Egogyn) o 84 + 7 cp, classe C (Seasonique)
- Nomegestrolo 2.5 mg + Estradiolo emiidrato 1.5 mg, 24 + 4 cp, classe C (Zoely)
- Noretisterone 0.5 mg + Estradiolo emiidrato 1 mg, 28 cp, classe A (Activelle)
Bifasici
- Ciproterone Acetato 1 mg + Estradiolo Valerato 2 mg (11 cp con Estradiolo Valerato 2 mg + 10 cp con Ciproterone Acetato 1 mg + Estradiolo Valerato 2), classe C (Climen)
- Desogestrel + Etinilestradiolo, 22 cp (7 cp azzurre 25 µg + 40 µg, 15 cp bianche 125 µg + 30 µg), classe C (Gracial)
- Diidrogesterone 10 mg + 17ß-estradiolo 1 mg (14 cp con 17ß-estradiolo 1 mg + 14 cp con Diidrogesterone 10 mg + 17ß-estradiolo 1 mg) classe A (Femoston 1/10 L)
- Diidrogesterone 10 mg + 17ß-estradiolo 2 mg (14 cp con 17ß-estradiolo 1 mg + 14 cp con Diidrogesterone 10 mg + 17ß-estradiolo 2 mg) classe A (Femoston 2/10 L)
- Medrossiprogesterone Acetato 10 mg + estradiolo valerato 2 mg (11 cp con estradiolo valerato 2 mg + 10 cp con medrossiprogesterone acetato 10 mg e estradiolo valerato 2 mg) classe C (Filena)
- Nomegestrolo 3.75 mg + Estradiolo 1.5 mg (10 cp con 1.5 mg di estradiolo, 14 cp con 1.5 mg di estradiolo + 3.75 mg di nomegestrolo), classe A (Naemis)
Trifasici
- Desogestrel + etinilestradiolo, 21 cp (7 cp gialle 50 µg + 35 µg, 7 cp rosse 100 µg + 30 µg, 7 cp bianche 150 µg + 30 µg) classe C (Lucille)
- Gestodene + etinilestradiolo, 21 cp (6 cp beige 50 µg + 30 µg, 5 cp marrone 70 µg + 40 µg, 10 cp bianche 100 µg + 30 µg), classe C (Triminulet)
Polifasica
- Dienogest + estradiolo valerato, 28 cp (2 cp giallo scuro con 3 mg di EV, 5 cp rosse con 2 mg di EV e 2 mg di D, 17 cp giallo chiaro con 2 mg di EV e 3 mg di D, 2 cp rosso scuro con 1 mg di EV, 2 cp bianche che non contengono principi attivi), classe C (Klaira)
Non orali
- Etonogestrel + etinilestradiolo (anello vaginale rilascia 120 µg + 15 µg/die), classe C (Nuvaring)
- Levonorgestrel 525 µg + estradiolo emiidrato 1.5 mg (cerotti transdermici, rilascia nelle 24 h 7 µg di levonorgestrel e 50 µg di estradiolo), classe A (Femity)
- Norelgestromina 6 mg + etinilestradiolo 600 µg (3 cerotti transdermici), classe C (Evra)
| Tabella sinottica degli estro-progestinici impiegati come contraccettivi | |||
| Progestinico (µg) | Estrogeno (µg) | Nome commerciale | Classe di prescrivibilità |
| Ciproterone acetato (2000) | Etinil-estradiolo (35) | Diane, 21 cp Visofid, 21 cp |
C |
| Clormadinone (2000) | Etinil-estradiolo (30) | Belara, 21 cpr riv (o 3 o 6 o 13 blister di 21 cpr) Eve, 21 cpr riv (o 3 o 4 o 6 blister di 21 cpr) Lybella, 21 cpr riv (o 3 o 6 blister di 21 cpr) |
C |
| Desogestrel (25-125) | Etinil-estradiolo (30-40) | Gracial, 22 cpr (o 66 cpr) | C |
| Desogestrel (50-100-150) | Etinil-estradiolo (35-30-30) | Lucille, 21 cpr (o 3 o 6 blister di 21 cpr) | C |
| Desogestrel (150) | Etinil-estradiolo (20) | Mercilon, 21 cpr (o 3 o 6 blister di 21 cpr) Novynette, 21 cpr (o 3 blister di 21 cpr) Securgin, 21 cpr (o 3 o 6 blister di 21 cpr) |
C |
| Desogestrel (150) | Etinil-estradiolo (30) | Planum, 21 cpr (o 3 blister di 21 cpr) Practil, 21 cp |
C |
| Dienogest (2000) | Etinil-estradiolo (30) | Novadien, 21 cpr (o 3 blister di 21 cpr) Serisima, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Sibilla 21 cpr (o 3 o 6 blister di 21 cpr) |
C |
| Dienogest (0-2000-3000-0-0) | Estradiolo valerato (3000-2000-2000-1000-0) | Klaira, 28 cpr | C |
| Drospirenone (3000) | Etinil-estradiolo (20) | Bravela, 24 + 4 cpr (o 3 o 6 o 13 blister di 24 + 4 cpr) Chrystelle, 21 cpr riv (o 2 o 3 o 6 o 13 blister di 21 cpr) Credigynette, 28 cpr (o 2 o 3 o 6 o 13 blister di 28 cpr) Daylette, 24 + 4 cpr (o 3 o 6 o 13 blister di 24 + 4 cpr) Drospil, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Drosurelle, 21 cpr riv (o 2 o 3 o 6 o 13 blister di 21 cpr) Kilmer, 24 + 4 cpr (o 3 o 6 o 13 blister di 24 + 4 cpr) Lerna, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Liladros, 21 cpr riv (o 3 blister di 21 cpr) Lusinelle, 21 cpr riv (o 2 o 3 o 6 o 13 blister di 21 cpr) Lutiz, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Mywy, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Rubidelle, 28 cpr (o 3 o 6 o 13 blister di 28 cpr) Rubira, 21 cpr riv (o 2 o 3 o 6 o 13 blister di 21 cpr) Yasminelle, 21 cpr riv (o 3 o 6 o 13 blister di 21 cpr) Yaz, 28 cpr riv (o 3 o 6 blister di 28 cpr) |
C |
| Drospirenone (3000) | Etinil-estradiolo (30) | Bellverene, 21 cpr (o 3 o 13 blister di 21 cpr) Calindir, 21 cpr (o 3 o 6 o 13 blister di 21 cpr) Credigyne, 28 cpr (o 2 o 3 o 6 o 13 blister di 28 cpr) Drosure, 21 cpr (o 2 o 3 o 6 o 13 blister di 21 cpr) Lusine, 21 cpr (o 2 o 3 o 6 o 13 blister di 21 cpr) Midiana, 21 cpr (o 3 o 6 o 13 blister di 21 cpr) Yasmin, 21 cpr riv 21 cpr (o 3 o 6 o 13 blister di 21 cpr) |
C |
| Etonogestrel (120) | Etinil-estradiolo (15) | Nuvaring, 1 dispositivo vaginale (per 3 settimane, rilascia 0.120 mg/0.015 mg ogni 24 ore) (o 1 confezione con 3 dispositivi) | C |
| Gestodene (60) | Etinil-estradiolo (15) | Arianna, 28 cpr riv (o 3 o 6 blister di 28 cpr) Minesse, 28 cpr riv (o 3 o 6 blister di 28 cpr) Yvette, 28 cpr riv (o 3 o 6 blister di 28 cpr) |
C |
| Gestodene (75) | Etinil-estradiolo (20) | Brilleve, 21 cpr Edesia, 21 cpr (o 3 o 6 blister di 21 cpr) Estinette, 21 cpr riv (o 3 o 6 blister di 21 cpr) Fedra, 21 cpr riv Gestodiol 0.075 + 0.020 mg, 21 cpr riv (o 3 o 6 blister di 21 cpr) Harmonet, 21 cpr riv |
C |
| Gestodene (75) | Etinil-estradiolo (30) | Brilleve, 21 cpr Gestodiol 0.075 + 0.030 mg, 21 cpr riv (o 3 o 6 blister di 21 cpr) Ginoden, 21 cpr riv Kipling, 21 cpr riv (o 3 blister di 21 cpr) Minulet, 21 cpr riv |
C |
| Gestodene (50-70-100) | Etinil-estradiolo (30-40-30) | Triminulet, 21 cpr riv | C |
| Levonorgestrel (100) | Etinil-estradiolo (20) | Lestronette, 21 cpr (o 3 o 6 blister di 21 cpr) Loette, 21 cpr riv (o 3 blister di 21 cpr) Miranova, 21 cpr riv Naomi, 21 cpr (o 3 o 6 o 13 o 50 blister di 21 cpr) |
C |
| Levonorgestrel (150) | Etinil-estradiolo (30) | Egogyn, 21 cpr riv Seasonique, 84 + 7 cpr |
C |
| Nomegestrolo (2500) | Estradiolo (1500) | Zoely, 24 + 4 cpr (o 144 + 24 cpr o 312 + 52 cpr) | C |
| Norelgestromina (6000) | Etinil-estradiolo (60) | Evra, 3 cerotti | C |
| Tabella sinottica degli estro-progestinici impiegati in menopausa | |||
| Progestinico (µg) | Estrogeno (µg) | Nome commerciale | Classe di prescrivibilità |
| Ciproterone acetato (0-1000) | Estradiolo valerato (200) | Climen, 21 cpr riv | C |
| Diidrogesterone (2500) | Estradiolo (500) | Femoston 0.5/2.5, 28 cpr (o 84 cpr o 280 cpr in blister) | A |
| Diidrogesterone (5000) | Estradiolo (1000) | Femoston 1/5 Conti, 28 cpr riv | A |
| Diidrogesterone (10.000) | Estradiolo (2000) | Femoston 2/10 Conti, 28 cpr riv | A |
| Diidrogesterone (10.000) | Estradiolo (1000) | Femoston L 1/10, 28 cpr riv | A |
| Drospirenone (2000) | Estradiolo (1000) | Angeliq, 28 cpr riv (o 3 blister di 28 cpr) | A |
| Levonorgestrel (7/24h) | Estradiolo (50/24h) | Femity 1.5 + 0.525 mg, 4 cerotti (o 12 cerotti) | A |
| Medrossiprogesterone (0-10.000) | Estradiolo valerato (2000) | Filena, 21 cpr (o 3 blister da 21 cpr) | C |
| Nomegestrolo (0-3750) | Estradiolo (1500) | Naemis, 24 cpr | A |
Scheda estrogeni
Cecilia Motta
Endocrinologia, Ospedale S. Andrea, Roma
(aggiornato al 13 febbraio 2018)
MECCANISMO D’AZIONE
Attivano recettori specifici
INDICAZIONI
Terapia sostitutiva in menopausa
Alterazioni mestruali se in associazione con progestinico
Induzione della pubertà
CONTRO-INDICAZIONI
Carcinoma mammario pregresso, sospetto o accertato
Tumori maligni estrogeno-dipendenti (es. carcinoma endometriale) sospetti o accertati
Sanguinamento genitale di natura non accertata; iperplasia endometriale non trattata
Tromboembolismo venoso (es. trombosi venosa profonda, embolia polmonare) o arterioso (es. ictus, angina pectoris, infarto miocardico) in atto o pregresso
Epatopatia acuta o storia di epatopatia finché gli esami di funzionalità epatica non siano tornati nella norma
Ipersensibilità nota ai principi attivi o ad uno degli eccipienti
Porfiria
Mastite cronica ricorrente o mammografia anormale, salvo che il medico non giudichi indispensabile la cura
Gravidanza e allattamento
Non usare da solo in presenza di utero.
EFFETTI COLLATERALI
| Frequenza degli effetti collaterali | |||||
| Classificazione per sistemi e organi | Frequente (> 1/10) |
Comune (da 1/10 a 1/100) |
Non comune (da 1/100 a 1/1.000) |
Raro (da 1/1.000 a 1/10.000) |
Molto raro (< 1/10.000) |
| Patologie dell’apparato riproduttivo e della mammella | Tensione mammaria | Emorragia da sospensione; spotting; vaginiti, compresa candidosi vaginale | Cambiamenti del flusso mestruale; carcinoma mammario* | Dismenorrea; galattorrea; aumento di dimensioni di miomi/fibromi uterini; negli uomini ginecomastia; in casi isolati iperplasia endometriale; cambiamenti fibrocistici del seno |
Carcinoma endometriale; carcinoma ovarico |
| Sistema cardiovascolare | Disturbi tromboembolici; aumento della pressione arteriosa | Infarto del miocardio; ictus; malattia coronarica | |||
| Apparato respiratorio | Embolia polmonare | Peggioramento dell’asma | |||
| Apparato gastrointestinale | Disturbi gastrici; nausea; anoressia; dolori addominali | Vomito; pancreatite | Carcinoma colorettale | ||
| Sistema epatobiliare | Malattia della colecisti | Ingrandimento degli emangiomi epatici | Ittero colestatico | ||
| Patologie di cute e sottocute | Melasma o cloasma; alopecia | Eruzioni cutanee; prurito; irsutismo | Eritema multiforme; eritema nodoso; porpora vascolare | ||
| Apparato muscolo-scheletrico e connettivo | Artralgie; crampi alle gambe | ||||
| Sistema immunitario | Eruzioni cutanee su base allergica; orticaria; angioedema; reazioni anafilattiche/anafilattoidi | ||||
| Sistema nervoso | Capogiri; cefalea; emicrania; vertigini | Accidenti cerebrovascolari; ictus; peggioramento dell’epilessia | Peggioramento della corea | ||
| Disturbi psichiatrici | Disturbi dell’umore; depressione | Riduzione della libido | Irritabilità | ||
| Apparato visivo | Scarsa tolleranza delle lenti a contatto | Trombosi vascolare retinica | |||
| Disordini generali e del metabolismo | Edema; variazioni del peso corporeo (aumento o diminuzione) | Aumento dei trigliceridi | Intolleranza al glucosio | Peggioramento della porfiria, ipocalcemia | |
PREPARAZIONI, VIA DI SOMMINISTRAZIONE, POSOLOGIA E LIMITAZIONI PRESCRITTIVE
Estradiolo
- 8 cerotti transdermici da 25 µg/die, contenenti 2 mg di estradiolo; classe A, RNR (Dermestril); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 8 cerotti transdermici da 50 µg/die, contenenti 4 mg di estradiolo; classe A, RNR (Dermestril); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 8 cerotti transdermici da 75 µg/die, contenenti 6 mg di estradiolo; classe A, RNR (Dermestril); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 8 cerotti transdermici da 100 µg/die, contenenti 8 mg di estradiolo; classe C, RNR (Dermestril); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 18 cpr vaginali da 10 µg di estradiolo in applicatori; classe C, RNR (Vagifem, Vagirux); iniziare con una cpr/die per 2 settimane, poi 2 cpr/settimana
- dispositivo vaginale 7.5 µg/die; classe A (Estring)
Estradiolo emidrato
- 4 cerotti transdermici da 25 µg/24 ore, contenenti 2.5 mg di estradiolo emidrato; classe A (Dermestril Septem); 1 cerotto/settimana
- 4 cerotti transdermici da 50 µg/24 ore, contenenti 5 mg di estradiolo emidrato; classe A (Dermestril Septem); 1 cerotto/settimana
- 4 cerotti transdermici da 50 µg/24 ore, contenenti 1.5 mg di estradiolo emidrato; classe A, RNR (Femseven 50); 1 cerotto/settimana
- 4 cerotti transdermici da 75 µg/24 ore, contenenti 7.5 mg di estradiolo emidrato; classe C, RR (Dermestril Septem, Femseven 75); 1 cerotto/settimana
- 8 cerotti transdermici da 25 µg/24 ore, contenenti 0.75 mg di estradiolo emidrato; classe A, RNR (Estraderm MX); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 8 cerotti transdermici da 50 µg/24 ore, contenenti 1.5 mg di estradiolo emidrato; classe A, RNR (Estraderm MX); 1 cerotto ogni 3-4 giorni (2 cerotti/settimana)
- 50 g di gel 0.1% (ogni dose rilascia 0.5 g di gel, ossia 0.5 mg di estradiolo emidrato); classe A (Estreva)
- 28 bustine monodose da 0.5 g di gel 0.1% per uso transdermico (0.5 mg di estradiolo emiidrato per bustina); classe A (Sandrena); 1 dose/die (0.5 mg di estradiolo)
- 28 bustine monodose da 1 g di gel 0.1% per uso transdermico (1 mg di estradiolo emiidrato per bustina); classe A (Sandrena); 1 dose/die (1 mg di estradiolo)
- spray transdermico, 1-3 nebulizzazioni/die (ogni nebulizzazione rilascia 90 µL di spray transdermico, soluzione, contenente 1.53 mg di estradiolo, equivalente a 1.58 mg di estradiolo emiidrato); classe CN (Lenzetto)
Estradiolo valerato
- 20 cpr per uso orale da 2 mg; classe A, RNR (Progynova); 1 cp/die
Etinilestradiolo
- non più disponibile
- 6-12 cp vaginali contenenti 30 µg estriolo + 50 mg lactobacillo acidophilus vivo liofilizzato; classe C (Donaflor); 1-2 cp/die per 6-12 giorni per perdite o infezioni vaginali o ripristino della flora; 1 cp/die per 1 settimana poi 1-2 cp/settimana per vaginiti atrofiche in post-menopausa
- 10 ovuli vaginali da 0.03 mg; classe C (Atrocom)
- 20 ovuli vaginali da 0.5 mg; classe A, RNR (Colpogyn)
- 20 ovuli vaginali da 1 mg; classe A, RNR (Colpogyn)
- 10 g di gel per uso vaginale, contenente 50 µg di estriolo/g + 10 cannule monouso o + cannula riutilizzabile; classe C, RNR (Gelistrol)
- crema vaginale 0.0125% da 30 g + 6 applicatori (1 applicatore = 500 µg di estriolo); classe A, RNR (Colpogyn)
Scheda progestinici
Cecilia Motta
Endocrinologia, Ospedale S. Andrea, Roma
(aggiornato al 22 febbraio 2018)
MECCANISMO D’AZIONE
Attivano un recettore specifico. A seconda della struttura molecolare possono anche essere parzialmente agonisti sul recettore degli androgeni o antagonisti su quello dei mineralcorticoidi.
INDICAZIONI
Aborto abituale o minaccia di aborto
Neoplasie ormono-dipendenti, quali carcinoma mammario e endometriale
Amenorrea primaria o secondaria
Insufficienza luteinica
In associazione a estrogeni per irregolarità mestruali e terapia ormonale sostitutiva in presenza di utero
CONTRO-INDICAZIONI
Insufficienza epatica grave, sanguinamento vaginale di natura non accertata, aborto interno o incompleto, malattia trombo-embolica in atto o pregressa, cancro mammario o dell’apparato genitale sospetto o accertato, trombo-flebiti, emorragia cerebrale
EFFETTI COLLATERALI
| Apparati e sistemi | Effetti |
| Sistema immunitario | Reazioni di ipersensibilità (ad es. anafilassi o reazioni di tipo anafilattoide, angio-edema) |
| Patologie endocrine | Effetti simil-corticoidi (ad es. sindrome cushingoide), prolungata anovulazione |
| Metabolismo e nutrizione | Ritenzione idrica/edema, variazione di peso, esacerbazione del diabete mellito |
| Disturbi psichiatrici | Confusione, depressione, euforia, modificazioni della libido, insonnia, nervosismo |
| Sistema nervoso | Capogiri, cefalea, diminuzione della concentrazione, sonnolenza, infarto cerebrale, effetti adrenergico-simili (ad es. tremori alle mani, sudorazione, crampi notturni ai polpacci) |
| Occhio | Disturbi della vista, cataratta diabetica, trombosi retinica |
| Cuore | Infarto del miocardio, insufficienza cardiaca congestizia, palpitazioni, tachicardia |
| Patologie vascolari | Malattie trombo-emboliche, trombo-flebiti |
| Patologie respiratorie, toraciche e del mediastino | Embolia polmonare |
| Patologie gastro-intestinali | Costipazione, diarrea, bocca secca, nausea, vomito |
| Patologie epato-biliari | Ittero |
| Cute e sottocute | Acne, alopecia, irsutismo, prurito, eruzione, orticaria |
| Patologie renali e urinarie | Glicosuria |
| Sistema riproduttivo e mammella | Perdite ematiche vaginali (irregolari, diminuzione, aumento), amenorrea, erosioni cervicali, galattorrea, mastodinia, alterazioni delle secrezioni cervicali |
| Patologie sistemiche e condizioni relative alla sede di somministrazione | Affaticamento, reazioni al sito d’inoculo, malessere, piressia, modifica dell’appetito |
| Esami diagnostici | Funzionalità epatica alterata, aumento dei globuli bianchi e della conta pastrinica, ipercalcemia, riduzione della tolleranza al glucosio, aumento della pressione sanguigna |
PREPARAZIONI, VIA DI SOMMINISTRAZIONE, POSOLOGIA E LIMITAZIONI PRESCRITTIVE
- gel vaginale 8%, in 15 applicatori mono-dose pre-riempiti; ogni applicatore rilascia 90 mg di progesterone; classe A (Crinone); per l’infertilità: dose media 1 applicatore dal 18° giorno del ciclo;
- 30 cps molli da 100 mg, per uso orale o vaginale; classe A (Progeffik, Prometrium); dose media 2-3 cp/die dal 17° al 26° giorno del ciclo;
- 12 ovuli vaginali da 200 mg, classe A (Esolut); dose media 1 cp/die dal 17° al 26° giorno del ciclo;
- 15 ovuli vaginali da 400 mg, classe A (Amelgen);
- 15 cps molli da 200 mg, per uso orale o vaginale; classe A (Progeffik, Prometrium); dose media 1 cp/die dal 17° al 26° giorno del ciclo;
- fiale di 1 mL da 100 mg/mL o 50 mg/mL di soluzione iniettabile per uso im, classe A (Prontogest); per amenorrea o oligomenorrea 25 mg/die per 5 giorni al mese;
- polvere 25 mg per soluzioni iniettabili da diluire in 1 mL, classe C (Pleyris); dal giorno del prelievo dell'ovocita, 1 iniezione/die, generalmente fino al raggiungimento di 12 settimane di gravidanza confermata.
- 12 o 25 compresse da 5 mg, classe A (Provera G); 2.5-10 mg per 5-10 giorni dal 16° giorno del ciclo;
- 12 o 25 compresse da 10 mg, classe C (Farlutal, Provera G); 2.5-10 mg per 5-10 giorni dal 16° giorno del ciclo;
- 10 compresse da 20 mg, classe C (Farlutal); 2.5-10 mg per 5-10 giorni dal 16° giorno del ciclo;
- 30 cp da 250 mg, classe A (Provera); indicazione per neoplasie ormono-dipendenti quali carcinoma mammario e endometriale;
- 30 compresse da 500 mg, classe A (Farlutal); indicazione per neoplasie ormono-dipendenti quali carcinoma mammario e endometriale;
- fiala da 1 mL (150 mg/mL = 150 mg), classe A (Depo-Provera); indicazione per neoplasie ormono-dipendenti quali carcinoma mammario e endometriale.
Idrossiprogesterone caproato
- non più disponibile.
- 30 cp 5 mg, classe A (Lutenyl); 1 cp dal 16° al 25° giorno del ciclo.
- 14 cp o 42 cp 10 mg, classe A (Dufaston); per amenorrea o irregolarità mestruali 5-10 mg x 2/die dall’11° al 25° giorno del ciclo.
- 30 cp da 10 mg; classe A (Primolut Nor); per amenorrea ½ cp dal 19° al 26° giorno del ciclo.
- 28 cp 75 µg, classe C (Azalia, Cerazette, Desantrel, Desirett, Kestrelle, Nacrez)
- 1 cp da 1.5 mg, classe C (Escapelle, levonorgestrel Adalvo, Norlevo);
- soluzione vaginale 13.5 mg, classe C (Jaydess);
- dispositivo a rilascio intra-uterino da 20 μg/24h, classe C (Benilexa)
- dispositivo a rilascio intra-uterino da 19.5 mg, durata 5 anni, classe C (Kyleena)
- dispositivo a rilascio intra-uterino da 19.5 mg, durata 5 anni, classe C (Mirena).
- 28 cp da 2 mg, classe C (Devicius, dienogest Aristo, Endodien, Endovelle, Vidagest, Visanne, Zafrilla)
Etonogestrel
Impianto sottocutaneo da applicarsi da parte di un operatore sanitario qualificato che abbia familiarità con la procedura, della durata di 3 anni. Un applicatore contenente 1 impianto per uso subdermico di 68 mg di etonogestrel, che rilascia 60-70 µg/die dalla 5°-6° settimana e diminuisce a circa 35-45 µg/die alla fine del primo anno, a circa 30-40 µg/die alla fine del secondo anno e a circa 25-30 µg/die alla fine del terzo anno; classe C, medicinale soggetto a prescrizione medica limitativa, da rinnovare volta per volta, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti in ostetricia e ginecologia (Nexplanon).
| Riassunto comparativo delle caratteristiche dei progestinici | ||||
| Gruppo | Derivazione | Molecola | Attività | |
| progestinica | androgenica | |||
| Pregnani | - | Progesterone | + | - |
| Progesterone | Idrossi-progesterone caproato | 0.2 | - | |
| Diidrogesterone | + | - | ||
| 17OH-progesterone | Medrossiprogesterone acetato | 0.3 | 0 | |
| Megestrolo acetato | 0.4 | 0 | ||
| Clormadinone acetato | + | - | ||
| Ciproterone acetato | + | - | ||
| 19-nor-progesterone | Nomegestrolo acetato | + | - | |
| Estrani | Nortestosterone | Noretisterone acetato | 1.2 | 0.6 |
| Dienogest | 1.4 | 0.6 | ||
| Gonani | Nortestosterone | Levonorgestrel | 5.3 | 8.3 |
| Norgestrel | 2.6 | 4.2 | ||
| Norgestinate | 1.3 | 1.9 | ||
| Desogestrel | 9 | 3.4 | ||
| Gestodene | 12.6 | 8.6 | ||
| Non steroidi | Spironolattone | Drospirenone | + | - |
| Riassunto comparativo (2) delle caratteristiche dei progestinici | ||
| Molecola | Nome e formulazione | Indicazioni |
| Progesterone | Crinone 8%, gel vaginale | Infertilità, fertilizzazione in vitro |
| Esolut 200 mg, ovuli vaginali Esolut crema vaginale, 100 mg |
Insufficienza luteinica | |
| Pleyris 25 mg, im | Fecondazione assistita | |
| Progeffik o Prometrium, cps orali o vaginali da 100 mg o 200 mg | Insufficienza progestinica Sindrome premestruale Mastopatie benigne Pre-menopausa Terapia ormonale sostitutiva della menopausa (in associazione a estrogeni) Infertilità Fecondazione assistita Minaccia di aborto |
|
| Prontogest 100 mg/mL, soluzione iniettabile | Ipermenorrea, polimenorrea, metrorragia, amenorrea, ipomenorrea, oligomenorrea Sindrome pre-mestruale Preparazione ad interventi chirurgici in gravidanza Minaccia d'aborto o di parto prematuro Profilassi della depressione post-parto Infertilità |
|
| Ciproterone acetato | Androcur cp 50 mg o 100 mg | Trattamento anti-androgeno nel carcinoma prostatico inoperabile |
| cp 2 mg + etinilestradiolo 35 µg (Diane, Visofid) | Irsutismo | |
| Desogestrel | cpr 75 µg (Azalia, Cerazette, Desogestrel Sandoz, Desogestrel Zentiva, Desopop, Kestrelle, Mirzam, Myrline, Nacrez) | Contraccezione |
| Dienogest | Visanne, cp 2 mg | Endometriosi |
| cp 2 mg + etinilestradiolo 30 µg (Dienogest ed Etinilestradiolo Gedeon Richter, Effiprev, Novadien, Serisima, Sibilla) | Contraccezione | |
| Diidrogesterone | Dufaston, cp 10 mg | Amenorrea o irregolarità mestruali TOS (in associazione a estrogeni) Minaccia d’aborto Infertilità Dismenorrea Endometriosi Meno-metrorragie funzionali |
| Levonorgestrel | cp 1.5 mg (Afterel, Escapelle, Norlevo, Stromalidan) | Contraccezione d’emergenza |
| Jaydess, dispositivo a rilascio intra-uterino da 13.5 mg | Contraccezione | |
| Kyleena, dispositivo a rilascio intra-uterino da 19.5 mg | Contraccezione | |
| sistema rilascio intra-uterino 20 µg/die (Benilexa, Mirena) | Contraccezione | |
| Medrossi-progesterone acetato | Depo-Provera im 50 mg/mL o 150 mg/mL | Neoplasie ormono-dipendenti (carcinoma mammario e endometriale) |
| Farlutal, cp 10 mg o 20 mg | Endometriosi Amenorrea secondaria |
|
| Farlutal, cp 500 mg, sospensione orale 500 mg/5 mL, fl im 500 mg/2.5 mL o 1 g/5 mL | Neoplasie ormono-dipendenti (carcinoma mammario e endometriale) | |
| 104 mg, iniettabile (Perlessa, Sayanaject) | Contraccezione femminile a lungo termine | |
| Provera, cp 250 mg | Neoplasie ormono-dipendenti (carcinoma mammario e endometriale) | |
| Provera G, cp 5 mg o 10 mg | TOS (in associazione a estrogeni) Meno-metrorragie funzionali Amenorrea secondaria |
|
| Megestrolo acetato | 160 mg, cpr o granulato per sosp orale (Gestroltex, Megace, Megestil, Megexia) | Carcinoma mammario Carcinoma endometriale |
| Nomegestrolo acetato | cp 5 mg (Lutenyl, Nomegestrol Farmitalia) | Turbe del ciclo mestruale (meno-metrorragia, amenorrea secondaria, emorragia uterina funzionale) Dismenorrea Sindrome pre-mestruale TOS (in associazione a estrogeni) |
| Zoely, cp 2.5 mg (+ estradiolo 1.5 mg) | Contraccezione | |
| Noretisterone acetato | Primolut Nor cp 10 mg | Amenorrea, polimenorrea, metrorragie Sindrome pre-mestruale Endometriosi |
| Clormadinone Drospirenone Gestodene Norgestimate Norgestrel |
Solo in associazione con estrogeni | Contraccezione |
| Riassunto comparativo (3) delle caratteristiche dei progestinici | ||||||||
| Molecola | Indicazioni approvate | |||||||
| Contraccez | Disturbi ciclo (premestr/ dismen) | Infertil/ PMA | Endometriosi | Sostegno Gravid | Chirurgia in gravid | Tumori | TOS (associare estrogeni) | |
| Progesterone | Progeffik Prometrium Prontogest |
Crinone Pleyris Progeffik Prometrium Prontogest |
Esolut Progeffik Prometrium Prontogest |
Prontogest | Progeffik Prometrium |
|||
| OH-Progesterone Caproato | Lentogest Proluton |
Proluton | Lentogest Proluton |
Lentogest | ||||
| Didrogesterone | Dufaston | Dufaston | Dufaston | Dufaston | Dufaston | |||
| MAP | Perlessa Sayanaject |
Farlutal Provera G |
Farlutal | Depo-provera Farlutal Depot |
Provera G | |||
| Megestrol | Gestroltex Megace Megestil Megexia |
|||||||
| Ciproterone |
+ estrogeno (indicazione irsutismo) |
Androcur | ||||||
| Nomegestrolo | Zoely (+ estradiolo) | Lutenyl Nomegestrol |
Lutenyl Nomegestrol |
|||||
| Noretisterone | Primolut Nor | Primolut Nor | ||||||
| Dienogest | + etinil-estradiolo (Dienogest ed Etinilestradiolo Gedeon Richter Effiprev Novadien Serisima Sibilla) |
Visanne | ||||||
| Levonorgestrel |
Afterel |
|||||||
| Desogestrel | Azalia Cerazette Desogestrel Sandoz Desogestrel Zentiva Desopop Kestrelle Mirzam Myrline Nacrez |
|||||||
| Clormadinone, Drospirenone, Gestodene, Norgestimate, Norgestrel | + estrogeno | |||||||
Endocrinologia della sessualità
In collaborazione con SIAMS
Fisiologia erezione, eiaculazione, orgasmo maschile
Fisiologia della sessualità femminile
Disfunzioni sessuali femminili
Endocrinologia della gravidanza, parto e allattamento
Unità feto-placentare: placenta e modificazioni ormonali durante la gravidanza fisiologica
Fecondazione e impianto
Rossella Mazzilli
Dipartimento di Medicina Clinica e Molecolare, “Sapienza” Università Roma, Unità di Andrologia, AO Sant’Andrea, Roma
DEFINIZIONE
La fecondazione, o singamia, è un processo che consiste nell’unione di due gameti con corredo cromosomico aploide (ovocita e spermatozoo) e nella fusione dei loro nuclei. Il risultato della fecondazione è una nuova cellula diploide, diversa dai gameti d’origine, che prende il nome di zigote (1).
LE TAPPE DELLA FECONDAZIONE
1. L’ovocita
Al momento dell’ovulazione, l’ovocita viene immesso nel fluido peritoneale. Viene quindi avviato, mediante le fimbrie tubariche, verso l’ostio addominale della tuba e raggiunge in pochi minuti il tratto ampollare di quest’ultima, ossia la sede dove avviene la fecondazione.
2. Lo spermatozoo
Nella fecondazione per via naturale, gli spermatozoi eiaculati risalgono dalla vagina al canale cervicale. In questa sede gli spermatozoi si depositano nelle cripte cervicali, da dove, per assicurare una presenza continua nelle vie genitali femminili, vengono dismessi in ondate sequenziali nell’utero, per poi colonizzare le tube e quindi il fluido peritoneale; in questa sede possono sopravvivere anche per 5-7 giorni. Il loro transito è influenzato da diversi fattori, quali le proprietà intrinseche degli spermatozoi, la contrattilità del tratto genitale e il movimento delle ciglia lungo la superficie dell’endometrio.
3. La fecondazione
La fecondazione si realizza a seguito di collisioni casuali tra l’ovocita, trasportato passivamente nell’ampolla della tuba, e gli spermatozoi che si muovono nelle vicinanze. Perché una collisione sia efficace, e permetta la penetrazione nella zona pellucida, è necessario che lo spermatozoo possieda una velocità adeguata (fattore energetico) e un’angolazione d’urto idonea (fattore casualità). Queste proprietà cinetiche vengono acquisite dallo spermatozoo mediante il processo di “capacitazione”, che inizia nell’epididimo (dove avviene anche il completamento della compattazione della cromatina) e si completa durante il transito nelle vie genitali femminili (2). Si tratta di una serie di modificazioni biochimiche che determinano tra l’altro la cosiddetta “motilità attivata” dello spermatozoo, che è caratterizzata da una maggiore frequenza e ampiezza del battito flagellare, quindi in grado di attraversare gli strati protettivi dell’ovocita.
Il riconoscimento, il legame e l’attraversamento della zona pellucida, che è specie-specifica, rappresentano un aspetto essenziale nella fecondazione (3). Perché ciò possa avvenire, è indispensabile che lo spermatozoo subisca un’ulteriore modificazione, costituita dalla “reazione acrosomiale”. Essa consiste in un evento di tipo esocitosico, che comporta la formazione, inizialmente a livello della regione acrosomiale anteriore, di numerosi punti di fusione tra la membrana acrosomiale esterna e il plasmalemma. Conseguentemente, avviene il rigonfiamento e la frammentazione dell’acrosoma e il rilascio della matrice acrosomiale. Essa contiene enzimi proteolitici, tra cui l’acrosina e la ialuronidasi, che facilitano la penetrazione dello spermatozoo attraverso la digestione della matrice glico-proteica delle cellule del cumulo ooforo, il cui insieme prende il nome di corona radiata. In tal modo lo spermatozoo si fa strada attraverso le cellule follicolari e raggiunge la zona pellucida, alla quale aderisce. Superata la zona pellucida, lo spermatozoo viene a trovarsi nello spazio peri-vitellino, tra l’oolemma e la zona pellucida (figura 1) (4-5).
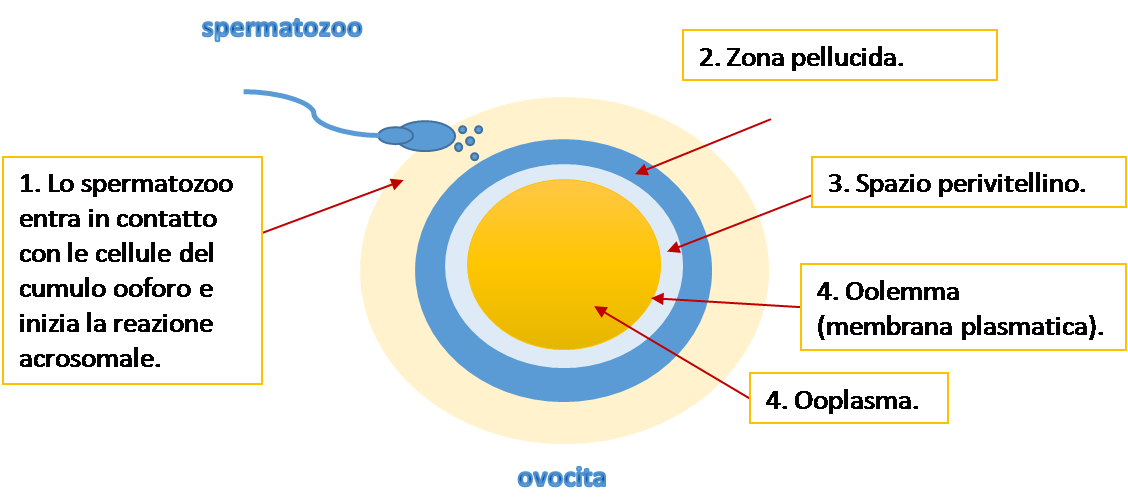
Figura 1: rappresentazione schematica dell’incontro Spermatozoo – Ovocita.
L’ultimo atto che lo spermatozoo deve compiere per completare la fecondazione, è quello di penetrare nel citoplasma ovocitario, processo denominato “fusione dei gameti”. A questo punto, vi è un aumentato flusso intra-cellulare di sodio e calcio, che determina una variazione di polarità della membrana ovocitaria; questo evento biochimico è responsabile del “blocco rapido” della polispermia, che consiste nell’impedire l’ingresso di altri spermatozoi attraverso la zona pellucida e prende il nome di reazione corticale.
Nella specie umana sia il nucleo che il flagello dello spermatozoo entrano nel citoplasma ovocitario. Subito dopo la penetrazione, il nucleo dello spermatozoo perde la sua membrana e la cromatina va incontro a un processo di decondensazione. Successivamente, le vescicole del reticolo endoplasmatico dell’ovocita si disperdono attorno alla cromatina del gamete maschile per ricostituire la membrana nucleare. Si forma così il “pronucleo maschile”.
Contemporaneamente, anche il gamete femminile va incontro ad un processo di attivazione. Infatti, l’ovocita, che fino a quel momento era rimasto bloccato allo stadio di metafase II, completa la seconda divisione meiotica ed emette il 2° globulo polare; i cromosomi ovocitari ritornano allo stadio di interfase: si forma così il “pronucleo femminile”. Questo processo si completa dopo circa 12 ore dall’inizio della fecondazione.
L’ultima fase dell’attivazione, che è anche il primo evento dello sviluppo embrionale, è rappresentato dall’unione dei due corredi cromosomici aploidi per formare lo zigote diploide, ossia con 46 cromosomi.
4. La determinazione del sesso
Il sesso cromosomico dell’embrione è determinato al momento della fecondazione: uno spermatozoo con corredo cromosomico 22+X determinerà un embrione femminile, 22+Y determinerà un embrione maschile (1).
5. La segmentazione e la formazione della blastocisti
Poco dopo la fecondazione, lo zigote va incontro a una serie di divisioni mitotiche (segmentazione) e nell’arco di 3-4 giorni discende lungo la tuba di Falloppio fino alla cavità uterina. A circa 72 ore dalla fecondazione, l’embrione è costituito da 12-16 cellule (o blastomeri) e prende il nome di morula.
Nelle successive 48 ore (in 5° giornata) all’interno della morula continua la replicazione cellulare e si forma una cavità piena di liquido circondata da uno strato di cellule: stadio della blastocisti. Alla periferia della blastocisti è presente un aggregato di cellule (embrioblasti), detto massa cellulare interna; da queste cellule si svilupperà il feto, dalla massa cellulare esterna (trofoblasto) avrà invece origine la placenta (1,6).
6. L’impianto
L’impianto nella cavità uterina ha inizio in 5°-6° giornata, quando l’epitelio trofoblastico aderisce all’epitelio dell’endometrio, il quale, dopo aver proliferato nei giorni precedenti l’ovulazione, cambia rapidamente aspetto, divenendo di tipo secretorio sotto l’influenza degli estrogeni e del progesterone, che sono prodotti in quantità crescente dal corpo luteo (6).
La blastocisti viene a contatto diretto con lo stroma dell’endometrio e l’epitelio la riveste completamente.
Successivamente, si formano delle lacune a livello della massa di cellule trofoblastiche e, grazie a un processo di erosione delle arteriole spirali da parte del trofoblasto stesso, è assicurata l’irrorazione sanguigna.
Al 14° giorno dopo la fecondazione la blastocisti è completamente inclusa nello stroma dell’endometrio e l’impianto è completo.
BIBLIOGRAFIA
- Sadler TW. Embriologia medica di Langman. 2nd Ed. Masson 2004.
- Bailey JL. Factors regulating sperm capacitation. Syst Biol Reprod Med 2010, 56: 334-48.
- Avella MA, Xiong B, Dean J. The molecular basis of gamete recognition in mice and humans. Mol Hum Reprod 2013, 19: 279-89.
- Ciotti PM, Fabbri R, Notarangelo L, et al. Atlante di ovociti ed embrioni umani. Carocci 2011.
- Lenzi A, Jannini EA, Foresta C, et al. Guida allo studio dell’andrologia. Società Editrice Universo 2012.
- Mastroianni L, Coutifaris C. Fisiologia della riproduzione. In: The F.I.G.O. manual of human reproduction. Rosenfield A, Fathala MF (Eds), Parthenon Publishing Co, Carnforth, Lancs, UK, 1991.
L'unità feto-placentare: endocrinologia della placenta e modificazioni ormonali durante la gravidanza fisiologica
Laura Proietti-Pannunzi
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
La gravidanza è una condizione unica, in cui il prodotto del concepimento necessita di impiantarsi, svilupparsi e raggiungere una maturazione considerevole nel corpo materno, nonostante esso presenti una metà geneticamente diversa dalla madre.
Emergenti prove sperimentali e cliniche suggeriscono che esiste un sistema di comunicazione biomolecolare molto complesso fra unità feto-placentare e miometrio, attivamente operativo nel controllo della contrattilità in gravidanza e nel timing del parto, attraverso la produzione di un numero sempre crescente di sostanze con attività endocrina, paracrina e immuno-regolatoria.
Nel corso della gravidanza il miometrio è stimolato da una serie di ormoni, prodotti dall'unità feto-placentare, responsabili dell’inibizione della contrattilità uterina per la quasi totalità della gestazione, ma anche della preparazione al travaglio mediante il raggiungimento di una maturità contrattile, potente e coordinata necessaria per l'espletamento del parto.
Le maggiori modifiche ormonali in corso di gravidanza sono rappresentate dalla produzione di elevati livelli di estrogeni, progesterone e gonadotropina corionica, tuttavia anche altre molecole entrano in gioco, seppur con ruoli minori.
Estrogeni
Prodotti dal corpo luteo nella fase iniziale di gestazione e successivamente dalla placenta, tendono ad essere più bassi nel primo trimestre, per poi aumentare progressivamente e in modo significativo fino a metà gestazione, rimanendo costantemente elevati fino al travaglio.
La placenta non esprime l’enzima 17α-idrossilasi, pertanto non è in grado di convertire progesterone a estrogeni o androgeni, ma richiede l’interazione coordinata tra la steroidogenesi surrenalica materna e fetale.
Gli estrogeni incrementano produzione ed espressione a livello del miometrio di molecole contrattili, tra cui il recettore per l'ossitocina e la connessina-43, proteina espressa a livello delle gap junctions, responsabile della conduzione degli impulsi elettrici. Regolano inoltre la produzione di prostaglandine da parte del miometrio, attraverso l'induzione della COX -2 mediante stimolazione di TGF-ß1. Contrattilità e travaglio vengono inoltre modulati attraverso la produzione di ossido nitrico sintetasi.
Il loro ruolo nel priming del miometrio al travaglio è sicuramente in collaborazione con altre molecole, tanto che si può osservare un normale travaglio anche in presenza di bassi livelli di estrogeni per deficit di solfatasi placentare o aromatasi.
Progesterone
Viene prodotto dal corpo luteo nel primo trimestre di gestazione e, successivamente, dal sincizio-trofoblasto della placenta. Poichè la placenta non può sintetizzare il colesterolo a partire dall’acetato, esso deve derivare dal colesterolo-LDL circolante.
Riveste multiple funzioni importanti, tutte atte all'inibizione della contrattilità uterina per la quasi totalità della durata della gravidanza: riduzione dell’espressione di Cx-43, stimolazione della produzione di ossido nitrico, down regolazione dell’espressione di canali del calcio e del recettore per l'ossitocina. L'azione del progesterone a livello del miometrio è mediata dal legame con il suo recettore (PR), una specifica proteina nucleare di cui sono state identificate tre isoforme: A, B e C. Soltanto le isoforme A e B sembrano rivestire un ruolo funzionale; le loro attività sono pressochè opposte, pertanto è possibile ipotizzare che il signaling che ne deriva dipenda dal rapporto fra le due isoforme, con una prevalenza del PR-A nella fase del travaglio.
Il progesterone presenta inoltre un importante ruolo nell’immuno-regolazione esercitata soprattutto a livello dell'interfaccia materno-fetale: incrementa la produzione di citochine da Th1 a Th2, inibisce la produzione di linfociti, il rilascio massivo di NO da parte dei macrofagi e l'attivazione delle natural killer materne.
Gonadotropina corionica
È un eterodimero formato da due subunità, alfa e beta, unite da legami non covalenti. È membro della famiglia di ormoni glicoproteici che includono anche FSH, LH e TSH, con i quali condivide la stessa subunità α, mentre la subunità ß è codificata da multipli geni localizzati sul cromosoma 19.
Viene prodotta dal sincizio-trofoblasto, con un picco massimo fra i 60-90 giorni dopo l’impianto, per poi declinare.
Ha azione simile all’LH ma con emivita più lunga: la sua funzione principale è il mantenimento della produzione di progesterone da parte del corpo luteo sino a quando non ne inizia la sintesi placentare. Inoltre, è coinvolta nello sviluppo della tolleranza immunologica peri-trofoblastica, attraverso l’induzione di apoptosi mediante la sintesi di molecole pro-apoptotiche, come ad esempio il Fas ligand. A livello del miometrio, invece, determina inibizione della contrattilità.
La regolazione della produzione della ß-hCG da parte della placenta non è ancora del tutto chiarita, tuttavia è stato ipotizzato un possibile coinvolgimento paracrino da parte di GnRH, inibine e activina di origine placentare. I livelli della ß-hCG correlano con lo stato funzionale del trofoblasto e quindi con lo stato di benessere del feto.
CRH
È un peptide ipotalamico prodotto anche dalle cellule del trofoblasto e sincizio-trofoblasto, dalla decidua placentare e dalle membrane fetali, i cui livelli incrementano durante la gravidanza, con un picco al termine della stessa.
Media le proprie azioni legandosi a specifici recettori localizzati nei tessuti bersaglio, di cui finora ne sono stati caratterizzati due (CRH-R1 e CRH-R2), entrambi presenti in varie isoforme.
È stato dimostrato un coinvolgimento nella regolazione della contrattilità uterina, con particolare importanza nell’inizio del travaglio, e della produzione di prostaglandine da parte della placenta, tuttavia le sue funzioni sono ad oggi ancora oggetto di dibattito.
Ossitocina
Ha un ruolo solo nella gravidanza e nel parto. Prodotta dall’ipotalamo e da numerosi tessuti extra-ipotalamici, quali decidua, amnion, chorion e in misura minore trofoblasto placentare.
L’ossitocina influenza la contrazione del miometrio attraverso multipli meccanismi complessi:
- incrementa la mobilizzazione degli ioni calcio attraverso l’attivazione della fosfolipasi C;
- incrementa il calcio intra-cellulare mediante attivazione della G-protein attivata da IP3 associata ai canali del calcio;
- incrementa la produzione di prostaglandine mediante espressione della COX-2;
- riduce l’attività biologica dei recettori del CRH.
L’ossitocina può modulare la contrattilità del miometrio anche attraverso meccanismi che non richiedono il legame con il recettore specifico: attiva la cascata delle ciclo-ossigenasi e lipo-ossigenasi, con produzione di prostaglandine e leucotrieni; incrementa la produzione di citochine quali TNF-α e TGF-β.
Vasopressina
È prodotta dal feto, si lega a recettori V1a, V1b e V2. Di questi il V1a sembra avere il ruolo principale nella gravidanza e nel travaglio.
Il ruolo è ancora incerto, ma sembra esercitare una azione contrattile sul miometrio anche attraverso il legame con i recettori dell’ossitocina.
Lattogeno placentare
L’hPL è prodotto dal sincizio-trofoblasto e secreto nella circolazione materna e fetale dalla 6° settimana di gestazione. Nel feto si lega a recettori della PRL e probabilmente ad un recettore specifico, modulando lo sviluppo embrionale, il metabolismo intermedio e stimolando la produzione di IGF-1, insulina, glucocorticoidi e surfactante polmonare.
GH
Durante la gravidanza viene prodotta per splicing alternativo una variante del GH, hGH-V, che presenta notevoli analogie con il GH ipofisario. Il GH placentare sostituisce gradualmente il GH materno, i cui livelli diventano indosabili. Stimola la produzione di IGF-1, aumenta la disponibilità di glucosio e aminoacidi per il feto, modula lo sviluppo placentare tramite meccanismi autocrini e paracrini.
Bibliografia
- Ticconi C, Belmone A, Piccione E, Rao CH. Feto-placental communication system with the myometrium in pregnancy and parturition: the role of hormones, neurohormones, inflammatory mediators, and locally active factors. J Matern Fetal Neonatal Med 2006, 19: 125-33.
- Molina EM. Fisiologia endocrina. Lange Physiology Series, McGraw-Hill 2004.
Endocrinologia del parto
Alfonsina Chiefari & Mariagrazia Deiana
UOC di Endocrinologia, AO Sant’Andrea, Facoltà di Medicina e Psicologia, “Sapienza” Università di Roma
Il parto è quel processo fisiologico attraverso il quale il feto e gli annessi fetali vengono espulsi dall’utero. Affinché ciò avvenga, si devono verificare due cambiamenti: l’utero deve trasformarsi da struttura quiescente a organo in grado di contrarsi attivamente, in modo coordinato, e la cervice deve essere capace di dilatarsi per permettere il passaggio del feto.
Asse ipotalamo-ipofisi-surrene
L’attivazione dell’asse ipotalamo-ipofisi-surreni fetale costituisce un momento fondamentale nell’induzione e nel mantenimento del parto. Durante la gravidanza i livelli circolanti materni e fetali di CRH aumentano progressivamente per effetto della produzione placentare e fetale, mentre i livelli di proteina legante il CRH (CRH-BP) diminuiscono progressivamente, fino a raggiungere il nadir al momento del parto; vi è pertanto un aumento dei livelli di ormone libero circolante. Non si sa con precisione cosa regoli la produzione placentare di CRH, ma viene inibita dal progesterone e stimolata dalle prostaglandine, dall’ossitocina e dallo stress.
Il CRH fetale stimola la secrezione di ACTH dall’ipofisi fetale, che, a sua volta, incrementa la produzione da parte del surrene fetale di cortisolo e di deidroepiandrosterone solfato (DHEA-s). Il DHEA-s viene convertito in estrogeno nel sincizio-trofoblasto placentare e l’estrogeno prodotto antagonizza l’effetto del progesterone sulla contrattilità uterina. Il cortisolo stimola invece la maturazione polmonare fetale e la produzione di surfactante, che potrebbe servire come segnale per l’inizio del travaglio (1).
Il CRH potenzia inoltre la produzione di prostaglandine da parte delle membrane fetali e le contrazioni indotte dall’ossitocina, aumentando la sensibilità recettoriale. Può anche direttamente influenzare la contrattilità miometriale. Sono stati, infatti, individuati diversi sottotipi recettoriali del CRH nel miometrio, con diversa espressione regionale, tale da favorire il rilasciamento della porzione inferiore dell’utero. Al contrario, i sottotipi recettoriali localizzati nelle membrane fetali o nella decidua potrebbero essere attivati dal CRH sintetizzato localmente e le prostaglandine, prodotte da questi tessuti in risposta al CRH, possono avere effetto stimolatorio della contrattilità sul fondo uterino (2).
Estrogeni
Diversamente dallo stato non gravidico, in cui l’ovaio è la principale fonte di estrogeni, durante la gravidanza questo ruolo viene rivestito dalla placenta e la concentrazione degli estrogeni aumenta progressivamente con l’età gestazionale. La placenta umana non possiede l’enzima necessario alla conversione del progesterone in estradiolo, ma il surrene fetale produce DHEA-s, che viene idrossilato nel fegato fetale in 16-OH-DHEA-S; quest’ultimo può essere aromatizzato dalla placenta in estriolo, il principale estrogeno circolante durante la gravidanza.
L’incremento del livello di estrogeni induce le modificazioni uterine e la maturazione della cervice. Gli estrogeni sono, infatti, coinvolti nella stimolazione della sintesi delle proteine contrattili del miometrio, incrementano la produzione di prostaglandine e aumentano l’espressione dei recettori. Sono anche associati con un’aumentata sensibilità dell’utero all’ossitocina, probabilmente attraverso un incremento del numero di recettori. Inoltre sia gli estrogeni che le prostaglandine promuovono la formazione di gap-junctions nel miometrio. Tutti questi cambiamenti permettono le contrazioni uterine coordinate (3).
Progesterone
È responsabile di un’azione di “blocco” sulla contrattilità miometriale e sulla maturazione cervicale. In molti mammiferi, infatti, i livelli di progesterone si riducono drasticamente verso la fine della gravidanza a causa della conversione placentare del progesterone in estrogeni. Questo crollo dei livelli di progesterone non si verifica però nella donna. È stato pertanto suggerito che il parto si associ a una riduzione “funzionale” del progesterone a livello dei recettori uterini. A questo potrebbe contribuire la diversa espressione di isoforme recettoriali e proteine leganti il progesterone. Durante il parto vi è la massima espressione, nel miometrio, dei recettori del progesterone di tipo A (PrA), che inibiscono l’attività trascrizionale dei recettori di tipo B (PrB), responsabili dell’inibizione della contrattilità uterina. Il parto potrebbe essere legato a un incremento del rapporto PrA/PrB, che spiegherebbe la rimozione del blocco indotto dal progesterone, pur in presenza di livelli circolanti invariati di quest’ormone (4).
Il progesterone stimola l’ossido nitrico sintetasi, coinvolto nella quiescenza uterina, riduce la produzione di prostaglandine e i recettori dell’ossitocina, e, nella cervice, incrementa l’inibitore tissutale delle metallo-proteinasi 1, che inibisce la collagenolisi. È pertanto il principale responsabile della quiescenza uterina e dell’integrità cervicale.
Prostaglandine
Le prostaglandine sono formate a partire dall’acido arachidonico, un acido grasso a catena lunga, attraverso un enzima, la ciclo-ossigenasi 2 (COX2), di cui sono stati individuati alti livelli durante il parto e nella fase immediatamente antecedente. La cascata potrebbe avviarsi con la rimozione del blocco del progesterone e l’incremento dei livelli di estrogeni, evento che destabilizza i lisosomi nelle membrane fetali. Con il rilascio del contenuto dei lisosomi, la fosfolipasi A2 è disponibile per idrolizzare i glicerol-fosfolipidi, rilasciando così l’acido arachidonico. I livelli di prostaglandine sono ridotti dal progesterone e incrementati dagli estrogeni.
Le prostaglandine sono prodotte nella placenta e nelle membrane fetali (principalmente amnion e decidua) e i livelli intra-uterini aumentano prima e durante il parto. PGF2α è prodotta principalmente dalla decidua materna e agisce sul miometrio, incrementando, insieme ai livelli elevati di estrogeni, il numero e le dimensioni delle gap-junctions tra le cellule miometriali, per rendere la muscolatura uterina un’unità funzionale. PGE2, di origine feto-placentare, è probabilmente più importante nel promuovere la maturazione cervicale attraverso la degradazione del collagene, la dilatazione dei piccoli vasi sanguigni cervicali e la rottura spontanea delle membrane fetali.
Alti livelli di estrogeni possono stimolare la formazione di recettori dell’ossitocina nel miometrio e nelle membrane fetali, e quindi incrementare la sensibilità uterina all’ossitocina materna e la responsività della decidua all’ossitocina fetale, con ulteriore produzione di prostaglandine.
Ossitocina
È un ormone prodotto dai nuclei sopra-ottici e para-ventricolari dell’ipotalamo, immagazzinato e rilasciato dalla neuro-ipofisi. Durante la gravidanza i livelli di ossitocina aumentano progressivamente, ma non vi è un ulteriore aumento prima del parto. Infatti, alla fine della gravidanza si assiste a un incremento della sensibilità uterina all’ossitocina, dovuto sia a un aumento del numero dei recettori nel miometrio e nella decidua, sia a un cambiamento della via di segnale intra-cellulare. Il legame dell’ossitocina ai suoi recettori accoppiati a proteina G, attiva la fosfolipasi C, con un incremento dei livelli di calcio intra-cellulare e un potenziamento della contrazione uterina. Inoltre vi è produzione dei precursori delle prostaglandine, che a loro volta incrementano il numero dei recettori per l’ossitocina, potenziandone l’azione.
Alcuni lavori hanno riportato come ci sia un inizio spontaneo del parto in donne con panipopituitarismo, ad indicare che l’ossitocina materna potrebbe non essere essenziale nell’induzione del parto. Questo ruolo potrebbe essere svolto dall’ossitocina fetale. La frequenza e l’intensità delle contrazioni mediate dall’ossitocina materna sembrerebbero utili nel ridurre l’emorragia post-partum, quando, dopo l’espulsione del feto e la separazione della placenta, l’ossitocina da questi prodotta non è più sufficiente (5).
Conclusioni
Sebbene la conoscenza dei meccanismi alla base del parto non sia ancora completa, è oramai certo che non vi è un singolo evento a iniziare il processo del parto. Ci sono molti fattori che collaborano insieme a questo scopo, ciascuno influenzando direttamente o indirettamente l’effetto dell’altro. Il parto risulta da una complessa interazione biochimica tra l’unità feto-placentare e la madre, con un molteplice numero di sostanze ad azione ormonale endocrina (CRH-cortisolo, estrogeni, progesterone, ossitocina) e locale, paracrina ed autocrina, coinvolte in tale processo (6).
Bibliografia
- Mendelson CR. Minireview: Fetal-maternal hormonal signaling in pregnancy and labor. Mol Endocrinol 2009, 23: 947–54.
- Stevens MY, Challis JR, Lye SJ. Corticotropin-releasing hormone receptor subtype 1 is significantly up-regulated at the time of labor in the human myometrium. J Clin Endocrinol Metab 1998, 83: 4107-15.
- Kota SK, Gayatri K, Jammula S, et al. Endocrinology of parturition. Indian J Endocrinol Metab 2013, 17: 50-9.
- Merlino AA, Welsh TN, Tan H, et al. Nuclear progesterone receptors in the human pregnancy myometrium: evidence that parturition involves functional progesterone withdrawal mediated by increased expression of progesterone receptor-A. J Clin Endocrinol Metab 2007, 92: 1927-33.
- Shinar S, Many A, Maslovitz S. Questioning the role of pituitary oxytocin in parturition: spontaneous onset of labor in women with panhypopituitarism - a case series. Eur J Obstet Gynecol Reprod Biol 2016, 197: 83-5.
- Navitsky J, Greene JF, Curry SL. The onset of human labor: current theories. Prim Care Update Ob Gyns 2000, 7: 197-9.
Endocrinologia dell'allattamento
Utilizzo dei farmaci endocrino-metabolici in corso di allattamento

