Inquadramento generale diagnostico delle patologie gonadiche femminili
Anatomia dell'ovaio
Maurizio Poggi, Chiara Pascucci
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
Le ovaie o gonadi femminili, sono ghiandole pari, ubicate vicino alla parete laterale del piccolo bacino. L’ovaio ha una posizione variabile, in quanto può seguire gli spostamenti dell’utero, sia in corso di gravidanza che a seguito di gravidanze pregresse. Nelle multipare l’ovaio assume spesso una posizione più bassa e posteriore, limitata davanti dall’uretere, indietro dalla parete pelvica posteriore e in basso e medialmente dal legamento utero-sacrale. L’ovaio non è ricoperto dal peritoneo viscerale, ma da un epitelio particolare, detto epitelio ovarico o germinativo (in passato si riteneva che vi originassero i gameti durante l’ontogenesi, ma in realtà le cellule germinali hanno origine fuori dalla gonade, nell’entoderma del sacco vitellino, e migrano in essa durante lo sviluppo), che origina dal rivestimento della cavità celomatica primitiva. Le ovaie hanno la forma di un ovoide appiattito, con il maggior asse verticale disposto su un piano pressoché sagittale, e consistenza dura con una superficie irregolare.
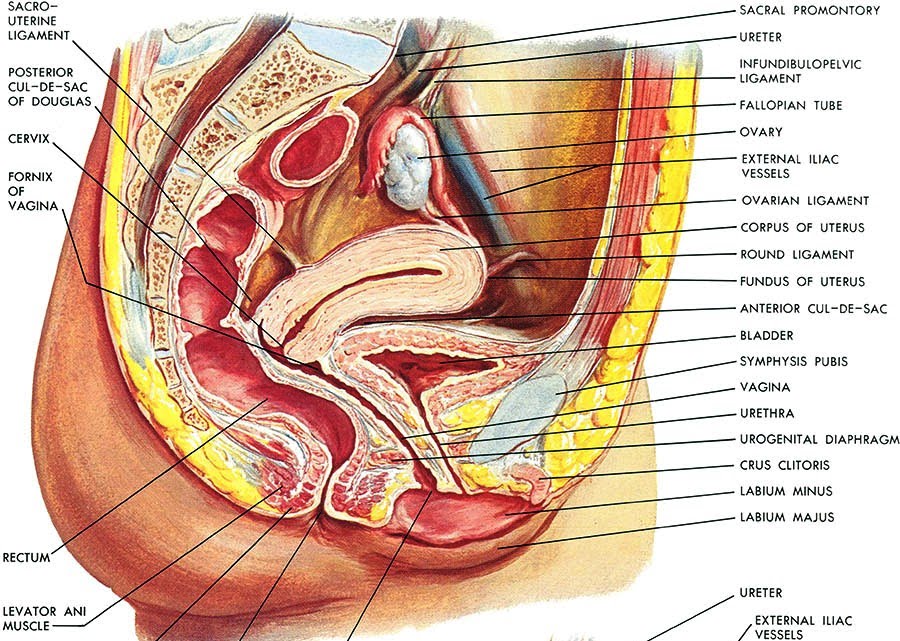
Durante il periodo fertile le dimensioni dell’ovaio sono: altezza 3.5 cm, larghezza 2 cm, spessore 1 cm. L’ovaio delle pluripare è più grosso di quello delle nullipare. Sia nelle bambine che durante la vecchiaia l’organo risulta più piccolo. Nel primo caso non è ancora avvenuto lo sviluppo, mentre in vecchiaia si verificano fenomeni di sclerosi.
L’aspetto dell’ovaio è variabile a seconda delle fasi della vita sessuale: prima della pubertà la superficie si presenta liscia e regolare; durante il periodo fertile assume un colorito grigio-rossastro e diventa notevolmente irregolare per la sporgenza di follicoli in via di maturazione e di corpi lutei. Con il progredire dell’età compaiono numerose cicatrici, esito dei processi di atresia follicolare e della regressione dei corpi lutei, mentre in menopausa l’ovaio tende a diventare atrofico, acquistando una consistenza quasi lignea. Infine, dopo i 70 anni la superficie dell’ovaio ritorna ad essere liscia per atrofia delle cicatrici stesse.
L’ovaio è mantenuto in sede da mezzi di fissità e precisamente da 4 legamenti: il legamento sospensore o lombo-ovarico, l’utero-ovarico, il mesovario e il legamento tubo-ovarico.
L’ovaio ha una duplice fonte di irrorazione: l’arteria genitale (ovarica) e il ramo ovarico dell’arteria uterina. L’arteria genitale nasce dall’aorta addominale, a livello della seconda vertebra lombare, a destra passa davanti alla vena cava inferiore e incrocia da ambo i lati l’uretere e il tratto iniziale dei vasi iliaci esterni, raggiunge l’estremità superiore dell’ovaio penetrando nel mesovario e dando origine ai rami che penetrano nell’ilo e si distribuiscono al parenchima ovarico. Il ramo ovarico nasce dall’arteria uterina e seguendo il legamento utero-ovarico raggiunge il mesovario per anastomizzarsi con l’arteria ovarica. Le vene formano un ricco plesso in corrispondenza della zona midollare dell’ovaio, vanno a formare il bulbo dell’ovaio e fanno capo alla vena uterina e alle vene ovariche. Le vene ovariche sono riunite in un plesso pampiniforme che risale verso l’addome nel legamento sospensore, poi convergono in un unico tronco che sbocca a sinistra nella vena cava inferiore e a destra nella vena renale. I linfatici efferenti dell’ovaio fanno capo ai linfonodi pre-aortici e para-aortici.
I nervi formano un ricco plesso attorno alle arterie. La zona della midollare dell’ovaio è ricca di fibre nervose, che seguendo il decorso dei vasi giungono alla zona corticale. Il plesso utero-ovarico proveniente dal plesso celiaco accompagna l’arteria genitale e fibre nervose provenienti dal plesso pelvico seguono il ramo ovarico dell’arteria uterina.
La zona corticale dell’ovaio è la parte più periferica, situata sotto l’epitelio ovarico. Ha uno spessore compreso dai 2 ai 10 mm ed è formata dallo stroma corticale, tessuto connettivo particolare dotato di un notevole polimorfismo e di una notevole capacità d’adattamento funzionale. Lo stroma contiene follicoli oofori e corpi lutei in vari stadi d’evoluzione o di regressione e cellule in grado di produrre ormoni androgeni. Sotto l’epitelio ovarico che ricopre la corticale, vi è un ricco strato di fibre collagene con scarse cellule che formano la falsa albuginea. La zona midollare è la zona più profonda e centrale dell’ovaio, in continuazione dell’ilo attraverso il quale decorrono i vasi sanguigni, linfatici e i nervi che si distribuiscono all’ovaio. La midollare è costituita da tessuto connettivo lasso che contiene fibre elastiche e fasci di fibre muscolari lisce che accompagnano le ramificazioni delle arterie. Queste ramificazioni vascolari presentano una disposizione a spirale caratteristica, che conferisce alla zona profonda della midollare una certa capacità di deformarsi in rapporto allo stadio di sviluppo dei follicoli situati nella corticale e a modificare la sua consistenza in rapporto allo stato di congestione delle arterie. Nella midollare troviamo anche vasi linfatici e corpi albicanti vascolari, che sono formazioni ialine risultato del processo di degenerazione della parete dei vasi ovarici. Nella zona dell’ilo troviamo cellule dalla forma allungata, fornite di un grosso nucleo e di un citoplasma acidofilo capaci di produrre androgeni.
Le ovaie svolgono il duplice compito sia di produrre oociti (funzione gametogenica) sia di secernere estrogeni, progesterone e una percentuale degli androgeni circolanti (funzione endocrina). I compartimenti in grado di sintetizzare steroidi sono:
- follicolo
- corpo luteo
- cellule interstiziali
Il follicolo è l’unità morfo-funzionale dell’ovaio. Può trovarsi in fase quiescente (follicoli primordiali) o in fase di maturazione. Già al momento della nascita la femmina possiede il suo completo patrimonio follicolare, che consta di circa 1 milione di follicoli primordiali; questo patrimonio va poi riducendosi, passando dalla nascita alla pubertà. Dal menarca alla menopausa solo 400-500 follicoli andranno incontro a completa maturazione e all’ovulazione, mentre tutti gli altri follicoli andranno incontro ad involuzione atresica.
I follicoli primordiali sono costituiti da un oocita circondato da uno strato di cellule appiattite rivestite da una lamina basale. L’oocita, del diametro di 25-30 µm, si trova bloccato nella profase della prima divisione meiotica. Le membrane plasmatiche dell’oocita e delle cellule follicolari sono strettamente adese fra loro, grazie a sistemi di giunzione detti desmosomi. Questi follicoli primordiali sono in fase quiescente e possono sia evolvere allo stadio primario che andare verso la regressione. La lamina basale separa le cellule follicolari dallo stroma circostante.
I follicoli secondari presentano cellule follicolari disposte in più strati attorno all’oocita, che continua a crescere. Tra le cellule follicolari compaiono piccoli spazi dove si accumula un po’ di liquido. La membrana plasmatica dell’oocita inizia a presentare delle villosità, che si ingranano con i prolungamenti citoplasmatici provenienti dalle cellule follicolari che lo circondano. Tra l’oocita e le cellule follicolari si viene a formare la zona pellucida. Si ha un’organizzazione del connettivo peri-follicolare in strati concentrici. I follicoli secondari migrano nella zona profonda, mentre i follicoli primordiali nella superficie della zona corticale.
Nei follicoli cavitari gli spazi tra le cellule follicolari confluiscono, formando una cavità unica che contiene il liquido follicolare secreto dalle cellule follicolari. L’accrescimento progressivo di questa cavità spinge le cellule follicolari alla periferia dove esse formano la parete del follicolo, costituita da pochi strati di cellule che per le loro caratteristiche sono state chiamate cellule della granulosa. Attorno all’oocita, che ha raggiunto il diametro definitivo di 125-150 µm, la granulosa forma una sporgenza chiamata cumulo ooforo. L’oocita è circondato dalla zona pellucida dello spessore di circa 5-10 µm. Le cellule che circondano l’oocita con interposizione della zona pellucida, hanno disposizione raggiata e formano la corona radiata. Intorno all’oocita si formano le guaine tecali. Le cellule dello stroma peri-follicolare si modificano, la sostanza inter-cellulare tra di esse si riduce notevolmente e rimane rappresentata soltanto da una trama di fibrille reticolari che accompagna una ricca rete capillare. La teca interna così formata ha cellule in grado di produrre androgeni. La teca esterna assume un aspetto più fibroso e vi si riscontrano alcune fibrocellule muscolari lisce.
I follicoli maturi hanno un diametro di 12-15 mm. Normalmente si ha un solo follicolo maturo per ciascun ciclo mestruale. La parete follicolare è sottile e il follicolo ripieno di liquido ha un aspetto cistico e sporge dalla superficie dell’ovaio. La porzione del contorno follicolare che sporge è molto sottile e trasparente ed è denominata stigma. A livello dello stigma avviene la rottura del follicolo e l’oocita circondato dalle cellule del cumulo ooforo viene espulso (follicolo deiscente). Alla deiscenza follicolare concorrono diversi meccanismi: la produzione di enzimi litici da parte delle cellule dell’epitelio superficiale e della teca, l’edema della parete follicolare, la contrazione di elementi muscolari peri-follicolari e la congestione dei vasi midollari. Nei follicoli maturi l’oocita porta a termine il suo accrescimento e completa la prima divisione meiotica, dando origine al primo globulo polare e all’oocita di secondo ordine, nel quale il corredo cromosomico è ormai aploide. Lo sblocco della meiosi è dovuto alla neutralizzazione da parte dell’LH di un fattore inibente la meiosi prodotto dalle cellule del cumolo ooforo e reperibile nel liquido follicolare. Al momento della sua espulsione l’oocita è bloccato nella metafase della seconda divisione meiotica. La progressione del follicolo attraverso i vari stadi di maturazione è dettata dall’azione del FSH. La produzione degli estrogeni da parte della teca interna, lo scoppio del follicolo e la successiva trasformazione delle sue pareti in corpo luteo sono invece dovuti all’azione dell’LH.
I follicoli involutivi sono tutti quelli che non raggiungono la completa maturazione e si arrestano a un stadio qualunque del loro sviluppo, con conseguente regressione e atresia follicolare. L’atresia follicolare deriva dalla necrosi dell’ovocita e delle cellule della granulosa, con ipertrofia delle cellule della teca che si trasformano in cellule interstiziali secondarie.
Le cellule interstiziali si distinguono a seconda dell’origine in cellule tecali-interstiziali e in cellule interstiziali secondarie.
Le cellule tecali-intersiziali sono localizzate nella teca interna dei follicoli e secernono androgeni, soprattutto androstenedione. Queste cellule acquisiscono attività enzimatica 3ßidrossi-steroido-deidrogenasi delta-isomerasi e di clivaggio della catena laterale del colesterolo, nonché i recettori per l’LH. Sotto lo stimolo dell’LH che giunge attraverso i capillari tecali, si ha l’evoluzione di queste cellule interstiziali in grosse cellule epiteliali capaci di secernere progesterone. Successivamente acquisiscono l’enzima 17alfa-idrossilasi C17-20 liasi e passano dall’essere cellule progestinico-secernenti a cellule androstenedione-secernenti.
Le cellule interstiziali secondarie si hanno allo stadio di atresia follicolare e si formano per l’ipertrofia delle cellule tecali interstiziali e continuano a produrre androgeni sotto lo stimolo dell’LH.
Il Corpo Luteo è la trasformazione, dopo l’ovulazione, del follicolo. La lamina basale, dopo la rottura del follicolo, si frammenta consentendo la penetrazione tra le cellule della granulosa dei fibroblasti e dei vasi della teca all’interno della cavità follicolare con la liberazione di citochine ed altri ligandi. Si forma così un coagulo che si organizza prendendo l’aspetto di un essudato connettivo circondato da un ammasso di emazie, fibrina e macrofagi ripieni di emosiderina. La penetrazione tra le cellule della granulosa dei vasi provenienti dalla teca interna è responsabile della trasformazione delle cellule della granulosa in cellule luteiniche di origine granulosa che producono progesterone. Nello stadio di maturità il corpo luteo appare come una formazione giallastra sporgente sulla superficie dell’ovaio. Le cellule della teca luteiniche esprimono invece l’enzima P450 17 a idrossilasi e dopo la luteinizzazione producono androstenedione che, grazie alla capacità aromatasica del corpo luteo viene trasformato in estradiolo. In caso di mancata fecondazione il corpo luteo va incontro a un processo di luteinizzazione che inizia otto giorni dopo l’ovulazione ed è secondario alla regressione delle cellule della teca, residuando così un ammasso di tessuto connettivo definito corpus albicans.
Bibliografia
- Monaco F. Endocrinologia Clinica. Società Editrice Universo, V Edizione.
- Balboni GC, et al. Anatomia Umana. Edi-Ermes, Volume II, III Edizione.
Azioni degli steroidi ovarici
Danuta Teresa Wolosinska, Sebastiano Vottari, Salvatore Monti
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
L'ovaio produce, sotto lo stimolo delle gonadotropine, gli steroidi sessuali (estrogeni, progesterone e androgeni), ma possiede anche la capacità di produrre ormoni peptidici (inibine, activine, relaxina e ormone anti-mulleriano).
ESTROGENI
Gli estrogeni, estradiolo (E2) ed estrone (E1), sono prodotti dalle cellule della granulosa ovarica attraverso l’aromatizzazione degli androgeni prodotti dalle cellule della teca. L'azione degli estrogeni si esplica soprattutto attraverso l'interazione con i recettori appartenenti alla superfamiglia dei recettori nucleari (azione genomica o classica), e, in minore misura, attraverso i recettori di membrana (azione non genomica).
Azione genomica
Gli estrogeni entrano nella cellula attraverso la membrana citoplasmatica (diffusione passiva) e si legano a un recettore nucleare (recettore per estrogeni, ER). Esistono due diversi recettori nucleari estrogenici, ERα ed ERβ, codificati da due geni differenti (ESR1 e ESR2), con un'omologia nella sequenza aminoacidica del 44%, espressi in diversi tessuti:
- ERα è espresso soprattutto nel sistema riproduttivo (utero, vagina, ovaio), ma anche nella mammella, nell’ipotalamo, nell’endotelio e nella muscolatura liscia dei vasi;
- ERβ è espresso maggiormente nell’ovaio ed in minor misura nel polmone, nel cervello e a livello dei vasi.
ER ha sei domini funzionali, A-F:
- il dominio A/B, N-terminale, contiene il segmento di attivazione 1 (AF1) che attiva la trascrizione indipendentemente dal ligando;
- il dominio C comprende il sito di legame al DNA (zink fingers);
- il dominio D contiene il segnale di localizzazione nucleare;
- il dominio E/F ha diverse funzioni, come il legame con il ligando, la dimerizzazione, la transattivazione ligando-dipendente mediata dal dominio AF2.
Nel nucleo della cellula bersaglio, ER è presente come monomero; quando avviene il legame con l'ormone, si verifica un cambiamento di conformazione, con successiva dimerizzazione che aumenta l'affinità di legame alle sequenze specifiche del DNA (elementi responsivi agli estrogeni - ERE) con la sequenza consenso GGTCA NNN TGACC. Il complesso ligando-ER-DNA recluta allora delle proteine che fungono da coattivatori o corepressori. I coattivatori possiedono proprietà istone-acetilasica, cioè acetilando gli istoni alterano la struttura della cromatina nella zona promotrice del gene bersaglio, in modo da dare inizio alla trascrizione. I corepressori possiedono invece proprietà istone-deacetilasica, che altera la cromatina e impedisce la trascrizione. Oltre che con i coattivatori e con i corepressori, gli ER possono interagire con altri fattori di trascrizione, come AP-1 o Sp1 (interazione proteina-proteina). In questo caso non vi è più il legame agli ERE, bensì alle specifiche sequenze regolatrici di AP-1 o Sp1.
Azione non genomica
Gli estrogeni possono interagire anche con recettori localizzati sulla membrana cellulare. Questi mediano l'attivazione rapida di alcune proteine, come le MAP-kinasi, o il rapido aumento dell'AMP-ciclico in seguito al legame con l'ormone. Sono inoltre responsabili del rapido rilascio di ossido nitrico (NO) o del rapido incremento dei livelli di calcio intra-citoplasmatico. A differenza dell'azione genomica, che di solito si esplica nell'arco di ore, l'azione non genomica si verifica in pochi secondi o minuti.
AZIONI FISIOLOGICHE
Sviluppo sessuale
Mediante un'azione diretta, gli estrogeni determinano lo sviluppo e la crescita della vagina, dell'utero e delle tube di Falloppio. Determinano inoltre la pigmentazione dei capezzoli e dell'areola mammaria. Sono responsabili dello sviluppo dei caratteri sessuali secondari, come l'aumento delle dimensioni della mammella per aumento dei dotti galattofori, aumento del tessuto adiposo e dello stroma, la distribuzione pilifera ginoide e la pigmentazione della regione genitale.
Ciclo mestruale
Gli estrogeni, insieme al progesterone, regolano il ciclo mestruale modulando, con effetto feed-back, la produzione delle gonadotropine. Determinano inoltre tutti i cambiamenti che avvengono durante il ciclo mestruale nelle tube di Falloppio, nell'utero, nella cervice uterina e nella vagina. In particolare, durante la fase follicolare o proliferativa l'estrogeno induce la proliferazione e la differenziazione dell'endometrio, aumentandone lo spessore. Induce inoltre l'espressione del recettore del progesterone, che rende le cellule capaci di rispondere a questo ormone nella seconda fase del ciclo mestruale. Nelle tube di Falloppio, gli estrogeni stimolano la contrattilità muscolare, influenzando così il tempo di transito della cellula uovo nell'utero. Aumentano la quantità del muco cervicale, incrementandone il contenuto acquoso, facilitano la penetrazione dello sperma nella cervice uterina e favoriscono le contrazioni del miometrio uterino. Stimolano inoltre la maturazione e la proliferazione dell'epitelio vaginale aumentando il numero di cellule superficiali.
Osso
Gli estrogeni contribuiscono a formare lo scheletro, a indurre la crescita e la fusione delle epifisi, determinando l'altezza finale dell'individuo. Regolano l'omeostasi ossea, in quanto riducono il riassorbimento osseo mediato dagli osteoclasti e favoriscono la formazione ossea mediata dagli osteoblasti. Gli estrogeni agiscono direttamente sugli osteoblasti e inducono la sintesi del collagene di tipo I, dell'osteocalcina, dell'osteopontina, dell'osteonectina e della fosfatasi alcalina (ALP). Riducono la produzione di citochine che stimolano gli osteoclasti, come IL-1, IL-6, TNFα, e aumentano la produzione di IGF-1, di BMP-6 e di TGFβ che svolgono un’azione di anti-riassorbimento. Aumentano anche la produzione di osteoprotegerina (OPG) da parte degli osteoblasti, che agisce da falso recettore e antagonizza il legame di OPG-L al suo recettore RANK, prevenendo così la differenziazione e la maturazione dei precursori degli osteoclasti. Gli estrogeni agiscono anche direttamente sugli osteoclasti inducendone l’apoptosi.
Sistema nervoso centrale
Gli estrogeni possiedono un effetto protettivo nei confronti delle malattie neurodegenerative, in particolare morbo di Parkinson, Alzheimer ed ictus cerebri. Gli estrogeni regolano la neurotrasmissione dopaminergica influenzando la sintesi, la captazione e il rilascio della dopamina. Inibiscono la degenerazione dei neuroni dopaminergici, riducendone l'apoptosi, regolando i fattori di crescita neurotrofici riducendo l'infiammazione, modulando i livelli di NO e proteggendo i neuroni contro lo stress ossidativo. Gli estrogeni, oltre all'effetto sul sistema dopaminergico, agiscono anche sui sistemi colinergico, serotoninergico e noradrenergico.
Azioni metaboliche
Gli estrogeni aumentano i livelli di trigliceridi e riducono lievemente i valori di colesterolo totale. In particolare, aumentano i valori di HDL e riducono i livelli di LDL e di Lp(a). Inducono un aumento della secrezione del colesterolo nella bile e una riduzione degli acidi biliari. Questo porta alla saturazione della bile con il colesterolo, che determina la formazione di calcoli della colecisti. Gli estrogeni non sembrano avere effetti rilevanti sul metabolismo dei carboidrati.
Sistema cardio-vascolare
Oltre agli effetti sul metabolismo dei lipidi, gli estrogeni inducono molteplici effetti sull'endotelio vascolare e sulla muscolatura liscia dei vasi. Inducono soprattutto la vasodilatazione attraverso il rapido rilascio di NO mediante un effetto non genomico (si verifica dopo 5-20 minuti dall'esposizione all'ormone). L'effetto genomico invece si esplica nella protezione nei confronti dell'aterosclerosi e nei confronti dei danni a carico dell'endotelio, riducendo così la formazione delle placche aterosclerotiche. Promuovono la crescita cellulare endoteliale e inibiscono la proliferazione delle cellule muscolari lisce dei vasi.
Tessuto adiposo
Gli estrogeni regolano il metabolismo e la disposizione del tessuto adiposo e svolgono un importante ruolo nell'adipogenesi, nella lipogenesi, nella lipolisi e nella proliferazione degli adipociti. Inibiscono la lipoprotein-lipasi (LPL), che regola il metabolismo dei trigliceridi e aumenta il deposito di acidi grassi negli adipociti. Aumentano la lipolisi, aumentando l'espressione della lipasi ormono-sensibile, che determina il rilascio in circolo degli acidi grassi liberi.
Altri effetti
Gli estrogeni possiedono effetti sulle proteine sieriche:
- aumentano i livelli plasmatici di CBG, TBG e SHBG
- determinano un lieve aumento dei fattori della coagulazione VII e XII e una riduzione di fattori anti-coagulanti come proteina C, proteina S e AT-III; influenzano anche la via fibrinolitica, riducendo i livelli di PAI-1.
PROGESTERONE
Il progesterone viene prodotto nella fase post-ovulatoria del ciclo mestruale dal corpo luteo. Rappresenta un prodotto intermedio della sintesi dei corticosteroidi, degli androgeni e degli estrogeni.
Azione genomica
Il progesterone agisce su un recettore (PR) appartenente alla famiglia dei recettori nucleari. Esistono due isoforme di tale recettore, PR-A e PR-B, codificate da un unico gene. Il dominio di legame del ligando in entrambe le isoforme è identico, pertanto l'ormone si lega in ugual misura a entrambi i recettori.PR-A è più corto del PR-B di 164 aminoacidi e agisce come inibitore trascrizionale di altri recettori steroidei. PR-B, invece, media l'attività stimolatoria del progesterone.
In assenza dell'ormone, il PR si trova nel nucleo sotto forma monomerica inattiva, legato alle shock protein (HSP-90, HSP-70 e p59). Quando il progesterone si lega al recettore, si verifica la dissociazione delle shock protein, la fosforilazione del recettore e la formazione di dimeri, che successivamente si legano agli elementi responsivi al progesterone (PRE) dei geni bersaglio. Si verifica allora il reclutamento di coattivatori, come SRC-1, NcoA-1 e NcoA-2, che a loro volta favoriscono l'interazione con altre proteine ad attività istone-acetilasica. Dopo l'acetilazione degli istoni, si ottiene un rimodellamento della cromatina che favorisce la trascrizione. La trascrizione però può essere anche attivata attraverso un'interazione diretta con fattori di trascrizione come TFIIB. Gli antagonisti del progesterone, una volta legati al recettore, inducono anch'essi la dimerizzazione del recettore, ma reclutano i corepressori (NcoR/SMRT) e successivamente l'istone-deacetilasi che impedisce la trascrizione.
Azione non genomica
Come avviene per gli estrogeni, anche il progesterone si lega a delle proteine di membrana e determina effetti in un breve intervallo di tempo (pochi minuti), come per esempio il rapido incremento di calcio intra-citoplasmatico e l'attivazione della cascata dei secondi messaggeri.
AZIONI FISIOLOGICHE
Apparato riproduttivo
il progesterone viene prodotto soprattutto nella seconda fase del ciclo mestruale, o fase luteinica. Riduce la proliferazione endometriale provocata dagli estrogeni e favorisce lo sviluppo dell'endometrio secretorio, stimolando la differenziazione cellulare e la stimolazione della crescita dei vasi endometriali. Influenza anche il secreto delle ghiandole endocervicali, riducendone il secreto e rendendolo più vischioso. In questo modo viene impedita la penetrazione dello sperma nella cervice uterina. L'ormone agisce anche sull'epitelio vaginale e sulle tube di Falloppio riducendo la contrattilità muscolare, sul miometrio uterino riducendone sempre la contrattilità, ed è quindi fondamentale per il mantenimento della gravidanza.
Ghiandola mammaria
Il progesterone, insieme agli estrogeni, induce la proliferazione degli acini della ghiandola mammaria. Questo processo è maggiormente evidente durante la gravidanza, ma si osserva anche durante la fase luteinica del ciclo mestruale. Il progesterone, a differenza di quanto avviene nell'endometrio, favorisce l'attività mitotica dell'epitelio mammario, che durante il ciclo mestruale è transitoria, in quanto l'esposizione continua all'ormone è seguita dall'arresto della crescita di tali cellule.
Sistema nervoso centrale
Il progesterone agisce sul centro ipotalamico della regolazione della temperatura corporea: nella fase luteinica del ciclo mestruale si assiste infatti ad un incremento della temperatura corporea di circa 0.5°C. Agisce anche sul centro della respirazione, aumentando la risposta ventilatoria all'anidride carbonica. Possiede inoltre azioni depressive e ipnotiche sul SNC, inducendo sonnolenza.
Azioni metaboliche
Il progesterone aumenta i livelli di insulina, sia a digiuno che in seguito all'ingestione di carboidrati, ma non altera il metabolismo glicidico. Stimola la lipoprotein-lipasi, aumenta la deposizione del tessuto adiposo, aumenta le LDL e riduce lievemente le HDL. Riduce infine l'azione dell'aldosterone sui tubuli renali, provocando un ridotto riassorbimento del sodio.
ANDROGENI
Gli androgeni, a livello ovarico, vengono prodotti dalle cellule della teca. L'ovaio produce circa il 50% del pool circolante di androstenedione, il 25% del testosterone, il 20% del DHEA e meno del 5% del DHEA-S. L'androstenedione, ormone ad attività androgenica bassa, può essere aromatizzato in estrone (E1) o ridotto in testosterone. Quest'ultimo agisce attraverso tre diversi meccanismi: legame diretto al recettore androgenico, conversione in alcuni tessuti a forma biologicamente più attiva (diidro-testosterone, che si lega anch'esso al recettore androgenico) e conversione da parte dell'aromatasi in estradiolo, che si lega invece al recettore estrogenico. Come gli estrogeni ed il progesterone, anche gli androgeni possiedono un'attività biologica genomica e una non classica o non genomica.
Azione genomica
Anche il recettore per gli androgeni appartiene alla superfamiglia dei recettori nucleari. E' formato da 918 aminoacidi, con un peso molecolare di 110 kDa. Viene suddiviso in quattro domini funzionali:
- A/B o N-terminale che contiene la regione AF-1 (funzione di attivazione) ligando-indipendente;
- DBD o dominio legante il DNA;
- dominio cerniera o di legame;
- LBD o dominio legante il ligando che contiene la regione AF-2, essenziale per la trascrizione ligando-dipendente e per la dimerizzazione del recettore.
Una volta avvenuto il legame ligando-recettore, vi è la dimerizzazione dello stesso, l'interazione con sequenze ARE (androgen response element), il reclutamento dei co-regolatori che possiedono attività acetilasica, e la successiva trascrizione di specifiche sequenze del DNA.
Azione non genomica
Consiste nell'interazione degli androgeni con i recettori di membrana, che induce una rapida attivazione dei secondi messaggeri, determinando l'aumento del calcio intra-citoplasmatico e l'attivazione di protein-chinasi come PKA, PKC e MAPK.
AZIONI FISIOLOGICHE
Cute
Il recettore per gli androgeni è espresso a livello dell’unità pilo-sebacea, in particolare a livello della ghiandola sebacea, nei cheratinociti dell’epitelio follicolare e nella guaina esterna della radice del pelo. Gli androgeni agiscono a livello cutaneo favorendo la comparsa dell’acne, stimolano la crescita e la secrezione del sebo, e la crescita pilifera. Gli androgeni aumentano le dimensioni del follicolo pilifero, il diametro del pelo e la durata della fase anagen della crescita del pelo.
Follicolo ovarico
Gli androgeni secreti dalle cellule della teca costituiscono i precursori degli estrogeni, fondamentali per la follicologenesi, e controllano l'atresia dei follicoli pre-antrali, riducendo l'espressione di recettori per gli estrogeni nella granulosa.
Osso
Gli androgeni hanno un effetto diretto sull'osso ed un effetto indiretto, attraverso la conversione del testosterone in estradiolo. Aumentano l'attività della fosfatasi alcalina e la sintesi del pro-collagene tipo 1 e di IGF-II. Sono strettamente associati alla densità ossea, in quanto regolano la produzione della matrice ossea e stimolano la mineralizzazione. Incrementano la produzione di TGFβ, importante fattore di crescita degli osteoblasti, e agiscono sugli osteoclasti, inibendo la differenziazione e la maturazione dei precursori degli osteoclasti.
Libido
Gli androgeni rappresentano fattori indipendenti che influenzano il desiderio e l’attività sessuale, come anche l’umore e la forza fisica. Non esistono cut-off per i livelli di testosterone predittivi della disfunzione sessuale, comunque esistono evidenze cliniche dell’effetto positivo della terapia con testosterone a basse dosi in donne con riduzione dell’appagamento sessuale.
Tessuto adiposo
Gli androgeni modulano la funzione degli adipociti e influenzano l’estensione del tessuto adiposo. In particolare, il diidro-testosterone inibisce la differenziazione degli adipociti, sia a livello del tessuto sottocutaneo che del grasso viscerale. L’azione degli androgeni però viene contrastata localmente dall’azione degli enzimi aldo-keto riduttasi 1C che inattivano gli androgeni. Si osserva una maggiore espressione enzimatica nel tessuto adiposo sottocutaneo che in quello viscerale.
Altri effetti
Il recettore per gli androgeni è espresso ubiquitariamente nel midollo osseo ed ha la funzione di regolare l'ematopoiesi. Gli androgeni hanno anche un’importante azione anabolica sul tessuto muscolare: inducono ipertrofia delle fibre muscolari tipo I e II e promuovono la differenziazione delle cellule mesenchimali multipotenti verso la linea miogenica.
BIBLIOGRAFIA
- Goodman-Gilman A. Le basi farmacologiche della terapia, X Edizione. McGraw-Hill 2003.
- Deroo BJ, Korach KS, Estrogen receptors and human disease. J Clin Invest 2006, 116: 561-70.
- Klinge CM. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res 2001, 29: 2905-19.
- Hill KK, et al. Structural and functional analysis of domains of the progesterone receptor. Molec Cell Endocrinol 2012, 348: 418-29.
- Thomas P. Characteristics of membrane progestin receptor alpha (mPRα) and progesterone membrane receptor component 1 (PGMRC1) and their roles in mediating rapid progestin actions. Front Neuroendocrinol 2008, 29: 292-312.
- Lee HJ, Chang C. Recent advances in androgen receptor action. Cell Molec Life Sci 2003, 60: 1613-22.
- Kang HY, et al. Mechanisms and clinical relevance of androgens and androgen receptor actions. Chang Gung Med J 2003, 26: 388-402.
Asse GnRH-Gn-ovaio e ciclo mestruale
Laura Proietti-Pannunzi
UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
Introduzione
La funzione riproduttiva femminile è un complesso processo reso possibile dall’interconnessione funzionale di vari organi endocrini raggruppati nell’asse ipotalamo-ipofisi-gonadi che, attraverso meccanismi di feed-back positivi e negativi, portano alla formazione dell’ovocita maturo (gamete femminile) durante la vita riproduttiva della donna.
Asse GnRH-Gonadotropine-Ovaio
Il GnRH (Gonadotropin-Releasing Hormone) rappresenta l’ormone centrale della funzione riproduttiva, poichè controlla la sintesi e il rilascio delle gonadotropine (FSH ed LH) da parte dell’ipofisi.
E’ un decapeptide identificato nel 1971, prodotto da neuroni distribuiti in una regione ipotalamica che comprende la zona del setto, il nucleo arcuato e l’area pre-ottica, prendendo contatto con i vasi portali ipofisari dove viene rilasciato.
La regolazione della secrezione del GnRH nei vasi portali avviene attraverso una rete complessa di neurotrasmettitori e neuromodulatori. I neuroni che producono GnRH ricevono afferenze di tipo dopaminergico, serotoninergico, noradrenergico, e neuropeptidiche (CRH, TRH, ecc). Ciò lascia supporre che un’ampia gamma di fattori e/o situazioni fisiopatologiche a carico del sistema nervoso, le loro terapie, o anche semplici condizioni di stress, possano alterare la secrezione di questo ormone.
Per una corretta attività dell’asse è necessario che la secrezione del GnRH avvenga in modo pulsatile, infatti l’esposizione dell’ipofisi a valori costanti di GnRH o l’aumento della secrezione ad una frequenza più elevata esita in una risposta refrattaria della ghiandola ipofisaria, con desensibilizzazione e down-regolazione dei recettori per il GnRH.
L’azione del GnRH sulle cellule gonadotrope ipofisarie è mediata dal legame a specifici recettori di membrana (GnRH-R).
Il GnRH ha una emivita di circa 10 minuti, viene catabolizzato attraverso una endopeptidasi ed una carbossipeptidasi a livello epatico ed escreto per via renale.
Il GnRH controlla la secrezione di ambedue le gonadotropine ipofisarie, l’ormone follicolo-stimolante (FSH) e l’ormone luteinizzante (LH). Queste sono glicoproteine costituite ciascuna da una subunità comune alfa (la stessa che forma anche il TSH e l’hCG) e da una subunità beta specifica per ognuno dei due ormoni (che ne permette l’identificazione a scopo diagnostico). Il GnRH almeno nell'adulto induce una secrezione maggiore di LH rispeto a FSH.
Anche la regolazione della secrezione delle gonadotropine è complessa, in quanto dipende non solo dalla quantità di GnRH nel circolo portale, ma, anche dalla sua pulsatilità secretoria. Variazioni della frequenza e dell’ampiezza della secrezione del GnRH sono alla base dell’induzione della pubertà e del meccanismo che porta all’ovulazione nella donna. La diversa pulsatilità e frequenza del GnRH determinano una variazione di sintesi e rilascio delle gonadotropine nelle differenti fasi del ciclo mestruale, caratterizzando un vero e proprio ciclo ‘ormonale’.
Le gonadotropine hanno anche un ritmo circadiano, circamensile e circannuale, che si modifica nelle diverse fasi della vita.
Esercitano le loro azioni mediante il legame a specifici recettori accoppiati alle proteine G. L’FSH è responsabile dell’attività delle cellule della granulosa e sostiene le prime fasi della crescita dei follicoli ovarici. L’LH ha un effetto trofico sulle cellule della teca ed è responsabile delle fasi finali di maturazione dei follicoli ovarici. Esso inoltre stimola la steroidogenesi ovarica, con produzione di estrogeni e progesterone nella donna.
Alla luce di quanto esposto è possibile affermare che l’asse funge da vero e proprio sistema di amplificazione a cascata, dove la secrezione di GnRH produce effetti sull’intero organismo attraverso le azioni sistemiche esercitate a vari livelli fino ad arrivare agli steroidi sessuali. Questo asse è caratterizzato da una serie di sistemi di feed-back (positivi o negativi), che ne permettono la regolazione a qualsiasi livello della cascata del segnale: ad esempio gli steroidi sessuali giocano un importante ruolo nel modulare l’attività dell’asse riproduttivo stesso, proprio attraverso la loro azione di feed-back sul sistema ipotalamo-ipofisario, regolando sia la liberazione di LH, che di GnRH.
Fattori di origine gonadica, quali inibina, attivina e follistatina sono anch’essi in grado di modulare la secrezione delle gonadotropine. Appare quindi evidente che anche alterazioni primarie della funzionalità gonadica (PCOS, POF, ecc) possano portare ad alterazioni della funzionalità dell’asse riproduttivo e ipergonadotropinemia.
La funzionalità dell’asse può essere alterata da numerosi fattori, fra cui l’eccessiva secrezione di prolattina, che è in grado di inibire la liberazione di GnRH.
L’asse ipotalamo-ipofisi-gonadi mostra marcate variazioni funzionali nelle diverse fasi della vita: sia la secrezione di GnRH che di gonadotropine subisce modificazioni sia nel periodo fetale che durante la pubertà, ma anche durante l’invecchiamento.
Durante il periodo riproduttivo le modificazioni dei livelli ormonali dell’asse nella donna seguono importanti fluttuazioni periodiche, che caratterizzano il vero e proprio ‘ciclo ormonale’. Esso è guidato dall’alternarsi della secrezione dei diversi ormoni ed è mirato al controllo ciclico della maturazione dell’ovocita e alla preparazione dell’apparato riproduttivo all’eventuale fecondazione e quindi all’instaurarsi della gravidanza.

I meccanismi di una efficiente riproduzione sessuale vengono garantiti attraverso il complesso e integrato controllo ormonale tra il sistema nervoso e l’apparato riproduttivo; esso avviene attraverso un duplice meccanismo di feed-back: feedback “corto” quello che si verifica fra diencefalo ed adenoipofisi; feedback “lungo” quello che si verifica fra ipofisi anteriore ed ovaio.
| Fattori che influenzano GnRH e Gonadotropine | ||
| Aumentati da | Diminuiti da | |
| GnRH | Noradrenalina Estrogeni ad alte concentrazioni |
PRL Endorfine Dopamina Serotonina Estrogeni a basse concentrazioni |
| LH/FSH | Estrogeni ad alte concentrazioni Clomifene Ipogonadismo primario |
Ipopituitarismo Ipercortisolismo Depressione Cachessia Intensa attività fisica Estrogeni a basse concentrazioni |
Il ciclo mestruale
Il ciclo mestruale si manifesta con una perdita ematica ciclica mensile dal menarca alla menopausa. E’ espressione di tutte le modificazioni endocrine che coinvolgono il sistema riproduttivo femminile.

Nella maggior parte delle donne la mestruazione si verifica ogni 25-35 giorni, con una cadenza media ogni 28 giorni. Il ciclo viene suddiviso in due fasi:
- la fase follicolare inizia il con il manifestarsi della mestruazione e termina con il picco dell’LH
- la fase luteale ha inizio con il picco dell’LH e termina al momento della comparsa delle mestruazioni successive.
In cicli regolarmente ovulatori la variabilità è principalmente dovuta a cambiamenti che si verificano nella fase follicolare, mentre la fase luteale è in genere maggiormente costante, con una durata media di 14 giorni. Inoltre una ciclicità meno regolare si riscontra nei primi anni dopo il menarca e negli anni che precedono la menopausa, poiché questi periodi sono caratterizzati da cicli mestruali spesso non ovulatori.
Il ciclo mestruale può essere ulteriormente suddiviso in ciclo ovarico, ciclo endometriale e ciclo vaginale ed ognuno di loro a sua volta riconosce le fasi follicolare e luteinica. Per convenzione il primo giorno del ciclo corrisponde al primo giorno della mestruazione ed inizia con il reclutamento, dal pool di follicoli antrali, dei follicoli primordiali che andranno incontro a maturazione e da cui verrà selezionato il follicolo dominante che giungerà a maturazione completa fino all’ovulazione, mentre gli altri diverranno atresici. Entrambe le fasi del ciclo a loro volta possono essere ulteriormente suddivise in tre periodi:
- precoce;
- intermedia;
- tardiva.
Nella fase follicolare precoce l’ovaio è ormonalmente poco attivo. Per tale motivo i livelli sierici di estrogeni e progesterone in questo periodo risultano bassi. Il GnRH stimola la secrezione dell’FSH, necessario per il reclutamento dei follicoli antrali dal pool di follicoli primordiali, da cui verrà selezionato quello che diverrà il follicolo dominante e andrà incontro ad ovulazione. L’ovaio in questa fase è quiescente, possono evidenziarsi piccoli follicoli fra i 3-8 mm di diametro e solo occasionalmente è possibile riscontrare il corpo luteo del ciclo precedente. Nei primi giorni della fase follicolare precoce l’endometrio è ecograficamente difficilmente riconoscibile, una volta terminata la mestruazione si visualizza come linea sottile.
Nella fase follicolare intermedia i follicoli reclutati per il nuovo ciclo iniziano a maturare e le cellule della granulosa, ricche in glicoproteine e polisaccaridi necessari per la nutrizione dell’oocita stesso e per la formazione del liquor follicoli, diventano ipertrofiche e vanno incontro a divisione. Le sostanze nutritive si accumulano tra le cellule e danno vita a piccole cavità denominate corpi di Call-Exner, che aumentano di volume e confluiscono formando una cavità centrale contenente il liquor e spostando in sede eccentrica l’oocita circondato da più strati di cellule della granulosa, che prendono il nome di cumulo ooforo. Nello stroma circostante viene delineandosi la teca interna, formata da cellule poligonali disposte in più strati; inizia la sintesi di fosfolipidi, colesterolo e vitamina C, elementi anch’essi necessari alla nutrizione dell’oocita.
Nelle cellule della granulosa e successivamente in quelle della teca inizia la steroidogenesi che porta alla sintesi e secrezione di estradiolo, dapprima sotto stimolo dell’FSH e, successivamente di inibina A prodotta dalle stesse cellule della granulosa.
L’incremento dei livelli di estradiolo esercita un feed-back negativo sull’ipotalamo e sull’ipofisi, riducendo le concentrazioni sieriche di FSH e LH e l’ampiezza dei picchi di LH. La frequenza media dei picchi del GnRH passa da 90 minuti della fase follicolare precoce ai 60 minuti della fase follicolare intermedia, questo probabilmente per il rilascio del feed-back negativo esercitato dal progesterone.
Ecograficamente, entro 7 giorni dall’inizio del ciclo mestruale è possibile evidenziare la presenza di follicoli con diametro di 9-10 mm. L’incremento dei livelli sierici di estradiolo determina la proliferazione delle ghiandole endometriali con lo sviluppo di un pattern a triplo strato (epitelio proliferativo o estrogenico).
Nella fase follicolare tardiva i follicoli producono concentrazioni di estradiolo ed inibina A che aumentano giornalmente durante la settimana che precede l’ovulazione. I livelli sierici di gonadotropine subiscono il feed-back negativo dell’estradiolo e di altre molecole secrete dall’ovaio.
In questa fase a livello ovarico viene isolato il follicolo dominante ed i restanti follicoli che facevano parte della coorte selezionata all’inizio del ciclo mestruale vanno incontro ad atresia. Il follicolo dominante aumenta il proprio diametro di circa 2 mm al giorno fino a raggiungere i 20-26 mm che indicano la piena maturazione. L’aumento dei livelli di estradiolo determina un incremento dello spessore endometriale e della viscosità del muco cervicale.
Picco di metà ciclo, ovulazione, fase luteinica precoce. Affinchè l’ovulazione avvenga, è necessario che i livelli di estradiolo continuino a salire fino a raggiungere un picco massimo approssimativamente il giorno precedente l’ovulazione. La persistenza di valori di estradiolo di circa 200 pg/mL per più di 24 ore è il fattore determinante la conversione del feed-back negativo in feed-back positivo sulla secrezione di LH, con conseguente incremento dei suoi livelli di circa 10 volte ed un più modesto incremento dei valori di FSH (di circa 4 volte).
Oltre all’estradiolo, altri fattori ovarici entrano in gioco, contribuendo all’incremento dei valori di LH. Ciò è stato dimostrato somministrando, in modo sperimentale, a donne solo estrogeni e progestinici dalla fase follicolare precoce alla fase tardiva, senza riuscire a raggiungere gli stessi livelli di gonadotropine.
In questa fase la frequenza dei picchi di secrezione dell'LH è approssimativamente oraria, ma l’ampiezza dei picchi incrementa drasticamente. Ancora non sono completamente elucidati tutti i meccanismi che determinano il passaggio del feed-back dell’LH da negativo a positivo: probabilmente un incremento dell’espressione dei recettori del GnRH a livello ipofisario potrebbe avere un ruolo, ma non sono state dimostrate modificazioni dell’input del GnRH sull’ipofisi.
Il picco di LH a livello ovarico determina sostanziali modificazioni: l’oocita del follicolo dominante termina la prima divisione meiotica, si porta sulla superficie ovarica e va incontro a deiscenza, con fuoriuscita dell’ovocita circondato dalle cellule della granulosa (corona radiata). In questa fase inoltre, a livello ovarico, si osserva un incremento della secrezione di citochine e attivatori del plasminogeno necessari per il processo ovulatorio. L’oocita viene rilasciato dal follicolo sulla superficie dell’ovaio circa 36 ore dopo il picco di LH e migra dalle tube di Falloppio alla cavità uterina. Prima di essere espulso, ha completato la meiosi riduzionale ed ha espulso il 1° globulo polare; il suo corredo cromosomico pertanto a questo punto si è ridotto a 23 cromosomi. L’oocita prende il nome di ovocita di secondo ordine e la sua fecondabilità dura 24 ore.
E’ stata dimostrata una stretta correlazione fra il picco di LH e l’espulsione dell’oocita dal follicolo maturo: questo ha consentito di standardizzare un test che misura l’LH sierico o urinario per stimare il timing ovulatorio in donne fertili.
Prima che l’oocita venga rilasciato, le cellule della granulosa che lo circondano iniziano a produrre progesterone, che esercita un effetto inibitorio sul GnRH, con conseguente riduzione dei picchi di LH. Il follicolo, ormai privo dell’oocita, va incontro a numerose altre modificazioni: nella cavità si forma un coagulo, le pareti vanno incontro a edema sierofibrinoso, le cellule della granulosa proliferano e nel loro citoplasma si accumulano lipidi; le cellule della teca interna s’ingrandiscono, assumono un aspetto stellare e migrano nella granulosa. Questa nuova formazione prende il nome di corpo luteo; è una ghiandola a secrezione endocrina che dura 12-14 giorni e secerne progesterone. Il progesterone determina importanti modificazioni sull’endometrio; si osserva infatti la cessazione della proliferazione e l’organizzazione ghiandolare, con lume ampio e contorni sinuosi, fino ad assumere un aspetto a “cavaturacciolo”. Le cellule dello stroma mostrano nucleo globoso e ampio citoplasma ricco di polisaccaridi (deciduiformi), si ipertrofizza la rete venosa, la mucosa uterina ecograficamente non mostra più i tre strati, ma un unico elemento brillante di 3-5 mm di spessore, diventa edematosa e “vellutata”, pronta ad accogliere l’uovo fecondato.
Fase luteinica media-tardiva. L’elevata secrezione di progesterone da parte del corpo luteo caratterizza il passaggio dalla fase media alla fase tardiva luteale. L’attività inibitoria di questo ormone sull’LH determina una riduzione dell’ampiezza e della frequenza dei picchi, con andamento ogni 4 ore. I picchi di progesterone inoltre si verificano subito prima di quelli dell’LH.
Se l’oocita viene fecondato e si impianta nell’utero, inizia a produrre ßhCG, che mantiene il corpo luteo e la produzione di progesterone, dando vita all’inizio della gestazione.
Se invece non avviene la fecondazione, il corpo luteo regredisce, si ha una brusca caduta dei livelli ormonali (sia degli estrogeni che del progesterone), che porta, a 48 ore di distanza, alla comparsa della mestruazione, con l’inizio di un nuovo ciclo. Al posto del corpo luteo resta una formazione fibrosa, definita corpus albicans, che con il tempo diverrà una cicatrice biancastra.
Il periodo mestruale è caratterizzato dalla desquamazione dell’endometrio risultante dalla proteolisi e dall’ischemia del suo strato superficiale. Gli enzimi proteolitici, accumulatisi nei lisosomi nella prima metà del periodo post-ovulatorio, vengono liberati in seguito al declino dei valori di estrogeni e progesterone, con conseguente digestione di cellule ghiandolari e stromali e dell’endotelio vasale. L’ischemia determinata dalla vasocostrizione induce la rottura dei capillari e provoca il sanguinamento. Inoltre la produzione di prostaglandine durante la fase secretiva tardiva contribuisce al rilascio di idrolasi acide e all’aumento delle contrazioni del miometrio, che facilitano l’espulsione dell’endometrio degenerato.
Bibliografia
- UpToDate. Physiology of the normal menstrual cycle.
- Mihm M, Gangooly S, Muttukrishna S. The normal menstrual cycle in women. Anim Reprod Sci 2011, 124: 229-36.
- Molina. Fisiologia Endocrina. Lange Physiology Series: pag 58-59; 237-254.
- Greenspan's Basic and Clinical endocrinology McGraw-Hill 9th edition: pag 83-85; 427-436.
- Berlingeri. Ginecologia e Ostetricia. Ed Piccin: pag 4-26.
Lo sviluppo puberale femminile normale
Rossella Gaudino
Dipartimento di Scienze della Vita e Riproduzione, Clinica Pediatrica, Policlinico, Verona
DEFINIZIONE
La pubertà, dal latino pubertas che significa maturità sessuale, è un insieme di fenomeni maturativi neuroendocrini complessi, di importanti cambiamenti biologici e psicosociali che culmina con il menarca, simbolo di conclusione dell’infanzia e inizio della capacità riproduttiva della donna (1).
Ricerche negli ultimi trent’anni hanno fermamente stabilito che la pubertà inizia con il rilascio pulsatile di gonadotropin-releasing hormone (GnRH), che è necessario per il normale sviluppo e funzionamento delle gonadi. L’età di inizio dello sviluppo puberale e di attivazione dell’asse ipotalamo-ipofisi-gonadi, che in genere inizia nelle femmine tra i 9 e i 13 anni, varia notevolmente fra individui sani e nella popolazione generale ed è influenzata da fattori sia genetici che ambientali (2,3).
L’importante correlazione all'interno di gruppi razziali/etnici, all'interno delle famiglie, e tra gemelli monozigoti rispetto ai gemelli dizigoti suggerisce che il 50-80% della variazione nell’età di inizio puberale sia determinata da fattori genetici. Il coinvolgimento dell’ambiente in tale diversità di inizio è invece sostenuto dalle differenze geografiche, dall’influenza della nutrizione, del peso corporeo, dell’attività fisica, così come dalle condizioni socio-economiche e dallo stile di vita (1,4).
Anche il “secular trends”, la tendenza secolare all’abbassamento dell’età di inizio della pubertà attualmente in arresto, e gli studi su bambini adottati sono prova delle implicazioni di fattori ambientali (1).
Probabilmente tale variabilità deriva da un’interazione multifattoriale tra varianti genetiche ed esposizione ambientale, anche se un gene specifico e un meccanismo preciso responsabile della variabilità nel timing puberale non è ancora stato individuato.
GENETICA DELLA PUBERTÀ NORMALE
Molti sono i progressi relativi all’individuazione di geni responsabili di patologie della pubertà, come ipogonadismo ipogonadotropo (HH) e sindrome di Kallmann (KS), ma i fattori genetici specifici che regolano la variazione nel timing puberale nella popolazione generale sono solo emergenti.
L'approccio più comunemente usato per identificare le varianti del timing puberale nella popolazione generale è stato l’utilizzo di studi di associazione basati su geni candidati. Recenti studi hanno utilizzato l'associazione tra varianti comuni (SNP, Singoli polimorfismi nucleotidici) in geni conosciuti coinvolti nell’ipogonadismo ipogonadotropo (GnRH, GnRH-R, GPR-54, Kiss1, LEP, LEP-R, FGF-R1, KAL1, PROK2 e PROK-R2) e l'età al menarca. Tuttavia le associazioni, solo nominalmente significative tra SNPs, indicano che la variazione genetica in geni noti “candidati” non sembra essere un modulatore sostanziale di timing puberale nella popolazione generale. Le limitazioni negli studi di associazione tradizionali sono il numero relativamente piccolo di individui e le piccole regioni di genoma analizzate (8).
La necessità di identificare nuovi geni non sorprende, dal momento che le mutazioni nei geni noti sono responsabili solo di circa il 30% dei casi di HH e KS.
Le attuali ricerche circa le associazioni genetiche di tratti, quali il timing puberale, si concentrano sul “genome wide association studies (GWAS)”, basandosi sulla prevalenza di comuni polimorfismi (SNPs) in casi e controlli. Gli studi GWA sono particolarmente potenti, perché analizzano numerosissimi SNPs (ben 900.000) in tutto il genoma e perché gli studi GWA collettivamente sono condotti in popolazioni di decine o addirittura centinaia di migliaia di individui. I risultati dei primi studi GWA ed età del menarca, pubblicati nel 2009, hanno confermato l’associazione in due loci 6q21 (vicino al gene LIN28B) e 9q31.2. Questi studi hanno coinvolto tra 17.000 e 25.000 persone tutte di origine europea, valutando anche altri fattori quali il telarca e la crescita puberale. LIN28B sembra svolgere un ruolo importante nella pluripotenza cellulare e cancro, ma è ancora oggetto di studio come questo sistema di regolazione modula la crescita e il timing puberale. La biologia dietro il locus di 9q31.2 rimane sconosciuta. Infine, recentemente, attraverso meta-analisi di GWAS sono stati individuati altri trenta loci associati all’età del menarca (5-7,9).
I loci attualmente identificati, tuttavia, malgrado l’alto livello di significatività statistica, possono spiegare solo una piccola percentuale (stimata in circa 1%) di “trait variance”. Inoltre, la maggior parte, se non tutti, gli SNPs associati, non hanno una rilevanza funzionale e sono quindi considerati come semplici tasselli “tags” di regioni genomiche associate al timing puberale. Anche se cominciano ora ad emergere le prime associazioni genetiche con i tempi della pubertà, il loro scarso effetto suggerisce che saranno necessari nuovi approcci e strategie per comprendere pienamente quel 50-70% di variazione genetica che influenza il timing puberale. Il prossimo passo sarà probabilmente quello di individuare nuove forme di studi GWA e gli sforzi di sequenziamento su larga scala per cercare le varianti genetiche più rare rispetto a quelle individuate da array GWA, nonché la ricerca di altri modi di eredità, quali ad esempio l’epigenetica (3,8).
REGOLAZIONE ORMONALE DELLA PUBERTÀ
Nella pubertà normale, la secrezione ormonale cambia drammaticamente con il rilascio pulsatile di gonadotropin-releasing hormone (GnRH) ipotalamico, che induce la produzione ipofisaria di gonadotropine (LH e FSH), che governano la steroidogenesi e gametogenesi ovarica.
In realtà, l’asse ipotalamo-ipofisi-gonadi (HPG) è già attivo durante l’età gestazionale e la produzione di LH e FSH inizia intorno alla dodicesima settimana di età gestazionale. Alla nascita, probabilmente per il feed-back negativo degli estrogeni placentari, si ha una riduzione dei livelli di gonadotropine che sono bassi. Con la riduzione dei livelli di estrogeni placentari, durante i primi 6 mesi di vita si ha un importante aumento dei livelli di gonadotropine che sono simili a quelli adulti. Questo periodo è anche chiamato “mini-pubertà” e sembra essere molto importante per la femminilizzazione dell’encefalo e l’identità sessuale (figura 1). Dopo le prime settimane di vita post-natale e durante tutto il periodo peri-puberale i neuroni GnRH-secernenti sono sottomessi a sistemi inibitori (GABA, derivati oppioidi) che ne impediscono la secrezione. Il meccanismo esatto di riattivazione dell’asse HPG, legato alla produzione intermittente di GnRH prima e durante il sonno, resta ancora sconosciuto. Un complesso reticolo di neuroni, neurotrasmettitori e neuropeptidi ad azione stimolatoria (i.e. glutammato, noradrenalina) o inibitoria (GABA, NPY) modula l’attivazione del GnRH pulse generator. Recentemente inoltre, la scoperta del gene Kiss-1 e il suo recettore GPR54 stanno emergendo come fattori chiave nella regolazione dello sviluppo puberale e riproduzione. La figura 2 mostra la complessità dei fattori coinvolti (13).

..............................................
Figura 1: Modificazioni ormonali dalla nascita all’età adulta

Figura 2: Complessità dei fattori chiamati in causa nell’attivazione dell’asse ipotalamo ipofisi gonadi
(Ojeda SR, et al. Endocrinology 2006, 147: 1166-74)
FSH ed LH, secreti in maniera pulsatile, stimolano la produzione ovarica (gonadarca) di estrogeni, progesterone e testosterone, indispensabili per la comparsa dei caratteri sessuali secondari, la corretta progressione dello sviluppo puberale, la maturazione degli organi sessuali interni fino al menarca e all’ovulazione. La produzione di ormoni surrenalici (adrenarca), che in genere avviene verso i 6 anni, indipendentemente dall’attivazione dell’asse HPG, è invece responsabile della peluria pubica e ascellare.
DESCRIZIONE CLINICA DELLA PUBERTÀ NORMALE
Caratteri sessuali secondari e organi interni
Le diverse sequenze della comparsa dei caratteri sessuali secondari e di sviluppo degli organi genitali esterni sono state classificate in 5 stadi evolutivi da Tanner. Lo stadio 1 corrisponde all’aspetto infantile o prepubere e lo stadio 5 all’aspetto adulto (figura 3). La pubertà si completa in genere entro un periodo di circa 4 anni.

Figura 3: Sviluppo puberale secondo gli Stadi di Tanner
Nelle femmine il primo segno clinico di inizio della pubertà e attivazione dell’asse HPG è la comparsa del bottone mammario (telarca età media 9.7 anni), espressione dello sviluppo iniziale della ghiandola mammaria e stadio T2 (o B2) di Tanner. In questo stadio è fondamentale distinguere il tessuto adiposo dal tessuto ghiandolare con il tatto, soprattutto nelle bambine sovrappeso, dove la distinzione non è possibile con la semplice osservazione. Il telarca può essere asimmetrico e diventare bilaterale anche distanza di 3-12 mesi. Per la progressione da T3-5 e lo sviluppo completo del seno adulto l’osservazione rimane il solo metodo di stadiazione.
Il pubarca, la peluria pubica, in genere compare più tardi (età media 10.6 anni in Italia) (12), circa 12 mesi dopo il telarca, anche se in alcune ragazze tale sequenza può essere invertita: dallo stadio P1 (assenza di peluria pubica) si osserva una progressiva modificazione della consistenza e dell'estensione della peluria, fino allo stadio P5 adulto con tipica distribuzione triangolare con base orizzontale.
L’aumento degli steroidi surrenalici e ovarici è inoltre responsabile della comparsa di comedoni, acne, seborrea al cuoio capelluto, e dei peli ascellari e anali (verso i 12-13 anni).
Anche la vulva si modifica sotto l’effetto degli estrogeni, con crescita dell’imene e delle piccole labbra, ispessimento della mucosa, corneificazione dell'epitelio vaginale, comparsa di leucorrea vaginale fisiologica e riduzione del pH vaginale.
Si ha sviluppo dell’utero e delle ovaie, con aumento del numero di follicoli. Nel soggetto prepubere l’utero è a forma di goccia e il rapporto collo/corpo (diametro antero-posteriore) è 35 mm e compare la linea iperecogena centrale (linea endometriale). All’inizio della pubertà il volume ovarico è 1.3 cm3 e al menarca di circa 4 cm3.
Il menarca, la prima mestruazione, avviene a circa 2 anni dal telarca (media in Italia 12.47 anni)(12). I primi cicli, raramente ovulatori, sono spesso irregolari e si normalizzano in genere entro 12-18 mesi dal menarca (10).
La crescita puberale
La crescita puberale rappresenta approssimativamente il 15-20% dell’altezza adulta e precede la fusione definitiva delle cartilagini di accrescimento. Si ha un accelerazione della velocità di crescita, che passa da 5 cm all’anno nel periodo peri-puberale a 7-10 cm all’anno durante il picco di crescita puberale. Il guadagno di crescita durante la pubertà (ampiezza totale di crescita puberale), sommato alla statura raggiunta prima dell’inizio della pubertà corrisponde alla statura adulta. Si potrebbe concludere che prima inizia la pubertà più si perda in statura definitiva, ma in realtà, all’interno di normali tempi puberali, l’ampiezza del picco non è costante e varia in modo inversamente proporzionale ai tempi di inizio della pubertà. Nella femmina l’accelerazione staturale, in genere, precede la comparsa del telarca e il guadagno di crescita puberale è in media 25 cm con un residuo di circa 5-10 cm dopo il menarca.
Durante la pubertà anche cuore, polmoni e tiroide aumentano di dimensioni in valore assoluto e relativo (10-11).
Composizione corporea
Una stretta relazione lega le modificazioni della composizione corporea, intesa come rapporto massa grassa e massa magra, e la pubertà. Già negli anni '70 si è avanzata l’ipotesi di un “peso critico”, definito dai 47.5 kg, necessario per la comparsa del menarca e per la riproduzione. Infatti, il ciclo mestruale richiede un minimo di 22% di massa grassa nella composizione corporea. Ciò viene avvalorato dal fatto che un aumento ponderale nel periodo peri-puberale predispone ad uno sviluppo puberale anticipato, mentre l’esercizio fisico intenso e l’anoressia nervosa sono associati a ritardi puberali. L'incremento ponderale associato alla pubertà è in media di 5-8 kg e varia secondo le diverse etnie. La cinetica di tale accrescimento ponderale non è spiegata nella classificazione di Tanner: la massa magra aumenta progressivamente durante i diversi stadi di sviluppo, mentre la massa grassa aumenta soprattutto durante la seconda parte dello sviluppo, con una riduzione del dispendio energetico a riposo (4).
Picco di massa ossea puberale
La massa ossea subisce importanti modificazioni durante la pubertà. Regolare durante il corso dell’infanzia, la crescita ossea (lunghezza, spessore, contenuto minerale osseo) accelera in maniera significativa durante la pubertà, con il picco di crescita osseo, poi prosegue più lentamente fino a circa 30 anni. La fase di mineralizzazione massimale avviene 6-12 mesi dopo il picco di crescita staturale ed è proprio questo periodo a maggior rischio di fratture per l’adolescente. Durante questo periodo, il picco di mineralizzazione ossea dipende da molti fattori, quali gli estrogeni, l’apporto di calcio e vitamina D, l’attività fisica, l’ormone della crescita. La carenza di uno qualsiasi di questi fattori durante il periodo puberale può favorire l’insorgenza di osteoporosi in età adulta (2).
Trasformazioni psicologiche
Con grandi variazioni individuali, durante il periodo puberale si assiste all’esigenza di autonomia, alla maturazione rapida dell’intelligenza, del ragionamento e della capacità di astrazione. Con la pubertà inizia l’età delle grandi discussioni ideologiche e della ricerca di identificazione fuori dal contesto familiare. Tali reazioni sono normali e indispensabili, affinché l’adolescente possa affermare la propria autonomia e acquisire una propria personalità.
Range di pubertà in Italia
Si definisce normale range di inizio puberale l’età entro la quale il 95% della popolazione femminile passa dallo stadio 1 di Tanner allo stadio 2, compreso tra gli 8 e i 13 anni. Tuttavia, un recente studio sottolinea l’importanza delle differenze tra paesi ed etnie. Saper riconoscere le caratteristiche di un inizio ed evoluzione “normale” di pubertà nella proprie ragazze, è di fondamentale importanza per poter essere in grado di individuare le condizioni patologiche della pubertà. Un recente studio multicentrico italiano, effettuato su 3783 ragazze, ha evidenziato che la media del menarca nella popolazione italiana è 12.4 anni (intervallo di confidenza 95% = 12.34–12.46) con una lieve differenza tra nord Italia (12.44 anni, IC=12.38-12.49) e sud Italia (12.10 anni, IC=12-12.28), con un range che va dai 10 ai 15 anni (95%); inoltre le ragazze hanno il menarca a un'età leggermente più precoce rispetto alle loro madri (media 0.13 anni), confermando comunque la riduzione anche in Italia del "secular trend”. Le variabili correlate indipendentemente e significativamente all’età del menarca sono il luogo di nascita dei genitori, il body mass index, la numerosità della famiglia e l’età menarcale materna. Questo studio conferma inoltre che fattori nutrizionale e genetici, in italia, sono fortemente correlati ad un menarca precoce, mentre quelli socio-economici non sembrano giocare lo stesso ruolo di un tempo (12).
VALUTAZIONE DELLA PUBERTÀ NORMALE
Per valutare un adeguato inizio e sviluppo puberale sono di fondamentale importanza l’anamnesi, l’osservazione clinica, l’esame obiettivo, con particolare attenzione alla compilazione della curva di crescita e della stadiazione di Tanner. In alcuni casi può rendersi necessaria una valutazione della maturazione ossea, attraverso una Rx età ossea, o un'ecografia pelvica. Tuttavia, se l’età e la clinica depongono per un regolare avanzamento dello sviluppo puberale, non sono necessari accertamenti ematochimici o strumentali specifici.
VARIANTI FISIOLOGICHE DELLA PUBERTÀ
Telarca prematuro isolato (figura 4)
- Età: 80% casi prima dei 2 anni
- Assenza di peluria pubica e di avanzamento dell’età ossea
- Bassi livelli di estrogeni e utero pre-pubere all’ecografia
- Nessun trattamento
- Evoluzione verso la regressione spontanea (70%) o stabile fino alla pubertà
- Necessita comunque di costante osservazione clinica perché deve rimanere isolato.

Figura 4: Telarca prematuro benigno
Pubarca prematuro isolato
- Isolato o associato a pelosità ascellare o ad acne e ad una maturazione ossea moderatamente aumentata.
- Frequente nelle femmine di 6-7 anni (soprattutto se sovrappeso o con alterazioni neurologiche croniche).
- Aumento moderato degli androgeni surrenalici.
- Escludere, attraverso il dosaggio degli androgeni surrenalici, alterazioni della sintesi degli ormoni surrenalici ad insorgenza tardiva (blocco parziale da deficit di 21-idrossilasi) o tumore secernente androgeni.
- Evoluzione benigna, in genere la pubertà compare ad età normale o lievemente anticipata.
Pubertà anticipata
- Inizio puberale tra gli 8 e i 10 anni
- Spesso familiare, in anamnesi storia di anticipo puberale in uno dei 2 genitori
- Non incide sostanzialmente sulla statura definitiva
- In genere non necessita di alcun trattamento ma attenti controlli clinici della velocità evolutiva
BIBLIOGRAFIA
- Parent A, Teilmann G, Juul A, et al. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev 2003, 24: 668-93.
- Hartge P. Genetics of reproductive lifespan. Nat Genet 2009, 41: 637-8.
- Gosden RG, Feinberg AP. Genetics and Epigenetics- Nature’s Pen-and-Pencil Set. N Engl Med 2007, 356: 731-3.
- Kaplowitz PB. Link between body fat and the timing of puberty. Pediatrics 2008, 121 Suppl 3: S208-17.
- Ong KK, Elks CE, Li S, et al. Genetic variation in LIN28B is associated with the timing of puberty. Nat Genet 2009, 41: 729-33.
- Perry JR, Stolk L, Franceschini N, et al. Meta-analysis of genome-wide association data identifies two loci influencing age at menarche. Nat Genet 2009, 41: 648-50.
- Sulem P, Gudbjartsson DF, Rafnar T, et al. Genome-wide association study identifies sequence variants on 6q21 associated with age at menarche. Nat Genet 2009, 41: 734-8.
- Gajdos ZKZ, Henderson KD, Hirschhorn JN, et al. Genetic determinants of pubertal timing in the general population. Mol Cell Endocrinol 2010, 324: 21-9.
- Elks CE, Perry JR, Sulem P, et al. Thirty new loci for age at menarche identifiedby a meta-analysis of genome-wide association studies. Nat Genet 2010, 42: 1077-85.
- Susman EJ, Houts RM, Steinberg L, et al. Longitudinal development of secondary sexual characteristics in girls and boys between ages 9 and 15 years. Arch Pediatr Adolesc Med 2010, 164: 166-73.
- Gluckman PD, Hanson MA. Evolution, development and timing of puberty. Trends Endocrinol Metab 2006, 17: 7-12.
- Rigon F, Bianchin L, Bernasconi S, et al. Update on age at menarche in Italy toward the levelling off of the secular trend. J Adolesc Health 2010, 46: 238-44.
- Ojeda SR, et al. Minireview: the neuroendocrine regulation of puberty: is the time ripe for a systems biology approach? Endocrinology 2006, 147: 1166-74.
Valutazioni ormonali ovariche
Marco Caputo* e Salvatore Monti**
*Ospedale Classificato Villa Salus, Venezia Mestre
** UOC Endocrinologia, AO Sant’Andrea, Roma
(aggiornato al 23 maggio 2017)
Nella valutazione della funzionalità gonadica femminile, nessuna determinazione biochimica è in grado per se di sostituirsi a una minuziosa anamnesi e a un accurato esame obiettivo, sempre della massima importanza nell’inquadramento e nella definizione degli scenari clinici determinati da un'alterata fisiopatologia ovarica. Fatta questa premessa, essenziale per collocare nella giusta prospettiva le possibilità e i limiti degli esami di laboratorio oggi disponibili, passiamo a esaminare sommariamente i test di più frequente utilizzo.
Gonadotropine
Il dosaggio di LH e FSH (1) è oggi eseguito in modo accurato e riproducibile mediante dosaggi immunometrici automatizzati. I precedenti metodi, essenzialmente RIA, non avevano sensibilità e specificità adeguate a distinguere bassi livelli fisiologici da alterazioni funzionali. La natura pulsatile della secrezione gonadotropinica non è normalmente un problema nella routine clinica, in quanto i valori bassi restano tali e quelli elevati sono molto superiori all'intervallo di riferimento. Non esistono più rischi di cross-reattività, mentre potrebbero ancora esserci problemi legati alla calibrazione dei differenti metodi, che possono dare, ancora oggi, risultati diversi per lo stesso campione. È pertanto fondamentale che il laboratorio specifichi nella risposta il metodo utilizzato.
La valutazione delle gonadotropine è indicata nei casi di amenorrea (primaria e secondaria) e di grave oligomenorrea e dovrebbe essere sempre associata al dosaggio dell’estradiolo. A metà ciclo, i valori di LH aumentano da quattro a sei volte, mentre quelli di FSH aumentano da due a tre volte. L'aumento di metà ciclo dura mediamente due giorni.
| Alterazioni delle concentrazioni delle gonadotropine | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche |
ipopituitarismo |
ipogonadismo primario |
| Modificazioni farmaco-indotte | FSH: estrogeni, fenotiazine LH: steroidi sessuali, fenotiazine, digossina, propranololo |
FSH: L-DOPA, ketoconazolo LH: ketoconazolo |
Il rapporto LH/FSH è più affidabile del dosaggio dell’estradiolo nella valutazione dello stato puberale: un rapporto > 0.7 indica un’attivazione puberale. Sebbene in passato il rapporto LH/FSH sia stato utilizzato nella diagnosi di sindrome dell’ovaio policistico (PCOS), attualmente non è un criterio diagnostico della sindrome; può essere richiesta nei casi associati a disturbi mestruali per escludere l’insufficienza ovarica (3).
Un'applicazione “dinamica” del dosaggio di gonadotropine si ha con il test al GnRH agonista. La risposta dinamica delle gonadotropine è utile quando non è possibile trarre conclusioni diagnostiche dai valori basali, nella diagnosi della pubertà precoce e nei casi di amenorrea, non responsiva alla somministrazione di progesterone (MAP test negativo), per distinguere la forma ipotalamica da quella ipofisaria.
La gonadotropina corionica umana (hCG) è prodotta in modesta quantità da differenti tessuti, tra cui l'ipofisi, mentre la placenta la secerne abbondantemente (2). La maggior parte dei metodi utilizzati in laboratorio è standardizzata per misurare l'ormone placentare nel corso del monitoraggio biochimico di inizio gravidanza, nel corso della quale la concentrazione raddoppia ogni due giorni nelle prime 12 settimane.
Al di fuori della gravidanza, quantità elevate di hCG si ritrovano nella malattia trofoblastica e in tumori sia maschili che femminili. Anche se può essere prodotta in eccesso l'intera molecola, più spesso queste neoplasia producono solo catene ß libere. Tali dosaggi sono utili come marcatori precoci di possibile recidiva neoplastica. Un’applicazione recente del dosaggio è quella utilizzata nella rilevazione precoce del rischio di trisomie, tra cui la sindrome di Down, in cui l'esame, associato ad altri parametri (translucenza nucale, PAPP-A, alfafetoproteina) serve a stratificare il rischio di queste complicanze.
Prolattina
Il dosaggio di PRL viene effettuato oggi con metodi immunometrici automatizzati (1), specialmente in chemiluminescenza (ICMA). Il dosaggio deve essere eseguito in fase follicolare precoce, tra 3°-8° giorno del ciclo mestruale.
Un singolo dosaggio elevato non è dirimente, a causa dell’andamento pulsatile e circadiano della secrezione.
Le concentrazioni ematiche di PRL sono influenzate da una serie di fattori, farmacologici e non. È opportuno tenere conto di queste variabili pre-analitiche nel programmare il prelievo e nell'interpretare i risultati.
Il dosaggio trova impiego principale come test di prima linea nella diagnostica di amenorree soprattutto secondarie (3), oligomenorrea, galattorrea e anovulazione (indipendentemente dalle alterazioni del ciclo mestruale). L’iperprolattinemia va preferibilmente confermata con l’esecuzione di almeno tre prelievi multipli a distanza di 15-20', utilizzando un unico accesso venoso per i tre prelievi. Va esclusa anche la presenza della cosiddetta Macroprolattina, cioè un aggregato di PRL e autoanticorpi anti-PRL, e di forme dimeriche, che non hanno significato biologico ma possono dare risultati elevati al test immunometrico (4). Molti metodi oggi minimizzano l'impatto della macroprolattina sul dosaggio, ma in certi casi si rende indispensabile escludere la presenza di aggregati ripetendo la misura dopo precipitazione in PEG: se il recupero di PRL è > 60% rispetto al dosaggio originario, si esclude la presenza di macroaggregati.
Valori > 200 ng/mL sono in genere diagnostici per adenomi ipofisari, ma pazienti con microadenomi possono presentare valori molto più bassi. A tali livelli conviene valutare anche la funzionalità tiroidea, perchè spesso l'ipotiroidismo si associa ad aumento delle concentrazioni di PRL. Con l'avvento delle più sofisticate tecniche di diagnostica per immagini, i testi dinamici per la PRL -una volta discretamente utilizzati- hanno perso interesse per la pratica clinica corrente.
Attivine e inibine
Sono proteine che svolgono attività antagonistiche a livello ovarico.
Le attivine non hanno trovato impiego nella diagnostica clinica di laboratorio, anche se sono state proposte come possibili marcatori di pre-eclampsia e nella diagnostica delle endometriosi, ma per ora senza applicazioni pratiche (5).
L'inibina A e l'inibina B riflettono l'attività di varie popolazioni cellulari della granulosa, con andamenti differenziati e opposti nel corso del ciclo mestruale fisiologico. La misura dei livelli sierici di inibina B ha trovato applicazione come indicatore biochimico di neoplasia in certi tumori della granulosa, nella valutazione di complicanze gravidiche e in quella dell'invecchiamento riproduttivo, perchè bassi livelli in fase follicolare precoce sembrano essere in relazione con un declino della funzionalità ovarica.
Ormone anti-mulleriano (AMH)
È una glicoproteina omodimerica dal peso molecolare di 140 kDa, che appartiene alla superfamiglia TGF-ß. Nella donna, AMH è prodotto soprattutto dalle cellule della granulosa dei piccoli follicoli pre-antrali e antrali. Indosabile alla nascita, aumenta gradualmente dalla pubertà e resta sostanzialmente stabile per tutta la vita riproduttiva, cominciando a declinare dopo la terza decade.
Il suo utilizzo è riservato alla valutazione della riserva ovarica (6), anche se talvolta è impiegato anche per disturbi del reclutamento follicolare e in casi di ambiguità sessuale del neonato (AMH nel maschio molto più elevato che nella femmina) e per distinguere tra ipogonadismo e pubertà ritardata. Nella sindrome di Turner e nell'ipogonadismo ipogonadotropo i valori sierici sono molto bassi, mentre sono consistentemente aumentati nella sindrome dell'ovaio policistico (valori > 5 ng/mL suggestivi, in assenza di disponibilità di ecografia ovarica). È necessario avere cura di separare il siero, per evitare il decadimento della molecola a temperatura ambiente, che provoca dosaggi inaccurati.
Estradiolo (E2)
È l'estrogeno più importante e riveste evidentemente un ruolo nella diagnostica clinica routinaria dei disturbi della funzionalità ovarica. Anche E2 si dosa oggi con metodi immunometrici automatizzati, che sono accurati per concentrazioni relativamente elevate, mentre mancano di specificità per i bassi dosaggi riscontrati nell'uomo e in post-menopausa. Nel prossimo futuro si attendono significativi miglioramenti dal processo di standardizzazione che vede coinvolta la FDA (Food and Drug Administration), le aziende del settore diagnostico e le società scientifiche del settore (7). Particolare cautela va usata nelle pazienti trattate con inibitori dell'aromatasi, in quanto si possono ottenere valori falsamente elevati per interferenza con gli anticorpi. Il rischio di errate decisioni terapeutiche si minimizza effettuando il dosaggio con metodi più specifici e sensibili, quali la LC/Tandem, analogamente a quanto richiesto per il dosaggio del testosterone. I metodi diretti (senza estrazione) sono ormai di utilizzo generale. Ricordarsi che gli intervalli di riferimento sono metodo-specifici e possono pertanto essere significativamente differenti.
Valori bassi o indosabili, associati ad alti livelli di FSH e LH indicano un deficit ovarico, valori bassi o indosabili associati a bassi livelli di FSH e LH indicano un deficit ipotalamo-ipofisario. La valutazione di E2 può essere utile nella valutazione dello stato puberale; inoltre alcuni rari tumori ovarici, quelli a cellule del Sertoli, possono produrre estrogeni.
Progesterone
Anche il progesterone si dosa oggi con metodi immunometrici diretti e automatizzati, in modo affidabile e sicuro e senza le precauzioni ancora necessarie per l'estradiolo.
Le concentrazioni sieriche sono ridotte nella fase follicolare (< 1.5 ng/mL) e iniziano a elevarsi subito prima del picco di LH, per poi aumentare progressivamente fino a un massimo che di solito si registra una settimana dopo l'avvenuta ovulazione. Dopo la menopausa, i valori sono pressochè indosabili.
Il dosaggio sierico di progesterone a metà della fase luteinica è utile per la valutazione dello stato ovulatorio: valori > 7 ng/mL sono indice di ciclo ovulatorio. Negli studi di fertilità si associano altri parametri (temperatura basale, monitoraggio ecografico ovarico, biopsie endometriali temporizzate). Il dosaggio di progesterone può essere richiesto anche per diagnosticare l'avvenuta ovulazione dopo induzione: in questi casi si attendono valori > 15 ng/mL.
In gravidanza, il livello di progesterone correla con l'attività del corpo luteo e la funzione placentare. Bassi livelli tra la 6° e l'8° settimana devono far sospettare un’anomalia intra-uterina o una gravidanza ectopica.
Androgeni
Nella donna gli androgeni originano da tre fonti: ovaio, surrene e compartimento periferico. La maggior parte di queste molecole sono prodotte e/o metabolizzate in più di un compartimento e pertanto nella valutazione clinica delle donne con sospetto iperandrogenismo si preferisce dosare più di un solo androgeno. Una volta era molto frequente il ricorso al dosaggio urinario dei 17-chetosteroidi: il loro utilizzo nella pratica clinica è scomparso, perchè sono un prodotto soprattutto surrenalico, riflettono poca la produzione di testosterone e sono molto aspecifici. Oggi i test più utilizzati sono il testosterone totale (T) e il deidroepiandrosterone solfato (DHEAS), per valutare rispettivamente la funzione ovarica e surrenalica, con qualche limitazione: i due terzi del testosterone circolante derivano da conversione periferica di androstenedione, e pertanto si trovano livelli periferici aumentati in caso di iperproduzione di androstenedione sia ovarica che surrenalica; nel caso del DHEAS, si possono trovare livelli fisiologici anche in certi casi di iperproduzione surrenalica (per es., nel deficit di 21-idrossilasi), e livelli alti di DHEAS possono riscontrarsi anche nelle iperandrogenemie prevalentemente ovariche (come la PCOS).
Soprattutto in presenza di un quadro clinico sospetto per neoplasia androgeno-secernente (improvvisa insorgenza di irsutismo severo, a rapida evoluzione, associato a virilismo), le valutazioni del T totale e del DHEAS possono essere utili nella diagnosi di:
- neoplasia ovarica: T totale > 2 ng/mL e DHEAS < 3 μg/mL;
- neoplasia surrenalica: T totale > 2 ng/mL e DHEAS > 6 μg/mL.
Esistono ancora seri problemi nella misura del T totale nella donna con i metodi immunometrici diretti automatizzati. Anche se recentemente un grande sforzo congiunto per la standardizzazione dei metodi di dosaggio ha già prodotto significativi miglioramenti, la raccomandazione per dosare la concentrazione di T nelle donne e nei bambini (tra gli altri della Endocrine Society) è quella di utilizzare metodi in spettrometria di massa previa cromatografia (8,9). Il dosaggio di testosterone libero con metodi immunometrici è assolutamente da proscrivere, in quanto totalmente inaccurato. Ugualmente problematico è il ricorso ad algoritmi per il calcolo del cosiddetto testosterone biodisponibile (Indice di Androgeni Liberi, FAI):
FAI= [testosterone (nmol/L)/SHBG (nmol/L)] x 100
perchè all’inaccuratezza della misura di T si somma quella di SHBG, e il prodotto finale va preso con grande "beneficio di inventario" (10,11).
Altri androgeni (diidrotestosterone, androstenedione glicuronide) hanno un esclusivo interesse di ricerca e nessuna applicazione clinica, al momento.
Per quanto riguarda la misura dei precursori androgenici nella donna, il 17-OH progesterone serve nel sospetto di deficit di 21-idrossilasi, forma più frequente di deficit enzimatico della steroidogenesi. In questo caso, soprattutto nelle “forme non classiche”, è talvolta indispensabile ricorrere al test di stimolo con ACTH per una corretta diagnosi, specialmente nelle forme non classiche. Oggi l'approfondimento diagnostico dirimente lo fornisce la genetica, con lo studio delle mutazioni del gene CYP21β, soprattutto in presenza di storia familiare positiva.
Per concludere, in presenza di un iperandrogenismo biochimico, è sufficiente dosare solo 3 androgeni: testosterone totale, DHEAS (diagnosi esclusione neoplasia) e 17-OH-progesterone (per escludere difetti della 21-idrossilasi).
Altri dosaggi ormonali
TSH. Serve a escludere alterazioni della funzionalità tiroidea, che possono essere responsabili di disturbi del ciclo mestruale.
Cortisolemia. Nei casi di iperandrogenismi e di disturbi mestruali, soprattutto in presenza di manifestazioni fenotipiche caratteristiche dell’ipercortisolismo, deve essere esclusa la sindrome di Cushing. L’esame più accurato è il test di soppressione di Nugent.
Insulina e metabolismo glicidico. L'insulino-resistenza e il diabete hanno un ruolo accertato e importante in molti iperandrogenismi.
GH e IGF-1: nell'acromegalia si possono trovare alterazioni della funzione ovarica. In presenza di sospetto clinico fondato, il dosaggio di IGF-1 permette quasi sempre la diagnosi di esclusione di acromegalia. In alcuni casi selezionati può essere utile ricorrere alla valutazione della soppressione del livello ematico del GH dopo carico orale di glucosio (OGTT).
Bibliografia
- Wheeler MJ. Assays for LH, FSH and prolactin. Methods Mol Biol 2006, 324: 109-24.
- Cole LA. Biological functions of hCG and hCG-related molecules. Reprod Biol Endocrinol 2010, 8: 102.
- Practice Committee of the American Society for Reproductive Medicine. Current evaluation of amenorrhea. Fertil Steril 2006, 86: S148-55.
- Beltran L, Fahie-Wilson MN, McKenna TJ, et al. Serum total PRL and monomeric prolactin reference intervals determined by precipitation with PEG: evaluation and validation on common immunoassay platforms. Clin Chem 2008, 54: 1673-81.
- Reis FM, Luisi S, Abrao MS, et al. Diagnostic value of serum activin A and follistatin levels in women with peritoneal, ovarian and deep infiltrating endometriosis. Hum Reprod 2012, 27: 1445-50.
- Nelson SM. La Marca A. The journey from the old to the new AMH assay: how to avoid getting lost in the values. Reprod Biomed Online 2011, 23: 411-20.
- Stanczyk FZ, Lee JS, Santen RJ. Standardization of steroid hormone assays: why, how, and when? Cancer Epidemiol Biomarkers Prev 2007, 16: 1713-9.
- Stanczyk FZ, Clarke NJ. Advantages and challenges of mass spectrometry assays for steroid hormones. J Steroid Biochem Mol Biol 2010, 121: 491-5.
- Janse F, Eijkemans M, Goverde A, et al. Assessment of androgen concentration in women: liquid chromatography-tandem mass spectrometry and extraction RIA show comparable results. Eur J Endocrinol 2011, 165: 925-33.
- Azziz R, Carmina E, Dewailly D, et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril 2009, 91: 456-88.
- Rosner W, Auchus RJ, Azziz R, et al. Utility, limitations and pitfalls in measuring testosterone: an Endocrine Society Position Statement. J Clin Endocrinol Metab 2007, 92: 405-13.
Ecografia pelvica femminile
Ricciarda Raffaelli & Elena Lavarini
UO Ginecologia e Ostetricia, Policlinico GB Rossi, Università di Verona
(aggiornato al 14 aprile 2017)
La diagnostica ecografica, per il basso costo, la facile accessibilità e l'alta accettabilità, rappresenta un imprescindibile primo approccio alla paziente ginecologica. Nello studio della gonade femminile, in particolare, riveste grande utilità la capacità di tale metodica di definire le caratteristiche acustiche dei diversi tessuti, distinguendo le strutture solide dalle liquide. L'ovaio in età fertile è, infatti, un organo "fisiologicamente cistico" (fig 1A e 1B), costituito da tessuto solido al cui interno si sviluppano follicoli contenenti fluido; ogni deviazione dalla struttura normale può essere così facilmente investigata.

Figura 1A: Ovaio visualizzato per via trans-addominale

Figura 1B: Ovaio visualizzato per via trans-vaginale
La diagnostica per immagini assume un ruolo primario nella ginecologia pediatrica, poiché il contributo dell'esame obiettivo pelvico è assai limitato in questo gruppo di pazienti.
L'esame può essere espletato con approccio trans-addominale (fig 1A), nel quale utero e annessi sono visualizzati mediante una sonda a bassa frequenza (3.5-5.0 MHz), attraverso la vescica urinaria distesa che funziona da finestra transonica e sposta in alto le anse intestinali (fig 2), e con approccio trans-vaginale (fig 1B), dove invece una sonda ad alta frequenza (5.0-8.0 MHz) viene inserita in vagina permettendo una migliore risoluzione d'immagine (fig 3).

Figura 2: Sonda trans-addominale

Figura 3: Sonda trans-vaginale
L'esplorazione ecografica avviene in tempo reale; questo, insieme all'esperienza dell'operatore, permette di ottenere informazioni che vanno oltre le caratteristiche dell'immagine (consistenza della struttura, dolore alla pressione della sonda, mobilità degli organi, possibilità di modificare il reperto attraverso la palpazione addominale).
Un ulteriore ausilio diagnostico, inoltre, deriva dalla possibilità di valutare la vascolarizzazione della struttura attraverso l'utilizzo del Color-Doppler. Ciò è importante ai fini di caratterizzare le lesioni neoplastiche e distinguere le adiacenti strutture vascolari (fig 4A e 4B).

Figura 4A: Utilizzo del color-doppler per caratterizzare strutture vascolari adiacenti

Figura 4B: Utilizzo del color-doppler per valutare la vascolarizzazione del tessuto
Infine, l'introduzione della tecnologia 3D, il cui valore clinico non è stato ancora compiutamente inquadrato, permette l'acquisizione di dati durante una singola scansione e la loro successiva rielaborazione nelle tre dimensioni. In questo ambito tale metodica si è rivelata piuttosto accurata nella definizione dei volumi (masse, cisti, ecc) (1,2) (fig 5).

Figura 5: Ricostruzione tridimensionale della struttura ovarica (da 3)
L'esplorazione ecografica degli annessi valuta essenzialmente tre parametri.
1. Sede
L'ovaio è abitualmente localizzabile tra due reperi: l'utero e la vena iliaca esterna. Una vescica repleta, una gravidanza iniziale, un aumento volumetrico dell’utero o dell'ovaio stesso, potrebbero causarne la risalita nella pelvi, o lo scivolamento nel cavo del Douglas (fig 6).

Figura 6. Anatomia della pelvi femminile e reperi ovarici (da F. Netter - Atlante di Anatomia Umana)
2. Dimensioni
Durante il periodo neonatale il volume delle ovaie dipende dallo sviluppo follicolare, a sua volta correlato alla stimolazione ormonale materna: è rilevabile nel loro contesto un numero variabile di follicoli di 2-5 mm.
In epoca pre-pubere lo sviluppo delle ovaie precede quello dell’utero e la comparsa dei primi segni clinici di pubertà; il volume aumenta progressivamente e l’aspetto diventa ipoecogeno, disomogeneo per la presenza di una corona periferica di micro-follicoli < 5 mm (4)(fig 7).

Figura 7: Ovaio prepubere con micro-follicoli periferici
Con l'attività follicolare tipica della vita adulta le ovaie subiscono cicliche variazioni di volume e di aspetto; normalmente le misure si interpretano allo stato "basale", ovvero all'inizio del ciclo mestruale. L'età e la multiparità ne aumentano il volume, che tende poi a ridursi progressivamente dalla pre-menopausa in poi. È opportuno misurare l'ovaio nelle sue tre dimensioni; tuttavia, laddove non è opportuna una valutazione volumetrica, anche il solo asse maggiore può essere indicativo (valore normale 25-35 mm; limite superiore 40 mm).
3. Aspetto
All'inizio del ciclo il parenchima ovarico presenta una fine ecogenicità, interrotta da lacune follicolari anecogene di 2-5 mm. Progredendo lungo la fase follicolare, una di queste lacune aumenta di dimensioni, fino a raggiungere i 20-25 mm intorno al 14° giorno, con l'imminente ovulazione (fig 8).

Figura 8: Immagine trans-addominale di follicolo ovarico dominante
Dopo l'ovulazione, la parete del follicolo si ispessisce e la cavità centrale si riempie di contenuto ematico per formare il corpo luteo, ben riconoscibile anche per la vascolarizzazione ("ring of fire" al controllo color-doppler) (fig 9).

Figura 9: immagine eco-color-doppler della vascolarizzazione periferica di un corpo luteo
Una deviazione da tale percorso si esprime all'imaging come patologia micro-follicolare (fig 10) (sindrome dell'ovaio policistico, ovaie multi-follicolari da anovulazione ipotalamica funzionale) o macro-follicolare (fig 11)(cisti funzionali, sindrome da luteinizzazione del follicolo).

Figura 10: Immagine ecografica trans-vaginale di struttura ovarica micro-follicolare

Figura 11: Cisti ovarica funzionale a pareti sottili regolari e contenuto transonico
Invece, la presenza di una struttura che non appare fisiologica, in ragione della forma, dell'ecostruttura o della persistenza oltre tre cicli mestruali, deve essere approfondita per distinguere una lesione maligna da una formazione benigna (idro-salpinge, cisti peritoneali, ascessi, fibromi, endometriomi). A tale proposito possono essere indicative una serie di caratteristiche, quali la componente solida irregolare, la presenza di numerose strutture papillari, una importante vascolarizzazione e la dimensione. Tali aspetti sono stati raggruppati in vari “scoring system” per quantificare il rischio di malignità, ma la predittività maggiore si ottiene con il giudizio di un operatore esperto (“pattern recognition”) (5-7) (fig 12A, 12B, 12C).

Figura 12A: Aspetto ecografico atipico di Cisti Dermoide, in diagnosi differenziale con Cisti Endometriosica

Figura 12B: Nonostante la presenza di indici di malignità (papille), un ecografista esperto è in grado di riconoscere un Tumore Borderline dell'Ovaio

Figura 12C: La complessità della massa, con presenza di setti e aree solide, permette di riconoscere un Tumore Maligno dell'Ovaio
Per la valutazione ecografica nella policistosi ovarica vedi il capitolo specifico
Bibliografia
- Gibbs RS, Karlan BY, Haney AF, et al. Danforth's Obstetrics and Gynecology, 10° edizione, Lippincott Williams & Wilkins, 2008.
- Ardaens Y, Guerin du Masgenet B, Coquel P. Ecografia Pratica in Ginecologia, 4° edizione, Verduci Editore, 2007.
- Poujade O, et al. Surgical management of infertility due to polycystic ovarian syndrome after failure of medical management. Eur J Obst Gyn Repr Biol 2011, 158: 242-7
- Portuese A, Raffaelli R, Dorta M, et al. Imaging in paediatric gynaecology. In: Pediatric and adolescent gynecology. Elsevier 2003: 273-97.
- Testa AC, Bourne TH. Characterising pelvic masses using ultrasound. Best Pract Res Clin Obstetr Gynecol 2009, 23: 725-38.
- Timmerman D, Testa AC, et al. Simple ultrasound-based rules for the diagnosis of ovarian cancer. Ultrasound Obstet Gynecol 2008, 31: 681-90.
- Ameye L, Valentin L, Testa AC, et al. A scoring system to differentiate malignant from benign masses in specific ultrasound-based subgroups of adnexal tumors. Ultrasound Obstet Gynecol 2009, 33: 92-101.
Sindrome premestruale
Paola Bianchi
Dipartimento Salute della donna e medicina territoriale, Azienda Ospedaliera Sant'Andrea, Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
I Disordini Premestruali (PMD) racchiudono una vasta gamma di sintomi fisici e psicologici, di gravità variabile, di interesse sia ginecologico che psichiatrico, avvertiti dalle donne in età fertile durante la fase luteale del ciclo mestruale, che scompaiono con l’arrivo o durante la mestruazione. Sebbene i PMD siano configurati come entità nosologica dagli anni ’50, tanto da comparire nelle linee guida di riferimento più usate in ginecologia, del tutto recentemente sono stati elaborati dei criteri diagnostici condivisi da una conferenza di Consenso dalla Società Internazionale per i Disordini Premestruali (ISPMD) (1). I PMD identificano una condizione clinica che può essere fortemente invalidante, sia per le donne che per le loro famiglie, e che ha un impatto sociale notevole in termini di assenza dal lavoro o dalla scuola.
La reale prevalenza della malattia, in assenza fino ad ora di criteri nosologici omogenei, è sostanzialmente sconosciuta; inoltre, la maggior parte dei lavori scientifici presenti in letteratura è basata su raccolte di dati retrospettivi che, per loro stessa natura, possono comportare alcuni errori nel ricordo dei sintomi. I dati riportati dai pochi studi epidemiologici prospettici indicano che circa il 5-8% delle donne riportano sintomi da moderati a severi. La maggior parte delle donne lamenta alcuni blandi sintomi nel periodo pre-mestruale (80-95%), considerati fisiologici più che patologici. Poco meno della metà riferisce una vera e propria Sindrome Premestruale (PMS) (30-40%) e soltanto una piccola percentuale (3-8%) rientra nella forma più grave, i Disordini Disforici Premestruali (PMDD), di pertinenza squisitamente psichiatrica (1). E’ chiaro che l’attività ovarica e probabilmente l’ovulazione sono condizioni indispensabili per il manifestarsi dei PMD: non esistono prima della pubertà ed in gravidanza, regrediscono completamente con la menopausa sia fisiologica che chirurgica. L’eziologia è a tutt’oggi sconosciuta, sebbene si ritenga essere correlata più ad una diversa sensibilità individuale ai metaboliti del progesterone, che non ad una sua anormale concentrazione.
La diagnosi prevede l’annotazione quotidiana su un diario dei sintomi comparsi in fase luteale, registrati per almeno due cicli consecutivi, che scompaiano con la fine della mestruazione, siano seguiti da un intervallo libero da sintomi e l’esclusione dell’esacerbarsi di patologie croniche di base che possano confondere l’interpretazione. Non sono indicati sintomi specifici tra gli oltre 200 previsti, ma alcuni sono considerati sintomi-chiave.
Durante la prima visita va raccolta un'accurata anamnesi, volta ad escludere la presenza di patologie di base mediche o psichiatriche, che possano peggiorare in fase luteale, come sindrome depressiva, attacchi di panico, ipotiroidismo, sindrome del colon irritabile, cistite interstiziale, endometriosi, dolore pelvico cronico, LES, disturbi dell’alimentazione, uso abituale di farmaci, abuso di droghe o alcool. Sono a disposizione alcuni questionari strutturati da somministrare per l’annotazione prospettica dei sintomi da parte delle pazienti: alcuni sono scomodi e limitati dalle considerazioni soggettive delle pazienti. Il più in uso è il DRSP (Daily Record of Severity of Problems) (2). La precedente classificazione del 2007 ad opera del Royal College of Obstetricians and Gynecologist (RCOG) (3), che divideva i PMD in Sindrome Premestruale (PMS) lieve, moderata e severa a seconda dell’impatto dei sintomi sulla vita quotidiana, esacerbazione premestruale di patologie preesistenti con incompleta risoluzione dei sintomi al finire della mestruazione e Disordini Disforici Premestruali (PMDD), è stata sostituita dalla nuova classificazione elaborata dalla conferenza di consenso pubblicata nel 2011, che ha proposto di suddividere i PMD in due grandi categorie: i PMD puri e le varianti dei PMD, quando siano presenti sintomi più complessi.
Criteri diagnostici per i disturbi premestruali “puri”:
- peggiorano con l’ovulazione;
- non esistono sintomi specifici, ma alcuni sono tipici della sindrome;
- può essere presente un numero variabile di sintomi;
- sono importanti sia segni fisici che psichici;
- i sintomi si ripresentano in fase luteale;
- i sintomi scompaiono con il finire del flusso mestruale;
- deve essere presente una settimana libera da sintomi tra la mestruazione e l’ovulazione;
- i sintomi devono essere annotati prospetticamente e non essere un racconto retrospettivo;
- i sintomi non devono rappresentare un'esacerbazione di una patologia sottostante fisica o psichiatrica;
- i sintomi devono causare una “disabilità” sostanziale.
Sintomi fisici:
- dolore articolare, muscolare o di schiena;
- tensione mammaria o mastodinia;
- sensazione di gonfiore addominale;
- emicrania o cefalea;
- aumento di peso;
- sensazione di gonfiore alle estremità (mani, piedi o entrambe).
Sintomi psicologici e comportamentali:
- modificazioni del senso della fame, bulimia, desiderio spasmodico di alcuni cibi;
- fatica, letargia o mancanza di energia;
- cambiamenti di umore (tristezza improvvisa con desiderio di piangere o aumentata predisposizione al rifiuto);
- irritabilità;
- rabbia;
- disturbi del sonno;
- irrequietezza;
- difficoltà di concentrazione;
- asocialità;
- sentirsi fuori controllo;
- mancanza di interesse nello svolgimento delle pratiche abituali;
- solitudine;
- ansia;
- depressione;
- confusione;
- tensione;
- disperazione.
| CARATTERISTICHE PMD "puro" |
| I sintomi ricorrono in cicli ovulatori I sintomi possono essere sia fisici che psicologici Il numero dei sintomi non è specificato I sintomi sono assenti dopo la mestruazione e prima dell’ovulazione Devono essere ricorrenti in fase luteale Devono essere raccolti con modalità prospettica almeno in due cicli I sintomi devono causare una temporanea “disabilità” importanti |
| CARATTERISTICHE PMD varianti | |
| Esacerbazione premestruale | Sintomi di una patologia fisica o psicologica di base, che peggiorano in fase premestruale |
| PMD causati da attività ovarica non ovulatoria |
Sintomi che insorgono in seguito all’attività ovarica, che comunque non culmina nell’ovulazione |
| PMD indotti da progestinici | I sintomi insorgono in seguito a somministrazione esogena di steroidi (terapia ormonale sostitutiva, contraccezione estro-progestinica). E’ una forma iatrogena ed il Progestinico somministrato introduce ex-novo o reinduce i sintomi tipici. |
| PMD in assenza di mestruazione | Sintomi che compaiono in assenza di flusso mestruale (isterectomia con conservazione degli annessi, IUS medicato al Levonorgestrel, ablazione endometriale) |
La definizione del RCOG di PMS combacia perfettamente con i criteri classificativi di PMD “puro”.
TERAPIA
Interventi non farmacologici
Una volta posta la diagnosi, in caso di sintomatologia lieve o moderata, si dovrebbe tentare un approccio non farmacologico, soprattutto in età adolescenziale, volto a modificare lo stile di vita introducendo tecniche di rilassamento, regolare esercizio aerobico (almeno 20-30 minuti per 3 volte a settimana), riduzione dell’assunzione di alcool e caffeina. Può essere utile la supplementazione con integratori alimentari a base di vitamina B6, agnocasto, magnesio, calcio carbonato, isoflavoni, ginko biloba (3-4). In caso di sintomatologia severa, deve essere presa in considerazione la terapia cognitivo-comportamentale, che in uno studio comparativo con la fluoxetina ha mostrato un effetto più duraturo nel tempo (5).
Interventi farmacologici
Diuretici. La somministrazione di Spironolattone, alla dose di 100 mg/die in fase luteale, riduce i sintomi legati all’umore, alla sensazione di gonfiore e la mastodinia (6).
Inibitori selettivi della ricaptazione della serotonina (SSRI). Gli SSRI (fluoxetina, paroxetina, citalopram, sertralina) si sono dimostrati efficaci nel ridurre i sintomi sia fisici che psichici, se somministrati in continuo o nei 14 giorni precedenti la comparsa del flusso mestruale, in genere a dosi inferiori rispetto a quelle utilizzate nella terapia dei disturbi dell’umore. Gli effetti collaterali sembrano minori con la terapia intermittente. Sono possibili effetti negativi sulla libido (7).
Terapie ormonali. La somministrazione di solo progesterone è inappropriata nel trattamento dei DPM. Il suo uso dovrebbe essere limitato a controbilanciare l’eventuale effetto della somministrazione di estrogeni sull’endometrio (8).
Soppressione dell’ovulazione. Può essere ottenuta con la somministrazione di estro-progestinici, danazolo, analoghi del GnRH o, infine, con la rimozione chirurgica delle ovaie.
Estro-progestinici. Se è necessaria la contraccezione, rappresentano i farmaci più indicati, da somministrare con modalità classica intermittente o, più modernamente, con schema continuo (9). Una recente revisione Cochrane non ha evidenziato un effetto migliore dei contraccettivi orali contenenti drospirenone rispetto agli altri nel trattamento dei DPM (10).
Danazolo e analoghi del GnRH. Pur rappresentando sul piano teorico un'opzione terapeutica, non vengono utilizzati nella pratica clinica per gli effetti androgenici correlati al primo ed i costi e gli effetti da carenza estrogenica dei secondi. Nel caso di utilizzo di GnRH analoghi, per ovviare agli effetti derivanti dall’ipoestrogenismo, si può comunque ricorrere ad una supplementazione estrogenica secondo lo schema “add-back”.
Trattamento chirurgico
La castrazione chirurgica rappresenta l’ultimo e mai utilizzato, almeno in Italia, strumento terapeutico a cui ricorrere in presenza di PMD di severa entità (opinione personale).
Bibliografia
- O’Brien PMS, Backstrom T, Brown C, et al. Towards a consensus on diagnostic criteria, measurement and trial design of the premenstrual disorders: the ISPMD Montreal consensus. Arch Womens Ment Health 2011, 14: 13-21.
- Endicott J, Nee J, Harrison W. Daily Record of Severity of Problems (DRSP): reliability and validity. Arch Womens Ment Health 2006, 9: 41-9.
- Royal College of Obstetricians and Gynecologist. Premenstrual Syndrome. Management. Green-top guideline 48. RCOG Press, 2007.
- Rapkin AJ, Mikacich A. Premestrual Syndrome and premenstrual dysphoric disorder in adolescents. Curr Opin Obstetr Gynecol 2008, 20: 455-63.
- Hunter MS, Ussher JM, Cariss M, et al. Medical (fluoxetine) and psychological (cognitive-behavioural therapy) treatment for premenstrual dysforic disorder. A study of treatment processes. J Psychosom Res 2002, 53: 811-7.
- Wang M, Hammarback S, Lindhe BA, et al. Treatment of premenstrual syndrome by spironolactone: a double-blind, placebo controlled study. Acta Obstet Gynecol Scand 1995, 74: 803-8.
- Brown J, O’ Brien PM, Marjoribanks J, et al. Selective serotonin reuptake inhibitors for premenstrual syndrome. Cochrane Database Syst Rev 2009, Apr 15 (2): CD001396.
- Ford O, Lethaby A, Roberts H, et al. Progesterone for premenstrual syndrome. Cochrane Database Syst Rev 2009 Apr 15 (2): CD003415.
- Freeman EW, Halbreich U, Grubb GS, et al. An overview of four studies of a continuous oral contraceptive (levonorgestrel 90 mcg/ethinyl estradiol 20 mcg) on premenstrual dysphoric disorder and premenstrual syndrome. Contraception 2012, 85: 437-45.
- Lopez LM, Kaptein AA, Helmerhorst FM. Oral contraceptives containing drospirenone for premenstrual syndrome. Cochrane Database Syst Rev 2012 Feb 15; 2:CD006586.
Dismenorrea
Paola Bianchi
Dipartimento Salute della donna e medicina territoriale, Azienda Ospedaliera Sant'Andrea, Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
La dismenorrea, come i PMD, rappresenta una condizione molto frequente, a volte invalidante, con un forte impatto socio-economico in termini di assenza dal lavoro o dall’attività scolastica. E’ definita come dolore in concomitanza con il flusso mestruale, localizzato ai quadranti inferiori dell’addome, con possibili irradiazione in regione lombare e alle cosce, a volte accompagnato da cefalea, nausea, vomito, diarrea e fatigue. La durata della sintomatologia dolorosa va in genere dalle 48 alle 72 ore.
Classicamente viene suddivisa in dismenorrea primitiva, ad insorgenza entro 12 mesi dal menarca e quando non sia identificabile una causa organica responsabile della sintomatologia, e dismenorrea secondaria, in genere ad insorgenza più tardiva, laddove sia possibile diagnosticare una patologia organica pelvica.
| Cause di dismenorrea secondaria | |
| Endometriosi Adenomiosi Fibromi uterini Polipi endometriali Stenosi del canale cervicale Patologie malformative ostruttive del tratto genitale Sindrome di Allen-Master Cisti ovariche |
| Altre cause associate a dismenorrea | |
| Malattia infiammatoria pelvica Aderenze Sindrome del colon irritabile Malattia infiammatoria intestinale Cistite interstiziale Gravidanza ectopica o aborto spontaneo non diagnosticati |
La prevalenza, anche in questo caso difficilmente valutabile a causa della natura assolutamente soggettiva dei sintomi e dalla carenza di criteri diagnostici codificati, varia dal 17 all’81% (1).
L’eziologia della dismenorrea primitiva è ancora oggi argomento di discussione: alla base potrebbe esserci un’eccessiva o incontrollata quantità di prostanoidi rilasciata dall’endometrio durante la mestruazione, che causa un'ipercontrattilità dell’utero, con alterazioni del flusso sanguigno locale. Anche l’ormone vasopressina potrebbe essere coinvolto, ma il suo ruolo rimane controverso (2). Nelle adolescenti che presentino dismenorrea nei primi sei mesi dal menarca, deve essere presa in considerazione la diagnosi di patologia malformativa ostruttiva del tratto genitale. In questi casi è necessaria un'ispezione dei genitali esterni, ma si soprassiede all’esecuzione del classico esame obiettivo ginecologico e si ricorre agli esami strumentali: ecografia pelvica e, in caso di positività, RMN.
La diagnosi di dismenorrea secondaria è più probabile se i sintomi compaiono dopo anni di flussi mestruali non dolorosi (3). Il dosaggio del marcatore Ca125 ha limitato valore clinico, a causa del valore predittivo negativo relativamente basso.
La diagnostica ambulatoriale prevede l’esecuzione dell’ecografia pelvica con sonda vaginale. La laparoscopia rappresenta la singola procedura con il più alto valore diagnostico, perché in grado di fornire una visualizzazione diretta della pelvi e di consentire la diagnosi in caso di forte sospetto di endometriosi, sindrome aderenziale, malattia infiammatoria pelvica.
Interventi non farmacologici
Anche in questo caso, come nei PMD, si dovrebbero proporre degli interventi non farmacologici di primo livello, che comprendano modifiche dello stile di vita, sebbene il ricorso all’esercizio fisico, evidentemente non gravato da effetti collaterali, non si sia dimostrato efficace tanto da raccomandarne l’uso (4). Anche per il ricorso all’agopuntura non esistono a tutt’oggi dati sufficienti (5).
Terapie farmacologiche
Anti-infiammatori non steroidei (FANS). I FANS sono molto efficaci nel ridurre i sintomi della dismenorrea, ma le pazienti dovrebbero essere informate sui possibili effetti collaterali legati all’uso di questa categoria di farmaci. Non ci sono dati sufficienti per dimostrare la superiorità di una molecola rispetto alle altre, tutte comunque più efficaci del paracetamolo (6). Lo schema più efficace prevede l’assunzione del farmaco subito prima della comparsa del flusso mestruale o comunque precocemente. Possono essere associati, se necessario, alla contraccezione ormonale.
Contraccezione ormonale. I contraccettivi ormonali rappresentano in genere i farmaci di prima scelta nelle donne che abbiano bisogno di contraccezione. Le formulazioni estro-progestiniche possono essere somministrate classicamente in maniera ciclica o con modalità continua, in modo da ridurre il numero di episodi di sanguinamento. Le donne dovrebbero essere sempre informate di questo gradito beneficio non contraccettivo durante un counseling per la contraccezione. Tuttavia, sebbene gli estro-progestinici siano universalmente considerati un trattamento standard, sono pochi i dati derivanti da studi randomizzati, controllati a supporto del loro uso (7-10). Non sembrerebbero esistere differenze tra le varie formulazioni o vie di somministrazione. Il sistema intrauterino medicato al Levonorgestrel (LNG-IUS) è anch’esso associato ad una significativa riduzione della sintomatologia dolorosa (11).
Dismenorrea secondaria
Si rende necessaria la terapia della patologia organica identificata (per esempio endometriosi), con il ricorso a terapie mediche o chirurgiche da valutare caso per caso.
Bibliografia
- Latthe P, Latthe M, Say L, et al. WHO systematic review of prevalence of chronic pelvic pain: a neglected reproductive health morbidity. BMC Public Health 2006, 6: 177.
- Dawood MY, Khan-Dawood FS. Differential suppression of menstrual fluid prostaglandin F2a, prostaglandin E2, 6-keto prostaglandin F1a and thromboxane B2 by suprofen in women with primary dysmenorrhea. Prostaglandins Other Lipid Mediat 2007, 83: 146-53.
- Lefebvre G, Pinsonneault O, et al; SOGC. Primary dysmenorrhea consensus guideline. J Obstet Gynaecol Can 2005, 27: 1117-46.
- Brown J, Brown S. Exercise for dysmenorrhoea. Cochrane Database Syst Rev 2010 Feb 17 (2): CD004142.
- Smith CA, Zhu X, He L, et al. Acupuncture for primary dysmenorrhea. Cochrane Database Syst Rev 2011 Jan 19 (1): CD007854.
- Marjoribanks J, Proctor M, Farquhar C, et al. Nonsteroidal anti-inflammatory drugs for dysmenorrhea. Cochrane Database Syst Rev 2010 Jan 20 (1): CD001751.
- Wong CL, Farquhar C, Roberts H, et al. Oral contraceptive pill for primary dysmenorrhoea. Cochrane Database Syst Rev 2009 Oct 7 (4): CD002120.
- Zahradnik HP, Hanjalic-Beck A, Groth K. Nonsteroidal anti-inflammatory drugs and hormonal contraceptives for pain relief from dysmenorrhea: a review. Contraception 2010, 81: 185-96.
- Lindh I, Andersson Ellstrom A, Milsom I. The effect of combined oral contraceptives and age on dysmenorrhea: an epidemiologic study. Hum Reprod 2012, 27: 676-82.
- Harada T, Momoeda M, Terakawa N, et al. Evaluation of a low-dose oral contraceptive pill for primary dysmenorrhea: a placebo-controlled, double-blind, randomized trial. Fertil Steril 2011, 95: 1928-31.
- Heikinheimo O, Gemzell-Danielsson K. Emerging indications for the levonorgestrel-releasing intrauterine system (LNG-IUS). Acta Obstet Gynecol Scand 2012, 91: 3-9.
Clinica e diagnostica della menopausa
Agostino Paoletta1 & Simona Ambroggio2
1Endocrinologia ULSS 6 Euganea, Cittadella (PD)
2Ginecologia Endocrinologica, Torino
(aggiornato al 25 febbraio 2018)
Definizioni
La menopausa può essere comunemente definita come la cessazione definitiva del periodo mestruale dopo almeno 1 anno di amenorrea, avendone escluso qualsiasi altra causa fisiologica o patologica.
La menopausa segna la fine della vita riproduttiva naturale femminile. Avviene in media a 50-51 anni. Si definisce precoce quando insorge prima dei 40 anni; può invece essere definita iatrogena quando insorge in seguito a chemioterapie anti-blastiche, radioterapia o asportazione chirurgica degli annessi (1).
- Menopausa: cessazione del ciclo mestruale da almeno 12 mesi consecutivi, indipendentemente da altre cause patologiche.
- Peri-menopausa: periodo intorno alla menopausa, da 2-10 anni prima fino a 12 mesi dopo la cessazione del ciclo.
- Transizione menopausale: caratterizzata da modificazioni del ciclo (lunghezza) e dell’assetto endocrino (aumento dei livelli di FSH); termina con la cessazione delle mestruazioni.
- Post-menopausa: periodo che inizia dalla fine delle mestruazioni.
Fisiopatologia
La transizione menopausale è un momento di forte instabilità ormonale. Durante la peri-menopausa gli intervalli tra una mestruazione e l’altra si riducono in maniera significativa, per la minore durata della fase follicolare. In risposta al calo degli estrogeni ovarici, la produzione di gonadotropine aumenta, a causa del ridotto feed-back inibitorio a livello ipotalamo-ipofisario. Inizialmente, l’aumento riguarda prevalentemente l’FSH, i cui livelli circolanti si innalzano più precocemente rispetto a quelli dell’LH. Ciò è dovuto alla riduzione della produzione di inibina, causata a sua volta dal ridotto numero di follicoli ovarici. L’aumento isolato della produzione di FSH causa, di frequente, nella fase iniziale della transizione menopausale un accorciamento dei cicli ovulatori, con un aumento della produzione di estradiolo e di metaboliti estrogenici. Con il progressivo calo della riserva follicolare, i cicli divengono progressivamente più irregolari e più frequentemente anovulatori, fino alla comparsa di periodi più o meno prolungati di amenorrea, caratterizzati da elevati livelli circolanti di gonadotropine, intervallati da occasionali rialzi dei livelli di estradiolo e ancor meno frequenti picchi di produzione di progesterone (in occasione di eventi ovulatori). Con l’esordio dell’amenorrea in menopausa i livelli di gonadotropine saranno perciò elevati (FSH > 40-60 mUI/mL, LH > 30-50 mUI/mL) (2).
La mancanza del tono estrogenico causa un’alterazione del tono dopaminergico a livello ipotalamico. La dopamina svolge importanti effetti di modulazione a livello centrale su varie strutture, in particolare proprio a livello ipotalamico: esercita un tono inibitorio sul rilascio del GnRH e questo tono viene meno con la menopausa spontanea o l’ovariectomia e si ripristina in modo adeguato con la terapia ormonale sostitutiva. L’insorgenza della menopausa determina anche una riduzione del tono serotoninergico, con conseguente decadimento dei controlli centrali svolti da questo neurotrasmettitore.
I cambiamenti endocrini, che sono alla base della transizione, sono prevalentemente conseguenza di una marcata diminuzione del numero dei follicoli ovarici (3-5). I più significativi cambiamenti includono una riduzione nei primi giorni del ciclo di inibina B e dei livelli di ormone anti-mulleriano (AMH). L’AMH è una proteina dimerica prodotta dalla granulosa dei follicoli pre-antrali e dai piccoli (2-4 mm) follicoli antrali in crescita e rappresenta la quantità del pool follicolare, essendo prodotto per il 60% della sua quota circolante da follicoli di 5-8 mm, per il 20-25% da follicoli di 2-5 mm, e solo per il 15-20% da follicoli > 8 mm, pertanto le sue concentrazioni sieriche si riducono con l’aumento dell’età. L’AMH presenta variabilità individuale dovuta all’eventuale utilizzo di contraccettivi orali, all’etnia, al fumo, al BMI (6). L’AMH è sostanzialmente stabile nell’arco del ciclo mestruale, anche se raggiunge valori più bassi in fase post-ovulatoria; tuttavia, in età avanzata la fluttuazione dei livelli di AMH durante le varie fasi del ciclo mestruale è molto bassa (7). L’AMH è stato introdotto nella pratica clinica come nuovo marcatore di riserva ovarica. È relativamente recente il suo uso come strumento di screening, ma presenta alcuni vantaggi nella diagnosi della menopausa. Innanzitutto, sembra che quest’ormone sia il primo marcatore a cambiare in seguito all’avanzare dell’età, seguito dall’FSH, mentre l’estradiolo declina tardivamente (8); inoltre, i livelli plasmatici di AMH correlano con la conta dei follicoli antrali (AFC) e la loro valutazione è interscambiabile; pertanto AMH pare essere in grado di identificare la diminuzione della funzione ovarica prima delle tecniche tradizionali.
Sintomi della menopausa
Irregolarità mestruali: sperimentate da circa il 90% delle donne prima della menopausa, durano dai 4 agli 8 anni.
Sintomi a breve termine: così definiti poiché tendono a comparire in prossimità della completa cessazione della produzione estrogenica ovarica. Comprendono i sintomi vasomotori (vampate di calore, sudorazioni notturne), tipici della carenza estrogenica, e i disturbi del sonno ad essi conseguenti. Si stima che fino all’85% delle donne soffrano di sintomi vasomotori, il 15% in modo severo. I fattori scatenanti possono essere: caldo, stress, cibi o bevande caldi e/o piccanti, alcool, caffeina.
Sintomi a medio termine: con il passare degli anni possono peggiorare, a differenza dei sintomi vasomotori, che possono ridursi sino a scomparire. Comprendono i disturbi del trofismo uro-genitale (irritazione vaginale, secchezza e dispareunia conseguenti all’atrofia della mucosa vaginale, prurito e irritazione vulvare; disturbi della minzione conseguenti all’atrofia della mucosa uretrale), che interferiscono con la funzione sessuale, al cui declino può inoltre contribuire in varia misura la riduzione della libido legata alla riduzione del testosterone.
Altri sintomi non esclusivamente riconducibili alla carenza estrogenica: cefalea, irritabilità, disturbi dell’umore (ansia e depressione), senso di affaticamento, ridotta capacità di concentrazione, diminuzione della memoria, insonnia, dolori articolari, tensione mammaria.
- Cambiamenti d’umore, irritabilità, senso di affaticamento e mancanza di concentrazione possono essere conseguenti alla deprivazione di sonno, dovuta alle vampate e alle fastidiose sudorazioni notturne.
- L’insonnia può dipendere anche da cause organiche, che interferiscono con una buona respirazione (fino all’apnea notturna), che vanno quindi indagate e trattate.
| Sintomi della menopausa | |
| Irregolarità mestruali | |
| Sintomi a breve termine | Sintomi vasomotori |
| Disturbi del sonno | |
| Sintomi a medio termine | Disturbi del trofismo uro-genitale |
| Altri sintomi | Cefalea Irritabilità Disturbi dell’umore (ansia e depressione) Senso di affaticamento Ridotta capacità di concentrazione Disturbi relazionali (ansietà sociale) Diminuzione della memoria Insonnia Dolori articolari Tensione mammaria Secchezza oculare |
La maggior parte degli studi epidemiologici ha evidenziato che solamente i sintomi vasomotori e l’atrofia vaginale aumentano in modo significativo nella fase della transizione post-menopausale, suggerendo per gli altri sintomi l’importanza di variabili distinte dalla carenza estrogenica. È emerso da diversi studi epidemiologici come la varietà e la gravità dei sintomi siano influenzati sia da fattori psico-sociali che dallo stile di vita (9). La salute e la qualità di vita (QOL) della donna in menopausa e post-menopausa rappresentano quindi un tema molto importante, perchè in questa fase della vita, oltre alle patologie legate all’incremento dell’età e agli effetti della deprivazione ormonale, s’inseriscono alcuni importanti fattori psico-sociali e relazionali. Inoltre, il prolungamento della vita media della donna ha largamente ampliato il periodo della menopausa nei Paesi industrializzati (l’OMS calcola che, nei prossimi 30 anni, il numero di donne in menopausa potrebbe più che raddoppiare). Tutto ciò comporterà una possibile maggiore incidenza di patologie direttamente o indirettamente correlate alla menopausa e quindi la necessità di prendere in considerazione la possibilità di una terapia ormonale sostitutiva.
Vampate di calore. Rappresentano sicuramente il disturbo più comune della peri- e post-menopausa: si riscontrano in circa il 70% delle donne in menopausa fisiologica e nella quasi totalità delle donne in menopausa chirurgica. Si è osservato che la presenza di vampate di calore si può manifestare anche dopo 10 anni dall’inizio della menopausa, in maniera frequente in circa il 3% delle donne. Per molte donne i sintomi vasomotori sono lievi, ma in una rilevante percentuale sono abbastanza gravi da interferire con la QOL (vampate moderato-severe anche dopo 15 anni in circa il 12% delle donne in menopausa). La comparsa delle vampate di calore può essere influenzata da fattori di rischio:
- fattori modificabili che aumentano il rischio: fumo di sigaretta, BMI > 30 kg/m2 e mancanza di esercizio fisico, abuso di the/caffé;
- fattori non modificabili: anamnesi materna positiva, menopausa precoce, menopausa chirurgica, chemioterapia, radioterapia.
Circa il 65% delle donne in menopausa e con una storia di cancro della mammella presenta vampate di calore; inoltre, la terapia adiuvante con tamoxifene con o senza chemioterapia è quasi sempre associata a un peggioramento sostanziale dei sintomi correlati alla menopausa.
In menopausa è importante escludere altre cause che potrebbero provocare le vampate di calore: ipertiroidismo, feocromocitoma, carcinoide, diabete, epilessia, insulinomi, infezioni, leucemie, disordini autoimmuni, tumori del pancreas, attacchi di panico e farmaci come anti-estrogeni o modulatori selettivi dei recettori estrogenici.
Depressione. Le donne maggiormente a rischio sono quelle nelle quali la sintomatologia depressiva si manifesta già durante la transizione menopausale o quelle che presentano una storia clinica già nota di depressione. A maggior rischio sono anche le donne con storia di menopausa chirurgica o con alterazioni del tono dell’umore in occasione delle fisiologiche fluttuazioni dei livelli ormonali durante il ciclo mestruale (sindrome premestruale) e nel post-partum, quelle con patologia tiroidea o con fattori socio-ambientali sfavorevoli.
Sessualità. La transizione menopausale può associarsi a modificazioni della sfera sessuale, in particolare a un calo della libido, che rappresenta la causa principale di disfunzione sessuale della donna in epoca post-menopausale. L’atrofia della mucosa vaginale è frequentemente causa di dispareunia. Per quanto riguarda la sessualità, nella paziente in post-menopausa l’intervento nei confronti del sintomo dispareunia deve essere effettuato quanto più possibile precocemente, per evitare l’innescarsi di un circolo vizioso, in cui la dispareunia potrebbe condurre ad una riduzione della soddisfazione, con conseguente ulteriore calo della libido.
Diagnosi
In post-menopausa, i livelli di FSH risultano notevolmente aumentati, i livelli di E2 sono bassi, mentre inibina B e AMH sono indosabili. La diagnosi di menopausa, per definizione, può essere posta quindi solo a posteriori e si basa sulla valutazione clinica, l’età e la sintomatologia della donna (10,11).
Bibliografia
- Santoro N, Brown JR, Adel T, et al. Characterization of reproductive hormonal dynamics in the perimenopause. J Clin Endocrinol Metab 1996, 81: 1495-501.
- Hale GE, Burger HG. Hormonal changes and biomarkers in late reproductive age, menopausal transition and menopause. Best Pract Res Clin Obstet Gynaecol 2009, 23: 7-23.
- Weiss G, Skurnick JH, Goldsmith LT, et al. Menopause and hypothalamic-pituitary sensitivity to estrogen. JAMA 2004, 292: 2991-6.
- Lanzoni C, Ricchieri F, Santagni S, et al. Modificazioni dell’asse ipotalamo-ipofisi-ovaio in premenopausa. Riv It Ost Gin 2008, 19: 835-9.
- Burger HG, Hale GE, Robertson DM, et al. A review of hormonal changes during the menopausal transition: focus on findings from the Melbourne Women’s Midlife Health Project. Human Reprod Update 2007, 13: 559–65.
- Petersen KB. Individual fertility assessment and counseling in women of reproductive age. Dan Med J 2016, 63: B5292.
- Kruszynska A, Slowinska-Srzednicka J. Anti-Mullerian hormone (AMH) as a good predictor of time of menopause. Prz Menopauzalny 2017, 16: 47-50.
- Su HI, Freeman EW. Hormone changes associated with the menopausal transition. Minerva Ginecol 2009, 61: 483-9.
- Barnabei VM, Grady D, Stovall DW, et al. Menopausal symptoms in older women and the effects of treatment with hormone therapy. Obstet Gynecol 2002, 100: 1209-18.
- Di Sabatino A, Musacchio MC, Orvieto R, et al. L’esaurimento della funzione ovarica: quando e come indagarla. Bollettino di Ginecologia Endocrinologica 2011, 5: 1-7.
- Santoro N, Crawford SL, Lasley WL, et al. Factors related to declining luteal function in women during the menopausal transition. J Clin Endocrinol Metab 2008, 93: 1711-21.
Terapia della menopausa
Agostino Paoletta1 & Simona Ambroggio2
1Endocrinologia ULSS 6 Euganea, Cittadella (PD)
2Ginecologia Endocrinologica, Torino
(aggiornato al 25 febbraio 2018) questo capitolo è in attesa di aggiornamento
INDICE
- Terapia ormonale sostitutiva
- Gli studi clinici
- Indicazioni attuali
- Premessa
- Quando e per quanto tempo
- Modalità di somministrazione e dosaggi
- Estrogeni
- Progestinici
- Schemi di terapia ormonale
- Risultati
- Vampate
- Atrofia vaginale
- Sessualità
- Apparato urinario
- Depressione
- Funzione cognitiva
- Osso
- Metabolismo
- Sistema cardio-vascolare
- Sistema cerebro-vascolare
- Mortalità
- Rischi
- Trombo-embolici
- Colecistopatie
- K mammario
- K ovarico
- K endometriale
- K colon
- Altri trattamenti ormonali
- Terapia ormonale bioidentica
- Tibolone
- Raloxifene
- Ospemifene
- Complesso tessuto selettivo degli estrogeni (TSEC)
- Terapie alternative
- Fito-estrogeni
- Anti-depressivi
- Clonidina
- Gabapentina
- Terapie comportamentali
- Indicazioni per la pratica clinica
- Sono necessari i progestinici quando la donna usa gli estrogeni per via topica?
- Che fare nella donna con:
- menopausa precoce
- osteoporosi (nota o forte familiarità)
- familiarità per tumore mammario
- pregresso tumore mammario
- anamnesi oncologica (diversa da quella mammaria)
- fibromi uterini
- dislipidemia
- ipertensione
- diabete
- obesità
- trombofilia nota o pregressa patologia trombo-embolica
- epatopatia
- tabagismo
- Conclusioni e raccomandazioni per la pratica clinica
- Bibliografia
| Tabella 1 Terapie disponibili |
|
| Terapia ormonale sostitutiva | Estrogenica Estro-progestinica |
| Altre terapie ormonali | Terapia ormonale bioidentica Tibolone Raloxifene Ospemifene TSEC |
| Terapie alternative | Fito-estrogeni Anti-depressivi Clonidina Gabapentina Terapie comportamentali |
LA TERAPIA ORMONALE SOSTITUTIVA (TOS)
GLI STUDI CLINICI
Alla fine degli anni Novanta il ricorso alla TOS in menopausa ebbe un importante “boom”, in termini di prescrizioni e di consumi, a seguito della pubblicazione di studi osservazionali che ne indicavano i benefici per i sintomi e per ridurre l’incidenza delle malattie cardio-vascolari e dell’osteoporosi.
Le prime importanti osservazioni su un possibile effetto protettivo della TOS nascevano dai risultati di un famoso studio osservazionale di coorte controllato, il Nurses’ Health Study (1), che aveva segnalato una minore incidenza di eventi cardio-vascolari nelle donne in menopausa sottoposte a TOS. Nel 2002 sono stati resi noti i dati dello studio Women’s Health Initiative (WHI) (2). Il WHI era un trial randomizzato e controllato (RCT) disegnato per valutare gli effetti della TOS in menopausa, in 16608 donne, di età compresa tra 50 e 79 anni, reclutate in 40 centri clinici americani dal 1993 al 1998. Lo studio prevedeva 2 bracci: nel primo (8.506 donne) veniva utilizzata una terapia estro-progestinica con Estrogeni Equini Coniugati (ECE) orali (0.625 mg/die) + Medrossiprogesterone Acetato (MAP) (2.5 mg/die), secondo lo schema combinato-continuo; nell’altro (8.102 donne senza utero) solo la terapia con ECE. Per l’indice globale dei rischi e benefici erano stati scelti come end-point principali il cancro della mammella e la malattia coronarica, mentre gli altri indici di rischio globale prevedevano l’ictus, l’embolia polmonare, il cancro dell’endometrio, del colon-retto, le fratture del femore e la morte per altre cause. Alla fine del 5° anno di trattamento (sugli almeno 8 previsti), il Comitato Indipendente per il Monitoraggio sulla Sicurezza del Farmaco decise di interrompere lo studio nel braccio di trattamento estro-progestinico, a causa di un apparente aumento del rischio di carcinoma della mammella e di un apparente effetto negativo su alcuni indici di rischio globale. Dopo 7 anni anche la parte dello studio che includeva le donne isterectomizzate, trattate con soli estrogeni, fu bloccata dal National Institutes of Health. La decisione venne presa in base all’osservazione di una mancata cardio-protezione e di una maggiore incidenza di ictus, come nel gruppo trattato con estro-progestinici. I dati dello studio evidenziarono che il rapporto rischi-benefici non era favorevole all’impiego della TOS per la prevenzione di malattie croniche in menopausa. Va sottolineato che gli studi presentavano alcune sostanziali differenze: negli studi osservazionali, la TOS era stata prescritta durante la transizione menopausale a donne quasi tutte di età > 55 anni che nella maggioranza dei casi non presentavano sintomi menopausali e non avevano mai assunto terapia estro-progestinica in precedenza. La pubblicazione dello studio WHI scatenò numerose polemiche. Si rilevò che l'età media delle donne partecipanti era di 63 anni e che solo il 3.5% era di età compresa tra 50-54 anni, età in cui le donne di solito prendono una decisione per quanto riguarda l'inizio dell’eventuale TOS. Inoltre, il WHI non aveva affrontato la principale indicazione per l'uso della TOS, rappresentata dal sollievo dei sintomi. Lo studio WHI presentava, inoltre, numerosi importanti bias: l'uso di una sola via di somministrazione (orale), una sola formulazione di estrogeni (ECE) e un solo tipo di progestinico (MAP). Questo studio esercitò un forte impatto sulla decisione da parte delle donne e dei loro operatori sanitari: dopo la pubblicazione dello studio WHI ci fu un drammatico cambiamento nelle abitudini prescrittive, con un declino entro il 2003 di circa il 40% della TOS in menopausa.
Il Million Women Study (MWS), un altro grande studio prospettico condotto su oltre 1 milione di donne inglesi in menopausa e pubblicato nel 2003 (3), rafforzò ed estese i risultati dello studio WHI. Le conclusioni evidenziarono che l’uso della TOS poteva essere associato a un aumentato rischio di carcinoma della mammella, che aumentava progressivamente con la durata del trattamento. Per il gran numero di partecipanti in questo studio, si è potuto valutare l’effetto del trattamento anche in base al tipo di terapia ormonale utilizzata: il rischio di carcinoma mammario era maggiore quando si utilizzava la terapia combinata estrogeni + progestinici; il rischio era più basso con l’uso dei soli estrogeni e non differiva significativamente nè in base al tipo di preparato (ECE o etinil-estradiolo), nè al dosaggio o alla via di somministrazione (orale, trans-dermica, impianto). Analogamente, anche il rischio con l’uso di progestinici era indipendente dal tipo di progestinico utilizzato (derivati del progesterone o del testosterone) e dalla modalità di somministrazione (sequenziale o continua).
Rossouw et al. (4) hanno rivalutato i dati dello studio WHI sulla base dell’età delle pazienti e del tempo trascorso dalla menopausa al momento dell’arruolamento. Pur in assenza di significatività statistica, questa nuova analisi dimostra che l’aumento del rischio cardio-vascolare riportato nei primi studi pubblicati è da attribuirsi, essenzialmente, alle pazienti che cominciano il trattamento in età più avanzata e a maggiore distanza dalla menopausa. Al contrario, l’incidenza delle malattie cardio-vascolari e la mortalità diminuiscono nelle donne più giovani (50-59 anni) trattate con TOS.
Ulteriori importanti informazioni si sono avute successivamente con i dati dell’Etude Epidemiologic de femmes de la Mutuelle Générale de l’Education Nationalle (E3N), uno studio prospettico condotto su una larga coorte di donne francesi (5). Due caratteristiche del disegno di questo studio lo differenziavano in maniera sostanziale dai precedenti: erano state incluse soltanto donne che non avevano mai effettuato in precedenza TOS ed era stato arruolato un numeroso gruppo di donne trattate con progesterone naturale. I risultati di questo studio hanno dimostrato che il rischio di cancro della mammella non era aumentato nelle donne trattate con estrogeni + progesterone naturale o didrogesterone, al contrario di quanto accadeva con l’associazione dell’estrogeno con altre tipologie di progestinico di sintesi; veniva dunque ipotizzato che il grado di androgenicità del progestinico utilizzato fosse responsabile dell’aumentato rischio di tumore mammario.
Dopo la pubblicazione dei risultati del WHI sono stati condotti numerosi ulteriori studi per esaminare gli effetti della TOS in donne di età compresa tra 50-55 anni, maggiormente indicata per il suo inizio. Altri studi sono in corso e sicuramente si farà ulteriore luce sugli eventuali benefici e rischi che tale terapia può comportare.
LE INDICAZIONI ATTUALI
Premessa
Prima di intraprendere un'eventuale terapia farmacologica ormonale in post-menopausa, è consigliabile migliorare lo stile di vita della donna: sono fondamentali dieta equilibrata, attività fisica regolare, riduzione dell’assunzione di alcool e cessazione del fumo di sigaretta. Molte donne aumentano di peso durante il periodo di transizione menopausale e il sovrappeso e l’obesità sono associati molto spesso ad aumentata morbilità e mortalità per malattie cardio-vascolari e diabete, oltre che per alcuni tipi di tumore, tra i quali quello della mammella e dell’endometrio.
Quando e per quanto tempo
La TOS non è indicata per tutte le donne in post-menopausa, in assenza di una chiara indicazione alla prescrizione, ma è una terapia da valutare con ciascuna donna, considerando le sue aspettative, i benefici del trattamento, i potenziali rischi, le tipologie di preparati. Infatti, la TOS comprende differenti composti (estrogeni, progesterone/progestinici, combinazione di estrogeni + progesterone/progestinico, tibolone, SERM, TSEC), che hanno differenti benefici e profili di sicurezza a seconda della via di somministrazione e del dosaggio. Pertanto, non si può parlare di UNA terapia ormonale sostitutiva, ma di DIFFERENTI tipologie di trattamento.
La TOS è un efficace trattamento per la sintomatologia vasomotoria, la sindrome genito-urinaria, i disturbi dell’umore e del sonno, e per migliorare la qualità di vita. Tuttavia, occorre valutare il profilo di rischio personale della paziente: l’età, l’età al momento della menopausa, la causa della menopausa, il tempo trascorso dall’ultima mestruazione, eventuali condizioni mediche emerse negli anni in seguito all’utilizzo di terapie ormonali, il rischio cardio-vascolare, metabolico, oncologico, osteoporotico e cognitivo.
Per permettere una decisione pienamente consapevole, le donne dovrebbero essere preliminarmente ben informate della transitorietà di alcuni sintomi, dei benefici e dei potenziali rischi della terapia, della possibile ricomparsa dei sintomi alla sospensione del trattamento ed anche delle possibili terapie alternative non ormonali.
| Tabella 2 Controindicazioni assolute alla TOS in menopausa |
| Sanguinamento vaginale non diagnosticato Trombosi venosa idiopatica in atto o recente Storia di neoplasia mammaria Patologia epatica attiva o cronica Cardiopatia coronarica Ipertensione arteriosa non trattata Porfiria cutanea tarda |
Prima di una eventuale TOS, la donna dovrebbe ricevere una completa valutazione anamnestica e clinica. Se si decide di intraprendere la TOS, sarà utile avere il risultato di una mammografia eseguita da non oltre 12 mesi, che dovrà essere ripetuta annualmente nel corso della terapia, come da normale protocollo di screening. In base alle caratteristiche di ciascuna donna, devono essere consigliati altri esami, come la densitometria ossea, l’ecografia pelvica e gli esami ematochimici.
Non esistono ancora dati definitivi circa la durata ottimale del trattamento per il controllo dei sintomi che nello stesso tempo non produca rischi, ma un trattamento personalizzato, iniziato prima dei 60 anni, e comunque prima di 10 anni dall’insorgenza della menopausa, ha il miglior rapporto rischio/beneficio. Attualmente non esistono ragioni per fissare un limite temporale all’utilizzo dell’HRT, anche se la paziente deve essere rivalutata annualmente con un controllo clinico e della sintomatologia. La decisione di continuare, sospendere o modificare il trattamento dipende dall’obiettivo di ciascun individuo e dalla rivalutazione del rapporto rischio/beneficio per ciascuna paziente (6). Al contrario, la presenza di patologie croniche e degenerative, clinicamente manifeste o subcliniche, nelle donne con età > 60 anni, rende irrazionale e non accettabile per i potenziali rischi associati l’inizio della TOS sistemica a dosaggi standard.
MODALITÀ DI SOMMINISTRAZIONE E DOSAGGI
Estrogeni
Estrogeni Coniugati Equini per via orale. Si tratta di un preparato costituito dall’associazione di almeno 10 differenti sostanze estrogeniche, estratte e purificate da urine di giumenta gravida: esteri solfati dell’anello estrogenico B saturo (estrone, 17beta-estradiolo, 17alfa-estradiolo) ed esteri solfati dell’anello estrogenico B insaturo (equilina, 17beta-diidroequilina, 17alfa-diidroequilina, equilenina, 17beta-diidroequilenina, 17alfa-diidroequilenina, delta-8-estrone). Numerosi studi mostrano come tutti e dieci gli estrogeni siano biologicamente attivi, sebbene alcuni di essi abbiano effetti più potenti (estrone solfato, equilina solfato e 17alfa-diidroequilina). Dopo l’assunzione, questi estrogeni sono rapidamente solforilati e circolano sotto questa forma. La dose standard è di 0.625 mg/die. Recenti studi mostrano come i soggetti trattati abbiano benefici anche con la somministrazione di dosi più basse di ECE (0.30 mg/die). Attualmente non sono più disponibili in Italia, se non nell’associazione ECE 0.45 mg/die + bazedoxifene 20 mg (Duavive).
17β-estradiolo per via orale. La micronizzazione della formulazione costituisce un mezzo per facilitare l’assorbimento senza necessità di coniugazione. Nonostante la scarsa biodisponibilità dell’E2 assunto per questa via, tanto nella forma micronizzata che come valerato, esso riesce a produrre adeguati effetti metabolici. La somministrazione orale di E2 micronizzato determina un picco ematico dopo 2-4 ore dall’assunzione, poiché l’assorbimento è accelerato dal piccolo volume delle molecole. La concentrazione plasmatica si mantiene elevata per circa 8-10 ore; il wash-out di E2 e dei suoi metaboliti si completa dopo 72 ore dall’assunzione di una singola dose.
17β-estradiolo per via trans-dermica. Questa via abolisce il primo passaggio epatico (non si hanno modificazioni dei marcatori della sintesi proteica) e determina livelli circolanti terapeutici di estradiolo con livelli più bassi di estrone e estrone solfato, per cui richiede dosi minori rispetto alla via orale. Si ha una variabilità inter-individuale nell’assorbimento e nel 6-8% dei casi il cerotto non aderisce perfettamente o si hanno problemi di allergia. Attualmente in commercio vi sono cerotti a matrice, efficaci e ben tollerati, ad eccezione di lievi reazioni cutanee al collante; tra di essi vi sono dispositivi che durano sette giorni. Questi cerotti determinano una maggiore stabilità dei livelli plasmatici di E2 rispetto al precedente sistema a serbatoio, attualmente in disuso. Dopo la rimozione del cerotto, i livelli di estradiolo declinano in 12-24 ore.
17β-estradiolo in gel. La formulazione è costituita da un gel idro-alcolico, attraverso il quale il principio attivo è assorbito dalla pelle, determinandosi a livello sottocutaneo un “effetto riserva” dell’ormone della durata di 24 ore. Le concentrazioni plasmatiche di E1 ed E2 sono significativamente elevate, stabili e con una ridotta variabilità intra-individuale, contrariamente a quanto avviene con la somministrazione orale di E2, in cui sono presenti ampie fluttuazioni. Si ha minore incidenza di reazioni cutanee rispetto al cerotto. Questa modalità terapeutica si adatta facilmente alle singole esigenze, con possibilità di somministrare dosaggi da 0.5 a 1 mg/die/dose di E2.
Estrogeni spray. Recentemente è stato introdotto in Italia un estrogeno trans-dermico in formulazione spray, con possibilità di somministrare 1.5 mg di E2 per nebulizzazione.
Estrogeni per via vaginale. Questa via di somministrazione è indicata per il mantenimento o il ripristino del trofismo a livello uro-genitale, in assenza di sintomatologia sistemica. I prodotti contenenti estrogeni possono essere somministrati sotto forma di crema, ovuli, compresse e anello vaginale. Gli estrogeni sono rapidamente assorbiti attraverso la parete vaginale: gli effetti non sono soltanto locali, soprattutto durante la fase iniziale del trattamento, quando l’epitelio vaginale è ancora atrofico e può presentare anche micro-fissurazioni della mucosa, e si assiste pertanto ad un certo grado di assorbimento sistemico. Nel momento in cui l’epitelio matura in risposta alla terapia, l’assorbimento diminuisce e, inoltre, sono sufficienti dosi più basse di estrogeni per prevenire la recidiva dell’atrofia. Diversi estrogeni con differente potenza possono essere somministrati per via vaginale (estradiolo, estriolo, promestriene).
- Estradiolo (cpr da 25 µg): ha un limitato assorbimento sistemico, con concentrazioni plasmatiche < 20 pg/mL nelle donne trattate con continuità. Concentrazioni plasmatiche inferiori sono state rilevate con l’utilizzo dell’anello vaginale contenente 2 mg di estradiolo emiidrato (con rilascio giornaliero di 7.5 µg/24h). Con entrambe le modalità di trattamento non sono stati osservati casi di proliferazione endometriale, per cui non sembra essere indicata l’aggiunta di un progestinico, anche se pare utile un controllo ecografico dell’endometrio durante il trattamento, a causa della variabilità individuale dell’assorbimento ormonale. Il dosaggio dovrebbe essere individualizzato. Dosaggi inferiori possono essere meglio tollerati e avere un migliore rapporto rischio/beneficio.
- Estriolo è un estrogeno debole a breve emivita, somministrabile sotto forma di crema, gel o ovuli. L’efficacia terapeutica sulla sindrome genito-urinaria e la sua sicurezza rispetto all’iperplasia endometriale sono ben noti (7).
- Promestriene (Colpotrophine) è un derivato estrogenico con una peculiarità farmacodinamica: non viene degradato dal citocromo P450 e non viene perciò assorbito dalla membrana basale cellulare. La sua azione risulta quindi esclusivamente locale a livello della mucosa vaginale, senza modificazione dei livelli plasmatici di gonadotropine ed estradiolo e senza stimolo alla proliferazione endometriale (8).
Nella somministrazione della TOS, dosaggi bassi di estrogeni (tabella 3) associati a bassi dosaggi di progestinici si sono dimostrati efficaci soprattutto nei confronti dei sintomi vasomotori e genito-urinari. Quantità di estrogeni inferiori a quelle tradizionalmente prescritte richiedono però, spesso, trattamenti più prolungati per ottenere la massima efficacia. Se dopo un periodo iniziale di 3-4 settimane di terapia a basso dosaggio l'effetto clinico non risultasse soddisfacente, sarà opportuno passare alla terapia con dosaggi standard. Basse dosi di estradiolo sono disponibili in varie formulazioni (gel, creme, spray). Per quanto riguarda gli effetti soprattutto a livello endometriale, con l’aggiunta all’estrogeno di un progestinico per almeno 12-14 giorni al mese, non si ha iperplasia, e si osservano elevati tassi di amenorrea in caso di utilizzo combinato continuo (> 80% dal 1° mese).
| Tabella 3 Dosaggi degli estrogeni in menopausa |
||
| Formulazione | Dose standard | Dose bassa |
| Estrogeni coniugati equini | 0.625 mg/die | 0.3-0.45 mg/die |
| 17β-estradiolo micronizzato per via orale | 2 mg/die | 0.5 mg/die |
| 17β-estradiolo trans-dermico (cerotto) | 50 µg/die | 14-37.5 µg/die |
| 17β-estradiolo trans-dermico (gel) | 1.5 mg/die | 0.014 mg/die |
| 17β-estradiolo spray nasale | 0.03 mg/die | 0.015 mg/die |
| Estrogeni per via vaginale | 25 µg/die | 10 µg/die |
Progestinici
La farmacocinetica e la farmacodinamica seguono le seguenti regole: rapido assorbimento con concentrazione plasmatica massima dopo 2-5 ore, metabolizzazione epatica, lunga emivita (da 6 a 48 ore a seconda del progestinico utilizzato), con livelli plasmatici stabili se il trattamento viene protratto. Oltre che con il recettore progestinico, possono interagire con altri recettori steroidei (androgenici, mineralcorticoidi, glucocorticoidi, estrogenici) ed essere quindi dotati di differenti specificità di profilo.
Progestinici per via orale. Questa via è utilizzata nella maggior parte dei casi, per la maggiore biodisponibilità rispetto al progesterone naturale (che viene rapidamente catabolizzato nel fegato e nell’intestino).
Progestinici per via intra-uterina. Questa modalità di somministrazione, con l’impiego di un dispositivo intra-uterino (LNG-IUS) a forma di T, della durata di 3-5 anni, determina il rilascio di levonorgestrel direttamente a contatto con la mucosa endometriale. Questa tipologia di rilascio determina bassi livelli plasmatici dell’ormone, mentre le sue concentrazioni tissutali sono particolarmente elevate a livello endometriale.
Progestinici per via trans-dermica. Noretisterone acetato e levonorgestrel possono essere somministrati sotto forma di patch in associazione a 17β-E2, rilasciati da una matrice acrilica adesiva che li incorpora.
Progesterone naturale (P). Viene così definito il composto chimicamente uguale al progesterone di origine ovarica. La via orale di somministrazione del P ne determina una biodisponibilità relativamente bassa, con scarso assorbimento e rapido metabolismo epatico (effetto di primo passaggio), ma la micronizzazione rende la biodisponibilità del P simile a quella dello steroide naturale e la variabilità intra- ed inter-individuale è simile a quella dei progestinici di sintesi. Inoltre, la sospensione in olio e il confezionamento in capsule in gelatina aumentano ulteriormente l’assorbimento intestinale del progesterone micronizzato. La concentrazione plasmatica è proporzionale alla dose somministrata e il picco plasmatico varia da caso a caso, anche a seconda delle caratteristiche della flora batterica intestinale e dell’assunzione o meno di cibo, ecc. L’ingestione concomitante di alimenti ne incrementa i livelli plasmatici, stimolandone quindi assorbimento e biodisponibilità, senza modificare la percentuale assorbita. L’affinità dei metaboliti del P per i recettori GABA-ergici fa sì che la sua somministrazione per questa via abbia un effetto ipno-inducente, che può essere desiderabile per soggetti che hanno disturbi del sonno e che per questo preferiranno l’assunzione serale del farmaco. Tuttavia, in alcuni soggetti particolarmente sensibili l’assunzione orale può determinare anche stati confusivi e per questo si preferisce la somministrazione per via vaginale. La possibilità di utilizzare il P naturale per una via diversa dall’orale consente di impiegare il preparato a basse dosi, disponibili soprattutto a livello endometriale, dove è altamente efficace nell’indurre la maturazione secretiva. Per via vaginale si possono utilizzare compresse, ovuli, crema, gel all’8%. La somministrazione intra-vaginale di progesterone ne determina un picco plasmatico un pò più tardivo o un pò più basso rispetto alla via orale. Come dosi si utilizzano 200 mg per via vaginale in un’unica o in due somministrazioni, oppure 90 mg in gel a giorni alterni; per via orale, a causa della rapida metabolizzazione, si consigliano 100 mg x 2/die.
| Tabella 4 Dosaggi dei progestinici in menopausa |
|||
| Tipo | Dose in sequenziale | Dose in combinata | Dose del solo progestinico in commercio |
| Medrossiprogesterone acetato | 10 mg | 2.5 mg | 5-10-20 mg |
| Noretisterone acetato | 1 mg | 1 mg | 10 mg |
| Nomegestrolo acetato | 5-2.5 mg | 2.5 mg | 5 mg |
| Medrogestone | 5 mg | 5 mg | 5 mg |
| Diidrogesterone | 10-20 mg | 5 mg | 10 mg |
| Progesterone per via vaginale (cp) | 200 mg | 100 mg | 100-200 mg |
| Progesterone per via orale (cp) | 200-300 mg | 100 mg | 100-200 mg |
Schemi di terapia ormonale
Nelle donne non isterectomizzate la TOS segue preferenzialmente lo schema tradizionale o sequenziale ciclico, in cui il progestinico viene aggiunto all’estrogeno nella seconda fase di ogni ciclo (per 12-14 giorni), seguito da una breve pausa di sospensione del trattamento; in tal caso, se la dose di estrogeno è sufficiente a far crescere la mucosa endometriale, si hanno dei flussi simil-mestruali, che debbono essere considerati normali quando conseguano alla sospensione del progestinico.
Più di recente è stato adottato lo schema combinato continuo, con assunzione continuativa dell’estrogeno e del progestinico contemporaneamente. Tale tipo di somministrazione porta alla pressoché totale atrofia della mucosa endo-uterina, così che dopo alcuni mesi di perdite ematiche irregolari si giunge, nella maggior parte dei casi, alla scomparsa dei flussi.
I RISULTATI
Le vampate di calore
Una revisione sistematica ed una metanalisi di 12 studi sulla terapia con estrogeni della durata di almeno 3 mesi, controllati verso placebo (9), hanno evidenziato che il numero di vampate di calore era significativamente ridotto, senza riscontrare significative differenze tra i vari tipi di estrogeni utilizzati (17ß-E2 per via orale o per via trans-dermica o ECE). L'aggiunta di un progestinico agli estrogeni non influenzava significativamente i risultati ottenuti. Dati simili sono stati osservati in una seconda metanalisi di 24 studi (10): la frequenza delle vampate era ridotta del 75% rispetto al gruppo placebo.
Va sottolineato che la maggior parte dei dati disponibili in letteratura a questo riguardo si basa sull’utilizzo di estrogeni a dosi standard. Tuttavia, si è visto che anche i dosaggi più bassi di estrogeni (tabella 3) sono in grado di ridurre significativamente le vampate di calore (11). In molte donne è risultato efficace un dosaggio ancora più basso (17ß-E2 0.014 mg/die per via trans-dermica).
Di recente per le vampate di calore sono state utilizzate terapie alternative (soia/isoflavoni, anti-depressivi e gabapentina, vedi oltre): sebbene questi agenti non siano efficaci quanto gli estrogeni, sono significativamente migliori del placebo (12).
Quando le vampate sono di lieve entità, allo stato attuale non vi è consenso se consigliare alcune integrazioni terapeutiche quali soia/isoflavoni, per mancanza di dati conclusivi, in particolare nelle donne con tumore della mammella. I cibi ricchi di isoflavoni potrebbero essere una scelta migliore rispetto alla supplementazione o ai cibi fortificati. Mancano dati sull’efficacia e non c’è consenso sull’impiego di ginseng, liquirizia, agopuntura, magnetoterapia, ecc.
Quando le vampate sono più severe e incidono sulla qualità della vita, deve essere presa in considerazione la terapia ormonale. Si raccomanda di utilizzare la dose più bassa per il controllo dei sintomi vasomotori. Con il regime ciclico ci può essere una ricomparsa delle vampate nel periodo di pausa, soprattutto con l’impiego del 17ß-E2 che ha una clearance più rapida.
Se le vampate persistono, dopo adeguamento del dosaggio, per più di 2-3 mesi di terapia, occorre prendere in esame altre cause del sintomo.
In conclusione, la TOS dà una riduzione delle vampate di calore: -75% di frequenza (IC 64-82%) e -87% di gravità (IC 73-94%).
Atrofia vaginale
La terapia con estrogeni promuove la crescita delle cellule vaginali, la maturazione cellulare, favorisce la ricolonizzazione con i lattobacilli, migliora lo spessore e l’elasticità della mucosa e ne aumenta il flusso sanguigno, diminuisce il pH vaginale a livelli pre-menopausali e migliora la risposta sessuale. Dosi basse di estrogeni, come 10 µg inseriti in vagina due volte a settimana o 7.5 µg/die con anello vaginale, migliorano sensibilmente l’atrofia vaginale e ne riducono i sintomi. Dosi da 7.5 a 25 µg di estradiolo per due volte alla settimana non sembrano determinare un’azione stimolatoria a livello endometriale.
In conclusione, l’effetto della TOS è positivo.
Sessualità
Gli estrogeni da soli possono non essere sufficienti per risolvere il problema sessuale e i progestinici possono avere effetti diversi, in base all’androgenicità. L’estrogenizzazione è importante, ma è necessario anche tenere conto che la TOS può interferire con la produzione epatica di SHBG e con la secrezione surrenalica degli androgeni, che possono avere un forte impatto sulla libido.
L’aggiunta di testosterone potrebbe migliorare il desiderio e l’attività sessuale, soprattutto quando è chiaramente evidente una carenza di androgeni come nella menopausa chirurgica, dove viene repentinamente a mancare la quota di androgeni prodotta dalle ovaie, tuttavia non vi è un consenso all’utilizzo, poiché tale terapia è sostenuta da dati limitati e gli effetti a lungo termine non sono noti. Le Linee Guida dell’Endocrine Society sconsigliano l’utilizzo di terapia androgenica nella donna, fatta eccezione nelle donne in post-menopausa con grave disordine ipoattivo del desiderio, senza controindicazioni ed esclusivamente in uno studio clinico durato 3-6 mesi, con monitoraggio dei livelli di testosterone plasmatici (13,14).
Tra i vari farmaci a disposizione, il tibolone (vedi oltre) sembra avere effetti specifici proprio sulla libido, oltre agli effetti positivi sui sintomi vaginali e generali della menopausa.
Gli estrogeni possono concorrere a migliorare il desiderio in modo diretto, in quanto contribuiscono a mantenere più trofici gli indicatori biologici, anatomici e funzionali, dell’identità sessuale femminile, e indiretto, sia perchè riducono i sintomi vasomotori, neurovegetativi e psichici che possono concorrere alla caduta della libido, sia perché possono ridurre i disturbi dell’eccitazione e la dispareunia, che possono inibire la risposta sessuale, causando una caduta secondaria del desiderio.
I progestinici possono avere invece azione diversa, a seconda della molecola di origine, dell’interazione, agonista o antagonista, con i recettori ormonali (progestinici, estrogenici, androgenici), dell’affinità con l’SHBG (se presente ed elevata, sposta il testosterone, aumentandone la frazione libera), dell’inibizione o meno della 5-alfa-reduttasi di tipo 2 (che converte il testosterone nella sua forma attiva, DHT).
In conclusione, la somministrazione della terapia ormonale personalizzata migliora la sessualità.
Apparato urinario
I dati sono molto contraddittori: estrogeni utilizzati localmente possono dare beneficio alle donne con vescica iperattiva e diminuzione del rischio di infezioni ricorrenti delle vie urinarie, ma gli estrogeni assunti per via sistemica sembrano peggiorare o provocare incontinenza, mentre bassi dosaggi di estradiolo trans-dermico non sembrano incidere sull’incontinenza (15). Al momento attuale nessun prodotto ormonale è però stato approvato e quindi non vi è nessuna indicazione per la cura delle patologie delle vie urinarie con la terapia ormonale.
Depressione
Alcuni studi randomizzati (16), anche se piccoli e di breve durata, hanno evidenziato come la TOS con estrogeni possa svolgere una significativa azione anti-depressiva, soprattutto se assunta per os nelle donne sintomatiche più giovani in peri-menopausa, mentre altri studi condotti nelle donne in post-menopausa avanzata non hanno dimostrato alcuna significativa azione protettiva (17). Sebbene la TOS abbia un effetto positivo sul tono dell’umore, non può essere considerata un anti-depressivo (18). Pertanto, un primo episodio depressivo lieve o moderato può costituire indicazione al trattamento ormonale sostitutivo. Negli episodi gravi, tuttavia, è indicata la terapia con anti-depressivi associati a psicoterapia.
Declino cognitivo e demenza senile
Numerosi studi osservazionali hanno evidenziato il possibile ruolo degli estrogeni nel prevenire il declino cognitivo e il rischio di demenza, se iniziati precocemente prima dei 65 anni, particolarmente dopo menopausa chirurgica o in presenza di sintomi associati alla menopausa, ma gli studi prospettici non lo hanno confermato. Lo studio collaterale del WHI sulle funzioni cognitive (WHIMS, 19), condotto su più di 7500 donne > 65 anni, durato circa 6 anni e che prevedeva test di memoria e di ideazione, misurazione delle attività relative alla memoria e altre funzioni cerebrali, non ha dimostrato nessun significativo effetto positivo con l’utilizzo della TOS. Anche il Nurses’ Health Study (NHS) non ha evidenziato alcun beneficio sulla funzione cognitiva a lungo termine con l'uso della TOS tra le donne che avevano iniziato la terapia già nei primi mesi della menopausa, anzi si è addirittura evidenziato un più rapido declino cognitivo proprio tra le donne che utilizzavano la terapia (20). Nello studio Women’s Health Across the Nation (21) le donne che avevano assunto terapia orale contraccettiva in peri-menopausa e poi la interrompevano in post-menopausa avevano un effetto cognitivo benefico, al contrario delle donne che iniziavano la terapia in post-menopausa, nelle quali si osservava un effetto negativo sulla performance cognitiva. Per le donne in post-menopausa di età > 65 anni, i risultati dei più ampi studi clinici ben disegnati indicano che la terapia con estrogeni non migliora la memoria o le altre abilità cognitive e che la terapia combinata estro-progestinica sembra addirittura peggiorare le capacità mnemoniche. Lo studio WHI, condotto su donne di età compresa tra 65 e 79 anni, ha registrato un aumento dell'incidenza della demenza con l’uso della TOS (19): la stima dei casi di demenza attribuiti alla TOS è di 12/10.000 donne per anno con i soli estrogeni (non significativo) e di 23/10.000 donne per anno con l’utilizzo dell’associazione E+P (aumento significativo). Dati dello studio WHI of Cognitive Aging, accessorio del WHI, e dello studio Memory WHI (22), che ha arruolato donne > 66 anni, hanno indicato peggioramento della memoria verbale ma effetto positivo sulla memoria figurata tra le donne che utilizzavano E+P rispetto a quelle che non la utilizzavano. Ultimamente, il Registro Finlandese per l’Osteoporosi ha riportato come l’utilizzo di TOS in donne di età compresa tra 47 e 56 anni riduca il rischio di sviluppare Alzheimer. Al momento non ci sono RCT che possano fornirci ulteriori informazioni. In sintesi, i dati disponibili non chiariscono adeguatamente se l’utilizzo della TOS assunta subito dopo la menopausa aumenti o diminuisca il tasso di declino cognitivo o riduca e ritardi il rischio di demenza. Attualmente è in corso uno studio per valutare il differente impatto della TOS sulle funzioni cognitive a seconda dell’età al trattamento, dei vari preparati estrogenici (ECE o estradiolo), della via di somministrazione, dell’associazione con progesterone micronizzato rispetto ai progestinici di sintesi (KEEPS Cognitive and Affective Study). In assenza di conclusioni più certe, l’inizio della TOS a dosi standard dopo i 65 anni non è raccomandato per la prevenzione della demenza e il declino cognitivo (15,18,23).
Osteoporosi e fratture
L’obiettivo del trattamento dell’osteoporosi è la prevenzione delle fratture. La scelta del trattamento deve essere basata sul rapporto rischio/beneficio e costo del farmaco. Pertanto, un trattamento specifico deve essere effettuato sulla base del rischio fratturativo individuale a 10 anni (modello FRAX per il calcolo del rischio di frattura, specifico per ogni Paese), o in presenza di osteoporosi (T-score ≤ -2.5 alla densitometria DEXA) o di osteopenia con ulteriori concomitanti fattori di rischio.
La TOS a dosi standard è efficace nel controllo dell’eccessivo turnover osseo, previene la perdita ossea in post-menopausa e riduce l’incidenza delle fratture, sia vertebrali che femorali, anche in donne senza rischio elevato di frattura: la TOS è infatti la sola terapia con comprovata efficacia nella riduzione delle fratture in donne con osteopenia. La TOS a basso dosaggio è risultata efficace nel ridurre la perdita di massa ossea, ma non vi sono dati rispetto alla riduzione dell’incidenza del rischio fratturativo.
Sebbene la TOS sia in grado di prevenire le fratture in post-menopausa ad ogni età, è fondamentale l’età di inizio del trattamento: i benefici sull’osso sono maggiori nel gruppo di donne tra i 50 e i 60 anni o entro 10 anni dall’ultima mestruazione, e superano nettamente i rischi; pertanto la TOS deve essere considerata la terapia di prima linea in questo caso. Nella fascia di età 60-70 anni occorre valutare attentamente i rischi correlati alla TOS e preferire l’utilizzo di altri farmaci per il trattamento dell’osteoporosi (6,15).
La durata del trattamento non ha un limite predefinito, ma deve essere rivalutata periodicamente rispetto all’obiettivo che ci si pone e agli eventuali rischi che possono insorgere all’aumento dell’età, poiché alla cessazione della terapia vi è una quota imprevedibile di perdita di massa ossea, sebbene permanga un certo grado di protezione dalla frattura dopo la cessazione della TOS.
Metabolismo
La TOS in menopausa è associata in generale alla riduzione del peso corporeo e della massa grassa.
Studi osservazionali e randomizzati come il WHI hanno dimostrato che la TOS (ECE con o senza MAP) riduce il rischio di sviluppare diabete, indipendentemente dai suoi effetti sul BMI. Questo effetto protettivo non sembrerebbe legato esclusivamente al miglioramento della sensibilità all’insulina.
Sistema cardio-vascolare
In tutto il sistema cardio-vascolare sono presenti recettori per estrogeni, progesterone e androgeni e gli steroidi sessuali lo influenzano profondamente.
Per quanto riguarda la prevenzione primaria, tutti i dati della letteratura (provenienti da studi osservazionali, RCT e metanalisi) sono concordi sul fatto che la TOS, se iniziata prima dei 60 anni e entro 10 anni dall’insorgenza della menopausa, riduca l’incidenza delle malattie cardio-vascolari e tutte le cause di morte. Al contrario, quando iniziata dopo i 60 anni o dopo 10 anni dalla menopausa, la TOS ha effetto nullo o anche avverso sul rischio cardio-vascolare. Quando le coronarie presentano già placche aterosclerotiche, gli estrogeni somministrati per via orale incrementano i livelli di metallo-proteinasi (MMP) che provocano instabilità della placca, con rischio di rottura e successiva trombosi. Questo fenomeno non si presenta nelle donne più giovani, con assenza o presenza minima di placche aterosclerotiche vasali, meglio se in menopausa da meno di 6 anni. Inoltre, la somministrazione di estrogeni per via trans-dermica non incrementa i livelli di MMP e pertanto ha rischio trombotico minore o nullo.
Vari studi dimostrano che la TOS riduce sia lo spessore dell’intima e della media della carotide (indice diretto di aterosclerosi subclinica, predittivo di rischio di eventi cardio-vascolari), sia l’accumulo di calcio a livello arterioso, correlato a sua volta con rischio di arteriosclerosi ed eventi cardio-vascolari.
Infine, studi clinici randomizzati ipotizzano una differente azione nella riduzione del rischio coronarico a seconda della tipologia di preparato utilizzato (24,25).
Sistema cerebro-vascolare
La selezione delle pazienti e l’inizio precoce della TOS sono determinanti sul rischio vascolare determinato dalla terapia. Entrambi questi fattori potrebbero spiegare i dati discordanti derivati da differenti studi sul rischio di ictus. Il rischio di ictus è età-correlato, quantificabile in un caso in più di 1000 donne per anno, ossia è un evento raro.
I risultati di studi osservazionali su TOS e rischio di ictus sono contraddittori. Diversi studi indicano un aumento del rischio di ictus ischemico, in linea con i risultati del WHI. Nel Nurses' Health Study, il RR di ictus nelle donne di 50-59 anni in terapia con E+P non era significativamente elevato (RR 1.34, IC95% 0.84-2.13), ma era significativamente maggiore tra le donne della stessa età che stavano utilizzando la terapia con soli estrogeni (RR 1.58, IC95% 1.06-2.37). Inoltre, la terapia con bassi dosaggi di estrogeni non sembra aumentare il rischio di ictus (bassi livelli di evidenza) e il dosaggio minimo di estrogeni impiegato (per esempio 0.3 mg ECE) non sembra associato ad un aumento del rischio, anche se bisogna considerare il numero relativamente basso di donne che stavano assumendo la terapia (26). Al contrario, altri studi non hanno dimostrato nessun significativo aumento del rischio di ictus quando viene utilizzata la TOS in menopausa (27-29). Alcuni studi suggeriscono un piccolo incremento del rischio di ictus ischemico anche in donne più giovani (50-60 anni) con l’utilizzo di estrogeni orali a dosi medio-alte, mentre la via di somministrazione trans-dermica non aumenta il rischio di ictus nella popolazione generale (6,25).
Non vi è un aumento significativo di ictus in donne di età < 60 anni che inizino la TOS entro 10 anni dall’ultima mestruazione. Lo studio Heart and Estrogen/Progestin Replacement (30) e lo studio di prevenzione secondaria Women’s Estrogen for Stroke (31) hanno evidenziato che il rischio di ictus non è significativamente aumentato. Lo studio Women’s International of long Duration Oestrogen after Menopause (32) non ha evidenziato alcun eccesso di rischio di ictus dopo 1 anno di terapia nelle donne trattate con E+P rispetto al gruppo placebo.
In conclusione, l’utilizzo di preparazioni estrogeniche trans-dermiche deve essere considerato a rischio trombotico basso/nullo, perciò come improbabile fonte di rischio di ictus e malattie cardio-vascolari (23).
Mortalità
La TOS è stata associata a una riduzione del 40% circa della mortalità totale femminile negli studi in cui le partecipanti avevano un'età media < 60 anni o erano già in menopausa da almeno 10 anni (33).
I RISCHI
Trombo-embolia venosa (TEV)
La TEV è il più frequente effetto collaterale correlabile all’utilizzo di estrogeni per os in donne in post-menopausa, con un rischio maggiore durante il primo anno di trattamento.
Gli estrogeni orali esercitano un effetto pro-trombotico dovuto all’effetto di “primo passaggio” epatico, con successivo incremento dei livelli plasmatici di D-dimero e trombina, riduzione dei livelli plasmatici di proteina C ed S coagulative, AT III e APC ratio, aumento dell’angiotensinogeno e alterazione del quadro lipidico (34). Inoltre, il rischio di TEV aumenta con l’età ed è direttamente correlato all’obesità e alla trombofilia.
Studi epidemiologici hanno dimostrato che non vi è alcun incremento del rischio di TEV con l’utilizzo di estradiolo trans-dermico (che non ha alcuna interferenza sui parametri coagulativi). Inoltre, vi sono forti evidenze che differenti tipi di progestinico utilizzati nella TOS influenzino in maniera diversa il rischio trombotico. Una terapia ormonale costituita da estrogeni trans-dermici e progesterone naturale ha un minor impatto sul rischio trombotico, specie in donne con più elevato rischio di base, mentre l’utilizzo di medrossiprogesterone acetato aumenta significativamente il rischio di TEV (6,15,23).
Non vi è indicazione ad effettuare uno screening per la trombofilia prima di iniziare una TOS, ma è fondamentale un’anamnesi familiare e personale accurata.
Anche il fumo potrebbe aumentare ulteriormente il rischio di TEV. Le donne fumatrici che volessero intraprendere una terapia ormonale in menopausa devono provare a smettere di fumare.
Alla luce di questi dati, le linee guida della North American Menopause Society (NAMS), dell’Endocrine Society, dell’International Menopause Society e dell’European Menopause and Andropause Society (EMAS) per la gestione delle donne in menopausa con una storia personale o familiare di TEV contengono affermazioni positive per quanto riguarda l’utilizzo trans-dermico, sia dell’estradiolo che del progesterone micronizzato: questa associazione trans-dermica conferisce un rischio significativamente più basso per TEV, ictus e malattie della colecisti. Sulla base di questi dati, ora inclusi nelle linee guida, l'uso di estradiolo e progesterone micronizzato per via trans-dermica potrebbe ridurre o addirittura annullare il rischio di TEV, ictus, colecistite, e forse anche di cancro della mammella, che è invece associato alla TOS per via orale.
Bisogna ricordare che interventi chirurgici, fratture e immobilizzazione possono predisporre alla trombosi venosa e che il rischio è aggravato di circa 2 volte quando viene utilizzata la terapia combinata orale E+P. Non esistono dati certi che la sospensione della terapia ormonale in menopausa possa ridurre il rischio di trombosi venosa, ma poichè si è visto che la terapia combinata per via orale può determinare un aumento del rischio di eventi trombo-embolici anche del 30%, si consiglia la sospensione in occasione di eventuali interventi chirurgici o nei casi che potrebbero aumentarne il rischio.
Malattie della colecisti
Gli estrogeni da soli o in combinazione con i progestinici aumentano il rischio di malattie della colecisti (colecistite, colelitiasi, colecistectomia). Tuttavia, alcuni studi osservazionali hanno evidenziato minori rischi di patologia della colecisti quando viene utilizzata la terapia trans-dermica (oppure quella orale a bassi dosaggi) rispetto a quella orale standard.
Cancro della mammella
L’incidenza di cancro della mammella è differente a seconda dei Paesi considerati, per cui non si possono estrapolare dati sulla TOS generalizzabili alle differenti etnie. Inoltre, i dati riguardanti il rischio di carcinoma mammario nelle donne che utilizzano la TOS rispetto a quelle che non la utilizzano sono ancora piuttosto contrastanti, perché la maggior parte degli studi a lungo termine prende in considerazione uno specifico preparato ormonale costituito dall’associazione di ECE + MAP e suggerisce un possibile incremento del rischio durante il trattamento. Inoltre, l’aumento della densità mammaria durante la TOS comporta una minore facilità di lettura della mammografia.
La terapia con soli estrogeni (ECE alla dose standard di 0.625 mg/die) ha dimostrato di non aumentare il rischio di tumore della mammella, anche con 15 anni di utilizzo. Sebbene alcuni studi abbiano ipotizzato un piccolo incremento del rischio sia con l’utilizzo di ECE che con estradiolo, nello studio WHI era presente persino una riduzione dell’incidenza di tumore mammario nel braccio di trattamento con soli estrogeni. Tuttavia l’associazione con il MAP è stata dimostrata incrementare il rischio di tumore della mammella.
Il possibile aumento di rischio di cancro mammario associato all’utilizzo della TOS è < 0.1% annuo (cioè meno di 1 cancro ogni 1000 donne, per anno di utilizzo), simile o addirittura inferiore al rischio associato a stili di vita scorretti (ridotta attività fisica, obesità, abuso di alcool) (15).
L’opinione attuale è che la TOS possa esercitare una stimolazione sulla proliferazione di cellule di tumori occulti pre-esistenti, troppo piccoli per essere diagnosticati dall’esame obiettivo o dagli studi di diagnostica per immagini. Probabilmente alcuni di questi piccoli tumori non sarebbero progrediti senza la stimolazione della terapia ormonale. Questa tipologia di tumore, a lenta progressione e con recettori per gli estrogeni positivi, potrebbe aumentare la sua velocità di sviluppo nelle donne in TOS, particolarmente con l’associazione con un certo tipo di progestinico. La terapia con soli estrogeni avrebbe invece un effetto molto ridotto o trascurabile nello sviluppo di questo tipo di tumore (25).
Secondo l’ipotesi long gap time, la riduzione del cancro della mammella associata all'uso di soli estrogeni osservata nel WHI potrebbe riflettere un effetto pro-apoptotico degli estrogeni nelle donne che intraprendono la terapia molti anni dopo l'insorgenza della menopausa. Studi in vitro su cellule cancerogene mammarie hanno, infatti, dimostrato che, se queste vengono deprivate di estrogeni per un lungo periodo, si sensibilizzano all’effetto pro-apoptotico dell’estradiolo (35). La diminuzione del rischio di cancro della mammella osservata nel braccio di soli E del WHI non è stata osservata nel MWS (36), dove il rischio relativo è risultato invece maggiore nelle donne che hanno intrapreso la terapia con estrogeni entro 5 anni dopo la menopausa, con un aumento assoluto del rischio di 13 casi ogni 10.000 donne per anno. Non è stato stabilito se la differenza tra questi risultati e il braccio WHI con soli E rifletta le differenze nei tempi di inizio della terapia, i tipi di estrogeni utilizzati, le popolazioni di studio, l'aumento della sorveglianza mammografica delle donne che usavano la terapia ormonale, o altri fattori non controllati in uno studio osservazionale. Il rischio di cancro della mammella aumentava quando la terapia con soli estrogeni veniva prolungata oltre 15 anni (37,38). Una grande meta-analisi, che ha analizzato dati di 67.370 donne negli studi osservazionali, non ha evidenziato nessun aumento del rischio di cancro della mammella in donne che avevano utilizzato la terapia con soli estrogeni per meno di 5 anni (39).
Tre studi successivi al WHI (di cui un ampio studio osservazionale europeo) hanno dimostrato come l’associazione di progesterone micronizzato o didrogesterone alla terapia con estradiolo orale o trans-dermico sia correlata ad un rischio di cancro mammario nullo rispetto a quello rilevato con l’utilizzo di progestinici sintetici. Tuttavia, la mammografia deve essere effettuata annualmente nellle donne in TOS (15,23): nel caso di pazienti che presentino una mammografia di difficile interpretazione per aumentata densità, è possibile ripeterla dopo 30 giorni di sospensione della TOS.
Possiamo concludere che attualmente non è possibile calcolare il rischio assoluto di carcinoma della mammella per ogni donna, poichè questo dipende da vari fattori, come il momento della menopausa, il tipo di trattamento, il BMI, l’eventuale progestinico utilizzato, la lunghezza del periodo di trattamento e la familiarità.
Cancro dell’ovaio
I dati pubblicati sul ruolo della terapia ormonale sul rischio di carcinoma ovarico sono contrastanti. Alcuni studi non hanno trovato nessuna associazione (40,41), ma vi è un cospicuo numero di dati sperimentali osservazionali, che evidenziano un'associazione tra rischio di cancro ovarico e TOS, in particolare se utilizzata per un lungo periodo (42,43). Nel National Institutes of Health American Association of Retired Person Diet and Health Cohort (44) non si è osservato nessun aumento di rischio per cancro ovarico se la terapia con soli estrogeni veniva utilizzata per meno di 10 anni, ma il rischio aumentava significativamente quando si superavano i 10 anni di trattamento. Un'importante metanalisi ha evidenziato un aumento del rischio annuo per cancro ovarico: con E + P di 1.11 volte (IC95% 1.02-1.21) e con solo E di 1.28 volte (IC95% 1.18-1.40) (45). Una seconda metanalisi sull’uso di qualsiasi TOS ha evidenziato un RR di 1.24 (IC95% 1.15-1.34) per studi di coorte e di 1.19 (IC95% 1.02-1.40) per studi caso-controllo (46). L’aumento del rischio riguarda esclusivamente i tumori sierosi ed endometrioidi e si evidenzia con un caso di cancro dell’ovaio in più di 1000 donne in TOS di età media 50 anni (con mortalità di un caso in più ogni 1700 utilizzatrici). Tuttavia, a causa di numerosi bias nei vari studi, mancano dati scientifici di buona qualità per definire l’esatto rischio di cancro dell’ovaio in TOS (15).
In conclusione, l'associazione tra cancro ovarico e terapia con E + P se utilizzata per più di 5 anni è rara, ma le donne ad aumentato rischio di cancro ovarico (per esempio, quelle con una storia familiare) devono essere informate circa questa potenziale associazione.
Carcinoma endometriale
L’utilizzo della terapia con estrogeni in assenza di associazione con progestinico in donne in post-menopausa non isterectomizzate correla con una maggiore incidenza del carcinoma dell’endometrio; tale rischio è dose- e tempo (di utilizzo)-dipendente. Un’importante metanalisi ha evidenziato un RR generale di 2.3 (IC95% 2.1-2.5), che saliva a 9.5 se gli estrogeni venivano utilizzati per oltre 10 anni (47). Il rischio era presente in maniera significativa anche dopo diversi anni dalla sospensione della terapia. Per ridurre il rischio, è raccomandato per le donne con utero intatto l’assunzione concomitante di un progestinico.
L’utilizzo di terapia sequenziale ciclica a lungo termine (3-5 anni) sembra essere associata a un incremento lieve ma statisticamente significativo di iperplasia endometriale, mentre la terapia ormonale combinata continua ne riduce il rischio. Tuttavia, il controllo dell’iperplasia endometriale dovuta alla proliferazione estrogeno-indotta dipende dalla tipologia, dalla dose e dal tempo di utilizzo del progestinico. Per bilanciare una terapia con estradiolo 2 mg/die per os oppure estradiolo trans-dermico 50 µg/die sono necessarie adeguate dosi di progesterone micronizzato (200 mg/die per 12-14 giorni al mese); in donne che utilizzino una terapia estrogenica a più elevato dosaggio o che abbiano un elevato BMI dovrebbero essere prese in considerazione dosi più elevate. Inoltre, nelle donne in terapia sequenziale ciclica bisogna prendere in considerazione un monitoraggio ecografico dello spessore endometriale, per valutare un eventuale adeguamento del dosaggio del progestinico nei casi a rischio di iperplasia (15,23).
La terapia con estrogeni non è consigliata a donne in post-menopausa con pregresso cancro dell’endometrio.
Cancro del colon
La maggior parte degli studi osservazionali mostra una riduzione del rischio di cancro del colon nelle donne che fanno uso di TOS e 3 metanalisi riportano un mantenimento di questo beneficio nei 4 anni successivi alla sospensione del trattamento. Nello studio WHI è stata rilevata una riduzione dell’incidenza dei tumori del colon nel braccio in terapia combinata (circa 6 casi in meno per 10.000 donne/anno), in accordo con alcuni studi osservazionali. Limitandosi alle donne di età < 60 anni, il beneficio è da considerarsi pressoché inesistente, perché in questa fascia di età l’incidenza dei tumori del colon è molto bassa nelle donne a rischio normale, mentre in quelle a rischio più alto (specie per familiarità) è fortemente raccomandato lo screening endoscopico per la diagnosi precoce.
In conclusione la TOS riduce l’incidenza di carcinoma del colon e la mortalità correlata, ma questo non può costituire un’indicazione alla TOS, sebbene possa in teoria entrare nella valutazione complessiva del rapporto beneficio-rischio.
ALTRI TRATTAMENTI ORMONALI
La Terapia Ormonale Bioidentica
Il termine “bioidentico” identifica una terapia che abbia la stessa struttura molecolare delle sostanze prodotte nel corpo umano, pertanto estradiolo e progesterone realizzati da industrie farmaceutiche e sottoposti a rigorosi controlli dalle Autorità preposte sono da intendersi come forme bioidentiche di TOS. Invece, ciò che commercialmente viene definita come terapia ormonale bioidentica (BHT) è una definizione inadeguata per descrivere preparazioni ormonali che contengono una miscellanea di vari ormoni, compresi estradiolo, estrone, estriolo, progesterone, DHEA e testosterone, normalmente prodotte in modo galenico, ma non soggette ai rigorosi controlli di qualità imposti ai prodotti farmacologici registrati. Gli ormoni bioidentici non sono “naturali”, ma sono sintetizzati in laboratorio da precursori di origine vegetale. Inoltre è stato riscontrato un incremento di carcinoma endometriale con l’utilizzo di BHT, in quanto il progesterone utilizzato in questi composti non sembra essere sufficiente a controbilanciare l’effetto estrogenico di stimolazione endometriale. In conclusione, i composti ormonali bioidentici non offrono comprovati benefici né sono sicuri per la salute delle donne. Tutte le società scientifiche e i dati clinici mettono in guardia sull’utilizzo di questo tipo di trattamento ormonale (15,23).
Tibolone
È uno steroide sintetico, 19-nortestosterone derivato, spesso descritto come prodotto di utilizzo per la TOS, ma con un profilo farmacologico unico e con significative differenze nel meccanismo d’azione rispetto alla terapia estrogenica o estro-progestinica. Infatti, ha contemporaneamente proprietà estrogeniche, progestiniche e androgeniche ed effetti tessuto-selettivi, con attività simil-estrogenica su osso, vagina e cervello, ma senza attività di stimolo proliferativo a livello endometriale. Inoltre, riduce in modo significativo l’SHBG, aumentando i livelli di testosterone libero circolante.
È utilizzato per ridurre i sintomi della menopausa, approvato per l'uso in Europa e Australia, ma non negli Stati Uniti (l’FDA ha negato l’autorizzazione nel 2006, richiedendo supplementi di dati che l’azienda non ha più fornito). Il tibolone è, infatti, in grado di alleviare in maniera significativa i sintomi vasomotori in menopausa e migliorare l'atrofia uro-genitale.
Il tibolone (1.25 mg/die per 2 anni) riduce nelle donne anziane in post-menopausa la perdita di massa ossea a livello della colonna lombare e dell'anca rispetto al raloxifene (60 mg/die). Lo studio LIFT (Long-Term Intervention on Fractures with Tibolone)(48), disegnato per testare se il trattamento con tibolone fosse in grado di ridurre il rischio di fratture vertebrali e, in secondo luogo, di modificare il rischio di fratture non vertebrali, cancro mammario, trombosi venosa profonda e malattie cardio-vascolari in donne anziane con osteoporosi, è stato interrotto prematuramente per un aumento del rischio di ictus (49). Lo studio LIBERATE (The Livial Intervention following Breast cancer; Efficacy, Recurrence And Tolerability Endpoints) (50) della durata di 3 anni in donne osteoporotiche di età > 60 anni, era partito dal presupposto che una crescente percentuale di donne con diagnosi di tumore mammario si rivolge al medico per risolvere o attenuare disturbi vasomotori e sessuali, spesso conseguenti al trattamento adiuvante della neoplasia. Lo studio ha dimostrato una significativa riduzione dell'incidenza di fratture vertebrali e non vertebrali, ma è stato sospeso in anticipo per l’eccesso di recidive di carcinoma mammario. Tibolone è stato associato anche a un aumentato rischio di ictus nelle donne anziane (ma non nelle più giovani) (34). Il tibolone non sembra aumentare il rischio di TEV o eventi coronarici (51). Ci sono dati contrastanti in letteratura circa la sicurezza endometriale di tibolone: in un RCT di grandi dimensioni (52) vs. ECE + MAP, il tibolone non ha indotto iperplasia endometriale o carcinoma nelle donne in post-menopausa ed è stato associato a miglior profilo di sanguinamento vaginale.
Il tibolone sembra, inoltre, in grado di migliorare il benessere sessuale in donne in post-menopausa, con aumento di desiderio, eccitazione, soddisfazione, e migliore compliance nei confronti della terapia trans-dermica estro-progestinica (53).
Raloxifene
È un SERM (Selective Estrogen Receptor Modulator), che esercita effetti:
- estrogenici su tessuto osseo, fattori della coagulazione, lipidi, utero, tessuti vaginali e centri cerebrali che controllano le vampate di calore;
- anti-estrogenici sulla mammella.
Come risultato delle sue azioni estrogeniche, il raloxifene a dosaggi di 60 mg/die migliora la BMD (colonna lombare +2.6%; collo del femore +2.1% a 4 anni) (54) e riduce le fratture vertebrali (RR 0.63, IC95% 0.52-0.77), ma non le fratture dell'anca (55).
L'incidenza di episodi di TEV è aumentata (RR 2.76, IC95% 1.30-5.86), anche se non si sono osservati aumenti della patologia coronarica (RR 0.95, IC95% 0.84-1.07) (56) o di ictus (RR 0.91, IC95% 0.58-1.41) (57). È stato osservato un aumento della mortalità da ictus solo nelle donne con un alto rischio in base al punteggio di Framingham (RR 1.75, IC95% 1.01-3.02), ma non in quelle a basso rischio (RR 1.08, IC95% 0.47-2.37)(58).
Come risultato delle sue azioni anti-estrogeniche, le donne trattate con raloxifene per osteoporosi avevano minore incidenza di cancro della mammella, come risulta dallo studio MORE (Multiple Outcomes of Raloxifene)(RR 0.28 IC95% 0.17-0.46) (59). Questo effetto è stato osservato sia nei sottogruppi a basso rischio (RR 0.67, IC95% 0.23-0.92) sia in quelli ad alto rischio (RR 0.33, IC95% 0.16-0.67), come riportato nello studio CORE (Continuing Outcomes Relevant to Evista) (60). La riduzione del rischio di carcinoma mammario invasivo con l’utilizzo di raloxifene è risultata simile all’uso del tamoxifene nello studio STAR (61), ma il tamoxifene riduceva maggiormente il carcinoma in situ. In uno studio caso-controllo (62) è stata osservata una riduzione del rischio di carcinoma endometriale (RR 0.50, IC95% 0.29-0.85) con raloxifene. La frequenza di vampate di calore è risultata aumentata (63).
Ospemifene
L’ospemifene è un SERM (Selective Estrogen Receptor Modulator), che agisce con effetto estrogenico agonista a livello vaginale ed effetto minimo o neutro su altri organi estrogeno-dipendenti (endometrio e mammella). Assunto alla dose giornaliera di 60 mg per os, ha un’emivita di 26 ore, ed è metabolizzato a livello epatico. Negli Stati Uniti è approvato come terapia per la dispareunia moderata/severa in donne in post-menopausa, mentre in Europa è indicato per l’atrofia vaginale moderata/severa nelle donne in post-menopausa che non siano “candidate” alla terapia con estrogeni locali. In studi clinici condotti su oltre 2000 donne in menopausa, l’utilizzo di ospemifene ha evidenziato una riduzione della dispareunia e della secchezza vaginale, con riduzione del pH vaginale e aumento delle cellule superficiali vaginali. È stata anche evidenziata una proliferazione endometriale, ma senza sviluppo di iperplasia o carcinoma endometriale dopo un anno di trattamento alla dose di 60 mg/die. Eventi avversi in corso di terapia possono essere vampate e crampi muscolari. Controindicazioni all’utilizzo sono neoplasie estrogeno-dipendenti (tumore mammario ed endometriale), aumentato rischio o pregressa TEV, infarto del miocardio ed ictus (64).
Complesso tessuto selettivo degli estrogeni (TSEC)
Con questo termine si intende l’associazione di uno o più estrogeni con un SERM. Questa nuova terapia è stata concepita per ottimizzare l’azione di ogni componente in maniera selettiva a livello tessutale, ovvero per minimizzare gli effetti negativi degli estrogeni su endometrio e mammella, mantenendo gli effetti positivi su osso e sintomatologia vasomotoria. Ogni SERM ha la capacità di indurre modificazioni strutturali differenti nel recettore estrogenico, modificazioni che influenzano la capacità del recettore stesso di interagire con co-attivatori o co-repressori coinvolti nella regolazione della trascrizione del gene bersaglio. La differenza nell’azione dei SERM può pertanto essere differente a seconda del recettore interessato, del cofattore, della successiva risposta che può condurre ad attività agonista o antagonista. La variabilità individuale (legata alle differenze fenotipiche degli individui) dell’espressione di coattivatori comporta una variabilità nella risposta tessutale alla terapia.
Tra tutti i SERM il basedoxifene si colloca come antagonista puro degli effetti estrogenici a livello di mammella ed endometrio, e come agonista a livello di osso e vampate, ed è pertanto stato associato agli ECE come trattamento farmacologico approvato in Europa per il trattamento della sintomatologia vasomotoria in donne intolleranti al progestinico. Attualmente è presente in commercio in Italia l’associazione di ECE 0.45 mg + bazedoxifene 20 mg/die (Duavive).
Il TSEC ha dimostrato una significativa efficacia nel ridurre la frequenza e l’intensità delle vampate, nel migliorare la qualità del sonno e la sindrome genito-urinaria. Inoltre, rispetto al placebo si è evidenziato un incremento significativo a 12 mesi della BMD lombare e femorale in donne in menopausa a rischio di frattura, con una riduzione significativa degli indicatori sierici di riassorbimento osseo. Per quanto riguarda tollerabilità e sicurezza, l’associazione di estrogeni e SERM a livello endometriale riduce in modo significativo il sanguinamento, con un tasso cumulativo di amenorrea elevato già dal primo mese di trattamento. Vi sono dati rassicuranti anche sul rischio di iperplasia e carcinoma endometriale dopo 12 e 24 mesi di trattamento, anche se sono necessari ulteriori studi di conferma del dato.
Rispetto al placebo l’utilizzo di TSEC non modifica la densità mammaria. Questo potrebbe avere una rilevanza clinica sul problema del tumore, perché la maggior densità mammaria è un fattore indipendente di rischio ed è associata con minor capacità della mammografia di individuare un tumore. Tuttavia, i dati disponibili sono limitati a due anni di trattamento farmacologico.
Per quanto riguarda l’apparato cardio-vascolare, non pare esserci un rischio additivo di ECE e bazedoxifene ma non è attualmente possibile conoscere il reale rischio di TEV, a causa del basso tasso di eventi in entrambi i gruppi, del ridotto tempo di follow-up e delle incognite sul meccanismo con cui ECE e SERM contribuiscono al rischio di TEV con TSEC.
È segnalata la necessità di precauzioni nell’utilizzo del farmaco in pazienti con BMI > 27 (per la possibile ridotta biodisponibilità del bazedoxifene e il conseguente rischio di iperplasia endometriale) o che utilizzino farmaci inibitori della CYP3A4, a causa dell’imprevedibile assorbimento e biodisponibilità del farmaco, oppure in donne con malattie epatiche/renali, perché il farmaco ha un primo passaggio epatico ed è escreto per via urinaria (65).
TERAPIE ALTERNATIVE
Fito-estrogeni
È così definita qualsiasi molecola non steroidea prodotta dal mondo vegetale che si leghi ai recettori degli estrogeni. Questi composti sono caratterizzati dalla presenza di due gruppi fenolici e presentano numerose analogie strutturali con gli estrogeni naturali, con quelli sintetici e con gli anti-estrogeni.
Gli isoflavoni sono strutturalmente simili al 17ß-estradiolo. Una volta assunti, vengono metabolizzati a daidzeina, che può essere ulteriormente metabolizzata dai batteri intestinali in equolo, un composto stabile che presenta una tipica attività simil-estrogenica. L’effetto simil-estrogenico degli isoflavoni è stato evidenziato soprattutto nelle donne asiatiche in post-menopausa, nelle quali si era osservato che l’abbondante assunzione alimentare era associata a minore incidenza di vampate di calore ed osteoporosi. Ci sono limitate evidenze a supporto del miglioramento della sintomatologia vasomotoria nelle donne di razza caucasica che utilizzino isoflavoni o cimicifuga racemosa. Una recente metanalisi del 2016 su numerosi studi clinici conclude con un’insufficiente evidenza di beneficio sulle vampate della cimicifuga racemosa. Nelle donne con pregresso tumore della mammella le linee guida NICE sconsigliano l’utilizzo di cimicifuga racemosa (66) e di isoflavoni (compreso il trifoglio rosso) (67).
In conclusione, i dati clinici sull’uso dei fito-estrogeni in menopausa dimostrano un insufficiente beneficio sulla sintomatologia vasomotoria, e ne controindicano attualmente l’utilizzo in donne con pregresso tumore mammario.
Anti-depressivi
Le linee guida internazionali EMAS 2015 e NAMS 2015, e le revisioni sistematiche di RCT raccomandano l’utilizzo degli inibitori selettivi della ricaptazione della serotonina (SSRI) e degli inibitori della ricaptazione della serotonina e della noradrenalina (SNRI) per il trattamento non ormonale della sintomatologia vasomotoria. Tuttavia, le linee guida NICE ne sconsigliano l’utilizzo come trattamento di prima linea.
Gli effetti collaterali di questa classe di farmaci sono dose-dipendenti e includono xerostomia, sonnolenza, costipazione e inappetenza.
Fra gli SSRI, quelli che hanno mostrato maggior beneficio sulla sintomatologia vasomotoria si sono rivelati la venlafaxina (da 37.5 mg/die sino al massimo di 150 mg/die), la paroxetina (al dosaggio di 10 mg/die) e il citalopram (al dosaggio di 10-30 mg/die) (66,67). La paroxetina può essere però associata a sindrome da astinenza nel 7% dei casi, un effetto collaterale inaccettabile (68). Inoltre, l’attività del citocromo CYP2D6 (che converte il tamoxifene nei suoi metaboliti attivi) è inibita dagli SSRI, in particolare da paroxetina e fluoxetina, che sono pertanto sconsigliati alle donne con sintomatologia vasomotoria operate per carcinoma mammario, mentre venlafaxina e citalopram hanno minor effetto interferente e possono essere perciò utilizzati (15).
Clonidina
L’alfa2-stimolante centrale clonidina riduce la reattività vascolare ed è l'anti-ipertensivo più studiato nel trattamento dei disturbi della menopausa (registrato anche per questa indicazione).
Dosi orali (0.1 mg/die) e trans-dermiche (1 mg/settimana) riducono in modo lieve, ma significativo (del 30-40%) gli episodi vasomotori, anche in donne mastectomizzate in terapia con anti-estrogeni (69,70).
Gli effetti collaterali sono dose-dipendenti: il maggiore è rappresentato dall’insonnia (in almeno il 50% dei casi). Essendo un anti-ipertensivo, ne é sconsigliato l’utilizzo alle pazienti ipotese (66,67).
Gabapentina
È un anti-epilettico, utilizzato anche per il dolore di tipo neuropatico.
Una revisione della letteratura di 13 RCT ne ha dimostrato l’efficacia (al dosaggio di 300 mg x 3/die) nel ridurre l’entità e il numero delle vampate in donne in menopausa con pregresso tumore mammario. La gabapentina sembra essere più efficace della venlafaxina sulla sintomatologia vasomotoria, ma è generalmente meno tollerata. Gli effetti collaterali sono dose-dipendenti: sonnolenza, capogiri, stanchezza, incremento ponderale (66,67).
Terapie comportamentali
Le terapie cognitive comportamentali riducono significativamente (almeno del 50%) la valutazione dell’impatto negativo della sintomatologia vasomotoria nelle donne con o senza pregresso tumore mammario, con un beneficio che si mantiene almeno per 6 mesi. Inoltre, riducono la frequenza delle sudorazioni notturne nel 39% delle donne in menopausa, fatta eccezione per quelle con pregresso tumore della mammella, il che potrebbe riflettere la differente eziopatogenesi della sintomatologia.
Le linee guida della NAMS raccomandano le terapie cognitive comportamentali per il trattamento della sintomatologia vasomotoria in menopausa (66,67).
Ipnosi
Le linee guida NAMS raccomandano l’ipnosi come trattamento della sintomatologia vasomotoria sulla base di studi clinici randomizzati in donne con e senza pregresso tumore della mammella, che mostrano una riduzione statisticamente significativa della frequenza soggettiva e oggettiva delle vampate (riduzione media del 55.8% dopo 12 settimane) (66,67).
Al contrario, attualmente non sono stati dimostrati benefici statisticamente significativi sulla sintomatologia vasomotoria di meditazione, rilassamento, esercizio fisico o yoga (66,67).
INDICAZIONI PER LA PRATICA CLINICA
Sono necessari i progestinici quando la donna usa gli estrogeni per via topica?
La necessità di associare un progestinico quando la donnea utilizza preparazioni estrogeniche per via vaginale è stata valutata in numerosi studi clinici e in una revisione Cochrane. Le preparazioni studiate comprendono crema e ovuli a base di estriolo, compresse vaginali di estradiolo alle dosi di 25 μg e 10 μg, crema agli ECE in due dosi e anelli vaginali che rilasciano estradiolo. Mentre le preparazioni di estriolo per via topica non sembrano stimolare l’endometrio, sia le preparazioni a base di ECE che quelle a base di estradiolo possono esercitare un effetto dose-dipendente di stimolazione. In una revisione Cochrane del 2006 (71) è stata riportata iperplasia endometriale in due studi in cui venivano utilizzate creme a base di ECE e in nessun caso in un altro studio che utilizzava ovuli all’estriolo. In studi recenti non sono state riscontrate aumentata incidenza di iperplasia o modificazioni dello spessore endometriale dopo 1–2 anni con compresse vaginali di estradiolo alla dose di 10-25 μg o con crema a base di ECE a basso dosaggio. Uno studio di 48 settimane che ha confrontato anello vaginale a rilascio di estradiolo e compresse vaginali di estradiolo alla dose di 25 μg non ha riscontrato modificazioni dello spessore endometriale, ma le utilizzatrici dell’anello avevano minore sanguinamento (72,73).
| Tabella 5 Condizioni particolari e indicazioni della terapia ormonale |
|
| Ipertrigliceridemia severa | Meglio la via trans-dermica |
| Fibromatosi uterina | Preferibile lo schema combinato-continuo o il tibolone |
| Storia di epatopatia o colelitiasi | Valutare prima la funzione epatica e preferire la via trans-dermica |
| Storia di malattie trombo-emboliche | Preferire la via trans-dermica |
| Emicrania e cefalea | Preferire lo schema combinato-continuo trans-dermico |
| Endometriosi | Preferire lo schema combinato-continuo o il tibolone |
Che fare nella donna con menopausa precoce?
Con questo termine, o meglio con quello di insufficienza ovarica precoce (POI), si intende una condizione associata a funzione ovarica residua intermittente, con possibilità anche di gravidanze spontanee in donne giovani, la cui triade diagnostica secondo le recenti linee guida ESHRE è costituita da amenorrea ≥ 4 mesi, sintomatologia da deficit di ormoni sessuali e 2 valori di FSH ≥ 25 UI/L a distanza di almeno 1 mese (74,75). Secondo le ultime linee guida (76,77), la POI è una condizione patologica le cui conseguenze sulla salute devono essere valutate in maniera diversa rispetto a quelle della menopausa fisiologica.
A seconda dell’eziopatogenesi e dell’età di insorgenza della disfunzione ovarica, la POI può presentarsi con amenorrea primaria e funzione riproduttiva già compromessa, oppure con amenorrea secondaria molto precoce o un po’ più tardiva, o come vera e propria menopausa precoce quando insorge oltre i 40 anni ma prima dei 45. Le conseguenze a breve e lungo termine dell’esaurimento ovarico sono sovrapponibili a quelle dovute alla menopausa spontanea, ma queste donne, che sono giovani, presentano inoltre un rischio cardio-vascolare molto aumentato, così come la possibilità di danno osseo, disfunzioni cognitive e aumentato rischio di morte precoce dovuta a qualsiasi patologia. Le possibili co-morbilità sono ancora più rilevanti in quei soggetti che non presentano sintomatologia vasomotoria e per questo motivo temporeggiano nell’assumere un’eventuale terapia sostitutiva. Questa è necessaria e fondamentale per la paziente, ma deve essere personalizzata in base all’età, all’intermittenza e imprevedibilità della funzione ovarica residua, ai bisogni della paziente (eventuale necessità contraccettiva), oltre che rispetto alle cause che hanno determinato la POI (genetiche, iatrogene, autoimmuni, ecc) e ai possibili rischi da esse derivanti (78).
La TOS nelle pazienti con POI è un’efficace terapia per le conseguenze a breve e lungo termine, indicata per prevenire l’osteoporosi, le patologie cardio-vascolari e la sindrome genito-urinaria, e migliorare la qualità di vita. Pertanto, il primo approccio terapeutico nella donna con POI e osteoporosi dev’essere la TOS e non i bisfosfonati. La somministrazione di estrogeni naturali per via trans-dermica permette di ottenere un effetto positivo sul quadro lipidico, sui marcatori dell’infiammazione e sulla pressione arteriosa, un netto miglioramento della funzione endoteliale vascolare, con assenza di effetto soppressivo sui livelli di IGF-I, mentre l’aggiunta del progesterone naturale o del didrogesterone ha un effetto metabolico neutro. La TOS dev’essere somministrata a dosaggi ormonali fisiologici, ed è preferibile al contraccettivo orale (il cui utilizzo deve essere considerato in caso di necessità contraccettiva); dev’essere inoltre proseguita fino all’età fisiologica per la menopausa.
Che fare nella donna con osteoporosi già nota o forte familiarità per osteoporosi?
I principali fattori di rischio per frattura osteoporotica sono rappresentati da ridotta massa ossea, storia di precedenti fratture, età e familiarità per fratture. Le donne candidate al trattamento sono soprattutto quelle con precedenti fratture da fragilità (vertebre, femore, radio e omero) e le donne con riduzione della densità ossea compatibile con osteoporosi (T-score < -2.5). Gli interventi terapeutici devono comprendere un adeguato introito alimentare di calcio e di vitamina D, meglio se sotto forma di dieta equilibrata contenente latte e derivati. La dose giornaliera di calcio raccomandata varia a seconda dell’età, ma è generalmente compresa tra 1000-1500 mg (vedi prevenzione dell’osteoporosi). È opportuno mantenere un BMI non < 19 kg/m2 e seguire stili di vita sani, praticando se possibile esercizio fisico in modo regolare. Per quanto riguarda l’utilizzo di farmaci specifici, vedi capitolo terapia osteoporosi.
La TOS prescritta per il controllo della sintomatologia post-menopausale riduce significativamente il rischio di fratture vertebrali e non vertebrali, incluse quelle di femore. Il dosaggio standard con 0.625 mg/die di ECE (o dosaggi equivalenti di altri composti) riduce il turn-over, aumenta la BMD e riduce il rischio di frattura in tutti i distretti esaminati (vertebre, femore, polso). Diverse preparazioni a basso dosaggio (25 µg E2 trans-dermico, 0.5-1 mg E2 orale, 0.3-0.45 mg ECE orali) hanno dimostrato un effetto positivo su turn-over osseo e BMD, suggerendo un effetto anti-fratturativo simile a quello del dosaggio standard. La FDA ha approvato per la prevenzione dell’osteoporosi un prodotto trans-dermico contenente E2 a un dosaggio pari a 14 µg/die (ultra-low-dose).
Dopo la pubblicazione dello studio WHI, è stata rivalutata con attenzione la raccomandazione all’utilizzo della TOS come terapia di prima scelta per l’osteoporosi (79,80). Attualmente i dati disponibili in letteratura dimostrano che, sebbene la TOS in post-menopausa sia in grado di prevenire le fratture ad ogni età, è fondamentale l’età di inizio del trattamento:
- tra i 50 e i 60 anni (o entro 10 anni dall’ultima mestruazione) i benefici sull’osso sono maggiori (e superano nettamente i rischi); pertanto, in queste pazienti la TOS deve essere considerata come terapia di prima linea. La durata del trattamento deve essere rivalutata periodicamente rispetto all’obiettivo che ci si pone e agli eventuali rischi che possono insorgere all’aumento dell’età, poiché alla cessazione della terapia vi è una quota imprevedibile di perdita di massa ossea, sebbene dopo la cessazione della TOS permanga un certo grado di protezione dalla frattura;
- nella fascia di età 60-70 anni occorre valutare attentamente i rischi correlati alla TOS e preferire l’utilizzo di altri farmaci per il trattamento dell’osteoporosi (6,15).
Che fare nella donna con familiarità per tumore mammario?
Limitati studi osservazionali suggeriscono che la TOS non aumenti ulteriormente il rischio di carcinoma mammario in donne con storia familiare positiva o con pregressa ovariectomia profilattica per mutazioni di BRCA 1 o 2.
Che fare nella donna con pregresso tumore mammario?
È fondamentale la modifica dello stile di vita (abolizione di fumo e alcool, calo ponderale, attività fisica, alimentazione corretta) per migliorare la sintomatologia vasomotoria, la qualità di vita e ridurre il rischio di recidiva (81).
La TOS è controindicata nelle donne con pregresso carcinoma mammario, ma ci sono numerose controversie.
Complessivamente, i risultati degli RCT suggeriscono cautela nell’utilizzo di una TOS con estrogeni orali in donne operate per tumore della mammella, anche se gli studi HABITS (Hormonal replacement therapy After Breast cancer. Is It Safe?) e Stockholm sono stati interrotti prematuramente e hanno rivelato numerosi bias. A causa del limitato numero di studi sulla sicurezza dell’utilizzo di tibolone e TSEC in donne con pregresso tumore della mammella, entrambi i trattamenti sono sconsigliati per queste pazienti (82,83).
Dopo il fallimento delle terapie locali non ormonali e dopo consulto con l’oncologo curante, potrebbe essere preso in considerazione l’uso di una terapia estrogenica locale, preferibilmente con promestriene.
L’uso degli SSRI ha un effetto positivo sulla sintomatologia vasomotoria, ma tali farmaci (soprattutto paroxetina e fluoxetina, ma meno venlafaxina e citalopram) sono controindicati nelle pazienti che assumono tamoxifene, poiché sono potenti inibitori del citocromo CYP2D6.
Il trattamento con laser a livello vaginale è indicato per l’atrofia nelle donne con pregresso carcinoma mammario (mentre è sconsigliato per le pazienti operate per tumore della portio e della vagina).
Che fare nella donna con anamnesi oncologica (diversa da quella mammaria)?
- Carcinoma endometriale: limitati studi indicano che il tumore di basso grado, al primo stadio e tipo I non è una controindicazione assoluta all’utilizzo della TOS, mentre ne è assolutamente sconsigliato l’uso nelle pazienti con carcinoma endometriale avanzato.
- Tumore dell'ovaio: le donne con tumore di tipo epiteliale o a cellule germinali potrebbero avere un beneficio dall’utilizzo della TOS, che è invece controindicata nell’adenocarcinoma di tipo endometrioide e nei tumori ovarici di origine granulosa.
- Tumori cervicali e vulvari a cellule squamose: non sono ormono-dipendenti e non costituiscono quindi una controindicazione alla TOS.
- Tumori ematologici (linfomi/leucemia): l’utilizzo della TOS è consigliato nelle giovani donne che vanno incontro a insufficienza ovarica precoce in seguito a chemioterapia, sebbene sia necessaria un’attenta sorveglianza mammaria in donne con pregresso trattamento radioterapico a livello mediastinico. È preferibile utilizzare in queste pazienti una terapia a basso impatto metabolico (estrogeni trans-dermici e progesterone micronizzato oppure didrogesterone).
- Pregresso carcinoma del colon: limitati studi suggeriscono che la TOS può essere utilizzata nelle donne con sintomatologia vasomotoria.
- Carcinoma polmonare: i dati riguardanti la sicurezza della TOS sono insufficienti e viene consigliata estrema cautela nella somministrazione.
- Melanoma: l’utilizzo della TOS non è controindicato nelle donne con melanoma localizzato, anche se si ipotizza un ruolo diverso per le formulazioni con solo estrogeno e per quelle con progestinico associato (84), ma se ne sconsiglia l’utilizzo nelle pazienti con melanoma metastatico.
In taluni tipi di tumore, qualora la terapia ormonale sistemica sia sconsigliata, potrebbero essere utilizzati gli estrogeni locali a livello vaginale per il trattamento della sindrome genito-urinaria. Tuttavia, sono necessari ulteriori RCT per valutare la possibile associazione tra somministrazione della TOS in donne con alcune patologie tumorali (polmone, melanoma, carcinoma del colon) e rischio di ripresa di malattia. Allo stesso modo è fondamentale ottenere ulteriori dati sul significato della presenza di recettori ormonali di alcuni tumori (polmone, endometrio, melanoma), che potrebbero modificare la decisione nell’utilizzo o meno di TOS nelle donne con queste patologie (83).
Che fare nella donna con fibromi uterini?
I fibromi uterini non rappresentano una controindicazione all’impiego della TOS. È comunque consigliabile valutare sempre prima le loro dimensioni e la sintomatologia della menopausa, con particolare riserva nei confronti dei fibromi sotto-mucosi. Considerare possibilmente uno schema combinato continuo o il tibolone, monitorando eventualmente la possibile modificazione volumetrica del fibroma con ecografia trans-vaginale periodica.
Che fare nella donna con dislipidemia?
Bisogna mirare al controllo dei fattori di rischio cardio-vascolari con mezzi non farmacologici e farmacologici. La terapia con statine non controindica l’uso della TOS.
La terapia estrogenica per os riduce i livelli circolanti di LDL e di Lp(a), aumenta i livelli di HDL e di trigliceridi. I trigliceridi aumentano in maniera dose-dipendente fino al 25% per probabile effetto di induzione epatica (o rallentamento della clearance), mentre non c’è uniformità di vedute circa l’incremento dose-dipendente delle HDL e la riduzione delle LDL in relazione al tipo di estrogeno utilizzato (E2 o ECE). Inoltre, la tipologia di progestinico associato può influenzare questo effetto sino a ridurlo in maniera significativa (come nel caso dei derivati del 19-nortestosterone). Al contrario, il progesterone micronizzato o il didrogesterone non interferiscono con l’azione degli estrogeni orali sul quadro lipidico. La Lp(a) non è influenzata dalla dieta o dall’attività fisica e le sole terapie veramente efficaci nel ridurne i livelli circolanti sono estrogeni e niacina.
Poiché la terapia con estrogeni orali aumenta anche i marcatori infiammatori (come la PCR), prima di intraprendere la terapia è consigliabile definire il rischio cardio-vascolare. Nella donna definita a rischio è opportuno eseguire al basale e durante il follow-up profilo lipidico completo, CPK, γGT (se statine); sulla base del rischio individuale, valutare se effettuare ulteriori esami, come omocisteina, PCR (marcatore di danno vascolare e infiammatorio) ed eco-colordoppler dei tronchi sovra-aortici.
Poiché la via di somministrazione della TOS condiziona la sua efficacia sul metabolismo delle lipoproteine, nelle donne con ipertrigliceridemia è preferibile un trattamento con estrogeni trans-dermici a basso dosaggio.
Che fare nella donna ipertesa?
Il trattamento farmacologico con anti-ipertensivi non controindica generalmente l’uso della TOS, ove non sia presente danno d’organo.
La via di somministrazione della terapia ormonale é importante nel caso in cui si voglia trattare una donna ipertesa (grado lieve-medio) o con valori pressori borderline: in questi casi è preferibile la via trans-dermica in associazione a un progestinico con profilo farmacologico più simile al progesterone naturale.
Che fare nella donna diabetica?
Il diabete compensato non controindica l’uso della TOS se la paziente è sintomatica. Si dovrebbe preferire una TOS per via trans-dermica con estrogeno a basso dosaggio in associazione al progesterone naturale. Inoltre, le donne con diabete mellito tipo 2 dovrebbero essere rassicurate rispetto all’assenza di interferenza della TOS sui livelli glicemici, e sull’assenza di effetti collaterali particolari, in assenza di complicanze diabetiche già presenti.
Che fare nella donna obesa?
L’obesità costituisce da sola un fattore di rischio cardio-vascolare. Le donne obese hanno, rispetto a quelle di peso normale, un aumento di mortalità per cancro dell’endometrio, cervice, vescica, colon, ovaio e in post-menopausa per la mammella. La carenza estrogenica può essere alla base degli sfavorevoli cambiamenti nella distribuzione (androide) del grasso corporeo in menopausa. L’uso della TOS tende a migliorare la distribuzione del grasso corporeo, mantenendo una distribuzione di tipo ginoide, anche se tale dato non è stato confermato. Ovviamente deve essere associato un adeguato programma dietetico, con riduzione dell’introito calorico, e l’attività fisica.
Le raccomandazioni IMS 2016 (15) consigliano la somministrazione di estrogeni per via trans-dermica nelle donne obese con sintomatologia vasomotoria, preferendo l’associazione con progesterone naturale. Le donne obese devono essere monitorate per il carcinoma endometriale.
Che fare nella donna con trombofilia nota o pregressa patologia trombo-embolica?
La condizione di trombofilia può essere ereditaria (mutazione del fattore V Leiden o della protrombina, deficit di AT III o di proteina C o S coagulative, ecc) e/o acquisita (invecchiamento, obesità, fumo, malattie croniche intestinali, sindrome da anticorpi anti-fosfolipidi, ecc).
Il rischio trombotico attribuibile alla TOS è differente a seconda della via di somministrazione, della dose giornaliera e della struttura chimica del composto estrogenico e dalla classe farmacologica del progestinico associato.
Gli estrogeni somministrati per os, a causa del loro effetto di “primo passaggio epatico”, causano una modificazione delle proteine della coagulazione, con riduzione delle proteine C ed S coagulative e dei livelli plasmatici di AT III e APC ratio, e contemporaneo aumento del D-dimero, del fattore VII coagulativo e della produzione di trombina, che comportano un aumentato rischio di eventi trombotici. Si è dimostrato invece che la somministrazione trans-dermica degli estrogeni non ha effetto sui marcatori della coagulazione e della fibrinolisi (34,85). Le pazienti con mutazione del fattore V o della protrombina presentano un rischio personale di sviluppare un evento trombo-embolico triplicato-quadruplicato rispetto alla popolazione generale. Nel caso di utilizzo di TOS con somministrazione di estrogeni per via trans-dermica questo rischio resta invariato, mentre la somministrazione di estrogeni per via orale ne moltiplica il rischio x 13 oppure x 25, a seconda degli studi considerati (84-86).
Inoltre l’associazione con progestinici di sintesi, specialmente il MAP, pare a maggior rischio di TEV rispetto all’associazione con progesterone micronizzato, anche se necessitano ulteriori studi per la conferma del dato.
Per la prescrizione della TOS è necessario escludere eventi trombotici e/o ischemici nell’anamnesi personale e familiare. Non è indicato effettuare lo screening trombofilico se l’anamnesi è muta. In caso di trombofilia (APCR, fattore V di Leiden, deficit proteina C, proteina S-libera e antitrombina III, protrombina), la TOS è da valutare attentamente in base all’età della paziente, alle indicazioni al trattamento, al bilancio tra rischio e beneficio e alla tipologia di preparato e via di somministrazione dell’eventuale TOS prescritta.
Che fare nella donna con epatopatia?
La malattia epatica cronica con normali test di funzionalità epatica non è una controindicazione alla terapia ormonale, ma ovviamente si preferisce la via trans-dermica. Anche in questo caso, la scelta di effettuare una TOS dipende dall’età, dalla patologia di base e dal bilancio rischio/beneficio. Ad esempio nelle pazienti con insufficienza ovarica precoce per patologia genetica (s. di Turner), in cui coesistono alterazioni del quadro epatico, la TOS è assolutamente indicata. In queste donne, in cui possono coesistere ulteriori fattori di rischio (anomalie cardio-vascolari, ipertensione, ipertrigliceridemia, obesità, sindrome metabolica, ecc) è preferibile l’utilizzo di una TOS a impatto metabolico neutro rispetto alla somministrazione di estrogeni per os (87).
Il danno epatico presente nelle pazienti con Thalassemia Major, che spesso incorrono in amenorrea secondaria ipogonadotropa a causa dell’accumulo ipofisario di ferro, è sovente data dall’associazione di un danno da accumulo marziale con epatopatia HCV-correlata. Questi fattori espongono le pazienti a maggior rischio trombotico, dovuto a deficit di AT III, proteine C ed S coagulative, aumento dei livelli plasmatici di D-dimero, oltre alla presenza di un danno vascolare endoteliale correlato all’emolisi. Per queste donne è fortemente controindicato sia l’utilizzo di un contraccettivo orale che di una TOS con somministrazione di estrogeni per os. Al contrario, la somministrazione di estrogeni trans-dermici associati a didrogesterone o progesterone micronizzato consente la presenza di flussi mestruali regolari, senza modificazione del rischio trombotico né impatto negativo a livello epatico (88).
Uno studio meno recente su donne in menopausa con epatite C cronica dimostra inoltre una minor evoluzione in fibrosi delle cellule epatiche nelle donne in terapia sostitutiva, ipotizzando un ruolo inibitorio degli estrogeni sulla trasformazione miofibroblastica delle cellule stellate (89).
In casi dubbi o con pluri-patologia è necessario un approccio multi-disciplinare.
Che fare nella donna che fuma?
Nello studio WHI il 50% delle 8.500 donne in TOS aveva fumato prima o continuato a fumare durante lo studio. È stato dimostrato che il fumo può ridurre o annullare completamente l'efficacia degli estrogeni somministrati per via orale, a seconda della durata e dell'intensità del consumo di nicotina. Il fumo è responsabile di circa la metà di tutte le morti evitabili e costituisce un importante fattore di rischio cardio-vascolare. La cessazione del fumo di sigaretta riduce del 50-65% il rischio di malattia coronarica, con annullamento dopo 2-3 anni e riduzione del 25% della mortalità. Nella patogenesi dell’osteoporosi il fumo riveste un ruolo importante, poichè è in grado di agire direttamente sull’osso, inibendo l’attività osteoblastica e alterando il micro-circolo. Il fumo determina un ipoestrogenismo relativo, con aumento dei livelli di androgeni e distribuzione del tessuto adiposo di tipo centrale, può anticipare l’epoca della menopausa e causare una sintomatologia vasomotoria più intensa e meno responsiva alla TOS per l’accelerato metabolismo degli estrogeni.
È stato osservato che gli effetti favorevoli della TOS con gli estrogeni non si riducono se somministrati per via trans-dermica nelle donne fumatrici. Questo tipo di terapia consente non solo un utilizzo degli estrogeni a più basso dosaggio, ma evita anche la formazione di metaboliti non fisiologici by-passando il fegato.
Sebbene alcuni studi caso-controllo sembrassero dimostrare un ruolo protettivo della TOS verso il tumore del polmone, soprattutto adenocarcinoma (OR 0.79, IC95% 0.66-0.95) e microcitoma (OR 0.37, IC95% 0.19-0.71), una recente metanalisi non ha confermato tale evidenza. Pertanto, considerati anche gli effetti dannosi CV del fumo, è prudente raccomandare alle donne che iniziano un trattamento sostitutivo di smettere di fumare (90,91). Le donne che, nonostante tutti gli avvertimenti, continuano a fumare dovrebbero essere trattate con TOS per via trans-dermica (92).
CONCLUSIONI E RACCOMANDAZIONI PER LA PRATICA CLINICA (6,14,15,23,76,77,93,94)
- La modificazione dello stile di vita è essenziale: in tutte le donne in menopausa è consigliabile evitare il fumo, praticare regolare attività fisica, evitare il consumo di alcool, evitare i cibi piccanti, ridurre lo stress, ridurre il sovrappeso.
- Prima di intraprendere un percorso terapeutico farmacologico, è consigliabile farlo precedere da interventi di “counseling”, spiegando i vantaggi e gli eventuali svantaggi della terapia e condividendo il tipo di farmaco da utilizzare, il dosaggio e la via di somministrazione.
- La terapia ormonale sostitutiva (TOS) rappresenta il trattamento più efficace per ridurre i sintomi della menopausa, dai sintomi vasomotori alla sindrome genito-urinaria a quelli dell’umore.
- I benefici superano i rischi se la terapia viene intrapresa prima dei 60 anni e a meno di 10 dall’inizio della menopausa, dopo avere escluso la presenza di contro-indicazioni.
- La TOS deve essere personalizzata in funzione delle caratteristiche individuali della donna, della storia personale e familiare, dei risultati degli eventuali esami clinici strumentali, delle preferenze e delle aspettative, oltre che della sintomatologia prevalente.
- Non esiste un dosaggio o una terapia ideale, adatta per tutte le donne a qualsiasi età. Ogni combinazione può avere caratteristiche peculiari che possono essere opportunamente utilizzate. I farmaci oggi a nostra disposizione consentono di personalizzare la terapia, modificando il dosaggio, la scelta del progestinico e la via di somministrazione, in base alle caratteristiche, agli obiettivi che si vogliono raggiungere e alle preferenze di ogni singola donna, per garantire efficacia e sicurezza.
- La dose da impiegare è la minima efficace, iniziando con dosi basse per poi eventualmente modificarle in funzione della risposta clinica e della possibile comparsa di effetti collaterali da sovra-dosaggio.
- Per quanto riguarda il tempo di utilizzo della TOS, non vi è alcuna indicazione a porre tassative limitazioni: la decisione di continuare o sospendere la terapia dipende dalle condizioni individuali della donna e dagli obiettivi clinici che si vogliono raggiungere. In assenza di contro-indicazioni, la TOS potrà essere utilizzata fintanto che la donna ne trarrà benefici e soprattutto se questi supereranno i rischi.
- L’insufficienza ovarica precoce deve essere considerata una patologia, le cui conseguenze sulla salute devono essere valutate in maniera diversa rispetto a quelle della menopausa fisiologica. Pertanto, la TOS deve essere considerata il primo approccio terapeutico e deve essere proseguita fino all’età fisiologica per la menopausa.
- Per le donne che non possono o non vogliono usare la TOS, dopo i cambiamenti dello stile di vita le terapie alternative rappresentano una possibile opzione, i cui dati di efficacia nella maggior parte dei casi sono limitati dalla mancanza di studi clinici controllati con placebo.
BIBLIOGRAFIA
- Grodstein F, Manson JE, Stampfer MJ. Postmenopausal hormone use and secondary prevention of coronary events in the nurses' health study, a prospective, observational study. Ann Intern Med 2001, 135: 1-8.
- Rossouw JE, Anderson GL, Prentice RL, et al. Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial. JAMA 2002, 288: 321-33.
- Beral V, Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003, 362: 419-27.
- Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA 2007, 297: 1465-77.
- Fournier A, Berrino F, Clavel-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat 2008, 107: 103-11.
- Gambacciani M, Biglia N, Cagnacci A, et al. Menopause and hormone replacement therapy. The 2017 recommendations of the Italian Menopause Society. Minerva Ginecol 2018, 70: 27-34.
- Moegele M, Buchholz S, Seitz S, et al. Vaginal estrogen therapy for patients with breast cancer. Geburtshilfe Frauenheilkd 2013, 73: 1017–22.
- Del Pup L, Di Francia R, Cavaliere C, et al. Promestriene, a specific topic estrogen. Review of 40 years of vaginal atrophy treatment: is it safe even in cancer patients? Anticancer Drugs 2013, 24: 989-98.
- Nelson HD. Commonly used types of postmenopausal estrogen for treatment of hot flashes: scientific review. JAMA 2004, 291: 1610–20.
- Maclennan AH, Broadbent JL, Lester S, et al. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database Syst Rev 2004, 4: CD002978.
- Bachmann GA, Schaefers M, Uddin A, et al. Lowest effective transdermal 17ß-estradiol dose for relief of hot flushes in postmenopausal women: a randomized controlled trial. Obstet Gynecol 2007, 110: 771–9.
- Loprinzi CL, Sloan J, Stearns V, et al. Newer antidepressants and gabapentin for hot flashes: an individual patient pooled analysis. J Clin Oncol 2009, 27: 2831–7.
- Wierman ME, Arlt W, Basson R et al. Androgen therapy in women, a reappraisal: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2014, 99: 3489-510.
- National Institute for Health and Care Excellence (UK). National Collaborating Centre for Women's and Children's Health (UK). Menopause Full Guideline. London 2015.
- Baber RJ, Panay N, Fenton A, and the IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone replacement therapy. Climacteric 2016, 19: 109-50.
- Althuser LL. The use of SSRI in depressive disorders in women. Clin Psych 2002, 63 suppl 7: 3-8.
- Burt VK, Hendrick VC. Women’s mental health II Ed. APA Publishing, Washington, DC: 2001.
- Pickar JH, Archer DF, Kagan R, et al. Safety and benefit considerations for menopausal hormone therapy. Expert Opin Drug Saf 2017, 16: 941-54.
- Shumaker SA, Legault C, Rapp SR, et al (WHIMS Investigators). Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women’s Health Initiative Memory Study; a randomized controlled trial. JAMA 2003, 289: 2651-62.
- Kang JH, Weuve J, Grodstein F. Postmenopausal hormone therapy and risk of cognitive decline in community-dwelling aging women. Neurology 2004, 63: 101-7.
- Greendale GA, Huang MH, Wight RG, et al. Effects of the menopause transition and hormone use on cognitive performance in midlife women. Neurology 2009, 72: 1850-7.
- Resnick SM, Maki PM, Rapp SR, et al. Effects of combination estrogen plus progestin hormone treatment on cognition and affect. J Clin Endocrinol Metab 2006, 91: 1802-10.
- Cobin RC, Goodman NG. American Association of Clinical Endocrinologists and American College of Endocrinology Position Statement on Menopause-2017 Update. Endocr Pract 2017, 23: 869-80.
- Lobo RA, Pickar JH, Stevenson JC et al. Back to the future: hormone replacement therapy as part of a prevention strategy for women at the onset of menopause. Atherosclerosis 2016, 254: 296-304.
- Lobo RA. Hormone-replacement therapy: current thinking. Nat Rev Endocrinol 2017, 13: 220-31.
- Grodstein F, Manson JE, Stampfer MJ, et al. Postmenopausal hormone therapy and stroke: role of time since menopause and age at initiation of hormone therapy. Arch Intern Med 2008, 168: 861-6.
- Arana A, Varas C, Gonzalez-Perez A, et al. Hormone therapy and cerebrovascular events: a population-based nested case-control study. Menopause 2006, 13: 730-6.
- Lobo RA. The risk of stroke in postmenopausal women receiving hormonal therapy. Climacteric 2009, 12 suppl 1: 81-5.
- Lisabeth L, Bushnell C. Stroke risk in women: the role of menopause and hormone therapy. Lancet Neurol 2012, 11: 82-91.
- Simon JA, Hsia J, Cauley JA, et al. Postmenopausal hormone therapy and risk of stroke: the Heart and Estrogen-progestin Replacement Study (HERS). Circulation 2001, 103: 638-42.
- Viscoli CM, Brass LM, Kernan WN, et al. A clinical trial of estrogen-replacement therapy after ischemic stroke. N Engl J Med 2001, 345: 1243-9.
- Vickers MR, MacLennan AH, Lawton B, et al. Main morbidities recorded in Women’s International Study of long Duration Oestrogen after Menopause (WISDOM): a randomised controlled trial of hormone replacement therapy in postmenopausal women. BMJ 2007, 335: 239-51.
- Grodstein F, Manson JE, Colditz GA, et al. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann Intern Med 2000, 133: 933-41.
- Rott H. Prevention and treatment of venous thromboembolism during HRT: current perspectives. Int J Gen Med 2014, 7: 433-40.
- Jordan VC, Ford LG. Paradoxical clinical effect of estrogen on breast cancer risk: a new biology of estrogen-induced apoptosis. Cancer Prev Res (Phila) 2011, 4: 633-7.
- Beral V, Reeves G, Bull D, et al, for the Million Women Study Collaborators. Breast cancer risk in relation to the interval between menopause and starting hormone therapy. J Natl Cancer Inst 2011, 103: 296-305.
- Colditz GA, Hankinson SE, Hunter DJ, et al. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N Engl J Med 1995, 332: 1589-93.
- Chen W, Manson J, Hankinson S, et al. Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med 2006, 166: 1027-32.
- World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Acute myocardial infarction and combined oral contraceptives: results of an international multicentre case-control study. Lancet 1997, 349: 1202-9.
- Kaufman DW, Kelly JP, Welch WR, et al. Noncontraceptive estrogen use and epithelial ovarian cancer. Am J Epidemiol 1989, 130: 1142-51.
- Sit AS, Modugno F, Weissfeld JL, et al. Hormone replacement therapy formulations and risk of epithelial ovarian carcinoma. Gynecol Oncol 2002, 86: 118-23.
- Weiss NS, Lyon JL, Krishnamurthy S, et al. Noncontraceptive estrogen use and the occurrence of ovarian cancer. J Natl Cancer Inst 1982, 68: 95-8.
- Mørch LS, Løkkegaard E, Andreasen AH, et al. Hormone therapy and ovarian cancer. JAMA 2009, 302: 298-305.
- Lacey JV Jr, Brinton LA, Leitzmann, et al. Menopausal hormone therapy and ovarian cancer risk in the National Institutes of Health-AARP Diet and Health Study Cohort. J Natl Cancer Inst 2006, 98: 1397-405.
- Greiser CM, Greiser EM, Dören M. Menopausal hormone therapy and risk of ovarian cancer: systematic review and meta-analysis. Hum Reprod Update 2007, 13: 453-63.
- Zhou B, Sun Q, Cong R, et al. Hormone replacement therapy and ovarian cancer risk: a meta-analysis. Gynecol Oncol 2008, 108: 641-51.
- Grady D, Gebretsadik T, Kerlikowske K, et al. Hormone replacement therapy and endometrial cancer risk: a meta-analysis. Obstet Gynecol 1995, 85: 304-13.
- Cummings SR, et al. for the LIFT Trial Investigators. The effects of tibolone in older postmenopausal women. N Engl J Med 2008, 359: 697-708.
- Cummings SR for LIFT Steering Committee. LIFT study is discontinued. BMJ 2006, 332: 667.
- Kenemans P, et al. Safety and efficacy of tibolone in breast cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. Lancet Oncol 2009, 10: 135-46.
- Winkler UH, Altkemper R, Kwee B, et al. Effects of tibolone and continuous combined hormone replacement therapy on parameters in the clotting cascade: a multicenter, double-blind, randomized study. Fertil Steril 2000, 74: 10–9.
- Archer DF, Hendrix S, Gallagher JC, et al. Endometrial effects of tibolone. J Clin Endocrinol Metab 2007, 92: 911–8.
- Nijland EA, Weijmar Schultz WC, et al. Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trail. J Sex Med 2008, 5: 646–56.
- Delmas PD, Davis SR, Hensen J, et al. Effects of tibolone and raloxifene on bone mineral density in osteopenic postmenopausal women. Osteoporos Int 2008, 19: 1153–60.
- Delmas PD, Ensrud KE, Adachi JD, et al. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical trial. J Clin Endocrinol Metab 2002, 87: 3609–17.
- Collins P, Mosca L, Geiger MJ, et al. Effects of the selective estrogen receptor modulator raloxifene on coronary outcomes in the Raloxifene Use for The Heart trial: results of subgroup analyses by age and other factors. Circulation 2009, 119: 922–30.
- Barrett-Connor E, Grady D, Sashegyi A, et al. Raloxifene and cardiovascular events in osteoporotic postmenopausal women: four-year results from the MORE (Multiple Outcomes of Raloxifene Evaluation) randomized trial. JAMA 2002, 287: 847–57.
- Barrett-Connor E, Cox DA, Song J, et al. Raloxifene and risk for stroke based on the Framingham Stroke Risk Score. Am J Med 2009, 122: 754–61.
- Cauley JA, Norton L, Lippman ME, et al. Continued breast cancer risk reduction in postmenopausal women treated with raloxifene: 4-year results from the MORE trial. Multiple Outcomes of Raloxifene Evaluation. Breast Cancer Res Treat 2001, 65: 125–34.
- Lippman ME, Cummings SR, Disch DP, et al. Effect of raloxifene on the incidence of invasive breast cancer in postmenopausal women with osteoporosis categorized by breast cancer risk. Clin Cancer Res 2006, 12: 5242–7.
- Vogel VG, Costantino JP, Wickerham DL, et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA 2006, 295: 2727–41.
- De Michele A, Troxel AB, Berlin JA, et al. Impact of raloxifene or tamoxifen use on endometrial cancer risk: a population-based case-control study. J Clin Oncol 2008, 26: 4151–9.
- Cranney A, Adachi JD. Benefit-risk assessment of raloxifene in postmenopausal osteoporosis. Drug Safety 2005, 28: 721–30.
- Palacios S, Mejias A. An update on drugs for the treatment of menopausal symptoms. Expert Opin Pharmacother 2015, 16: 2437-47.
- NICE Guidelines. Oestrogen deficiency symptoms in postmenopausal women: conjugated oestrogen and basedoxifene acetate. December 2016.
- Hickey M, Szabo RA, Hunter MS. Non-hormonal treatments for menopausal symptoms. BMJ 2017, 359: j5101.
- Woyka J. Consensus statement for non-hormonal-based treatments for menopausal symptoms. Post Reprod Health 2017, 23: 71-5.
- Tonks A. Withdrawal from paroxetine can be severe, warns FDA. BMJ 2002, 324: 260.
- Rymer J, Morris EP. Extracts from "Clinical Evidence": Menopausal symptoms. BMJ 2000, 321: 1516-9.
- Pandya KJ, Raubertas RF, Flynn PJ, et al. Oral clonidine in postmenopausal patients with breast cancer experiencing tamoxifen-induced hot flashes: a University of Rochester Cancer Center Community Clinical Oncology Program study. Ann Intern Med 2000, 132: 788-93.
- Suckling J, Kennedy R, Lethaby A, et al. Local oestrogen therapy for vaginal atrophy in post menopausal women. Cochrane Database Syst Rev 2006, Issue 4: CD 001500.
- Ulrich L, Naessen T, Elia D, et al. Endometrial safety of ultra-low-dose Vagifem 10 μg in postmenopausal women with vaginal atrophy. Climacteric 2010, 13: 228–37.
- Weisberg E, Ayton R, Darling G, et al. Endometrial and vaginal effects of low-dose estradiol delivered by vaginal ring or vaginal tablet. Climacteric 2005, 8: 83–92.
- ESHRE Guideline Group on POI, et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod 2016, 31: 926-37.
- Ebrahimi M, Asbagh FA, Pathogenesis and causes of premature ovarian failure: an update. Int J Fertil Steril 2011, 5: 54-65.
- Committee on Gynecologic Practice. Hormone therapy in primary ovarian insufficiency. Obstet Gynecol 2017, 129: e134-41.
- Hamoda H. The British Menopause Society and Women’s Health Concern recommendations on the management of women with premature ovarian insufficiency. Post Reproductive Health 2017, 23: 22-35.
- Nguyen HH. Premature ovarian insufficiency in general practice: meeting the needs of women. Aust Fam Physician 2017, 46: 360-6.
- Ettinger B, Genant HK, Cann CE. Postmenopausal bone loss is prevented by treatment with low-dosage estrogen with calcium. Ann Int Med 1987, 104: 40-5.
- Ettinger B, Genant HK, Steiger P, Madvig P. Low-dosage micronized 17ß-estradiol prevents bone loss in post-menopausal women. Am J Obstet Gynecol 1992, 166: 479-88.
- Santen RJ, Steunkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab 2017, 102: 3647-6
- Garrido Oyarzùn MF, Castelo-Branco C. Use of hormone therapy for menopausal symptoms and quality of life in breast cancer survivors. Safe and ethical? Gynecol Endocrinol 2017, 33: 10-5.
- Kuhle CL, Kapoor E, Sood R et al. Menopausal hormone therapy in cancer survivors: a narrative review of the literature. Maturitas 2016, 92: 86-96.
- Botteri E, Steer NC, Sakshaug S, et al. Menopausal hormone therapy and risk of melanoma: do estrogen and progestins have a different role? Int J Cancer 2017, 141: 1763-70.
- Canonico M. Hormone therapy and hemostasis among postmenopausal women: a review. Menopause 2014, 21: 753-62.
- Lekovic D, Miljic P, Dmitrovic A, Thachil J. How do you decide on hormone replacement therapy in women with risk of venous thromboembolism? Blood Rev 2017, 31: 151-7.
- Pinsker JE. Turner Syndrome: updating the paradigm of clinical care. J Clin Endocrinol Metab 2012, 97: E994-1003.
- Ambroggio S, Peris C, Picardo E, et al. ß-Thalassemia patients and gynecological approach: review and clinical experience. Gynecol Endocrinol 2016, 32: 171-6.
- Codes L, Asselah T, Cazals-Hatem D, et al. Liver fibrosis in women with cronic hepatitis C: evidence for the negative role of menopause and steatosis and the potential benefit of hormone replacement therapy. Gut 2007, 56: 390-5.
- Pesatori AC, Carugno M, Consonni D, et al. Hormone use and risk for lung cancer: a pooled analysis from the International Lung Cancer Consortium (ILCCO). Br J Cancer 2013, 109: 1954-64.
- Bae JM, Kim EH. Hormonal replacement therapy and the risk of lung cancer in women: an adaptative meta-analysis of cohort studies. J Prev Med Public Health 2015, 48: 280-6.
- Mueck AO, Seeger H. Smoking, estradiol metabolism and hormone replacement therapy. Curr Med Chem Cardiovasc Hematol Agents 2005, 3: 45-54.
- The 2012 Hormone Therapy Position Statement of The North American Menopause Society. Menopause 2012, 19: 257-71.
- Santen RJ, Allred DC, Ardoin SP, et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab 2010, 95 (7 Suppl 1): s1-s66.
Classificazione delle amenorree e dei disturbi del ciclo
Costanzo Moretti * & Fedra Mori **
*Cattedra di Endocrinologia, Università di Torvergata, Roma
**UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
L’amenorrea (assenza di flussi mestruali) in una donna in fase fertile è una condizione che può essere transitoria, intermittente o permanente, derivante da una disfunzione dell'unità ipotalamo-ipofisaria, delle ovaie, dell’utero o della vagina. Infatti, mentre la presenza di un ciclo mestruale regolare può essere interpretata come il segno di un “buono stato di salute” (1), i disordini del ciclo mestruale possono rappresentare l’epifenomeno di altre patologie ed una diagnosi precoce diventa fondamentale anche per prevenire le complicanze legate all’amenorrea (2-3).
La definizione di amenorrea è correlata all’età in cui essa si manifesta, essendo classicamente divisa in:
- primaria - assenza di menarca, cioè di cicli mestruali, in un'adolescente di età uguale/superiore ai 15 anni che presenta caratteri sessuali secondari, oppure assenza di flussi mestruali spontanei in una ragazza di età uguale o superiore ai 13 anni, che non mostra segni di sviluppo puberale.
- secondaria – scomparsa di cicli mestruali per più di tre mesi in una donna con precedenti cicli regolari o per più di 6 mesi, nel caso in cui i cicli precedenti siano irregolari.
Questa suddivisione non tiene però conto del fatto che qualsiasi causa di amenorrea secondaria (compresa la gravidanza) può essere responsabile anche di amenorrea primaria, una condizione per la quale tuttavia sono più probabili problematiche genetiche od anatomiche.
CLASSIFICAZIONE EZIOLOGICA
In accordo con la American Society for Reproductive Medicine, proponiamo una classificazione eziologica dell’amenorrea (4) (escluse le condizioni congenite di ambiguità dei genitali), che ha il vantaggio di fornire i presupposti per un più agevole approccio clinico:
- Difetti anatomici dei genitali interni (outflow tract)
- Ipogonadismo primario
- Cause ipotalamiche
- Cause ipofisarie
- Disordini di altre ghiandole endocrine
- Cause multifattoriali
1) Difetti anatomici
In questo gruppo sono comprese tutte quelle condizioni di amenorrea primaria associata allo sviluppo di normali caratteri sessuali secondari.
Difetti anatomici con cariotipo XX
- Sindrome di Mayer-Rokitanski-Kuster-Hauser (Agenesia Mulleriana) (5): aplasia o ipoplasia dell’utero e dei 2/3 superiori della vagina. Generalmente la diagnosi viene posta quando l’adolescente si rivolge al ginecologo per la difficoltà/impossibilità ad avere un rapporto sessuale oppure, nei casi di abbozzi uterini con endometrio funzionante, per la comparsa di dolori addominali
- Imene imperforato, setto vaginale trasverso, agenesia/disgenesia cervicale, sinechie intrauterine (sindrome di Asherman) (6)
Difetti anatomici con cariotipo XY
- Sindrome da insensibilità completa agli androgeni (CAIS) (7): disordine recessivo legato al cromosoma X, dovuto ad alterazioni strutturali del recettore per gli androgeni, che comporta assenza di sviluppo dei caratteri sessuali maschili che sono testosterone-dipendenti. In questo caso i genitali esterni sono tipicamente femminili, con mancato sviluppo di utero e cervice, ma sono palpabili i testicoli in area inguinale.
- Deficit di 5α-reduttasi: il disordine legato a questo difetto comporta fenotipo sessuale femminile o genitali ambigui. Alla pubertà è presente una iniziale virilizzazione, ma per l'impossibilità di convertire il testosterone a diidro-testosterone (DHT) è assente la mascolinizzazione DHT-dipendente (8).
- Sindrome “vanishing testis”: questa sindrome si verifica in soggetti 46,XY che presentano un fenotipo femminile, assenza di sviluppo gonadico (gonadi rudimentali) e dunque assenza di produzione di testosterone, estrogeni o ormone antimulleriano (AMH) (9).
2) Ipogonadismo primario (ipergonadotropo)
Si tratta di una condizione caratterizzata da una'insufficiente/assente attività ovarica, con conseguente incremento delle gonadotropine. Sviluppo mammario e peluria sessuale possono essere presenti o assenti in funzione dell’epoca di comparsa dell’ipogonadismo, che può comportare sia amenorrea primaria che secondaria.
Disgenesia gonadica
In questa classe sono comprese una serie di condizioni nelle quali si osserva anomalo sviluppo gonadico (streak gonads), associato a precoce esaurimento del patrimonio ovocitario e follicolare. Le pazienti affette presentano generalmente amenorrea primaria e sviluppo variabile dei caratteri sessuali secondari.
- Sindrome di Turner X0: si presenta con assente o ridotto sviluppo dei caratteri sessuali secondari, genitali esterni ed interni di tipo femminile, bassa statura, amenorrea primaria e una serie di anomalie somatiche, viscerali e scheletriche (10). Circa il 30% delle ragazze affette inizia la pubertà spontaneamente ed una piccola minoranza arriva fino al menarca (11). Oltre alla variabile classica della sindrome di Turner, sono presenti i mosaicismi e le microdelezioni. In presenza di microdelezioni, lo studio del cariotipo mostra assetto cromosomico normale di tipo femminile (46, XX), perché la metodica non possiede abbastanza sensibilità per cogliere piccole perdite di tessuto cromatinico. Pertanto, se il sospetto di disgenesia gonadica è fondato, bisogna ricorrere all’utilizzo di tecniche più avanzate, come la FISH.
- Disgenesia gonadica XX: sebbene nella maggior parte dei casi l’eziologia rimanga sconosciuta, sono stati implicati diversi geni quali FSH-R, PMP15, NR5A1 (12). Le pazienti si differenziano clinicamente dalla sindrome di Turner perché presentano alta statura.
- Disgenesia gonadica XY (Sindrome di Swyer): pazienti con fenotipo e genitali esterni/interni di tipo femminile e cariotipo XY. Nel 15-30% dei casi si osserva una mutazione di SRY (sex determining region of Y chromosome) o un'alterazione del cromosoma Y (13).
Insufficienza ovarica prematura (POF)
La diagnosi viene formulata in presenza di amenorrea (che può anche essere primaria), elevati livelli plasmatici di FSH e ridotti livelli plasmatici di estrogeni, in donne di età inferiore ai 40 anni. La patogenesi può essere varia.
- Cause genetiche, con coinvolgimento del cromosoma X, di autosomi o di singoli geni. Tra i singoli geni interessati, certamente è necessario ricordare FMR1, localizzato sul braccio lungo del cromosoma X (16). In base al numero di triplette CGG in posizione 5’UTR si riconoscono tre alleli: normale (da 6 a 55 triplette), premutato (da 55 a 200 triplette) e mutato (> 200 triplette). Le conseguenze della completa mutazione di FMR1 sono rappresentate dalla sindrome dell’X fragile, mentre la premutazione si osserva nel 20-28% dei casi di insufficienza ovarica prematura (16).
- Sindrome di Turner: donne con mosaicismo (45 X0/XX) possono avere menarca, le mestruazioni possono essere presenti per diversi anni e può anche verificarsi gravidanza (11).
- Trisomia X: si presenta con particolari caratteristiche cliniche (epicanto, ipertelorismo, clinodattilia, dita sovrapposte, petto escavato, ipotonia ed iperestensibilità delle articolazioni) e talvolta anomalie genito-urinarie (14).
- Riarrangiamenti, traslocazioni o delezioni del cromosoma X nei quali venga soprattutto coinvolta la regione Xq13.3-q27 (tabella 1) (15).
- Autoimmunità: la POF può essere associata ad insufficienza surrenalica come si osserva nelle sindromi polighiandolari autoimmuni di tipo I e II, oppure può essere associata a tireopatia autoimmune, anticorpi contro la parete gastrica e il recettore per l'acetil-colina, diabete tipo 1. Nelle ooforiti autoimmuni la fertilità può essere parzialmente conservata e può osservarsi un'insufficienza ovarica intermittente (15)
- Danno ovarico da chirurgia, chemioterapia o terapia radiante (17).
| Tabella 1 Anomalie del cromosoma X associate a POF (da Journal of Autoimmunity 2009, 33: 35-41) |
|||||
| Difetto del cromosoma X | Aspetti Clinici | Frequenza di POF | |||
| Numerico | Monosomia X: 45,X0 o mosaico 45,X/46,XX | Sindrome di Turner: bassa statura, deficit ovarico, plica nucale, linfedema, anomalie cardiovascolari e renali, ipertensione e patologia autoimmune della tiroide POF: anomalie genitourinarie e patologie autoimmuni |
80-100% | ||
| Trisomia X: 47,XXX | 3.8% | ||||
| Strutturale | Delezioni | Amenorrea primaria o secondaria | |||
| Xp11 | 100% | ||||
| Xq26-qter (locus POF1) | Molti segni somatici della Sindrome di Turner (od Ullrich-Turner) | 100% | |||
| Xq13.3-Xq21,1 (locus POF2) | |||||
| Isocromosoma 46,X,i(Xq) | Sindrome POF | ||||
| Traslocazioni bilanciate X-autosoma che coinvolgono Xq26-qter (locus POF1) o Xq13.3-Xq21.1 (locus POF2) | 80% | ||||
| Geni | Premutazione FMR1(Xq27.3 Locus POF1) | POF, FXTAS (Fragile X-associated Tremor–Ataxia Syndrome), patologie autoimmuni, ipotiroidismo | 15% (familiare), 3%(sporadica) | ||
| BMP15 (Xp11.2, Locus POF4) | Disgenesia ovarica, POF | 0-10% (dipende dalla etnia) | |||
| DACH2 (Xq21.3) | POF | 2.7% | |||
| Microdelezioni FMR2 (Xq28) | POF | 1.5% | |||
| DIAPH2 (Xq22, Locus POF2A) | POF | ? | |||
Alterata sintesi ed azione delle gonadotropine
Sono state osservate mutazioni della β-subunità, mutazioni inattivanti della G-protein associata al recettore per le gonadotropine, e difetti di glicosilazione delle due tropine ipofisarie. Tutte queste condizioni si associano ad ipogonadismo ipergonadotropo e sono clinicamente indistinguibile dalla disgenesia gonadica. La diagnosi differenziale si ottiene solo con la biopsia ovarica, che mostra la presenza di follicoli, che sono invece assenti nelle disgenesie (18, 19)
Deficit enzimatici
Citocromo P450c17: è un enzima con due distinte funzioni (17α-idrossilasi e 17,20 liasi), che gioca un ruolo fondamentale nella sintesi degli ormoni surrenalici ed ovarici. Il deficit completo di 17α-idrossilasi è un disordine raro che determina diminuita secrezione di cortisolo, iperproduzione di ormone adrenocorticotropo, corticosterone e desossicorticosterone. Non sono prodotti steroidi sessuali, sia gonadici che surrenalici, e i soggetti affetti tipicamente presentano ipertensione ed ipokaliemia, infantilismo sessuale nelle femmine e genitali femminili o ambigui nel maschio (20).
Galattosemia
Malattia genetica caratterizzata da deficit di galactosio-1-fosfato uridil-transferasi, che può associarsi ad ipogonadismo ipergonadotropo, da verosimile insufficienza ovarica prematura (21).
3) Cause ipotalamiche (Ipogonadismo Ipogonadotropo)
Sono caratterizzate da un'alterata/assente secrezione di GnRH, che comporta una diminuita secrezione pulsatile di gonadotropina e la cui eziologia può essere congenita od acquisita. Clinicamente si può osservare amenorrea primaria e ritardo puberale oppure amenorrea secondaria.
Cause Genetiche
Sono state identificate mutazioni di proteine responsabili dello sviluppo e migrazione dei neuroni GnRH-secernenti, della secrezione e dell’azione del GnRH (tabella 2). Tutte queste condizioni sono responsabili di ipogonadismo ipogonadotropo con amenorrea primaria senza sviluppo puberale. Il deficit congenito di GnRH può essere ereditato come condizione autosomico-dominante, autosomico-recessiva o legata alla X. La forma più frequente è rappresentata dalla Sindrome di Kalmann, che si associa ad anosmia (22).
| Tabella 2 Genetica dell’ipogonadismo ipogonadotropo isolato (da Molecular and Cellular Endocrinology 2010, 324: 30-8) |
|||||
| Gene | Locus | Prodotto del gene | Funzione nell’asse riproduttivo | Trasmissione | Fenotipo |
| Kal 1 | Xp22.3 | Anosmin-1 | Migrazione neuroni GnRH | Legata a X | s. di Kallmann |
| FGF8 FGFR1 |
10q25 8p12 |
FGF-8 e suo recettore | Migrazione neuroni GnRH | AD | s. di Kallmann o o ipogonadismo ipogonadotropo normo-osmico |
| NELF | 9q34.3 | Fattore LHRH nasale embrionario | Migrazione neuroni GnRH | AD (?) | s. di Kallmann |
| PROK2 PROKR2 |
3p21.1 20p12.3 |
Prochineticina-2 e suo recettore | Migrazione neuroni GnRH | AR | s. di Kallmann o o ipogonadismo ipogonadotropo normo-osmico |
| CHD7 | 8q12.1 | Cromodominio elicasi proteina legante DNA | Sviluppo di neuroni GnRH | AD | s. CHARGE, s. di Kallmann o o ipogonadismo ipogonadotropo normo-osmico |
| GnRH GnRH-R |
8p21 4q13.2-3 |
GnRH e suo recettore | Sintesi e segnale GnRH | AR | Ipogonadismo ipogonadotropo normo-osmico |
| KISS1-R | 19p13.3 | Recettore per kisspeptin | Controllo secrezione del GnRH | AR | Ipogonadismo ipogonadotropo normo-osmico |
| TAC3 TAC3-R |
12q13-12 4q25 |
Neurokinina B e suo recettore | Sconosciuta | AR | Ipogonadismo ipogonadotropo normo-osmico |
Amenorrea ipotalamica funzionale
Rappresenta la forma di amenorrea più frequente nelle adolescenti ed accompagna generalmente situazioni quali anoressia, esercizio fisico intenso, stress (23). E’ caratterizzata da un'assente/ridotta pulsatilità di secrezione del GnRH, bassi livelli di gonadotropine ed estrogeni. Sono numerosi i fattori coinvolti nella genesi di questa alterazione, tra cui importanti le alterazioni di leptina e kisspeptin, ma l’esatto meccanismo patogenetico non è ancora chiarito. Generalmente si manifesta come amenorrea secondaria, anche se non può essere esclusa nelle forme primarie con ritardo puberale (24,25).
Altre cause acquisite
Tumori cerebrali, infezioni o malattie croniche sistemiche possono, attraverso vari meccanismi (distruzione/compressione, perdita di peso e malnutrizione, terapie) associarsi ad amenorrea ipogonadotropa.
4) Cause ipofisarie (Ipogonadismo Ipogonadotropo)
Come nelle forme ipotalamiche si riconoscono cause congenite (26), associate ad amenorrea primaria, mancato sviluppo puberale e deficit di altre tropine ipofisarie, e cause acquisite.
Cause genetiche
Sono state descritte mutazioni di diversi fattori di trascrizione indispensabili per un normale sviluppo embriogenetico dell’ipofisi e per la differenziazione delle diverse linee cellulari ipofisarie (27). Tra questi sono implicati:
- PROP1, la cui mutazione è responsabile di ipopituitarismo con ipogonadismo e deficit di ACTH progressivo (26).
- HESX1, la cui mutazione si associa talvolta a displasia setto-ottica e ipogonadismo (27)
Cause acquisite
Tumori ipofisari, secernenti o non secernenti, sella vuota, malattie infiammatorie (sarcoidosi) e lesioni ischemiche ipofisarie (s. Sheean) possono essere responsabili di ipogonadismo (28). La causa più frequente è rappresentata dalla iperprolattinemia, la cui manifestazione clinica peculiare è appunto rappresentata dall'amenorrea, generalmente secondaria e più raramente primaria. Da non dimenticare, oltre all’adenoma PRL-secernente, la possibilità che l’iperprolattinemia sia l’effetto collaterale di un trattamento farmacologico.
5) Disordini di altre ghiandole endocrine
Nella pratica clinica è comune il riscontro di amenorrea nelle pazienti affette da sindrome di Cushing, sindromi adrenogenitali e disfunzioni tiroidee.
6) Cause multifattoriali
Certamente la sindrome dell’ovaio policistico rappresenta una delle più comuni endocrinopatie dell’età adulta, con una prevalenza stimata tra il 4 ed il 12% (29). Sebbene la maggior parte delle pazienti si presenti con oligomenorrea, l’amenorrea, anche primaria, non può escludere la diagnosi, soprattutto se in presenza di normali caratteri sessuali secondari, obesità ed insulino-resistenza. A differenza delle altre condizioni sopra citate, in queste pazienti si osservano normali valori plasmatici di gonadotropine ed estrogeni.
In questo capitolo, possiamo considerare anche i tumori ovarici, sebbene il meccanismo patogenetico dell'amenorrea sia completamente diverso da quelli precedentemente descritti.
- Tumori a cellule della granulosa: generalmente caratterizzati da aumentata produzione di estrogeni, ma talvolta associati ad una elevata sintesi di inibina A e/o B determinando la comparsa di amenorrea (30). Nel caso di incremento consensuale delle due forme di inibina, osserveremo un quadro ormonale da ipogonadismo ipogonadotropo, invece se è interessata solo l’inibina B osserveremo ridotti livelli di estrogeni ed FSH soppresso ma LH nel range di normalità.
- Tumori ovarici o surrenalici associati ad aumentata produzione di androgeni: accanto all'amenorrea, si osserveranno segni di iperandrogenismo e/o virilizzazione.
Bibliografia
- Popat VB, Prodanov T, Calis KA, et al. The menstrual cycle: a biological marker of general health in adolescents. Ann N Y Acad Sci 2008, 1135: 43-51.
- Misra M, Klibanski A. Bone metabolism in adolescents with anorexia nervosa. J Endocrinol Invest 2011, 34: 324-32.
- Roe AH, Dokras A. The diagnosis of polycystic ovary syndrome in adolescents. Rev Obstet Gynecol 2011, 4: 45-51.
- Practice Committee of American Society for Reproductive Medicine. Current evaluation of amenorrhea. Fertil Steril 2008, 90 (5 Suppl): S219-25.
- Sultan C, Biason-Lauber A, Philibert P. Mayer-Rokitansky-Kuster-Hauser syndrome: recent clinical and genetic findings. Gynecol Endocrinol 2009, 25: 8-11.
- Myers EM, Hurst BS. Comprehensive management of severe Asherman syndrome and amenorrhea. Fertil Steril 2012, 97: 160-4.
- Arnhold IJ, Melo K, Costa EM, et al. 46,XY disorders of sex development (46,XY DSD) due to androgen receptor defects: androgen insensitivity syndrome. Adv Exp Med Biol 2011, 707: 59-61.
- Kim KS, Kim J. Disorders of sex development. Korean J Urol 2012, 53: 1-8.
- Antic T, Hyjek EM, Taxy JB. The vanishing testis: a histomorphologic and clinical assessment. Am J Clin Pathol 2011, 136: 872-80.
- Reindollar RH. Turner syndrome: contemporary thoughts and reproductive issues. Semin Reprod Med 2011, 29: 342-52.
- Aso K, Koto S, Higuchi A, et al. Serum FSH level below 10 mIU/mL at twelve years old is an index of spontaneous and cyclical menstruation in Turner syndrome. Endocr J 2010, 57: 909-13.
- Rey RA, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Pract Res Clin Endocrinol Metab 2011, 25: 221-38.
- Cools M, Pleskacova J, Stoop H, et al; Mosaicism Collaborative Group. Gonadal pathology and tumor risk in relation to clinical characteristics in patients with 45,X/46,XY mosaicism. J Clin Endocrinol Metab 2011, 96: E1171-80.
- Tartaglia NR, Howell S, Sutherland A, et al. A review of trisomy X (47, XXX). Orphanet J Rare Dis 2010, 5:8.
- Cordts EB, Christofolini DM, Dos Santos AA, et al. Genetic aspects of premature ovarian failure: a literature review. Arch Gynecol Obstet 2011, 283: 635-43.
- Shelling AN. Premature ovarian failure. Reproduction 2010, 140: 633-41.
- Meczekalski B, Podfigurna-Stopa A. Genetics of premature ovarian failure. Minerva Endocrinol 2010, 35: 195-209.
- Berger K, Souza H, Brito VN, et al. Clinical and hormonal features of selective follicle-stimulating hormone (FSH) deficiency due to FSH beta-subunit gene mutations in both sexes. Fertil Steril 2005, 83: 466-70.
- Huhtaniemi I, Jiang M, Nilsson C, et al. Mutations and polymorphisms in gonadotropin genes. Mol Cell Endocrinol 1999, 151: 89-94.
- Kota SK, Modi K, Jha R, et al. 17-α-Hydroxylase deficiency: An unusual case with primary amenorrhea and hypertension. Indian J Endocrinol Metab 2011, 15: 127-9.
- Dixit H, Rao L, Padmalatha V, et al. Genes governing premature ovarian failure. Reprod Biomed Online 2010, 20: 724-40.
- Silveira LF, Trarbach EB, Latronico AC. Genetics basis for GnRH-dependent pubertal disorders in humans. Mol Cell Endocrinol 2010, 324: 30-8.
- Winston AP. The clinical biochemistry of anorexia nervosa. Ann Clin Biochem 2012 Feb 20.
- Legroux-Gérot I, Vignau J, Biver E, et al. Anorexia nervosa, osteoporosis and circulating leptin: the missing link. Osteoporos Int 2010, 21: 1715-22.
- Mehta A, Dattani MT. Developmental disorders of the hypothalamus and pituitary gland associated with congenital hypopituitarism. Best Pract Res Clin Endocrinol Metab 2008, 22: 191-206.
- Kelberman D, Turton JP, Woods KS, et al. Molecular analysis of novel PROP1 mutations associated with combined pituitary hormone deficiency (CPHD). Clin Endocrinol (Oxf) 2009, 70: 96-103.
- Cohen LE. Genetic disorders of the pituitary. Curr Opin Endocrinol Diabetes Obes 2012, 19: 33-9.
- Ska?ba P, Guz M. Hypogonadotropic hypogonadism in women. Endokrynol Pol 2011, 62: 560-7.
- Dewailly D, Hieronimus S, Mirakian P, et al. Polycystic ovary syndrome (PCOS). Ann Endocrinol (Paris) 2010, 71: 8-13.
- Kurihara S, Hirakawa T, Amada S, et al. Inhibin-producing ovarian granulosa cell tumor as a cause of secondary amenorrhea: case report and review of the literature. J Obstet Gynaecol Res 2004, 30: 439-43.
Clinica e diagnostica delle amenorree e dei disturbi del ciclo
Costanzo Moretti & Fedra Mori
*Cattedra di Endocrinologia, Università di Torvergata, Roma
**UOC di Endocrinologia, Azienda Ospedaliera Sant’Andrea, Roma
Segni e sintomi che accompagnano una condizione di amenorrea possono essere chiaramente molto diversi se stiamo considerando una amenorrea primaria o secondaria.
AMENORREA PRIMARIA
Assenza di segni di sviluppo puberale
Nelle bambine di età superiore ai 13 anni che non presentano segni di sviluppo puberale deve essere posta una diagnosi differenziale tra ritardo costituzionale (per altro più raro nelle femmine) e le varie possibili forme di ipogonadismo (iper o ipogonadotropo) (1,2).
L’osservazione di elevati livelli di gonadotropina è fortemente indicativa di disgenesia gonadica o di insufficienza ovarica prematura. L’esame del cariotipo è in grado di diagnosticare la sindrome di Turner (incluse le condizioni di mosaicismo), dimostrare la delezione parziale del cromosoma X o la presenza del cromosoma Y (3).
Al contrario, il riscontro di bassi/normali (per età) livelli plasmatici di FSH ed LH o i test di stimolo (GnRH test o test con analoghi) non permettono di discriminare tra ritardo puberale e forme ipogonadotrope. In questo caso una radiografia della mano e del polso per età ossea può essere d’aiuto, poiché una età biologica inferiore a quella anagrafica può suggerire un ritardo puberale (4). Nei casi in cui sia confermato il sospetto di ipogonadismo ipogonadotropo, deve essere prescritto dapprima un esame neuroradiologico (RMN), volto all'esclusione di neoformazioni cerebrali o malformazioni della zona ipotalamo-ipofisaria, e successivamente, ove possibile, un esame genetico finalizzato all'identificazione di eventuali mutazioni.
Normale sviluppo puberale
Se è presente sviluppo mammario in assenza di peluria sessuale, dobbiamo orientarci verso una possibile sindrome da insensibilità agli androgeni. L’esame del cariotipo, la valutazione dei livelli plasmatici di testosterone e l'esecuzione di una ecografia o di una RMN addome/pelvi in questo caso sono dirimenti. In considerazione dell’alto rischio di sviluppo di gonadoblastoma o disgerminoma, è indispensabile in questi pazienti la ricerca e rimozione chirurgica delle gonadi (5).
Se invece lo sviluppo puberale è completo e soprattutto accompagnato da ricorrenti dolori addominali, con livelli di FSH e composizione corporea nella norma, è necessario eseguire esami di diagnostica per immagini della pelvi, per verificare l’integrità dei genitali interni. Nel caso di un esame negativo per malformazioni uterine, dobbiamo prendere in considerazione la presenza di imene imperforato, setto vaginale trasverso, sinechie, anche se quest’ultime sono più frequentemente causa di amenorrea secondaria.
AMENORREA SECONDARIA
La causa più frequente di amenorrea secondaria è rappresentata dalla gravidanza. Una volta che questa sia stata esclusa, l’anamnesi deve orientarsi verso la valutazione dello stile di vita (intensa attività fisica) e le abitudini alimentari (6), deve essere indagato l’eventuale uso di farmaci in grado di determinare amenorrea, quali la metoclopramide o gli anti-psicotici ai quali si associa frequentemente iperprolattinemia (7).
La familiarità per menopausa precoce, malattie metaboliche o malattie autoimmunitarie, pregressi trattamenti chemio- o radioterapici, coesistenti patologie sistemiche o la presenza di flushes, dolori addominali, secchezza vaginale, disturbi del visus e cefalea, sono tutti elementi che possono già orientare verso una diagnosi.
All’esame obiettivo appare importante la valutazione del BMI e la ricerca di eventuali segni di iperandrogenismo e/o virilizzazione, achantosis nigricans, masse addominali, galattorrea, tireopatia.
Nel caso di segni di iperandrogenismo, debbono essere prese in considerazione diverse possibilità: PCOS, SAG non-classica, sindrome di Cushing, mentre una recente e rapida insorgenza di irsutismo può indicare la presenza di una neoplasia androgeno-secernente. Il dosaggio in fase follicolare precoce del 17αOH-progesterone potrà orientarci od escludere una SAG non classica, mentre valori di testosterone maggiori di 150-200 ng/mL (5.2-6.9 nmol/L) (8) o quelli di DHEA-S maggiori di 700 µg/dL (13.6 µmol/L) sono fortemente indicativi per tumore androgeno-secernente (9).
Se l’esame obiettivo non è suggestivo ed abbiamo effettuato il dosaggio di PRL e del TSH, escludendo quindi iperprolattinemia e tireopatie, bisogna formulare una diagnosi differenziale tra le diverse possibili cause di amenorrea.
In questo caso ci viene in aiuto il test di provocazione con progesterone, che può essere effettuato somministrando per via orale o per via i.m. un preparato progestinico. Il sanguinamento mestruale avviene generalmente tra 2 e sette giorni dopo il termine della somministrazione e testimonia un'adeguata estrogenizzazione dell’endometrio ed una pervietà delle vie genitali. L’assenza di sanguinamento richiede la prosecuzione dell’iter diagnostico e la somministrazione di estro-progestinici. Se si verifica il sanguinamento mestruale, possiamo escludere la gravidanza e le sinechie uterine. A questo punto, il dosaggio delle gonadotropine permetterà di orientarci verso una causa ipotalamo-ipofisaria (ipogonadotropa) od ovarica (ipergonadotropa) dell'amenorrea (10).
Tra le forme ipogonadotrope dobbiamo prendere in considerazione le forme funzionali che, come abbiamo detto, sono di più frequente riscontro nelle adolescenti con disturbi alimentari o sottoposte ad intenso esercizio fisico, oppure sono secondarie a malattie sistemiche intercorrenti o patologie/danno ipotalamo-ipofisario (tumori, traumi con conseguente ipopituitarismo, ecc).
La valutazione della risposta di LH ed FSH al GnRH test può aiutarci nel discriminare le due forme.
Gli esami strumentali di ausilio per il clinico sono rappresentati da: DEXA per la valutazione della composizione corporea (percentuale di grasso compresa tra il 20 ed il 32% nella donna in fase fertile) ed RMN della regione ipotalamo-ipofisaria.
Elevati livelli di FSH indicano al contrario un'insufficiente attività ovarica. In questo caso può essere suggerito l’esame del cariotipo, per escludere una sindrome di Turner con mosaicismo, oppure lo studio di FMR1 per verificare una eventuale premutazione o sindrome dell’X fragile. In quest’ultimo caso è opportuno offrire una valutazione genetica anche ai familiari della paziente.
Sebbene manchino ancora dati normativi, il dosaggio dell’ormone anti-mulleriano (AMH) sembra poter rappresentare un buon marker nella valutazione del progressivo declino della funzione ovarica delle pazienti con POF (11).
BIBLIOGRAFIA
- Bordini B, Rosenfield RL. Normal pubertal development: part II: clinical aspects of puberty. Pediatr Rev 2011, 32: 281-92.
- Bordini B,Rosenfield RL. Normal pubertal development: Part I: The endocrine basis of puberty. Pediatr Rev 2011, 32: 223-9.
- Maclaran K, Panay N. Premature ovarian failure. J Fam Plann Reprod Health Care 2011, 37: 35-42.
- Palmert MR, Dunkel L. Clinical practice. Delayed puberty. N Engl J Med 2012, 366: 443-53.
- Gottlieb B, Beitel LK, Trifiro MA. Androgen Insensitivity Syndrome. In: Pagon RA, Bird TD, Dolan CR, Stephens K, editors. Gene Reviews [Internet]. Seattle (WA): University of Washington, Seattle; ?1999 Mar 24: 1993 [updated 2011 Oct 06].
- Fenichel RM, Warren MP. Anorexia, bulimia, and the athletic triad: evaluation and management. Curr Osteoporos Rep 2007, 5: 160-4.
- Inder WJ, Castle D. Antipsychotic-induced hyperprolactinaemia. Aust N Z J Psychiatry 2011, 45: 830-7.
- Bode D, Seehusen DA, Baird D. Hirsutism in women. Am Fam Physician 2012, 85: 373-80.
- Cavlan D, Bharwani N, Grossman A. Androgen- and estrogen-secreting adrenal cancers. Semin Oncol 2010, 37: 638-48.
- Kiningham RB, Apgar BS, Schwenk TL. Evaluation of amenorrhea. Am Fam Physician 1996, 53: 1185-94.
- Visser JA, Schipper I, Laven JS, et al. Anti-Müllerian hormone: an ovarian reserve marker in primary ovarian insufficiency. Nat Rev Endocrinol 2012, 8: 331-41.

