Inquadramento generale diagnostico delle malattie metaboliche dell'osso
L'unità funzionale ossea
Cristina Eller-Vainicher, Iacopo Chiodini
UO Endocrinologia e Diabetologia, Fondazione IRCCS Cà Granda - Ospedale Maggiore Policlinico, Milano
L’osso è uno speciale tessuto connettivo mineralizzato che, insieme alla cartilagine, costituisce lo scheletro e ha funzioni sia meccaniche sia metaboliche. Esso è costituito da una componente cellulare (osteoclasti, osteoblasti e osteociti) inserita in una matrice extra-cellulare ricca di fibre di collagene, proteine non collageniche e proteoglicani.
Gli osteoclasti, che originano da cellule staminali emopoietiche, sono cellule giganti multinucleate, specializzate nel riassorbimento della matrice ossea. Aderiscono alla matrice ossea calcificata attraverso una parte della membrana cellulare detta zona di adesione e a questo livello, attraverso l’azione di enzimi specifici (fosfatasi acida tartaro-resistente TRAP, catepsina K e anidrasi carbonica di tipo 2), determinano il riassorbimento osseo.
La formazione e attivazione degli osteoclasti avviene attraverso la via RANK-L/osteoprotegerina (OPG). Il legame tra RANK (Receptor Activator for Nuclear Factor KB), presente sulla superficie degli osteoclasti, e il suo ligando specifico RANK-L, ne promuove la differenziazione e attivazione. L’OPG, una proteina prodotta dagli osteoblasti, antagonizzando con il legame RANK-L/RANK, agisce da regolatore fisiologico del metabolismo osseo. Molti altri fattori stimolano l’osteoclastogenesi, tra cui calcitriolo, PTH, TNFα, prostaglandina E2, IL-1, IL-6, IL-11, IL-17.
Gli osteoblasti, che originano da cellule staminali mesenchimali, sono deputati alla formazione della matrice organica dell’osso. Mantengono rapporti sia con gli osteociti, sia con gli osteoclasti e determinano la differenziazione e attivazione di questi ultimi. A livello delle lacune di riassorbimento, create dagli osteoclasti, inizialmente producono collagene e fosfatasi alcalina, successivamente osteocalcina, BMP e osteopontina. La mineralizzazione di questa matrice avviene a distanza di qualche giorno, per consentire la stabilizzazione dei legami di cross-link tra le fibre di collagene, per migliorarne robustezza e resistenza. A livello molecolare l’attivazione della via Wnt/β-catenina gioca un ruolo fondamentale per la differenziazione osteoblastica. Tale via, cruciale in senso anabolico, è regolata negativamente dagli inibitori di Wnt, come dickkopf-1 (Dkk-1) e sclerostina, che legano e bloccano il recettore di Wnt LRP-5. Inoltre svariati fattori di crescita intervengono a modulare, in senso positivo, l’osteoblastogenesi, come BMP (bone morphogenetic proteins) e TGF-ß (transforming growth factor ß). L’attività degli osteoblasti è regolata inoltre da numerosi altri ormoni e fattori di crescita tra cui PTH/PTH-rp, GH, ormoni tiroidei, insulina, calcitriolo, ormoni sessuali, glucocorticoidi, IL-1, TNFα.
Gli osteociti, che derivano da un processo di differenziazione terminale degli osteoblasti rimasti intrappolati nella matrice, rappresentano più del 90% di tutte le cellule del tessuto osseo. Hanno un ruolo fondamentale nella regolazione del rimodellamento osseo. Queste cellule condividono alcune proprietà morfologiche con le cellule nervose, sono dotate, infatti, di lunghi prolungamenti citoplasmatici inseriti nei canalicoli della matrice, che li connettono con altri osteociti e con gli osteoblasti superficiali. Attraverso questi prolungamenti, raccolgono le informazioni meccaniche relative ai micro-danneggiamenti e le trasformano in segnali biochimici. Gli osteociti esprimono anche alcuni fattori noti per regolare il metabolismo del fosforo, suggerendo un loro ruolo nella mineralizzazione della matrice. Inoltre, a loro compete la produzione e secrezione di sclerostina, uno dei principali inibitori della via di segnale Wnt/β-catenina, che deprime la differenziazione osteoblastica e la neoformazione di tessuto osseo.
L’attività concertata dei diversi tipi cellulari dà luogo al rimodellamento osseo, un processo che dura per tutta la vita dell’individuo, caratterizzato da una precisa sequenza coordinata (attivazione, riassorbimento, inversione, formazione e fase di riposo) che consente all’osso di crescere durante lo sviluppo scheletrico, riparare i micro-danneggiamenti, assicurare la competenza meccanica dello scheletro e mantenere normali livelli di calcemia e fosforemia. Il rimodellamento ha inizio con l’attivazione di cellule quiescenti di origine osteoblastica (lining cells) situate sulla superficie ossea. A livello della superficie resa attiva sono reclutati i precursori degli osteoclasti e gli osteoclasti maturi che aderiscono alla superficie e dissolvono la matrice. Al termine del riassorbimento osseo gli osteoclasti scompaiono e compaiono cellule mononucleate che preparano la superficie alla fase successiva; segue quindi la maturazione degli osteoblasti che concludono il rimodellamento osseo con la sintesi e la deposizione di matrice ossea. Al termine della formazione, nuove cellule di rivestimento inattive, di derivazione osteoblastica, tornano a coprire la superficie ossea, mantenendo il tessuto quiescente fino al ciclo successivo. Il rimodellamento continuo del tessuto osseo ha fatto sì che, convenzionalmente, esso sia distinto in unità anatomo-funzionali dette Basic Multicellular Unit (BMU). Normalmente solo il 10% delle BMU è sede di rimodellamento, mentre il 90% è quiescente. La percentuale di BMU attive può raddoppiare in determinate condizioni caratterizzate da perdita di massa ossea (i.e. la cessazione della funzione gonadica).
Bibliografia
- Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet 2011, 377: 1276-87.
- Sambrook P, Cooper C. Osteoporosis. Lancet 2006, 367: 2010-8.
- Brandi ML. Microarchitecture, the key to bone quality. Rheumatology 2009, 48 Suppl 4: iv3-8.
Diagnostica di laboratorio e strumentale delle malattie ossee
Trabecular Bone Score (TBS)
Il laboratorio nello studio del metabolismo osseo
Daniela Bosco1 & Andrea Frasoldati2
1UODS di Endocrinologia, Azienda Ospedaliera San Giovanni-Addolorata, Roma
2SC di Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia
Le indagini di laboratorio utili per l’inquadramento diagnostico di un paziente con osteoporosi rispondono fondamentalmente a due obiettivi:
- fornire una valutazione del metabolismo calcio-fosforo (esami di I livello)
- indirizzare il percorso diagnostico verso eventuali forme di osteoporosi/osteopenia a verosimile genesi secondaria (esami di II livello).
La normalità degli esami di I livello esclude con un’accuratezza di ~90% altre malattie o forme da osteoporosi secondaria.
| Tabella 1 Esami bioumorali nella diagnosi di osteoporosi |
|
| Esami di I livello | Emocromo completo VES Elettroforesi proteica Calcemia e fosforemia Creatininemia Fosfatasi alcalina totale Transaminasi e γGT Calciuria |
| Esami di II livello | TSH PTH 25OH-vitamina D Testosterone Cortisoluria Immunofissazione sierica e urinaria Anticorpi anti-transglutaminasi Esami specifici per patologie sospette (triptasi, ecc) |
Marcatori di turn-over osseo
Si tratta di molecole coinvolte nei processi di formazione e riassorbimento del tessuto osseo (enzimi, prodotti intermedi di sintesi o di degradazione della matrice ossea) (4,5).
Sul piano clinico, i marcatori di turn-over osseo (Bone Turnover Markers, BTM) vengono comunemente distinti in marcatori di neoformazione ossea e marcatori di riassorbimento osseo.
| Tabella 2 Marcatori di metabolismo osseo |
|
| di formazione | Fosfatasi alcalina Osteocalcina Peptidi terminali del procollagene |
| di riassorbimento | Idrossiprolina Fosfatasi acida Cross-links Telopeptidi del collagene Idrossilisina |
Il ruolo diagnostico dei BTM è quello di definire l’effettivo stato metabolico del tessuto scheletrico: se la densitometria fornisce una valutazione statica della quota di tessuto osseo presente nell’organismo, i BTM costituiscono un indice dinamico dello stato di attività del tessuto osseo e della velocità del suo rimodellamento. Il loro impiego, tuttavia, è condizionato da un’ampia variabilità individuale, alla quale concorrono fattori di carattere fisiologico (età, sesso, etnia, gravidanza e allattamento, alimentazione e stile di vita, ritmicità circadiana e stagionale, ecc.), patologico (alterata funzionalità renale o epatica, allettamento prolungato e ipomobilità, farmaci) e laboratoristico (tipo di dosaggio utilizzato). Infine, alcuni marcatori possono fungere sia da indici di riassorbimento che da indici di formazione ossea. Per tutte queste ragioni, i BTM non vengono oggi proposti nella valutazione clinica di routine, ma hanno un utilizzo in situazioni selezionate, come il monitoraggio degli effetti della terapia farmacologica per l’osteoporosi. È comunque ipotizzabile che con l’affinamento delle tecniche di dosaggio e una migliore comprensione del loro significato biologico il loro impiego sia destinato ad aumentare (6-8).
Marcatori di formazione ossea
Fosfatasi alcalina e isoenzima osseo. La fosfatasi alcalina (ALP) è una glicoproteina a struttura dimerica che catalizza l’idrolisi di numerosi fosfo-monoesteri. E’ presente in tutti i tessuti corporei, con livelli più alti nell’epitelio intestinale, tubulo convoluto prossimale del rene, fegato, ossa e placenta. A livello scheletrico l’isoenzima (bALP) è sintetizzato dagli osteoblasti e interviene nel processo di mineralizzazione ossea. Tra le patologie ossee, i più alti livelli di bALP sono riscontrabili nella malattia di Paget e nelle patologie tumorali ossee. Un incremento moderato si osserva nell’osteomalacia, antagonizzato dalla somministrazione di vitamina D. L’iperparatiroidismo primario e secondario può essere accompagnato da modesti aumenti di bALP. Le fratture ossee provocano aumenti repentini ma transitori di bALP.
I livelli di ALP sono inoltre dipendenti dall’età. La crescita fisiologica del sistema scheletrico aumenta il livello di ALP nel siero di 1.5-2.5 volte rispetto ai valori di un adulto. Durante il terzo trimestre di gravidanza è osservabile un aumento di 2-3 volte la normalità per il contributo dell’ALP placentare.
L’ALP si dosa su prelievo ematico. Ha un’emivita di 1-2 giorni, che la rende meno sensibile alle variazioni giornaliere, e non è influenzata dalla funzione renale.
La determinazione della massa o dell’attività dell’ALP o dell’isoenzima osseo (bALP) viene ottenuta con metodo immunologico (chemiluminescenza, immunoenzimatico, RIA). L’isoforma bALP può risultare falsamente aumentata nei casi di patologia epato-biliare per la cross-reattività con l’isoenzima epatico.
Osteocalcina. L’osteocalcina è la proteina non-collagene maggiormente rappresentata nel tessuto scheletrico (10-20% delle proteine non collageniche); presenta una struttura monomerica di 49 aminoacidi e tre residui di acido γ-carbossi-glutammico (peso molecolare ca. 5800 D). L’osteocalcina viene sintetizzata dagli osteoblasti ma anche da odontoblasti e condrociti, sotto il controllo di vitamina D3 e vitamina K, che regola la carbossilazione dei residui di acido γ-carbissiglutammico, indispensabili per il legame tra ioni calcio e idrossi-apatite. L’osteocalcina in circolo comprende sia la quota proveniente dalla sintesi sia quella derivante dal riassorbimento osseo (quantità maggiore). E’ pertanto un indicatore di formazione (attività osteoblastica) e al tempo stesso di riassorbimento. I suoi livelli ematici sono inoltre influenzati dalla ritmicità circadiana (picco alle 4 del mattino) e dalla funzione renale (aumenta in corso di bassa filtrazione glomerulare) (tab. 15). Nel sangue è presente sia come osteocalcina intatta (aminoacidi 1-49, circa 30%), assai instabile, sia come frammento N-terminale (aminoacidi 1-43, circa 30%), assai più stabile.
L’osteocalcina viene correntemente proposta come parametro utile per monitorare l'efficacia delle terapie anti-riassorbitive. I livelli circolanti aumentano in quadri clinici quali l’osteoporosi, l’iperparatiroidismo primitivo e secondario, il morbo di Paget.
| Tabella 3 Cause di alterati livelli di osteocalcina |
|
| Diminuiti | Gravidanza Epatopatie croniche Ipoparatiroidismo Deficit GH Terapia cronica con cortisonici |
| Aumentati | Malattia di Paget Osteoporosi Iperparatiroidismo primitivo e secondario Insufficienza renale cronica Neeoplasie scheletriche primitive e metastatiche Anti-convulsivanti Estrogeni |
Peptidi C-terminale e N-terminale del pro-collagene di tipo I (P1CP e P1NP). Sono i prodotti finali della sintesi del collagene per l’azione dell’endopeptidasi sulla molecola di pro-collagene di tipo I. Dopo il clivaggio, le due estremità N terminale (P1NP) e C terminale (P1CP) del proptide entrano in circolo, sia come forma trimerica che come forma monomerica. I differenti metodi di analisi possono misurare sia la forma monomerica che quella trimerica. Possono essere misurati con metodi immunometrici. Per la frazione C-terminale si adotta il metodo ELISA, mentre per la frazione N-terminale si impiega il metodo RIA competitivo. La misurazione del P1NP ha il vantaggio della bassa variabilità diurna, l’assenza di influenza dei pasti, ha un metabolismo epatico e non è influenzata dalla funzione renale. La loro specificità come indicatori di turn-over osseo è limitata dall’esistenza di una significativa produzione extra-ossea (es. cutanea) del collagene di tipo 1, e dalle patologie epatiche, in grado di interferire con la fisiologica metabolizzazione dei peptidi.
Il dosaggio del P1NP si è dimostrato utile nel monitoraggio della terapia con teriparatide. Nei pazienti in trattamento con teriparatide si assiste a un incremento dei valori di P1NP già dopo il 1° mese di terapia e il suo aumento è correlato all’aumento della densità minerale ossea valutata dopo 12 mesi. P1NP può pertanto fornire indicazioni circa la risposta al trattamento con teriparatide ben prima del controllo densitometrico.
Marcatori di riassorbimento osseo
Telopeptidi del collagene di tipo I (CTX, NTX). Si tratta di prodotti di degradazione delle porzioni carbossi-terminale (CTX) e amino-terminale (NTX) delle regioni non-elica del collagene di tipo I, per azione della catepsina K osteoclastica. Si riconosce, inoltre, un frammento più ampio della porzione carbossi-terminale del collagene di tipo 1, che però si genera per azione di metalloproteasi (ICTP-1 o CTX.MMP). Possono essere dosati nelle urine e nel siero. Il dosaggio nel sangue è influenzato dal pasto e dal ritmo circardiano ed è pertanto consigliabile venga eseguito la mattina a digiuno. Il dosaggio nelle urine delle 24 ore permette di superare tali variabili. La determinazione di NTX si esegue con metodo immunoenzimatico con anticorpo monoclonale che riconosce la catena α2 del frammento N-terminale. La determinazione sierica del CTX, con metodo RIA, trova applicazione più diffusa per la maggiore attendibilità e semplicità di esecuzione rispetto quella urinaria.
I telopeptidi C- e N-terminali risultano elevati nei pazienti con elevato riassorbimento osseo e tendono a normalizzarsi per effetto delle terapie che inibiscono il riassorbimento. Evidenze cliniche confermano, infatti, riduzioni dei livelli di NTX del 60% dopo denosumab, del 50% dopo alendronato e del 40% dopo risedronato.
Cross-links del collagene: piridinolina e dessosipiridolina. Durante la degradazione del collagene sono rilasciati in circolo i cross-link presenti tra le molecole di collageno. Si tratta di legami crociati intra- e inter-molecolari che stabilizzano la molecola di collagene. Durante il riassorbimento osseo i cross-link vengono spezzati dalle proteasi degli osteoclasti e rilasciati in circolo in forma libera o coniugata con altri peptidi. Possono essere dosati nelle urine e nel siero. Presentano un picco la mattina e sono scarsamente influenzati dal pasto. Sono dosati due tipi di prodotti: piridinolina, meno specifica per l’esistenza di una produzione extra-ossea (cartilagine, tendini, parete dei vasi sanguigni); deossipiridolina, più specifica, poiché presente soltanto nelle ossa e nella dentina. Sono dosati con metodi immunometrici.
Fosfatasi acida tartrato-resistente (TRAP). E’ attualmente uno dei marcatori di elevato turn-over osseo, per la sua significativa correlazione con la perdita di densità minerale ossea. La frazione tartrato-resistente della fosfatasi acida proviene dagli osteoclasti, dalle cellule di Kupfer del fegato, dai macrofagi, dagli eritrociti. In particolare, l’isoforma 5b dell’isoenzima osseo, prodotto dagli osteoclasti durante la fase di riassorbimento e coinvolto nella degradazione della matrice ossea, si concentra nel ruffled border e nello spazio di riassorbimento.
TRAP5b è aumentato nelle condizioni di incrementato turnover come nella malattia di Paget e nelle metastasi ossee. I metodi per la determinazione di TRAP sono per la maggior parte colorimetrici e non consentono la differenziazione tra le due isoforme 5a (di altra origine non ancora identificata) e 5b (specifica degli osteoclasti).
Idrossiprolinuria. L’idrossiprolina proveniente dall’idrossilazione post-traduzionale dei residui di prolina corrisponde ad una quota significativa (~ 14%) della composizione aminoacidica del collagene. Viene eliminata in misura significativa con le urine, per il 95-97% legata a peptidi e per il restante 3-5% in forma libera. La determinazione si esegue con metodi colorimetrici o cromatografici (HPLC) dopo conversione, per idrolisi, dei peptidi in forma libera. La misura dell’idrossiprolinuria è stata impiegata in passato come indicatore di riassorbimento osseo. Oggi, il suo utilizzo è limitato per la scarsa affidabilità, attribuibile a diversi fattori. E’ noto che l’idrossiprolina urinaria può derivare da proteine diverse dal collagene osseo (per es. è stato calcolato che il 10-15% proviene dal catabolismo del fattore C1q del complemento) e una dieta ricca in cibi contenenti elevate quantità di collagene può determinare valori elevati di idrossiprolinuria.
| Tabella 4 Cause di alterati livelli di idrossiprolinuria |
|
| Diminuiti | Ipopituitarismo Ipoparatiroidismo Ipotiroidismo Malnutrizione Farmaci (aspirina, bisfosfonati, anti-neoplastici) |
| Aumentati | Gravidanza Dieta Malattia di Paget Iperparatiroidismo Ipertiroidismo Acromegalia Stati infiammatori (il fattore C1q del complemento presenta una regione ricca di idrossiprolina) Farmaci (GH, ormoni tiroidei, fenobarbital) |
Idrossilisina e derivati glicosidici (GHYL). L’idrossilazione della lisina assicura la stabilità dei cross-link intra- e inter-molecolari del collagene. L’idrossilisina è, pertanto, una componente comune del collagene presente in diversi tessuti ma, anche, delle proteine non collageniche. La glicosilazione dei residui di idrossilisina porta alla formazione di derivati glicosidici del collagene specifici nei diversi tessuti. In particolare, nel collagene osseo prevalgono i residui monoglicosilati, i quali durante il riassorbimento osseo vengono rilasciati in circolo ed eliminati con le urine in assenza di tappe metaboliche intermedie. I GHYL costituiscono quindi un marcatore di una buona specificità (non è influenzato dalla dieta), ma ancora poco diffuso nella pratica clinica.
| Tabella 5 Utilità dei principali indicatori di rimodellamento osseo |
|||||
| Analita | Sistema | Molto utile | Utile | Poco utile | Inutile |
| ALP ossea | Siero | x | |||
| Osteocalcina | Siero/plasma | x | |||
| P1NP | Siero | x | |||
| P1CP | Siero | x | |||
| DPD | Urine | x | |||
| NTX | Urine | x | |||
| NTX | Siero | x | |||
| CTX | Urine | x | |||
| CTX | Siero | x | |||
| ICTP | Siero | x | |||
| TRAP | Siero/plasma | x | |||
Bibliografia
- Adami S, Adami S, Bertoldo F, et al; Società Italiana dell'Osteoporosi, del Metabolismo Minerale e delle Malattie dello Scheletro. Guidelines for the diagnosis, prevention and treatment of osteoporosis. Reumatismo 2009, 61: 260-84.
- National Osteoporosis Foundation.
- Levine JP. Identification, diagnosis, and prevention of osteoporosis. Am J Manag Care 2011, 17 Suppl 6: 170-6.
- Garnero P. Biomarkers for osteoporosis management: utility in diagnosis, fracture risk prediction and therapy monitoring. Mol Diagn Ther 2008, 12: 157-70.
- Vasikaran L, et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for International reference standard. Osteoporosis Int 2011, 22: 391-420.
- Dreyer P, Vieira GH. Bone turnover assessment: a good surrogate marker? Arq Bras Endocrinol Metab 2010 54: 99-105.
- Pagani F, Francucci CM, Moro L. Markers of bone turnover: biochemical and clinical perspectives. J Endocrinol Invest 2005, 28 (10 Suppl): 8-13.
- Reginster JY, Collette J, Neuprez A, et al. Role of biochemical markers of bone turnover as prognostic indicator of successful osteoporosis therapy. Bone 2008, 42: 832-6.
- Price CP, Milligan TP, Darte C. Direct comparison of performance characteristics of two immunoassay for bone isoform of alkaline phosphatase in serum. Clin Chem 1997, 43: 2052-7.
- Parviainen M, Kuronen I, Kokko H, et al. Two-site enzyme immunoassay for measuring intact human osteocalcin in serum. J Bone Miner Res 1994 9: 347-54.
- Tsujimoto M, Chen P, Miyauchi A, et al. PINP as an aid for monitoring patients treated with teriparatide. Bone 2011, 48: 798-803.
- Halleen JM, Alatalo SL, Suominen H, et al. Tartrate-resistant acid phosphatase 5b: a novel serum marker of bone resorption. J Bone Miner Res 2000, 15:1337-45.
La densitometria ossea
Stefania Bonadonna
UOS Dipartimentale di Riabilitazione Neuromotoria ad indirizzo Oncologico, Pio Albergo Trivulzio, Milano
LE APPARECCHIATURE
Con il termine Densitometria ossea, o Mineralometria Ossea Computerizzata (MOC) si descrivono varie tecniche diagnostiche mirate alla valutazione della densità ossea:
- la densitometria ossea a doppio raggio fotonico (DEXA)
- la tomografia computerizzata quantitativa (QCT)
- la densitometria ad ultrasuoni (QUS).
La densitometria ossea a doppio raggio fotonico (DEXA)
La DEXA è la tecnica di prima scelta nella valutazione della densità minerale ossea (BMD) in quanto è la metodica riconosciuta dall’OMS per i criteri diagnostici di osteoporosi.
E’ una tecnica rapida, di facile utilizzo, da prediligersi per diversi vantaggi:
- è accurata (la misurazione della BMD è esatta)
- è precisa (riproducibile con insignificante margine di errore)
- può essere eseguita in diversi siti scheletrici
- vengono utilizzate radiazioni a basso dosaggio (tra 1 e 5 mSv) e, tramite l’immagine della colonna toracica e lombare, può essere valutata la presenza di fratture vertebrali (VFA) senza bisogno di eseguire radiografia convenzionale della colonna.
La DEXA misura la BMD areale in grammi per centimetri quadrati (g/cm2), usando radiazioni ionizzanti con raggio fotonico a 2 diversi gradi di energia. Per maggior precisione diciamo che la densitometria misura il contenuto minerale osseo (BMC). Tale valore viene rapportato all’area di osso su cui è stata eseguita la scansione densitometrica, ottenendo così il valore della BMD. Pertanto, si può dire che la diversa attenuazione dei raggi che attraversano l’osso o gli altri tessuti corporei permette una misura quantitativa della BMD che è indipendente dalla struttura corporea del soggetto esaminato. Il limite di tale misurazione è che non essendo una valutazione volumetrica, non è in grado di valutare lo spessore dell’osso o le sue diverse componenti (corticale e trabecolare).
I siti indagati tramite esecuzione di DEXA sono: rachide lombare (L1-L4), femore prossimale (anca, collo femorale e trocantere), avambraccio (terzo distale del radio), o in rari casi, può essere eseguita “total body”. Nella pratica clinica i valori di BMD (intesi come g/cm2) non vengono utilizzati, si utilizzano invece i valori di T-score (numero di deviazioni standard rispetto ad una popolazione giovane sana di riferimento) o di Z-score (numero di deviazioni standard rispetto ad una popolazione di riferimento della stessa età) così da avere dei valori standardizzati che sono indipendenti dal tipo di densitometro DEXA utilizzato.
Nell’esecuzione di una DEXA bisogna porre attenzione ad alcuni errori di valutazione relativi all’apparecchiatura, al software, al tecnico esecutore dell’esame, al posizionamento del paziente e a degli eventuali artefatti, tramite i quali si può infatti andare incontro a falsi negativi o a falsi positivi.
Innanzitutto è sempre obbligatorio eseguire una calibrazione dell’apparecchiatura, secondo le linee guida indicate dal fabbricante, solitamente una volta alla settimana. I dati del fantoccio devono essere analizzati e revisionati, per essere certi della loro esattezza. Qualora ci fossero differenze nei risultati ottenuti dalla calibrazione, l’apparecchio deve essere revisionato.
Tutte le immagini DEXA devono essere attentamente rivalutate in termini di posizionamento del paziente, scansione ed artefatti prima di fornire un valore di BMD e di T-score o Z-score. Il medico deve analizzare l’immagine DEXA con la stessa attenzione con cui si analizza una qualsiasi altra radiografia.
Gli errori più comuni che attengono al posizionamento del paziente riguardano: mancata centratura della colonna vertebrale, anca in adduzione o in rotazione esterna; riguardo la lettura della DEXA lombare si può sbagliare nel conteggio delle vertebre, nella suddivisione spaziale della singola vertebra o nell’includere becchi osteofitosici o particolari aspetti artrosici della singola vertebra, che andrà in tal caso esclusa all’atto della lettura dell’esame; attenzione anche a sottostanti calcificazioni vasali di origine aterosclerotica, a pregresso impianto di stent o filtri in vena cava, a recente utilizzo di mezzo di contrasto per lo studio del tratto digerente e ad oggetti esterni quali piercing ombelicale, bottoni o parti metalliche del reggiseno. A livello dell’anca può esserci errore nel determinare le aree di maggior interesse e si possono avere artefatti di origine artritica o artrosica, che tendono a sovrastimare l’esame, come pure artefatti esterni quali monete o chiavi tenute in tasca.
Molta attenzione va posta nell’immobilità del paziente durante l’esecuzione dell’esame.
La tomografia computerizzata quantitativa (QCT)
Tutti gli apparecchi tomodensitometrici possono essere impiegati nella misurazione della densità minerale ossea se forniti di uno speciale adattatatore e di sistemi particolari di calibrazione. Esistono inoltre dei tomodensitometri dedicati alla valutazione della BMD. Il vantaggio rispetto alla DEXA è che forniscono una valutazione tri-dimensionale o volumetrica della densità ossea e permettono una separazione spaziale dell’osso trabecolare da quello corticale. D’altro canto, l’alta dose di radiazioni a cui viene sottoposto il paziente (100-300 mrem per la colonna), la lunghezza dell’esame (circa 30 min per la colonna) uniti alla minor precisione ed accuratezza dell’esame e agli alti costi fanno sì che tale metodica venga riservata alla valutazione di casi selezionati.
La densitometria ad ultrasuoni (QUS)
Solo negli ultimi anni la valutazione della densitometria ossea tramite l’utilizzo di ultrasuoni ha trovato un ruolo nella pratica clinica. Gli ultrasuoni però non vengono qui impiegati come mezzo per produrre un’immagine (come solitamente avviene nelle ecografie dirette ad altri organi), ma forniscono una valutazione quantitativa della densità ossea. In teoria, la velocità con cui l’onda sonora si propaga attraverso l’osso dipende dalla densità e dalla qualità dell’osso stesso. Densità e qualità sono i due determinanti della resistenza dell’osso, pertanto la velocità di propagazione del suono può correlarsi al rischio di frattura. Alcuni densitometri ad ultrasuoni (misurazione a livello delle falangi) valutano quindi due parametri: la velocità di propagazione dell’onda sonora (SOS) e l’attenuazione della velocità di propagazione dell’onda sonora (BUA). Nei densitometri che misurano al calcagno, tali parametri sono stati combinati in un unico parametro chiamato stiffness index. Il basso costo, la praticità degli apparecchi (di solito sono trasportabili) e l’assenza di radiazioni ionizzanti rendono facilmente eseguibile tale valutazione. Purtroppo la precisione di tali apparecchi e la scarsa riproducibilità dell’esame, nonché la notevole differenza di rilevazione esistente tra le diverse apparecchiature non hanno ancora permesso di utilizzare tale metodica nel follow-up del paziente. Tale metodica trova comunque una sua collocazione quale esame di screening sulla popolazione e nella valutazione delle osteoporosi secondarie.
Densitometria Ossea e Osteoporosi
Nell’ambito della valutazione dell’osteoporosi, l’organizzazione mondiale della Sanità (WHO) ha validato la misura della BMD tramite DEXA, definendo 3 diverse categorie:
- NORMALE: T-score > -1
- OSTEOPENIA: -1> T-score >-2.5
- OSTEOPOROSI: T-score <-2.5
- OSTEOPOROSI CONCLAMATA: T-score <-2.5 con frattura osteoporotica
La DEXA nell’ambito dell’osteoporosi viene utilizzata (1) per la diagnosi, (2) insieme ad altri fattori, nell’ambito dell’algoritmo per la valutazione del rischio fratturativo (FRAX), (3) per monitorare i pazienti in terapia.
Infine ricordiamo che, se pur è vero che i trattamenti dell’osteoporosi primitiva sono mirati a riportare a valori di BMD nel range di norma, rimane comunque fondamentale individuare eventuali cause di osteoporosi secondaria, nelle quali il trattamento appare assai più complesso. La misurazione della BMD tramite DEXA, infatti, non permette in alcun modo di distinguere forme di osteoporosi primitiva da quelle secondarie; sarà quindi compito del clinico valutare correttamente il paziente in modo da potergli garantire il trattamento più completo possibile, eventualmente associando alla valutazione densitometrica quella ecografica tramite ultrasonometria ossea.
Diverse sono le linee-guida alle quali attenersi nell’esecuzione dell’esame densitometrico e nell’interpretazione dei risultati.
INDICAZIONI ALL’ESECUZIONE DI DENSITOMETRIA OSSEA
Secondo l’International Society of Clinical Densitometry devono essere sottoposte a densitometria ossea:
- tutte le donne di età superiore ai 65 anni
- tutte le donne in menopausa di età inferiore ai 65 con fattori di rischio per osteoporosi
- tutte le donne in periodo peri-menopausale con fattori di rischio clinici quali basso peso corporeo, precedente frattura o utilizzatrici di farmaci ad alto rischio per osteoporosi
- maschi di età superiore ai 70 anni
- maschi di età inferiore ai 70 anni con fattori di rischio per osteoporosi
- tutti gli adulti con precedente frattura da fragilità
In generale raccomandano l’esecuzione di densitometria ossea in
- tutti gli adulti con una patologia o una condizione fisica associate a ridotta massa ossea o a perdita di massa ossea
- tutti gli adulti che assumono terapie associate a ridotta massa ossea o a perdita di massa ossea
- tutti i soggetti per i quali si presuppone un trattamento farmacologico
- tutti i soggetti in trattamento farmacologico per monitorare gli effetti della terapia
- tutti i soggetti non in trattamento, nei quali l’eventuale riscontro di perdita di massa ossea indurrebbe l’inizio di una terapia
- tutte le donne al momento in cui interrompono la terapia estro-progestinica sostitutiva
In Italia il Servizio Sanitario Nazionale ha demandato alle single Regioni la stesura dei LEA (Livelli Essenziali di Assistenza) ai quali bisogna attenersi nella prescrizione di una Densitometria Ossea tramite il SSN, indipendentemente dalle linee-guida internazionali.
INTERPRETAZIONE DEI RISULTATI DELLA DENSITOMETRIA OSSEA
Nelle donne in post-menopausa (e nel periodo peri-menopausale) e nei maschi di età superiore ai 50 anni
- si utilizza il T-score
- si applicano i criteri WHO
Nelle donne in pre-menopausa e nei maschi di età inferiore ai 50 anni
- si utilizza lo Z-score invece del T-score
- Z-score < -2.0 viene definito come “inferiore al range atteso per età”
- Z-score > -2.0 viene definito come “nel range atteso per età”
Il limite della densitometria ossea DEXA è che esegue una proiezione piana dell’osso (areale non volumetrica, non considera il volume dell’osso). Nel bambino tale volume appare ridotto rispetto all’adulto, per cui si raccomanda di controllare sempre la precisione dell’area che viene analizzata e sono state calcolate delle correzioni da applicare al risultato ottenuto. Si utilizza il solo Z-score e la terminologia utilizzata prevede “normale o ridotta densità minerale ossea in rapporto all’età cronologica”.
BIBLIOGRAFIA
- NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy, March 7-29, 2000: highlights of the conference. South Med J 2001, 94: 569-73.
- World Health Organization: FRAX WHO fracture risk assessment Tool.
- Blake GM, Fogelman I. The clinical role of dual energy X-ray absorptiometry. Eur J Radiol 2009, 71: 406-14.
- Binkley N, Bilezikian JP, Kendler DL, et al; International Society for Clinical Densitometry.Official positions of the International Society for Clinical Densitometry and Executive Summary of the 2005 Position Development Conference. J Clin Densitom 2006, 9: 4-14.
- Bonnick SL. Bone Densitometry in Clinical Practice. Application and Interpretation. Humana Press, Third Edition 2010.
Trabecular Bone Score (TBS)
Sara Cassibba
Endocrinologia e Diabetologia, Ospedale Papa Giovanni XXIII, Bergamo
(aggiornato al 28 aprile 2015)
Definizione e metodica
Il Trabecular Bone Score (TBS) è un indice studiato per fornire una valutazione della micro-architettura ossea, che risulti facilmente applicabile alla pratica clinica. La micro-architettura è una componente fondamentale della resistenza ossea (1), tuttavia le tecnologie utilizzate per la sua determinazione diretta (indagini istomorfometriche, HRpQCT e RMN) sono applicabili al solo ambito della ricerca. Il TBS fornisce una stima indiretta della qualità dell’osso e correla con i parametri valutati dai metodi d’analisi diretta, in particolare con il numero e la connettività delle trabecole e con l’ampiezza degli spazi inter-trabecolari (2).
L’algoritmo matematico per il calcolo del TBS si basa sulla valutazione della trama dell’immagine densitometrica a doppio raggio X della colonna lombare. Viene elaborato in pochi minuti da un software istallato sui densitometri di ultima generazione, senza aumento dei tempi d’esame per il paziente.La proiezione bidimensionale di un osso trabecolare con buona micro-architettura differisce da quella di un osso degradato per la distribuzione spaziale e l'ampiezza delle variazioni d'intensità dei pixel. L’informazione che deriva da tale analisi fornisce un dato quantitativo che correla con la resistenza dell’osso alla frattura ed è complementare e indipendente rispetto alla densità minerale ossea (DMO): a parità di DMO è possibile avere una micro-architettura più o meno compromessa (fig. 1) (2).
Il valore di TBS è calcolato per ogni vertebra e per la colonna lombare nel suo complesso. Sono escluse dall'analisi le vertebre fratturate o con alterazioni artrosiche evidenti.


Figura 1. Esempio di come il TBS risulti indipendente dalla DMO ed esemplificazione dei principi del TBS: trabecole più numerose, connesse e meno sparse si traducono in elevati valori di TBS; un basso numero di trabecole con scarsa connessione ed elevata separazione esitano in un basso TBS (2).
La tabella 1 mostra i cut-off del TBS nelle donne in post-menopausa (3). Non sono ancora stati proposti intervalli equivalenti per gli uomini (2).
| Tabella 1 Cut-off di TBS nelle donne in post-menopausa (proposto da un gruppo di lavoro internazionale di utliizzatori del TBS) |
|
| Valore di TBS | Classificazione |
| ≤ 1200 | Micro-architettura degradata |
| 1200-1350 | Micro-architettura parzialmente degradata |
| ≥ 1350 | Micro-architettura normale |
Applicazioni
Il TBS può essere utilizzato come parametro del rischio di frattura, indipendente dalla DMO, nelle donne in post-menopausa con età ≥ 50 anni. In questa categoria di soggetti studi traversali dimostrano che valori ridotti di TBS correlano con la presenza di tutti i tipi di frattura osteoporotica; studi prospettici evidenziano la capacità del TBS di essere un fattore di rischio di frattura da fragilità, indipendente dalla DMO. Negli uomini e nei soggetti giovani non sono disponibili dati sufficienti (2).
L’uso del TBS è di particolare utilità nelle situazioni in cui l’aumentato rischio di frattura da fragilità risulti sottostimato dalla DMO, come le osteopenie, in cui si verifica il maggior numero di fratture da fragilità (4), e le osteoporosi secondarie (5). Studi preliminari hanno messo in evidenza che l’uso combinato del TBS e della DMO nell’ambito dell’algoritmo FRAX migliora la stima del rischio di frattura (2).
Il TBS non ha utilità comprovata nel monitoraggio di efficacia delle terapie per l’osteoporosi. Con i farmaci anti-riassorbitivi i cambiamenti del TBS sono nettamente inferiori rispetto a quelli della DMO, in linea con il meccanismo conservativo di questa categoria di farmaci. Il teriparatide determina un aumento del TBS inferiore ma concorde con la DMO, come atteso per l’effetto anabolico del farmaco. Nel complesso gli studi riportano che il 30-60% dei pazienti che assume farmaci per l’osteoporosi ottiene in 2-3 anni un aumento del TBS che eccede il least significant change (2). Risulta ancora in via di definizione se l’aumento del TBS in corso di trattamento farmacologico rifletta un indice di efficacia anti-fratturativa.
Limiti tecnici
La presenza di obesità viscerale può inficiare la stima del TBS per l’eccessiva rappresentazione dei tessuti molli sovrastanti la regione di interesse. Il software tiene conto dell’indice di massa corporea (BMI), che tuttavia non distingue l’accumulo addominale dell’adipe dall’adiposità presente in altri siti. L'adeguamento del TBS è peraltro ottimizzato solo per valori di BMI compresi tra 15 e 35 kg/m2.
Un altro importante limite è legato all’impossiblità di confrontare i risultati del TBS ottenuti da diversi densitometri, a meno di un processo di calibrazione (2).
Conclusioni
Il TBS è una tecnologia promettente e applicabile alla routine clinica che fornisce dati complementari e indipendenti rispetto alla DMO e permette una migliore stima del rischio di frattura nelle donne in post-menopausa con età ≥ 50 anni. Sono necessari ulteriori studi per validare l'introduzione del TBS nell'ambito degli algoritmi di stima del rischio fratturativo, per verificarne l'applicabilità nello studio della popolazione maschile e di soggetti con BMI 35 kg/m2.
Bibliografia
- NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001, 285: 785-95.
- Silva BC, Leslie WD, Resch H, et al. Trabecular bone score: a noninvasive analytical method based upon the DXA image. J Bone Miner Res 2014, 29: 518-30.
- Cormier C, Lamy O, Poriau S. TBS in routine clinical practice: proposals of use. For the Medimaps Group, 2012.
- Siris ES, Chen YT, Abbott TA, et al. Bone mineral density thresholds for pharmacological intervention to prevent fractures. Arch Intern Med 2004, 164: 1108-12.
- Ulivieri FM, Silva BC, Sardanelli F, et al. Utility of the trabecular bone score (TBS) in secondary osteoporosis. Endocrine 2014, 47: 435-48.
Radiofrequency Echographic Multi Spectrometry (REMS)
Serena Palmieri
Endocrinologia, Fondazione IRCCS Ca' Granda, Ospedale Maggiore Policlinico, Milano
(aggiornato al 31 marzo 2024)
La REMS (Radiofrequency Echographic Multi Spectrometry) è una tecnologia innovativa non ionizzante, che permette la diagnosi di osteoporosi e la valutazione del rischio di fratture da fragilità tramite una scansione ecografica dei siti anatomici assiali di riferimento, collo femorale (FN) e colonna lombare (LS) (1).
Principi di funzionamento
La stima della BMD (Bone Mineral Density) mediante densitometria DXA (Dual Energy X-ray Absorbtiometry) e REMS è equivalente in termini di approccio concettuale. Mentre per la DXA vi è una interazione dei raggi X con il tessuto osseo, per la REMS vengono utilizzati segnali ecografici nativi non filtrati (detti anche segnali ultrasonici a radiofrequenza, RF) ottenuti mediante una scansione ecografica del collo del femore e delle vertebre lombari (figura 1).
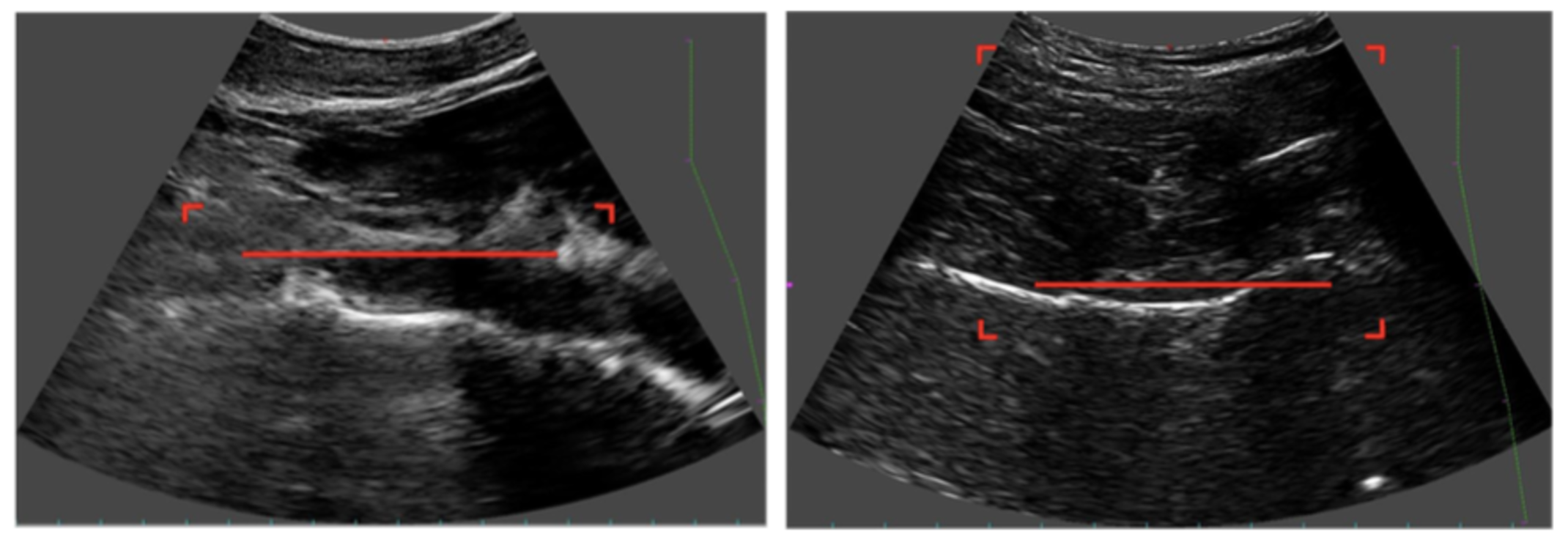
Figura 1
Regolazione ottimale della profondità di scansione e posizione del fuoco durante la scansione ecografica
Colonna vertebrale (sinistra): la profondità di scansione va regolata in modo da avere le interfacce vertebrali nella porzione verticalmente ed orizzontalmente centrale dell’immagine B-Mode. La posizione del fuoco (linea rossa) va scelta in modo che la linea rossa sia vicina alle vertebre ma sempre al di sopra di esse.
Femore prossimale (destra): l’interfaccia del collo femorale è posta al centro dell’immagine ecografica, parallela alla linea del fuoco e al di sotto di essa.
Il segnale generato dall’interazione dei segnali a RF con il tessuto osseo viene quindi rilevato da un sensore dedicato e tradotto in un valore quantitativo (N-REMS), che, attraverso successivi processi di calibrazione e confronto con una serie di curve di riferimento, consente di ottenere una stima della BMD, del T-score e dello Z-score (figura 2 e figura 3) (2).
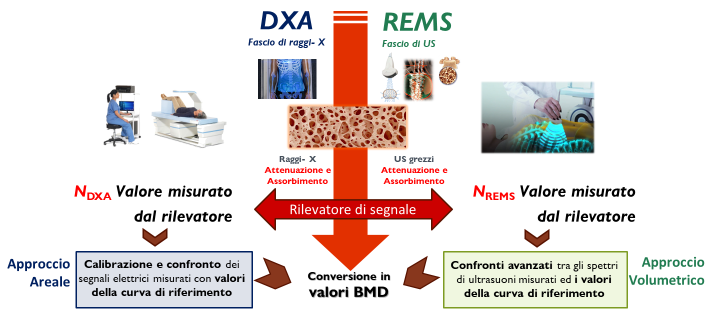
Figura 2. Principi di funzionamento
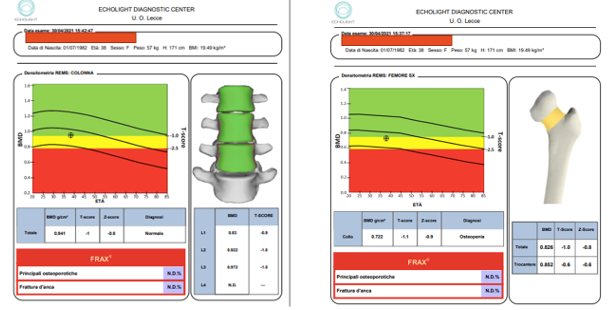
Figura 3. Esempio di referto REMS
La REMS, attraverso l'analisi di spettri di singole linee di scansione ha il vantaggio di consentire l’identificazione e l'esclusione automatica dei segnali corrispondenti ad artefatti, come calcificazioni vascolari e osteofiti, che normalmente determinano una sovra-stima della BMD misurata con metodica DXA. In una coorte di 500 pazienti affetti da artrosi diagnosticata radiologicamente, la percentuale di pazienti classificati come osteoporotici sulla base della BMD misurata con metodica REMS è risultata nettamente più elevata rispetto a quella dei pazienti classificati come osteoporotici sulla base della BMD misurata con la DXA (rispettivamente, 39.4% vs 15.1% per FN + LS e 30.5% vs 6.0% considerando solo LS), confermando quanto già evidenziato in precedenti studi e case-report (3).
Validazione clinica
L'accuratezza della tecnologia REMS per la stima della BMD è stata validata attraverso differenti studi clinici mediante confronto con la DXA, che rimane ad oggi il gold standard per la diagnosi di osteoporosi.
Il primo di questi studi è stato condotto su un campione di 1914 donne in menopausa (51-70 anni) reclutate in 6 diversi centri italiani (4). Nel dataset primario (n = 1195 esami LS, n = 1373 esami FN), ottenuto escludendo tutti i casi di DXA e REMS con errori (per quanto riguarda la REMS errori nell’impostazione del fuoco e scelta della profondità durante la scansione ecografica), è stata evidenziata una buona concordanza tra le due metodiche, pari all’88.8% (k = 0.824, p < 0.001) per LS e 88.2% (k = 0.794, p < 0.001) per il FN, con sensibilità e specificità della REMS > 90% nel discriminare i pazienti osteoporotici dai non osteoporotici per entrambi i siti anatomici (4). Un ulteriore interessante risultato dello studio è rappresentato dalla precisione e ripetibilità delle misure ottenute con REMS, entrambe valutate come Coefficiente di Variazione dell’Errore Quadratico Medio (CV-RMS): la precisione è risultata pari a 0.38% per LS e 0.32% per il FN, per una variazione minima significativa (LSC) del 1.05% e 0.88%, rispettivamente; la ripetibilità inter-operatore è stata valutata in 0.54% per LS e 0.48% per FN. Questi valori risultano significativamente inferiori a quelli riportati in letteratura relativamente alla tecnologia DXA, offrendo un vantaggio in un’ottica di monitoraggio a breve termine dello stato osseo (4).
Questi risultati sono stati riconfermati in un ampio studio multicentrico Europeo, condotto su 4307 donne di etnia caucasica, di età compresa tra 30 e 90 anni, dove la REMS ha mostrato sensibilità e specificità nel discriminare i pazienti osteoporotici dai non osteoporotici del 90.4% e 95.5%, rispettivamente, per il FN e 90.9% e 95.1% per LS (5). In questo studio la REMS ha mostrato inoltre un’ottima capacità nel discriminare i pazienti con pregressa frattura osteoporotica, con un’area sotto la curva (AUC) del T-score nella curva ROC maggiore rispetto a DXA, sia per LS che per FN (5).
REMS ha mostrato di essere una tecnologia affidabile per la diagnosi dell'osteoporosi anche nella popolazione maschile, confermando quanto già osservato nei precedenti studi condotti esclusivamente sulle donne. In una coorte di 603 maschi caucasici tra i 30 e i 90 anni la tecnologia REMS ha mostrato sensibilità e specificità nel discriminare i pazienti osteoporotici dai non osteoporotici del 90.1% e 93.6%, rispettivamente, per LS e del 90.9% e 94.6% per FN (6). I valori del T-score stimati dalla REMS sono risultati altamente correlati con i valori di T-score forniti dalla DXA, documentando l’esistenza di una sostanziale equivalenza tra le due tecniche di misurazione (r = 0.91, p < 0.0001 per LS e r = 0.90, p < 0.0001 per FN) (6). Anche negli uomini la REMS ha mostrato ottimi risultati in termini di precisione a breve termine e ripetibilità tra operatori, superiori a quelli della DXA (6).
Dati preliminari suggeriscono come la tecnologia REMS possa essere più sensibile nel valutare lo stato osseo nei pazienti affetti da diabete mellito tipo 2 (DM2) rispetto alla DXA, che, paradossalmente, sovra-stima i valori di BMD in questa categoria di pazienti ad alto rischio di fratture da fragilità. In uno studio condotto in 90 donne affette da DM2 e confrontate con 90 controlli sani di pari età e sesso, i valori di BMD calcolati mediante DXA sono infatti risultati più alti nelle pazienti rispetto ai controlli, mentre i valori di BMD stimati dalla REMS sono risultati più bassi nelle pazienti rispetto ai controlli, anche se in maniera non significativa (7). La BMD mediante REMS ha consentito di classificare come osteoporotiche un numero maggiore di donne con DM2, rispetto alla BMD mediante DXA (47.0% vs 28.0%, rispettivamente) (7).
Predizione del rischio di frattura e Fragility Score
Nel 2020 è stato pubblicato uno studio osservazionale prospettico condotto su 1370 donne di età compresa tra i 30 e i 90 anni seguite per 5 anni, volto a indagare la capacità del T-score misurato con la REMS, rispetto alla DXA, di predire la frattura da fragilità (8). L’incidenza totale di fratture nello studio è stata del 14.0%. Per la LS, considerando il cut-off del T-score di -2.5, la REMS ha identificato i pazienti fratturati con sensibilità del 65.1% e specificità del 57.7% (OR = 2.6, AUC = 0.65), mentre la DXA ha mostrato sensibilità del 57.1% e specificità del 56.3% (OR = 1.7, AUC = 0.61). Per il FN la capacità predittiva del T-score è risultata simile tra REMS e DXA, con AUC non significativamente differenti (8).
La tecnologia REMS è stata recentemente implementata con il Fragility Score (FS), con l'obiettivo di valutare la micro-architettura ossea e fornire una stima del rischio di frattura indipendente dalla BMD. Il FS è un parametro adimensionale, calcolato confrontando gli spettri specifici del paziente con modelli di riferimento per spettri ossei classificati come “fragili” e “non fragili”, precedentemente ottenuti da soggetti con o senza fratture da fragilità. In uno studio osservazionale prospettico condotto su una coorte di 1989 pazienti caucasici di entrambi i sessi e di età compresa tra 30 e 90 anni, il FS ha identificato in maniera efficace i pazienti a rischio di fratture da fragilità incidenti nel breve termine (5 anni), con valori di AUC significativamente più alti di quelli ottenuti con i T-score misurati sia mediante DXA che REMS (AUC = 0.811 per le donne e 0.780 per gli uomini) (9).
Conclusioni e prospettive future
La tecnologia REMS, eseguita da operatori adeguatamente formati, ha dimostrato elevata accuratezza nella diagnosi di osteoporosi rispetto al gold standard DXA, con il vantaggio di essere trasportabile e priva di radiazioni ionizzanti. Sono necessari ulteriori studi per comprendere le popolazioni in cui la tecnologia REMS potrebbe rappresentare un’alternativa migliore alla DXA per la diagnosi di osteoporosi, la stima del rischio fratturativo e il follow-up. Ad oggi ai fini della rimborsabilità dei farmaci per l’osteoporosi non si può ancora prescindere dalla DXA.
Bibliografia
- Diez-Perez A, Brandi ML, Al-Daghri N, et al. Radiofrequency echographic multi-spectrometry for the in-vivo assessment of bone strength: state of the art-outcomes of an expert consensus meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging Clin Exp Res 2019, 31: 1375-89.
- Conversano F, Franchini R, Greco A, et al. A novel ultrasound methodology for estimating spine mineral density. Ultrasound Med Biol 2015, 41: 281-300.
- Caffarelli C, Al Refaie A, Mondillo C, et al. The advantages of radiofrequency echographic multispectrometry in the evaluation of bone mineral density in a population with osteoarthritis at the lumbar spine. Diagnostics (Basel) 2024, 14: 523.
- Di Paola M, Gatti D, Viapiana O, et al. Radiofrequency echographic multispectrometry compared with dual X-ray absorptiometry for osteoporosis diagnosis on lumbar spine and femoral neck. Osteoporos Int 2019, 30: 391-402.
- Cortet B, Dennison E, Diez-Perez A, et al. Radiofrequency Echographic Multi Spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone 2021, 143: 115786.
- Adami G, Brandi ML, Caffarelli C, et al. Bone health status evaluation in men by means of REMS technology. Aging Clin Exp Res 2024, 36: 74.
- Caffarelli C, Tomai Pitinca MD, Al Refaie A, et al. Ability of radiofrequency echographic multispectrometry to identify osteoporosis status in elderly women with type 2 diabetes. Aging Clin Exp Res 2022, 34: 121-7.
- Adami G, Arioli G, Bianchi G, et al. Radiofrequency echographic multi spectrometry for the prediction of incident fragility fractures: a 5-year follow-up study. Bone 2020, 134: 115297.
- Pisani P, Conversano F, Muratore M, et al. Fragility Score: a REMS-based indicator for the prediction of incident fragility fractures at 5 years. Aging Clin Exp Res 2023, 35: 763-73.
TC e RM nello studio dell'osso
Roberto Cesareo (con la collaborazione di Mario Iozzino - Radiologo)
Endocrinologia, Ospedale S. Maria Goretti, Latina
Tomografia computerizzata quantitativa (QCT)
La tomografia computerizzata quantitativa è l'unica tecnica non invasiva che misura la reale densità di tessuto osseo in un determinato volume (mg/cm3) senza la sovrapposizione di altri tessuti e che consente il calcolo separato della componente ossea trabecolare e corticale. Questa tecnica viene eseguita con i comuni scanner utilizzati per calcolare la densità ossea, utilizzando però appositi fantocci standard di riferimento.
La QCT è eseguita generalmente a livello del rachide lombare. In ciascuna vertebra esaminata viene definita una ROI (region of interest) costituita solo da osso trabecolare, i cui valori vengono convertiti, sulla base della calibrazione del phantom, in valori equivalenti di densità minerale. Tuttavia per distinguere correttamente le tre frazioni (osso, midollo rosso e midollo giallo) è necessaria una QCT a doppia energia, altrimenti il midollo giallo per la sua bassa densità determina una sottostima della densità esaminata.
La QCT può essere utilizzata anche con la tecnica volumetrica (vQCT), che consente l'analisi tridimensionale della regione analizzata e che permette tale valutazione anche in altri segmenti scheletrici come il collo femorale. Se, inoltre viene eseguita ad alta risoluzione (µCT) la metodica consente di rilevare importanti aspetti di tipo biomeccanico dell'osso, quali lo spessore trabecolare, la distanza intra-trabecolare e la disposizione spaziale delle trabecole ed il momento d'inerzia. Negli ultimi anni sono stati progettati e commercializzati anche apparecchi che effettuano tomografia computerizzata periferica (pQCT), in genere utilizzati per l'analisi scheletrica di segmenti distali quali il radio ultra-distale o la regione distale della tibia.
Gli svantaggi di questa metodica, anche se attenuati con l'utilizzo di pQCT, sono i costi elevati e l'elevato irradiazione, per cui non può essere indicata come esame di I° livello nel paziente con osteoporosi, né tanto meno nel follow-up dei pazienti in trattamento farmacologico.
Risonanza magnetica
Nella RM convenzionale il tessuto osseo ha una bassa intensità di segnale e appare nero per la scarsa numerosità di protoni. Pertanto per fornire immagini relative alla struttura ossea, la RM ha necessità di sfruttare il segnale proveniente dal grasso del midollo giallo e dei tessuti circostanti.
La RM è operatore- e centro-dipendente (per scelta dei piani di studio, delle sequenze, dei mezzi di contrasto e per l’interpretazione dei reperti).
Vantaggi: riproducibilità, accuratezza, utilizzo di radiazioni non ionizzanti, elevata risoluzione di contrasto, visione multiplanare, ampia copertura dello scheletro, fino all’RM “whole body” (WBMRI).
Svantaggi: indagine non standardizzata, bassa specificità delle alterazioni di segnale (pur essendo alta la sensibilità; perciò i reperti dubbi in caso di diagnostica differenziale con fratture patologiche devono essere integrati con la clinica, i dati di laboratorio e l’eventuale valutazione microscopica di campioni bioptici), accessibilità limitata con il sistema sanitario nazionale, costi ancora elevati, controindicazioni (per coloro che non possono essere esposti ai campi magnetici: pace-maker, mezzi di osteosintesi non RM-compatibili).
La RM ha aperto nuove possibilità alla radiologia diagnostica per la valutazione dell’osso e del midollo osseo. La RM è la sola tecnica capace di visualizzare direttamente il midollo osseo nelle sue componenti di midollo rosso e giallo. L’intensità del segnale riflette le componenti principali del midollo osseo. L’osso trabecolare-corticale manca quasi completamente di protoni mobili, che danno un segnale basso oppure nullo. Vi sono tre pattern non specifici di RM di midollo patologico:
- focale, caratterizzato dalla presenza di un’area di sostituzione del midollo normale
- diffuso omogeneo
- diffuso eterogeneo (aspetto variegato a sale e pepe).
Il pattern diffuso omogeneo o variegato si osserva frequentemente nelle malattie ematologiche. Per contro è possibile un aspetto osteomidollare normale all’esame RMN in pazienti con compromissione midollare documentata solo da biopsia. La RM è superiore alla TC nell’individuare il pattern focale in assenza di osteolisi.
La RM non ha ancora trovato un ruolo nella quantificazione del rischio di frattura, valutando per ora il crollo già avvenuto.
L’aspetto in RM del tessuto osteomidollare dipende molto dalla sequenza usata e dal contenuto relativo di acqua e grasso al suo interno.
- Sequenza convenzionale SE (spin echo) T1 pesata: efficace per lo studio del tessuto osteomidollare, grazie alla capacità di evidenziare la differente intensità di segnale del midollo rosso e giallo, alla capacità sufficientemente elevata di individuare la patologia osteo-midollare, alla buona qualità di immagine e ai tempi di acquisizioni relativamente brevi. Gli svantaggi di tale sequenza comprendono la bassa specificità, dal momento che la maggior parte delle patologie osteo-midollari ha bassa intensità di segnale, e la sensibilità relativamente bassa in età pediatrica per la somiglianza di intensità di segnale fra il midollo rosso normale ed il basso segnale delle patologie midollari in questa sequenza.
- Sequenza SE (spin echo) T2 pesata: è di buona sensibilità nell’individuazione della patologia midollare e permette una buona individuazione della componente fluida delle lesioni; tuttavia la qualità delle immagini è intermedia ed il tempo di acquisizione medio-lungo.
- Sequenze Fast SE T2 pesate: hanno ampliamente rimpiazzato le convenzionali SE T2 pesate, grazie alla notevole riduzione del tempo di esame. Tuttavia nonostante questo vantaggio e la buona qualità di immagine, la sequenza FSE T2 pesata presenta uno svantaggio importante rappresentato dall’elevato segnale proveniente dal grasso, che diminuisce il contrasto fra lesioni ed osso normale.
- Sequenze a soppressione del grasso: sono considerate le più sensibili ad individuare la patologia; esistono 4 tipi principali di sequenze a soppressione del grasso: 1) Short T1 inversion recovery (STIR); 2) saturazione selettiva; 3) sequenze a chemical shift; 4) sequenze ad opposizione di fase. Le sequenze in soppressione del grasso eseguite sul piano sagittale consentono di apprezzare l’eventuale presenza di edema intra-spongioso, indice di frattura recente per i somi vertebrali crollati.
- Sequenze in diffusione: l’aumento del liquido interstiziale nell’edema del midollo osseo dovuto ad una frattura da compressione benigna può essere differenziabile dalla ridotta mobilità delle molecole d’acqua che si ha nell’infiltrazione di cellule tumorali. L’ipo e isointensità riflette il crollo acuto benigno, mentre l’iperintensità e’ indicativa di infiltrazione tumorale. I lavori pubblicati in letteratura riportano che le sequenze di diffusione sono uno strumento addizionale per differenziare le fratture vertebrali dovute ad un crollo osteoporotico con edema midollare dal crollo metastatico.
Sulla base dell’imaging morfologico, si esegue posizionamento del volume di acquisizione spettroscopica (VOI) ed il calcolo dei coefficienti di diffusione apparente (ADC), che sono significativamente più bassi nella malattia metastatica rispetto a quelli dell’edema midollare, e più bassi nel soggetto osteoporotico rispetto al soggetto normale.
Dopo iniezione di gadolinio, il midollo osseo normale non mostra alterazioni di intensità di segnale nelle sequenze T1 pesale. Al contrario, le lesioni neoproduttive presentano un importante aumento di segnale.
L’imaging RM dopo mdc con sequenze gradient-echo in opposizione di fase, in cui il midollo ematopoietico ha una bassa intensità di segnale, diversamente dall’intensità intermedia del midollo adiposo, si è dimostrato adatto ad evidenziare il coinvolgimento del midollo osseo.
L’enhancement del midollo osseo non è adeguatamente valutabile con le sequenze SE T1 pesate, ma meglio analizzato con sequenze dinamiche ultraveloci. L’enhancement del midollo osseo normale diminuisce con l’età e con la conversione adiposa, pur con variabilità interindividuale. L’imaging rapido dinamico dopo iniezione di gadolinio può dimostrare un’anomala impregnazione del midollo anche nel caso di coinvolgimento midollare diffuso.
Recentemente sono state sviluppate particelle superparamagnetiche di ossido di ferro di piccole dimensioni, per valutare l’attività fagocitaria anche del midollo osseo. Queste sono captate dal sistema reticolo-endoteliale del midollo osseo e riducono il segnale T1 e T2 del midollo osseo normale, migliorando così il contrasto fra midollo normale ed infiltrato.
La RM del midollo osseo dimostra accuratamente l'edema intra-spongioso in sede di frattura, l’estensione della frattura, la presenza di compressione spinale associata, ed è utile nella diagnosi differenziale delle fratture vertebrali, specialmente con l’uso delle sequenze RM pesate in diffusione. Inoltre stima i tempi dell'evento fratturativo, in quanto il grado di edema intra-spongioso individuato con le sequenze STIR e anche con le sequenze T2 a soppressione del grasso riflette sia la severità che l'età della frattura valutata. La RM inoltre, anche senza mdc, costituisce un esame utile al fine di una distinzione tra frattura osteoporotica e frattura neoplastica: un segnale di tipo grasso, la preservazione dei peduncoli vertebrali, l'integrità del muro posteriore, l'assenza di masse di tessuto solido sono tutti segni indiretti di benignità, fermo restando che nei casi di difficile inquadramento diagnostico la biopsia ossea rimane l'esame gold standard.
La RM è inoltre la tecnica radiologica di riferimento nell'imaging pre- e post-vertebroplastica. Questa consiste nell’iniezione di cemento sintetico sotto guida fluoroscopica o TC all’interno di un corpo vertebrale divenuto patologico per osteoporosi, traumi, angiomi, metastasi, neoplasie ematologiche. Dall'imaging RM post-vertebroplastica è possibile valutare la distribuzione del cemento nel corpo vertebrale: il cemento acrilico si presenta come un’area focale intra-spongiosa prevalentemente ovalare, ma anche rotondeggiante e a carta geografica, e tale aspetto tende a stabilizzarsi dopo 6 mesi dal trattamento. Viene inoltre valutata la omogeneità o disomogeneità di distribuzione del cemento. Il cemento appare ipointenso in T1 e T2, l'alone peri-cementizio ipointenso in T1 ed iperintenso in T2, espessione di edema della spongiosa. Il segnale nell’area limitrofa al cemento ha modesto incremento dopo trattamento, spiccato incremento ad un mese dal trattamento, riduzione di intensità dopo sei mesi dal trattamento. L’esame RM viene eseguito prima e dopo il trattamento, al fine di valutarne gli effetti sulle dimensioni delle vertebre.

Nell'immagine TC multistrato a sinistra si evidenzia netta frattura di D9 e D11 e deformazione con avvallamento della limitante somatica superiore di L1 e L4, e inferiore di L2. Nell'immagine STIR a destra (sequenza Inversion Recovery ) si evidenzia edema della spongiosa del corpo vertebrale di D3, D4, D5, D6, indice di lesione recente.
Bibliografia
- Vande Berg BC, Malghem J, Lecouvet FE, et al. Magnetic resonance imaging of normal bone marrow. Eur Radiol 1998, 8: 1327-33.
- Vanel D, Dromain C, Tardivon A. MRI of bone marrow disorders. Eur Radiol 2000, 10: 224-9.
- Vande Berg BC, Malghem J, Lecouvet FE, et al. Classification and detection of bone marrow lesions with magnetic resonance imaging. Skel Radiol 1998, 27: 529-45.
Morfometria vertebrale
Roberto Cesareo (con la collaborazione di Mario Iozzino - Radiologo)
Endocrinologia, Ospedale S. Maria Goretti, Latina
La frattura vertebrale si manifesta come deformazione del corpo vertebrale per riduzione di una delle sue altezze, senza evidenza di una discontinuità dell'osso. La valutazione semiquantitativa secondo la classificazione di Genant consente di visualizzare le fratture da fragilità ossee e di classificarle a seconda della percentuale di riduzione delle altezze vertebrali in fratture di grado lieve, moderato o severo. La morfometria vertebrale è la tecnica che consente di misurare le altezze vertebrali anteriore, centrale e posteriore, con una determinazione di tipo quantitativo delle fratture vertebrali su base osteoporotica. In base a tale misurazione, le fratture vertebrali vengono distinte come fratture a cuneo anteriore, biconcava e da compressione, a seconda del numero delle altezze vertebrali coinvolte. La morfometria vertebrale viene eseguita su immagini ottenute con apparecchio radiologico tradizionale (morphometric X-ray Radiography, MRX) o su quelle ottenute con apparecchio per densitometria eseguite con tecnica assorbimetrica (Morphometric X-ray Absorbimetry, MXA). In base a tali esami, viene definita frattura vertebrale una riduzione di una delle altezze del corpo vertebrale del valore soglia di 4 mm o del 15%.

Morfometria radiografica (MRX)
E' bene subito precisare che la morfometria vertebrale è un esame quantitativo e non è in grado di discernere le vere fratture vertebrali dalle deformità non su base osteoporotica (ernie di Schmorl, scoliosi, morbo di Scheuermann, ecc.). Pertanto, per evitare anche accanimenti terapeutici ingiustificati, sarebbe corretto che la prima valutazione di un radiogramma effettuato per valutare eventuali fratture vertebrali fosse eseguita attraverso la valutazione di metodi semiquantitativi (metodi di Genant), che è rivolta a valutare le fratture di grado moderato o severo oltre che ad escludere altre cause di deformità vertebrali. Quando, tuttavia, in caso di deformazioni lievi, tale approccio risulti insufficiente a stabilire se l'entità della deformazione abbia raggiunto o superato la soglia di frattura, è allora necessario misurare le altezze vertebrali, cioè effettuare la valutazione quantitativa ovvero la morfometria vertebrale.
L'esame viene eseguito su immagini radiografiche in proiezione laterale del rachide del tratto toracico e lombare. Le altezze vertebrali vengono misurate posizionando manualmente o con apposito software dedicato punti di repere in numero di 6, di cui 3 superiori e 3 inferiori, sui corpi vertebrali. E' importante, per evitare artefatti, che il paziente venga posizionato in posizione laterale in modo da valutare per ciascuna vertebra una sola limitante superiore ed inferiore e che la vertebra T12 e L1 risultino visualizzabili sia sulle radiografie del tratto toracico che lombare.

Morfometria assorbimetrica (MXA)
Questa metodica può essere eseguita con i densitometri di ultima generazione. Il vantaggio della metodica si deve alla dose radiante sensibilmente più bassa. Infatti, l'ultima generazione di densitometri produce un fascio di raggi X a ventaglio che, dopo collimazione a fessura, attraversano l'oggetto e vengono letti da una schiera di rilevatori. Con questa tecnologia il fascio di raggi X viene emesso senza perdita di fotoni e quindi non è richiesta la schermatura dei locali. Inoltre la presenza di una braccio a C rotante di 90° e di un tavolo mobile consentono di ottenere una proiezione laterale della colonna dorsale e lombare, mantenendo il paziente in posizione supina. I limiti della metodica sono determinati dalla minore risoluzione spaziale delle immagini rispetto a quelle rilevate con la metodica MRX, per cui non è in grado di rilevare le fratture di grado lieve, anche se, almeno per quanto riguarda le fratture di grado moderato e severo, studi comparativi hanno rilevato una buona concordanza. Inoltre, spesso non è ben visualizzabile la parte superiore del rachide toracico, per la sovrapposizione di tessuti molli ed osso.
Ovviamente per i limiti di risoluzione spaziale sopra riportati, tale metodica non si presta a valutazioni di tipo semiquantitativo con analisi dell'esame di tipo qualitativo. L’esame eseguito con metodica MXA non può essere utilizzato, pertanto, nella diagnosi di frattura vertebrale, anche se potrebbe, in futuro, trovare una sua collocazione nel follow-up delle lesioni vertebrali diagnosticate al basale con la metodica MRX. Nella diagnosi definitiva di frattura vertebrale da fragilità sarebbe comunque importante non tanto e non solo il riscontro della riduzione in altezza dei corpi vertebrali, ma anche e soprattutto la consensuale depressione centrale del piatto vertebrale, dato anatomico scarsamente rilevabile nelle deformazioni vertebrali di tipo non fratturativo.
Bibliografia
- Genant HK, WU CY, van Kuijk C, et al. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res 1993, 8: 1137-48.
- Lewiecki EM, Laster AJ. Clinical review: Clinical applications of vertebral fracture assessment by dual-energy x-ray absorptiometry. J Clin Endocrinol Metab 2006, 91: 4215-22.
Ultrasonografia ossea (QUS)
Roberto Cesareo (con la collaborazione di Mario Iozzino - Radiologo)
Endocrinologia, Ospedale S. Maria Goretti, Latina
La QUS è una metodica ampiamente utilizzata nello studio dell’osteoporosi; essa è in grado di fornire una predizione del rischio di frattura uguale, o addirittura superiore, a quella espressa dalla DXA (tabella 1) [1,2 ].
| Tabella 1 Densitometria ossea a raggi X (DXA) ed ultrasonografia ossea (QUS) (adattato da 3) |
||
| Predittività delle fratture vertebrali | ||
| Variabile | Sito osseo | OR (95% CI) |
| BUA | Calcagno | 2.7 (1.5-4.8) |
| SOS | Calcagno | 2.8 (1.5-5.2) |
| Stiffness | Calcagno | 3.0 (1.6-5.6) |
| AD-SoS | Falangi | 2.1 (1.3-3.4) |
| UBPI | Falangi | 2.2 (1.1-4.4) |
| BMD (DXA) | Colonna lombare | 2.1 (1.2-3.9) |
| BMD (DXA) | Colonna lombare | 1.9 (1.0-3.3) |
| BMD (DXA) | Trocantere | 2.7 (1.5-4.8) |
| BMD (DXA) | Femore in toto | 2.4 (1.3-4.3 |
La QUS utilizza un fascio di ultrasuoni in trasmissione attraverso il tessuto osseo, che consente una valutazione quantitativa del contenuto minerale osseo, ma, probabilmente, anche qualitativa dell'organizzazione strutturale del sito scheletrico indagato. Questa osservazione consente di comprendere per quale motivo i risultati della QUS mostrino una correlazione molto debole con quelli ottenuti mediante DXA e chiarisce che le due metodiche non sono alternative, ma, piuttosto, complementari, in quanto i parametri QUS sono predittori indipendenti del rischio di frattura.
Un errore molto frequente che si commette utilizzando la QUS è quello di formulare una diagnosi di osteoporosi o di osteopenia sulla base dei criteri classificativi dell'OMS. Queste metodiche non hanno dati sufficienti per servire a questo scopo, che resta esclusivo della DXA, mentre sono supportate da robuste evidenze per quel che riguarda il rischio di frattura [4].
I siti ossei maggiormente utilizzati nella QUS sono il calcagno, composto prevalentemente da tessuto trabecolare, e la falange, costituita da tessuto corticale e trabecolare in percentuali simili. I parametri misurati a livello del calcagno sono la velocitaà di trasmissione (SoS - Speed of Sound) e l'attenuazione (BUA - Broadband Ultrasound Attenuation), cui si associa la stiffness, combinazione matematica di SOS e BUA; nella QUS condotta sulle falangi vengono invece misurati parametri più complessi che si ricavano dall'analisi dell'onda ultrasonora, AD-SoS (Amplitude Dependent Speed of Sound), e UBPI (Ultrasound Bone Profiler Index) [5]. Sono disponibili molte apparecchiature per l’esecuzione della QUS, anche su siti ossei differenti, quali la tibia, il polso, la patella, ma non tutte hanno dati registrativi di eguale robustezza. Le linee guida della International Society for Clinical Densitometry identificano nella QUS del calcagno l’unica metodica attualmente affidabile, sia per la valutazione del rischio di frattura, sia per l’esecuzione di indagini epidemiologiche; proprio lo screening di primo livello, volto ad individuare i soggetti da sottoporre a DXA, sembra essere l’applicazione più promettente di questo tipo di QUS, tenendo anche conto dei costi relativamente bassi dell’apparecchiatura, nonché della facile trasportabilità e dell’assenza di radiazioni [4].
Bibliografia
- Bauer DC, Gluer CC, Cauley JA, et al. Broadband ultrasound attenuation predicts fractures strongly and independently of densitometry in older women. A prospective study. Arch Intern Med 1997, 157: 629-34.
- Hans D, Dargent-Molina R, Schott AM, et al. Ultrasonographic heel measurements to predicthip fracture in elderly women: the? EPIDOS prospective study. Lancet 1996, 348: 511-4.
- Hartl F, et al. Discriminatory ability of quantitative ultrasound parameters and bone mineral density in a population-based sample of postmenopausal women with vertebral fractures: results of the Basel Osteoporosis Study. J Bone Miner Res 2002, 17: 321-30.
- Krieg MA, Barkmann R, Gonnelli S, et al. Quantitative Ultrasound in the Management of Osteoporosis: The 2007 ISCD Official Positions. J Clin Densitom 2008, 11: 163-87.
- Njeh CF, Hans D, Fuerst T et al. Quantitative Ultrasound: Assessment of Osteoporosis and Bone Status. Martin Duniz Ltd ed, Londra, 1999.
Biopsia ossea e istomorfometria
Alfredo Scillitani
Endocrinologia, Casa Sollievo della Sofferenza, San Giovanni Rotondo (FG)
(aggiornato al 10 gennaio 2017)
PREMESSE
Nella vita adulta l’osso, per l’azione coordinata delle sue cellule, organizzate nelle Unità Multicellulari di Base, a loro volta riunite in pacchetti di Unità Strutturali di Base, va incontro ad un continuo processo di riassorbimento e successiva formazione, detto rimodellamento o “turnover”. Tale processo, della durata normalmente di circa 6 mesi, inizia con il riassorbimento da parte degli osteoclasti, cui segue la deposizione della matrice ossea (osteoide) da parte degli osteoblasti, che poi va incontro alla mineralizzazione. Esso consente di rinnovare continuamente l’osso in funzione delle sue necessità (formandolo ove è necessario e riassorbendolo ove non lo è; si pensi alla riparazione di microdanni, oppure a ossa sottoposte a carico, rispetto alle stesse successivamente non sottoposte a carico per situazioni sopraggiunte come l’immobilizzazione).
Tutte le malattie metaboliche dell’osso insorte in età adulta sono caratterizzate da un’alterazione del processo di rimodellamento.
La biopsia ossea consente di prelevare una “carota” di tessuto osseo, su cui poi viene eseguita l’analisi istomorfometrica (cioè la valutazione quantitativa della microarchitettura, del rimodellamento e del metabolismo ossei), che comporta la valutazione di parametri statici e dinamici. Affinchè questi ultimi possano essere registrati, è necessario che l’osso venga “marcato” con sostanze che vengono poi rilevate.
La biopsia e la successiva analisi istomorfometrica sul campione bioptico consentono di studiare direttamente il turnover scheletrico, permettendo di verificare l’alterazione che ne è alla base. I parametri istomorfometrici misurati sono paragonati a quelli calcolati in una popolazione sana. In tal modo si comprende qual è l’alterazione del rimodellamento scheletrico.
L’istomorfometria ossea è importantissima per capire meccanismo d’azione, sicurezza e efficacia di nuovi farmaci osteotropi: infatti, a parte gli studi preclinici su modelli animali, ogni nuovo farmaco osteotropo deve essere testato con l’istomorfometria in sottogruppi di pazienti.
Scopo della istomorfometria ossea nella pratica clinica è ricavare informazioni (i.e. fare una diagnosi, valutare l’aderenza e/o la risposta alla terapia, ecc.), cui consegue un certo comportamento clinico. Naturalmente, essendo una procedura invasiva, rischio e spesa devono essere controbilanciati dalle informazioni che si possono ottenere. Di fatto, la maggior parte delle malattie metaboliche dell’osso possono essere gestite senza biopsia ossea, e comunque sarebbe impensabile e improponibile indicare sistematicamente tale metodica diagnostica, ma ci sono alcune situazioni in cui può essere suggerita la biopsia dopo marcatura con tetraciclina.
Considerando tali premesse, le indicazioni cliniche per tale procedura sono molto poche. L’istomorfometria può essere utile per:
- diagnosticare una forma subclinica di osteomalacia se si sospetta un difetto di mineralizzazione;
- diagnosticare e valutare la risposta alla terapia nell’osteomalacia vitamina D-resistente e in malattie simili;
- caratterizzare le diverse forme di osteodistrofia renale: questo comporta terapie differenti, indicate in alcuni casi e controindicate in altri (ad esempio i bisfosfonati da usare nelle forme osteoporotiche, ma controindicati nelle forme malaciche o nella forma adinamica);
- se si sospetta una rara malattia metabolica o per cercare di chiarire casi di fragilità scheletrica in circostanze inusuali di difficile comprensione;
- valutare l’aderenza al trattamento in una sindrome malassorbitiva.
DOPPIA MARCATURA CON TETRACICLINA
Metodica: somministrare demetilclortetraciclina 150 mg per 4 volte al giorno per bocca per 3 giorni, quindi 2 settimane di sospensione, poi ancora demetilclortetraciclina 150 mg per 4 volte al giorno per bocca per altri 3 giorni. Dopo 5-14 giorni di sospensione, si esegue la biopsia ossea.
Commenti: la tetraciclina si lega al tessuto osseo a livello del fronte di mineralizzazione attivo (giunzione tra osso mineralizzato e osteoide) e può essere evidenziata nelle sezioni ossee esaminate al microscopio a luce UV, perché fluorescente a una lunghezza d’onda di 350 nm. La doppia assunzione di tetraciclina può dare origine alla presenza su alcuni bordi trabecolari di doppia marcatura in condizioni fisiologiche, di singola marcatura o nessuna marcatura (queste ultime classicamente nelle forme malaciche). Questo dipende dalla fase del rimodellamento scheletrico nell’area che stiamo osservando al momento dell’assunzione della tetraciclina.
BIOPSIA OSSEA
La sede in cui viene eseguita la biopsia ossea è la cresta iliaca, facilmente accessibile, che consente di prelevare campioni con un’adeguata quantità di osso trabecolare. Essa può eventualmente essere ripetuta nel tempo dal lato opposto (per vedere ad esempio la risposta o mancata risposta di un trattamento).
L’esame si esegue in anestesia locale, 2 cm dietro la spina iliaca antero-superiore e 2 cm sotto la cresta iliaca, con un ago il cui diametro interno è > 7.5 mm per eseguire il prelievo di una “carota” di tessuto osseo. L’adeguatezza del prelievo dipende anche dall’esperienza dell’operatore. Gli effetti collaterali riportati sono in genere rari e transitori: dolore per 2 giorni, ematoma nella zona del prelievo, più raramente infezione locale.
La carota di tessuto osseo viene conservata per 2 giorni in etanolo al 70%, quindi viene tagliata non decalcificata in sezioni di differente spessore, alcune delle quali sono colorate per la misurazione dei parametri istomorfometrici statici, mentre altre di più larga sezione sono osservate al microscopio UV per la valutazione dei parametri dinamici.
ESAME ISTOMORFOMETRICO
Indici statici
- Volume Osseo Totale = quantità di tessuto osseo (mineralizzato + osteoide), espresso in percentuale rispetto all’area totale dei campi esaminati al microscopio.
- Porosità Corticale (Ct.Po) = area dei fori intra-corticali, come percentuale dell’area corticale totale.
- Volume Osseo Trabecolare (BV/TV) = percentuale dell’area totale occupata da osso trabecolare.
- Volume Osteoide = quantità di matrice ossea non calcificata, espressa come percentuale rispetto al volume osseo totale.
- Spessore Medio dell’Osteoide (O.Th) = rapporto tra Volume Osteoide e Superficie Osteoide.
- Diametro Medio Trabecolare = (Volume Osseo Totale/Superficie trabecolare Totale) x 2
- Indice Osteoclasti = numero di osteoclasti nell’unità di superficie di tessuto esaminata al microscopio.
- Superficie Osteoide (OS/BS) = percentuale di superficie trabecolare con osteoide non mineralizzata in percentuale rispetto alla superficie trabecolare totale.
- Superficie di riassorbimento = superficie interessata da processi di erosione in percentuale rispetto alla superficie trabecolare totale.
Questi ultimi 2 indici possono essere distinti in:
- “attivi” se sono presenti sulla superficie osteoblasti (OB) cuboidali indicatori di osteogenesi attiva e gli osteoclasti (OC) sono a contatto con la superficie ossea indicatori di riassorbimento;
- “inattivi” se sono presenti sulla superficie altri tipi di cellule OB e per gli OC le lacune di Howship sono vuote.
Indici dinamici
Misurano eventuali alterazioni della mineralizzazione
- Superficie Mineralizzante = indica quante superfici ossee sono in fase di mineralizzazione, cioè marcate. È espressa in percentuale rispetto alla superficie trabecolare totale. È opportuno distinguere la frazione occupata da una doppia marcatura rispetto a quella occupata da una singola marcatura.
- Velocità di Mineralizzazione (MAR, Mineral Apposition Rate) = indica l’attività media di mineralizzazione, in altri termini a quale velocità viene calcificato l’osteoide. Si calcola misurando all’ingrandimento 200x la distanza tra le marcature ai siti di doppia marcatura, diviso per i giorni intercorsi tra la prima e la seconda assunzione di tetraciclina, e si esprime in µm/die.
- Frequenza di Attivazione (Ac.f) = è la probabilità che in qualsiasi punto sulla superficie dell’osso trabecolare inizierà un nuovo ciclo di rimodellamento.
- BFR (Bone Formation Rate) = indica quanto osso è stato mineralizzato nell’unità di tempo e si calcola moltiplicando la MAR per la lunghezza delle superfici marcate.
- MLT (Mineralization Lag Time) = intervallo, espresso in giorni, tra formazione di osteoide e mineralizzazione.
Per una più dettagliata e completa descrizione di tali indici si faccia riferimento alle indicazioni bibliografiche.
| Indici istomorfometrici in alcune malattie metaboliche dell’osso | ||||||
| Spazi midollari | Osso corticale | Osso trabecolare | Rimodellamento osseo | Morfologia dell’osteoide | Mineralizzazione dell’osteoide | |
| Osteoporosi post-menopausale | - | Deficit con trabecolazioni endo-corticali | Deficit con poche connessioni trabecolari | Ac.f generalmente aumentata, ma i valori variano molto | - | - |
| Osteoporosi indotta da glucocorticoidi | - | Deficit | Deficit | Precoce aumento e successiva riduzione della Ac. f | - | - |
| Iperparatiroidismo primitivo | Si può rilevare fibrosi peri-trabecolar | Deficit, incremento di Ct.Po, con trabecolazioni endo-corticali | Tipicamente insignificante | Ac.f aumentata | Si può rilevare osso "woven” | - |
| - | Deficit | Deficit talora con scarsa connettività trabecolare | Ac.f aumentata | - | - | |
| Osteopatia da ipovitaminosi D | Si può rilevare tessuto fibroso | - | - | Precoce aumento della Ac.f | - | Precoce aumento di OS/BS; successivamente incremento di MLT e O.Th; la doppia marcatura può essere assente |
| Osteopatia ipofosfatemica | Si può rilevare tessuto fibroso | - | - | - | - | Incremento di MLT e O.Th; la doppia marcatura può essere assente |
| Osteodistrofia renale ad alto turnover | Si può rilevare tessuto fibroso | Trabecolazioni endo-corticali | Anormalità negli osteoblasti, osteociti e trabecole | Attività di rimodellamento aumentata in maniera marcata | Si può rilevare osso "woven” | Incremento OS/BS |
| Osteodistrofia renale a basso turnover | - | - | - | Attività di rimodellamento ridotta in maniera marcata | - | Incremento OS/BS (tipo osteomalacico); ridotto OS/BS (tipo adinamico) |
| Osteodistrofia renale tipo misto | Si può rilevare tessuto fibroso | - | BV/TV variabili | Attività di rimodellamento aumentata e ridotta (a macchia di leopardo) | Irregolare, si può rilevare osso "woven” e osteoide | Incremento OS/BS e O.Th |
BIBLIOGRAFIA
- Recker RR, Barger-Lux MJ. Transilial bone biopsy. In: Bilezikian JP, Raisz L, Rodan GA, eds. Principles of bone biology, 2nd Academic Press, San Diego, CA, USA, 2001: pp. 1625-34.
- Rao DS, Matkovic V, Duncan H. Transiliac bone biopsy: complications and diagnostic value. Henry Ford Hosp Med J 1980, 28: 112-8.
- Recker RR. Bone biopsy and histomorphometry in clinical practice. In: Primer on the metabolic bone diseases and disorders of mineral metabolism, 7th Published by the American Society for Bone and Mineral Research, Washington DC, 2008: pp 180-6.
- Parfitt AM, Drezner MK, Glorieux FH, et al. Bone histomorphometry: standardization of nomenclature, symbols, and units. J Bone Miner Res 1987, 2: 595-610.
- Kulak CA, Dempster DW. Bone histomorphometry: a concise review for endocrinologists and clinicians. Arq Bras Endocrinol Metabol 2010, 54: 87-98.
Clinica e diagnostica dell'osteoporosi primaria
Fabio Vescini1, Roberto Cesareo2 e Michele Zini3
1SOC Endocrinologia e Malattie del Metabolismo, Azienda Ospedaliero-Universitaria S. Maria della Misericordia, Udine; 2Endocrinologia, Ospedale S. Maria Goretti, Latina; 3Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia
Definizione e diagnosi densitometrica
L’osteoporosi è una malattia sistemica dello scheletro, caratterizzata da una riduzione della resistenza ossea e da un conseguente aumento del rischio di frattura.
La resistenza ossea è costituita da una componente qualitativa (micro-architettura, geometria, proprietà materiali) che, a tutt’oggi, è di difficile misurazione nella pratica clinica e da una quantitativa; quest’ultima è, attualmente, la componente ossea più correttamente misurabile, attraverso la densitometria ossea (dual X ray absorptiometry o DXA). Con questa metodica si ottiene la stima della densità minerale ossea (BMD), che è strettamente correlata al rischio di frattura. Confrontando la BMD del soggetto in esame con quella di una popolazione giovane e sana, dello stesso sesso, si ottiene il T-score che rappresenta la differenza, espressa in deviazioni standard (DS), della BMD misurata rispetto alla media di riferimento. In accordo alla classificazione clinica della Organizzazione Mondiale della Sanità (tabella 1) un T-score compreso fra + 2.5 DS e – 1 DS è considerato normale; per valori compresi fra – 1 DS e – 2.5 DS si parla di osteopenia, mentre al di sotto delle 2.5 DS viene posta diagnosi di osteoporosi. La contemporanea presenza di osteoporosi e una o più fratture da fragilità identifica l’osteoporosi conclamata.
In base alla linee guida della International Society of Clinical Densitometry la diagnosi di osteoporosi va posta sul peggiore T-score rilevato, indipendentemente dal sito di misurazione. In altri termini il rilievo di osteoporosi del rachide e di osteopenia del femore, o viceversa, deve essere refertato come osteoporosi, senza operare distinzioni sito-specifiche di gravità della patologia [1]. Si ricorda inoltre che la densitometria “total body” non ha ancora sufficienti evidenze in letteratura per potere essere utilizzata nella diagnosi di osteoporosi.
| Tabella 1 Classificazione clinica dell'OMS |
|
| Classificazione | T-score |
| Normale | > - 1 |
| Osteopenia | -1⇔ -2.5 |
| Osteoporosi | < -2.5 |
| Osteoporosi conclamata | < -2.5 + frattura/e da fragilità |
La diagnosi ottenuta mediante DXA non può, tuttavia, sostituire la diagnosi clinica; la semplice misurazione del T-score non deve, perciò, essere considerata la soglia di intervento farmacologico, ma semplicemente la soglia diagnostica. La terapia va decisa in base al rischio individuale di frattura, che rappresenta la vera e propria soglia terapeutica. Inoltre le forme secondarie di osteoporosi devono obbligatoriamente essere escluse prima di iniziare qualunque terapia.
Di seguito verranno descritti i fattori di rischio di frattura (FdR) e gli algoritmi disponibili per il calcolo del rischio. Verranno altresì analizzati i parametri di laboratorio indispensabili per una corretta diagnosi differenziale fra le varie forme di osteoporosi.
Fattori di rischio
Il principale FdR per la frattura osteoporotica è senza dubbio la BMD; per ogni riduzione di una DS del T-score il rischio di frattura viene circa raddoppiato (tabella 2). Tuttavia altri FdR, completamente indipendenti dalla BMD, giocano un ruolo nella patogenesi delle fratture osteoporotiche. La tabella 3 ne riporta un elenco, con i livelli di evidenza scientifica sul rischio di frattura.
| Tabella 2 Rischio relativo di frattura per ogni diminuzione di una DS della BMD (modificato da 2) |
||||
| Rischio Relativo di frattura | ||||
| T-score | Avambraccio | Femore | Vertebre | Tutte |
| Radio distale | 1.7 | 1.8 | 1.7 | 1.4 |
| Femore | 1.4 | 2.6 | 1.8 | 1.6 |
| Vertebre | 1.5 | 1.6 | 2.3 | 1.5 |
| Tabella 3 Fattori di rischio clinici per frattura, indipendenti dalla densità minerale ossea (modificato da 3) |
|
| Fattore di rischio | Livello di evidenza |
| Età | Alto |
| Pregresse fratture da fragilità | Alto |
| Terapia cronica con glucocorticoidi | Alto |
| Aumentato rischio di cadute (bassa acuità visiva, malattie neuromuscolari, ecc) | Alto |
| Ridotto apporto di calcio | Alto |
| Carenza di Vitamina D | Alto |
| Fumo | Alto |
| Familiarità per fratture | Intermedio |
| Menopausa precoce (< 45 anni) | Intermedio |
| Basso peso corporeo | Intermedio |
| Ridotta attività fisica | Intermedio |
| Abuso di alcolici | Basso |
Molti di questi FdR entrano a fare parte degli algoritmi per il calcolo del rischio di frattura. Fra questi il più utilizzato è il FRAX®, adottato dall'Organizzazione Mondiale della Sanità, che richiede l’inserimento dei seguenti FdR: età, peso, altezza, pregresse fratture da fragilità, familiarità positiva per frattura del femore, uso di steroidi, fumo, presenza di artrite reumatoide, abuso alcolico, cause note di osteoporosi secondaria (diabete tipo 1, ipertiroidismo di lunga durata, osteogenesi imperfetta, ipogonadismo o menopausa prima dei 45 anni, malnutrizione cronica, malassorbimento intestinale, epatopatie croniche). Infine può essere aggiunto il valore della BMD, misurato sul collo del femore, anche se è possibile ottenere il risultato senza l’inserimento di questa variabile.
Il rischio di frattura a 10 anni, fornito dal FRAX®, viene espresso in percentuale e riferito a due tipologie di fratture: quelle osteoporotiche maggiori globalmente considerate (vertebre, avambraccio, femore o spalla) e, più specificatamente, quelle del femore.
Il risultato del FRAX® non va considerato come la soglia di intervento oltre la quale trattare; questa decisione deve essere sempre presa in base al giudizio clinico, anche se, ad esempio, la “Food and Drugs Administration” (FDA) consiglia di iniziare una terapia farmacologica per valori di FRAX® superiori al 20% per quel che riguarda le fratture osteoporotiche maggiori (oppure > 3% per il femore).
Dal punto di vista eziopatogenetico si riconoscono un'osteoporosi primitiva e una secondaria.
La forma primitiva è, principalmente, costituita dalle osteoporosi post-menopausale e senile, mentre le forme secondarie si presentano in corso di altre patologie (es. iperparatiroidismo, ipertiroidismo, ipogonadismo, ipercortisolismo, celiachia, insufficienza renale cronica, artrite reumatoide, connettiviti), in seguito all’uso di farmaci (cortisonici, anti-epilettici, anti-coagulanti, anti-estrogeni, inibitori dell’aromatasi), o per squilibri nutrizionali (dieta povera di calcio, carenza di vitamina D) (tabella 4).
| Tabella 4 Cause di osteoporosi secondaria |
|
| Malattie endocrine | Ipogonadismo (primario/secondario) Iperparatiroidismo Ipertiroidismo Ipercortisolismo Diabete tipo 1 Acromegalia Deficit di GH Iperprolattinemia |
| Malattie gastro-intestinali | Epatopatie croniche Morbo celiaco Malattie infiammatorie croniche intestinali Gastrectomia Sindrome da malassorbimento |
| Malattie ematologiche | Mastocitosi sistemica Mieloma Leucemie Linfomi Malattia di Gaucher Emocromatosi Talassemia |
| Malattie reumatiche | Artrite reumatoide LES Artrite psoriasica Sclerodermia Spondilite anchilosante |
| Malattie renali | Ipercalciuria idiopatica Osteodistrofia renale Nefropatia da analgesici Acidosi tubulare Litiasi renale idiopatica |
| Altro | Osteogenesi imperfetta BPCO Anoressia nervosa Fibrosi cistica Immobilizzazione Sclerosi multipla Porfiria Infezione da HIV Sindrome di Marfan Deficit di vitamina D Rachitismo Ipofosfatasia |
| Farmaci | Corticosteroidi Anti-convulsivanti Litio Ormoni tiroidei a dosi TSH-soppressive Diuretici dell’ansa Chemioterapici Immuno-soppressori Anti-coagulanti Agonisti del GnRH Anti-aromatasici |
Appare chiaro che una corretta diagnosi differenziale fra queste forme di osteoporosi consentirà una terapia adeguata. Pochi, semplici esami consentono di escludere circa il 90% delle forme secondarie di osteoporosi, mentre per i casi più complessi sarà necessario eseguire indagini specifiche e mirate (es. test di soppressione al desametasone nel sospetto di ipercortisolismo).
Nel paziente con diagnosi densitometrica di osteoporosi vanno sempre eseguiti i seguenti esami che, come già detto, consentono di escludere la maggior parte delle forme secondarie di osteoporosi: VES, emocromo completo, protidemia frazionata, creatininemia, calcemia, fosforemia, fosfatasi alcalina, calciuria su urine delle 24 ore. Spesso si tende a non valutare l’escrezione urinaria del calcio sulle urine di 24 ore, perché questa indagine può risultare un poco complessa per il paziente. Al contrario, per una sola volta, è molto importante eseguirla, in quanto è l’unica indagine che consente di escludere la presenza di ipercalciuria; in un lavoro del 2002 Tannenbaum et al. dimostrarono che il 9.8% delle loro diagnosi di osteoporosi post-menopausale era errato, in quanto, valutando l’escrezione urinaria di calcio, questa percentuale di pazienti risultava affetta da ipercalciuria [4]. L’anno seguente Giannini et al. trovarono una percentuale di ipercalciurie misconosciute pari al 19% [5]. E’ del tutto evidente che sbagliando la diagnosi si sbaglia anche la terapia, che in questi casi avrebbe dovuto comprendere l’impiego di un diuretico tiazidico.
Il tessuto osseo è soggetto ad un continuo processo di rimodellamento, per tutto l’arco della vita, che vede coinvolti gli osteoclasti, deputati ad erodere cavità nell’osso, e gli osteoblasti che riempiono queste cavità con la matrice ossea che, poi, viene mineralizzata. Il risultato di queste azioni, combinate e bilanciate, è la continua sostituzione di osso vecchio con osso nuovo, ovvero il rinnovamento dello scheletro. La perdita di massa ossea può essere il risultato di una ridotta neodeposizione osteoblastica, ovvero di un eccessivo riassorbimento osteoclasto-mediato, oppure di entrambe le condizioni. La drastica diminuzione del livello di ormoni estrogeni, che avviene dopo la menopausa, accelera i processi di riassorbimento osseo, sbilanciando l’equilibrio del rimodellamento e, in ultima analisi inducendo una perdita netta di massa ossea. Inoltre l’osso, come qualsiasi altro tessuto, organo od apparato, tende ad invecchiare e con il passare degli anni si assiste ad una naturale riduzione della massa ossea dovuta sia ad un rallentamento della neodeposizione di osso, sia ad un incremento del riassorbimento di questo tessuto. Dopo il raggiungimento del picco di massa ossea, intorno ai 25-30 anni, inizia una progressiva riduzione della BMD che ammonta, nei due sessi, ad una perdita dello 0.5-1% per anno (6); nelle donne questa perdita accelera considerevolmente in concomitanza della menopausa, per poi riportarsi, dopo circa un decennio, al tasso di perdita della popolazione maschile (7).
L’attività degli osteoclasti e degli osteoblasti può essere misurata mediante il dosaggio dei marcatori di turn-over osseo. Esistono molti tipi di marcatori, dosabili sia nel plasma, sia nelle urine, che possono essere così schematizzati:
- enzimi correlati all’azione degli osteoclasti e degli osteoblasti
- frammenti del collagene
- composti non-collagenici della matrice intercellulare
I marcatori oggi più utilizzati sono la fosfatasi alcalina ossea, enzima che riflette l’attività osteoblastica e il frammento carbossi-terminale del collagene di tipo I (CTX), che evidenzia l’entità del riassorbimento osseo osteoclasto-mediato.
Buone evidenze della letteratura mostrano che l’aumento dei marcatori di turnover osseo è un predittore di frattura osteoporotica indipendente dalla BMD. Inoltre i marcatori di turn-over, in modo particolare quelli di riassorbimento, subiscono una netta riduzione in corso di terapia con farmaci anti-riassorbitivi (es. bisfosfonati, estrogeni), che avviene in tempi molto brevi: 3-6 mesi. Ciò permette di valutare l’efficacia di una terapia e, soprattutto l’aderenza del paziente al trattamento prescritto molto prima che con la rivalutazione della BMD, per la quale è necessario fare trascorrere un tempo minimo di 1.5-2 anni.
Nonostante queste evidenze è ancora prematuro indicare l’uso dei marcatori nella pratica clinica quotidiana, in quanto esso è alterato dall'ampia variabilità di dosaggio e biologica. Ulteriori studi sono necessari per confermare l’uso dei marcatori di turn-over osseo nei singoli pazienti.
Bibliografia
- Baim S, et al. Official Positions of the International Society for Clinical Densitometry and executive summary of the 2007 ISCD Position Development Conference. J Clin Densitometry 2008, 11: 75-91.
- Marshall D, et al. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996, 312: 1254-9.
- Adami S, Adami S, Bertoldo F, Brandi ML, et al; Società Italiana dell'Osteoporosi, del Metabolismo Minerale e delle Malattie dello Scheletro. Guidelines for the diagnosis, prevention and treatment of osteoporosis. Reumatismo 2009, 61: 260-84.
- Tannenbaum C, et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab 2002, 87: 4431-7.
- Giannini S, et al. Hypercalciuria is a common and important finding in postmenopausal women with osteoporosis. Eur J Endocrinol 2003, 149: 209-13.
- Orwoll ES, Klein RF. Osteoporosis in men. Endocr Rev 1995, 16: 87-116.
- Recker RR. Transmenopausal and age-related changes in bone remodeling. J Musculoskelet Neuronal Interact 2003, 3: 411-2.
Prevenzione dell'osteoporosi
Fabio Vescini1, Roberto Cesareo2 e Michele Zini3
1SOC Endocrinologia e Malattie del Metabolismo, Azienda Ospedaliero-Universitaria S. Maria della Misericordia, Udine; 2Endocrinologia, Ospedale S. Maria Goretti, Latina; 3Endocrinologia, Arcispedale S. Maria Nuova, Reggio Emilia
L’osteoporosi non è solo conseguente alla perdita ossea che accade con l’avanzare dell’età. Infatti nella genesi della osteoporosi una crescita ossea sub-ottimale nelle prime fasi della vita è importante tanto quanto la perdita di massa ossea che si verifica in età adulta.
Ottimizzare la salute dell’osso è quindi un processo che dura tutta la vita sia nei maschi che nelle femmine. Agire sui fattori che influenzano la salute dell’osso a tutte le età è essenziale per prevenire l’osteoporosi e le possibili fratture conseguenti.
Il raggiungimento di un adeguato picco di massa ossea resta l’obiettivo essenziale se si vuole evitare che il successivo, normale declino della densità ossea porti al raggiungimento della soglia di frattura in età precoce.
Lo scheletro umano alla nascita contiene circa 25 g di calcio, mentre nell'età adulta ne contiene circa 1000 g. E' indubbio che una dieta che contenga una quantità adeguata di calcio è essenziale per questa trasformazione ed il suo fabbisogno varia a seconda delle varie età della vita come riportato in tabella.
| Fabbisogno di calcio | |
| Età | mg/die |
| 1-5 anni | 800 |
| 6-10 anni | 800-1200 |
| 11-24 anni | 1200-1500 |
| 25-50 anni | 1000 |
| Gravidanza e allattamento | 1200-1500 |
| Donne post-menopausa in trattamento estrogenico | 1000 |
| Uomini di 50-65 anni | 1000 |
| Donne post-menopausa senza trattamento estrogenico | 1500 |
| Uomini > 65 anni | 1500 |
L'apporto di vitamina D dovrebbe essere pari ad almeno 400-600 UI/die, che è facilmente ottenibile con una corretta esposizione alla luce solare (sono sufficienti 10-20'/die). In caso di impossibilità a ciò, dovrà essere assunta dall'esterno come supplementi (solitamente per via orale, eccetto documentati quadri di malassorbimento), visto lo scarso alimentare.
È importante inoltre seguire stili di vita sani, senza assunzione di alcol nè fumo, limitando anche l'assunzione di caffè e di cloruro di sodio.
Infine l'attività fisica è importante a tutte le età:
- nei bambini ed in età giovanile, dove è necessario il raggiungimento del massimo picco di massa ossea, è consigliabile un’attività sportiva regolare, preferibilmente in carico e con un impatto importante;
- nella prima età post-menopausale e nelle donne in pre-menopausa si devono creare i presupposti per un mantenimento o una minore riduzione possibile della massa ossea, incoraggiando una regolare attività fisica, personalizzando la tipologia degli esercizi;
- nelle persone anziane l'attività fisica ha come obiettivi la prevenzione delle cadute, il miglioramento dell’agilità, dell’equilibrio e della coordinazione. A volte l’anziano può trovare beneficio da attività collettive come la danza, che, oltre a migliorare la forza muscolare e la capacità aerobica, può sviluppare la propriorecettività, svolgendo quindi un ruolo determinante nel migliorare l’equilibrio e la coordinazione, prevenendo le cadute e costituendo anche un’alternativa per quei soggetti non adatti a praticare esercizi di rinforzo muscolare.
Algoritmi per il calcolo del rischio di frattura
Valentina Camozzi
UOC Endocrinologia, DIMED, Università di Padova
(aggiornato al 28 aprile 2015)
Gli algoritmi per il calcolo del rischio di frattura rappresentano uno strumento di supporto per il clinico che si propone di valutare un soggetto per il rischio di incorrere in una frattura da fragilità. L’esigenza è nata dall’osservazione che la misura della densità minerale ossea (BMD) non sempre è sufficiente a identificare i soggetti a rischio e dalla necessità di adeguare il trattamento in termini di costo/beneficio.
Nel 1994, si identificò nel T-score < -2.5 il cut-off oltre i quale il rischio di frattura tendeva esponenzialmente ad aumentare e per anni i pazienti sono stati trattati quando si superava questa soglia (1). Per quanto la riduzione della densità minerale ossea rappresenti il maggior determinante della fragilità ossea e le variazioni del T-score siano altamente predittive di frattura, non solo per il sito misurato (colonna verso colonna) ma anche verso le altre sedi di frattura (es. colonna verso collo femorale), nel 2004 lo studio N.O.R.A. evidenziò che la distribuzione delle fratture era parimenti frequente in soggetti con osteopenia o con osteoporosi (2). Ancor prima, era stato dimostrato chiaramente che la presenza di una o più fratture da fragilità rappresenta un rischio addirittura superiore alla ridotta densità minerale ossea (compresa nel terzili più bassi) per incorrere in una nuova frattura (3).
Nel 2008 a cura dell’OMS furono rese note numerose tabelle in cui veniva calcolato il rischio di frattura a 10 anni in base a determinate combinazioni cliniche (WHO Technical Report 2008). Da qui l’evidenza che, indipendentemente dalla BMD, numerosi fattori, modificabili e non, erano in grado di cambiare sensibilmente il rischio: l’età, il basso BMI, l’uso di cortisonici, l’abitudine al fumo e l’abuso di alcool, la presenza di cause secondarie di osteoporosi (in particolare le malattie reumatologiche). L’elaborazione di questi dati ha portato allo sviluppo di un algoritmo predittivo, denominato FRAX, reperibile gratuitamente on-line. L’algoritmo, specifico per ogni Paese, è stato creato utilizzando il rischio svedese di frattura di femore aggiustato per un determinato fattore per le principali etnie europee. Il calcolo non viene rivelato ed è coperto da brevetto e valuta il rischio a 10 anni per la frattura di femore e per le fratture maggiori (vertebre, femore, polso , omero, ecc), considerando o meno la BMD al collo femorale. In questo modo vengono identificate anche le soglie di intervento farmacologico o i soggetti da sottoporre a una valutazione densitometrica (4,5).Dopo il FRAX sono nati altri algoritmi, comprendenti fino ad oltre 20 fattori di rischio: non solo un aumento del numero dei fattori di rischio non ha migliorato la predittività, ma in alcuni studi il calcolo senza tenere conto della BMD non è stato in grado di cogliere i soggetti più a rischio. Questo si è verificato in particolare nelle fasce di età più giovane (età < 65 anni), sottolineando che la densità minerale ossea, se pur dotata di bassa sensibilità, per la sua buona specificità riveste ancora un ruolo importante, quando è bassa (T score < -2.5), specialmente nel primo decennio di osservazione. I vari algoritmi presentano soglie diverse di rischio e solo per il FRAX vi sono le evidenze maggiori per quanto riguarda la risposta al trattamento (6-8).
Il FRAX è senza dubbio l’algoritmo più studiato e utilizzato,ma presenta dei limiti: al di là dei risultati non sempre univoci se si considera o meno la BMD nel calcolo, e sebbene presenti una buona correlazione fra rischio ed età, T-score e BMI, rispetto ai dati noti in letteratura, appare discutibile la correlazione ottenuta con i fattori di rischio clinici. Le variabili sono valutate come dicotomiche, quando è noto che la quantità è importante, specie quando si tratta dell’uso di glucocorticoidi. Inoltre, non viene presa in considerazione la presenza di patologie francamente osteopenizzanti: mentre viene considerata l’artrite reumatoide, non sono riportate altre patologie reumatiche (connettiviti) o altre situazioni dannose per l'osso (uso di inibitori dell'aromatasi, AIDS, iperparatiroidismo primitivo, ecc), altrettanto importanti anche se meno frequenti.Parecchi pazienti, che secondo le norme prescrittive esistenti nel nostro paese (nota 79) meriterebbero il trattamento, secondo il FRAX rischierebbero di non essere presi in considerazione.
Per superare il problema, sotto l’egida delle principali Società Scientifiche del Metabolismo Osseo e patologie correlate (SIOMMMS e SIR) è nato il derived fracture risk assessment o DeFRA. Per ottenere questo nuovo algoritmo le tabelle del WHO Technical Report sono state rianalizzate: per le stesse variabili continue (età, T-score del femore e BMI) i risultati correlano esattamente con il FRAX, ma sono state incluse sia variabili dicotomiche (precedenti fratture diverse da femore e colonna, presenza di artrite reumatoide o altre connettiviti) che graduate (fumo, dose di cortisonico, numero di fratture pregresse).Tale strumento, si trova on-line ed è di accesso gratuito a tutti (9).
Questo tipo di approccio consente una valutazione più ampia dei pazienti e l’identificazione più precisa dei soggetti a rischio. Per quanto riguarda il trattamento, considerando i costi rapportati al NNT (numero di pazienti che bisogna trattare per ridurre una frattura), questa analisi potrebbe portare a una condotta di trattamento più adeguata, secondo la gravità del soggetto. L’algoritmo, nato anche dalla necessità di rendere gestibile sul territorio in modo più esteso il “problema osteoporosi”, può essere percepito come un limite da alcuni colleghi. Va sempre considerato che qualsiasi “calcolo” non si sostituisce al clinico:il rischio di frattura va contestualizzato in ogni singolo paziente (l’età e le comorbilità possono condizionare uno stesso valore) e il rischio stesso si può modificare nel tempo, sia perché viene iniziato un trattamento, sia perché può cambiare la situazione clinica del soggetto.
Bibliografia
- Kanis JA, Melton LJ 3rd, Christiansen C, et al. The diagnosis of osteoporosis. J Bone Miner Res 1994, 9: 1137-41.
- Siris ES, Brenneman SK, Miller PD, et al. Predictive value of low BMD for 1-year fracture outcomes is similar for postmenopausal women ages 50-64 and 65 and older: results from the National Osteoporosis Risk Assessment (NORA). J Bone Miner Res 2004, 19: 1215-20.
- Ross PD, Davis JW, Epstein RS, et al. Pre-existing fractures and bone mass predict vertebral fracture incidence in women. Ann Intern Med 1991, 114: 919-23.
- Kanis JA, Johnell O, Oden A, et al. FRAX and the assessment of fracture probability in men and women from the UK. Osteoporos Int 2008, 19: 385-97.
- Kanis JA, McCloskey EV, Johansson H, et al. National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX: assessment and intervention thresholds for the UK. Osteoporos Int 2008, 19: 1395-408.
- Rubin KH, Friis-Holmberg T, Hermann AP, et al. Risk assessment tools to identify women with increased risk of osteoporotic fracture: complexity or simplicity? A systematic review. J Bone Miner Res 2013, 28: 1701-17.
- Roux S, Cabana F, Carrier N, et al. The World Health Organization Fracture Risk Assessment Tool (FRAX) underestimates incident and recurrent fractures in consecutive patients with fragility fractures. J Clin Endocrinol Metab 2014, 99: 2400-8.
- Sornay-Rendu E, Duboeuf F, Boutroy S, et al. How to predict fragility fracture beyond 10 years? The OFELY study. J Clin Endocrinol Metab 2014, 99: 4690-7.
- Adami S, Bianchi G, Brandi ML, et al. Validation and further development of the WHO 10-year fracture risk assessment tool in Italian postmenopausal women: project rationale and description. Clin Exp Rheumatol 2010, 28: 561-70.
Terapia dell'osteoporosi primaria e analisi critica della nota AIFA 79
Roberto Cesareo1, Ilaria Terrinoni1, Fabio Vescini2 e Michele Zini3
1Endocrinologia, Ospedale S. Maria Goretti, Latina
2SOC Endocrinologia e Malattie del Metabolismo, AOU S. Maria della Misericordia, Udine
3Endocrinologia, Arcispedale S. Maria Nuova IRCCS, Reggio Emilia
(aggiornato al 16 gennaio 2020)
Vengono qui di seguito riportati i più importanti studi clinici sull'osteoporosi che hanno mostrato risultati significativi sulla riduzione delle fratture.
Due importanti studi, condotti negli anni ’90, dimostrarono che l’associazione di calcio e colecalciferolo era in grado di ridurre il rischio di frattura in pazienti anziani (età > 65 anni) istituzionalizzati, sia a livello vertebrale, sia non-vertebrale (1,2).
Negli anni seguenti sono stati pubblicati molti altri studi, che hanno valutato sia l’associazione di calcio e vitamina D, sia la somministrazione singola di ciascuno di essi. I risultati prodotti sono stati contrastanti, anche se alcune metanalisi hanno fornito dati chiaramente interpretabili: la somministrazione del solo calcio non riduce significativamente il rischio di frattura, mentre in associazione al colecalciferolo riduce il rischio del 13% (RR 0.87, IC95% 0.77-0.97). Questo risultato è strettamente dipendente dall'aderenza al trattamento: con una compliance > 80% la riduzione del rischio relativo di frattura arriva al 24% (RR 0.76, IC95% 0.67-0.86), mentre per aderenze inferiori il dato perde significatività (3).
Un’altra metanalisi ha evidenziato che anche la sola somministrazione di vitamina D è in grado di ridurre il rischio di frattura, ma solo per dosi giornaliere > 400 UI; a queste posologie il rischio relativo di frattura non-vertebrale era 0.80 (IC95% 0.72-0.89), mentre quello relativo alla frattura del femore risultava pari a 0.82 (IC95% 0.69-0.97) (4).
Un recente studio randomizzato della durata di 9 mesi, condotto su 689 donne di età > 70 anni, afferma che l’efficacia del colecalciferolo a dosaggi intermittenti (150.000 UI ogni 3 mesi) non riduce significativamente l’incidenza di fratture (5). A fronte di ciò, vi sono recenti studi di tipo metanalitico, che pongono il sospetto che l’assunzione di calcio e vitamina D, singolarmente o in associazione, possa aumentare il rischio cardio-vascolare e quello di caduta nei pazienti anziani. Bolland e collaboratori in una metanalisi del 2011 osservano, infatti, un aumento del rischio di infarto del miocardio e ictus in donne in menopausa trattate con integratori di calcio con o senza vitamina D (6). I ricercatori, analizzando i dati di 16178 pazienti, riscontrano un rischio cardio-vascolare più elevato nelle pazienti non trattate con calcio prima della randomizzazione. Al contrario, la supplementazione con calcio e vitamina D nelle pazienti già in terapia non sembra modificare il rischio cardio-vascolare. Gli autori ipotizzano che il brusco aumento dei livelli di calcio dopo la supplementazione possa essere responsabile dell’aumentato rischio cardio-vascolare. Secondo i calcoli dei ricercatori, l’analisi rischio/beneficio depone a sfavore degli integratori: su 1000 pazienti trattati per cinque anni con integratori di calcio, potrebbero verificarsi sei casi di infarto del miocardio o ictus (NNH 178), con la prevenzione di tre sole fratture (NNT 302). Al contrario, una metanalisi condotta da Mao e collaboratori nel 2013 (8), raccoglie dati su 11 studi, con una popolazione totale di 50252 pazienti, evidenziando in pazienti che assumono calcio con o senza vitamina D un non significativo aumento del rischio cardio-vascolare (OR 1.03, IC95% 0.94-1.12; P = 0.54) e di eventi cardio-vascolari maggiori: infarto del miocardio (OR 1.08, IC95% 0.96-1.22; P = 0.21) o ictus (OR 1.01, IC95% 0.91-1.13; P = 0.80). Il rischio sembra essere maggiore nella popolazione di sesso maschile (8). Seppure non significativi dal punto di vista statistico, i dati riportati sul rischio di eventi cardio-vascolari (es. rischio di infarto del miocardio 28% maggiore rispetto al placebo) lasciano aperta la discussione sull’effettiva sicurezza del calcio.
Le metanalisi risultano comunque invalidate da alcuni importanti bias metodologici (diversi dosaggi di calcio, diverse formulazione di vitamina D, assunzione di integratori prima della randomizzazione), per cui sarebbero necessari ulteriori studi per la definizione del rischio cardio-vascolare associato al calcio.
Oggi non si può ritenere che la sola terapia con calcio e vitamina D rappresenti una forma di trattamento efficace per l'osteoporosi, anche se a tutti i pazienti deve essere garantito un adeguato apporto di calcio e vitamina D. È ben dimostrato che livelli plasmatici sufficienti (> 30 ng/mL) di 25OHD sono in grado di migliorare la risposta ai farmaci per l’osteoporosi (8). Mentre un apporto sufficiente di calcio può essere ottenuto con la dieta, ciò non è possibile per la vitamina D, che se necessario deve essere somministrata dall’esterno.
CALCITONINA
È disponibile un solo studio clinico controllato a 5 anni, che evidenzia dati di efficacia sulla riduzione delle fratture vertebrali (9), mentre non vi sono dati di significatività sulle fratture femorali. Nello studio si è rilevato un elevato drop-out, che pone seri dubbi sulla reale efficacia anti-fratturativa di questa molecola che, di fatto, è uscita dall’armamentario farmacologico per l'osteoporosi.
TERAPIA ESTRO-PROGESTINICA
Lo studio WHI, effettuato su circa 16600 donne di età compresa tra 50 e 79 anni a cui era stata prescritta terapia con estrogeni coniugati equini e medrossiprogesterone acetato per via orale, ha evidenziato una riduzione delle fratture vertebrali e anche delle fratture di femore (10). Tuttavia, in associazione alla terapia estrogenica, sono stati riscontrati effetti collaterali importanti, in particolare un'aumentata incidenza di carcinoma della mammella, di eventi cardio-vascolari, cerebro-vascolari e trombo-embolici venosi. Il rapporto rischio/benefico è quindi sfavorevole, e la terapia estrogenica non può essere ritenuta un approccio standard quando l’obiettivo primario sia il trattamento dell’osteoporosi. Come criterio generale, l’uso razionale degli estrogeni è oggi limitato alla terapia sostitutiva della menopausa precoce o alla terapia ormonale sostitutiva in corso di sindrome climaterica, quando questa sia clinicamente rilevante con impatto significativo sulla qualità di vita e si sia dimostrata resistente ad altri provvedimenti (es. estrogeni topici, isoflavonoidi della soia).
MODULATORI SELETTIVI DEL RECETTORE PER GLI ESTROGENI (SERM)
Lo studio MORE, che ha visto l'utilizzo del raloxifene su circa 7700 donne di età media di 66 anni, ha evidenziato una chiara riduzione delle fratture vertebrali, ma assenza di dati di efficacia sulla riduzione delle fratture non-vertebrali o di femore (11). Anche lo studio CORE, estensione dello studio MORE con utilizzo di raloxifene fino 8 anni, ha confermato l’inefficacia di questo farmaco sulla riduzione del rischio di fratture non-vertebrali (12).
Dei SERM di nuova generazione (bazedoxifene, ospemifene, arzoxifene, lasofoxifene), bazedoxifene in uno studio clinico randomizzato in doppio cieco ha dimostrato sicuri dati di efficacia sulla riduzione sulle fratture vertebrali e anche non-vertebrali, anche se ad una attenta valutazione la significatività sulle fratture non-vertebrali è data dall'efficacia sulle fratture minori (13). Non vi sono ancora chiari dati di efficacia sulla riduzione delle frattura d'anca e persistono, come peraltro per il raloxifene, aumentati rischi di tipo trombo-embolico venoso.
Alendronato
Lo studio FIT, rivolto a pazienti sia in prevenzione primaria che secondaria, ha evidenziato una riduzione del rischio relativo di nuove fratture intorno al 50%, sia per le fratture vertebrali che femorali (14). Lo studio non ha documentato effetti collaterali degni di nota rispetto al placebo, anche se c'è da dire che nella fase di pre-randomizzazione sono stati esclusi pazienti affetti da patologie gastro-intestinali o in terapia con farmaci gastro-lesivi. Il farmaco si è dimostrato efficace in un ampio spettro di condizioni cliniche: prevenzione primaria, prevenzione secondaria, fratture vertebrali, fratture non vertebrali, osteoporosi da corticosteroidi. Pur con end-point secondari, l’uso del farmaco è validato anche per periodi di trattamento prolungati. Compatibilmente con la tollerabilità del farmaco (che è complessivamente buona, soprattutto se viene assunto con le modalità corrette) e l'aderenza del paziente al piano di cura, è da perseguire l’obiettivo di un trattamento protratto nel tempo. A tutt’oggi, l’alendronato rimane uno dei farmaci di prima scelta per il trattamento dell’osteoporosi.
Risedronato
Anche l'utilizzo del risedronato ha evidenziato riduzione delle fratture vertebrali e non vertebrali, con dati sovrapponibili a quelli dell'alendronato (15). Inoltre, gli effetti del risedronato sulla riduzione dell'incidenza delle fratture d'anca sono stati valutati nello studio HIP, che ha documentato una riduzione del rischio relativo pari al 40%, ma solo in donne anziane e con bassi valori densitometrici in sede femorale e che avevano una frattura vertebrale al basale (16). Anche il risedronato è stato valutato in uno studio di estensione e l'incidenza delle fratture vertebrali ha dimostrato un trend positivo di riduzione, come nello studio registrativo a tre anni, anche se non ci sono dati di significatività sulla riduzione delle fratture non-vertebrali (17).
Ibandronato
Lo studio multicentrico registrativo, della durata di 3 anni, condotto su 2946 donne in menopausa, di età compresa tra 55 e 80 anni, ha documentato una chiara efficacia sulla riduzione delle fratture vertebrali, ma assenza di significatività sulle fratture non-vertebrali (18). Studi successivi, che hanno previsto dosi cumulative differenti della molecola, sia dal punto di vista della posologia che nella modalità di assunzione, sembrerebbero evidenziare dati di efficacia anche sulle fratture non vertebrali (19); mancano tuttavia dati di sicura efficacia sulla riduzione di frattura dell'anca. Nonostante questa importante limitazione, il farmaco risulta utile nelle forme di osteoporosi a prevalente localizzazione vertebrale, anche per la mono-somministrazione mensile, che favorisce la compliance e l’aderenza al trattamento.
Zoledronato
Già noto per il trattamento delle metastasi ossee e del mieloma, lo zoledronato è stato valutato per la terapia dell’osteoporosi nello studio HORIZON, alla dose di 5 mg ev una volta all’anno (20). Le credenziali di efficacia del farmaco dimostrate dallo studio HORIZON sono molto buone, anche se il farmaco paga una lieve, ma significativa, tossicità cardiaca (episodi di fibrillazione atriale) e renale (insufficienza renale acuta reversibile). Pur non essendo stati dimostrati nello studio episodi di osteonecrosi della mandibola (ONJ), lo zoledronato rimane pur sempre il farmaco principalmente responsabile di questo effetto collaterale. La particolare modalità di somministrazione (endovenosa annuale) impone nuove considerazioni sulla nicchia di appropriatezza dell’uso di questo farmaco, che non è ancora definita, e sul setting assistenziale (necessariamente ospedaliero).
Clodronato
I dati di efficacia di questa molecola sono derivati solo dall'impiego della formulazione orale (800 mg/die per os) e dimostrano una riduzione significativa delle fratture vertebrali incidenti (21).
Il problema dell'osteonecrosi della mandibola
L’ONJ è un effetto collaterale ben noto in ambito onco-ematologico, ove si è verificata la grande maggioranza dei casi. Si tratta di una necrosi del tessuto osseo, che si può manifestare nei pazienti trattati con bisfosfonati (ma anche con farmaci attivi sull’osso appartenenti ad altre classi) a seguito di manovre odontoiatriche invasive. Nei pazienti in trattamento con bisfosfonati orali per osteoporosi, i casi segnalati sono estremamente scarsi e aneddotici, tuttavia, anche in questi soggetti è opportuno seguire alcuni criteri:
- nei pazienti non ancora in trattamento, le procedure odontoiatriche vanno completate prima di iniziare la terapia;
- nei pazienti già in trattamento e con procedure odontoiatriche differibili, il bisfosfonato deve essere sospeso per 3-6 mesi. In questo tempo non ci si può aspettare la scomparsa del farmaco dal tessuto osseo (data la lunghissima emivita ossea dei bisfosfonati), ma un periodo di clearance è comunque consigliato;
- nei pazienti già in trattamento e con procedure odontoiatriche non differibili, l’odontoiatra presterà particolare attenzione ad operare con la massima asepsi e il minimo traumatismo possibili, procedendo a un’adeguata profilassi antibiotica (amoxicillina + acido clavulanico) e a uno stretto follow-up (22).
Le fratture atipiche e la "drug holiday"
Dal 2005 un numero crescente di segnalazioni ha descritto casi di fratture femorali localizzate distalmente al piccolo trocantere (sotto-trocanteriche o diafisarie, ST/DF) in pazienti in terapia con bisfosfonati. La task force dell’American Society for Bone and Mineral Research sulle fratture atipiche ST/DF del femore ha definito le caratteristiche principali e secondarie della frattura atipica del femore. Queste fratture sono state inizialmente denominate “atipiche” prevalentemente in relazione alla sede, alle caratteristiche radiologiche e all'età di insorgenza, che le distinguono dalle classiche fratture da fragilità dei pazienti anziani osteoporotici (23).
Le fratture ST/DF atipiche di femore sono un evento raro, che può presentarsi sia in pazienti in terapia con bisfosfonati sia in soggetti mai esposti a questi farmaci, che presentano altre condizioni morbose o fattori di rischio. Sulla base dei dati disponibili, il rapporto rischio/beneficio nell’uso dei bisfosfonati nella prevenzione delle fratture da fragilità è decisamente a favore del beneficio, considerato l’elevato numero di fratture che si eviterebbero nel produrre un’“ipotetica” frattura ST/DF atipica. Inoltre, sulla base delle prove disponibili, principalmente derivanti dagli studi epidemiologici e dalle segnalazioni post-immissione in commercio, il rischio di questa tipologia di fratture del femore sembra correlarsi con l'utilizzo a lungo termine dei bisfosfonati. Pertanto, sia per questo motivo, sia per le evidenze cliniche ancora non del tutto dirimenti in merito all'efficacia dei bisfosfonati in termini di riduzione delle fratture a lungo termine, vengono a tutt'oggi proposte delle raccomandazioni in merito all'eventuale sospensione dell'assunzione in tali pazienti ("drug holiday") (tabella 1).
| Tabella 1 Pazienti candidabili o no alla "drug holiday" |
|
| È opportuno sospendere i bisfosfonati dopo 3-5 anni |
Pazienti che assumono bisfosfonati senza indicazione:
Pazienti senza frattura vertebrale incidente o prevalente, che hanno iniziato il trattamento per osteoporosi al collo femorale, e che, dopo 5 anni di terapia, non hanno fratture incidenti e presentano un T-score al collo femorale > -2.0. |
| È opportuno proseguire il trattamento con bisfosfonati anche dopo 3-5 anni | Pazienti con frattura vertebrale all’inizio del trattamento. Pazienti senza frattura vertebrale incidente o prevalente, che hanno iniziato il trattamento per osteoporosi al collo femorale, e nei quali persiste un T-score < -2.5 dopo 5 anni di terapia. Pazienti in trattamento cronico con glucocorticoidi. |
Pertanto, dopo 3-5 anni di trattamento andrà rimodulato in ogni singolo paziente il rapporto rischio-beneficio, per valutare l'eventuale sospensione della terapia o invece un suo proseguimento. Al momento non ci sono raccomandazioni forti e studi di elevata evidenza clinica in grado di stabilire la durata dell'eventuale "drug holiday". Tuttavia, la rivalutazione del rischio andrebbe effettuata dopo 1 anno dalla sospensione per il risedronato, dopo 1-2 anni per l'alendronato e dopo 2-3 anni per lo zoledronato (24,25).
Lo studio SOTI, condotto su 1640 pazienti in menopausa con osteoporosi e almeno una frattura vertebrale, ha rilevato una riduzione di circa il 40% delle fratture vertebrali alla fine del terzo anno di trattamento (26). Lo studio TROPOS ha evidenziato una riduzione del 16% delle fratture non-vertebrali (27), mentre analisi post-hoc hanno evidenziato, su una sotto-popolazione a più alto rischio, anche una riduzione delle fratture di femore, che è stata confermata persistere anche su studi di estensione che hanno previsto l'utilizzo di questa molecola.
Il riscontro di effetti collaterali, peraltro in parte già segnalati in questi studi, ma recentemente documentati anche al di fuori degli studi registrativi, con aumentata incidenza di trombo-embolia venosa, porta alla contro-indicazione all'assunzione di tale molecola in pazienti che hanno diatesi trombofilica. Studi post-marketing hanno riportato un’aumentata incidenza di sintomi e segni clinici della sindrome da ipersensibilità definita DRESS (Drug Rash with Eosinophilia and Systemic Symptoms), in seguito al cui riscontro è obbligatoria l'immediata sospensione del farmaco.
In ultimo, sempre analisi di tipo post-marketing hanno rilevato il riscontro di complicanze cardio-vascolari anche severe in seguito all’assunzione di tale farmaco, per cui ad aprile 2013 l’Agenzia Europea dei Medicinali (EMA) aveva raccomandato la restrizione d’uso per ridurre il rischio di problemi cardiaci e a gennaio del 2014 Il Comitato di valutazione dei Rischi per la Farmaco-vigilanza (PRAC) ha raccomandato che il ranelato di stronzio non debba più essere usato per il trattamento dell’osteoporosi (28). Al momento, anche se i dati (in particolar modo in merito agli eventuali effetti di tipo ischemico) non sono concordanti e conclusivi, il ranelato di stronzio è contro-indicato in pazienti con ipertensione non correttamente controllata e in coloro che risultino affetti da cardiopatia ischemica, arteriopatie periferiche e/o vasculopatie cerebrali; il suo utilizzo è esclusivamente ristretto a pazienti che siano intolleranti all'assunzione di altri presidi farmacologici utili per il trattamento dell'osteoporosi (29,30).
È il frammento comprendente i primi 34 aminoacidi dell'ormone paratiroideo, ottenuto con la tecnica del DNA ricombinante. Esplica un effetto anabolizzante, con spiccato aumento dei parametri densitometrici e riduzione sull'incidenza delle fratture vertebrali e non vertebrali, nella prevenzione secondaria dell’osteoporosi post-menopausale. Si somministra quotidianamente per via sotto-cutanea, per un periodo massimo di 24 mesi.
Teriparatide ha mostrato dati di efficacia, ma solo dal punto di vista densitometrico, in corso di osteoporosi maschile ed è risultato efficace nel ridurre il rischio di fratture vertebrali su pazienti in terapia cortisonica (31). La grandezza dell’effetto riportata negli studi registrativi è elevata. La dispensazione del farmaco a carico SSN è riservata a:
- pazienti con 3 o più fratture vertebrali e/o femorali;
- pazienti che incorrono in una nuova frattura vertebrale o in una frattura di femore in corso di trattamento con uno degli altri farmaci della nota 79 (alendronato, alendronato + vit. D3, risedronato, zoledronato, denosumab, raloxifene, ibandronato, ranelato di stronzio) da almeno un anno;
- pazienti con 1 frattura vertebrale e/o femorale e T-score ≤ -4 a livello del rachide e/o del femore;
- pazienti con una frattura vertebrale e/o femorale, in trattamento da più di 12 mesi con dosi > 5 mg/die di prednisone (o dosi equivalenti di altri corticosteroidi).
Il teriparatide è quindi destinato al trattamento delle forme più severe di osteoporosi, specie nei pazienti non responsivi agli altri farmaci.
PTH 1-84
Questa molecola non è più utilizzata nella terapia dell'osteoporosi. Attualmente è stata approvata sia da FDA che da EMA per la terapia sostitutiva nei pazienti con ipoparatiroidismo.
È un anticorpo monoclonale umano, inibitore reversibile del RANKL.
Uno studio registrativo della durata di 3 anni ha documentato significativi dati di efficacia sui parametri densitometrici e soprattutto sulla riduzione delle fratture vertebrali, non-vertebrali e femorali (32).
Gli effetti collaterali riportati sono poco rilevanti (aumentata incidenza di infezioni, in particolare cellulite). Le indicazioni AIFA per la dispensazione del farmaco a carico del SSN sono:
- trattamento dell’osteoporosi in donne in post-menopausa e in uomini ad aumentato rischio di fratture;
- trattamento della perdita ossea associata a terapia ormonale ablativa in uomini con cancro alla prostata e in donne con cancro della mammella ad aumentato rischio di fratture;
- trattamento della perdita ossea associata a terapia sistemica con glucocorticoidi a lungo termine in pazienti adulti ad aumentato rischio di frattura.
Denosumab viene somministrato alla posologia di 60 mg per via sotto-cutanea una volta ogni 6 mesi.
Uno studio di estensione ha rilevato la persistenza dell'efficacia, con un progressivo aumento densitometrico sia in sede lombare che femorale dopo 10 anni di terapia (33). Un altro studio ne ha validato l'efficacia in termini di aumento densitometrico anche nell'osteoporosi maschile (34). Infine, a conferma dell'efficacia in termini di compliance, un recente studio ha dimostrato l'efficacia del farmaco in termini di aderenza e persistenza se raffrontato con la somministrazione settimanale di alendronato (35).
Il farmaco può essere assunto anche in corso di insufficienza renale senza modificazioni posologiche. Denosumab a tutt'oggi occupa un importante ruolo come efficace farmaco nel trattamento dell'osteoporosi, sia in soggetti intolleranti all'assunzione di bisfosfonati sia in pazienti in pluri-terapia farmacologica o altri per i quali si sospetti che l'aderenza farmacologica possa risultare ridotta.
Dagli studi registrativi è emerso che i pazienti trattati con denosumab possono sviluppare infezioni cutanee (principalmente cellulite, 0.4% dei casi trattati). Studi di post-marketing hanno segnalato alcuni casi di ONJ e fratture di femore atipiche, con incidenza sovrapponibile a quella rilevata per i bisfosfonati. Sono stati riportati anche casi di anafilassi e ipocalcemia severa, per cui è raccomandata sempre la titolazione dei livelli di calcio prima e in corso di assunzione di tale trattamento farmacologico e un adeguato apporto di calcio e vitamina D (33).
| Tabella 2 Efficacia di diversi trattamenti sul rischio di frattura nell’osteoporosi post-menopausale |
|||
| Farmaco | Vertebrali | Non-vertebrali | Femorali |
| Alendronato | x | x | x |
| Risedronato | x | x | x |
| Ibandronato | x | no | no |
| Zoledronato | x | x | x |
| Clodronato | x | no | no |
| Ranelato di Stronzio | x | x | x |
| Denosumab | x | x | x |
| Raloxifene | x | no | no |
| Bazedoxifene | x | no | no |
| Lasofoxifene | x | x | no |
| Teriparatide | x | x | no |
È un anabolizzante analogo del PTHrp.
È un anticorpo monoclonale umanizzato diretto contro sclerostina, una glicoproteina secreta dagli osteociti, che riveste un ruolo fondamentale come inibitore dell’attività osteoblastica. Il suo effetto principale è quello di aumentare l’attività degli osteoblasti e la neo-formazione ossea; gli studi prodotti, tuttavia, hanno anche dimostrato un effetto inibitorio sugli osteoclasti e, di conseguenza, un’attività anti-riassorbitiva. Nello studio registrativo romosozumab si è dimostrato in grado di ridurre l’incidenza di fratture vertebrali e di aumentare significativamente la BMD, già dopo un solo anno di terapia (35,36).
LA NOTA AIFA 79
Il dato saliente che caratterizza la nota 79 è la soglia diagnostica in base alla quale stabilire l'eventuale trattamento farmacologico e la categorizzazione dei farmaci in prima, seconda e terza scelta.
Soglia diagnostica
Nella nota viene sottolineato il concetto in base al quale i maggiori dati di efficacia, intesi in termini di NNT (number needed to treat), siano presenti nei pazienti in prevenzione secondaria, cioè soggetti con pregresse fratture da fragilità ossea. In questi soggetti il grado di rischio è ritenuto più elevato, conformemente ai dati della letteratura, in coloro che:
- presentano fratture multiple;
- hanno marcata riduzione della densità ossea;
- sono in terapia cortisonica;
- vanno incontro a nuove fratture (vertebrali e/o femorali) nonostante l’assunzione di terapia farmacologica adeguata.
Per i pazienti in prevenzione primaria (cioè senza pregressi eventi fratturativi), visto il limitato numero di evidenze scientifiche per questa categoria di soggetti, viene giustificata una terapia farmacologica solo se presentano una marcata alterazione densitometrica in sede vertebrale e femorale, oppure se a un'alterazione densitometrica meno rilevante su questi siti ossei si associa la presenza di dati anamnestici positivi quali familiarità per fratture vertebrali e/o femorali o la comorbilità di artrite reumatoide o altre connettiviti, diabete mellito, BPCO, malattia infiammatoria cronica intestinale, morbo di Parkinson, sclerosi multipla e grave disabilità motoria.
Infine, nei pazienti in terapia cortisonica (trattamento previsto per più di 3 mesi con almeno 5 mg/die di prednisone o equivalenti) o in corso di blocco ormonale adiuvante (carcinoma mammario o prostatico) è posta indicazione al trattamento indipendentemente dal dato densitometrico.
Trattamenti farmacologici
Con la nota 79 sia in prevenzione primaria che secondaria i trattamenti farmacologici sono stati suddivisi in livelli di efficacia. In base a questa arbitraria classificazione, i livelli vengono così ripartiti (tabella 3).
| Tabella 3 | ||
| Prevenzione primaria | Pazienti in terapia cortisonica (da almeno 3 mesi, vedi sopra) | I scelta: alendronato, risedronato, zoledronato. II scelta: denosumab. |
| Pazienti in corso di blocco ormonale (K mammella/prostata) | I scelta: alendronato, risedronato, zoledronato, denosumab. | |
| Pazienti con T-score femorale e/o colonna < -4 | I scelta: alendronato (± vitamina D), risedronato. II scelta: denosumab, zoledronato, ibandronato, raloxifene, bazedoxifene. III scelta: stronzio ranelato. |
|
| Prevenzione secondaria | Pazienti con 1 o 2 fratture | I scelta: alendronato (± vitamina D), risedronato, zoledronato. II scelta: denosumab, ibandronato, raloxifene, bazedoxifene. III scelta: stronzio ranelato. |
| Pazienti con 3 o più fratture vertebrali e/o femorali | I scelta: teriparatide. II scelta: denosumab, zoledronato. III scelta: alendronato (± vitamina D), risedronato, ibandronato, stronzio ranelato. |
|
| Pazienti con almeno 1 frattura vertebrale e/o femorale e T-score ≤ -4. Pazienti con almeno 1 frattura e trattamento cortisonico per almeno 12 mesi con prednisone o equivalente (5 mg/die). Pazienti con nuova frattura vertebrale o femorale nonostante trattamento con farmaci in nota 79 da 1 anno |
I scelta: teriparatide. II scelta: denosumab, zoledronato. III scelta: alendronato (± vitamina D), risedronato, ibandronato, stronzio ranelato. |
|
| Pazienti con fratture non vertebrali e non femorali con un T-score femorale e/o vertebrale ≤ -3 | I scelta: alendronato, risedronato, zoledronato. II scelta: denosumab, ibandronato, raloxifene, bazedoxifene. III scelta: stronzio ranelato. |
|
BIBLIOGRAFIA
- Chapuy MC, Arlot ME, Duboeuf F, et al. Vitamin D3 and calcium to prevent hip fractures in the elderly women. N Engl J Med 1992, 327: 1637-42.
- Dawson-Hughes B, Harris SS, Krall EA, et al. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med 1997, 337: 670-6.
- Tang BM, Eslick GD, Nowson C, et al. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet 2007, 370: 657-66.
- Bischoff-Ferrari HA, Willett WC, Wong JB, et al. Prevention of nonvertebral fractures with oral vitamin D and dose dependency: a meta-analysis of randomized controlled trials. Arch Intern Med 2009, 169: 551-61.
- Glendenning P, Zhu K, Inderjeeth C, et al. Effects of three-monthly oral 150,000 IU cholecalciferol supplementation on falls, mobility, and muscle strength in older postmenopausal women: a randomized controlled trial. J Bone Miner Res 2012, 27: 170-6.
- Bolland MJ, Grey A, Avenell A, et al. Calcium supplements with or without vitamin D and risk of cardiovascular events: reanalysis of the Women’s Health Initiative limited access dataset and meta-analysis. BMJ 2011, 342: d2040.
- Mao PJ, Zhang C, Tang L, et al. Effect of calcium or vitamin D supplementation on vascular outcomes: a meta-analysis of randomized controlled trials. Int J Cardiol 2013, 169: 106-11.
- Adami S, Giannini S, Bianchi G, et al. Vitamin D status and response to treatment in post-menopausal osteoporosis. Osteoporos Int 2009, 20: 239-44.
- Chesnut CH 3rd, Silverman S, Andriano K, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. PROOF Study Group. Am J Med 2000, 109: 267-76.
- Cauley JA, Robbins J, Chen Z, et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women's Health Initiative randomized trial. JAMA 2003, 290: 1729-38.
- Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999, 282: 637-45. Erratum in: JAMA 1999, 282: 2124.
- Siris ES, Harris ST, Eastell R, et al. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res 2005, 20: 1514-24.
- Silverman SL, Christiansen C, Genant HK, et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3-year, randomized, placebo-, and active-controlled clinical trial. J Bone Miner Res 2008, 23: 1923-34.
- Black DM, Thompson DE, Bauer DC, et al. Fracture risk reduction with alendronate in women with osteoporosis: the Fracture Intervention Trial. FIT Research Group. J Clin Endocrinol Metab 2000, 85: 4118-24.
- Reginster J, Minne HW, Sorensen OH, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int 2000, 11: 83-91.
- McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001, 344: 333-40.
- Sorensen OH, Crawford GM, Mulder H, et al. Long-term efficacy of risedronate: a 5-year placebo-controlled clinical experience. Bone 2003, 32: 120-6.
- Chesnut III CH, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004, 19: 1241-9.
- Bauss F, Schimmer RC. Ibandronate: the first once-monthly oral bisphosphonate for treatment of postmenopausal osteoporosis. Ther Clin Risk Manag 2006, 2: 3-18.
- Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007, 356: 1809-22.
- McCloskey EV, Beneton M, Charlesworth D, et al. Clodronate reduces the incidence of fractures in community-dwelling elderly women unselected for osteoporosis: results of a double-blind, placebo-controlled randomized study. J Bone Miner Res 2007, 22: 135-41.
- Wong PK, Borromeo GL, Wark JD. Bisphosphonate-related osteonecrosis of the jaw in non malignant bone disease. Rheumatol Int 2013, 33: 2189-98.
- Shane E, Burr D, Ebeling PR. Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2010, 25: 2267–94.
- Brown JP, Morin S, Leslie W, et al. Bisphosphonates for treatment of osteoporosis. Expected benefits, potential harms, and drug holidays. Can Fam Physician 2014, 60: 324-33.
- Diab DL, Watts NB. Bisphosphonate drug holiday: who, when and how long. Ther Adv Musculoskel Dis 2013, 5: 107–11.
- Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004, 350: 459-68.
- Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005, 90: 2816-22.
- European Medicines Agency. European Medicines Agency recommends that Protelos/Osseor remain available but with further restrictions. 21/2/2014.
- Reginster JY. Cardiac concerns associated with strontium ranelate. Expert Opin Drug Saf 2014, 13: 1209-13.
- Cooper C, Fox KM, Borer JS. Ischaemic cardiac events and use of strontium ranelate in postmenopausal osteoporosis: a nested case–control study in the CPRD. Osteoporos Int 2014, 25: 737–45.
- Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001, 344: 1434-41.
- Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009, 361: 756-65. Erratum in: N Engl J Med 2009, 361: 1914.
- Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol 2017, 5: 513-23.
- Orwoll E, Teglbjærg CS, Langdahl BL, et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density. J Clin Endocrinol Metab 2012, 97: 3161–9.
- Geller M, Wagman RB, Siddhanti S. Early findings from Prolia post-marketing safety surveillance for atypical femoral fracture, osteonecrosis of the jaw, severe symptomatic hypocalcemia, and anaphylaxis. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases 2014, apr 2-5: OC40.
- Appelman-Dijkstra NM, Papapoulos SE. Modulating bone resorption and bone formation in opposite directions in the treatment of postmenopausal osteoporosis. Drugs 2015, 75: 1049–58.
- Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med 2016, 375: 1532-43.
- Vescini F, Attanasio R, Balestrieri A, et al. Italian association of clinical endocrinologists (AME) position statement: drug therapy of osteoporosis. J Endocrinol Invest 2016, 39: 807-34.
- AME. Osteonecrosi delle ossa mascellari da bisfosfonati o denosumab: analisi del rischio e azioni cliniche. AME raccomanda 1/2018.
Terapie sequenziali e di combinazione per l’osteoporosi
Fabio Vescini, Antonio Stefano Salcuni & Alessandro Brunetti
SOC Endocrinologia, Azienda Sanitaria Universitaria – Friuli Centrale
(aggiornato al 20 dicembre 2023)
PREMESSA
Il panorama farmacologico per l’osteoporosi si è progressivamente ampliato negli ultimi anni. Attualmente sono disponibili farmaci anti-riassorbitivi, anabolici e a duplice azione (anabolica e anti-riassorbitiva), ma alcune di queste terapie posso essere utilizzate solo per un periodo limitato, ponendo la necessità di una terapia sequenziale. Inoltre, il peggioramento del quadro clinico in corso di trattamento con un farmaco osteo-attivo può richiedere il passaggio ad un’altra classe farmacologica o alla combinazione di due farmaci. Conoscere dunque le corrette sequenze o combinazioni terapeutiche è fondamentale per ottenere risultati ottimali, in termini di miglioramento della densità minerale ossea (BMD) e riduzione del rischio fratturativo.
TERAPIA SEQUENZIALE
Esistono diverse possibili combinazioni.
Farmaco anabolico o a duplice azione seguito da anti-riassorbitivo
La terapia sequenziale classica, che ha mostrato la migliore efficacia in termini di aumento della BMD e riduzione del rischio fratturativo, è rappresentata da una terapia anabolica (teriparatide, abaloparatide) o duplice azione (romosozumab) seguita da una terapia anti-riassorbitiva.
Gli studi DATA-SWITCH e FRAME (Fracture study in postmenopausal women with osteoporosis) hanno chiaramente evidenziato come l’utilizzo di denosumab al termine, rispettivamente, di due anni di teriparatide o di un anno di romosozumab, consenta un ulteriore miglioramento della BMD e una riduzione del rischio fratturativo (1,2).
Anche l’utilizzo sequenziale di bisfosfonati dopo teriparatide (3) o romosozumab (4) ha mostrato un effetto positivo sulla BMD, anche se in minor misura rispetto a denosumab (5,6). Lo studio ACTIVExtend (Abaloparatide Comparator Trial in Vertebral Endpoints Extension) ha confermato un effetto positivo dei bisfosfonati orali in terapia sequenziale anche dopo abaloparatide (7).
Farmaco anti-riassorbitivo seguito da anabolico o da duplice azione
L’efficacia di tale sequenza terapeutica dipende dal tipo di anti-riassorbitivo utilizzato. I farmaci anti-riassorbitivi maggiormente utilizzati nella pratica clinica sono i bisfosfonati e il denosumab. I bisfosfonati (alendronato, risedronato, ibandronato, zoledronato) possono restare all’interno della matrice ossea per diverso tempo, anche dopo la sospensione del trattamento, determinando un’inibizione prolungata del riassorbimento osseo. Alcuni studi suggeriscono una riduzione dell’effetto anabolico di teriparatide nei pazienti che sono stati precedentemente trattati con bisfosfonati rispetto ai pazienti naïve (8,9). Tuttavia, l’effetto anti-fratturativo di teriparatide risulta comunque mantenuto (10,11). A differenza dei bisfosfonati, l’effetto inibitorio del denosumab sul riassorbimento osseo si esaurisce rapidamente alla sospensione della terapia. Infatti, già dopo sei mesi dall’ultima somministrazione si verifica un rapido aumento degli indici di riassorbimento osseo, noto come effetto “rebound”. Le cause di tale fenomeno non sono ancora del tutto note. Alcuni autori suggeriscono che l’inibizione di RANK-ligando determinata da denosumab sia associata all’accumulo di precursori degli osteoclasti, che si riattivano rapidamente al termine del trattamento, con conseguente aumento del riassorbimento osseo (2). Lo studio DATA-SWITCH (1) ha valutato l’uso di teriparatide in pazienti già trattati con denosumab per 2 anni e ha mostrato come vi sia una riduzione transitoria della BMD a livello lombare ed una più profonda e duratura riduzione a livello femorale e radiale. Per tali ragioni, nella pratica clinica non è consigliabile l’utilizzo di teriparatide dopo sospensione di denosumab.
Recenti studi hanno indagato anche l’utilizzo sequenziale di romosozumab dopo farmaci anti-riassorbitivi. Lo studio STRUCTURE (Study evaluating the effect of Romosozumab Compared with Teriparatide in postmenopausal women with osteoporosis at high risk for fracture previously treated with bisphosphonate therapy) ha valutato l’efficacia di romosozumab rispetto a teriparatide in donne in post-menopausa precedentemente trattate con bisfosfonati per un periodo medio di sei anni. Dopo follow-up di 12 mesi, le pazienti trattate con romosozumab presentavano un incremento della BMD superiore rispetto a teriparatide, sia a livello lombare (+9.8% vs +5.4%, p < 0.0001) sia a livello del femore totale (+2.6% vs -0.6%, p < 0.0001) (13).
Non vi sono solide evidenze in letteratura sull’efficacia di una terapia sequenziale con romosozumab dopo denosumab. In uno studio di fase 2 su 16 pazienti, il trattamento con un secondo ciclo di romosozumab dopo due anni di denosumab, ha mantenuto sostanzialmente stabili i valori di BMD alla colonna (+2.3%) e al femore (-0.1%) (14).
Farmaco anti-riassorbitivo seguito da altro anti-riassorbitivo
L’utilizzo sequenziale di un farmaco anti-riassorbitivo dopo un altro anti-riassorbitivo prevede di solito due scenari:
- l’utilizzo di zoledronato o denosumab dopo bisfosfonati orali in caso di scarsa tolleranza o fallimento terapeutico di questi ultimi ed impossibilità ad avviare terapia anabolica. In uno studio retrospettivo su circa 650 donne precedentemente trattate con bisfosfonati orali, l’utilizzo sequenziale di zoledronato o denosumab ha mostrato miglioramento significativo della BMD e riduzione del rischio fratturativo, con maggiore efficacia di denosumab rispetto a zoledronato (15);
- l’utilizzo sequenziale dei bisfosfonati (orali o endovena) dopo la sospensione del denosumab per prevenzione dell’effetto “rebound”. L’uso di anti-riassorbitivi come i bisfosfonati è da considerare assolutamente obbligatorio per la prevenzione dell’effetto “rebound” dopo sospensione di denosumab. Un recente position statement della European Calcified Tissue Society (ECTS) consiglia l’utilizzo sequenziale di alendronato o zoledronato, in base alla durata del precedente trattamento con denosumab (16).
Farmaco anabolico seguito da farmaco a duplice azione
Gli studi che hanno valutato questo passaggio sono pochi e con scarsa numerosità campionaria. In una piccola coorte di 16 pazienti trattati con romosozumab dopo un anno di teriparatide si è evidenziato un aumento significativo della BMD lombare (+11.2%) e femorale (+4.4%) (17). Tuttavia, non vi sono dati sulla riduzione dell’incidenza di fratture.
Non vi sono attualmente studi in letteratura sull’utilizzo di teriparatide dopo romosozumab.
TERAPIA DI COMBINAZIONE
Pochi studi clinici e studi osservazionali con evidenze limitate hanno esaminato la possibilità di combinare un farmaco anti-riassorbitivo con un farmaco anabolico. Tuttavia, attualmente tale opzione non è rimborsabile da parte del SSN, quindi la spesa per uno dei due farmaci è da considerare a carico del paziente.
La combinazione teriparatide + alendronato è stata valutata in un RCT su circa 90 pazienti, mostrando uno svantaggio in termini di miglioramento della BMD rispetto a teriparatide in mono-terapia (1), anche se la dose di teriparatide utilizzata nello studio era di 40 μg/die, quindi doppia rispetto a quella utilizzata nella pratica clinica.
La combinazione zoledronato + teriparatide è stata valutata in uno studio prospettico su circa 400 donne affette da osteoporosi post-menopausale, mostrando un effetto positivo sulla BMD rispetto ai singoli farmaci in monoterapia (19).
La combinazione più efficace è tuttavia rappresentata da teriparatide + denosumab: lo studio DATA ha evidenziato un chiaro vantaggio di tale combinazione rispetto a teriparatide in mono-terapia, in termini di miglioramento della BMD sia a livello lombare (+12.9% vs +9.5%, p = 0.01) che a livello femorale (+6.3% vs +2%, p < 0.01) (20). Inoltre, si è documentato un aumento dello spessore corticale e della resistenza ossea (21).
Non vi sono ancora in letteratura studi sulla combinazione di romosozumab con farmaci anti-riassorbitivi.
BIBLIOGRAFIA
- Leder BZ, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet 2015, 386: 1147–55.
- Cosman F, et al. FRAME study: the foundation effect of building bone with 1 year of romosozumab leads to continued lower fracture risk after transition to denosumab. J Bone Miner Res 2018, 33: 1219–26.
- Kurland ES, et al. The importance of bisphosphonate therapy in maintaining bone mass in men after therapy with teriparatide [human parathyroid hormone(1-34)]. Osteoporos Int 2004, 15: 992–7.
- Saag KG, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017, 377: 1417–27.
- Kocjan T, et al. Switching to denosumab or bisphosphonates after completion of teriparatide treatment in women with severe postmenopausal osteoporosis. Endocr Pract 2021, 27: 941–7.
- Cosman F, et al. Romosozumab and antiresorptive treatment: the importance of treatment sequence. Osteoporos Int 2022, 33: 1243–56.
- Bone HG, et al. ACTIVExtend: 24 months of alendronate after 18 months of abaloparatide or placebo for postmenopausal osteoporosis. J Clin Endocrinol Metab 2018, 103: 2949–57.
- Obermayer-Pietsch BM, et al. Effects of two years of daily teriparatide treatment on BMD in postmenopausal women with severe osteoporosis with and without prior antiresorptive treatment. J Bone Miner Res 2008, 23: 1591–600.
- Miller PD, et al. Early responsiveness of women with osteoporosis to teriparatide after therapy with alendronate or risedronate. J Clin Endocrinol Metab 2008, 93: 3785–93.
- Yoshiki F, Nishikawa A, Taketsuna M, et al. Efficacy and safety of teriparatide in bisphosphonate-pretreated and treatment-naive patients with osteoporosis at high risk of fracture: post hoc analysis of a prospective observational study. J Orthop Sci 2017, 22: 330–8.
- Middleton ET, Steel SA, Doherty SM. The effect of prior bisphosphonate exposure on the treatment response to teriparatide in clinical practice. Calcif Tissue Int 2007, 81: 335–40.
- Kim AS, Girgis CM, McDonald MM. Osteoclast recycling and the rebound phenomenon following denosumab discontinuation. Curr Osteoporos Rep 2022, 20: 505–15.
- Langdahl BL, et al. Romosozumab (sclerostin monoclonal antibody) versus teriparatide in postmenopausal women with osteoporosis transitioning from oral bisphosphonate therapy: a randomised, open-label, phase 3 trial. Lancet 2017, 390: 1585–94.
- Kendler DL, et al. Bone mineral density gains with a second 12-month course of romosozumab therapy following placebo or denosumab. Osteoporos Int 2019, 30: 2437–48.
- Miller PD, et al. Denosumab or zoledronic acid in postmenopausal women with osteoporosis previously treated with oral bisphosphonates. J Clin Endocrinol Metab 2016, 101: 3163–70.
- Tsourdi E, et al. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab 2021, 106: 264–81.
- Ebina K, et al. Effects of prior osteoporosis treatment on early treatment response of romosozumab in patients with postmenopausal osteoporosis. Bone 2020, 140: 115574.
- Finkelstein JS, Wyland JJ, Lee H, Neer RM. Effects of teriparatide, alendronate, or both in women with postmenopausal osteoporosis. J Clin Endocrinol Metab 2010, 95: 1838–45.
- Cosman F, et al. Effects of intravenous zoledronic acid plus subcutaneous teriparatide [rhPTH(1-34)] in postmenopausal osteoporosis. J Bone Miner Res 2011, 26: 503–11.
- Leder BZ, et al. Two years of denosumab and teriparatide administration in postmenopausal women with osteoporosis (the DATA Extension Study): a randomized controlled trial. J Clin Endocrinol Metab 2014, 99: 1694–700.
- Tsai JN, et al. Effects of two years of teriparatide, denosumab, or both on bone microarchitecture and strength (DATA-HRpQCT study). J Clin Endocrinol Metab 2016, 101: 2023–30.
Scheda bisfosfonati
Fabio Vescini
SOC Endocrinologia e Malattie del Metabolismo, Azienda Ospedaliero-Universitaria S. Maria della Misericordia, Udine
Meccanismo d’azione
Inibizione del riassorbimento osseo mediante induzione dell’apoptosi osteoclastica.
Preparazioni, via di somministrazione, posologia
Alendronato:
- cp 10 mg (1 cp/die): Adronat, Genalen
- cp 70 mg (1 cp/settimana): Adronat, alendronato Almus, alendronato DOC, alendronato EG, alendronato Mylan, alendronato Pensa, alendronato Sandoz, alendronato TEVA, alendronato Zentiva, Alendros, Alenic, Aston, Doryx, Dralenos, Fosamax, Genalen, Glamor, Loss, Nofrattil, Osteum, Porodron, Poronal, Realen,
- cp effervescenti 70 mg: Binosto
- soluzione orale 70 mg: Bonasol
Alendronato + colecalciferolo:
- 70 mg + 2800 UI (1 cp/settimana): Adrovance, A+C Accord, A+C DOC, A+C Mylan, A+C Sandoz, A+C Teva, Fosavance, Vantavo
- 70 mg + 5600 UI (1 cp/settimana): Adrovance, A+C Accord, A+C DOC, A+C Mylan, A+C Pensa, A+C Sandoz, A+C Teva, Fosavance, Vantavo
- cp riv 5 mg (1 cp/die): Actonel
- cp riv 35 mg (1 cp/settimana): Actonel, Cedravis, Fodren, Optinate, Rilovans, Riseceus, Risectol, Risedronato Accord, Risedronato Alter, Risedronato Aurobindo, Risedronato DOC, Risedronato EG, Risedronato Sandoz, Risedronato Tecnigen, Risedronato Zentiva, Risencal, Trimmer, Vesnar
- cp riv 75 mg (2 cp/mese): Actonel, Optinate, Risedronato Aurobindo, Risedronato DOC, Risedronato EG,
- cps 400 mg (1cps/die): Clasteon, Clodron, Difosfonal
- fl 100 mg/3.3 mL (+ lidocaina 1%, 1 fl im ogni 7-14 giorni): Clasteon, Clodeosten, Clodron, clodronato ABC, clodronato TEVA, Clody, Difosfonal, Moticlod, Niklod
- fl 200 mg/4 mL (+ lidocaina 1%, 1 fl im ogni 7-14 giorni): Clasteon, Clodron, clodronato TEVA, Clody, Difosfonal, Niklod
- fl 300 mg/10 mL (1 fl ev ogni 3-4 settimane): Clasteon, Clodron, clodronato ABC, Clody, Difosfonal
- cp 50 mg: Bondronat, ibandronato Teva
- cp 150 mg (1 cp/mese): Baxogar, Bonviva, ibandronato Alter, ibandronato Aurobindo, ibandronato DOC, ibandronato EG, ibandronato Mylan, ibandronato Pensa, ibandronato Sandoz, ibandronato Tecnigen, ibandronato Teva, ibandronato Zentiva
- fl 2 mg/2 mL: Bondronat
- fl 3 mg/3 mL (1 fl ev ogni 3 mesi): Bonviva, ibandronato Accord
Pamidronato:
- fl 15 mg/5 mL: Pamidronato Bioindustria, Pamidronato Hikma
- fl 30 mg/10 mL: Pamidronato Bioindustria, Pamidronato Hikma, Texpami
- fl 60 mg/10 mL: Pamidronato Bioindustria, Pamidronato Hikma, Texpami
- fl 90 mg/10 mL: Pamidronato Bioindustria, Pamidronato Hikma, Texpami
- fl 25 mg, fl 100 mg: Nerixia
- fl 4 mg/5 mL (1 fl ev all’anno): acido zoledronico Accord, acido zoledronico Hikma, acido zoledronico Mylan, acido zoledronico Tillomed, Zometa
- fl 5 mg/100 mL (1 fl ev all’anno): acido zoledronico Altan, Aclasta
Indicazioni
Prevenzione dell'osteoporosi post-menopausale (clodronato)
Terapia dell’osteoporosi post-menopausale (alendronato, clodronato, zoledronato) in donne ad alto rischio di frattura (ibandronato)
Riduzione del rischio di fratture vertebrali (alendronato, risedronato, ibandronato) e dell’anca (alendronato, risedronato)
Riduzione del rischio di frattura in pazienti con osteoporosi secondaria all’uso di corticosteroidi (alendronato e risedronato)
Terapia dell’osteoporosi associata a trattamento a lungo termine con glucocorticoidi (in donne in post-menopausa e in uomini ad aumentato rischio di frattura)(zoledronato)
Terapia dell’osteoporosi negli uomini ad elevato rischio di fratture (risedronato), compresi quelli con una recente frattura dell’anca da trauma lieve (zoledronato)
Contro-indicazioni
Ipocalcemia
Gravidanza e allattamento
Insufficienza renale di grado severo (VFG < 35 mL/min)
Bambini e adolescenti
Per i preparati orali:
- patologie dell’esofago (malattia da reflusso gastro-esofageo, stenosi dell’esofago, acalasia)
- impossibilità a mantenere la stazione eretta per almeno 30 minuti dopo l’assunzione del farmaco
Per ibandronato: pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit di Lapp-lattasi, o da malassorbimento di glucosio-galattosio
Per clodronato fl 100 mg im (contiene lidocaina 1%): ipersensibilità alla lidocaina, o ad altri anestetici locali di tipo amidico
Precauzioni d’uso
Pazienti con severa parodontopatia in procinto di essere sottoposti ad interventi odontostomatologici
Altre malattie dentarie che richiedono interventi cruenti con esposizione dell’osso mascellare e/o mandibolare
Pazienti, senza evidenza di osteoporosi, che presentino ispessimento radiologico sospetto della corticale del femore
Non assumere con bevande diverse dall’acqua o in associazione a altri farmaci (es. calcio, anti-acidi, integratori alimentari)
L’acqua utilizzata per l’assunzione del farmaco deve essere povera di calcio (interferenza con l’assorbimento intestinale)
Per lo zoledronato:
- l’infusione deve essere sempre preceduta da un’adeguata somministrazione di colecalciferolo (dose di carico da 50.000 a 125.000 UI di vitamina D, somministrata per via orale o per via intramuscolare)
- vista la relativa frequenza di ipocalcemia, può essere necessario somministrare calcio carbonato (500 mg x 2/die) per alcuni giorni dopo l’infusione del farmaco
Effetti collaterali
Per lo zoledronato: in una rilevante percentuale di casi, specie alla prima infusione del farmaco, può presentarsi una reazione di fase acuta, con febbre, cefalea, artralgie, mialgie, che può essere trattata con la somministrazione di paracetamolo o ibuprofene.
Limitazioni prescrittive
Nota AIFA 79
Scheda SERM
Fabio Vescini
SOC Endocrinologia e Malattie del Metabolismo, Azienda Ospedaliero-Universitaria S. Maria della Misericordia, Udine
La sigla SERM significa Selective Estrogen Receptor Modulators (modulatori selettivi del recettore estrogenico).
Meccanismo d’azione
Agonisti/antagonisti recettoriali del recettore estrogenico che, a livello osseo, inibiscono il riassorbimento osteoclasto-mediato.
Preparazioni, via di somministrazione, posologia
Raloxifene cp 60 mg (Evista, Optruma, Raloxifene Sandoz): 1 cp/die
Bazedoxifene cp 20 mg (Conbriza): 1 cp/die
Indicazioni
Trattamento dell’osteoporosi in donne in post-menopausa ad aumentato rischio di frattura.
Contro-indicazioni
Tromboembolia venosa (presente o pregressa)
Donne in età fertile
Sanguinamenti uterini non spiegati
Pazienti con segni o sintomi sospetti di carcinoma endometriale
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti
Effetti collaterali
Trombosi venosa profonda (comprese embolia polmonare e trombosi retinica), crisi vasomotorie, crampi muscolari.
Precauzioni d’uso
Sindrome climaterica
Intolleranza al galattosio, insufficienza di Lapp-lattasi o malassorbimento di glucosio-galattosio.
Limitazioni prescrittive
Nota AIFA 79.

