Forma familiare
Tireopatie iatrogene
Luca Piantoni
UOC Malattie Endocrine, Polo Ospedaliero Integrato S. Eugenio e CTO A. Alesini, Azienda USL Roma C
(aggiornato al 30 dicembre 2019)
Numerosi sono i farmaci che sono stati associati nel tempo a quadri di patologia tiroidea. La bassa frequenza di segnalazioni e la reale incidenza di tali quadri ha comportato modeste ricadute cliniche fino all’introduzione in clinica cardiologica di una molecola ad alta efficacia anti-aritmica – l’amiodarone – , ma gravata da significativi effetti sulla funzione tiroidea. Tali quadri rappresentano oggi la prima causa di tiroiditi iatrogene. Per la loro frequenza e per i possibili effetti di ipofunzione o tireotossicosi si è ritenuto di affrontarlo come argomento specifico e separato.
Il campo dei farmaci in campo anti-infiammatorio anti-neoplastico è in continua evoluzione. Alcune molecole hanno un valore storico. Per altre, di recente introduzione, non sempre sono disponibili dati specifici.
ANTI-EPILETTICI
È noto che i farmaci anti-epilettici possono influenzare il metabolismo e l’efficacia di altri farmaci (1), inclusi quelli ormonali, richiedendo talora una modificazione dei dosaggi e una particolare attenzione ai possibili effetti collaterali. A loro volta, i farmaci ormonali possono influenzare l’azione degli anti-epilettici (2,3).
Gli anti-epilettici possono influenzare sia la secrezione degli ormoni tiroidei che la terapia sostitutiva. Nei pazienti in terapia anti-convulsivante è stato descritto un rischio aumentato di disfunzioni tiroidee. I meccanismi principali con cui gli anti-epilettici esercitano un’influenza nei pazienti ipotiroidei in terapia sostitutiva comprendono:
- la competizione tra il farmaco anti-epilettico e l’ormone tiroideo per il legame alle proteine plasmatiche (fenitoina, carbamazepina, oxcarbazepina);
- il metabolismo accelerato degli ormoni tiroidei per induzione degli enzimi epatici CYP3A4 e UGT (fenobarbital, fenitoina, carbamazepina, oxcarbazepina);
- l’aumento della conversione periferica della T4 a T3.
L’aumento del metabolismo epatico degli ormoni tiroidei può portare a una riduzione della T4 plasmatica. Il valproato può precipitare un ipotiroidismo, ma i meccanismi d’azione non sono chiari.
Nessuno studio è stato rivolto specificatamente all’influenza dei farmaci anti-epilettici nei pazienti con ipotiroidismo centrale. Per mantenere nella norma i valori di FT4 nei pazienti con ipotiroidismo secondario che assumono farmaci anti-epilettici con azione di induzione enzimatica, può essere necessario un aumento del dosaggio della terapia con tiroxina. Concentrazioni terapeutiche di fenitonina e carbamazepina possono spiazzare la T4 e la T3 dal legame con le proteine, interferendo col dosaggio. Va anche tenuto presente che la tiroxina riduce la soglia epilettogena, per cui va evitato il sovra-dosaggio ed è importante la valutazione clinica per evidenziare segni di sotto- o sovra-dosaggio. I pazienti ipopituitarici assumono una terapia ormonale sostitutiva multipla, per cui vanno anche tenuti presenti gli effetti delle altre terapie ormonali sulla dose necessaria di ormone tiroideo. Data la scarsità di questi dati, l’invito è sempre quello di controllare la concentrazione della FT4 in terapia (possibilmente con metodiche come la dialisi all’equilibrio, per evitare interferenze) e di valutare clinicamente il paziente.
Nella meta-analisi di Zhang del 2016 (4) i neurologi cinesi hanno ricercato gli effetti dei farmaci anti-epilettici sulla funzionalità tiroidea in pazienti con epilessia. Dei 35 studi presi in esame, 25 erano focalizzati sugli effetti di specifici farmaci anti-epilettici: acido valproico (VPA), carbamazepina (CBZ), fenitoina (PHT). La metanalisi dimostra globalmente un’alterazione del profilo tiroideo in pazienti in trattamento con anti-epilettici rispetto ai controlli sani, in particolare:
- significativa riduzione di T4 (differenza media standardizzata, SMD -1.839) e FT4 (SMD -1.190);
- incremento di TSH (SMD + 0.445);
- non significative variazioni di T3 e FT3.
Questo andamento si conferma anche analizzando separatamente i pazienti in mono-terapia con VPA, PHT o CBZ; nei pazienti in trattamento con CBZ si riscontra anche una riduzione delle concentrazioni di T3.
È noto che gli anti-epilettici possono influenzare trasporto, metabolismo ed eliminazione degli ormoni tiroidei, attraverso diversi meccanismi (5,6), peraltro non del tutto chiariti. Dai dati presenti in letteratura, fenobarbital, PHT e CBZ attivano il sistema degli enzimi epatici microsomiali (P450) e per questa via accelerano il metabolismo degli ormoni tiroidei. Inoltre, è stato anche descritto un aumento dell’enzima glucuronil-transferasi, che interviene anch’esso nel catabolismo degli ormoni tiroidei. Ne consegue una riduzione della T4, per incremento della sua degradazione, che comporta un aumento compensatorio del TSH. Alcuni anti-epilettici sono inoltre in grado di competere con l’ormone tiroideo per il legame alla TBG (PHT e derivati, CBZ) e questo può portare a un artefatto nel dosaggio, con una diminuzione apparente di FT4. PHT influenza anche l’attività desiodasica, incrementando la conversione periferica della T4 a T3. Ecco due esempi:
- paziente di 56 anni (acido valproico + sodio valproato): TSH 1.76 mU/L, FT3 2.76 pg/mL (vn 2-4.4), FT4 7.84 pg/mL (vn 9.3-17);
- paziente di 36 anni (acido valproico + sodio valproato + eslicarbamazepina acetato + zonisamide): TSH 2.94 mU/L, FT3 2.51 pg/mL (vn 2-4.4), FT4 0.34 pg/mL (vn 0.7-1.7).
L’incongruenza dei valori, anche dopo la ripetizione in diverso laboratorio, suggerisce l’utilità di verificare l’assunzione di terapie precedentemente non riferite dal paziente.
Alcuni anti-epilettici potrebbero avere anche effetti diretti sulla secrezione di TSH: ad esempio, VPA, stimolando il sistema GABAergico, può ridurre la secrezione di somatostatina, che è un inibitore della secrezione del TSH. Inoltre, VPA può associarsi a carenza di Zinco e Selenio, che giocano un ruolo nella sintesi degli ormoni tiroidei. Le alterazioni delle concentrazioni degli ormoni tiroidei sembrano essere reversibili dopo la sospensione dell’anti-epilettico. I limiti dello studio, riconosciuti dagli stessi autori, sono dovuti al fatto che tutti gli studi inclusi sono osservazionali e inoltre gli anti-epilettici di nuova generazione non sono stati inclusi nell’analisi. Peraltro, i farmaci tradizionali considerati sono a tutt’oggi ampiamente utilizzati. Non sono inoltre disponibili dati sull’eventuale presenza di segni di autoimmunità tiroidea nei pazienti. Infine, non viene descritto il riscontro di manifestazioni cliniche di ipotiroidismo in questi pazienti e resta incerta la rilevanza clinica delle alterazioni nel profilo ormonale tiroideo riscontrate (7).
Che fare: si sottolinea la necessità di controllare la funzionalità tiroidea nei pazienti in terapia cronica con anti-epilettici. L’indicazione al trattamento delle alterazioni riscontrate andrà valutata da parte dell’endocrinologo, in base alla loro entità, facendo riferimento in particolare al TSH (nel paziente con normale funzionalità ipofisaria) e al contesto clinico. Particolare attenzione andrà posta nei pazienti con pre-esistenti problemi tiroidei e/o già in terapia sostitutiva. Può essere considerato con il neurologo un eventuale passaggio a un farmaco di ultima generazione (leviracetam), che non sarebbe un induttore enzimatico e non avrebbe mostrato tali effetti.
IMMUNO-TERAPIA ONCOLOGICA
L’immuno-terapia oncologica si fonda sul principio del riconoscimento di antigeni tumore-specifici da parte dei linfociti del paziente. Essa può sfruttare sia l’immunità umorale che cellulo-mediata e può prevedere l’uso di citochine, anticorpi monoclonali anti-antigeni tumorali o inibitori dei check-point immunitari, virus oncolitici, trasferimento adottivo di cellule T e vaccini anti-cancro. In tutti questi tipi di terapia si possono avere disfunzioni tiroidee. Un’interessante revisione ha analizzato la letteratura pubblicata sull’argomento fino al marzo 2017 (8).
Interleuchina-2
Uso clinico: melanoma metastatico, carcinoma a cellule renali.
Prevalenza di disfunzione tiroidea: 22% per tireopatie non altrimenti specificate, 15-40% per ipotiroidismo, 19% per ipertiroidismo (anche subclinico transitorio).
Patogenesi: probabilmente multi-fattoriale, si associa alla comparsa di auto-immunità tiroidea.
Interferone gamma
Uso clinico: oltre che in oncologia, è stato utilizzato anche per malattie autoimmuni (ad esempio sclerosi multipla) e infettive (ad esempio epatite virale) (9).
Meccanismo d’azione: immuno-modulazione, proprietà anti-virali e anti-neoplastiche.
Prevalenza di disfunzione tiroidea: variabile dall’1 al 50% per tireopatie in generale, 20% per ipotiroidismo autoimmune, 2-3% per tiroidite distruttiva.
Patogenesi: espressione ectopica sul tireocita di molecole del complesso di isto-compatibilità, con aumento della presentazione di auto-antigeni; linfocitosi con incremento percentuale di linfociti natural killer e B.
Inibitori dei check-point immunitari (vedi anche capitolo specifico)
Sono possibili, e ormai ben noti, effetti collaterali a carico di ipofisi, tiroide e, più raramente, surreni e pancreas endocrino.
Uso clinico: melanoma e la maggior parte dei tumori solidi (in particolare del polmone e del rene).
Meccanismo d’azione: promozione della risposta delle cellule T ai tumori, attraverso l’inibizione dei cosiddetti check-point immunitari, vie metaboliche che regolano in senso inibitorio l’azione dell’immunità cellulo-mediata.
- CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4): tra gli anticorpi anti-CTLA-4, più spesso associati a ipofisite, ricordiamo ipilimumab (Yervoy) e tremelimumab;
- PD-1 (programmed cell death protein-1)/PD-1 ligando: tra gli anticorpi anti-PD-1, pembrolizumab (Keytruda), nivolumab (Opdivo) e pidilizumab; tra gli anti-PD-L1, durvalumab (Imfinzi), atezolizumab (Tecentriq), avelumab (Bavencio).
Prevalenza di disfunzione tiroidea: alto rischio di tireopatie autoimmuni, maggiore per gli anticorpi anti-PD-1 e ancor di più quando si associano diversi farmaci (tabella), come ad esempio per la combinazione di ipilimumab con nivolumab nella terapia del melanoma. Nel caso degli anticorpi anti-PD-1 si possono avere anche tiroiditi distruttive, con una prevalenza del 12%. In particolare, per nivolumab sono stati documentati ipotiroidismo (2-40%, rischio relativo = 12), ipertiroidismo e tiroidite (1-6.5%) e, più in generale, possono verificarsi tireotossicosi transitoria, ipotiroidismo transitorio o definitivo, orbitopatia di Graves, tiroidite silente, peggioramento di pre-esistente tireopatia autoimmune e, raramente, forme gravi come tempesta tireotossica ed encefalopatia responsiva agli steroidi. Più spesso si tratta di forme lievi di tiroidite silente su base autoimmune.
L’ipo e/o ipertiroidismo possono svilupparsi in fase relativamente precoce durante la terapia con questi farmaci (mediana di 9-11 settimane circa dopo l’inizio di nivolumab o dopo 2-3 dosi di ipilimumab) e comunque in qualunque fase del trattamento (10). Raramente la gravità della tireopatia è tale da richiedere la sospensione della terapia o incidere sulla sopravvivenza.
| Prevalenza di disfunzione tiroidea da inibitori dei check-point immunitari | |||
| Tipo di trattamento | Disfunzione tiroidea non specificata | Ipotiroidismo | Ipertiroidismo* |
| Anti-CTLA-4 | 23% | 4-15% | 3% |
| Anti-PD-1 | 39% | 9-40% | 1-13% |
| Anti-PD-L1 | 7-21% | 7-21% | 10% |
| Anti-CTLA-4 + anti-PD-1 o anti-PD-L1 | 50% | 2-27% | 22-30% |
| *comprese forme subcliniche transitorie | |||
Patogenesi: reazione cellulo-mediata contro auto-antigeni in seguito alla down-regolazione dei linfociti T regolatori e alla promozione dei linfociti T effettori, induzione di auto-immunità tiroidea, legame degli anticorpi a PD-L1 e PD-L2 presenti nei tireociti normali; sono stati descritti inoltre anticorpi anti-cellule tireotrope.
Virus oncolitici
Uso clinico: melanoma.
Meccanismo d’azione: infezione di cellule neoplastiche ad opera di un virus Herpes Simplex combinato con un fattore di crescita (GM-CSF), che determina sia un effetto cito-tossico diretto, sia il rilascio di antigeni tumorali in grado di indurre la risposta immunitaria (effetto indiretto).
Prevalenza di disfunzione tiroidea: rara.
Patogenesi: non nota.
Trasferimento adottivo di cellule T
Uso clinico: melanoma, neoplasie ematologiche.
Meccanismo d’azione: auto-trapianto di linfociti infiltranti il tumore.
Prevalenza di disfunzioni tiroidee: finora non sono state descritte disfunzioni endocrine, ma potrebbero essere possibili visto che l’esperienza con questa strategia terapeutica è ancora limitata.
Patogenesi: ipotizzato meccanismo auto-immune.
Vaccini anti-cancro
Uso clinico: carcinoma prostata, pancreas, colon, polmone, melanoma, a cellule renali.
Meccanismo d’azione: vengono iniettate nel paziente cellule cancerose, preventivamente irradiate per prevenirne la replicazione nell’ospite, o antigeni tumorali purificati, con l’obiettivo di indurre e amplificare la risposta immunitaria tumore-specifica. Possono essere utilizzati da soli o in associazione a IL-2, GM-CSF, batteri inattivi, adiuvanti. Il vaccino può essere sia autologo (cellule tumorali del paziente) che allogenico (cellule di un altro paziente con una neoplasia simile). Complessivamente, non ci sono stati finora benefici significativi in termini di sopravvivenza.
Prevalenza di disfunzione tiroidea: 0-25% per tireopatie non altrimenti specificate, 4-11% per ipotiroidismo, 11-24% per ipertiroidismo (anche subclinico transitorio).
Patogenesi: mimetismo molecolare con auto-antigeni tiroidei, induzione di auto-immunità tiroidea.
Che fare. Sono possibili sia forme di ipotiroidismo di marcata entità che forme di tireopatia ad atteggiamento funzionale fluttuante, con rapido passaggio dall'iper all'ipotiroidismo, e l’insorgenza può essere rapida. Sulla base dei dati disponibili, appare utile dosare in tutti i pazienti sottoposti a immuno-terapia oncologica:
- subito prima dell’inizio della terapia: anticorpi anti-TPO e anti-Tg, TSH e FT4;
- in corso di terapia: TSH e FT4, ogni 2-3 mesi in caso di positività degli auto-anticorpi o meno frequentemente in caso di assenza, secondo giudizio clinico.
La presenza di tireopatia pre-esistente non costituisce una controindicazione all’immunoterapia oncologica, ma si raccomanda un monitoraggio più stretto della funzione tiroidea.
In caso di insorgenza de novo di tireopatia, la sospensione dell’immuno-terapia non è generalmente richiesta, data l’efficacia della terapia tiroxinica per l’ipotiroidismo e di tionamidi e ß-bloccanti per l’ipertiroidismo. Sia l’ipotiroidismo che l’ipertiroidismo conclamati vanno trattati secondo le linee guida correnti. L’uso di corticosteroidi è raccomandato solo in caso di concomitante ipofisite o di orbitopatia di Graves, qualora questa sia di grado moderato-severo e non migliori dopo la sospensione dell’immuno-terapia.
Non ci sono evidenze forti per raccomandare o controindicare la terapia delle disfunzioni tiroidee subcliniche nei pazienti oncologici, per cui si rimanda al giudizio clinico; sembra tuttavia ragionevole proporre un iniziale periodo di osservazione, anche alla luce delle possibili interferenze transitorie sulla funzione tiroidea sia della malattia neoplastica che delle terapie oncologiche.
È possibile che gli eventi avversi endocrini siano ancora non correttamente stimati per la presenza di diversi fattori confondenti presenti nei pazienti oncologici: sick euthyroid syndrome, terapia con steroidi e/o altri farmaci con effetto sulla funzione tiroidea (ad esempio inibitori di tirosin-chinasi), radioterapia, esecuzione di TC con mdc iodati, sottovalutazione in favore di sintomi e segni legati alla malattia neoplastica, soprattutto se avanzata.
INIBITORI DELLE TIROSIN-CHINASI (TKI)
In oncologia è nettamente aumentato l’utilizzo di TKI, in mono-terapia o in associazione a chemio- o radioterapia. Esiste quindi una nutrita serie di dati sugli effetti di questi farmaci sul sistema endocrino e sulla funzione tiroidea in particolare (11-15).
La classe di questi farmaci è in continuo ampliamento. Due sono le molecole più consolidate nell’uso e sulle quali è presente quindi il maggiore numero di dati:
- sunitinib (Sutent®) per GIST, carcinoma renale, NET pancreatico;
- sorafenib (Nexavar®) per carcinoma differenziato della tiroide (DTC), carcinoma midollare della tiroide (MTC) e carcinoma renale.
L’ipotiroidismo è l’evento più frequente, a nuova genesi o come peggioramento del profilo ormonale in corso di ipotiroidismo già conosciuto. Le percentuali di incidenza di ipotiroidismo clinico o subclinico, variano in modo ampio nelle statistiche: 7-85% per sunitinib, 6-42% per sorafenib.
È stata riportata una fase transitoria di ipertiroidismo.
I limitati studi su vandetanib (Caprelsa, MTC), motesanib (MTC e DTC) e cabozantinib (Cabometyx, Cometriq, MTC) hanno mostrato dati sovrapponibili, con ampli range statistici. Pazopanib (Votrient, carcinoma renale), se utilizzato in pazienti con DTC sdifferenziato (n = 37), ha aumentato il TSH nel 62% dei casi. Per imatinib (Glivec) il riscontro di aumento del TSH nel 60% dei pazienti già in terapia tiroxinica sostitutiva dopo tiroidectomia, con necessità di adeguamento della terapia e l’assenza di effetti nei soggetti non tiroidectomizzati, inducono a ipotizzare un effetto extra-tiroideo della molecola. Vengono segnalati iper e ipotiroidismo nel 22% dei casi con nilotinib (Tasigna) e nel 50% con dasatinib (Sprycel), utilizzati per la leucemia mieloide cronica. L’uso di axitinib (Inlyta) nei pazienti affetti da carcinoma renale determina ipotiroidismo nel 20% dei trattati.
I meccanismi di interferenza con l’asse ipotalamo-ipofisi-tiroide sarebbero questi:
- azione diretta sulla tiroide e sulla biosintesi degli ormoni tiroidei e possibile sviluppo di positività anticorpale: sunitinib, sorafenib e nilotinib; l’inibizione della captazione dello iodio e dell’attività della tireo-perossidasi può contribuire alla riduzione della biosintesi degli ormoni tiroidei;
- interferenza sul trasporto degli ormoni tiroidei, per inibizione da parte dei TKI sui trasportatori MCT8 e MCT10;
- interferenza sul metabolismo degli ormoni tiroidei per induzione della desiodasi di tipo 3 e sul metabolismo del TSH, che risente meno dell’azione del feed-back negativo di T3 e T4 a livello ipofisario.
Che fare: utile valutare la funzione tiroidea, prima della terapia e 4 settimane dopo il termine del trattamento: sulla base dei livelli di TSH e della sua evoluzione, considerare l’eventuale introduzione di L-tiroxina.
BEXAROTENE
La terapia con bexarotene (Targretin®) è utilizzata nel trattamento delle manifestazioni cutanee nei pazienti con linfoma cutaneo a cellule T di grado avanzato. Il farmaco attiva i 3 recettori intra-cellulari X dei retinoidi, i quali regolano l'espressione di geni che controllano la differenziazione e la crescita delle cellule.
La terapia è associata a ipotiroidismo centrale, per ridotta secrezione ipofisaria di TSH (16,17).
Sono stati anche valutati gli effetti periferici dello bexarotene sul metabolismo degli ormoni tiroidei, con uno studio su pazienti privi di tiroide in terapia tiroxinica sostitutiva. Il bexarotene è risultato aumentare la degradazione periferica degli ormoni tiroidei, attraverso una via non desiodasi–mediata e tale effetto si aggiunge a quello a livello ipofisario. L’anomalia riscontrabile nei dati funzionali della tiroide va segnalata al paziente e ai suoi curanti.
Il paziente dovrà quindi essere trattato con una terapia tiroxinica, monitorata sulla base dei livelli di FT4 e indipendentemente dai bassi livelli di TSH, come d’uso nelle forme di ipotiroidismo centrale.
ANTI-PSICOTICI
Le fenotiazine, anti-psicotici tipici, alterano principalmente la captazione dello iodio, ma riducono anche la risposta del TSH al TRH.
Le non fenotiazine, anti-psicotici tipici, possono indurre la formazione di auto-anticorpi della tiroide e aumentare i livelli di TSH.
Gli anti-psicotici atipici, di cui fanno parte clozapina (Leponex®), risperidone (Risperdal®), olanzapina (Zyprexa®), paliperidone (Invega®), quetiapine (Seroquel®) e aripiprazolo (Abilify®), sono usati per il trattamento della schizofrenia e delle forme maniacali severe nei pazienti bipolari. La dopamina agisce sull’asse ipotalamo-ipofisi-tiroide attivando i recettori D2, ma ha un effetto inverso su ipotalamo e cellule tireotrope. La dopamina può inibire la secrezione del TSH. In considerazione del loro profilo dopamino-agonista, gli anti-psicotici atipici possono parzialmente ridurre la risposta del TSH al TRH, in genere senza indurre ipotiroidismo franco. L’ipotiroidismo nella maggioranza dei casi è dovuto a ridotta sintesi e rilascio di ormoni tiroidei.
In considerazione delle spiccate differenze farmacologiche tra le diverse molecole del gruppo e del numero limitato di casi di ipotiroidismo, al momento non si ritiene che l’effetto sulla funzionalità tiroidea possa essere considerato un effetto di classe farmacologica (18-21).
LITIO
Il litio, in forma di carbonato è tuttora ampiamente usato in clinica psichiatrica nella profilassi e nel trattamento della sindrome bipolare, con una posologia di 1000-1500 mg/die in fase di attacco e 300–400 mg/die come dose di mantenimento. L’indice terapeutico è modesto e richiede periodici dosaggi delle concentrazioni terapeutiche, da mantenere nel range 0.4-1 mM/L.
L'utilizzo a lungo termine è stato associato a disfunzione tiroidea: l’incidenza riportata di ipertiroidismo è molto rara, più frequente è il rischio di ipotiroidismo, fino a 8 volte quello della popolazione generale, con riferita frequenza maggiore per sesso femminile ed età > 50 anni. Non sono ancora chiariti il ruolo della familiarità per tireopatie e della presenza di auto-immunità tiroidea precedente al trattamento con litio.
Che fare: prima dell’inizio della terapia è quindi raccomandato un dosaggio di TSH, FT4, FT3, Ab-TPO e Ab-Tg e in corso di trattamento il controllo periodico di FT4 e TSH.
BIOTINA
La biotina è una vitamina idrosolubile appartenente al gruppo B, utilizzata nel trattamento del deficit di biotina, nel trattamento di alcune malattie della pelle o in nutrizione parenterale come supplemento vitaminico. La biotina è contenuta anche in alcuni integratori alimentari.
Il rischio di ottenere risultati falsati delle indagini di laboratorio a causa della biotina è maggiore nei seguenti gruppi:
- pazienti con insufficienza renale, che possono avere concentrazioni di biotina più elevate nel sangue e tempi di eliminazione più lunghi;
- pazienti affetti da sclerosi multipla esposti ad alte dosi di biotina (fino a 300 mg/die) negli studi clinici;
- bambini con malattie metaboliche rare (deficit di biotinidasi, deficit di olocarbossilasi sintetasi, gangli basali sensibili alla biotina-tiamina), poiché dipendono da alte dosi di biotina.
La biotina può interferire con molti esami di laboratorio, tra i quali: troponina, PTH, cortisolo, FSH e LH, vitamina D. In ambito di diagnostica per tireopatie la biotina può determinare risultati per le indagini di funzionalità della tiroide che mimano la malattia di Graves e comportare quindi un trattamento non necessario con farmaci anti-tiroidei (22).
ACIDO TRI–IODO-TIROACETICO (TRIAC)
Analogo della T3, è presente in alcuni integratori alimentari (dimagranti, acceleratori del metabolismo), in preparazioni galeniche e come farmaco (Triacana, Teatrois). Può indurre ipotiroidismo da inibizione del TSH, bassi livelli di fT4 ed elevati livelli di fT3. Il paziente spesso convive con la sintomatologia clinica per mesi prima di giungere al riscontro della causa. Tipico il quadro sierologico, con elevati livelli di fT3 e quindi TSH nettamente soppresso, e fT4 nettamente inferiore per assenza di stimolo del TSH. Esempio: paziente di 48 anni, TRIAC 1.5 mg, 1 cp x 3; FT3 > 40 pg/mL (v.n. 1.5-4.8), FT4 < 3 pg/mL (v.n. 8.9-17.6), TSH 0.009 μU/mL (v.n. 0.4-4.0).
Su Internet è possibile reperire in diversi siti a libero accesso “istruzioni dettagliate" sull’uso del TRIAC, che si riportano a titolo di esempio ovviamente non condividendone il contenuto! “Nello sport il Triacana viene utilizzato per perdere rapidamente il grasso in eccesso, senza ricorrere a diete estreme che finiscono, inevitabilmente, per favorire il catabolismo muscolare. Per questo motivo, il Triacana è un farmaco particolarmente apprezzato dai body-builder, che lo utilizzano per migliorare la definizione muscolare in vista di una competizione (spesso associandolo a steroidi anabolizzanti non aromatizzabili). Se da un lato il Triacana ha un'azione inferiore rispetto a Cytomel (T3) e Synthroid (tiroxina), dall'altro è considerato più sicuro. Il ciclo inizia normalmente con due pastiglie di Triacana da 0.35 mg da assumere a distanza di 12 ore. Giorno dopo giorno la dose verrà incrementata di due compresse fino ad arrivare alle 10-14 pastiglie al giorno. L'assunzione va distribuita nel corso della giornata in modo da mantenere stabili i livelli plasmatici di tiratricol (questo metabolita ha un'emivita di circa 6 ore). La durata d'assunzione non deve superare i tre mesi ed in ogni caso è importante non sospenderla bruscamente. Similmente alla fase iniziale, la dose andrà infatti diminuita di due pastiglie al giorno fino a sospendere completamente l'assunzione. Tale coda ha lo scopo di riattivare la naturale funzionalità tiroidea, depressa dall'utilizzo cronico di Triacana”.
LEVOTIROXINA + ESCINA EMULSIONE
Il prodotto è in commercio in Italia come crema (Somatoline®) di libera vendita. L’indicazione è quella della pannicolopatia edemato-fibro-sclerotica (conosciuta come “cellulite”). 100 g di emulsione contengono 100 mg di levotiroxina e 300 mg di escina. Nella scheda tecnica, tra le controindicazioni per la tiroide, riportata solo l’intolleranza allo iodio e inoltre si afferma che "nei limiti della posologia indicata, Somatoline non determina effetti collaterali sistemici e non interferisce con i principali parametri di funzionalità tiroidea”.
Il tipo di preparazione e l’estensione della patologia nonché l’auto-medicazione può comportare l’utilizzo su superfici estese e per lungo periodo. Se sono rare le segnalazioni di esordio di patologia Basedowiana, verosimilmente per la slatentizzazione di una predisposizione pre-esistente, molto più frequente (e stagionale) il riscontro di casi di tireotossicosi sierologiche. Tipicamente si riscontrano valori di TSH anche nettamente soppresso, valori inferiori al limite di FT4 ed elevati valori di FT3. I quadri sono abitualmente asintomatici o pauci-sintomatici, e regrediscono con la sospensione del prodotto senza necessità di terapia tireostatica.
FUCUS VESCICOLOSUS (ALGA BRUNA, KELP)
È un'alga appartenente alla famiglia delle fucacee, con habitat naturale sulla costa atlantica del mare del nord Europa. I principali componenti attivi sono: polisaccaridi (acido alginico, fucoidano, laminaria), iodio (0.05-0.2%), vitamine e minerali (soprattutto vitamina C). Si utilizza prevalentemente l'estratto secco titolato, da 500 a 900 mg/die, e l’estratto fluido, in gocce, assunto alla dose di 25-40 gocce x due volte/die. Sono anche numerosi gli integratori dietetici per la linea e per la cellulite che contengono il fucus. Per tale motivo, per una titolazione in principi attivi non necessariamente rigorosa, e spesso per l’assenza di una specifica anamnesi di patologie tiroidee, la sua assunzione può slatentizzare condizioni di ipertiroidismo subclinico o complicare la gestione di una terapia tiroxinica (potenziamento dell'azione).
IODOPOVIDONE
Lo iodopovidone (PVP-I) è un complesso ottenuto dalla combinazione del polimero polivinil-pirrolidone (PVP) con lo iodio sotto forma di ioni triioduro. L'uso più comune di questo principio attivo, in varie forme e associazioni, è quello di disinfettante della cute o delle ferite, per trattamenti anti-settici e per l'igiene orale. Essendo solubile sia in acqua sia in alcol o altri solventi, di solito è presentato come soluzione idro-alcolica (es. per uso esterno al 10%). Il nome del preparato più diffuso in Italia a base di iodopovidone è Betadine, ma è presente anche con altri nomi commerciali e in forma di farmaco generico. Sono stati riportati casi di ipertiroidismo in pazienti in corso di dialisi peritoneale. I tappi di disconnessione dei cateteri dialitici sono pre-trattati con iodopovidone. I casi sono prevalentemente correlati a pazienti in età infantile o comunque con bassi volumi di soluzioni dialitiche e quindi con maggiore concentrazione di iodio nel dialisato. Le segnalazioni hanno determinato un alert dell’Agenzia per il controllo dei farmaci della Gran Bretagna, in accordo con il produttore del dispositivo (23).
RITONAVIR
Questa molecola viene impiegata nei regimi anti-virali per il trattamento dell’HIV e dell’epatite cronica da HCV.
Il ritonavir induce la glucuronidazione della L-T4, con il risultato di una potenziale riduzione dell’esposizione sistemica. Tale effetto, che presenta una variabilità individuale molto ampia, può modificare gli effetti terapeutici della L-T4.
Che fare: nei pazienti trattati con L-T4 viene suggerito il monitoraggio del TSH almeno durante il primo mese dall’inizio e/o dalla fine del trattamento con ritonavir (24,25).
ALEMTUZUMAB
Uso clinico: alemtuzumab (Lemtrada) è un anticorpo monoclonale anti-CD52 utilizzato nei pazienti adulti con sclerosi multipla (SM) recidivante-remittente attiva (26-28) Tale terapia aumenta il rischio di insorgenza di patologie autoimmuni, tra cui anche quelle di pertinenza tiroidea.
Disfunzione tiroidea: una descrizione dettagliata della tipologia di disfunzione tiroidea correlata ad alemtuzumab è stata effettuata nello studio CAMMS223, nel quale 334 pazienti con SM sono stati randomizzati in un rapporto 1:1:1 a interferone ß-1a (44 µg sc x 3/settimana) o ad alemtuzumab a due diversi dosaggi (12 o 24 mg/d in 3-5 giorni consecutivi, una volta all’anno). Gli autori riferiscono che alemtuzumab può produrre alterazione della funzione tiroidea con maggior frequenza rispetto all’interferone ß-1a (34% vs 6.5%), con elevata prevalenza di ipertiroidismo da m. di Basedow (22%) e con tireopatie frequentemente recidivanti. Le tireopatie autoimmuni (sia tireotossicosi che ipotiroidismo) sono comparse nei 48 mesi successivi alla prima esposizione al farmaco. La maggior parte degli eventi è stata classificata di grado lieve-moderato. Nella maggioranza dei pazienti che hanno manifestato tireopatie (circa l'80%), gli Ab anti-TPO non erano presenti in condizioni basali. Vari studi, tra i quali uno molto recente (28), hanno dimostrato che le patologie tiroidee hanno un picco di incidenza dai primi mesi fino al 3° anno post-terapia con alemtuzumab (e poi si osserva un calo, sino al 5° anno).
Che fare: è consigliato il dosaggio del TSH prima di intraprendere il trattamento e successivamente ogni 3 mesi fino a 48 mesi dall’ultima somministrazione. Dopo questo periodo, i test devono essere eseguiti in funzione dei risultati clinici.
BIBLIOGRAFIA
- Zaccara G, Perucca E. Interaction between antiepileptic drugs and other drugs. Epileptic Disord 2014, 16: 409-31.
- Del Monte P. Ipopituitarismo e farmaci anti-epilettici. AME Flash 8/2015.
- Del Monte P. Anti-epilettici e tiroide: risultato di una recente meta-analisi. AME News 39/2016.
- Zhang YX, Shen CH, Lai QL, et al. Effects of antiepileptic drug on thyroid hormones in patients with epilepsy: a meta-analysis. Seizure 2016, 35: 72-9.
- Dorizzi R. Effetti dei farmaci sugli esami tiroidei. Endowiki.
- Sarne D. Effects of the environment, chemicals and drugs on thyroid function. Endotext (updated 9/27/2016).
- Hamed SA. The effect of antiepileptic drugs on thyroid hormonal function: causes and implications. Expert Rev Clin Pharmacol 2015, 8: 741-50.
- Di Donna V, Corsello S. Tireopatie da immuno-terapia oncologica. AME Flash 25/2018.
- Zuppi P. HCV, interferone e tiroide. AME Flash maggio 2010.
- Paragliola R, Corsello S. Effetto degli inibitori delle tirosin-chinasi sulla funzione tiroidea. AME News 72/2014.
- Caputo M. Farmaci biologici e danno tiroideo. AME News Farmaci 41/2014.
- Illouz F, Braun D, Briet C, et al. Endocrine side-effects of anti-cancer drugs: thyroid effects of tyrosine kinase inhibitors. Eur J Endocrinol 2014, 171: R91-9.
- Torino F, Corsello SM, Longo R, et al. Hypothyroidism related to tyrosine kinase inhibitors: an emerging toxic effect of targeted therapy. Nat Rev Clin Oncol 2009, 6: 219-28.
- Maynard MA, Marino-Enriquez A, Fletcher JA, et al. Thyroid hormone inactivation in gastrointestinal stromal tumors. N Engl J Med 2014, 370: 1327-34.
- Baxi S, Yang A, et al. Immune-related adverse events for anti-PD-1 and anti-PD-L1 drugs: systematic review and meta-analysis. BMJ 2018, 360: k793.
- Smit JWA, Stokkel MPM, Pereira AM, et al. Bexarotene-induced hypothyroidism: bexarotene stimulates the peripheral metabolism of thyroid hormones. J Clin Endocrinol Metab 2007, 92: 2496-9.
- Haugen BR. Drugs that suppress TSH or cause central hypothyroidism. Best Pract Res Clin Endocrinol Metab 2009, 23: 793-800.
- Church CO, Callen EC. Myxedema coma associated with combination aripiprazole and sertraline therapy. Ann Pharmacother 2009, 43: 2113-6.
- Bou KR, Richa S. Thyroid adverse effects of psychotropic drugs: a review. Clin Neuropharmacol 2011, 34: 248-55.
- Wetzel H, Wiesner J, Hiemke C, Benkert O. Acute antagonism of dopamine D2-like receptors by amisulpride: effects on hormone secretion in healthy volunteers. J Psychiatr Res 1994, 28: 461-73.
- Kelly DL, Conley RR. Thyroid function in treatment-resistant schizophrenia patients treated with quetiapine, risperidone, or fluphenazine. J Clin Psychiatry 2005, 66: 80-4.
- Biotina: come influenza i risultati di laboratorio? Luglio 2019.
- Medicines and Healthcare products Regulatory Agency. MiniCap peritoneal dialysis disconnect cap with povidone-iodine - monitor thyroid function in patients with small fill volumes. 17 December 2014.
- Pirali B. Rischio di interazione tra ritonavir e levotiroxina. AME News Farmaci 22/2018.
- Pirali B. Alemtuzumab e tiroide. AME News Farmaci 43/2017.
- Daniels GH, et al. Alemtuzumab-related thyroid dysfunction in a phase 2 trial of patients with relapsing-remitting multiple sclerosis. J Clin Endocrinol Metab 2014, 99: 80-9.
- Mahzari M, Arnaout A, Freedman MS. Alemtuzumab induced thyroid disease in multiple sclerosis: a review and approach to management. Can J Neurol Sci 2015, 42: 284-91.
- Coles AJ, et al. Alemtuzumab CARE-MS II 5-year follow-up: efficacy and safety findings. Neurology 2017, 89: 1117-26.
Chirurgia strabologica per l'orbitopatia di Graves
Stefano Amodeo
Facoltà di Medicina e Psicologia, UOC di Oftalmologia, Università di Roma Sapienza; Ospedale Sant’Andrea di Roma.
(aggiornato a luglio 2025)
Anatomia dei muscoli extra-oculari
I muscoli extra-oculari, di origine mesodermica, iniziano il loro sviluppo tra la 3° e la 4° settimana di gestazione. L’allineamento del bulbo oculare è determinato dalla componente muscolare estrinseca e dai tessuti molli ad esso circostanti.
La posizione del bulbo oculare all’interno della cavità orbitaria presenta una tipica deviazione, con un angolo di circa 23° tra l’asse anatomico bulbare e l’asse antero-posteriore dell’orbita; tale peculiare posizione permette di spiegare le varie azioni motorie esercitate da ogni singolo muscolo extra-oculare.
Cinque dei sei muscoli extra-oculari originano dall’apice orbitario, il muscolo piccolo obliquo origina dall’osso mascellare subito posteriormente al bordo orbitario.
I muscoli retti (superiore, inferiore, laterale e mediale) si inseriscono sulla sclera tramite strutture tendinee, anteriormente all’equatore del bulbo oculare; i muscoli obliqui, muscoli rotatori dell’occhio, si inseriscono posteriormente all’equatore; il muscolo obliquo inferiore si inserisce nel quadrante infero-laterale del bulbo senza una particolare struttura tendinea.
Fisiologia dei movimenti oculari
La posizione degli occhi è, per ciascuno di essi, regolata dai sei muscoli extra-oculari, i quali opportunamente innervati, permettono di dirigere lo sguardo in tutte le direzioni. Esistono fini meccanismi nervosi che regolano il movimento contemporaneo di tutti questi muscoli:
- la “legge dell’innervazione reciproca” (legge di Sherrington) afferma che durante una visione simultaneamente un muscolo riceve uno stimolo a contrarsi, mentre il suo antagonista riceve uno stimolo di uguale entità ma di tipo inibitorio;
- la “legge della corrispondenza motoria” (legge di Hering) afferma che gli impulsi a contrarsi sono inviati contemporaneamente a quei muscoli che compiono la stessa azione, cioè che fanno compiere movimenti coniugati ai due occhi.
Il mancato allineamento degli assi visivi comporta una condizione chiamata “strabismo”.
Una deviazione di questi assi che intervenga in età infantile ha effetti diversi da una che interviene in età adulta: il sistema visivo di un bambino non è completamente formato, e può mettere in atto meccanismi di compenso, come la “soppressione” dell’immagine e la “corrispondenza retinica anomala”. Nell’adulto non sono possibili riadattamenti neuro-sensoriali di questo tipo, con conseguente deviazione degli assi visivi, che genera diplopia e confusione.
Definizione e classificazione di strabismo e diplopia
La diplopia è la percezione di uno stesso oggetto in due diverse zone del campo visivo; viene distinta in monoculare (percepita con un solo occhio) e binoculare (percepita con l’utilizzo contemporaneo dei due occhi), e può presentarsi in senso orizzontale, verticale ed obliquo.
In condizioni fisiologiche, le immagini provenienti da uno stesso oggetto cadono su punti retinici corrispondenti dei due occhi, in modo tale che le due proiezioni retiniche dell’oggetto siano integrate, a livello della corteccia cerebrale in un’unica immagine con un processo chiamato “fusione”.
Per distinguere tra diplopia monoculare e binoculare è sufficiente occludere alternativamente i due occhi: se la diplopia scompare si è di fronte ad una forma binoculare, mentre se permane è una forma monoculare che interessa l’occhio non occluso.
La diplopia monoculare è spesso dovuta a problematiche riguardanti l’occhio interessato, tra cui anche patologie che interessano i mezzi diottrici (come la cataratta).
La principale causa di diplopia binoculare è lo strabismo, ma il disturbo può anche essere dovuto a traumi, malattie del sistema nervoso centrale (tumori, sclerosi multipla, ipertensione endocranica), malattie neuro-muscolari (come la miastenia gravis) o diabete mellito.
Lo strabismo può essere classificato secondo due criteri generali:
- per “posizione” che gli occhi assumono: orizzontale (convergente o divergente), verticale o ciclo-torsionale;
- per “entità della deviazione” nelle varie posizioni di sguardo: se uguale nelle varie posizioni, si parla di strabismo concomitante; se diversa, si parla di strabismo inconcomitante, ed in questo caso la deviazione è massima nel campo d’azione del muscolo deficitario.
Un'ulteriore distinzione, in rapporto allo stato manifesto della deviazione, permette di identificare uno strabismo manifesto (eterotropia) e uno latente (eteroforia): nelle eteroforie si ottiene il parallelismo degli assi visivi e la fusione delle immagini con un notevole sforzo dei muscoli extra-oculari, con conseguente affaticamento e cefalea; nelle eterotropie, invece, la deviazione degli assi visivi è sempre evidente.
In caso di strabismo convergente (dove gli assi visivi convergono) si parla di esodeviazione (esoforia se latente, esotropia se manifesto), mentre se è divergente (con assi visivi divergenti) si parla di exodeviazione (exoforia se latente, exotropia se manifesto). Per una deviazione verso l’alto si parla di ipertropia, per una verso il basso di ipotropia.
Esistono forme di pseudo-strabismo, dove particolari conformazioni delle orbite e la fisionomia del volto simulano deviazione dei bulbi oculari non esistenti. Le forme di pseudo-strabismo possono essere facilmente evidenziate rilevando i riflessi corneali centrati rispetto al campo pupillare.
Lo strabismo “concomitante” riconosce diverse cause, come ostacoli di tipo ottico (opacità dei mezzi diottrici o difetti refrattivi particolarmente elevati), ostacoli di tipo sensoriale (malattie della retina o del nervo ottico), problemi relativi all’innervazione dei muscoli extra-oculari (paralisi sopra-nucleari), o problemi relativi al meccanismo di accomodazione/convergenza.
Lo strabismo “inconcomitante” è, fondamentalmente, di tipo paralitico: le cause possono riguardare diverse strutture del sistema nervoso ed essere di varia natura (neoplastica, traumatica, vascolare, infettive, miastenia gravis e altre patologie autoimmuni, e metaboliche), oppure interessare direttamente particolari muscoli (come nel morbo di Graves-Basedow, con infiltrati che interessano il ventre muscolare e ne limitano la funzionalità).
Nelle forme inconcomitanti è presente, spesso, diplopia, alterata localizzazione degli oggetti nello spazio e torcicollo oculare (il soggetto assume particolari posizioni anomale del capo per compensare il deficit muscolare e non avere diplopia), con notevole discomfort per il soggetto.
A seconda della causa e della sua localizzazione, la paresi o la paralisi può colpire uno o più muscoli, con diversi quadri clinici.
In presenza di strabismi a grande angolo, cioè quando il bulbo oculare risulta particolarmente deviato, il paziente può non accusare diplopia, in quanto fisiologicamente viene attuato il fenomeno della soppressione oculare, cioè quel fenomeno di salvaguardia che permette, a livello celebrale, di “spegnere” l’immagine dell’occhio estremamente deviato, consentendo una visione monoculare che elimina il fenomeno della confusione alla base della diplopia.
Il fenomeno della diplopia risulta particolarmente invalidante per il paziente strabico, in quanto si trova sempre a dover cercare di comprendere quale delle due immagini percepite è quella reale e quale è quella gestita dall’occhio deviato.
Diagnosi di strabismo
Va fatta tenendo conto di vari fattori: l’età del paziente, la modalità di insorgenza e i disturbi associati, la presenza di eventuali deficit di refrazione (valutati in cicloplegia), l’acuità visiva, la presenza di eventuali deficit muscolari (singoli o multipli) e la loro entità.
Un test semplice e importante è il cover-test, che permette di capire se si tratta di deviazioni convergenti o divergenti e di distinguere tra forie e tropie; con i prismi (particolari lenti che permettono di deviare la luce verso una particolare direzione) si può eseguire il cover-test prismatico, con cui si può valutare l’entità della deviazione.
Il test della motilità oculare, attraverso la valutazione dell’escursione del bulbo verso le cosiddette “posizioni diagnostiche principali”, permette lo studio dell’attività di ogni singolo muscolo.
Lo schermo di Hess-Lancaster determina l’eventuale presenza di diplopia, l’entità della deviazione e, soprattutto, i muscoli interessati.
Semeiotica dello strabismo distiroideo
La limitazione della motilità oculare è dovuta al coinvolgimento infiammatorio dei muscoli extra-oculari, che aumentano fino ad otto volte rispetto alle dimensioni normali, come si può facilmente valutare sia soggettivamente, che mediante metodiche d’indagine quali ecografia o TC.
Si possono riconoscere tre fasi successive:
- una prima fase definita congestizia, in cui vi è infiltrazione da parte di cellule linfocitarie, proliferazione dei fibroblasti e deposizione di mucopolisaccaridi, con formazione di edema infiammatorio;
- segue una seconda fase, detta degenerativa, durante la quale si verifica la progressiva degenerazione delle fibre muscolari interessate, che perdono elasticità;
- infine, la fase di fibrosi muscolare, che rende il muscolo rigido e inestensibile. In caso di fibrosi marcata, il muscolo si accorcia, trascinando il bulbo oculare nella sua direzione di azione e determinando una deviazione oculare anche in posizione primaria di sguardo.
I muscoli più spesso coinvolti sono i retti mediali e inferiori.
Questa condizione, definita miopatia restrittiva, si manifesta con la paralisi dello sguardo verso l’alto, spesso monolaterale, dovuta alla contrattura fibrosa che impedisce la rotazione dell’occhio nella direzione opposta a quella del muscolo coinvolto, poiché esso non è più in grado di allungarsi (contrattura fibrosa del retto inferiore, che simula una paralisi del retto superiore), e con visione offuscata, diplopia e sensazione di limitazione dei movimenti oculari.
I disturbi oculomotori che si rilevano nell’orbitopatia tiroide-correlata sono comunemente non concomitanti, in quanto l’angolo di strabismo risulta differente nelle varie posizioni di sguardo. La caratteristica di non concomitanza può avere la sua origine o su base paralitica oppure restrittiva: nella forma di tipo paralitico la causa risiede in un'insufficiente contrazione, mentre nelle forme restrittive è presente un ostacolo di natura meccanica, che permette lo scorrimento muscolare all’interno dell’orbita stessa.
Il tessuto muscolare dei muscoli oculomotori affetti da orbitopatia tiroide-correlata è coinvolto quindi da un fenomeno infiammatorio, seguito da fibrosi con conseguente rigidità muscolare, incapacità alla contrazione e ipomobilità del bulbo oculare. In tal caso si assiste a una restrizione della rotazione bulbare in direzione opposta all’azione muscolare del muscolo coinvolto, incapace di contrarsi. Nel caso in cui il muscolo antagonista non presenti alterazioni, a seguito della sua contrazione si determina un enoftalmo, con associato ipertono oculare da compressione esterna.
Nei casi di grave entità, in cui la componente muscolare risulta particolarmente compromessa, il paziente presenta un ampio angolo di deviazione anche in posizione primaria, con diplopia praticamente sempre presente.
Nello strabismo tiroide-correlato è di estrema importanza porre una corretta diagnosi differenziale tra strabismo restrittivo e strabismo paralitico, anche in funzione di una pianificazione del trattamento chirurgico. Il test delle duzioni forzate permette di rilevare una limitazione passiva dei movimenti del globo oculare. Il test si esegue anestetizzando la superficie oculare e muovendo il bulbo oculare con una pinza dentata per valutarne motilità, resistenza ed eventuali limitazioni. Durante tale test, è estremamente importante agire in direzione opposta a quella in cui si sospetta la limitazione meccanica, non premendo sul bulbo; pressioni eccessive o manovre troppo energiche possono rendere difficoltosa l’interpretazione del test, rendendone vana l’esecuzione.
L’orbitopatia di Graves fa parte delle malattie autoimmunitarie e determina edema peri-orbitario, ispessimento marcato dei muscoli extra-oculari, proptosi, retrazione palpebrale, aumento della pressione endo-oculare fino alla neuropatia ottica.
Le alterazioni della motilità oculare di maggiore riscontro si caratterizzano per una limitazione della motilità in uno o in entrambi gli occhi; la limitazione dell’elevazione è di gran lunga fra i più comuni deficit della motilità, seguita dalla limitazione dello sguardo orizzontale. Il muscolo retto laterale è solitamente il meno compromesso.
Una delle principali manifestazioni della patologia tiroide-correlata, è la retrazione della palpebra superiore, di solito causata da iperstimolazione simpatica. Contrariamente alla convinzione comunemente diffusa, la retrazione palpebrale, e non la proptosi, è il segno patognomonico più frequente dell’orbitopatia di Graves. La retrazione palpebrale si presenta con il segno di Dalrympe, una retrazione della palpebra superiore e/o inferiore, con edema e ispessimento delle stesse ed è responsabile di problemi funzionali ed estetici a seconda del suo grado di gravità.
I meccanismi responsabili di tale manifestazione clinica non sono ancora del tutto chiari, ma si suppone che siano rappresentati sia dall’incremento dei livelli circolanti di ormone tiroideo e dall'aumentata stimolazione simpatica del muscolo di Muller, sia dalla fibrosi causata dall’infiltrazione muscolare da parte di linfociti e fibroblasti con conseguenti esiti cicatriziali.
Per la valutazione della retrazione palpebrale si tiene conto della posizione delle palpebre in posizione primaria di sguardo. La posizione di entrambe le palpebre viene misurata in riferimento al limbus sclero-corneale, che in condizioni fisiologiche è coperto dalla palpebra superiore e lambito solo marginalmente da quella inferiore.
La retrazione palpebrale va sempre distinta dalla pseudo-retrazione dovuta alla proptosi bulbare, all’uso di farmaci simpatico-mimetici, alle alterazioni del mesencefalo, come nel caso della sindrome di Parinaud (nota anche come sindrome del mesencefalo dorsale, una malattia neurologica causata da una lesione a carico del tetto del mesencefalo), e ad altre patologie meno frequenti.
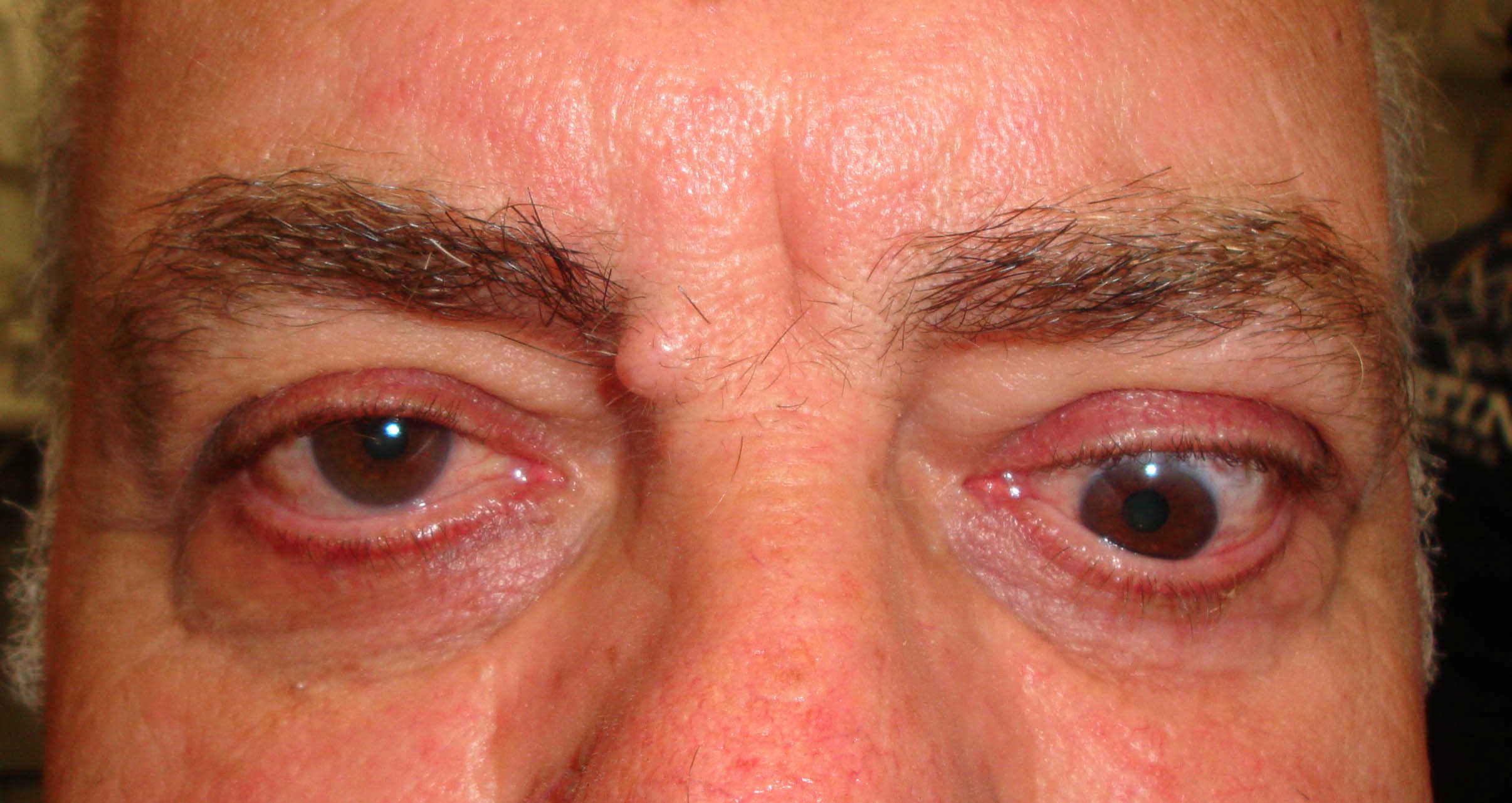
Figura 1
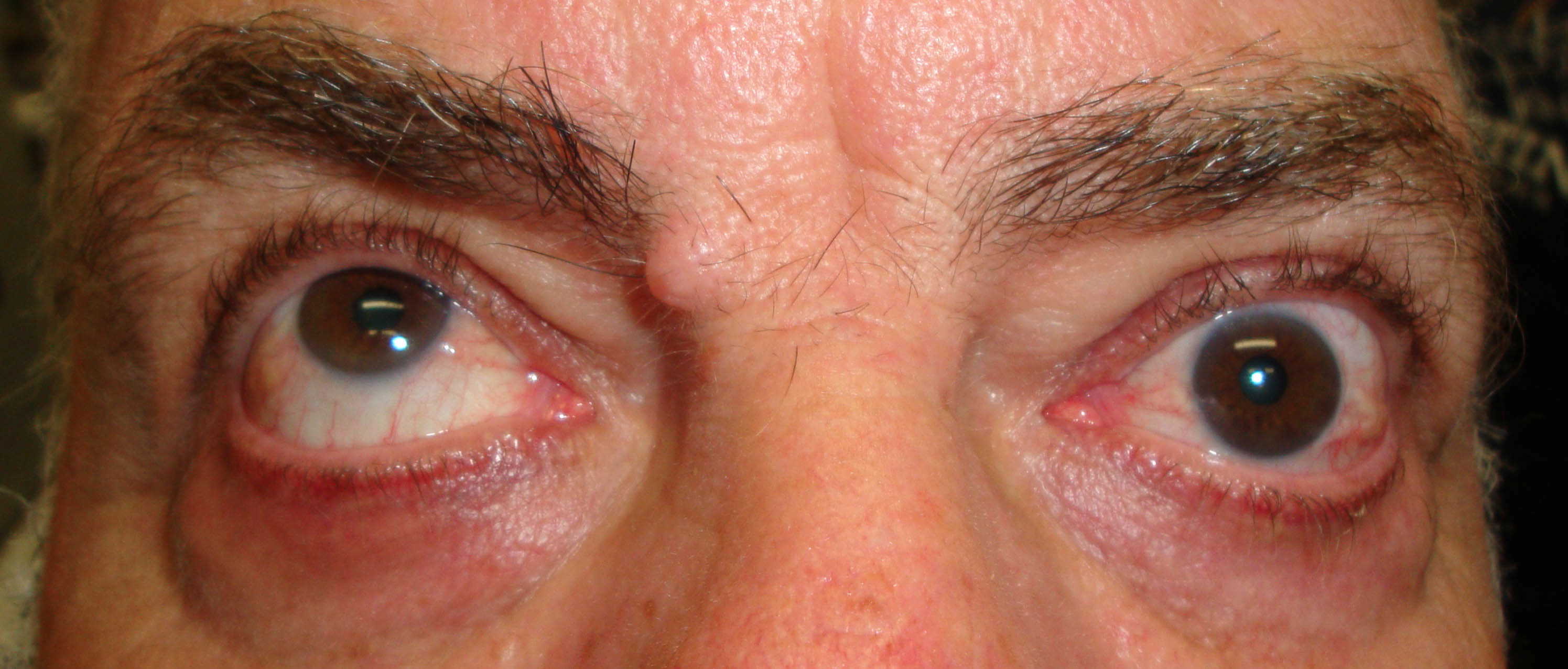
Figura 2
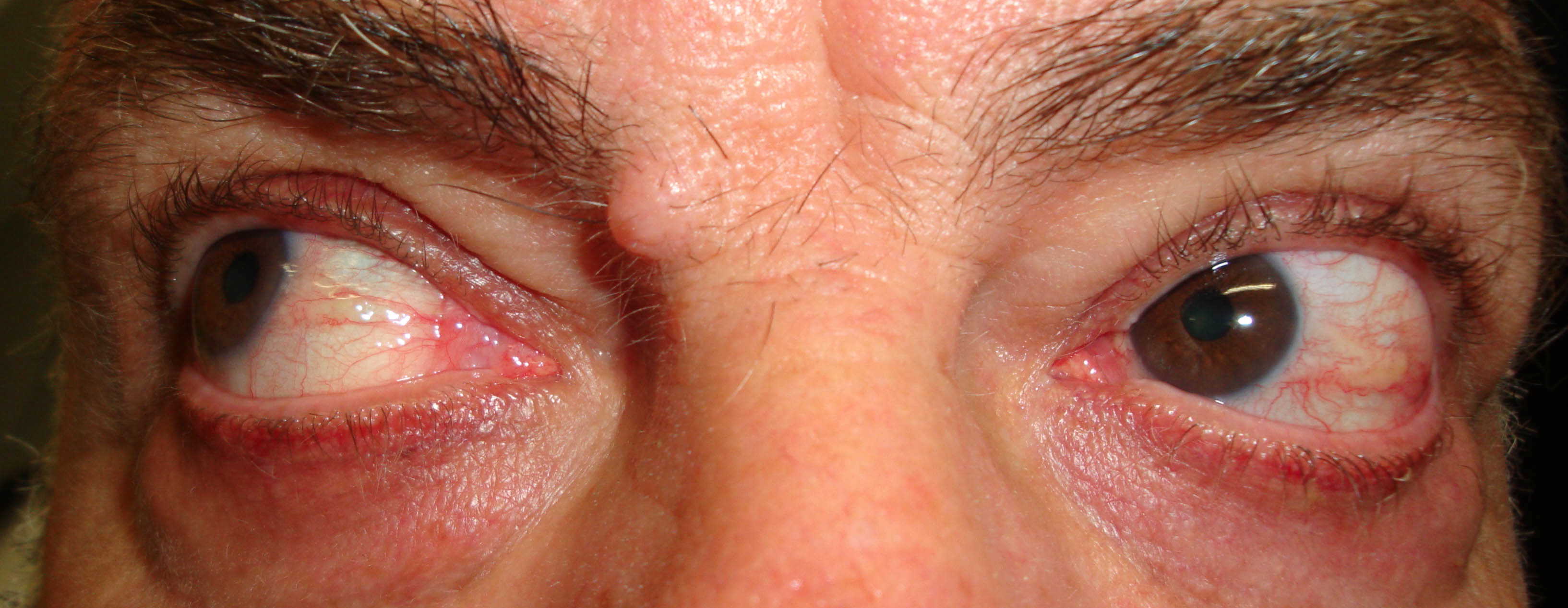
Figura 3
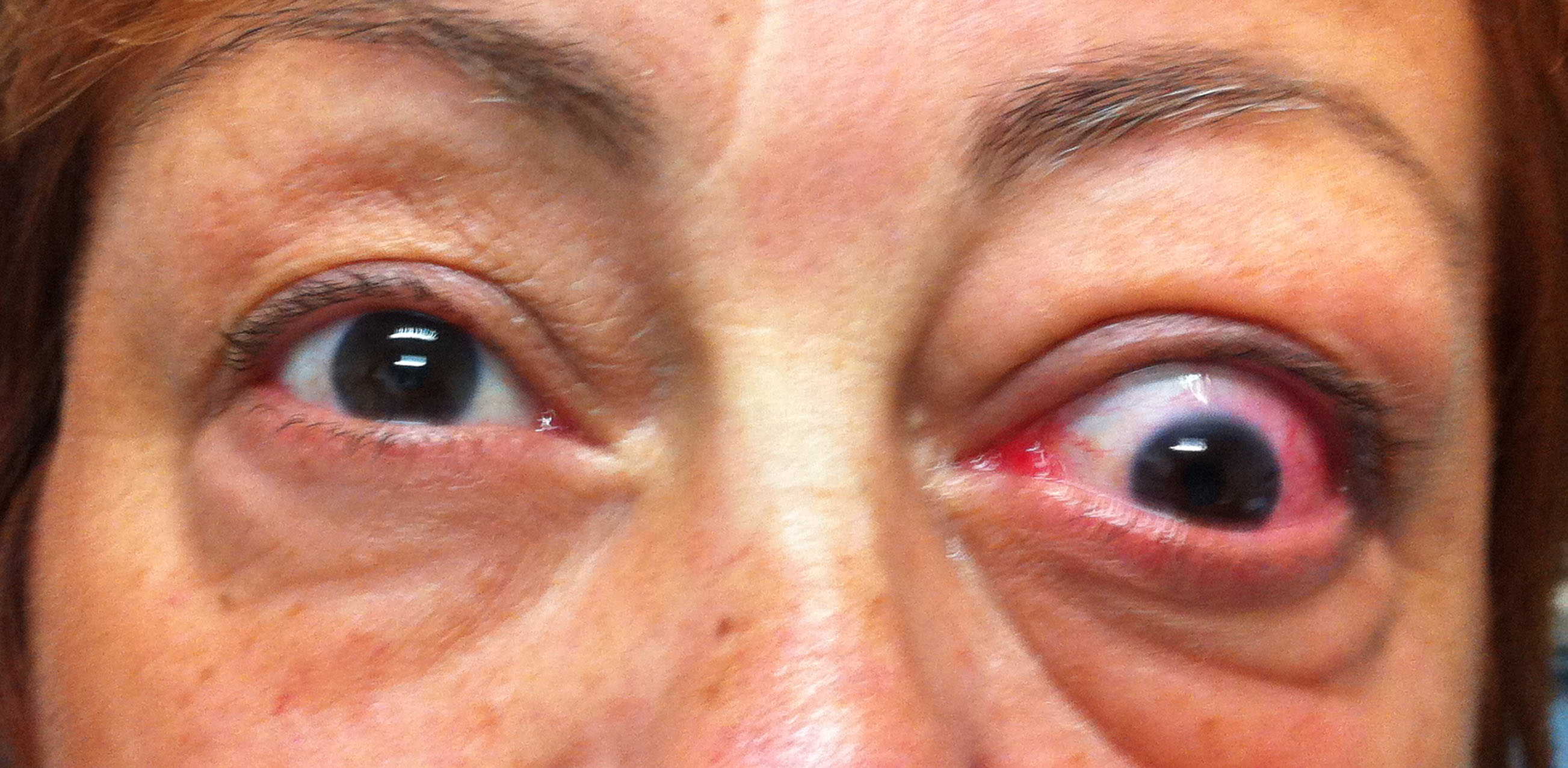
Figura 4
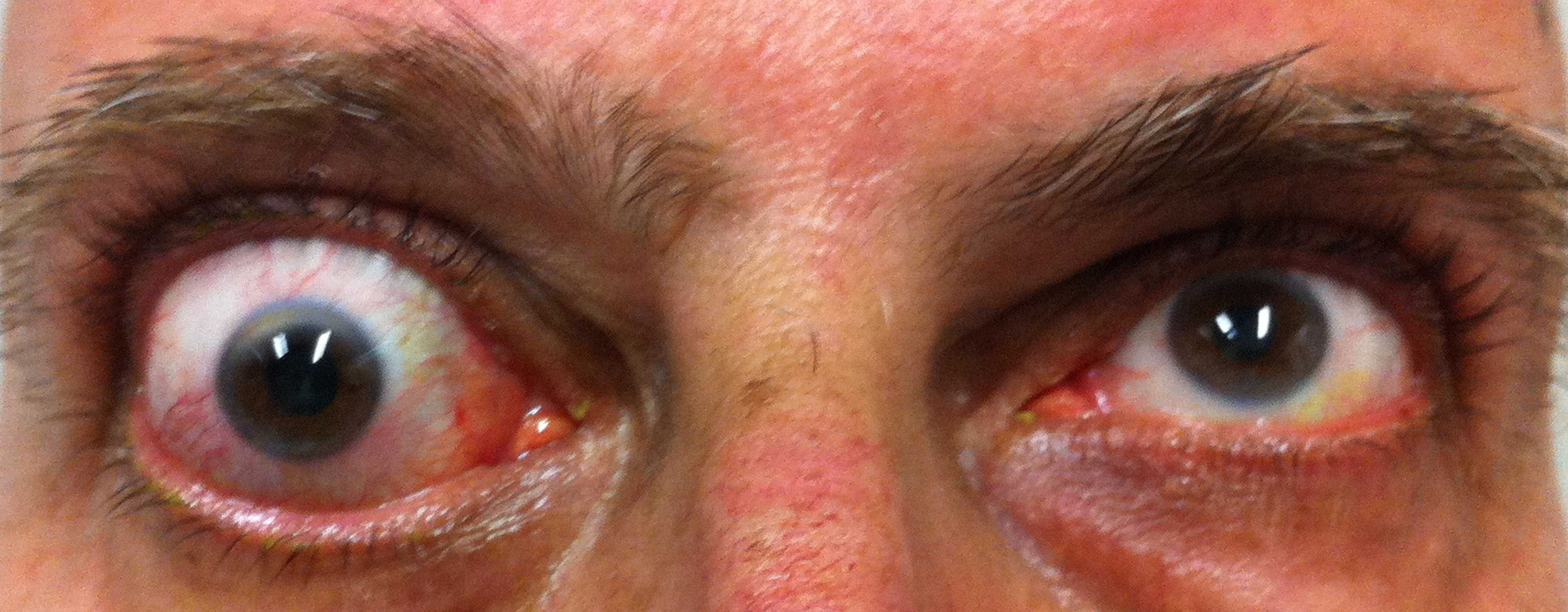
Figura 5
Figure 1-5. Esame della motilità oculare in pazienti affetti da orbitopatia di Graves: evidente l'alterazione della motilità verticale con deficit di elevazione.
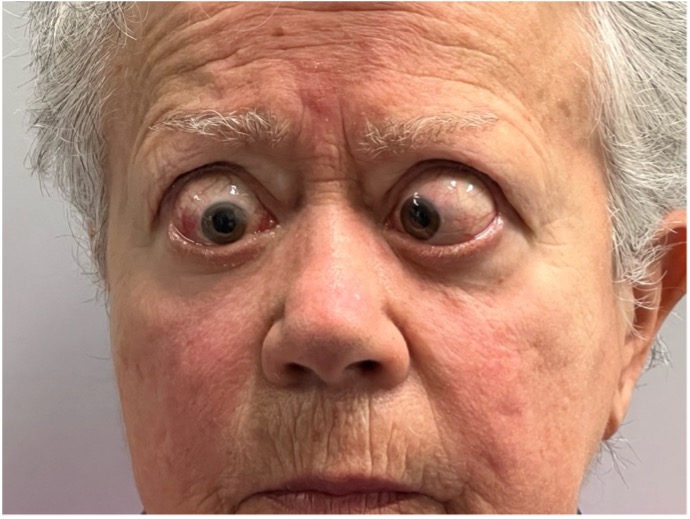
Figura 6
Paziente affetta da importante esoftalmo bilaterale associato a retrazione della palpebra superiore con strabismo convergente
L’ortottica è la scienza che, con le sue regole e con esami specifici, quale lo schermo di Hess, permette di valutare il paziente strabico, rilevando quale è il miglior trattamento medico o chirurgico da mettere in atto. Dopo attenta valutazione ortottica, preceduta talvolta anche da uno studio neuroradiologico dell’orbita, è possibile identificare qual è il muscolo che maggiormente determina la diplopia.
In presenza di piccole compromissioni della muscolatura, il paziente mette in atto alcune posture definite PAC, o anomala posizione del capo, che gli consentono di ridurre o addirittura annullare la visione doppia. Ad esempio, nel caso in cui un bulbo oculare presenta un coinvolgimento del muscolo retto inferiore, con conseguenza impossibilità a elevare l’occhio, il paziente tenderà a elevare il mento e il capo per permettere anche all’altro occhio di posizionarsi verso il basso, annullando in questo modo la diplopia.
Scopo dell’ortottica è cercare di identificare il muscolo compromesso e riuscire a generare un visione singola attraverso lenti particolari definite “prismi”. I prismi sono lenti molto particolari, in grado di spostare l’immagine vista dal paziente a livello del piano retinico. Questo consente di ridurre o addirittura annullare la diplopia nei casi in cui le due immagini percepite dal paziente risultino non particolarmente distanti tra loro. Questo non significa che è sempre possibile utilizzare lenti prismatiche per ridurre la diplopia, in quanto queste particolari lenti non sono sempre tollerate dal paziente.
In presenza di contemporanei strabismi sia verticali che orizzontali, la possibilità di correggere contemporaneamente la visione doppia risulta molto difficile, in quanto i prismi agiscono solamente su un asse di deviazione. Nei casi in cui non è possibile l’utilizzo delle lenti prismatiche l’unica modalità per ridurre la diplopia in questi pazienti risulta l’intervento chirurgico. Scopo dell’intervento è permettere la riunificazione delle immagini dei due occhi, cercando di eliminare la confusione generata dalla diplopia. Dal punto di vista chirurgico, è possibile agire soltanto su due o al massimo tre dei sei muscoli extra-oculari, in quanto attraverso le inserzioni tendinee dei muscoli extra-oculari penetrano all’interno dell’occhio le arterie ciliari, che servono a gestire la vascolarizzazione di tutta la porzione anteriore dell’occhio. Quando si eseguono interventi a livello della muscolatura estrinseca, si interagisce con le inserzioni tendinee dei muscoli, recidendo quindi la componente vascolare. Si comprende quindi che non è possibile agire su molti muscoli, in quanto, a seguito della resezione della componente vascolare associata alle inserzioni tendinee dei muscoli, si possono determinare fenomeni ischemici a livello dell’occhio.
La valutazione ortottica pre-operatoria deve cercare di identificare quale o quali sono i muscoli extra-oculari maggiormente responsabili della diplopia. Solitamente si viene a determinare un fenomeno di tipo restrittivo, quindi il muscolo che non si rilassa non consente la rotazione del bulbo oculare. La valutazione dell’angolo di diplopia, espressa in diottrie prismatiche, consente di concretizzare un piano operatorio, che prevede il distacco del muscolo dalla sua fisiologica inserzione e la sua riapposizione più posteriormente, nel caso il muscolo determini una sindrome restrittiva, o più anteriormente, nel caso in cui sia presente una ipofunzione muscolare.
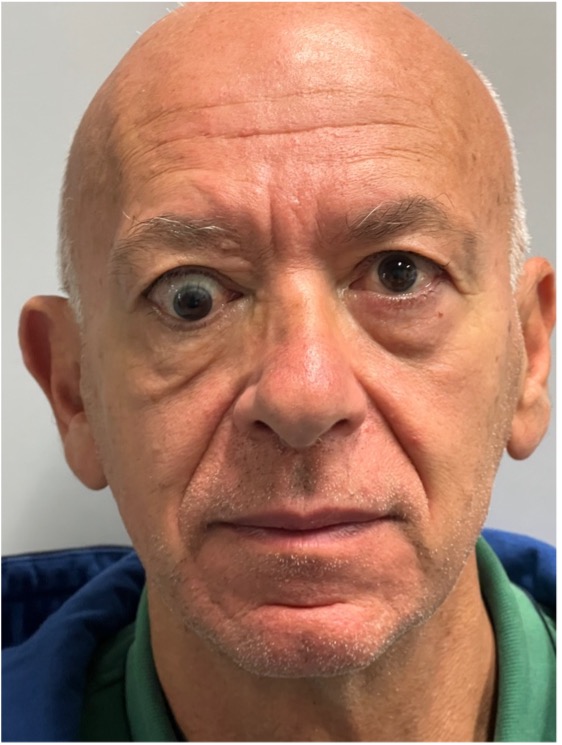
Figura 7
Strabismo verticale insorto dopo chirurgia decompressiva dell’orbita

Figura 8
Strabismo orizzontale insorto dopo chirurgia decompressiva dell’orbita
Trattamento chirurgico dello strabismo
L’intervento chirurgico di strabismo può essere eseguito sia in anestesia locale che in anestesia generale. L’anestesia locale consente la valutazione intra-operatoria degli assi visivi, mentre nel caso di anestesia generale questa valutazione non è eseguibile, non avendo il paziente la fissazione del controlaterale. Non tutti gli interventi chirurgici possono essere eseguiti in anestesia locale, in quanto in presenza di grosse alterazioni della motilità, il bulbo oculare, durante l’intervento chirurgico, viene stirato in vario modo e si potrebbe generare dolore particolarmente forte.
Nel caso in cui venga scelto di eseguire l’intervento chirurgico in anestesia generale, è possibile eseguire il test della duzione forzata, che, mentre il paziente è privo di coscienza, permette di valutare se sono presenti restrizioni ai movimenti oculari determinati da una compressione del bulbo oculare dall’esterno. Questo test permette quindi di differenziare se lo strabismo è determinato da ipofunzione muscolare o da affollamento dell’orbita che causa incapacità rotatorio del bulbo oculare.
Gli obiettivi della chirurgia sono:
- normalizzare lo sguardo in posizione primaria, sia nella fissazione per vicino che per lontano;
- consentire la fusione massima, sia per vicino che per lontano.
Lo scopo del trattamento chirurgico nello strabismo paralitico è essenzialmente funzionale, mirato a ripristinare la visione binoculare, almeno in alcune posizioni di sguardo. Non è possibile in alcun modo riuscire a ristabilire completamente la visione binoculare “in tutte le posizioni di sguardo” e cioè in tutte le posizioni di lateralità o di elevazione che è possibile generare grazie all’uso di tutti e sei i muscoli extra-oculari nella normale fisiologia della visione binoculare.
I principi chirurgici sono:
- rinforzare il muscolo deficitario;
- indebolire l’antagonista omolaterale iperfunzionante;
- rinforzare l’agonista controlaterale;
- eventuali interventi di supplenza del muscolo deficitario da parte degli altri muscoli extra-oculari non coinvolti.
L’entità della correzione chirurgica dei muscoli extra-oculari risulta non del tutto prevedibile in termini di rapporto tra millimetri di recessione o resezione e diottrie prismatiche di strabismo corrette o da correggere.
I risultati chirurgici dipendono da numerosi fattori:
- tipo di tecnica chirurgica;
- tipo di esposizione del muscolo;
- accuratezza dell’isolamento del ventre muscolare con liberazione di eventuali briglie aderenziali o tendini di arresto;
- corretto posizionamento dei punti di sutura, sia a livello del tendine muscolare che apposizione più o meno serrata a livello sclerale.
Fattore di estremo rilievo nella diplopia basedowiana è l'alterata costituzione anatomica muscolare, con fenomeni fibrotici indotti che compromettono definitivamente la contrazione dei vari metameri. È ormai noto che interventi chirurgici di indebolimento (recessione muscolare) risultano più efficaci degli interventi di rafforzamento muscolare; si afferma quindi che sono necessari quantità più grandi di resezione per produrre un effetto pari a quello che si ottiene con la recessione dell’antagonista.
Da quanto esposto si può facilmente dedurre che non è possibile utilizzare un'unica affermazione con la quale si possa ottenere una corretta resezione o recessione in tutti i pazienti. La quantità di correzione deve essere distribuita su tutti i muscoli extra-oculari secondo un determinato programma chirurgico, in modo tale da rendere simmetrica l’azione dei singoli muscoli sinergici e antagonisti, modulando l’ampiezza dell’atto operatorio in modo del tutto soggettivo, in rapporto all’esperienza chirurgica di ciascun operatore.
Gli interventi a livello dei muscoli oculari possono determinare un indebolimento dell’azione del muscolo o eventualmente un suo rafforzamento. Gli interventi di recessione, dove il muscolo viene spostato più posteriormente rispetto alla sua fisiologica inserzione, consentono di ridurre l’azione di un muscolo. Interventi come le retropessie di un muscolo non hanno particolari indicazioni in questo tipo di patologia. Talvolta può essere utile eseguire una miotomia marginale, cioè eseguire delle incisioni a livello del muscolo, diminuendo così la sua forza contrattile e determinandone l’indebolimento per la riduzione del numero degli elementi contrattili, senza modificare il contatto tra il muscolo il globo oculare. Svantaggio di questa tecnica è che le alterazioni determinate da una miotomia a livello del muscolo risultano irreversibili con perdita di forza contrattile, mentre in presenza di una recessione si può sempre riposizionare il muscolo nella sua fisiologica inserzione.
Una tipologia di intervento chirurgico adottato in casi molto limitati è la resezione muscolare aggiustabile, tecnica chirurgica dove è possibile applicare dei fili di sutura con una particolare annodatura sulla superficie esterna del bulbo oculare, che consente eventualmente di allentare o stringere maggiormente le suture per modificare l’azione muscolare nel caso in cui, il giorno dopo l’intervento, si dovesse notare una non adeguata correzione dello strabismo. Tale tecnica chirurgica è stata ultimamente abbandonata e viene riservata solo a casi molto particolari di interventi sul muscolo retto laterale.
In questo tipo di patologia non è possibile eseguire interventi chirurgici quali le supplenze muscolari e le duplicazioni del muscolo, a causa dell’alterazione della componente istologica del muscolo stesso.
Bisogna sempre informare il paziente che gli interventi chirurgici di strabismo hanno il compito di cercare di stabilire il miglior parallelismo nello sguardo in posizione primaria. È necessario far comprendere che talvolta potranno essere necessari anche due interventi, perché, in presenza di quadri particolarmente complessi, la gestione tramite approcci chirurgici successivi permette una miglior calibrazione.
Le sindromi restrittive non sono sempre prevedibili come risultato post-operatorio, in quanto proprio le modifiche strutturali che hanno coinvolto i singoli muscoli non permettono di ipotizzare il risultato chirurgico con assoluta certezza.
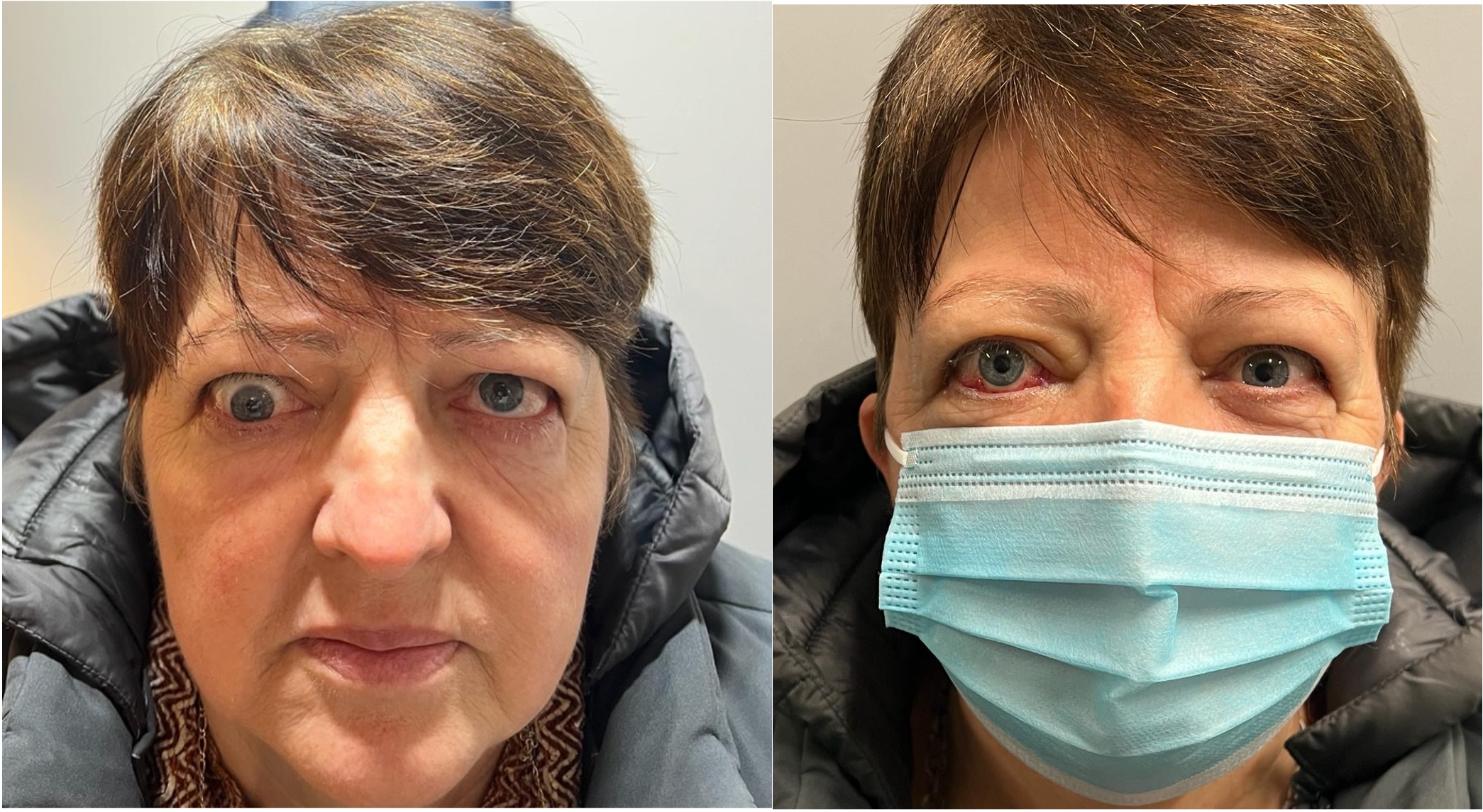
Figura 9
A sinistra strabismo verticale restrittivo con deficit di elevazione dell’occhio destro.
A destra valutazione post-operatoria (eseguita recessione indebolimento del muscolo retto inferiore dell’occhio destro).
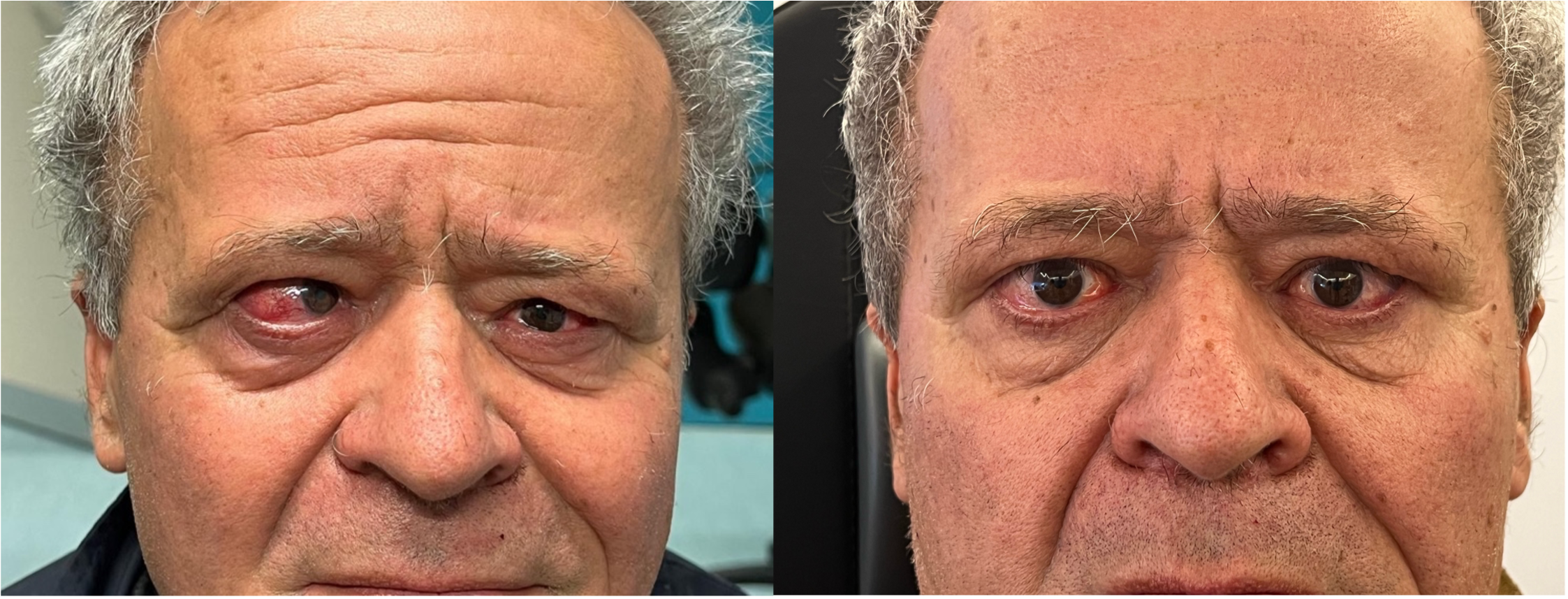
Figura 10
Strabismo orizzontale post decompressione: valutazione pre- e post chirurgia dello strabismo
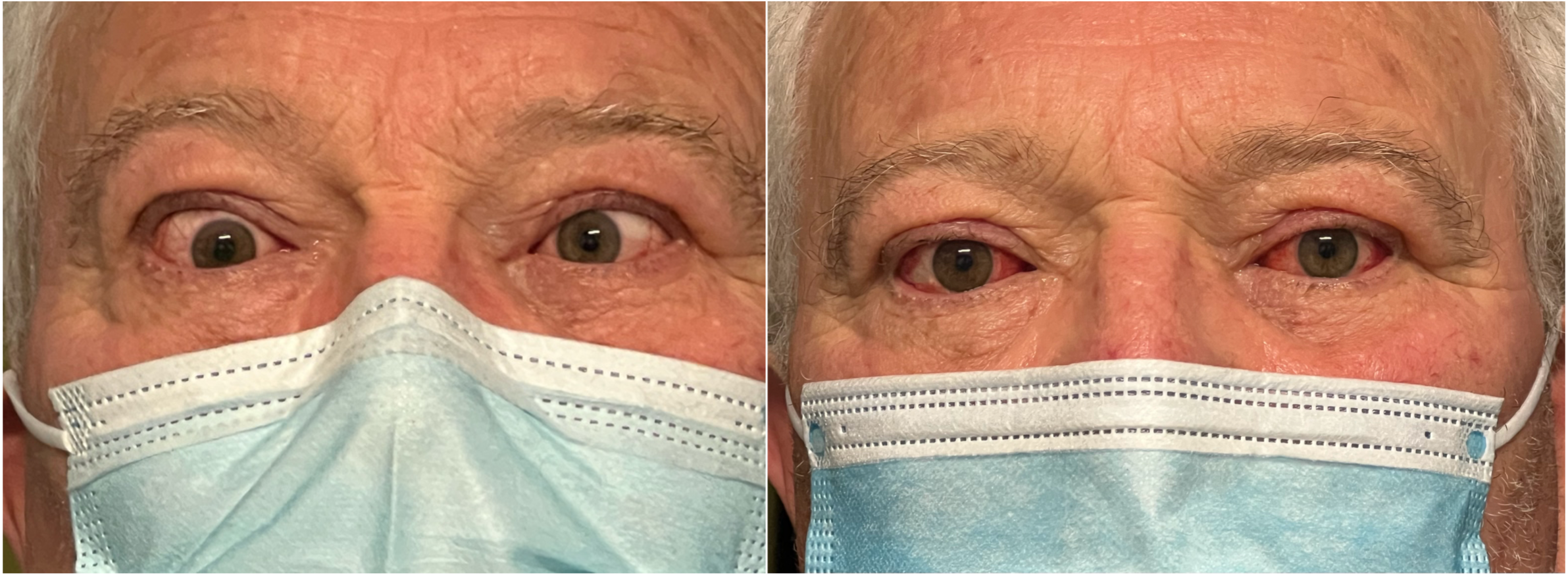
Figura 11.
A sinistra valutazione pre-operatoria dello strabismo post decompressione: strabismo convergente bilaterale.
A destra valutazione post-operatoria dopo intervento di indebolimento (recessione) bilaterale dei muscoli retti mediali.
Bibliografia
- Lyons CJ, Rootman J. Strabismus in Graves' orbitopathy. Pediatr Endocrinol Rev 2010, 7 suppl 2: 227-9.
- Jellema HM, Braaksma-Besselink Y, Limpens J, et al. Proposal of success criteria for strabismus surgery in patients with Graves' orbitopathy based on a systematic literature review. Acta Ophthalmol 2015, 93: 601-9.
- Jellema HM, Eckstein A, Oeverhaus M, et al. Incidence of A pattern strabismus after inferior rectus recession in patients with Graves' orbitopathy: a retrospective multicentre study. Acta Ophthalmol 2023, 101: e106-12.
Tireopatie da inibitori dei check-point immunitari
Andrea Corsello
Unità di Chirurgia Endocrina, Ospedale Isola Tiberina–Gemelli Isola, Roma
Dipartimento di Medicina e Chirurgia Traslazionale, Università Cattolica del Sacro Cuore, Roma
(aggiornato al 30 giugno 2025)
Introduzione ed epidemiologia
Negli ultimi anni gli inibitori dei check-point immunitari (ICI) hanno rivoluzionato il trattamento di diversi tipi di carcinomi, introducendo anche una nuova gamma di effetti collaterali, classificati come eventi avversi immuno-correlati (EAIC), principalmente dovuti all’attivazione generalizzata del sistema immunitario. Tra questi, quelli endocrini sono particolarmente rilevanti, poiché possono causare danni permanenti e influenzare in modo significativo la qualità di vita e la sopravvivenza. Gli EAIC endocrini colpiscono più frequentemente la tiroide (tiroidite), l’ipofisi (ipofisite), le surrenali (adrenalite) e il pancreas (diabete insulino-dipendente).
Le tireopatie sono il più frequente EAIC endocrino correlato a ICI, con incidenza variabile a seconda del regime utilizzato e dell’inclusione o meno dei disturbi subclinici. In generale, il range di incidenza di tireopatie conclamate correlate a ICI è 8.9-22.2%, con frequenza maggiore in corso di terapia combinata ipilimumab-nivolumab (anti-CTLA-4 + anti-PD-1) o mono-terapia con anti-PD-1 rispetto a mono-terapia con anti-PD-L1 o anti-CTLA-4 (figura 1) (1,2).
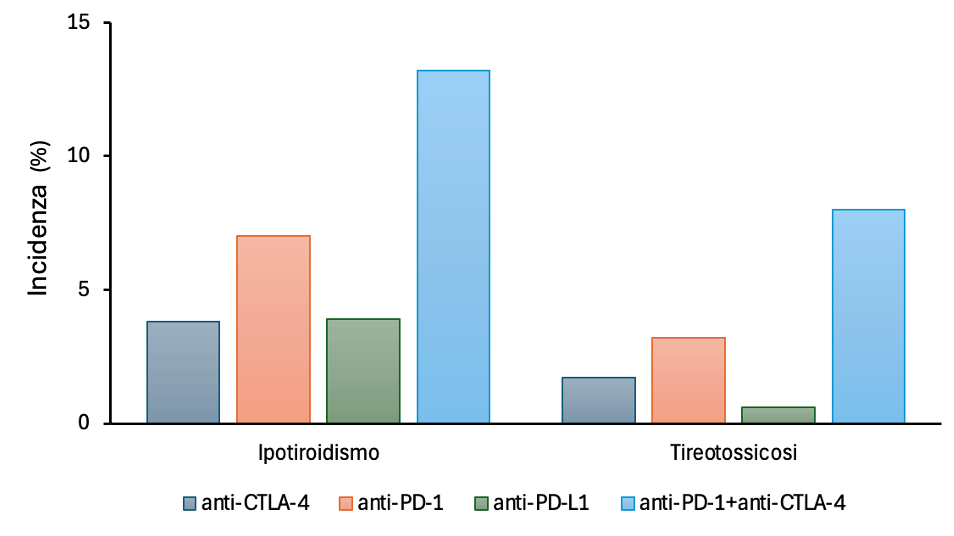
Figura 1. Incidenza delle disfunzioni tiroidee indotte dai diversi regimi di ICI (dati tratti da 2).
Presentazione clinica
La disfunzione tiroidea indotta da ICI sembra il risultato di una tiroidite distruttiva. In accordo con questa ipotesi, è stato osservato un tipico andamento bifasico: una prima fase transitoria di tireotossicosi che compare precocemente (entro 2-6 settimane dall’inizio della terapia), seguita da una fase di ipotiroidismo persistente, che insorge tra la 8° e la 12° settimana.
Sono state riportate anche altre presentazioni cliniche, come l’insorgenza di ipotiroidismo isolato, persistente o transitorio, non preceduto dalla fase di tireotossicosi, oppure la tireotossicosi isolata seguita dal ripristino spontaneo dell’eutiroidismo.
Nonostante gli esami di funzione tiroidea (FT3, FT4, TSH) risultino spesso marcatamente alterati, la maggior parte dei pazienti presenta sintomi lievi. È quindi ipotizzabile che durante questi cambiamenti marcati ma repentini dei livelli di ormoni tiroidei i pazienti possano rimanere clinicamente eutiroidei e i sintomi gravi tenderebbero a manifestarsi solo nei casi di tireotossicosi prolungata o di ipotiroidismo non prontamente riconosciuto e trattato. In particolare, la fase di tireotossicosi può essere talmente precoce e transitoria da non essere diagnosticata e quindi riportata negli studi. Questo spiegherebbe sia la mancata insorgenza di sintomi severi che la maggior frequenza di ipotiroidismo “isolato” riportata dagli studi.
Riuscire a prevedere l’evoluzione verso l’ipotiroidismo è utile, perché permette di prevenire l’insorgenza di sintomi e quindi di evitare dilazioni nella somministrazione degli ICI. Analisi condotte su una coorte di 50 pazienti con tireopatia correlata ad anti-PD-1 hanno dimostrato che una tireotossicosi grave a insorgenza rapida è fortemente associata a maggiore probabilità di evoluzione verso l’ipotiroidismo. Inoltre, la presenza di anticorpi anti-tireoglobulina (TgAb) durante la fase tireotossica rappresenta un ulteriore fattore predittivo per lo sviluppo di ipotiroidismo (3).
Il quadro ecografico tipico della tireotossicosi da ICI consiste nella presenza di aree ipoecogene, disomogeneità parenchimale, vascolarizzazione globalmente ridotta, e progressiva atrofia.
Lo sviluppo di morbo di Basedow-Graves e di orbitopatia tiroidea sono stati descritti solo in rari casi, sia con anti-CTLA-4 che con anti-PD-1. In alcuni di questi pazienti, i TRAb sono risultati negativi e la diagnosi è stata possibile solo attraverso l’attenta valutazione del contesto clinico, ecografico e scintigrafico (4,5).
Fattori di rischio
Diversi studi hanno cercato di identificare possibili fattori di rischio per l’insorgenza di tireopatie durante la terapia con ICI. I principali fattori per cui è stato ipotizzato un ruolo predittivo sono:
- positività degli auto-anticorpi tiroidei (TgAb e TPOAb);
- livelli “elevati” di TSH (> 4.9 mU/L);
- aumentata captazione tiroidea di 18F-FDG alla PET;
- elevato indice di massa corporea (BMI);
- precedente terapia con inibitori della tirosin-chinasi (TKI).
Tra questi, quello maggiormente studiato è lo stato anticorpale in pazienti che hanno ricevuto terapia con anti-PD-(L)1. Diversi autori hanno, infatti, riportato come la positività anticorpale (in particolare TgAb) prima di iniziare la terapia con anti-PD-(L)1 si associ ad maggior rischio di sviluppare tireopatie conclamate (6,7). Anche lo sviluppo di una positività di TgAb durante il trattamento con pembrolizumab (anti-PD-1), in pazienti con negatività anticorpale allo stato basale, sembra correlato a rischio aumentato di tireopatia da ICI (8).
Nel complesso però, non ci sono ancora evidenze definitive che supportino un ruolo causale degli auto-anticorpi nella patogenesi delle tireopatie da ICI e che la positività allo stato basale o lo sviluppo di positività anticorpale durante il trattamento aumentino il rischio di questa complicanza. Infine, poiché è indispensabile il monitoraggio routinario di TSH ed FT4 durante la terapia con ICI, la misurazione ad ogni ciclo degli auto-anticorpi tiroidei probabilmente non faciliterebbe la diagnosi di disfunzioni tiroidee, ma comporterebbe un aumento dei costi.
Associazione con la prognosi
In linea teorica, lo sviluppo di EAIC potrebbe riflettere una risposta immunitaria più significativa ed essere quindi associato a miglioramento della sopravvivenza. Numerosi studi hanno approfondito questo aspetto, indagando l’associazione tra vari EAIC e gli esiti clinici in diversi tipi di tumore, con risultati non sempre concordanti. Anche per quanto riguarda le tireopatie, i dati sul possibile miglioramento della prognosi non sono conclusivi. In particolare, la maggior parte degli studi in pazienti con carcinoma polmonare non a piccole cellule trattati con anti-PD-1 hanno evidenziato una correlazione positiva tra lo sviluppo di tireopatie e miglior sopravvivenza (sia libera da progressione che co9mplessiva), ma questo risultato non è stato confermato in altri studi e non è stato osservato in pazienti con altri tipi di tumore (in particolare il melanoma) (9).
Sulla base dell’osservazione che lo stesso EAIC può essere correlato o meno alla prognosi a seconda della primitività del tumore, è emersa l’ipotesi che antigeni comuni sia al sito primitivo del tumore sia al tessuto danneggiato possano contribuire agli effetti prognostici degli EAIC (9). Uno studio pilota ha identificato auto-anticorpi tiroidei specifici, diversi da TgAb e TPOAb, in pazienti con EAIC tiroidei sottoposti a terapia con anti-PD-1, suggerendo la possibile presenza di antigeni comuni coinvolti nella risposta immunitaria (10).
Gestione clinica (figura 2)
Prima dell’inizio della terapia con ICI è utile eseguire uno screening della funzione tiroidea tramite dosaggio di FT4 e TSH. Questo è utile non solo perché permette la diagnosi e il trattamento di eventuali tireopatie già presenti e non note, ma soprattutto perché la presenza di una disfunzione tiroidea pre-esistente può complicare la diagnosi di EAIC tiroidei, quando ci si basa su una singola misurazione eseguita in corso di trattamento.
Successivamente, come raccomandato dalla maggior parte delle linee guida (ASCO, ESMO, ESE), è utile un monitoraggio di FT4 e TSH ogni 4-6 settimane (11). In particolare, il monitoraggio dopo quattro settimane dall’inizio dalla terapia è utile al fine di poter identificare la fase transitoria di tireotossicosi. È indubbia l’utilità del dosaggio dell’FT4, e non solo del TSH, sia per valutare il grado di tireotossicosi che perché affidarsi esclusivamente al TSH può portare ad errori interpretativi (in particolare in casi in cui sono utilizzati in concomitanza anti-CTLA-4). L’ipotiroidismo centrale dovuto a EAIC ipofisari è infatti relativamente frequente con gli anti-CTLA-4 e può presentarsi con valori bassi di TSH, simulando una tireotossicosi.
Durante la fase di tireotossicosi, il dosaggio degli anticorpi anti-recettore del TSH (TRAb) è utile per la diagnosi differenziale con i rari casi di morbo di Basedow-Graves associati a ICI.
Come precedentemente accennato, il dosaggio dei TgAb e TPOAb ad ogni ciclo di trattamento non è necessario, ma può essere utile al momento della diagnosi di tireopatia da ICI (sia tireotossicosi che ipotiroidismo) per un inquadramento completo del paziente.
Generalmente alla diagnosi di tireopatia da ICI eseguiamo sempre anche l’ecocolordoppler della tiroide, che aiuta nel distinguere la tireotossicosi dal morbo di Basedow-Graves e può fornire informazioni sulla probabilità che l’ipotiroidismo sia persistente (es. tiroide atrofica).
In caso di sospensione degli ICI è raccomandato proseguire il monitoraggio della funzione tiroidea (TSH e FT4), poiché le disfunzioni possono manifestarsi anche a distanza di tempo. Il controllo può essere effettuato con cadenza meno frequente (ad esempio ogni 6–12 mesi o in presenza di sintomi o segni clinici suggestivi) per almeno due anni.
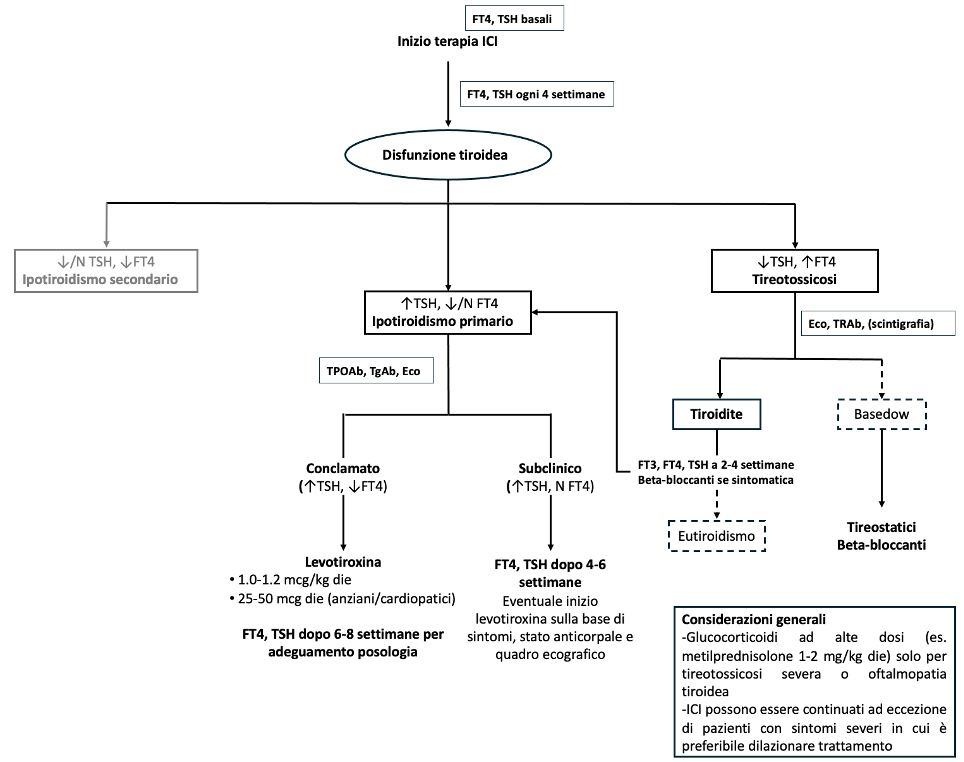
Figura 2. Flow-chart della gestione clinica delle tireopatie da inibitori dei checkpoint immunitari (ICI).
Le linee tratteggiate indicano uno scenario meno frequente rispetto alle linee continue. ↑: aumentato; N: normale; ↓: ridotto
Per quanto riguarda il trattamento, i casi di tireotossicosi sono per la maggior parte pauci-sintomatici e di breve durata ed è quindi sufficiente la semplice osservazione. Nella pratica clinica, monitoriamo FT4 e TSH ogni 2-3 settimane al fine di verificare la risoluzione spontanea e l’eventuale transizione verso l’ipotiroidismo.
Nei pazienti con tireotossicosi sintomatica è raccomandato l’uso dei ß-bloccanti (es. propranololo 40-80 mg/die come dose iniziale). L’utilizzo di glucocorticoidi ad alte dosi è sconsigliato, eccetto nei casi di tireotossicosi grave e sintomatica e nei rari casi di orbitopatia tiroidea. Non esistono infatti evidenze a supporto dell’efficacia terapeutica dei glucocorticoidi nel ridurre il rischio di danno tiroideo e di successivo ipotiroidismo. Tuttavia, nei casi di tireotossicosi severa, possono essere impiegati per ridurre la conversione periferica di T4 in T3. Anche i tireostatici sono impiegati raramente, considerato che la maggior parte dei casi è dovuta a ressi follicolare e non a ipersecrezione ormonale.
Nei pazienti che sviluppano ipotiroidismo conclamato, il trattamento consiste nella somministrazione di levotiroxina (LT4). Spesso, dopo la fase di tireotossicosi, si assiste ad una riduzione netta e repentina dei valori di FT4 (ed FT3) con valori di TSH anche marcatamente elevati (> 50-100 mIU/L). Pertanto, il dosaggio iniziale di LT4 deve essere quasi sostitutivo (circa 1.0-1.2 µg/kg die). In pazienti anziani con comorbilità cardiologiche si preferisce maggior cautela, utilizzando dosaggi iniziali di 25-50 µg/die di LT4. Il monitoraggio degli esami di funzione tiroidea dopo 6-8 settimane permette l’adeguamento della posologia.
Nei pazienti che invece sviluppano ipotiroidismo subclinico o comunque con valori di TSH < 10 mUI/L, si può proseguire con la semplice osservazione e rivalutare la necessità della terapia sostitutiva dopo 4-6 settimane. Analogamente, nei pazienti che sono ben compensati con un basso dosaggio di levotiroxina (< 1.0 µg/kg die) andrebbe considerata la possibile ripresa della funzione tiroidea e tentata la riduzione/sospensione della terapia.
Una considerazione importante riguarda l’eventuale sospensione degli ICI. Non esiste alcuna evidenza che tale sospensione aumenti le probabilità di recupero della funzione endocrina. Salvo in pazienti particolarmente sintomatici, la terapia con ICI può essere continuata senza dilazioni. In particolare, come anticipato precedentemente, spesso si osservano valori di FT4 e TSH marcatamente alterati (sia in casi di tireotossicosi che di ipotiroidismo) ma i pazienti sono pauci-sintomatici ed è sufficiente l’inizio di una terapia con ß-bloccanti o sostitutiva con LT4 senza dover dilazionare il trattamento oncologico (11). In caso di pazienti sintomatici con compromissione del benessere generale, può essere considerato un breve rinvio della somministrazione degli ICI (1-2 settimane), per consentire il recupero clinico ed evitare che eventuali eventi avversi di nuova insorgenza possano aggravare ulteriormente la situazione.
Bibliografia
- Chang LS, Barroso-Sousa R, Tolaney SM, et al. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints. Endocr Rev 2019, 40: 17-65.
- Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: a systematic review and meta-analysis. JAMA Oncology 2018, 4: 173-82.
- Yamauchi I, Hakata T, Sugawa T, et al. Prediction-based prompt levothyroxine replacement to prevent a hypothyroid state after immune-related adverse events involving the thyroid gland. Endocr J 2023, 70: 987-98.
- Brancatella A, Viola N, Brogioni S, et al. Graves’ disease induced by immune checkpoint inhibitors: a case report and review of the literature. Eur Thyroid J 2019, 8: 192-5.
- Sagiv O, Kandl TJ, Thakar SD, et al. Extraocular muscle enlargement and thyroid eye disease-like orbital inflammation associated with immune checkpoint inhibitor therapy in cancer patients. Ophthalmic Plast Reconstr Surg 2019, 35: 50-2.
- Zhou X, Iwama S, Kobayashi T, et al. Risk of thyroid dysfunction in PD-1 blockade is stratified by the pattern of TgAb and TPOAb positivity at baseline. J Clin Endocrinol Metab 2023, 108: e1056-62.
- Kobayashi T, Iwama S, Yamagami A, et al. Elevated TSH level, TgAb, and prior use of ramucirumab or TKIs as risk factors for thyroid dysfunction in PD-L1 blockade. J Clin Endocrinol Metab 2022, 107: e4115-23.
- Osorio JC, Ni A, Chaft JE, et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol 2017, 28: 583-9.
- Yamauchi I, Yabe D. Best practices in the management of thyroid dysfunction induced by immune checkpoint inhibitors. Eur Thyroid J 2025, 14: e240328.
- Yamauchi I, Yasoda A, Hakata T, et al. Novel thyroid-specific autoantibodies in patients with immune-related adverse events involving the thyroid gland. Thyroid Sci 2024, 1: 100009.
- Husebye ES, Castinetti F, Criseno S, et al. Endocrine-related adverse conditions in patients receiving immune checkpoint inhibition: an ESE clinical practice guideline. Eur J Endocrinol 2022, 187: G1-21.

