Anatomia del surrene
Cristian Fiori, Francesco Porpiglia
SCDU Urologia - AOU San Luigi Gonzaga, Orbassano (Torino), Università degli Studi di Torino
Le ghiandole surrenaliche sono organi posti in corrispondenza della parete addominale posteriore superiore, lateralmente alla colonna vertebrale, in contatto con il polo superiore dei reni, subito caudalmente al diaframma.
Forma e posizione
Hanno forma irregolarmente piramidale, a base inferiore; la surrenale di destra ricorda un berretto frigio, quella di sinistra assume forma semilunare. Le misure medie sono 3 x 4 x 1 cm (cranio-caudale, latero-laterale, antero-posteriore) per un peso di circa 10 grammi. Sono situate posteriormente al peritoneo parietale posteriore e sono accolte, unitamente al rispettivo rene, in un'atmosfera adiposa entro la loggia renale e delimitate dalla fascia omonima.
Vascolarizzazione
Ciascuna surrenale è irrorata da tre arterie:
- l'a. surrenalica superiore, ramo dell'a. frenica inferiore;
- l'a. surrenalica media che origina direttamente dall'aorta;
- l'a. surrenalica inferiore, la più voluminosa, che proviene dall'arteria renale omolaterale.
Le vene si distinguono in un gruppo periferico, più esiguo, ed un gruppo centrale. Le prime abbandonano l'organo come vene accessorie che si aprono nelle vene freniche renali e perirenali. Le vene del gruppo centrale confluiscono nella voluminosa vena surrenalica principale. Questo vaso sbocca a destra nella vena cava inferiore e a sinistra nella vena renale [1,2] (fig. 1).
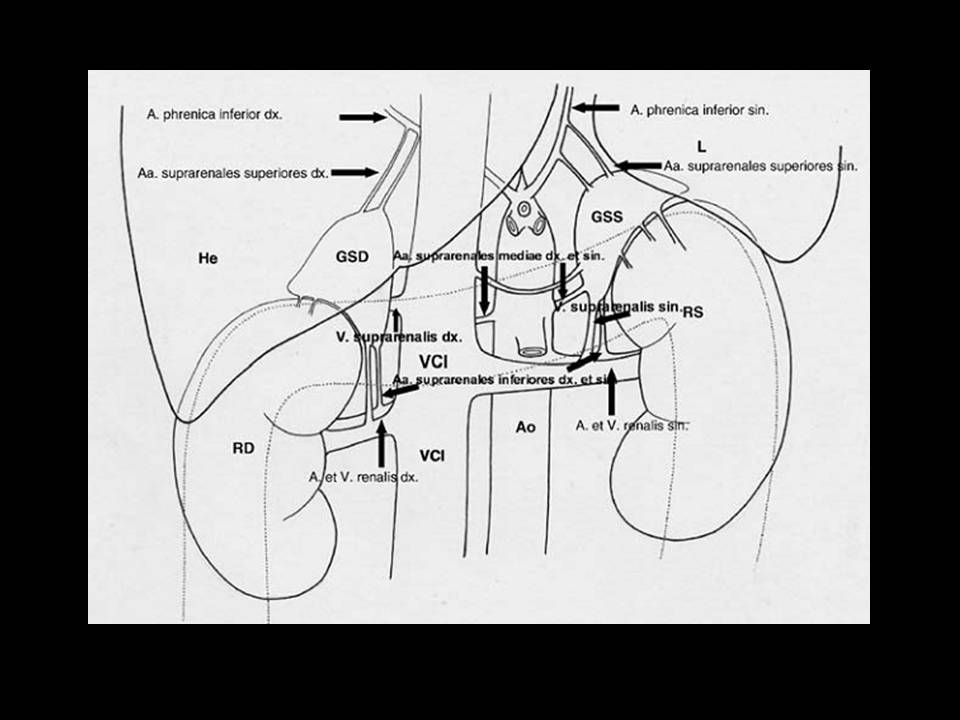
Figura 1. Posizione, rapporti e punti di repere chirurgici delle ghiandole surrenaliche (da Zacharias et al. Eur Urol 2006, 49: 448).
Cenni di anatomia chirurgica
L'anatomia chirurgica della regione surrenalica varia significativamente a seconda del lato e dell'approccio chirurgico considerato (trans-peritoneale o retro-peritoneale).
Approccio trans-peritoneale. A destra, il campo chirurgico è inizialmente occupato dal margine inferiore del fegato: la valutazione delle caratteristiche anatomiche della regione surrenalica generalmente non può prescindere dal sollevamento di questo verso l'alto mediante retrattore. Dopo questa manovra si apprezzano gli elementi anatomici che delimitano la regione surrenalica destra, ovvero la seconda porzione del duodeno e la vena cava inferiore medialmente, il polo inferiore del rene infero-lateralmente e la riflessione del peritoneo parietale posteriore sul fegato in alto. Lo stesso peritoneo parietale posteriore ricopre tutta l'estensione della regione surrenalica e comunemente è possibile identificare, in trasparenza, il surrene già a un'ispezione preliminare (fig. 2). Con l'approccio trans-peritoneale, per accedere alla loggia surrenalica è dunque necessaria l'??incisione del peritoneo posteriore.
A sinistra la regione surrenalica è ricoperta dal colon trasverso, dalla flessura sinistra del colon e dal mesocolon. E' dunque fondamentale mobilizzare queste strutture fino all'identificazione della regione surrenalica, che è delimitata infero-lateralmente dal polo superiore del rene sinistro, medialmente dalla coda del pancreas e superiormente dalla milza.
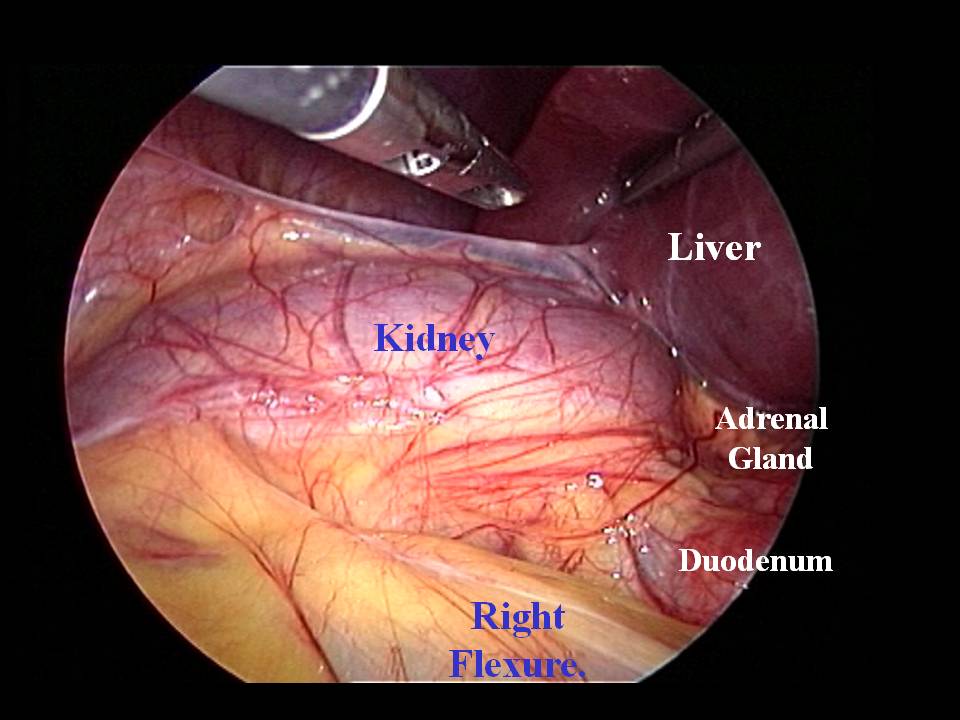
Figura 2. Visione laparoscopica in corso di surrenectomia trans-peritoneale destra. Si notino i rapporti della regione surrenalica con il fegato, il rene e il duodeno. Con questo approccio la ghiandola è raggiunta attraverso un'incisione del peritoneo posteriore.
Approccio retro-peritoneale. Con questo approccio la ghiandola surrenalica è identificabile senza interposizione del peritoneo. I rapporti con gli organi viciniori sono ovviamente i medesimi, ma l'approccio chirurgico è diretto e non richiede nè incisione del peritoneo parietale nè mobilizzazione degli organi addominali, come richiesto dall'approccio trans-peritoneale [3] (fig. 3).
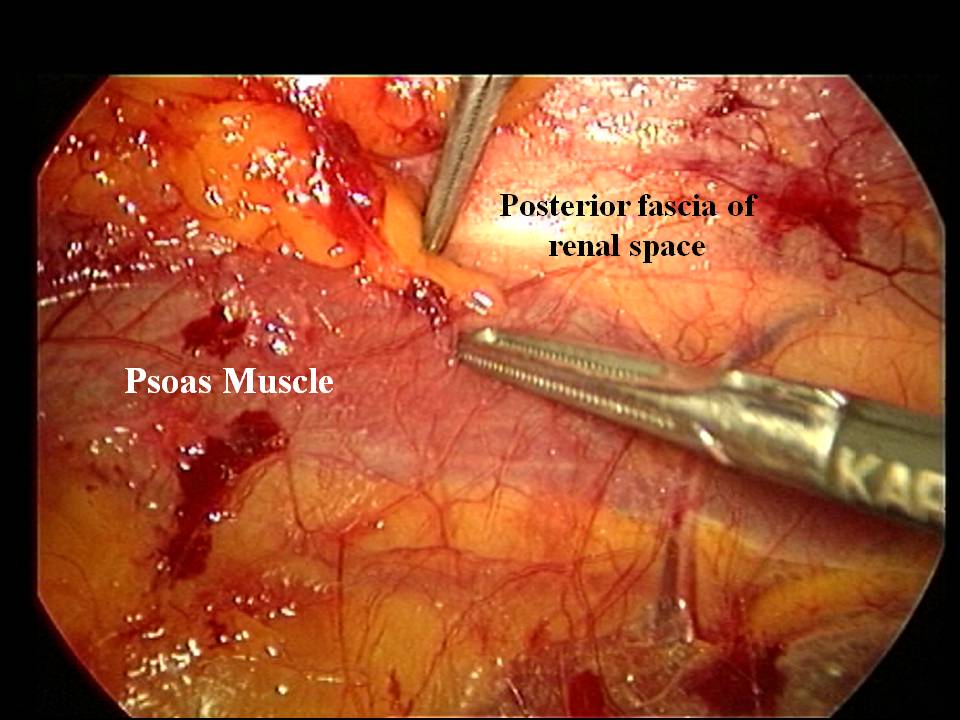
Figura 3. Visione laparoscopica in corso di surrenectomia retro-peritoneoscopica destra. Nelle fasi iniziali dellâ??intervento la loggia surrenalica è indistinguibile da quella renale. La dissezione inizia lungo il profilo del muscolo psoas, in genere ben evidenziabile.
Bibliografia
- Balboni GC, et al. Anatomia Umana. Edizioni Edi Ermes 1994, vol 1: 598-609.
- Testut L, et al. Trattato di anatomia topografica. Edizioni UTET 1977, vol 2: 683-93.
- Guazzoni G, et al. Chirurgia laparoscopica del surrene. Giorgio Nada Editore 1996: 13-6.
- Zacharias et al. Transperitoneal laparoscopic adrenalectomy: outline of the preoperative management, surgical approach, and outcome. Eur Urol 2006, 49: 448-59.
Imaging dei surreni
Alessandro Prete1,2, Giuseppe Reimondo3 e Antonio Stigliano4
1Institute of Metabolism and Systems Research, University of Birmingham, Birmingham, UK
2Department of Endocrinology, Queen Elizabeth Hospital Birmingham, University Hospitals Birmingham NHS Foundation Trust, Birmingham, UK
3Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
4Dipartimento di Medicina Clinica e Molecolare - Ospedale Sant'Andrea - Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
Il riscontro di masse surrenaliche è un problema frequente. La diagnosi di una massa surrenalica può avvenire a seguito di indagini eseguite per il sospetto di una patologia surrenalica o – più frequentemente – in maniera incidentale. Infatti, il 3-7% delle tecniche di imaging dell’addome (in particolar modo tomografia computerizzata, TC, e risonanza magnetica, RM) eseguite per motivi non legati al sospetto di una patologia surrenalica porta al riscontro di una massa surrenalica in età adulta; la prevalenza raggiunge il 10% se si considera la popolazione anziana (1-3). Il riscontro di masse surrenaliche è un’evenienza comune anche durante la stadiazione di tumori maligni extra-surrenalici, che può includere TC, RM e tomografia ad emissione di positroni (PET).
La natura delle masse surrenaliche è varia ed include tumori benigni e maligni del cortico-surrene e della midollare surrenalica, nonché tumori di origine extra-surrenalica. Le varie tecniche di imaging dei surreni sono utilizzate (da sole o in combinazione) per la caratterizzazione delle masse surrenaliche dal punto di vista morfologico e – nel caso di imaging medico-nucleare – anche funzionale.
Scintigrafia e PET per lo studio dei surreni
Bibliografia
- Fassnacht M, Arlt W, Bancos I, et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol 2016, 175: G1-34.
- Dinnes J, Bancos I, Ferrante di Ruffano L, et al. Imaging for the diagnosis of malignancy in incidentally discovered adrenal masses: a systematic review and meta-analysis. Eur J Endocrinol 2016, 175: R51-64.
- Reimondo G, et al. Adrenal incidentalomas are tied to increased risk of diabetes: findings from a prospective study. J Clin Endocrinol Metab 2020, DOI: 10.1210/clinem/dgz284.
Ecografia surrenalica
Alessandro Prete1,2, Giuseppe Reimondo3 e Antonio Stigliano4
1Institute of Metabolism and Systems Research, University of Birmingham, Birmingham, UK
2Department of Endocrinology, Queen Elizabeth Hospital Birmingham, University Hospitals Birmingham NHS Foundation Trust, Birmingham, UK
3Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
4Dipartimento di Medicina Clinica e Molecolare - Ospedale Sant'Andrea - Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
(aggiornato all'8 gennaio 2020)
La possibilità di ottenere delle corrette informazioni circa la morfologia delle ghiandole surrenaliche con questa metodica è affidata in buona parte all’esperienza dell’operatore. Inoltre, la loro visualizzazione è strettamente correlata all’habitus del paziente (1). Entrambe queste condizioni ne limitano evidentemente l’impiego nella pratica clinica.
La visualizzazione delle ghiandole surrenaliche in età neonatale appare meno complessa, in considerazione del maggior volume delle stesse. Le finestre acustiche per lo studio dei surreni sono rappresentate a destra da quella epatica e a sinistra da quella splenica. Le scansioni, intercostali, sono sia assiali che longitudinali e avvengono con paziente in posizione supina o in decubito laterale sul fianco opposto. Il surrene, nell’adulto, si presenta interamente ad ecostruttura ipoecogena. Nel neonato è possibile invece riconoscere la parte midollare, come struttura più ecogena rispetto alla corticale.
La sensibilità diagnostica dell’ecografia relativamente alla diagnostica delle masse surrenaliche dipende dalla grandezza della lesione. Questa è di circa il 65% per masse ≤ 3 cm (2) (figura 1). Ovviamente, la sensibilità dell’ecografia per le indagini morfologiche surrenaliche è molto inferiore a TC e RM (3,4). Alcuni studi attribuiscono un ruolo all’ecografia nel follow-up delle masse surrenaliche, preferibilmente > 3 cm (specialmente nel surrene destro), precedentemente diagnosticate con altre metodiche radiologiche. Purtroppo, a differenza di queste, l’ecografia non riesce a discriminare la natura benigna o maligna delle lesioni (5).
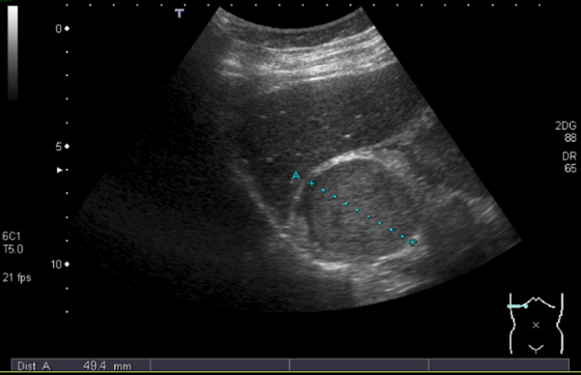
Figura 1: ecografia di feocromocitoma surrenalico destro di circa 5 cm
Bibliografia
- Yeh HC. Sonography of the adrenal glands: normal glands and small masses. AJR Am J Roentgenol 1980, 135: 1167-77.
- Suzuki Y, Sasagawa, Suzuki H, et al. The role of ultrasonography in the detection of adrenal masses: comparison with computed tomography and magnetic resonance imaging. Int Urol Nephrol 2001, 32: 303-6.
- Abrams HL, Siegelman SS, Adams DF, et al. Computed tomography versus ultrasound of the adrenal gland: a prospective study. Radiology 1982, 143: 121-8.
- Suzuki K, Fujita K, Ushiyama T, et al. Efficacy of an ultrasonic surgical system for laparoscopic adrenalectomy. J Urol 1995, 154: 484-6.
- Fontana D, Porpiglia F, Destefanis P, et al. What is the role of ultrasonography in the follow-up of adrenal incidentalomas? The Gruppo Piemontese Incidentalomi Surrenalici. Urology 1999, 54: 612-6.
TC e RM dei surreni
Alessandro Prete1,2, Giuseppe Reimondo3 e Antonio Stigliano4
1Institute of Metabolism and Systems Research, University of Birmingham, Birmingham, UK
2Department of Endocrinology, Queen Elizabeth Hospital Birmingham, University Hospitals Birmingham NHS Foundation Trust, Birmingham, UK
3Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
4Dipartimento di Medicina Clinica e Molecolare - Ospedale Sant'Andrea - Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
(aggiornato all'8 gennaio 2020)
Tomografia computerizzata
La TC è una tecnica radiologica dotata di buona sensibilità nell’individuare lesioni surrenaliche anche di dimensioni contenute (figure 1 e 2). A questo si aggiunge la buona sensibilità di questa metodica nei confronti della densità lipidica. L’abbondante quantità di lipidi contenuti nel citoplasma delle cellule adenomatose, contrariamente a quanto si osserva nelle altre lesioni, rende questa metodica particolarmente adatta allo studio delle masse surrenaliche (1-3). Esiste una relazione lineare inversa tra la concentrazione di grassi e quella di attenuazione nelle immagini ottenute dalla TC senza mezzo di contrasto.
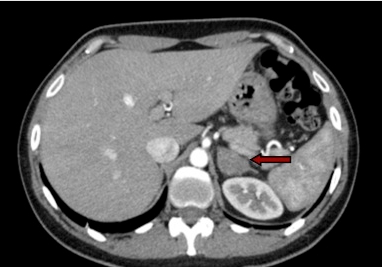
Figura 1: TC con evidenza di adenoma surrenalico sinistro
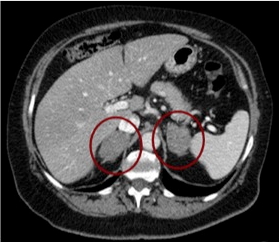
Figura 2: TC con evidenza di adenoma surrenalico bilaterale
La densitometria nella TC dei surreni è fondamentale, poiché le caratteristiche strutturali della maggior parte delle masse surrenaliche non sono sufficientemente specifiche da consentire una precisa caratterizzazione. Essa dimostra che il valore medio di attenuazione, espresso in unità Hounsfield (Hounsfield unit, HU), è discriminante circa la natura delle lesioni. La densità Hounsfield è una scala quantitativa che descrive la radio-sensibilità, assegnando valori calibrati alla scala dei grigi nelle immagini ricostruite. I valori sono riferiti alla differenza relativa del coefficiente lineare di attenuazione rispetto all’acqua. Nella valutazione delle lesioni surrenaliche, le HU devono essere misurate senza mezzo di contrasto:
- HU ≤ 10 (TC senza mezzo di contrasto): diversi studi mostrano che una densità ≤ 10 HU ha una sensibilità del 91-100% e una specificità del 60-82% nel differenziare una lesione surrenalica benigna da una maligna (4). È importante tuttavia sottolineare che si assiste a una riduzione di sensibilità e specificità qualora la massa surrenalica venga diagnosticata durante follow-up per una neoplasia extra-surrenalica (sensibilità 79-98%, specificità 38-91%) (4);
- HU > 10 (TC senza mezzo di contrasto): lesioni con densità > 10 HU sono considerate indeterminate (ovvero hanno un rischio maggiore di malignità) e possono essere necessarie altre metodiche di imaging per la loro caratterizzazione. Tuttavia, almeno un terzo degli adenomi surrenalici sono tumori a scarso contenuto lipidico, che possono mostrare valori di attenuazione > 10 HU (lipid-poor adenomas) (5,6).
In aggiunta al valore di HU, anche le dimensioni e l'aspetto di una massa surrenalica alla TC (eterogeneità, margini, invasione dei tessuti circostanti) possono aiutare a distinguere tra lesioni benigne e maligne:
- gli adenomi appaiono generalmente di dimensioni contenute, a contorni regolari e omogenei;
- i carcinomi sono frequentemente di grandi dimensioni, hanno un contenuto disomogeneo per la presenza di emorragia intra-lesionale, necrosi e/o calcificazioni (figura 3). Il cut-off dimensionale attualmente suggerito dalle linee guida oltre il quale il rischio di malignità aumenta significativamente è 4 cm (7);
- le metastasi, spesso bilaterali, appaiono come lesioni disomogenee, di dimensioni variabili, a margini irregolari, con aree centrali necrotiche o emorragiche (8).
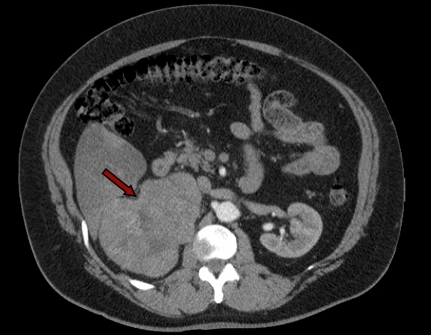
Figura 3: TC con evidenza di carcinoma surrenalico destro
Il ruolo del mezzo di contrasto nella valutazione TC delle masse surrenaliche è molto dibattuto. Si riteneva che gli adenomi avessero tipicamente un enhancement omogeneo e scarso dopo somministrazione di mezzo di contrasto, mentre carcinomi e metastasi un enhancement marcato. Tuttavia, una revisione sistematica e meta-analisi della letteratura ha messo in evidenza come le evidenze riguardanti l’utilizzo del mezzo di contrasto nel distinguere masse surrenaliche benigne e maligne siano molto limitate (4). Inoltre, dati molto recenti mostrano come la TC con mezzo di contrasto ha una sensibilità del 78-92% e una specificità solo del 50-57% nella differenziazione di masse surrenaliche con HU > 10 HU; pertanto, questa metodica non sembrerebbe fornire informazioni aggiuntive a un esame TC senza mezzo di contrasto (9). L’utilizzo del mezzo di contrasto ha inoltre bassa specificità nel differenziare masse cortico-surrenaliche da tumori della midollare (feocromocitomi) (10). Anche in questo caso, la valutazione densitometrica alla TC senza mezzo di contrasto sembra fornire maggiori informazioni: in una serie retrospettiva di 376 feocromocitomi, il 99.5% aveva HU > 10 (10).
Risonanza magnetica
La RM permette un’agevole identificazione di masse surrenaliche (figura 4), e sembra avere buona accuratezza nel discriminare le lesioni benigne da quelle maligne se confrontata con la TC senza mezzo di contrasto (7). Tuttavia, i dati presenti in letteratura sono piuttosto limitati (4).
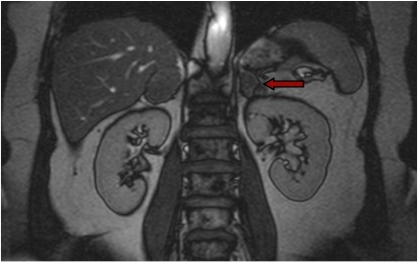
Figura 4: RMN con evidenza di adenoma surrenalico sinistro
La differenziazione tra masse benigne e maligne è basata sul chemical shift. Esso rappresenta le differenti frequenze di risonanza dei protoni del grasso e dell’acqua. Questo permette la diagnosi differenziale tra gli adenomi ad abbondante contenuto lipidico e le altre lesioni e sembra migliorare la performance dell’esame anche nei confronti di quelle lesioni benigne a minor contenuto lipidico (11-13). L’indagine riporta dati relativi all’analisi quantitativa o qualitativa della perdita di intensità di segnale delle lesioni surrenaliche relative ai tessuti di riferimento (fegato, muscolo e milza) in sequenze cosiddette in-fase e in opposizione di fase, attraverso le quali è possibile discriminare tra adenomi e non adenomi con una sensibilità dell’84-100% e una specificità del 92-100%.
In generale, gli adenomi appaiono come ipo- o iso-intensi rispetto al fegato nelle immagini T1-pesate e iper- o iso-intensi rispetto al fegato nelle immagini T2-pesate. I carcinomi presentano elevata intensità di segnale nelle immagini T1- e T2-pesate per la presenza di emorragia e di necrosi. Dopo somministrazione di mezzo di contrasto, i carcinomi possono mostrare un enhancement periferico con ipoperfusione centrale (6,14).
La RM risulta anche molto utile per la diagnosi differenziale tra lesioni della corticale e della midollare surrenalica. Tipicamente, i feocromocitomi sono marcatamente iperintensi nelle immagini T2-pesate (light-bulb sign) e presentano intenso enhancement del gadolinio, con multiple piccole aree di necrosi centrale (salt-and-pepper sign) (15).
Bibliografia
- Grumbach MM, Biller BM, Braunstein GD, et al. Management of the clinically inapparent adrenal mass ("incidentaloma"). Ann Intern Med 2003, 138: 424-9.
- Kloos RT, Gross MD, Francis IR, et al. Incidentally discovered adrenal masses. Endocr Rev 1995, 16: 460-84.
- Mansmann G, Lau J, Balk E, et al. The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev 2004, 25: 309-40.
- Dinnes J, Bancos I, Ferrante di Ruffano L, et al. Imaging for the diagnosis of malignancy in incidentally discovered adrenal masses: a systematic review and meta-analysis. Eur J Endocrinol 2016, 175: R51-64.
- Johnson PT, Horton KM, Fishman EK. Adrenal mass imaging with multidetector CT: pathologic conditions, pearls, and pitfalls. Radiographics 2009, 29: 1333-51.
- Korobkin M, Brodeur FJ, Francis IR, et al. CT time-attenuation washout curves of adrenal adenomas and nonadenomas. AJR Am J Roentgenol 1998, 170: 747-52.
- Fassnacht M, Arlt W, Bancos I, et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol 2016, 175: G1-34.
- Francis IR, Gross MD, Shapiro B, et al. Integrated imaging of adrenal disease. Radiology 1992, 184: 1-13.
- Ebert I, Schloetelburg W, Petritsch B, et al. Multiphasic CT for differentiation of adrenal masses: wash-out CT does not hold, what it promises? (abstract) European Network for the Study of Adrenal Tumours (ENSAT) Annual Conference. Uppsala, Sweden, 2019.
- Canu L, Van Hemert JAW, Kerstens MN, et al. CT characteristics of pheochromocytoma: relevance for the evaluation of adrenal incidentaloma. J Clin Endocrinol Metab 2019, 104: 312-8.
- Haider MA, Ghai S, Jhaveri K, Lockwood G. Chemical shift MR imaging of hyperattenuating (>10 HU) adrenal masses: does it still have a role? Radiology 2004, 231: 711-6.
- Israel GM, Korobkin M, Wang C, et al. Comparison of unenhanced CT and chemical shift MRI in evaluating lipid-rich adrenal adenomas. AJR Am J Roentgenol 2004, 183: 215-9.
- Bilbey JH, McLoughlin RF, Kurkjian PS, et al. MR imaging of adrenal masses: value of chemical-shift imaging for distinguishing adenomas from other tumors. AJR Am J Roentgenol 1995, 164: 637-42.
- Outwater EK, Siegelman ES, Radecki PD, et al. Distinction between benign and malignant adrenal masses: value of T1-weighted chemical-shift MR imaging. AJR Am J Roentgenol 1995, 165: 579-83.
- McDermott S, McCarthy CJ, Blake MA. Images of pheochromocytoma in adrenal glands. Gland Surg 2015, 4: 350-8.
Scintigrafia e PET per lo studio dei surreni
Alessandro Prete1,2, Giuseppe Reimondo3 e Antonio Stigliano4
1Institute of Metabolism and Systems Research, University of Birmingham, Birmingham, UK
2Department of Endocrinology, Queen Elizabeth Hospital Birmingham, University Hospitals Birmingham NHS Foundation Trust, Birmingham, UK
3Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
4Dipartimento di Medicina Clinica e Molecolare - Ospedale Sant'Andrea - Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
(aggiornato all'8 gennaio 2020)
Scintigrafia per lo studio della corticale surrenalica
I radioisotopi comunemente impiegati nello studio scintigrafico del cortico-surrene sono 131I-6ß-iodometil-norcolesterolo (NP-59) e 75Se-selenometil-19-norcolesterolo (1). L’esame prevede l’impiego di un elevato dosaggio di radio-tracciante, che purtroppo rappresenta uno degli svantaggi di questa tecnica (2). Il pattern scintigrafico surrenalico si definisce:
- concordante quando la captazione del radio-farmaco è esclusiva o prevalente a carico di un surrene; generalmente si riferisce ad adenoma corticale o a iperplasia nodulare unilaterale (figura 1);
- discordante è quello con assente o ridotta captazione da parte di una lesione all’interno di una ghiandola surrenalica; può essere riferito alla presenza di carcinoma, di metastasi o di lesioni surrenaliche occupanti spazio;
- simmetrico quando la captazione è a carico di entrambi i surreni (figura 2).
![]()
Figura 1: Scintigrafia surrenalica (in alto immagine a 3 giorni, in basso a 7 giorni) che evidenzia una captazione monolaterale sinistra (concordante con la presenza della lesione).

Figura 2: Scintigrafia surrenalica (in alto immagine a 3 giorni, in basso a 7 giorni) che evidenzia un pattern simmetrico di captazione.
La sensibilità della scintigrafia nel differenziare lesioni benigne da quelle maligne varia dal 71% al 100%, la specificità dal 50% al 100% (3,4). A causa della limitata risoluzione della scintigrafia, modelli concordanti e discordanti di captazione possono fallire la diagnosi nelle lesioni < 2 cm di diametro (3,5). Si deve anche considerare che alcuni tumori benigni surrenalici di origine extra-corticale, come il mielo-lipoma, producono un quadro discordante di assorbimento (suggestivo quindi di un tumore maligno), rappresentando un falso positivo (6).
L’assorbimento del NP-59 in corrispondenza del surrene sede della lesione con mancata visualizzazione della ghiandola contro-laterale può verificarsi nonostante test endocrini normali ed in assenza di segni e sintomi clinici evidenti (3). La captazione scintigrafica rappresenta quindi un segno molto precoce di autonomia funzionale, ma la bassa specificità di questa metodica la rende di dubbia utilità clinica.
Complessivamente, l’insufficiente risoluzione spaziale, la mancanza di esperienza nell’interpretazione dei dati, la limitata disponibilità del tracciante e la lunghezza della procedura – che richiede una scansione seriale in 5–7 giorni – sono i principali inconvenienti metodologici della scintigrafia surrenalica (5).
Scintigrafia per lo studio della midollare surrenalica
La scintigrafia con 123I-metaiodo-benzilguanidina (123I-MIBG) è stata a lungo utilizzata per la conferma diagnostica e localizzazione di feocromocitomi/paragangliomi (figura 3). La MIBG è un precursore della guanetidina, con una struttura molecolare simile a quella della noradrenalina, che si accumula all’interno di tumori secernenti catecolamine dopo somministrazione endovenosa (7). Attualmente, l’uso della scintigrafia con 123I-MIBG è scoraggiato nella fase diagnostica dei feocromocitomi/paragangliomi, in quanto raramente fornisce informazioni maggiori rispetto a TC e RM e può anche portare a errori di interpretazione delle altre metodiche di imaging (8). Il suo uso dovrebbe essere per lo più riservato a quei pazienti con feocromocitoma/paraganglioma metastatico, in cui viene presa in considerazione la terapia radiorecettoriale con MIBG (9).

Figura 3: Feocromocitoma sinistro. Pannello A: scintigrafia con 123I-MIBG che mostra area fotopenica centrale (area di necrosi). Pannello B: correlato TC.
PET per lo studio della corticale surrenalica
18F-FDG PET
Il tracciante generalmente utilizzato nella PET è rappresentato dal fluorodesossiglucosio (18F-FDG), un radio-farmaco analogo del glucosio, che viene captato in misura proporzionale al grado di attività metabolica del tessuto in esame (figura 4). In base a questo criterio, la metodica si propone di discriminare le lesioni maligne da quelle benigne (10).

Figura 4: PET/TC con 18F-FDG, che evidenzia una lesione surrenalica destra captante il radio-tracciante. A destra immagine PET, a sinistra immagine TC.
In virtù del suo eccellente valore predittivo negativo, la 18F-FDG-PET rappresenta un valido ausilio nel discriminare masse non-secernenti con densitometria equivoca alla TC. Tuttavia, lesioni maligne surrenaliche a contenuto necrotico o emorragico possono causare falsi negativi per la scarsa captazione di 18F-FDG.
L'analisi quantitativa della PET con 18F-FDG viene eseguita utilizzando valori di uptake standardizzato (standardized uptake value, SUV) o adottando criteri di valutazione qualitativa rispetto alla captazione epatica. La combinazione della PET con la risoluzione spaziale della TC permette di unire le informazioni funzionali della PET con quelle morfologico-densitometriche della TC. La sensibilità della 18F-FDG-PET/TC per identificare lesioni maligne è del 93-98%, con una specificità dell’87-94% (11). È stato stimato che un rapporto di SUV < 1.45-1.60 è altamente predittivo di lesione benigna (12,13).
PET con metomidate
L’impiego del metomidate, un inibitore specifico dell’enzima 11ß-idrossilasi, si propone come promettente radio-tracciante per l’identificazione della natura surrenalica della lesione (14). Questo tracciante trova un suo campo di impiego nella diagnostica delle neoplasie maligne del cortico-surrene. L’11C-metomidate consente anche di effettuare una stadiazione della neoplasia e l’identificazione di eventuali ripetizioni metastatiche (15). Purtroppo, la marcatura dell’11C-metomidate è resa difficoltosa dalla necessità di avere un ciclotrone a breve distanza dal centro di medicina nucleare. Questo ostacolo giustifica l’impiego di un altro tracciante, il 123I-iodometomidate (14).
Infine, studi attualmente in corso stanno valutando l’utilità della PET/TC con 11C-metomidate nella valutazione diagnostica di pazienti con iperaldosteronismo primario. I dati preliminari sono incoraggianti e suggeriscono un’ottima performance se confrontata col gold standard del cateterismo delle vene surrenaliche (16).
PET per lo studio della midollare surrenalica
Qualora necessario, diverse tecniche di imaging medico-nucleare possono essere utilizzate nella valutazione diagnostica e di stadiazione di masse surrenaliche sospette per feocromocitoma/paraganglioma. Esse includono la PET/TC con analoghi della somatostatina (68Ga-DOTA-SSA PET/CT), la PET/TC con fluorodiidrossifenilalanina (18F-FDOPA) e la PET/TC con 18F-FDG. L’utilizzo di queste metodiche si basa sulla disponibilità nei vari centri e – ove possibile – dovrebbe tener conto del genotipo del paziente, ovvero della presenza o meno di mutazioni germinali nei geni di suscettibilità per feocromocitoma/paraganglioma (9).
Bibliografia
- Rubello D, Bui C, Casara D, et al. Functional scintigraphy of the adrenal gland. Eur J Endocrinol 2002, 147: 13-28.
- Carey JE, Thrall JH, Freitas JE, Beierwaltes WH. Absorbed dose to the human adrenals from lodomethylnorcholesterol (I-131) "NP-59": concise communication. J Nucl Med 1979, 20: 60-2.
- Gross MD, Shapiro B, Bouffard JA, et al. Distinguishing benign from malignant euadrenal masses. Ann Intern Med 1988, 109: 613-8.
- Gross MD, Shapiro B, Francis IR, et al. Scintigraphic evaluation of clinically silent adrenal masses. J Nucl Med 1994, 35: 1145-52.
- Falke TH, Sandler MP. Classification of silent adrenal masses: time to get practical. J Nucl Med 1994, 35: 1152-4.
- Barzon L, Scaroni C, Sonino N, et al. Incidentally discovered adrenal tumors: endocrine and scintigraphic correlates. J Clin Endocrinol Metab 1998, 83: 55-62.
- McDermott S, McCarthy CJ, Blake MA. Images of pheochromocytoma in adrenal glands. Gland Surg 2015, 4: 350-8.
- Rao D, van Berkel A, Piscaer I, et al. Impact of 123I-MIBG scintigraphy on clinical decision making in pheochromocytoma and paraganglioma. J Clin Endocrinol Metab 2019, 104: 3812–20.
- Taieb D, Jha A, Treglia G, Pacak K. Molecular imaging and radionuclide therapy of paraganglioma and pheochromocytoma. Endocr Relat Cancer 2019, 26: R627-52.
- Han SJ, Kim TS, Jeon SW, et al. Analysis of adrenal masses by 18F-FDG positron emission tomography scanning. Int J Clin Pract 2007, 61: 802-9.
- Boland GW, Dwamena BA, Jagtiani Sangwaiya M, et al. Characterization of adrenal masses by using FDG PET: a systematic review and meta-analysis of diagnostic test performance. Radiology 2011, 259: 117-26.
- Nunes ML, Rault A, Teynie J, et al. 18F-FDG PET for the identification of adrenocortical carcinomas among indeterminate adrenal tumors at computed tomography scanning. World J Surg 2010, 34: 1506-10.
- Guerin C, Pattou F, Brunaud L, et al. Performance of 18F-FDG PET/CT in the characterization of adrenal masses in noncancer patients: a prospective study. J Clin Endocrinol Metab 2017, 102: 2465-72.
- Hahner S, Stuermer A, Kreissl M, et al. [123I]Iodometomidate for molecular imaging of adrenocortical cytochrome P450 family 11B enzymes. J Clin Endocrinol Metab 2008, 93: 2358-65.
- Hennings J, Lindhe O, Bergstrom M, et al. [11C]metomidate positron emission tomography of adrenocortical tumors in correlation with histopathological findings. J Clin Endocrinol Metab 2006, 91: 1410-4.
- Lenders JWM, Eisenhofer G, Reincke M. Subtyping of patients with primary aldosteronism: an update. Horm Metab Res 2017, 49: 922-8.
Inquadramento generale diagnostico
Biosintesi, trasporto e metabolismo degli steroidi
Vito A. Giagulli
Dipartimento di Medicina Interna, U.O. di Malattie Metaboliche ed Endocrinologia, P.O. Monopoli-Conversano, Presidio di Conversano AUL/BA
INTRODUZIONE
Gli steroidi sono ormoni cruciali per numerosi processi fisiologici, che vanno dallo sviluppo corporeo alla riproduzione, regolando molti processi dell’omeostasi corporea.
Le ghiandole che secernono gli steroidi sono la corticale del surrene, le gonadi e la placenta.
La cellula di Leydig per il testicolo è la sede principale di secrezione del testosterone (T), mentre per l’ovaio diversi compartimenti (il follicolo, il corpo luteo e le cellule interstiziali), interagendo tra di loro, sintetizzano sia gli androgeni che gli estrogeni. Tuttavia, fra le ghiandole secernenti steroidi, la corticale del surrene presenta particolari peculiarità: secernere il più ampio spettro di steroidi (glicocorticoidi, mineralcorticoidi, androgeni e, in piccole quantità, estrogeni), avendo zone anatomicamente ben delimitate (glomerulare, fascicolata e reticolata) con diverse attività, meccanismi di secrezione e di controllo da parte di altri ormoni che agiscono lontano dalla loro sede di secrezione (ACTH, renina/angiotensina) (feed-back) (1).
Altri tessuti o organi extra-ghiandolari (cute, tessuto adiposo, cuore, fegato, prostata, cervello, ecc) possono sintetizzare o metabolizzare steroidi, sebbene non siano regolati dal feed-back di altri ormoni. Essi, infatti, sono dotati di uno specifico corredo enzimatico, la cui attività viene modulata o dall’azione di massa di altri steroidi provenienti dal torrente sanguigno o da altri fattori ormonali e non, prodotti localmente (2,3).
STRUTTURA BIOCHIMICA, TERMINOLOGIA E CLASSIFICAZIONE DEGLI STEROIDI
Il colesterolo è il principale precursore degli ormoni steroidei, la cui struttura chimica è caratterizzata da un nucleo ciclopentano-peridrofenantrenico [3 anelli di 6 atomi di carbonio (A, B e C) e un anello a 5 atomi di carbonio (D), fusi in una trans-configurazione che dà alla molecola un struttura grossolanamente piana] con un gruppo idrossilico legato al carbonio 3, un doppio legame tra C5 e C6, una catena laterale idrocarburica legata al carbonio 17, un gruppo metilico (carbonio 19) legato al carbonio 10 ed un secondo gruppo metilico (carbonio 18) legato al carbonio 13; per un totale di 27 atomi di carbonio.
Tre serie di steroidi sono sintetizzati dalle ghiandole steroidosecernenti:
- pregnani: steroidi a 21 atomi di carbonio (progestinici, pregnenolonici, glicocorticoidi e mineralcorticoidi);
- androstani: steroidi a 19 atomi di carbonio (androgeni);
- estrani: steroidi a 18 atomi di carbonio (estrogeni).
BIOSINTESI DEGLI STEROIDI

Le modificazioni necessarie che portano alla sintesi degli steroidi si posso così riassumere.
- Il colesterolo può essere sintetizzato ex novo dall’acetil-CoA nel citosol della cellula surrenalica o captato dalle lipoproteine a bassa densità (LDL) o ad alta densità (HDL) in circolo, mediante i recettori per le LDL e dello scavanger receptor B1 (SRB1), rispettivamente. La lipasi ormono-sensibile stimolata dall’ACTH rende disponibile il colesterolo per la sintesi degli steroidi.
- Clivaggio, a livello della membrana mitocondriale interna, della catena idrocarburica in posizione 17, con rilascio di una molecola a 6 atomi di carbonio e sintesi di pregnenolone (P5).
- Isomerizzazione del doppio legame tra C5 e C6: da Δ5 a Δ4 e ossidazione del gruppo idrossilico in posizione 3β a gruppo chetonico con sintesi di progesterone (P4). Quest’ultimo è idrossilato o in posizione 17α o 21: in questa maniera vengono sintetizzati tutti i Δ4 pregnani, cioè tutti i precursori del cortisolo (F) (11-deossicortisolo) e dell’aldosterone (11-deossicorticosterone) (DOC). Un secondo clivaggio (17-20 liasi) della catena in posizione 17 sia dei Δ5 che dei Δ4 pregnani porta alla sintesi degli androgeni deboli: DHEA ed androstenedione (A). Il DHEA a opera della solfotransferasi può essere convertito in DHEA-S, mentre l’A, grazie all’azione dell’enzima 17β-idrossilasi (17βHDS), viene convertito in T. Dagli androgeni Δ4 si formano gli estrogeni (gli androgeni Δ5 non sono aromatizzabili). Tutte queste reazioni avvengono nel reticolo endoplasmatico liscio della cellula secernente.
- Una serie di idrossilazioni a livello della membrana mitocondriale interna in posizione 11, 18 e 19 porta alla sintesi di F e di aldosterone, passando attraverso i composti, rispettivamente, corticosterone (S) e 18 idrossi-corticosterone.
GLI ENZIMI
Le reazioni enzimatiche della steroidogenesi sono di due tipi: ossido-riduzione e idrossilazione.
Gli enzimi coinvolti appartengono a tre grosse classi di proteine:
- i citocromi P450 (CPY) contenenti eme;
- le idrossisteroido-deidrogenasi (HDS);
- le solfotransferasi (SULT).
L’espressione dei CPY e HDS a livello delle ghiandole secernenti, fatta eccezione per la placenta, richiede l’azione del fattore di trascrizione SF1 (steroidogenic factor 1).
Citocromi P450
I componenti della famiglia dei CYP sono detti citocromi P450, poiché presentano un caratteristico picco di assorbimento a 450 nm in presenza di CO (3).
Essi vengono sintetizzati nel citoplasma ad opera di differenti geni e poi trasportati al loro sito d’azione: il mitocondrio (CYP del 1° tipo) o il reticolo endoplasmatico liscio (CYP del 2° tipo) (3).
I CYP possiedono un gruppo eme e una apoproteina e utilizzano NADPH come potere riducente (trasferimento di elettroni) per le reazioni di idrossilazione, con la produzione di una molecola di acqua e NADP+. Per questa reazione, i CYP del 1° tipo hanno una catena di proteine costituita da una flavoproteina (ferrodossina-reduttasi) e dalla ferro-solfo-proteina (adrenodossina), mentre quelli del 2° tipo ricevono elettroni dal NADPH tramite una singola proteina POR (P450-ossidoreduttasi) alcune volte assistita dal citocromo b5 (4, 5). Pertanto, possiamo così riassumere le reazioni dei CYP.
- A livello mitocondriale (CYP del 1° tipo):
- P450scc (P450 monoossigenasi, enzima limitante per la sintesi degli steroidi) catalizza il clivaggio in posizione 20-22 della catena alifatica del colesterolo;
- P450 11β converte l’11desossicortisolo in F e il DOC in corticosterone ed è strettamente correlato al P450 c11AS che sintetizza l’aldosterone (aldosterone-sintetasi).
- A livello del reticolo endoplasmatico liscio (CYP del 2° tipo):
- P450 c17 catalizza sia la l7α-idrossilazione che il clivaggio della catena laterale del 17α-idrossiprogesterone (17αOH P4) o idrossipregnenolone (17αOH P5) rispettivamente in A e DHEA;
- P450 c21 catalizza l’idrossilazione in posizione 21 sia dei glucocorticoidi che dei mineralcorticoidi;
- P450 carom aromatizzaiΔ4androgeni deboli (A) o il T rospettivamente in estrone (E1) o estradiolo (E2), consumando 3 equivalenti di ossigeno molecolare e 3 molecole di NADPH (4).
La famiglia dei CYP si trova in maniera diffusa sia nelle ghiandole secernenti steroidi che nei tessuti o organi extra-ghiandolari (3,5).
Idrossisteroido-deidrogenasi
Gli enzimi della famiglia delle HDS sono classificati, in accordo alla loro attività, come deidrogenasi o reduttasi: le prime utilizzano il NAD come cofattore per ossidare gli idrossi-steroidi in cheto-steroidi, mentre le reduttasi utilizzano il NADPH per ridurre i chetosteroidi in idrossi-steroidi (3,5,6). Sebbene questi enzimi in vitro siano bidirezionali (in accordo a pH e cofattori), in vivo sono monodirezionali (riducenti od ossidanti), visto che la direzione dipende dalla concentrazione dei cofattori, che in vivo è sempre eccedente quella degli steroidi, in quanto strettamente connessa allo stato ossido-riduttivo della cellula. Infatti, in vivo il gradiente NADPH/NADP è mantenuto elevato grazie al ciclo dei pentoso-fosfati, mentre il gradiente NADH/NAD è mantenuto ridotto dalla rigenerazione dell’ATP a livello della catena respiratoria nel mitocondrio (6).
Le HDS presentano diverse isoforme, sintetizzate da differenti geni (specifici per specie e per tessuto) (4,6). Nell’uomo abbiamo:
- 2 isoforme della 3β-HDS: la prima è espressa a livello di placenta, fegato e mammella, mentre la seconda a livello di surreni e gonadi;
- almeno 14 isoforme di 17β-HDS, che si caratterizzano per specificità del substrato, cofattore utilizzato e funzione fisiologica. Infatti, la corticale del surrene non è in grado di secernere grandi quantità di T ed estrogeni poiché la 17β-HDS è scarsamente espressa (3,4). Le 17β-HDS più importanti sono:
- il tipo 1 che converte E1 in E2 a livello ovarico, placentare e mammario;
- il tipo 3 espressa esclusivamente a livello testicolare, che converte l’A in T in presenza di NADPH.
Solfotransferasi
Alla famiglia delle solfotransferasi (SULFT) appartengono quegli enzimi che agiscono sugli estrogeni (SULFT 1E1) in tessuti extra-ghiandolari (pelle e fegato) e quelli (SULFT A1) che, a livello della corticale del surrene, solforizzano il gruppo 3β-idrossi Δ5 pregnani (P5, 17αOH-P5) e 3β-idrossi Δ5 androstani (DHEA e androstenediolo) (3). Le SULFT A1 utilizzano come cofattore il 3-fosfo-adenosino-5-fosfosolfato tipo 2, la cui carenza può causare nel feto di sesso femminile una mascolinizzazione spiccata, per aumento significativo nel sangue del rapporto DHEA/DHEAS (7).
REGOLAZIONE DELLA STEROIDOGENESI
La secrezione degli steroidi da parte delle ghiandole può essere continua (cronica) o acuta, in risposta ad eventi acuti come lo stress generato da ipotensione, ipopotassiemia, ipoglicemia o, come nel caso delle gonadi, dalla rapida pulsatilità della secrezione di LH.
ACTH e, in maniera simile, LH, stimolando la concentrazione intracellulare di adenosin-monofosfato ciclico (cAMP), promuovono la crescita delle cellule, mantengono il normale funzionamento dell’impianto enzimatico secretorio, favoriscono il reclutamento del colesterolo, stimolano la trascrizione genica degli enzimi e della proteina StAR (steroidogenetic acute regulatory protein) (3, 8).
L’angiotensina II specificamente è in grado di stimolare l’espressione genica degli enzimi (P450 11β, P450 c11AS) necessari per la sintesi dell’aldosterone (9).
StAR, funzionando come carrier per il colesterolo, ne incrementa il trasporto dal citoplasma alla membrana mitocondriale interna, mettendo a disposizione grandi quantità di substrato al P450scc. StAR è espressa in tutte le ghiandole secernenti steroidi, eccetto la placenta. StAR non è dipendente dal P450scc e viene regolato da cAMP indotto dall’ACTH e dalla proteina DAX-1, che sopprimerebbe l’induzione della sua trascrizione.
Un altro importante fattore che regola la sintesi degli steroidi è lo “steroidogenic factor 1”(SF1), che modula la trascrizione di numerosi enzimi e in particolare del P450cscc.
SPECIFICITÀ DELLA SINTESI A LIVELLO DELLE GHIANDOLE E DEGLI ORGANI EXTRA-GHIANDOLARI
Non tutte le ghiandole (e/o organi extraghiandolari) sono in grado di secernere steroidi di tutte e tre le linee (glico-attivi, mineralo-attivi e steroidi sessuali), dato che la loro capacità sintetica e secretoria è funzione del loro corredo enzimatico. Inoltre, la sintesi di alcuni steroidi può essere realizzata grazie alla collaborazione di diversi compartimenti della ghiandola (e/o di organi extra-ghiandolari).
| Specificità tissutale della steroidogenesi | ||||
| Organo | Zona funzionale | Regolazione | Corredo enzimatico | Sintesi |
| Surrene | Glomerulare | Angiotensina | P450c17 assente | Aldosterone |
| Fascicolata | ACTH | espresso P450c17 ma non citocromo b5 | glico-attivi (l7α-idrossilazione dei pregnani) = cortisolo | |
| Reticolare | ACTH | espressi il P450c17 e il citocromo b5 | androgeni deboli (DHEA, A e androstenediolo) per clivaggio delle catene idrofobiche di 17αP4 o 17αP5 | |
| Testicolo | LH | espressi 3β-HDS2 e 17β-HDS3 ma non SULT2A1 | androgeni deboli non possono essere coniugati ad acido solforico ma vengono ridotti a T | |
| Ovaio | Granulosa | LH | espresso P450 scc ma non P450c17 | P4 e P5 |
| Teca | FSH | ricche di P450aro e 17β-HDS1 | P4 e P5 convertiti a estrogeni o androgeni deboli | |
Nella ghiandola surrenalica sono attive sia le vie Δ5 che quelle Δ4 per la sintesi di tutti e tre i gruppi degli steroidi (pregnani, androstani ed estrani). Nel testicolo è più attiva la via Δ5 che quella Δ4 per la sintesi degli androgeni, mentre nell’ovaio, poiché gli androgeni Δ5 non possono essere aromatizzati,la via più attiva è quella Δ4 (1,3,4,5).
Tra gli organi extra-ghiandolari secernenti steroidi ricordiamo il cervello e il cuore.
Diversi enzimi (P450 scc, 3α-HDS, 20α-HDS) sia della sintesi dei pregnani (P5, P4, allopregnenolone)che della sintesi (5α-reduttasi, 17β-HDS, P450arom ) degli ormoni sessuali (A, DHEA, DHT ed E2) sono stati identificati nel sistema nervoso centrale, periferico e nella glia in diverse specie di mammiferi e nell’uomo. Tuttavia, la funzione dei neurosteroidi (sebbene correlati a diverse funzioni del comportamento, dell'impulso sessuale, del tono dell’umore e della memoria) rimane ancora poco nota. A differenza delle ghiandole steroido-secernenti che presentano da una specifica sequenza di enzimi che permette la sintesi di steroidi a partire dal colesterolo, i nervi e la glia sono dotati quasi esclusivamente di un solo enzima. Pertanto, la sintesi di neurosteroidi (DHEA, allopregnenolone) è possibile grazie alla diffusione dei precursori da alcune cellule ad altre o per la collaborazione tra neuroni e cellule gliali (10).
Il muscolo cardiaco umano normale, poiché possiede tutta la catena degli enzimi (P450 scc, 3β-HDS, P450 c21, P450 11β) della sintesi dei mineralo-attivi, è in grado di sintetizzare DOC e S, ma non F ed aldosterone, poiché non sono espressi rispettivamenteP450 c17 e P450 c11AS. Tuttavia, il muscolo cardiaco di soggetti affetti da scompenso esprime il P450 c11AS e può sintetizzare aldosterone con funzioni paracrine ed autocrine (5).
SECREZIONE E PRODUZIONE EMATICA DEGLI STEROIDI
Fatta eccezione per F e aldosterone, che sono secreti esclusivamente dal surrene, nei due sessi esiste un'evidente differenza tra secrezione e produzione di androgeni ed estrogeni.
Nella donna fertile gli estrogeni e gli androgeni deboli circolanti sono prevalentemente di secrezione ovarica, mentre il T sierico ha origine per 50% dalla secrezione ovarica e per il restante 50% dalla produzione periferica per conversione degli androgeni deboli.
Alla menopausa, se il T sierico è di origine prevalentemente ovarica, gli estrogeni derivano dalla conversione degli androgeni soprattutto a livello del tessuto adiposo (11,12).
Nel maschio adulto, giovane e anziano, il T circolante è esclusivamente di secrezione testicolare, mentre gli estrogeni circolanti hanno origine dalla conversione periferica (tessuto adiposo prevalentemente) degli androgeni (1,11,14).
TRASPORTO DEGLI STEROIDI
Poiché tutti gli steroidi sono idrofobici, essi viaggiano nel torrente sanguigno prevalentemente veicolati da proteine. Il legame con le proteine definisce la specificità della proteina veicolante.
L’albumina lega in maniera aspecifica (bassa affinità) tutti gli steroidi sierici ed è presente nel sangue in concentrazioni (~ 4.3 g/dL) in eccesso rispetto a quelle degli steroidi stessi. Le proteine veicolanti specifiche, al contrario, hanno un legame con lo steroide ad alta affinità e presentano una bassa capacità di trasporto, perché la loro concentrazione nel sangue è ridotta e quindi saturabile in eccesso dallo steroide circolante. Infine, una piccolissima quantità di steroidi viaggia del tutto libera nel sangue, cioè non legata a proteine. Generalmente, quest'ultima frazione più quella non legata specificamente (la quota legata all’albumina) vengono ritenute quote biologicamente attive (14).
Trasporto degli steroidi del gruppo pregnani
F, 17αOH-P4, P4 e DOC (ma non aldosterone) si legano in maniera specifica alla corticosteroid-binding globulin (CBG), una α2-globulinasecreta dal fegato, la cui concentrazione sierica è compresa tra 25-35 mg/dL. Diversi ormoni possono influenzare le concentrazioni plasmatiche di CBG:
- ridotti da androgeni e corticosteroidi;
- aumentati da estrogeni e ormoni tiroidei.
La tabella riassume le percentuali di legame di questi steroidi con la CBG e l’albumina, tenendo conto dei livelli fisiologici sierici di F (5-25 μg/dl), 17αOH-P4 (0.5-1.5 ng/mL), P4 (1-2 ng/mL maschio, 2-10 ng/mL femmina), DOC (20 ng/dL) e aldosterone (5-19 μg/dl) e della loro affinità relativa alla CBG.
| Trasporto dei glicocorticoidi e mineralcorticoidi | |||
| Ormone | Frazione legata (%) | Frazione libera (%) | |
| CBG | Albumina | ||
| Cortisolo | > 75 | < 10 | 1-2 |
| Progesterone | 50 | 48 | 1 |
| DOC | 36 | > 60 | 1 |
| Aldosterone | < 17 | > 50 | > 30 |
Trasporto degli steroidi del gruppo androstani ed estrani
La proteina che lega specificamente gli ormoni sessuali, nota come sex hormone-binding globulin (SHBG), ha differente concentrazione nell’uomo (50 ± 20 nM/L) rispetto alla donna (75 ± 30 nM/L). L’invecchiamento nel maschio comporta un progressivo aumento fisiologico della SHBG (12). Numerosi ormoni possono influenzare la secrezione epatica della SHBG:
- aumentata da ormoni tiroidei ed estrogeni;
- diminuita da androgeni, F, GH e PRL.
La presenza di un gruppo idrossilico in 17β caratterizza lo steroide che è in grado di legare la proteina, mentre la costante di affinità dello steroide sessuale e la sua concentrazione plasmatica caratterizzano la specificità di legame dello steroide con la SHBG. Pertanto, l’affinità relativa degli ormoni sessuali per la SHBG è la seguente: DHT > 3α-androstanediolo > T > E2 (11,13,14).
| Trasporto degli ormoni sessuali | |||
| Ormone | Frazione legata (%) | Frazione libera (%) | |
| SHBG | Albumina | ||
| Nel maschio | |||
| DHT | 60 | 39 | < 1 |
| 3α-androstanediolo | 55 | 44 | < 1 |
| Testosterone | 49 | 49 | 1 |
| Estradiolo | 40 | 58 | 1 |
| Androstenedione | 3 | 88 | 9 |
| DHEA | 4 | 93 | 3 |
| Nella femmina | |||
| DHT | 84 | 15 | < 1 |
| 3α-androstanediolo | 79 | 20 | < 1 |
| Testosterone | 77 | 22 | 1 |
| Estradiolo | 59 | 39 | < 2 |
| Androstenedione | 5 | 86 | 9 |
| DHEA | 5 | 90 | 5 |
METABOLISMO DEGLI STEROIDI
Classicamente il catabolismo degli steroidi viene suddiviso in splancnico (epatico) ed extra-splancnico (tessuti periferici sensibili). Solo una piccolissima parte (1-2%) del cortisolo, dell’aldosterone e del T viene eliminata direttamente nelle urine. Sebbene la sede principale del catabolismo di tutti gli steroidi sia il fegato (splancnico), quello a livello extra-splancnico può presentare caratteristiche peculiari dipendenti dallo steroide e, soprattutto, dall’espressione del corredo enzimatico dello stesso tessuto.
Il catabolismo epatico presenta tappe enzimatiche comuni per tutti gli steroidi (1,11,12):
- riduzione dei doppi legami a livello dell’anello A del nucleo ciclopentano-peridrofenantrenico;
- riduzione del gruppo chetonico in posizione 3;
- coniugazione con acido glucuronico e/o acido solforico.
Seguendo queste tappe si formano una serie di composti che vengono poi escreti con le urine:
- dal cortisolo tetra-idrocortisolo o tetra-idrocortisone e loro allo-isomeri;
- dall’aldosterone tetra-idroaldosterone;
- dagli androgeni derivati 17-chetosteroidi (androsterone, androstanediolo, etiocolanolone);
- dagli estrogeni idrossi-derivati il cui maggior metabolita è l’estriolo.
Metabolismo extra-splancnico
Glucocorticoidi. I livelli circolanti di F sono regolati dalla attività della 11β-HDS1 che, a livello di diversi organi o tessuti sensibili (rene, tessuto adiposo, ecc), metabolizza in modo reversibile il cortisolo in cortisone (metabolita scarsamente attivo rispetto al F) (14).
Mineralcorticoidi. Una quota consistente (15%) di aldosterone viene direttamente coniugata dal rene con l’acido glucuronico ed escreto come aldosterone-18-glucuronide (1).
Androgeni ed estrogeni. Ha una valenza rilevante, soprattutto nella donna, sia in condizioni fisiologiche che patologiche (2), Infatti, ben il 50% del T circolante nella donna fertile deriva dal metabolismo di A e DHEA. Diversi tessuti possono compartecipare a modulare i livelli circolanti degli androgeni soprattutto nelle donne e degli estrogeni prevalentemente nel maschio (2,11). Ciò dipende dalla concentrazione e attività degli enzimi tessutali, in particolare dal rapporto tra l’attività della 5α-reduttasi (che trasforma il T in DHT) e della P450aro che trasforma gli androgeni Δ4 in estrogeni. Il tessuto adiposo di ambo i sessi, essendo ricco di P450aro ma non di 17β-HDS e 5α-reduttasi, può convertire tutti gli androgeni deboli Δ4 in E1 ed E2 più che in T. Invece, a livello della cute e dell’unità pilo-sebacea della donna, dove sono ben rappresentati tutti gli enzimi necessari per la sintesi degli androgeni forti (solfatasi, 3β-HDS, 17β-HDS, 5α-reduttasi, 3α-HDS), gli androgeni deboli Δ4 e Δ5 possono essere prevalentemente convertiti in T e DHT se l’espressione del P450 aro è insufficiente, aumentando così la possibilità di sviluppare acne, alopecia ed irsutismo.
BIBLIOGRAFIA
- Stewart PM. The Adrenal Gland. in: Williams Textbook of Endocrinology, Kronerberg, Melmed, Polonsky and Larsen eds. 11th Edition, Saunders 2008: 445-503.
- Labrie F. Intracrinology. Mol Cell Endocrinol 1991, 78: C113-8.
- Miller WL, Auchus RJ. The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders. Endocr Rev 2011, 32, 81-151.
- Miller WL. Minireview: regulation of steroidogenesis by electron transfer. Endocrinology 2005, 146: 2544-50.
- Payne AH, Hales DB. Overview of steroidogenesis enzymes in the pathway from cholesterol to active steroid hormones. Endocr Rev 2004, 25: 947-70.
- Agarwal AK, Auchus RJ. Minireview: cellular redox state regulates hydroxysteroid dehydrogenase activity and intracellular potency. Endocrinology 2005, 146: 2531-38.
- Noordam C, Dhir V, MNelis JC, et al. Inactivating PAPSS2 mutation in a patient with premature pubarche. N Engl J Med 2009, 360: 2310-8.
- Xing Y, Parker CR, Edward M, et al. ACTH is a potent regulator of gene expression in human adrenal cells. J Molec Endocrinol 2010, 45: 59-68.
- Romero DG, Gomez-Sancez EP, Gomez-Sancez CE. Angiotensin II-regulated transcription regulatory genes in adrenal steroidogenesis. Physiol Genomics 2010, 42A: 259-66.
- Pelletier G. Steroidogenic enzymes in the brain: morphological aspect. Progress in Brain Research. Martini L eds, 2010, 181: 193-207.
- Vermeulen A, Giagulli VA. Physiopathology of plasma androstanediol glucuronide. J Steroid Biochem Molec Biol 1999, 39: 829.
- Longcope C. Androgen Metabolism and Clearance in Androgen Excess Disorders in Women. Azziz R, Nestler JE, Dewallary D Eds, Lippincott-Raven 1997: 37-46.
- Kaufman JM, Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005, 26: 833-76.
- Lawson AJ, Walker EA, Lavery GG, et al. Cortisone-reductase deficiency associated with heterozygous mutations in 11 βhydroxysteroid dehydrogenase type 1. Proc Natl Acad Sci USA 2011, 108: 4111-6.
Azioni degli steroidi surrenalici
Vito A. Giagulli
Dipartimento di Medicina Interna, U.O. di Malattie Metaboliche ed Endocrinologia, P.O. Monopoli-Conversano, Presidio di Conversano AUL/BA
Tutti gli steroidi esercitano la loro azione attraverso il legame al loro specifico recettore, che traslocando nel nucleo della cellula target, regola l’espressione di alcuni geni con sintesi di specifiche proteine (effetto genomico).
Recettori per gli steroidi
Appartengono alla superfamiglia dei recettori nucleari. Sono proteine (50-100 x 103 dalton) caratterizzate da 3 domini:
- per il ligando (lo steroide in questo caso);
- per il legame con il DNA;
- per l’attivazione della trascrizione genica.
Molti meccanismi modulano i livelli plasmatici dei ligandi (precursori, sintesi, trasporto nel sangue, ecc), ma il legame tra il ligando e il suo recettore permette di attivare il recettore che, a sua volta, regola la trascrizione o la repressione di geni. Il recettore, sintetizzato a livello dei ribosomi nel citoplasma, viene trasportato nel nucleo grazie a una specifica sequenza del recettore, detta “nuclear localization signal”.
Specifici recettori possono legarsi a singoli ligandi, ma spesso alcuni recettori possono mediare il segnale di alcune famiglie di ormoni. L’esempio classico è dato dal recettore degli androgeni, che può legare testosterone e diidro-testosterone (DHT), e dai recettori dei glico-attivi e dei mineralo-attivi, che possono legare sia cortisolo che aldosterone, presentando un'omologia strutturale del 57% nel dominio per il ligando e del 97% nel dominio del legame con il DNA. Pertanto, la prevalenza del legame di uno steroide rispetto all’altro viene modulato dalla presenza nei tessuti bersaglio di specifici enzimi: 5α-reduttasi per gli androgeni forti (T e DHT) e 11β-idrossi-deidrogenasi 2 per i glico-attivi. Quest'ultimo enzima, infatti, convertendo cortisolo in cortisone, dotato di scarsa affinità per il recettore dei mineralo-attivi, permette all’aldosterone di legarsi liberamente al proprio recettore (1,2).
Infine, molte evidenze documentano effetti acuti (spesso farmacologici) mediati da non ben caratterizzati recettori di membrana (effetti non genomici) per gli ormoni steroidei (2).
Azioni dei glucorticoidi
Poichè i recettori per il cortisolo sono ubiquitari, la sua azione interessa praticamente ogni organo e tessuto (controllo dei processi dell’omeostasi corporea).
Possiamo dividere gli effetti dei glicocorticoidi in 2 tipi:
- fisiologici ad azione lenta (genomici): richiedono diverse ore (4-8 ore) e prevedono la sintesi di proteine (enzimi, proteine regolatrici) o la loro inibizione (ACTH ipofisaria);
- farmacologici ad azione rapida (non genomici): richiedono pochi minuti (reazione da stress), come per la defosforilazione della lipocortina 1 (proteina con attività anti-infiammatoria).
Possiamo così riassumere gli effetti dei glicorticoidi
- metabolici (genomici):
- attività gluconeogenica, anti-insulinica e lipolitica a digiuno, mentre lipido-sintetica in condizione di iperinsulinemia;
- attività proteolitica prevalente in tessuti extra-epatici;
- inibizione dell’assorbimento intestinale di calcio, con aumento dell'escrezione renale di calcio e fosforo;
- mineralcorticoide con ipocaliemia in caso di ipercortisolismo;
- cardiovascolari (non genomici):
- modulano la pressione arteriosa con azione mineralo-attiva e sui recettori adrenergici;
- a livello cardiaco azione inotropa, cronotropa e dromotropa positiva;
- polmonari (genomici e non): stimolano la formazione del surfattante alveolare e potenziano l’effetto delle catecolamine sui recettori β2;
- cerebrali (genomici e non): regolano l’attività di neurotrasmettitori adrenergici e serotoninergici, partecipando alla modulazione di attività psichiche e comportamentali;
- endocrini (genomici): riducono la risposta ipofisaria stimolata di GH, TSH, LH, ACTH; riducono della secrezione testicolare basale o stimolata di T;
- anti-infiammatori (non genomici): bloccano la liberazione di amine vasoattive dai mastociti, bloccano la sintesi di prostaglandine, leucotreni e citochine, riducono la liberazione di enzimi lisosomiali;
- immuno-soppressivi (genomici): inibiscono l’espressione degli antigeni di superficie di classe II del complesso maggiore di istocompatibilità sui monociti e macrofagi; inibiscono la sintesi di interleuchine e interferoni con ridotta cooperazione dei linfociti T e B (2).
Azioni dell’aldosterone
Gli effetti dei mineralcorticoidi vengono divisi in genomici e non e in renali ed extra-renali:
- renali (tubulo renale distale)(genomici):
- attivazione e aumento del numero delle pompe sodiche ATP-dipendenti site sul versante ematico della membrana cellulare;
- permeabilizzazione del versante tubulare della membrana cellulare (maggior substrato per l’attività della pompa);
- incremento dell'energia (ATP) per la pompa.
- extra-renali (genomici):
- attivazione della pompa sodica a livello del colon, con eliminazione intra-luminale di potassio;
- induzione di ipertrofia cardiaca e fibrosi nei soggetti con scompenso cardiaco, inibita dall’azione di anti-aldosteronici (spironolattone);
- up-regulation dei recettori dell'angiotensina II a livello delle arterie di resistenza (2).
Tra i meccanismi non genomici, cioè non inibiti dallo spironolattone, ricordiamo:
- l’attivazionedell’afflusso di ioni calcio nelle cellule muscolari lisce arteriose;
- l’attivazione della pompa sodio-potassio nelle cellule miocardiche tramite l'ausilio della protein-chinasi calcio/lipide-dipendente.
Azioni degli androgeni surrenali
Sebbene durante la vita presentino una significativa variazione nella concentrazione ematica (aumento alla pubertà, con declino progressivo con l'invecchiamento, prevalente nella donna), il ruolo fisiologico degli androgeni surrenalici (DHEA(S), androstenedione e androstendiolo) rimane ad oggi del tutto oscuro. Sono definiti deboli, in quanto non presentano un'azione propria androgenica, poiché non hanno un loro specifico recettore, ma la loro attività androgenica si esplica attraverso la conversione in androgeni forti (Testosterone e DHT) a livello dei tessuti sensibili. Tutte le esperienze cliniche di terapia sostitutiva con DHEA come ormone anti-vecchiaia sono risultate deludenti (3).
Bibliografia
- Lazar MA. Mehanism of action of hormones that act on nuclear receptor. In: Williams Textbook of Endocrinology, Kronerberg, Melmed, Polonsky and Larsen eds, 11th Edition, Saunders 2008: 37-46.
- Stewart PM. The Adrenal Gland. In: Williams Textbook of Endocrinology, Kronerberg, Melmed, Polonsky and Larsen eds, 11th Edition, Saunders 2008: 445-503.
- Davis SR, Paniari M, Stanczyk F. DHEA replacement for menopausal women. J Clin Endocrinol Metab 2011, 96: 1642-53.
Asse CRH-ACTH-surreni
Giuseppe Reimondo
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
L’asse ipotalamo-ipofisi-surrene (hypothalamic pituitary adrenal, HPA) è un sistema neuroendocrino di trasduzione-amplificazione di segnali dal cervello alla periferia, che rappresenta il punto chiave della stretta integrazione fra i sistemi endocrino, nervoso e immune e costituisce uno dei più importanti sistemi di adattamento: la sua attivazione permette di rispondere efficacemente a condizioni di stress, ma la sua inattivazione risulta altrettanto importante, in quanto espone l’organismo a un eccesso di mediatori endocrini, nervosi e immuni dello stress, che determina diverse condizioni patologiche (1).
La stazione ipotalamica di controllo dell’asse HPA è costituita dai nuclei paraventricolari (PVN), i quali producono il corticotropin releasing hormone (CRH) e l’arginin-vasopressina (AVP). La presenza di CRH è stata anche riscontrata in regioni extra-ipotalamiche, nel sistema limbico.
Sono stati identificati due diversi recettori per il CRH: il CRH-R1, quasi totalmente localizzato a livello dell’ipofisi anteriore, e il CRH-R2, localizzato prevalentemente a livello periferico.
La produzione di CRH è inserita in una rete regolatoria complessa costituita da neuro-trasmettitori, neuro-peptidi, citochine e ormoni: le catecolamine e il neuropeptide Y (NPY) sembrano avere un ruolo stimolatorio sulla sua secrezione. Le interazioni funzionali di NPY-catecolamine-CRH indicano il ruolo chiave dei rapporti fra sistema HPA e sistema simpato-adrenergico (1).
Nell’organizzazione fortemente gerarchica dell’asse HPA, la seconda tappa, a livello ipofisario, è rappresentata dalla liberazione di ACTH determinata dall’azione del CRH. L’ACTH è un peptide di 39 aminoacidi, che deriva dal clivaggio di un precursore proteico, la pro-opiomelanocortina (POMC). Le funzioni cellulari attivate dall’ACTH includono, oltre alla steroidogenesi, anche la proliferazione cellulare. La sensibilità surrenalica all’azione dell’ACTH è molto elevata. L’azione di stimolo è bifasica: una risposta rapida in caso di stress, attraverso l’immediata liberazione in circolo di steroidi provenienti da un pool di pronto rilascio; contemporaneamente, si attiva la neosintesi a partire dal colesterolo, che può richiedere da pochi minuti a qualche ora (2).
Nelle condizioni di stress prolungato si osserva la cronicizzazione dell’effetto dell’ACTH, con iperplasia cellulare che si accompagna ad un effetto angiogenetico e all’incremento del tessuto stromale. L’effetto cronico dell’ACTH modifica la produzione ormonale del cortico-surrene, privilegiando la sintesi glicocorticoide a scapito di quella androgenica (e non raramente di quella di aldosterone) (2).
I PVN sono anche la sede dove si integrano le attività oressanti e anoressanti con quelle di altri fattori di controllo del comportamento alimentare e della spesa energetica, quali leptina, GHrelin e GH-secretagoghi che hanno effetto stimolatorio sull’asse HPA.
L’asse HPA è ricco di meccanismi di autocontrollo, il più noto dei quali è esercitato dal cortisolo a livello dei nuclei paraventricolari e dell’ipofisi anteriore per controllare la produzione e il rilascio di CRH e ACTH. L’asse HPA riceve anche importanti segnali di feed-back da altre aree cerebrali quali ippocampo e amigdala.
I complessi meccanismi modulatori rendono conto dell’alta variabilità dei livelli circolanti di glicocorticoidi, sia in relazione alle fluttuazioni spontanee del ritmo circadiano, sia alle risposte a condizioni di stress. Oltre il 70% della produzione giornaliera di ACTH e cortisolo è fisiologicamente concentrata nelle otto ore successive alla mezzanotte. I picchi ormonali sono più frequenti e di maggiore ampiezza nelle ore notturne e nelle prime ore del mattino. Si contano complessivamente 15-18 picchi secretori. Anche il CRH è rilasciato in modo pulsatile con un ritmo circadiano, con caratteristiche secretorie apparentemente dissociate temporalmente dal ritmo del cortisolo (3-5).
Al di là dei complessi meccanismi regolatori, l’interpretazione più stimolante del ritmo circadiano ipofiso-surrenalico è che la fase di salita notturna e del mattino rifletta un quotidiano stress fisiologico, finalizzato ad accrescere le potenzialità di difesa dell’organismo e ad aumentare la sicurezza di sé. Questa up-regulation nei confronti dell’ambiente esterno condurrebbe ad una migliore possibilità di sopravvivenza e di affermazione. Nella successiva fase di discesa, di riposo e di ricarica, che si estende circa da mezzogiorno a mezzanotte, l’organismo è geneticamente programmato a ricevere una minore quantità di glicocorticoidi. La centrale operativa ipotalamica, se sollecitata in modo critico per fronteggiare un evento stressante nella fase di riposo, lo può fare con appropriata intensità, ma solo se l’evento è singolo e casuale. Quando lo stress è ripetitivo o di durata prolungata, il sistema risponde in maniera sempre meno efficiente. In sintesi, l’organizzazione circadiana è essenziale per allenare l’organismo a risposte neuroendocrine di tipo fasico, mentre le risposte di tipo tonico non sono fisiologiche. Il passaggio da fasico a tonico è, pertanto, anche il passaggio da fisiologico a patologico. È infatti noto come gli stress che sopravvengono lontano dalla fisiologica acrofase circadiana e gli stress prolungati nel tempo sono a maggior rischio di implicazioni patologiche (3-5).
Bibliografia
- Tsigos C, Chrousos GP. Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress. J Psychosom Res 2002, 53: 865–71.
- Hauger RL, Datzenberg FM. Regulation of the stress response by corticotropin-releasing factor receptors. In: Conn PM, Freeman ME, eds. Neuroendocrinology in physiology and medicine. Totowa: Humana Press 2000: 261–87.
- Arborelius L, Owens MJ, Plotsky PM, Nemeroff CB. The role of corticotropin-releasing factor in depression and anxiety disorders. J Endocrinol 1999, 160: 1–12.
- Ferrari E, Cravello L, Muzzoni B, et al. Age-related changes of the hypothalamic-pituitary-adrenal axis: pathophysiological correlates. Eur J Endocrinol 2001, 144: 319-29.
- Buckley TM, Schatzberg AF. On the interactions of the hypothalamic-pituitary-adrenal (HPA) axis and sleep: normal HPA axis activity and circadian rhythm, exemplary sleep disorders. J Clin Endocrinol Metab 2005, 90: 3106–14.
Asse renina-angiotensina-aldosterone
Anna Pia
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
Il sistema renina-angiotensina-aldosterone (SRAA) è un meccanismo ormonale "a cascata", deputato al controllo della pressione arteriosa attraverso la regolazione dell'equilibrio idro-elettrolitico e del tono della muscolatura vascolare arteriosa (1).
La renina è un enzima glicoproteico circolante prodotto dalle cellule dell’apparato iuxta-glomerulare, situato a livello dell’arteriola afferente del glomerulo renale. Aumenta in risposta ai seguenti stimoli:
- riduzione del volume plasmatico circolante (ipovolemia o ipotensione);
- alterazioni elettrolitiche (iposodiemia in particolare);
- stimoli da parte del sistema nervoso simpatico.
La renina converte un peptide inattivo, l’angiotensinogeno (prodotto dal fegato) in angiotensina I. A sua volta quest’ultimo peptide viene convertito in angiotensina II da un enzima (ACE, angiotensin-converting enzyme), presente principalmente a livello dei capillari polmonari. L’angiotensina II è il principale prodotto bioattivo del sistema SRAA, con azione ormonale endocrina, ma anche autocrina e paracrina. È un potente vasocostrittore, con azione diretta a livello arteriolare. A livello renale, determina vasocostrizione delle arteriole efferenti del glomerulo, con conseguente effetto di aumento della pressione arteriosa sistemica e della pressione di filtrazione glomerulare. Nella corticale del surrene l’angiotensina II determina il rilascio dell’aldosterone (1).
L’aldosterone è un ormone di natura steroidea, prodotto nella zona glomerulare del corticosurrene. La sua secrezione è stimolata principalmente dal sistema SRAA e dall’iperpotassiemia e inibita dall’ipopotassiemia. L’aldosterone agisce attraverso i recettori per i mineralcorticoidi espressi a livello epiteliale, prevalentemente a livello dei tubuli renali (ansa di Henle e tubulo contorto distale), favorendo il riassorbimento di sodio e acqua dall’urina; nel contempo, per un fenomeno di scambio, potassio e idrogenioni vengono secreti nel tubulo. L’aldosterone agisce anche sul sistema nervoso centrale, inducendo il senso della sete e facilitando il rilascio dell’ormone antidiuretico dall’ipotalamo. L’effetto comune di questi meccanismi è quello di aumentare la volemia e quindi la pressione arteriosa. La letteratura più recente ha inoltre studiato gli effetti extra-renali dell'aldosterone, che contribuiscono al danno cardiovascolare e alle complicanze metaboliche mediate dai recettori dei mineralcorticoidi, attraverso meccanismi d'azione indipendenti dalla pressione arteriosa (2). L’aldosterone, ma anche l’angiotensina II, è in grado di determinare un rimodellamento della muscolatura di vasi e cuore, provocando iperplasia dei miocardiociti e delle cellule muscolari lisce dei vasi (3); inoltre l'aldosterone agisce anche a livello di adipociti (4) e macrofagi (5). Proprio l'attivazione dei recettori dei mineralcorticoidi a livello dell'endotelio, delle cellule muscolari lisce vascolari, dei macrofagi e degli adipociti favorirebbe i processi infiammatori che portano poi a fibrosi e al conseguente danno d'organo, non solo renale, ma anche vascolare e cardiaco (2).
Bibliografia
- Carey RM. Primary aldosteronism. J Surg Oncol 2012, 106: 575-9.
- Nguyen Dinh Cat A, Jaisser F. Extrarenal effects of aldosterone. Curr Opin Nephrol Hypertens 2012, 21: 147-56.
- Sechi LA, Colussi G, Di Fabio A, Catena C. Cardiovascular and renal damage in primary aldosteronism: outcomes after treatment. Am J Hypertens 2010, 23: 1253-60.
- Marzolla V, Armani A, Zennaro MC, et al. The role of the mineralocorticoid receptor in adipocyte biology and fat metabolism. Mol Cell Endocrinol 2012, 350: 281-8.
- Bienvenu LA, Morgan J, Rickard AJ, et al. Macrophage mineralocorticoid receptor signaling plays a key role in aldosterone-independent cardiac fibrosis. Endocrinology 2012, 153: 3416-2.
Diagnostica ormonale del corticosurrene
Indagini basali
Test dinamici
- per l'ipersecrezione ACTH-cortisolo
- test con desametasone
- prelievi notturni (sangue e saliva)
- test con CRH
- test con CRH + desametasone
- test con desmopressina
- cateterismo dei seni petrosi
- per il deficit ACTH-cortisolo
- test con ACTH
- ipoglicemia insulinica
- per l'iperaldosteronismo
- test con fludrocortisone
- test con carico salino ev
- test con captopril
- cateterismo selettivo delle vene surrenaliche
- per le SAG
- test con ACTH per 17OHP
Valutazione renina e aldosterone
Anna Pia
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
| Alterazioni delle concentrazioni di renina | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche |
Postura eretta
Nefropatia interstiziale cronica Ipertensione arteriosa essenziale (ad elevata renina) Ipertensione maligna Cirrosi epatica Scompenso cardiaco congestizio Sindrome nefrosica Sindrome di Bartter Tumori secernenti renina Insufficienza corticosurrenalica primitiva |
|
| Modificazioni farmaco-indotte | ß-bloccanti Clonidina Liquirizia FANS Steroidi |
Diuretici Sartani ACE-inibitori Calcio-antagonisti diidro-piridinici SSRI Diuretici dell’ansa Abuso di lassativi Bloccanti della renina (aliskiren) Spironolattone, Eplerenone |
| Alterazioni delle concentrazioni di aldosterone | ||
| Diminuite da | Aumentate da | |
| Cause fisiopatologiche |
Espansione della volemia effettiva:
Malattia di Addison Deficit cronico di ACTH (effetto modesto) Deficit cronico di secrezione reninica (ipoaldosteronismo iporeninemico da diabete, ecc) Pre-eclampsia Deficit enzimatici surrenalici |
Gravidanza
Ipersecrezione di renina associata ad ipertensione arteriosa:
Ipersecrezione di renina non associata ad ipertensione arteriosa:
|
| Modificazioni farmaco-indotte | ß-bloccanti ACE-inibitori (effetto acuto) Sartani (effetto acuto) Liquirizia FANS Clonidina Aminoglutemide Chetoconazolo Steroidi Eparine |
Abuso di lassativi Diuretici tiazidici e dell’ansa (furosemide, acido etacrinico) Diuretici anti-aldosteronici, eplerenone Estro-progestinici Dopamino-agonisti (effetto acuto) SSRI |

Rapporto Aldosterone/Renina
Anna Pia e Soraya Puglisi
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
(aggiornato al 28 gennaio 2020)
| Rapporto Aldosterone/Renina (ARR) | |
| Indicazioni | Consigliabile nei pazienti affetti da:
Familiarità per iperaldosteronismo primitivo. L’ipopotassiemia non è una condizione necessaria per effettuare lo screening. |
| Meccanismo d’azione | La valutazione dell’ARR si basa sull’aspetto fisiopatologico peculiare dell’iperaldosteronismo primario, caratterizzato dall’ipersecrezione autonoma di aldosterone, con conseguente soppressione cronica della renina e dell’attività retinica (PRA). Tale assetto bio-umorale viene particolarmente evidenziato dalla contemporanea determinazione dei due ormoni e dal calcolo del loro rapporto. Il razionale del test è quello di amplificare il comportamento divergente dei due ormoni: nei pazienti con iperaldosteronismo primitivo, l’aldosterone plasmatico (il numeratore del rapporto) è aumentato e questo, attraverso un feed-back negativo, sopprime la produzione di renina (il denominatore del rapporto). La valutazione dei singoli parametri può in effetti risultare inadeguata, in quanto la renina/PRA può essere soppressa in varie altre condizioni ipertensive, così come possono essere invece variabili i livelli di aldosterone: per esempio, nell’ipertensione nefro-vascolare sia PRA che aldosterone sono elevati, mentre sono entrambi ridotti nelle ipertensioni da eccesso di mineralcorticoidi diversi dall’aldosterone o in corso di assunzione di sostanze ad azione simil-mineralcorticoide. Inoltre, l’ARR permette di evidenziare modeste elevazioni dell’aldosterone, ancora nei limiti di norma ma inappropriatamente elevate per i ridotti livelli di renina. |
| Contro-indicazioni | Nessuna. |
| Relazione con età, sesso, peso corporeo, gravidanza | Le popolazioni afro-americane hanno ridotti livelli di PRA e aldosterone, perciò dovrebbero essere utilizzati cut-off specifici. Spesso nella popolazione anziana e nei pazienti con IRC, la PRA è inibita (con valori < 0.6 ng/mL/h), determinando falsi positivi; anche negli obesi si possono riscontrare valori di PRA ridotti, mentre i valori aumentano durante la gravidanza. |
| Precauzioni |
Nel paziente con difficile controllo pressorio, è possibile utilizzare alcuni farmaci anti-ipertensivi con minori effetti sul sistema renina-angiotensina-aldosterone: verapamil slow-release, idralazina, prazosina, doxazosina, terazosina.
|
| Esecuzione |
|
| Possibili effetti collaterali | Nessuno. |
| Valutazione risultati |
La renina può essere dosata come attività reninica plasmatica (PRA) oppure come renina diretta (DRC). Il sospetto di iperaldosteronismo primario è tanto maggiore quanto più la PRA è soppressa (< 1 ng/mL/h) o la DRC è ridotta (< 8 mUI/L), in presenza di valori di aldosterone elevati (> 15-20 ng/dL). Non esiste unanimità circa il cut-off di ARR, che dovrebbe essere stabilito in base all’apporto sodico della dieta della popolazione locale e alle caratteristiche del dosaggio di PRA nel singolo laboratorio, in particolare il minimo valore misurabile di PRA. L’adozione di diversi livelli di cut-off può modificare sensibilità e specificità del test di screening. |
| Interpretazione | L'ARR viene generalmente considerato positivo se > 30-50 (misurando l’aldosterone in ng/dL e la PRA in ng/mL/h) oppure > 3.7 (misurando l’aldosterone in ng/dL e la renina in mU/L). Non c’è tuttavia consenso circa il potere diagnostico del test: sensibilità 64-100% e specificità 87-100%. Sensibilità e specificità del test infatti sono condizionate dal valore scelto come cut-off: alcuni autori considerano positivo un valore di ARR > 20, aumentando la sensibilità, ma inevitabilmente riducendo la specificità del test; quando si considera, ad esempio, un cut-off pari a 40, la specificità del test è circa dell'85%, con un valore predittivo positivo dell'80%. |
| Attendibilità e ripetibilità dei risultati | Poiché l’ARR ha una grande variabilità, sia per problemi analitici che pre-analitici, è consigliabile ripetere il dosaggio almeno due volte. Il cut-off dell’ARR è fortemente influenzato dal metodo di dosaggio della renina (DRC o PRA) e dall’unità di misura con cui viene espresso l’aldosterone (ng/dL o pg/mL o pmol/L). Attualmente è sempre più diffuso il dosaggio della DRC, in quanto si effettua con metodo immuno-enzimatico e, rispetto al dosaggio della PRA, è un dosaggio automatizzato, meno operatore-dipendente, meno costoso, più rapido (> 150 campioni/h) e con un miglior confronto inter-assay. Il valore della DRC presenta una maggior ampiezza nell’intervallo di normalità, ma sembra esistere una buona correlazione tra valori di renina attiva e di PRA (1 ng/mL/h di PRA corrisponde a 8.2 mU/L di DRC). Il fattore di conversione tra DRC e PRA può essere validato nei singoli laboratori, ma l’applicazione dei fattori di conversione è sconsigliato nel calcolo dell’ARR: è meglio valutare il rapporto tra aldosterone e DRC con appropriato cut-off di riferimento. In generale comunque, quando si usa il dosaggio di DRC, il riscontro di valori di renina diretta vicini ai limiti inferiori di norma in due successive determinazioni, in concomitanza con concentrazioni di aldosterone > 15 ng/dL, è sospetto per l’esistenza di iperaldosteronismo primitivo. |
| Giudizio complessivo costo beneficio e costo-efficacia | È un test dotato di elevati rapporti costo-beneficio e costo-efficacia, e rappresenta l’indagine di screening più affidabile. |
| Bibliografia |
|
Test di soppressione con fludrocortisone
Anna Pia
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
| Test di soppressione con fludrocortisone | |
| Indicazioni | Conferma della diagnosi di iperaldosteronismo primario. Si effettua nei pazienti con esami di primo livello suggestivi di iperaldosteronismo primario (rapporto Aldosterone (ng/dL)/Attività Reninica Plasmatica (ng/mL/h) > 30-50). |
| Meccanismo d’azione | La somministrazione di un mineralcorticoide esogeno (fludrocortisone) inibisce l’attività di stimolo del sistema renina-angiotensina endogeno sulla sintesi e secrezione di aldosterone, con una riduzione dei livelli circolanti dell’ormone. Una mancata inibizione dell’aldosteronemia è indicativa di un’ipersecrezione primaria di aldosterone. |
| Controindicazioni | Ipertensione severa Insufficienza cardiaca congestizia Ictus Infarto miocardico, FA Ipopotassiemia Insufficienza renale (creatininemia > 1.5 mg/dL o creatinina clearance < 30 mL/min) |
| Precauzioni | Durante tutto il test è necessario un monitoraggio stretto della pressione e della potassiemia. È opportuna una supplementazione preventiva di potassio per os. |
| Condizioni preliminari | Sospensione dei farmaci interferenti sulla secrezione di aldosterone (diuretici, ß-bloccanti, ACE-inibitori, sartani, antagonisti recettoriali dell’aldosterone) Correzione dell’eventuale ipopotassiemia Compenso pressorio (usando α-bloccanti e calcio-antagonisti) |
| Esecuzione |
|
| Possibili effetti collaterali | Ipopotassiemia (controllo della potassiemia almeno due volte al giorno), rialzo dei valori pressori |
| Interpretazione | Un valore di aldosteronemia al termine del test > 6 ng/dL è indicativo di iperaldosteronismo primario se, al termine del test, la PRA risulta < 1 ng/mL/h, i livelli di cortisolo alle h 10.00 sono minori di quelli registrati alle h 08.00 e il potassio è nei limiti. |
| Attendibilità e ripetibilità dei risultati | È storicamente considerato il gold standard tra i test di conferma nella diagnosi di iperaldosteronismo primario, sebbene sia stato estensivamente impiegato in pochi centri e non esistano dati affidabili sulla sua predittività. |
| Giudizio complessivo costo beneficio e costo-efficacia | Il test presenta costi elevati, in quanto richiede l’ospedalizzazione per il rischio di grave ipopotassiemia e importante rialzo dei valori pressori. Per tale motivo e per la mancanza di una chiara superiorità in termini di potere diagnostico, questo test è stato sostituito nella maggior parte dei Centri dal test con infusione salina. |
| Bibliografia |
|
Test da carico acuto salino endovenoso
Anna Pia
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
| Test da carico acuto salino endovenoso | |
| Indicazioni | Conferma della diagnosi di iperaldosteronismo primario. Si effettua nei pazienti con esami di primo livello suggestivi di iperaldosteronismo primario: rapporto Aldosterone (ng/dL)/Attività Reninica Plasmatica (ng/mL/h) > 30-50. |
| Meccanismo d’azione | La rapida espansione del volume circolante riduce l’attività dello stimolo del sistema renina-angiotensina sulla sintesi e secrezione di aldosterone, che rapidamente riduce i suoi livelli circolanti. Una mancata riduzione dell’aldosteronemia è indicativa di ipersecrezione primaria di aldosterone. |
| Controindicazioni | Ipertensione severa Storia di scompenso cardiaco congestizio Insufficienza renale (creatininemia > 1.5 mg/dL o creatinina clearance < 30 mL/min) |
| Precauzioni | È opportuno che i valori pressori durante il test non siano superiori a 160/100 mmHg |
| Condizioni preliminari | Sospensione dei farmaci interferenti sulla secrezione di aldosterone (diuretici, ß-bloccanti, ACE-inibitori, sartani, antagonisti recettoriali dell’aldosterone) Correzione dell’eventuale ipopotassiemia Compenso pressorio (usando α-bloccanti e calcio-antagonisti) Apporto sodico dietetico libero |
| Esecuzione |
|
| Possibili effetti collaterali | Attenzione ai livelli pressori |
| Interpretazione | Il test viene considerato positivo (diagnostico di iperaldosteronismo primario) se i valori di aldosterone alla fine dell’infusione risultano > 10 ng/dL, negativo quando i valori di aldosterone risultano < 5 ng/dL. Livelli plasmatici di aldosterone compresi tra 5 e 10 ng/dL sono “non determinati”, ossia costituiscono una “zona grigia” tra ipertensione essenziale a bassa renina e iperaldosteronismo primitivo. La maggior parte degli autori sembra comunque concorde nel considerare questi pazienti come affetti da iperaldosteronismo primitivo, più spesso sostenuto da un’iperplasia surrenalica bilaterale che da un adenoma. |
| Attendibilità e ripetibilità dei risultati | Sensibilità e specificità di circa il 75%. L’accuratezza diagnostica è maggiore nel riconoscere l’adenoma. Vi sono dati contrastanti circa l’effetto della variazione individuale nell’apporto salino sui risultati del test. |
| Giudizio complessivo costo beneficio e costo-efficacia | E' considerato il test di conferma dotato del miglior rapporto costo-efficacia nella diagnosi biochimica di iperaldosteronismo primario. Comunque, l’accuratezza diagnostica è solo moderata, anche utilizzando i cut-off ottimali in centri di ricerca, per la sovrapposizione dei risultati tra pazienti che hanno o meno la malattia. Il test è più efficace nell’escludere, piuttosto che confermare, l’iperaldosteronismo. |
| Bibliografia |
|
Test con captopril
Anna Pia
Dipartimento di Scienze Cliniche e Biologiche, Medicina Interna 1 a Indirizzo Endocrinologico, AOU San Luigi di Orbassano, Università di Torino
| Test con captopril | |
| Indicazioni | Pazienti affetti da ipertensione ed ipopotassiemia, che non possono tollerare l’espansione acuta del volume plasmatico, previa esclusione di iperaldosteronismo secondario (ipertensione nefrovascolare) e di ipopotassiemia indotta da altre cause |
| Meccanismo d’azione | Il captopril inibisce l’azione dell’ACE e quindi la conversione enzimatica di angiotensina I in angiotensina II. Se somministrato a pazienti con normale sistema renina-angiotensina, il captopril determina una riduzione della produzione di angiotensina II e di aldosterone e un incremento del rilascio di renina (per il venir meno del feed-back negativo). È stato suggerito che il captopril abbia un effetto minimo o nullo sulla secrezione di aldosterone e/o di renina nei pazienti con produzione autonoma di aldosterone e possa, quindi, essere utilizzato per differenziare l’iperaldosteronismo primitivo dall’ipertensione essenziale |
| Controindicazioni | Ipersensibilità al farmaco Gravidanza Ipotensione Disidratazione Stenosi bilaterale dell’arteria renale |
| Relazione con età, sesso, peso corporeo, gravidanza | Le popolazioni afro-americane hanno ridotti livelli di PRA e aldosterone, perciò dovrebbero essere utilizzati cut-off specifici |
| Precauzioni | Anziani, pazienti con modesto aumento dei valori pressori (eventualmente utilizzare 25 mg anziché 50 mg) |
| Condizioni preliminari | Sospensione da almeno 4-6 settimane dei diuretici o antagonisti del recettore per i mineralocorticoidi. Riduzione progressiva di ß-bloccanti, ACE-inibitori o sartani, e clonidina, fino alla sospensione alcune settimane prima del test. Possono essere mantenuti α-bloccanti (doxazosina) e/o calcio-antagonisti (verapamil in formulazione a lenta cessione), al fine di controllare le ipertensioni severe. Il regime dietetico prevede un apporto di 120-130 mmoL/die di sodio e 70-80 mmoL/die di potassio. |
| Esecuzione |
|
| Possibili effetti collaterali | Ipotensione |
| Interpretazione | Un valore di ARR > 30 è stato proposto quale cut-off per la diagnosi di iperaldosteronismo primitivo. Un cut-off di aldosteronemia post-captopril di 14-16 ng/dL avrebbe la migliore accuratezza diagnostica nell’identificare l’iperaldosteronismo, e in particolare l’adenoma. Quando utilizzato come test di conferma, la sua efficacia diagnostica è paragonabile al test con infusione salina, sebbene quest’ultimo appaia leggermente superiore in alcuni studi |
| Attendibilità e ripetibilità dei risultati | Vi sono dati contrastanti circa l’effetto sul risultato del test della variazione individuale nell’apporto salino, come accade in pazienti in cui tale apporto non sia opportunamente standardizzato |
| Giudizio complessivo costo beneficio e costo-efficacia | Il test presenta vantaggi in termini di costi e tempi, in quanto un test positivo non richiede ulteriori test di conferma (come il carico salino). Il test è ben tollerato e applicabile in situazioni che controindicano l’esecuzione del carico salino (come l’ipertensione severa o l’insufficienza cardiaca ). Il cut-off ottimale è ancora oggetto di discussione e vi è maggiore esperienza con l’infusione salina; pertanto quest’ultimo viene solitamente preferito come test di conferma al captopril, che viene raccomandato solo in pazienti nei quali il carico salino o la somministrazione di fludrocortisone siano controindicati. Comunque, l’accuratezza diagnostica è solo moderata, anche utilizzando i cut-off ottimali in centri di ricerca, per la sovrapposizione dei risultati tra pazienti che hanno o meno la malattia. Il test è più efficace nell’escludere, piuttosto che confermare, l’iperaldosteronismo. |
| Bibliografia |
|
Test con ACTH per 17OHP
Pina Lardo & Antonio Stigliano
Dipartimento di Medicina Clinica e Molecolare - Ospedale Sant'Andrea - Facoltà di Medicina e Psicologia, "Sapienza" Università di Roma
(aggiornato al 29/3/2020)
| Test con ACTH per 17OHP | |
| Indicazioni | Valutazione della risposta del 17OHP e di altri steroidi precursori per confermare la presenza di un difetto enzimatico, qualora i livelli basali non siano diagnostici. |
| Meccanismo d’azione | L’ACTH stimola il corticosurrene a secernere cortisolo ed i metaboliti intermedi della biosintesi steroidogenetica. Dosi farmacologiche di ACTH possono svelare la presenza di blocchi nelle vie di sintesi steroidee, con incremento degli steroidi a monte della tappa enzimatica coinvolta. |
| Controindicazioni | Nessuna. |
| Materiale necessario per l’esecuzione | ACTH (Synachten) fl 250 μg. |
| Relazione con età, sesso, peso corporeo | Nessuna. |
| Criticità | Sospensione eventuale terapia glucococorticoidea e/o estroprogestinica. |
| Condizioni preliminari | Fase follicolare precoce, al mattino, digiuno. |
| Esecuzione |
|
| Possibili effetti collaterali | Entro il primo minuto dal bolo ev di ACTH possibili flushing, lieve nausea, cefalea, in una percentuale limitata di soggetti. Non sono state descritte reazioni allergiche all’ACTH. |
| Parametri da monitorare durante l’esecuzione | Pressione arteriosa, frequenza cardiaca. |
| Manovre da eseguire dopo la fine del test | Nessuna. |
| Valutazione risultati | Valori di 17OHP < 1000 ng/dL (30 nmol/L) escludono la diagnosi. |
| Attendibilità e ripetibilità dei risultati | Solo in presenza di valori basali < 200 ng/dL (< 6 nmol/L). |
| Giudizio complessivo costo-beneficio e costo-efficacia | LC/Tandem metodica più sensibile; immunometria più vantaggiosa economicamente ma con minor sensibilità. |
| Bibliografia |
|

