Genetica
Anatomia del pancreas
Vincenzo Triggiani
Endocrinologia e Malattie Metaboliche, Dipartimento Interdisciplinare di Medicina, Università degli Studi di Bari “Aldo Moro”
Il pancreas è una voluminosa ghiandola, con duplice funzione esocrina ed endocrina, annessa all’apparato digerente, avente forma allungata in senso trasversale e appiattita in senso sagittale, situata in posizione mediana, all’altezza delle prime due vertebre lombari, nello spazio retro-peritoneale, in corrispondenza della regione epigastrica. Presenta una guaina connettivale, dalla quale originano sottili setti che suddividono il parenchima in lobuli. Misura 12-15 cm in lunghezza, 4 cm in altezza e 1.5-2 cm in spessore, mentre il peso è di 70-110 g.
È possibile suddividerlo in tre porzioni.
- La testa, la parte più voluminosa, accolta all’interno della “C” duodenale, che si prolunga inferiormente nel processo uncinato; è rivestita anteriormente dal peritoneo ed è in rapporto con la parte pilorica dello stomaco e la parte superiore del duodeno. Posteriormente è rivestita dalla fascia retro-pancreatica, che la separa dal coledoco, dalla vena porta e dalla vena cava inferiore. La zona di passaggio tra testa e corpo è denominata istmo pancreatico.
- Il corpo, leggermente obliquo dal basso verso l'alto, contrae rapporto anteriormente con il peritoneo della borsa omentale e con la parete posteriore dello stomaco. Posteriormente è rivestito dalla fascia retro-pancreatica ed è in rapporto con la vena mesenterica superiore, l’aorta, la ghiandola surrenale e il rene sinistro.
- La coda si estende fino alla faccia gastrica della milza e posteriormente è in rapporto con il rene sinistro, ed è collegata all’ilo della milza dal legamento pancreatico-lienale.
Il pancreas è irrorato dalle arterie pancreatico-duodenali superiori e inferiori, che provengono dall’arteria celiaca, e da vasi che originano dall’arteria splenica. Il drenaggio venoso è tributario del sistema portale: le vene pancreatiche drenano corpo e coda e sboccano nella vena splenica; le vene pancreatico-duodenali sboccano nella vena splenica o direttamente nella vena porta. La rete linfatica, particolarmente ricca, drena nei linfonodi pancreatico-lienali e celiaci.
L’innervazione efferente è sotto il controllo vagale, mentre le vie afferenti decorrono lungo i nervi splancnici.
La componente esocrina rappresenta circa l’80% della ghiandola. Le subunità funzionali del pancreas esocrino sono gli acini, delimitati da cellule secernenti. Nel lume acinare si raccoglie il secreto, che poi fluisce nei dotti intra-lobulari e quindi nei dotti inter-lobulari, che sboccano a loro volta nel dotto pancreatico principale di Wirsung. Questo inizia in corrispondenza della coda e percorre tutta la ghiandola, aumentando di calibro, si unisce al coledoco, per poi sboccare a livello della seconda porzione del duodeno, in corrispondenza della papilla duodenale maggiore (di Vater), attraverso lo sfintere di Oddi. Dal dotto principale origina a livello dell’istmo il dotto pancreatico accessorio (di Santorini) che attraversa la testa del pancreas per sfociare nel duodeno in corrispondenza della papilla duodenale minore, circa 2 cm sopra l’ampolla di Vater.
Il succo pancreatico prodotto dalla componente esocrina è costituito da costituenti inorganici, quali acqua, sodio, potassio, cloro e bicarbonato, e costituenti organici, gli enzimi lipasi, amilasi, proteasi, ribonucleasi e desossiribonucleasi, deputati alla digestione dei nutrienti. Per proteggere il pancreas dall’autodigestione, gli enzimi proteolitici sono prodotti in forma inattiva, per poi essere attivati nel lume intestinale.
La componente endocrina rappresenta circa il 2% dell’organo ed è costituita dalle isole di Langerhans, collocate prevalentemente a livello del corpo-coda. Sono costituite da diversi tipi cellulari:
- le cellule α (20%) producono glucagone;
- le cellule β (75%) producono insulina;
- le cellule δ producono somatostatina;
- le cellule PP producono polipeptide pancreatico;
- le cellule ε producono ghrelina.
Bibliografia
- Stranding S. Anatomia del Gray. Le basi anatomiche per la pratica clinica, Ed. Elsevier, 2009.
Fisiologia del metabolismo glucidico
Vincenzo Triggiani
Endocrinologia e Malattie Metaboliche, Dipartimento Interdisciplinare di Medicina, Università degli Studi di Bari “Aldo Moro”
Il glucosio ha una posizione centrale nel metabolismo, sia perché è un eccellente combustibile, sia perché da esso deriva una varietà di composti metabolici intermedi per le biosintesi (figura). Esso può infatti essere:
- utilizzato per la sintesi di polisaccaridi complessi destinati allo spazio extra-cellulare;
- immagazzinato nella cellula sotto forma di glicogeno;
- ossidato a piruvato tramite la glicolisi per produrre ATP e intermedi metabolici;
- ossidato attraverso la via del pentosio-fosfato per produrre ribosio-5-fosfato necessario per la sintesi degli acidi nucleici e NADPH usato per i processi biosintetici riduttivi.
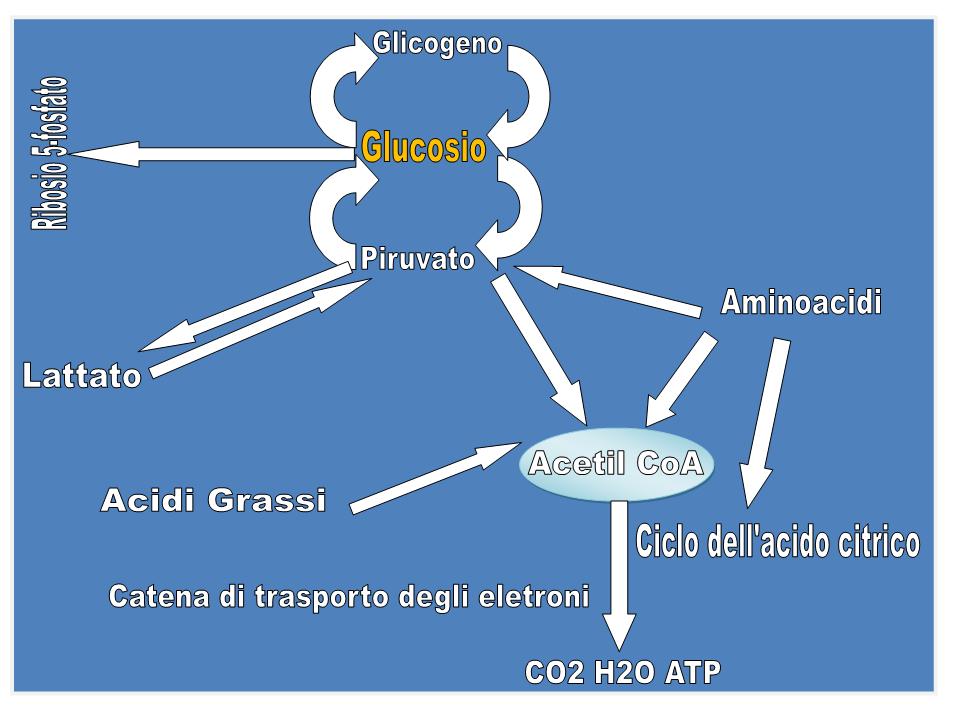
Nella glicolisi, una molecola di glucosio viene degradata, mediante una serie di reazioni citosoliche catalizzate da dieci enzimi, a 2 molecole di piruvato, mentre parte dell’energia rilasciata viene recuperata sotto forma di ATP e NADH. Per ogni molecola di glucosio trasformata in 2 molecole di piruvato la resa netta è di 2 molecole di ATP e 2 di NADH. In condizioni aerobiche, il piruvato viene ossidato ad acetato che entra sotto forma di acetil-CoA nel ciclo di Krebs (ciclo dell’acido citrico), per essere ossidato a CO2, grazie all'intervento del NAD+ e del FAD che si riducono a NADH e FADH2. La catena respiratoria, un complesso sistema ossido-riduttivo, nel processo della respirazione mitocondriale riossida i coenzimi ridotti, trasferendo all'ossigeno gli elettroni sottratti, con formazione di H2O e conservazione dell’energia rilasciata sotto forma di ATP (fosforilazione ossidativa). Quando invece i tessuti non possono essere riforniti di una quantità di O2 sufficiente per ossidare il piruvato e il NADH derivanti dalla glicolisi, come avviene in caso di un esercizio muscolare violento, il NAD+ viene rigenerato dal NADH per mezzo della riduzione del piruvato a lattato che è catalizzata dalla lattato-deidrogenasi. Il lattato viene poi riconvertito in glucosio dal fegato nella fase di recupero dopo l’attività muscolare intensa. Se il lattato è prodotto in grande quantità (ad es. in una corsa veloce), l’acidificazione conseguente alla ionizzazione dell’acido lattico nel muscolo e nel sangue limita la capacità di contrarsi del muscolo stesso. Gli eritrociti, non avendo mitocondri, anche in condizioni di aerobiosi non possono ossidare il piruvato a CO2 e quindi producono lattato. La glicolisi è la sola fonte di energia metabolica per alcuni tessuti come il cervello, la midollare renale, gli eritrociti e gli spermatozoi.
Il glucosio deriva soprattutto dall’amido contenuto nella dieta (cereali e legumi in particolare), mentre il glicogeno contenuto negli alimenti di origine animale (fegato e muscolo) contribuisce in minima parte. L’amido viene attaccato dalle amilasi salivare e soprattutto pancreatica e il glucosio liberato viene assorbito dall’epitelio intestinale e passa nel sangue, stimolando la secrezione pancreatica di insulina, che fa entrare il glucosio nel muscolo e nel tessuto adiposo e stimola sia l’ossidazione del glucosio che la sintesi di glicogeno, mentre inibisce la scissione del glicogeno a glucosio. L’ossidazione di un grammo di glucidi genera all’incirca 4 kcal.
Glucosio deriva anche da disaccaridi, come saccarosio e lattosio. Altri monosaccaridi (fruttosio, galattosio e mannosio) entrano nella glicolisi in punti diversi.
Oltre che da fonti esogene, il glucosio può derivare dalla degradazione del glicogeno endogeno, forma di deposito del glucosio all’interno soprattutto degli epatociti e del muscolo, derivante dall’azione della glicogeno-sintetasi, attivata dall’insulina secreta in risposta al pasto. Il glicogeno muscolare viene demolito dalla glicogeno-fosforilasi muscolare attivata dall’adrenalina, dagli ioni calcio e dal cAMP durante l’attività muscolare e il glucosio liberato viene utilizzato per le esigenze del muscolo stesso in condizioni di aerobiosi o anaerobiosi. Il glicogeno epatico viene degradato dalla glicogeno-fosforilasi, attivata dal glucagone, a glucosio che può passare in circolo per le esigenze dei tessuti, in particolare del sistema nervoso, tra un pasto e l’altro e nel digiuno.
Il fegato (e in minor misura il rene e le cellule dell’epitelio intestinale) può produrre glucosio, oltre che da lattato e piruvato, anche a partire da precursori non glucidici (gluconeogenesi), come il glicerolo e quegli aminoacidi (glucogenici) che possono formare piruvato o altri intermedi del ciclo di Krebs. Il glucosio può essere sintetizzato dai trigliceridi, più esattamente dal glicerolo derivante dalla scissione di questi, ma non dagli acidi grassi, in quanto il catabolismo di questi porta alla formazione di acetil-CoA, che non può essere trasformato in piruvato perché la reazione della piruvato-deidrogenasi è irreversibile. La gluconeogenesi condivide 7 delle 10 tappe della glicolisi, che avvengono in direzione opposta. Essa è energeticamente dispendiosa ma essenziale: la trasformazione di 2 molecole di piruvato in una di glucosio richiede infatti 4 molecole di ATP e 2 di GTP, ma in tal modo viene garantito un adeguato rifornimento di glucosio anche quando non c’è apporto con la dieta e sono state esaurite le riserve di glicogeno.
Una parte del glucosio viene ossidata nella via del pentosio-fosfato, che porta alla sintesi di ribosio-5-fosfato, zucchero fosforilato precursore della sintesi dei nucleotidi (sintesi di acidi nucleici, ATP, NADH, FADH2, CoA) e alla produzione di NADPH, riducente utilizzato per la sintesi di acidi grassi, colesterolo, ormoni steroidei, e per contrastare gli effetti dannosi dei radicali liberi dell’ossigeno.
Bibliografia
- Nelson DL, Cox MM. Introduzione alla biochimica di Lehninger. 4° edizione. Zanichelli Editore.

