Endowiki: aggiornamento continuo di endocrinologia
Per tutti gli operatori di endocrinologia: lo stato dell'arte su clinica e terapia.
Uno strumento semplice e fruibile da tutti coloro che intendono essere sempre aggiornati, promosso dai migliori operatori del settore.
News
Il/la bambino/a normale
Asse GHRH-GH-IGF
Fabio Buzi
SC Pediatria, AO "C. Poma", Mantova
Il GH, il principale regolatore della crescita somatica, viene secreto in maniera pulsatile dalle cellule somatotrope dell’ipofisi anteriore. I regolatori della secrezione pulsatile del GH sono due fattori ipotalamici: il GHRH (GH-Releasing Hormone), stimolatorio, e la Somatostatina (GHRIF, GH-releasing – inhibiting hormone), inibitoria (1).
Il GHRH è un peptide di 44 aminoacidi che si trova in diverse forme circolanti, di cui le principali sono la 1-44 e la 1-40; per l’attività dell’ormone sono necessari almeno i primi 29 aminoacidi; tutte le forme derivano da modificazioni post-traduzionali di un più ampio peptide progenitore (2). Il GHRH agisce attraverso il legame a un recettore (GHRH-R) che fa parte della famiglia di recettori accoppiati a G-protein: il legame di GHRH al suo recettore incrementa i livelli di AMP ciclico intra-cellulare e attraverso una G-protein stimolatoria (Gs) attiva l’adenilato-ciclasi, incrementa il Ca libero intra-cellulare, rilascia GH preformato e stimola la trascrizione di GH mRNA e la sintesi di nuovo GH (3). Mutazioni del GHRH-R nell’uomo sono la causa di rare forme di deficit di GH familiare (4,5).
Un altro ormone secretagogo per il GH è la Ghrelina, prodotta in vari organi oltre che nell’ipotalamo, dove è presente un'elevata espressione del suo recettore (GHSR tipo 1a)(6). Il ruolo di questo secretagogo nella crescita in età evolutiva non è chiaro.
L’ipotalamo del bambino riceve influenze dall’ambiente esterno e da afferenze corticali e sotto-corticali, attraverso i vari neuro-modulatori, neuro-ormoni e neuro-peptidi, come evidente nei casi di c.d. “bassa statura psico-sociale”, dove l’ambiente affettivo del bambino influenza chiaramente la secrezione di GH (il passaggio da un ambiente sfavorevole a uno più favorevole, sia socialmente che affettivamente, porta alla ripresa della crescita staturo-ponderale e a un'aumentata secrezione di GH) (7).
Il GH è una proteina di 191 aminoacidi. L’85-90% del GH circolante ha peso molecolare di 22 kDa; per splicing alternativo si produce una isoforma di 20 kDa che rappresenta il restante 10-15%. Il gene del GH (GH-N) appartiene a una famiglia che comprende i geni per il GH (GH-N, GH-V), per la prolattina (PRL) e per i lattogeni placentari.
La secrezione di GH presenta un modello circadiano con picchi discreti che, in età evolutiva, si verificano soprattutto durante le ore notturne e sono in rapporto con gli stadi del sonno (1,8). La secrezione di GH varia consistentemente con l’età, raggiungendo la massima secrezione durante lo sviluppo puberale e l’adolescenza fino all’età giovane-adulta, per poi diminuire gradualmente con l’avanzare dell’età (9,10).
Il GH in circolo si lega a due proteine vettrici: una a bassa affinità, di significato poco chiaro, che lega preferenzialmente l’isoforma da 20 kDa, e una ad alta affinità (GH-Binding Protein, GHBP) che rappresenta la forma solubile del dominio extra-cellulare del recettore del GH (GHR). Si ritiene che il ruolo della GH-BP sia molteplice: trasporto in circolo del GH, riserva circolante dell’ormone, diminuzione del tasso di degradazione del GH con aumento della sua emivita in circolo.
Il GH esercita i suoi effetti sulla crescita attraverso azioni sul metabolismo e sulla differenziazione cellulare. Molti di questi effetti sono mediati dalla sua attività stimolatoria sulla produzione di fattori di crescita (GFs), e in particolare della IGF-I (Insulin-like Growth Factor–I), prodotta principalmente dal fegato. Lo stimolo alla produzione di IGF-I avviene attraverso il legame del GH al GHR, con l’attivazione di una complessa cascata post-recettoriale. Il legame del GH al GHR porta alla dimerizzazione del recettore stesso sulla superficie cellulare delle cellule bersaglio (fegato, osso, muscolo e vari altri tessuti), con successiva attivazione di diverse vie post-recettoriali. Questi eventi consistono, in sintesi, nell’interazione del GHR con la proteina JAK2, con creazione di siti di ancoraggio per vari mediatori del segnale; reclutamento delle JAK2; reclutamento di proteine STAT, e in particolare della STAT5b; variazioni di processi di fosforilazione e defosforilazione di proteine citoplasmatiche e nucleari; legame di STAT5b al DNA e innesco della trascrizione dei geni bersaglio, in primo luogo per la sintesi di GF. Un’altra via di trasmissione del segnale del GH utilizza il sistema dell’Inositolo Fosfato (IP) e ERK1/2. Difetti dei geni che codificano per ciascuno dei fattori della sequenza post-recettoriale del segnale sono potenziali candidati come cause di diverse forme di bassa statura, e molti di essi sono stati dimostrati dalla letteratura scientifica (11).
I GF sono una serie di proteine, di cui l’IGF-I è quella più direttamente implicata nella crescita staturo-ponderale, in parte GH-dipendente. Il suo ruolo è quello di intervenire nella proliferazione e differenziazione cellulare di vari organi e tessuti e nei processi di crescita, metabolismo, invecchiamento e carcinogenesi. Per quanto riguarda la fase evolutiva, media principalmente l’azione del GH nella crescita delle ossa lunghe attraverso azioni specifiche sulle cartilagini di accrescimento. Circola legata a proteine vettrici (BP), di cui quella a più alta affinità è la IGF-BP3. Come per le GH-BP, il ruolo delle IGF-BP è molteplice: allungamento dell’emivita della IGF-I, funzione di riserva, migliore e più omogenea distribuzione ai vari tessuti e trasporto dell’IGF-I in circolo ai vari bersagli. L’IGF-I, in particolare, circola sottoforma di complesso ternario, formato dalla IGF-I stessa, dalla IGF-BP3 e da una subunità acido-labile (ALS):
- l’IGF-I libera rappresenta circa l’1% dell’IGF-I circolante e ha un’emivita di circa 10 minuti;
- il complesso IGF-I-IGF-BP3 rappresenta il 10-15% dell’IGF-I in circolo e ne porta l’emivita a 30-90 minuti;
- il complesso ternario IGF-I – IGF-BP3 - ALS rappresenta circa l’85% della IGF-I e ne estende l’emivita a più di 12 ore.
L’IGF-I, a sua volta, agisce sulla differenziazione e proliferazione cellulare attraverso l’azione su un recettore (IGFR) che fa parte della famiglia dei recettori per l’insulina. L’attivazione dell’IGFR innesca una cascata post-recettoriale attraverso i sistemi IP e ERK 1/2.
Tutti i diversi step fin qui descritti, dalla sintesi di GHRH all’azione periferica sui tessuti, sono controllati da numerosi geni codificanti e regolatori, la cui alterazione può portare a diverse forme genetiche di patologie della crescita (10,12).
Come tutti gli assi endocrini, anche l’asse GHRH-GH-IGF-I è regolato da meccanismi di feed-back: corto del GH sull’ipotalamo, lungo di IGF-I (e altri fattori influenzati dal GH, come acidi grassi liberi e glucosio) sull’ipotalamo e sull’ipofisi. Il controllo della secrezione di GH comprende quindi due sistemi a circuito chiuso (closed-loop: GH e IGF-I) e uno a circuito aperto (controllo neurale) (6).
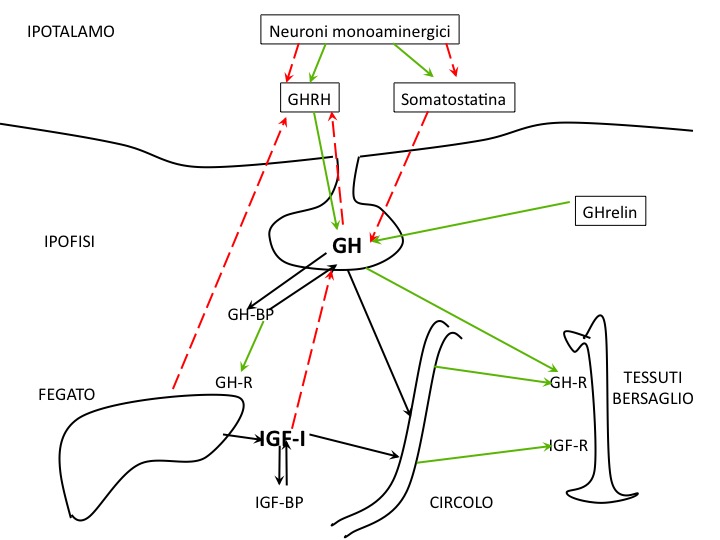
Rappresentazione schematica dell'asse: le frecce verdi rappresentano vie o azioni stimolatorie, quelle rosse inibitorie (vedi testo per le abbreviazioni)
Bibliografia
- Giustina A, Veldhuis JD. Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human. Endocr Rev 1998, 19: 717-97.
- Mayo KE, Cerelli GM, Lebo RV, et al. Gene encoding human growth hormone-releasing factor precursor: structure, sequence, and chromosomal assignment. Proc Natl Acad Sci USA 1985, 82: 63-7.
- Mayo KE, Godfrey PA, Suhr ST, et al. Growth hormone-releasing hormone: synthesis and signaling. Recent Prog Horm Res 1995, 50: 35-73.
- Wajnrajch MP, Gertner JM, Harbison MD, et al. Nonsense mutation in the human growth hormone-releasing hormone receptor causes growth failure analogous to the little (lit) mouse. Nat Genet 1996, 12: 88-90.
- Baumann G, Maheshwari H. The Dwarfs of Sindh: severe growth hormone (GH) deficiency caused by a mutation in the GH-releasing hormone receptor gene. Acta Paediatr 1997, S423: 33-8.
- Low MJ. Neuroendocrinology. In: Williams Textbook of Endocrinology 2007.
- Peck MN, Lundberg O. Short stature as an effect of economic and social conditions in childhood. Soc Sci Med 1995, 41: 733-8.
- Buzi F, Zanotti P, Tiberti A, et al. Overnight growth hormone secretion in short children: independence of the sleep pattern.J Clin Endocrinol Metab 1993, 77: 1495-9.
- Hindmarsh PC, Matthews DR, Brook CG. Growth hormone secretion in children determined by time series analysis. Clin Endocrinol (Oxf) 1988, 29: 35-44.
- Dattani M, Preece MA. Growth hormone deficiency and related disorders: insights into causation, diagnosis, and treatment. Lancet 2004, 363: 1977-87.
- Rosenfeld RG, Kofoed E, Little B, et al. Growth hormone insensitivity resulting from post-GH receptor defects. Growth Horm IGF Res 2004, 14 suppl A: S35-8.
- Wit JM, Mullis PE. Genetics of growth. Horm Res Pediatr 2013, 80: 379-80.
Sviluppo staturale: tappe fisiologiche e strumenti di valutazione
Fabio Buzi
SC Pediatria, AO "C. Poma", Mantova
Tappe della crescita
La crescita è un fenomeno complesso, che si effettua attraverso una serie di meccanismi che agiscono sui diversi organi e settori del corpo, secondo tappe che si ripetono nella popolazione in modo regolare. Non consiste solo nell’aumento delle dimensioni del corpo, ma anche nelle modifiche dei rapporti tra diversi segmenti corporei: basti pensare al rapporto tra le dimensioni della testa e quelle del corpo, che nel neonato è di circa 1:4 e nell’adulto diventa circa 1:8.
La crescita nel suo insieme è, fondamentalmente, il risultato dell’interazione tra fattori genetici (es. patrimonio genetico genitoriale, etnia) e ambiente (es. condizioni socio-economiche, nutrizione, componenti culturali in senso lato, epigenetica). Sebbene la crescita non sia un fenomeno continuo e lineare (cioè, analizzata per piccoli intervalli di tempo, si verifica con piccole accelerazioni e decelerazioni, anche con differenze stagionali: ad es. leggermente più accelerata d’estate), può essere rappresentata per intervalli di tempo più lunghi (semestri, anni) come un fenomeno lineare, che, dalla nascita all’età giovane-adulta, si verifica secondo uno schema trifasico:
- fase di rapida crescita staturale e ponderale nei primi (3-4) anni di vita;
- fase di crescita lineare fino all’esordio della pubertà;
- scatto di crescita puberale (spurt) che porta alle dimensioni pressoché definitive e si esaurisce gradualmente fino alla cosiddetta “crescita zero".
Non tutti i settori corporei però seguono questo modello, pertinente più specificamente alla statura (quindi scheletro), ai muscoli e ai principali organi interni: il cervello (e con esso il neuro-cranio) cresce molto rapidamente nei primi 2 anni di vita, raggiungendo a 2-3 anni le dimensioni quasi definitive (come accennato più sopra a proposito del rapporto testa:corpo); il tessuto linfatico raggiunge le massime dimensioni alla pubertà, per poi ridursi fino all’età adulta; l’apparato genitale mantiene invece le dimensioni infantili fino alla pubertà, dove si sviluppa raggiungendo nel giro di pochi anni le dimensioni definitive. Queste differenze sono ben rappresentate nella figura 1, dove le variazioni sono espresse come percentuale raggiunta della dimensione finale dei diversi organi e apparati.
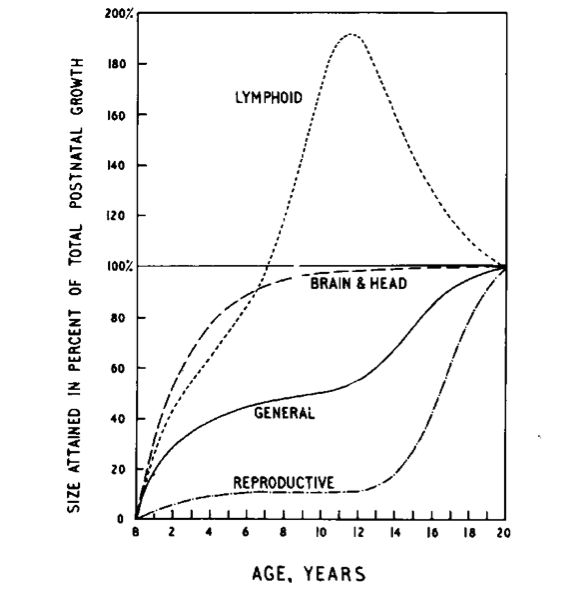
Figura 1 (da 5)
Valutazione della crescita staturale
La crescita staturo-ponderale del bambino è uno dei mezzi più sensibili per valutarne il benessere e la salute. Per poterla studiare correttamente sono però necessari alcuni requisiti:
- l’uso di strumenti precisi;
- l’adozione di una tecnica di misurazione corretta;
- l’utilizzo di standard di crescita adeguati.
L’uso di strumenti precisi si basa sullo stesso principio per il quale si deve usare uno sfigmomanometro ben tarato per misurare la pressione arteriosa o un kit di laboratorio con il minimo di coefficiente di variazione per valutare i livelli di un analita: se così non fosse, rischieremmo di basarci su valori errati per prendere decisioni diagnostiche e terapeutiche. Secondo gli standard internazionali, la misurazione della statura si deve eseguire con strumenti di precisione, come ad es. lo Stadiometro di Harpenden, che fornisce valori approssimati al millimetro, e che rappresenta uno strumento indispensabile in un Centro di Auxologia. La necessità di uno strumento preciso e di una tecnica di misurazione corretta risiede in questo principio: per valutare la velocità di crescita (HV) occorrono almeno due misurazioni a distanza di tempo congrua (normalmente 6 mesi; mai meno di 3 mesi). La HV viene espressa in cm/anno (quindi 12 mesi): è evidente che anche un minimo errore infra- o inter-misuratore verrà moltiplicato per 2 o per 4 se la misurazione viene effettuata su 6 o su 3 mesi, rispettivamente. Quindi un errore di soli 0.5 cm in meno alla prima misurazione e di 0.5 cm in più alla seconda darà un valore in eccesso di 4 cm se la misurazione è stata fatta su 3 mesi o di 2 cm se su 6 mesi, e viceversa!
Piuttosto che utilizzare i classici "statimetri" annessi alla bilancia (piano di appoggio dei piedi mobile, asta centimetrata flessibile, elemento scorrevole sull’asta mobile su perno: altissimo livello di imprecisione dello strumento!), è meglio fissare al muro un centimetro metallico inestensibile a partenza dal piano del pavimento e perfettamente perpendicolare al pavimento stesso e utilizzare poi una squadra per la misurazione del soggetto con tecnica di misurazione corretta.
La tecnica corretta di misurazione è la seguente:
- il soggetto deve stare in piedi (senza scarpe!!) con talloni ravvicinati e adesi al piano posteriore;
- la testa deve essere orientata sul cosiddetto Piano di Francoforte (una linea immaginaria passante per il meato acustico esterno e il margine inferiore dell’orbita deve essere orizzontale);
- il misuratore esercita una lieve pressione verso l’alto sulle mastoidi per favorire la migliore posizione eretta, controllando che il soggetto non alzi i talloni e invitandolo contemporaneamente a inspirare;
- in questo momento leggerà il valore sul contatore dello stadiometro (il piano di misurazione dello stadiometro Harpenden è mobile e controbilanciato, e il contatore è a fianco dello stesso) o, in caso di attrezzo più “artigianale”, sul centimetro metallico millimetrato fissato al muro.
Questa modalità è impossibile per bambini piccoli che non mantengono la posizione eretta o che si oppongono alla misurazione, ciò che avviene praticamente sempre sotto i 2 anni di età e spesso in bambini di giovane età (fino a 3-4 anni) piuttosto oppositivi. Esistono a questo proposito stadiometri orizzontali (Infantometro, Stadiometro orizzontale), che necessitano della presenza di due operatori per la misurazione corretta del soggetto, con tecnica analoga a quella già descritta.
La tipica curva di crescita è rappresentata in figura 2, dove si possono distinguere le 3 fasi principali descritte precedentemente:
- una prima fase di crescita rapida dalla nascita fino ai 3-4 anni, per cui la lunghezza alla nascita aumenta del 50% circa alla fine del primo anno e del 60% alla fine del secondo, con pendenza elevata che gradualmente diminuisce fino ai 4 anni circa;
- una seconda fase piuttosto regolare fino all’inizio della fase puberale;
- una terza fase di crescita rapida (scatto di crescita puberale, spurt) e successivo arresto accrescitivo, corrispondenti alla pubertà e al raggiungimento della statura definitiva.
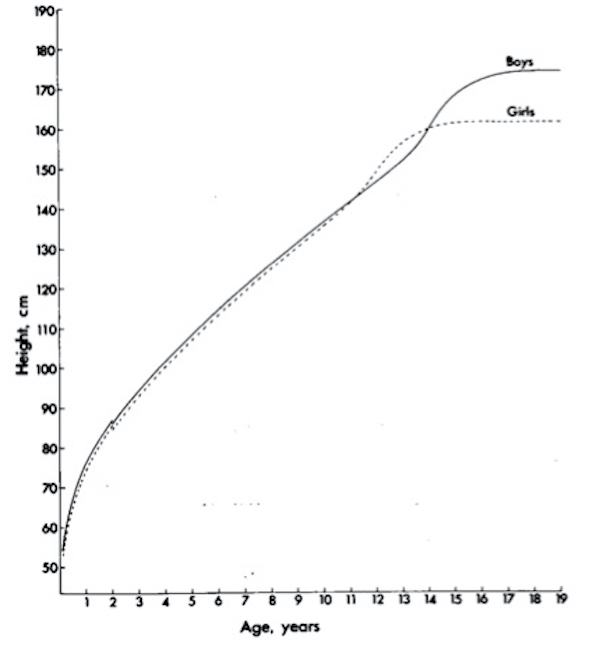
Figura 2. Evoluzione della statura rispetto all'età nei 2 sessi (mod da 6)
Nella prima e nella seconda fase le differenze statistiche tra maschi e femmine sono trascurabili, mentre nella terza fase si stabiliscono le differenze staturali tipiche tra i due sessi. Durante la prima e la seconda fase il maschio “medio” (cioè di peso medio alla nascita e che cresce a velocità media lungo il 50° percentile) ha una statura minimamente superiore alla femmina “media”. La femmina entra però in pubertà mediamente prima del maschio e presenta lo spurt circa 2 anni prima di quest’ultimo, superandolo temporaneamente in altezza. Il maschio successivamente la risupera dopo lo spurt e raggiunge un’altezza finale di circa 12-13 cm maggiore: questa differenza è costante per maschi e femmine adulti appartenenti allo stesso percentile, ed è uno dei presupposti per il calcolo dell’altezza media dei genitori corretta per sesso (v. oltre).
Velocità di crescita
Mentre questo modello generale di crescita è valido per tutti i bambini, esiste una grande variabilità individuale, sia per quanto riguarda l’entità dell’altezza sia per i tempi in cui viene iniziata e conclusa la fase puberale (soggetti di altezza più bassa, media e più alta; soggetti che maturano più lentamente o più rapidamente). Il modello di crescita appena descritto viene chiamato curva “di distanza”, perchè rappresenta la distanza in termini di altezza percorsa dal bambino: in qualche modo è come se dovessimo misurare la distanza tra due città in termini di km. Questo modello non ci dice però in quanto tempo e in che modo (accelerazioni, decelerazioni) questa distanza viene coperta. Lo si può quindi trasformare in curva di velocità, mantenendo sull’asse delle x l’età cronologica e sostituendo all’altezza sull’asse delle y la velocità di crescita (Height Velocity, HV) in cm/anno: è come se mettessimo i km/ora di un mezzo che percorre la distanza tra le due città di cui sopra (figura 3). In questo caso tutti i fenomeni precedentemente descritti vengono amplificati, e si può cogliere più facilmente la fase di alta velocità dei primi 2-3 anni di vita, la fase di crescita regolare successiva e la 3° fase puberale con lo spurt e il successivo decremento fino alla crescita zero. Questo modello è certamente più sensibile nel cogliere eventuali variazioni individuali anche minime nel ritmo di crescita, ed è quindi clinicamente importante. La velocità di crescita si esprime in cm/anno, quindi per calcolarla servirebbe misurare la statura in 2 successive rilevazioni a distanza di 12 mesi. Poiché questo non è sempre pratico (o desiderabile), si utilizzano comunque 2 rilevazioni (ad almeno 3 mesi di distanza, meglio 6), normalizzate a 12 mesi con una semplice proporzione:
velocità (cm/anno) = delta statura/frazione di tempo
dove delta statura è la differenza in cm tra le due misurazioni in quell'intervallo di tempo e frazione di tempo è l'intervallo fra le 2 misurazioni calcolato in decimali di anno (esempio: 3 mesi = 3/12 = 0.25; 6 mesi = 6/12 = 0.5, ecc.). Esiste a questo proposito una tabella dei millesimi di anno che si impara ad usare facilmente ed è più precisa; una scorciatoia può essere dividere il numero di giorni dell'intervallo per 365: ad esempio se l'intervallo tra le due misurazioni fosse 95 giorni (95/365 = 0.26) e in quell'intervallo il paziente fosse cresciuto di 1.8 cm, la sua velocità in cm/anno sarebbe 1.8/0.26 = 6.9 cm/anno.
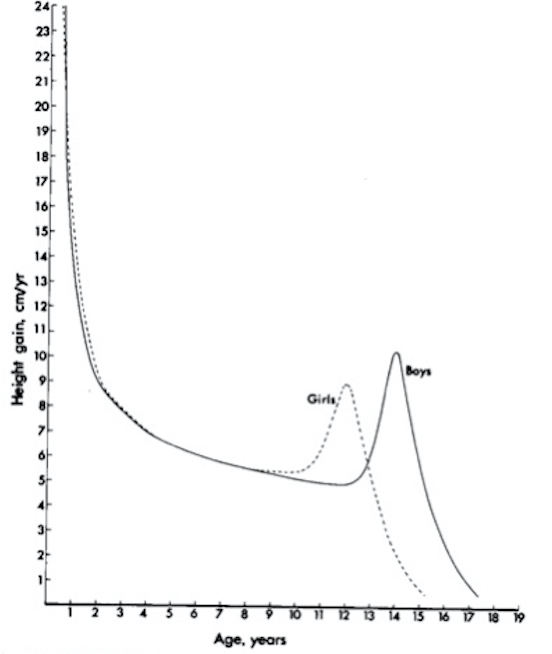
Figura 3. Rappresentazione grafica della velocità di crescita alle diverse età nei 2 sessi (da 6)
I due modelli descritti (curva di “distanza” e curva di “velocità”) costituiscono i presupposti per le tabelle di crescita normalmente conosciute come curve dei percentili o degli Standard di crescita. Questi consistono in tabelle o grafici che permettono di confrontare l’altezza o la HV di un soggetto in esame con quelle di una popolazione di riferimento. Si basano sulla raccolta di dati di un ampio campione rappresentativo della popolazione di riferimento. Normalmente sono rappresentati con linee che identificano diversi percentili (o centili); 3° (o 5°), 10°, 25°, 50°, 75°, 90° e 97° (o 95°), comprendendo quindi la distribuzione al 94% (o 90%) di una determinata variabile della popolazione (altezza, HV, ma anche circonferenza cranica, segmenti corporei, ecc.). La scelta di utilizzare come estremi della distribuzione il 3° e il 97° piuttosto che il 5° e il 95° percentile è del tutto arbitraria e non rappresenta altro che il 94% delle osservazioni nel primo caso e il 90% nel secondo. Poiché l’altezza (come pure la HV e altre variabili antropometriche: statura da seduti, lunghezza arti inferiori, diametro bi-trocanterico, diametro bis-acromiale, circonferenza cranica, ecc.) si distribuisce in modo Gaussiano, può essere espressa anche in termini di deviazione standard (SD) dalla media, in quanto in tal caso la mediana (50° percentile della distribuzione) corrisponde praticamente alla media aritmetica della distribuzione. In questo senso:
- +1 e -1 SD corrispondono rispettivamente all’84° e al 16° centile e comprendono il 78% delle osservazioni;
- +2 e -2 SD corrispondono rispettivamente al 98° e al 2° centile e comprendono il 96% delle osservazioni
- +3 e -3 SD comprendono praticamente tutte le osservazioni (99.8%).
In particolare:
- il 75° e il 25° centile corrispondono rispettivamente a +0.64 e -0.64 SD;
- il 90° e il 10° centile corrispondono rispettivamente a +1.28 e -1.28 SD;
- il 97° e il 3° centile corrispondono rispettivamente a +1.88 e -1.88 SD;
- il 50° centile corrisponde ovviamente a 0 SD.
Poiché, però, i bambini crescono e i valori di altezza e delle altre variabili antropometriche cambiano con l’età e con il genere, è necessario rappresentare tali valori in termini di SD come punteggi standardizzati per l’età e per il genere, utilizzando le medie e le SD pubblicate per le diverse popolazioni e per le diverse variabili e trasformandole in Standard Deviation Score (SDS: punteggi standardizzati, appunto), attraverso il seguente calcolo:
SDS = (x-X)/SD
dove x è la misura rilevata nel soggetto in esame, X la media di tale variabile calcolata per età e genere nella popolazione di riferimento, e SD la SD calcolata per la stessa età e genere. Ciò significa, per esempio, che una bimba di 4 anni con statura sul 25° centile, in base alle equivalenze sopra riportate, avrà una SDS di –0.64. Questo vale anche per la HV, ma con diverso criterio. A differenza della curva di distanza, infatti, la curva di velocità deve essere interpretata in un modo diverso: qualunque sia il centile di distanza sul quale il bambino cresce, il modello di crescita è sempre lo stesso. Come si può osservare dalle curve dei percentili (figura 4), i “canali” di crescita (3°-10°, 10°-25° centile, ecc.) sono praticamente paralleli tra loro: ne deriva che un soggetto che cresce sul 10° percentile di distanza dovrà avere la stessa velocità di uno che cresca sul 75° o sul 50°: questa velocità dovrà essere intorno al 50° centile e variare dal 25° al 75° nell’arco di uno o più anni. Un soggetto cioè che cresca costantemente (per più anni) anche poco al di sotto del 25° percentile di HV “taglierà” i centili di distanza verso il basso, “perdendo terreno”; il contrario per uno che cresca sempre al di sopra del 75°.
Anche la HV può essere espressa come SDS, con l’attenzione di riferire l’età al punto di mezzo tra due successive misurazioni, in quanto la HV è uno spazio/tempo e quindi può essere rappresentata non da un punto ma da un segmento, i cui estremi sono l’età della prima misurazione e quella della misurazione successiva. Ad esempio, per un bambino che venga misurato la prima volta a 6 anni e la seconda volta a 6 anni e mezzo, l’età a cui riferire il calcolo della SDS di HV (HV-SDS) sarà 6 anni e 3 mesi.
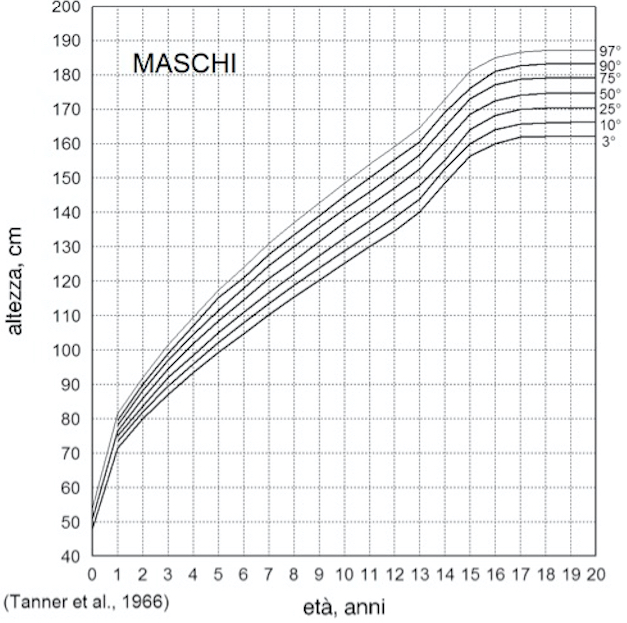
Figura 4. Percentili di crescita. Dopo aver misurato la statura del bambino, la rappresento con un punto all'incrocio fra l'età in ascissa e l'altezza in ordinata. Eseguendo misurazioni seriate e unendo con una linea i relativi punti, posso identificare se la crescita è regolare (segue il suo percentile), oppure tende a tagliare i percentili verso l'alto (crescita eccessiva) o verso il basso (deficit di crescita)
Standard di riferimento
La scelta degli standard da usare per altezza e HV è un altro argomento spesso dibattuto. Le carte di crescita più “complete”, elaborate con una metodologia di campionamento molto precisa, sono quelle di Tanner e Whitehouse e Tanner e Davies (popolazione inglese e popolazione statunitense rispettivamente). Sono certamente le più diffuse, ma non sono rappresentative della nostra popolazione, sia per l’origine che per la cronologia del campionamento (Inghilterra anni ’60 e successivi aggiornamenti, USA anni ’80). Inoltre, presuppongono la trasformazione dell’età “anni + mesi” in età decimale (anno + decimale di anno), calcolo molto semplice ma poco utilizzato perché implica l’uso della tabella dei millesimi di anno di Tanner. Esistono ormai da anni curve di crescita staturale e ponderale rappresentative della realtà italiana dai 2 ai 19 anni (3) (figura 5). Va comunque osservato che la popolazione è sempre più composita, dati i flussi migratori e gli standard dovrebbero quindi essere continuamente aggiornati. Le carte di crescita devono in ogni caso essere considerate degli strumenti da utilizzare criticamente, tenendo conto di altre componenti della crescita, come i condizionamenti genetici (es. stature dei genitori, etnia del soggetto in esame), ambientali (nutrizione, eccesso o difetto ponderale, ecc.) e maturazione biologica (età ossea).
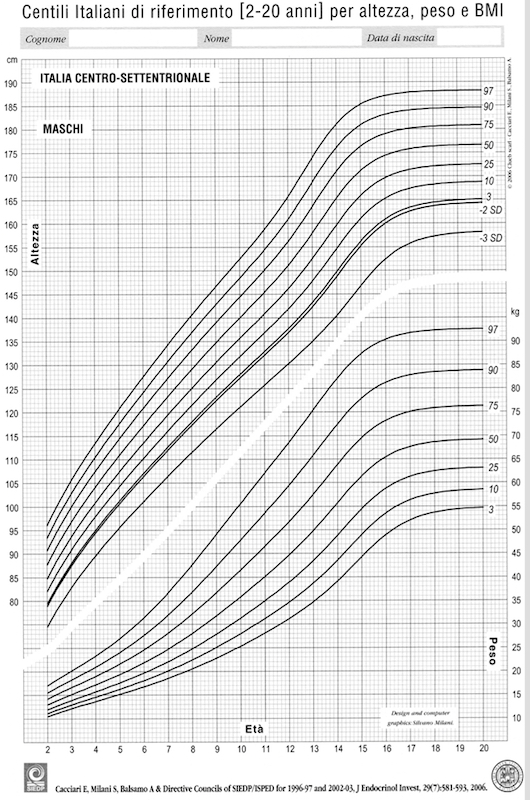
Figura 5. Curve di crescita staturale e ponderale per i maschi italiani (da 3)
Qualunque sia la curva standard di crescita utilizzata, bisogna infine ricordare che la variabile più importante è la HV. A questo proposito, nonostante siano state elaborate diverse carte di crescita di distanza per statura e peso, le curve di HV tuttora universalmente utilizzate per la HV e per il calcolo della HV-SDS sono quelle di Tanner e Whitehouse (figura 6), in quanto costruite con una metodologia di campionamento molto precisa e specifica (longitudinale) e non derivate semplicemente dalla rielaborazione dei dati (trasversali) di crescita lineare. Per le età da 0 a 2 anni esistono poi carte più dettagliate, che prendono in considerazione la lunghezza supina (0-2 anni) e quella eretta fino ai 5 anni e mezzo (Tanner 1973) o quelle della NCHS o della WHO e molte altre ancora. Anche in questo caso, come già detto, è bene decidere di utilizzare un certo tipo di standard cui abituarsi e usarlo con le attenzioni già esposte precedentemente.
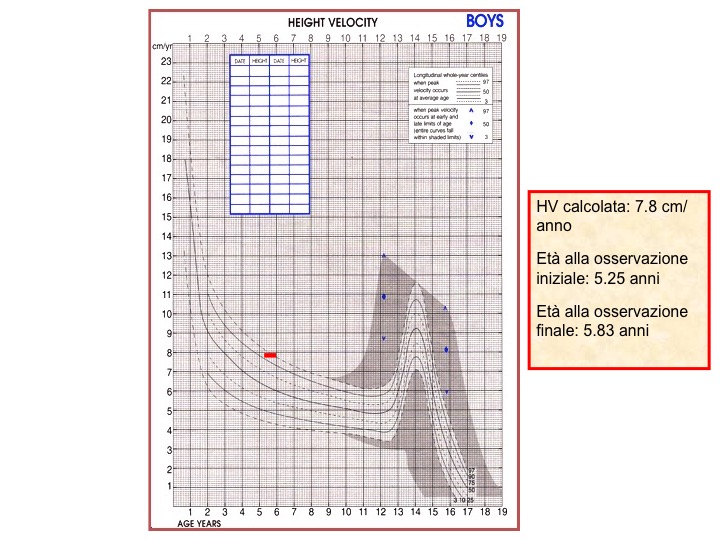
Figura 6. Curva della velocità di crescita. la HV è una velocità, quindi un "spazio su tempo", e si svolge quindi nel corso del tempo e non in un piccolo istante (cioè al momento della visita, come per la rilevazione dell'altezza o del peso). La HV sarà quindi rappresentata da un segmento (e non da un punto, come per l'altezza o il peso), che avrà come estremi l'età della prima rilevazione e l'età della seconda rilevazione; il percentile sarà riferito al punto di mezzo di tale segmento. Il bambino dell'esempio sopra ha una velocità di crescita che lo colloca tra il 90° e il 97° percentile
Bersaglio genetico
La crescita è fortemente condizionata geneticamente, in particolare dalle stature dei genitori. È possibile, quindi, valutare l’altezza di un soggetto in rapporto a quelle dei suoi genitori. Un metodo pratico è quello della costruzione del “bersaglio genetico”, che si basa sulla già citata differenza statistica di circa 12.5 cm (12–13 cm) tra altezza media dei maschi e altezza media delle femmine da adulti. È quindi possibile trasformare il percentile di altezza di un padre nel percentile femminile sottraendo 12.5 cm alla sua altezza reale e allo stesso modo trasformare quella di una madre in percentile maschile addizionando alla sua altezza i 12.5 cm. Già in questo modo si potrà vedere se la statura del soggetto in esame, maschio o femmina che sia, si trovi nella stessa posizione occupata da uno o entrambi i genitori. La costruzione del “bersaglio genetico” consiste poi nel calcolo della statura media dei genitori corretta per genere (Mid Parental Height, MPH), secondo il modello (tutte le misure sono in cm):
- MPH maschio = (altezza paterna + altezza materna + 12.5)/2;
- MPH femmina = (altezza paterna + altezza materna - 12.5)/2.
È possibile calcolare la SDS della MPH (MPH-SDS) rapportando il valore della MPH al valore della statura finale di una femmina o di un maschio (età: 19 anni), e confrontare così la altezza-SDS del soggetto in esame (femmina o maschio) con la MPH-SDS dei suoi genitori.
Infine, si può calcolare il “bersaglio genetico” aggiungendo alla MPH ± 10 cm per i maschi e ± 9 cm per le femmine: questi limiti ci danno la MPH ±2 SD per quella coppia genitoriale, in quanto 1 DS per le stature da adulti è 5 cm per i maschi e 4.5 per le femmine. Questo calcolo valuta la statura attesa del 96% dei figli di un determinato sesso di quella coppia genitoriale e non è una previsione di statura finale del singolo soggetto in esame! Si può essere più "conservativi" nel definire il bersaglio, restringendone i limiti: ad esempio +8 e -8 cm dalla MPH o ancora meno.
Crescita ponderale
Il peso deve essere rilevato per mezzo di una bilancia ben tarata (bilancia pesa-infanti per le età da 0 a 2-3 anni e bilancia a stadera o elettronica per le età successive), che assicuri un’approssimazione a 0.1 kg. Il soggetto deve essere pesato nudo, meglio se al mattino a digiuno e dopo aver evacuato. La crescita ponderale non è molto diversa da quella staturale e presenta le stesse fasi e le stesse variazioni inter-individuali. Esistono anche per il peso le carte di crescita rappresentate in centili. Essendo il peso una variabile non distribuita in modo Gaussiano (poiché risente fortemente dei condizionamenti ambientali e nutrizionali), non è corretta la sua rappresentazione in termini di SDS: è possibile però calcolare per le diverse età l’Indice di Massa Corporea (Body Mass Index, BMI) e rapportarlo alle carte specifiche pubblicate (in Italia sono disponibili quelle di Cacciari et al).
Valutazione delle proporzioni corporee
Esistono inoltre metodi per valutare le proporzioni corporee dei bambini durante la crescita e individuare possibili asimmetrie e disarmonie.
Un sistema è quello della rilevazione del rapporto segmento superiore/segmento inferiore. Un metodo è quello di confrontare la statura da seduto (Sitting Height, SH) con la lunghezza sub-ischiatica (Sub-ischial Leg Length, SLL) per mezzo di uno strumento specifico derivato dallo stadiometro di Harpenden, applicato a uno sgabello indeformabile di lunghezza fissa o semplicemente utilizzando un analogo sgabello appoggiato allo stadiometro:
- SH = altezza misurata con lo stadiometro - altezza dello sgabello;
- SLL = altezza del soggetto - SH.
Anche per queste variabili esistono carte dei percentili specifiche.
Un altro metodo più semplice è quello della rilevazione dello span (apertura estrema delle braccia e sua misurazione) e confronto con l’altezza del soggetto: normalmente lo span non eccede di ± 5 cm l’altezza.
Variazioni più specifiche delle proporzioni corporee vengono poi ottenute per mezzo dell’antropometro, uno strumento modulare finalizzato alla misurazione di singoli segmenti corporei (lunghezza degli arti, diametri vari – cranico, bis-acromiale, bi-trocanterico, ecc.) di pertinenza però decisamente specialistica (es. dismorfologia, genetica clinica).
Bibliografia
- Benso L, Conrieri M. Metodiche di valutazione auxologica. In: Quaderni di endocrinologia pediatrica. G. Tonini Ed. Vol. I, Archimedica, Torino 1996.
- Buzi F. Gli standard di crescita: le curve di riferimento. Attendibilità e utilizzo pratico. In: Quaderni di endocrinologia pediatrica. G. Tonini Ed. Vol. I, Archimedica, Torino 1996.
- Cacciari E, Milani S, Balsamo A, et al. Italian cross-sectional growth charts for height, weight and BMI (2 to 20 yr). J Endocrinol Invest 2006, 29: 581-93.
- Nicoletti I. Auxologia normale e patologica. Ed. Centro Studi Auxologici. Firenze, 1994.
- Tanner JM. Foetus into man. 2nd Ed, 1989. Castelmead Publications, Ware, UK.
- Tanner JM, Whitehouse RH, Takahishi M. Standards from birth to maturity for height, weight, height velocity, and weight velocity: British children 1965. Arch Dis Child 1966, 41: 454-71 e 613-35.
- Tanner JM, Whitehouse RH. Clinical longitudinal standards for height, weight, height velocity, weight velocity, and stages of puberty. Arch Dis Child 1976, 51: 170-9.
- Tanner JM, Davies PSW. Clinical longitudinal standards for height and height velocity for North American Children. J Pediatr 1985, 107: 317-29.
Valutazione dell'età ossea
Fabio Buzi
SC Pediatria, AO "C. Poma", Mantova
I bambini non crescono tutti allo stesso ritmo e non maturano tutti allo stesso modo e nello stesso tempo. Questo è molto evidente all’età della pubertà, quando troviamo soggetti già fisicamente “adulti” e coetanei ancora totalmente infantili: basti pensare ai componenti, maschili e femminili, di una seconda o terza media. Queste differenze sono comunque già presenti a tutte le età, fin dalla nascita. Per esempio, le femmine sono, in media, biologicamente più avanti rispetto ai maschi già dalla metà della vita fetale in poi. Allo stesso modo, alcuni bambini (maschi e femmine) sono più precoci nella maturazione rispetto ad altri nel corso della fase evolutiva pre- e post-natale: per citare J.M. Tanner, pioniere dell’Auxologia, “l’analogia ci viene dalla musica classica: alcuni bambini suonano la loro crescita come “andante”, altri come “allegro”, e un numero minore come “lentissimo”. Sembra che l’eredità giochi un grande ruolo nell’impostare il metronomo, ma noi non ne conosciamo il meccanismo fisiologico”.
È evidente come sia necessaria una misura della maturazione biologica di un bambino, per distinguere nell’ambito della fisiologia i “maturatori normali” dai “tardi maturatori” e dai “maturatori precoci”, e cogliere allo stesso modo i ritardi o gli anticipi patologici. Tra i possibili indicatori di maturazione biologica, l’età staturale, l’età ponderale, l’età psicologica e l’età dentale sono assolutamente inadeguate a questo compito, perché risentono di troppe influenze ambientali, nutrizionali, genetiche, culturali e sociali. L’indicatore più affidabile di maturazione biologica è l’età ossea.
La maturità scheletrica è una buona misura di quanto le ossa di un certo settore siano progredite nel processo di maturazione, non tanto in grandezza quanto nella loro forma e nella loro posizione rispetto alle altre ossa contigue, e questo è possibile valutarlo per mezzo di una semplice radiografia. Ogni segmento osseo inizia la sua maturazione prima come centro di ossificazione primario, per poi passare attraverso diversi stadi di ingrandimento e modellamento fino alla forma definitiva: molte ossa, come le ossa lunghe, presentano più centri di maturazione (es. epifisi), che maturano indipendentemente dal centro di maturazione principale, e alla fine raggiungono la forma finale attraverso la fusione delle epifisi con la metafisi dell’osso stesso. Questo è ben evidenziabile con una radiografia diretta dell’osso, in cui i centri di ossificazione assumono aspetti radiologici diversi durante le varie fasi maturative, aspetti morfologici che possono essere utilizzati come indicatori discriminanti delle singole tappe maturative. Sebbene queste modificazioni costituiscano un processo continuo e non delle vere tappe distinte, la loro valutazione può essere ridotta a indicatori di sviluppo discreti.
Teoricamente qualsiasi segmento osseo corporeo potrebbe essere utilizzato a questo fine, ma in pratica le ossa della mano e del polso costituiscono la parte più adatta alla valutazione della maturità scheletrica, per l’elevato numero di ossa corte (carpo) e ossa lunghe (falangi), e per la semplicità di esecuzione di una radiografia diretta della mano. Gli “indicatori di maturità” (cioè i segmenti ossei – nuclei di ossificazione - delle ossa di radio, ulna, carpo, ossa metacarpali e falangi) sono pressoché gli stessi nei due principali metodi impiegati al mondo per la determinazione dell’età ossea: il metodo di Greulich e Pyle (G&P) (successive edizioni: 1950 e 1959) e quello di Tanner e Whitehouse (TW), nelle sue successive edizioni (TW1, TW2 e TW3). Questi due metodi sono stati resi disponibili sottoforma di atlanti da utilizzare nella pratica clinica. Viene esplicitato nell’atlante il metodo di esecuzione della radiografia (posizione della mano, distanza dalla fonte di raggi, ecc). Per convenzione gli indicatori sono stati studiati sulla mano sinistra di un campione di soggetti, femmine e maschi separatamente, in diverse fasi evolutive, in modo longitudinale (sempre i medesimi soggetti durante la loro crescita). La scelta della mano sinistra è dovuta al fatto che, al tempo del campionamento (G&P: anni 1920-50, USA; TW: 1950–70, UK) la mano sinistra era quella meno frequentemente menomata (a quel tempo ancora molti ragazzi lavoravano nelle fabbriche e potevano aver subito incidenti sul lavoro): non ha senso quindi utilizzare la mano destra nei mancini come avviene spesso in alcune Radiologie, perché gli standard di riferimento sono stati rilevati comunque sulla mano sinistra.
In pratica ciascun metodo dovrebbe essere utilizzato seguendo attentamente le istruzioni in esso contenute: in realtà questo non sempre avviene, specie per il metodo G&P, in cui sono presentate radiografie campione a successive età dell’intera mano e polso separatamente per femmine e maschi, per cui la valutazione avviene spesso affrettatamente per semplice confronto tra la radiografia del soggetto in esame e quella dell’atlante più simile dal punto di vista morfologico. Questo può in realtà portare a errori di valutazione.
Esaminiamo brevemente i due metodi più usati.
Nell’atlante G&P (figura 1) il metodo corretto di valutazione, suggerito dagli Autori, sarebbe il seguente:
- confrontare la radiografia del soggetto in esame con lo standard dello stesso genere e dell’età cronologica più vicina;
- confrontare la radiografia con gli standard adiacenti;
- scegliere lo standard che sembra assomigliare più fedelmente alla radiografia in esame;
- esaminare ciascun segmento osseo in sequenza ordinata, attribuendo ai singoli segmenti l’età ossea corrispondente, secondo le istruzioni contenute nel testo dell’atlante;
- infine, arrivati allo standard più somigliante, attribuire l’età ossea corrispondente o estrapolarne una intermedia tra le due più simili.
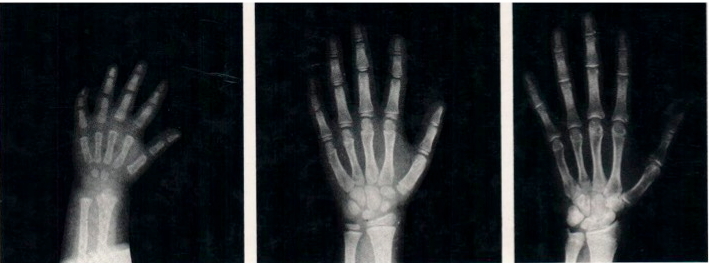
Figura 1. Metodo a confronto (es. Greulich& Pyle): la radiografia del paziente viene confrontata con immagini campione in sequenza temporale evolutiva pubblicate su un Atlante di riferimento; al-alla paziente in esame viene attribuita l’età ossea dell’immagine di riferimento che più si avvicina (per caratteristiche morfologiche e maturative delle ossa del polso e delle falangi) alla Rx in esame; nell’Atlante di Greulich& Pyle, ad esempio, le radiografie campione sono divise per sesso e sono in progressione di 6 mesi dalla nascita alla maturità.
Questa procedura è stata poi perfezionata ulteriormente da Roche rendendola più rigida, ma con tempi di lettura piuttosto lunghi.
Con il metodo TW (figure 2 e 3) la scelta di presentare le immagini dei singoli segmenti ossei e non della mano e polso per intero è stata finalizzata a evitare eccessiva soggettività e letture frettolose “per confronto diretto”. Consiste nell’attribuzione di un punteggio a 20 segmenti ossei scelti tra i nuclei di ossificazione delle epifisi distali di radio e ulna e di quelli delle ossa metacarpali e delle falangi (13 segmenti) più 7 ossa del carpo. Il sistema è un po’ più complesso rispetto a quello di G&P (che, forse anche per questa ragione, è quello comunque più usato a livello mondiale) e implica una fase di addestramento dell’operatore, che porta alla pressoché completa memorizzazione dei criteri di punteggio, accelerando così i tempi di esecuzione della lettura. Devono essere rigorosamente seguite le indicazioni del testo sull’attribuzione di uno stadio maturativo rispetto al precedente o successivo, pena risultati del tutto inaffidabili. Per facilitare l’operatore, gli indicatori di maturità di ciascun osso e di ciascuno stadio sono stati esemplificati graficamente accanto alle immagini radiologiche del segmento in esame. La somma dei punteggi attribuiti a ciascun segmento conduce all’età ossea del soggetto in esame. Mentre nella versione TW1 il punteggio derivava dalla valutazione di tutte le 20 ossa selezionate dal metodo, nell’aggiornamento TW2 vengono distinte 3 diverse modalità: punteggio “20 ossa” (come nel TW1), punteggio “RUS” (radio, ulna e ossa metacarpali e falangee) (quest'ultimo più utile nella valutazione clinica – endocrinologica) e “CARPAL”, limitato alle sole ossa del carpo. La successiva versione (TW3) prende invece in considerazione le sole ossa RUS ed è fornita con software per l'utilizzo tramite computer.
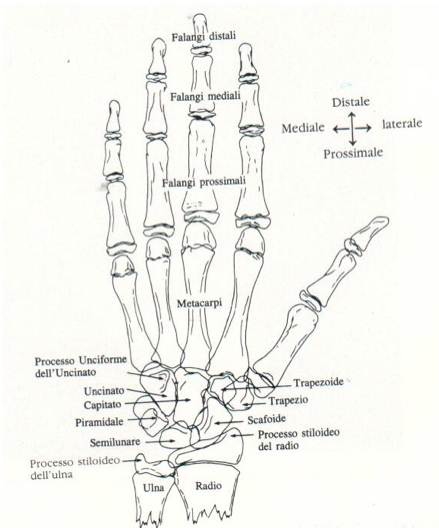
Figura 2. Segmenti ossei presi in considerazione nel metodo a punteggio di Tanner& Whitehouse (TW). Le versioni più utilizzate sono 2:
-
TW2, a sua volta suddivisa in 3 sottotipi:
-
«20 ossa», che considera tutti i 20 segmenti scelti, sia del carpo che di radio, ulna, metacarpo e falangi;
-
«RUS» (Radio Ulna Short bones), che utilizza solo radio, ulna, metacarpo e falangi;
-
Carpo, che utilizza solo i segmenti ossei del carpo;
-
-
TW3, la più recente, che utilizza solo le ossa «RUS».
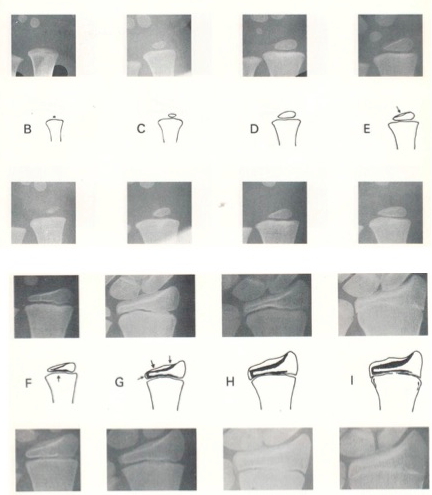
Figura 3. Esempio di metodo a punteggio (Tanner Whitehouse: TW): i diversi segmenti ossei presi in considerazione sono schematizzati con disegni che esemplificano altrettanti criteri morfologici per l’attribuzione di un punteggio (B,C,D,E,F,G,H,I) con l’aggiunta di immagini radiografiche che aiutano l’operatore nella scelta dello stadio da attribuire: la somma dei punteggi dei singoli segmenti (epifisi distale di radio e ulna, nuclei di ossificazione del I, III e V metacarpo, delle falangi prossimali di I, III e V dito, delle falangi medie di III e V dito, e delle falangi distali di I, III e V dito, presi in considerazione nell’ultima versione del metodo TW, chiamata «TW3») corrisponde alla «età ossea» del soggetto in esame. Per applicare questo metodo (TW, nelle versioni TW2 e TW3) è necessario un «training» specifico teorico e pratico. Nella figura è riportata la schematizzazione per l’epifisi distale del radio (modificato da Tanner VJM, Whitehouse RH, Cameron N. Valutazione della maturazione scheletrica e predizione dell'altezza adulta. Metodo TW2. Ed. italiana a cura di A. Tenore. Martinucci Pubblicazioni Mediche, Napoli, 1990).
Con entrambi i metodi può inoltre essere attuata una previsione della statura finale più probabile: per il metodo G&P con il sistema di Bailey e Pinneau; con i metodi TW con il sistema Tanner-Whitehouse. Le equazioni di predizione prendono in considerazione l’età cronologica e il genere del soggetto e la sua età ossea; può essere aggiunta, se disponibile, la velocità di crescita e, sempre se disponibile, la differenza in età ossea a distanza di un anno. Questa previsione viene poi utilizzata confrontandola con il “bersaglio genetico” nella valutazione complessiva della crescita del soggetto in esame.
Esistono ancora ulteriori metodi di lettura dell’età ossea, come il metodo FELS, che però è molto complesso e non utilizzato correntemente nella pratica clinica, così come modifiche dei metodi sopra esposti apportate da singole scuole auxologiche.
Il consiglio è quello di scegliere un metodo di lettura e utilizzarlo correntemente, possibilmente affidandolo a uno o due valutatori, sempre gli stessi per ciascun Centro, che divengano esperti e quindi il più possibile affidabili, ricordando che l’età ossea non è un parametro “certo”, ma che contribuisce, assieme alle altre variabili auxologiche e cliniche, a formulare un giudizio complessivo sulla crescita del soggetto in esame.
Bibliografia
- Aicardi G, Vignolo M, Di Battista E, Mattei R. La valutazione dell’età scheletrica. In: Quaderni di endocrinologia pediatrica. G. Tonini Ed. Vol. I, Archimedica, Torino 1996.
- Bailey N, Pinneau SR. Tables for predicting adult height from skeletal age: revised for use with the Greulich-Pyle hand standards. J Pediatr 1952, 40: 423-41.
- Greulich WW, Pyle SI. Radiographic atlas of skeletal development of the hand and wrist. 2nd Ed, Stanford University Press, Stanford, California, 1959.
- Roche AF. The measurement of skeletal maturation. In: Johnston FE, Roche AF, Susanne C, Eds. Human physical growth and maturation. Plenum Press, New York 1979.
- Tanner JM. Foetus into man. 2nd Ed, Castlemead Publications, Ware, UK, 1989.
- Tanner JM, Whitehouse RH, Marshall WA, et al. Assessment of skeletal maturity and prediction of adult height. 2nd Ed, Academic Press, London, 1983.
- Tanner JM, Healy M, Goldstein H, et al. Assessment of skeletal maturity and prediction of adult height (TW3 Method), 3rd Ed, WB Saunders, Harcourt Publishers Ltd, London, 2001.
- Vignolo M, Milani S, Cerbello G, et al. FELS, Greulich-Pyle, and Tanner-Whitehouse bone age assessments in a group of Italian children and adolescents. Am J Hum Biol 1992, 4: 493-500.