Endowiki: aggiornamento continuo di endocrinologia
Per tutti gli operatori di endocrinologia: lo stato dell'arte su clinica e terapia.
Uno strumento semplice e fruibile da tutti coloro che intendono essere sempre aggiornati, promosso dai migliori operatori del settore.
News
Inquadramento generale diagnostico delle malattie paratiroidee
Anatomia delle paratiroidi
Ignazio Emmolo
Chirurgia della Tiroide e delle Paratiroidi, Casa di Cura “Città di Bra” – Bra (Cuneo)
Anatomia normale
Le paratiroidi sono quattro, due per lato, distinte in superiori e inferiori. Il 3-15% delle persone presenta ghiandole soprannumerarie, di solito una, ben raramente due, eccezionalmente di più [1,2]. La paratiroide ha consistenza molle e può avere forma diversa: tondeggiante, ovale, allungata, bilobata, a goccia, a fagiolo, a frittella, ecc. Il colore è giallo-bruno più o meno intenso in base alla quantità di cellule adipose presenti dentro la ghiandola [foto A, foto B]. Il grasso può avvolgerla parzialmente o completamente [foto C, foto D]. La dimensione è di 4-5 millimetri, potendo variare in relazione alla forma. Il peso di ogni ghiandola va da 30 a 50 milligrammi, a seconda del sesso e dell’età. Nello stesso soggetto le paratiroidi possono differire tra di loro per dimensione e peso: tutte le ghiandole non pesano più di 200 milligrammi (generalmente intorno a 140 mg)[3].
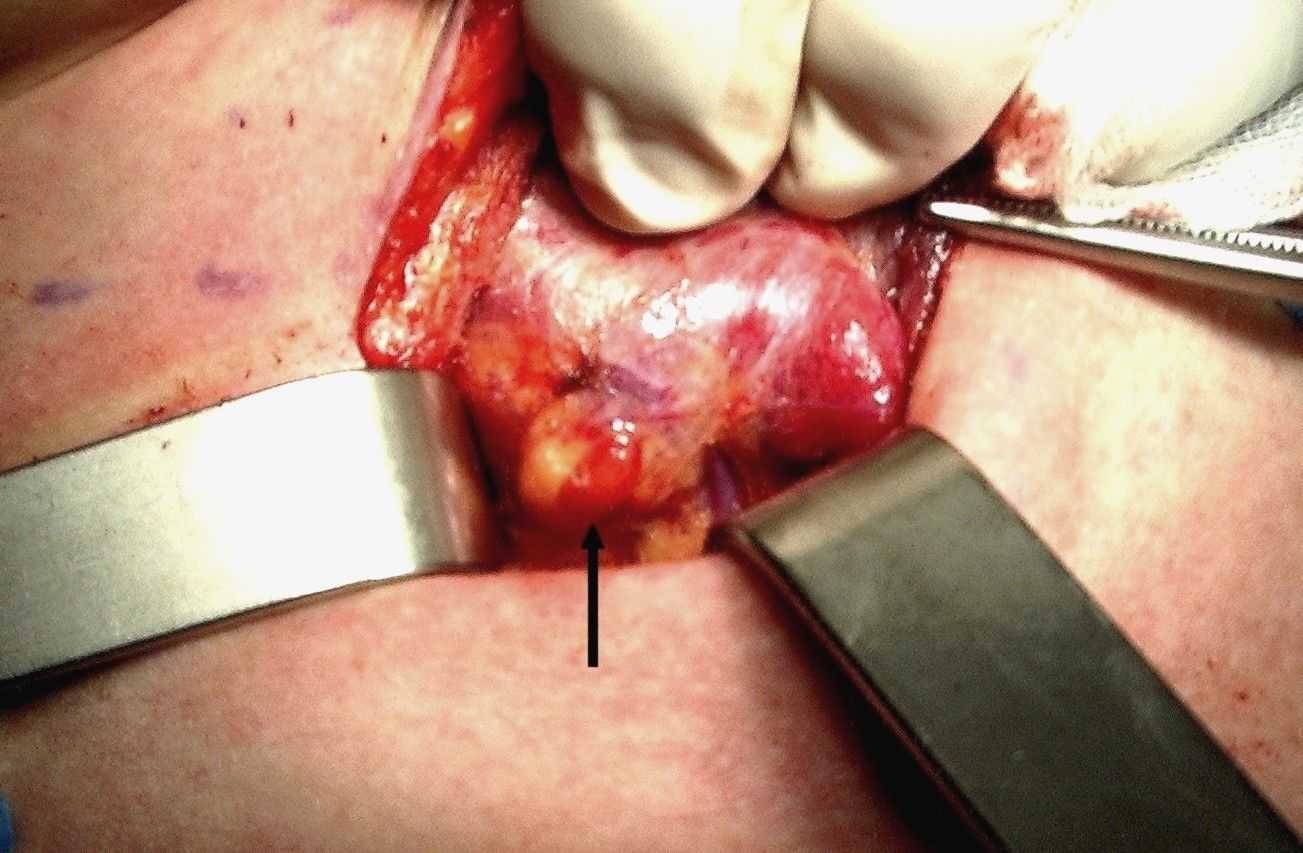
Figura A. Paratiroide normale
La freccia indica la ghiandola situata a ridosso del lobo tiroideo. Essa ha colore bruno intenso che contrasta con il giallo del tessuto adiposo sul quale poggia.
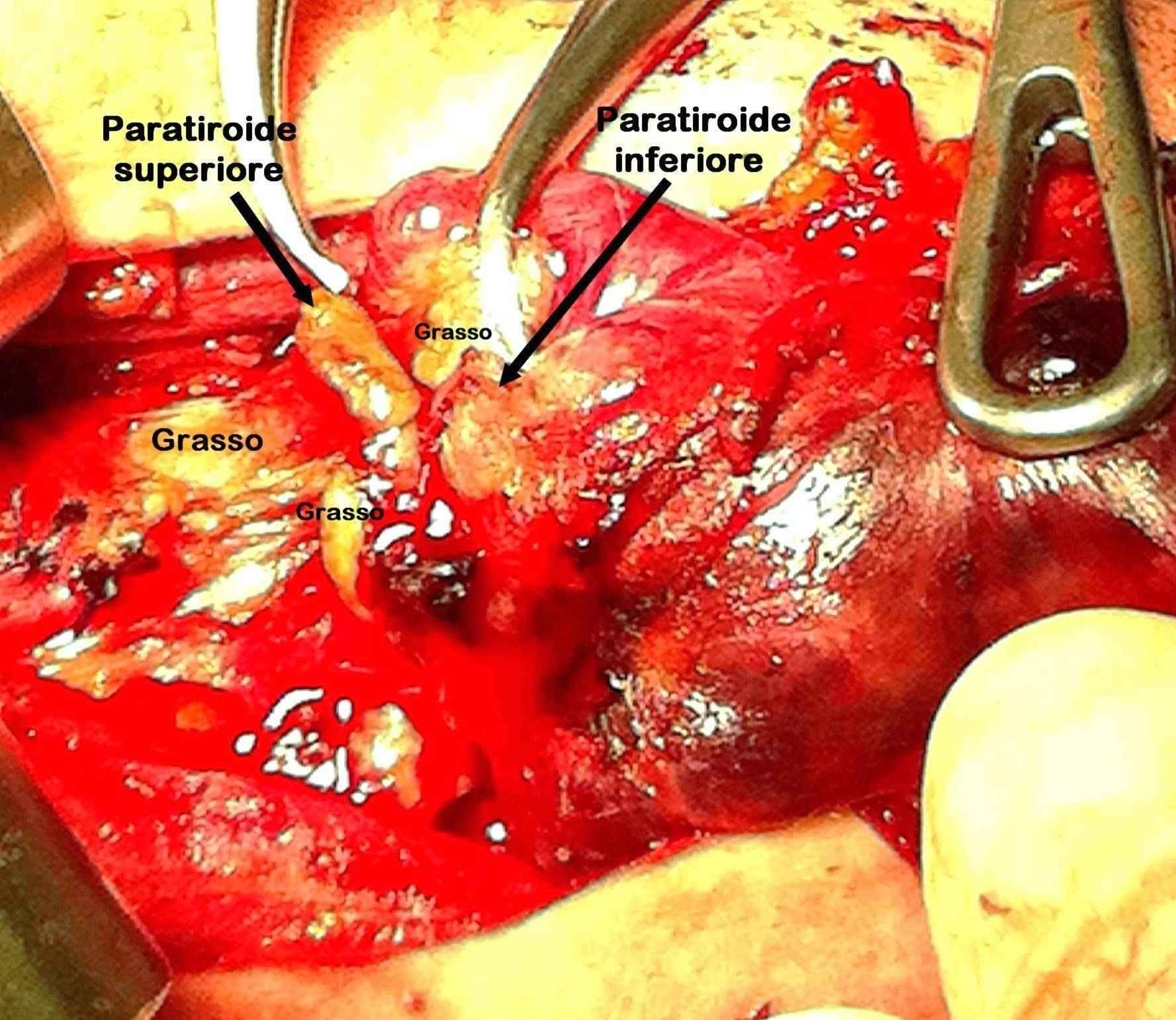
Figura B. Paratiroidi normali
In questa paziente le due paratiroidi hanno colore bruno chiaro e sono poco distinguibili dal tessuto adiposo.
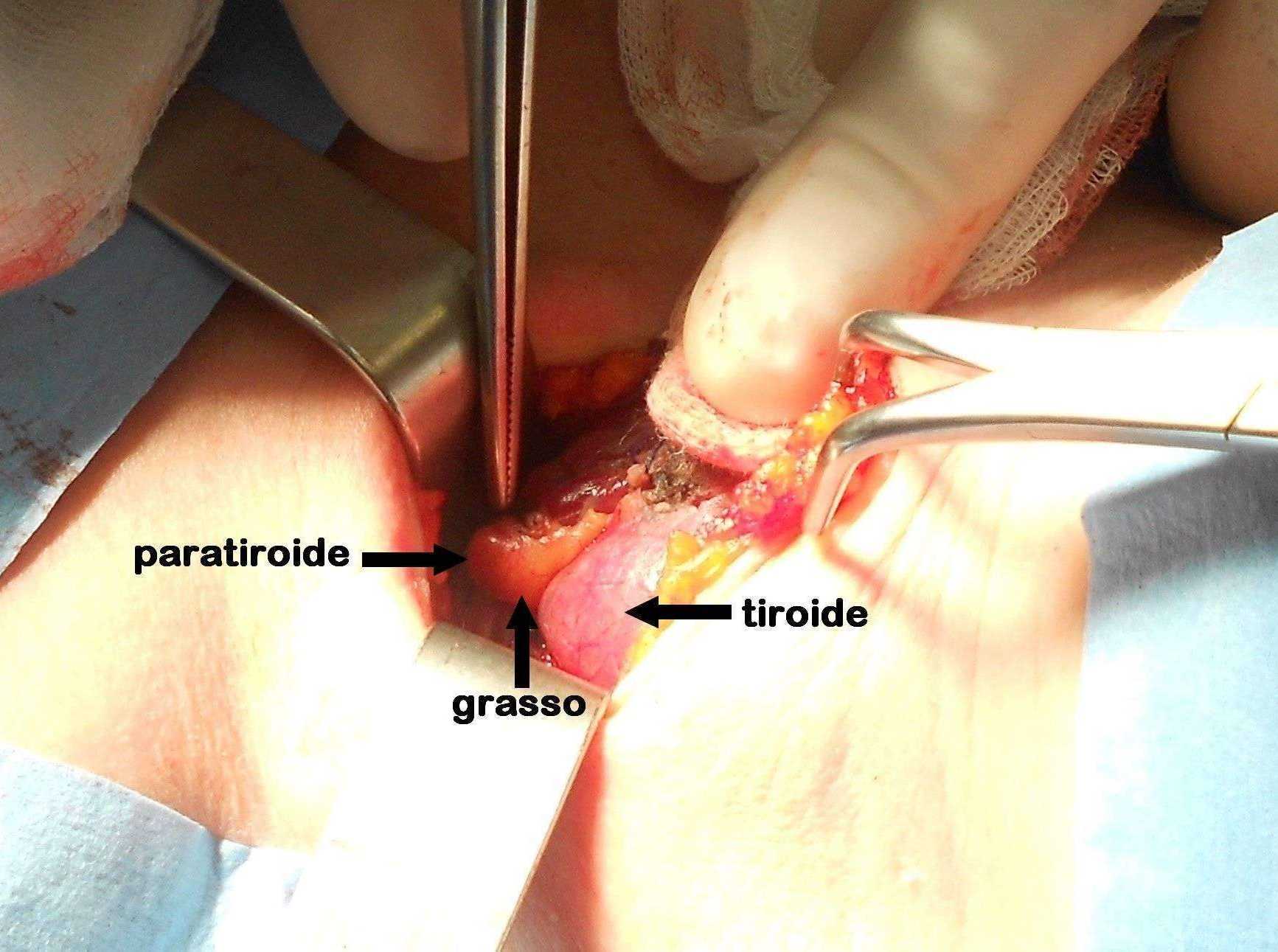
Figura C. Paratiroide parzialmente coperta da grasso
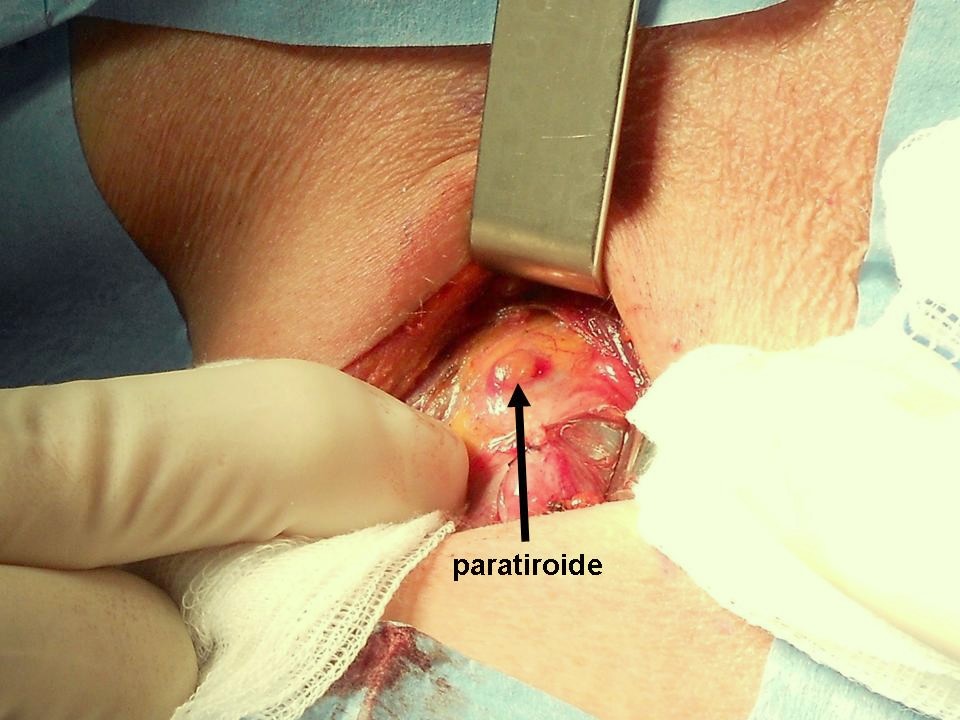
Figura D. Paratiroide completamente coperta da grasso
Un sottile strato di tessuto adiposo ricopre la piccola paratiroide.
L’origine embriologica delle paratiroidi rende conto sia della loro sede di impianto sia delle non rare ectopie [foto E]. Le paratiroidi superiori nascono dalla quarta tasca branchiale assieme alla porzione laterale del lobo tiroideo ed alle cellule parafollicolari. Le inferiori prendono origine dalla terza tasca, assieme al timo. Le inferiori percorrono quindi un tragitto più lungo e, di conseguenza, hanno una posizione meno costante rispetto alle superiori. Queste ultime si trovano di norma sulla superficie posteriore del lobo tiroideo, a livello della porzione medio-superiore [foto F]. Le inferiori hanno invece una sede d’impianto più variabile, il più delle volte vicina al polo tiroideo inferiore o al di sotto di esso [foto G]. In circa l’80% dei casi esiste una simmetria di sede tra i due lati [2]. Nel 15-20% dei soggetti le paratiroidi, specie le inferiori, si trovano in sede ectopica che, in ragione della migrazione embriologica, può essere compresa tra la regione sottomandibolare e quella iuxtapericardica[4]. La sede ectopica delle ghiandole superiori sarà cervicale, mentre quella delle inferiori potrà essere cervicale o mediastinica. Le paratiroidi ectopiche posso trovarsi: sopra il polo tiroideo superiore, dietro il faringe o l’esofago, nella guaina del fascio giugulo-carotideo, all’interno della tiroide, nel cellulare tireo-timico, all’interno del timo [foto H], in sede mediastinica superiore o inferiore, ecc.
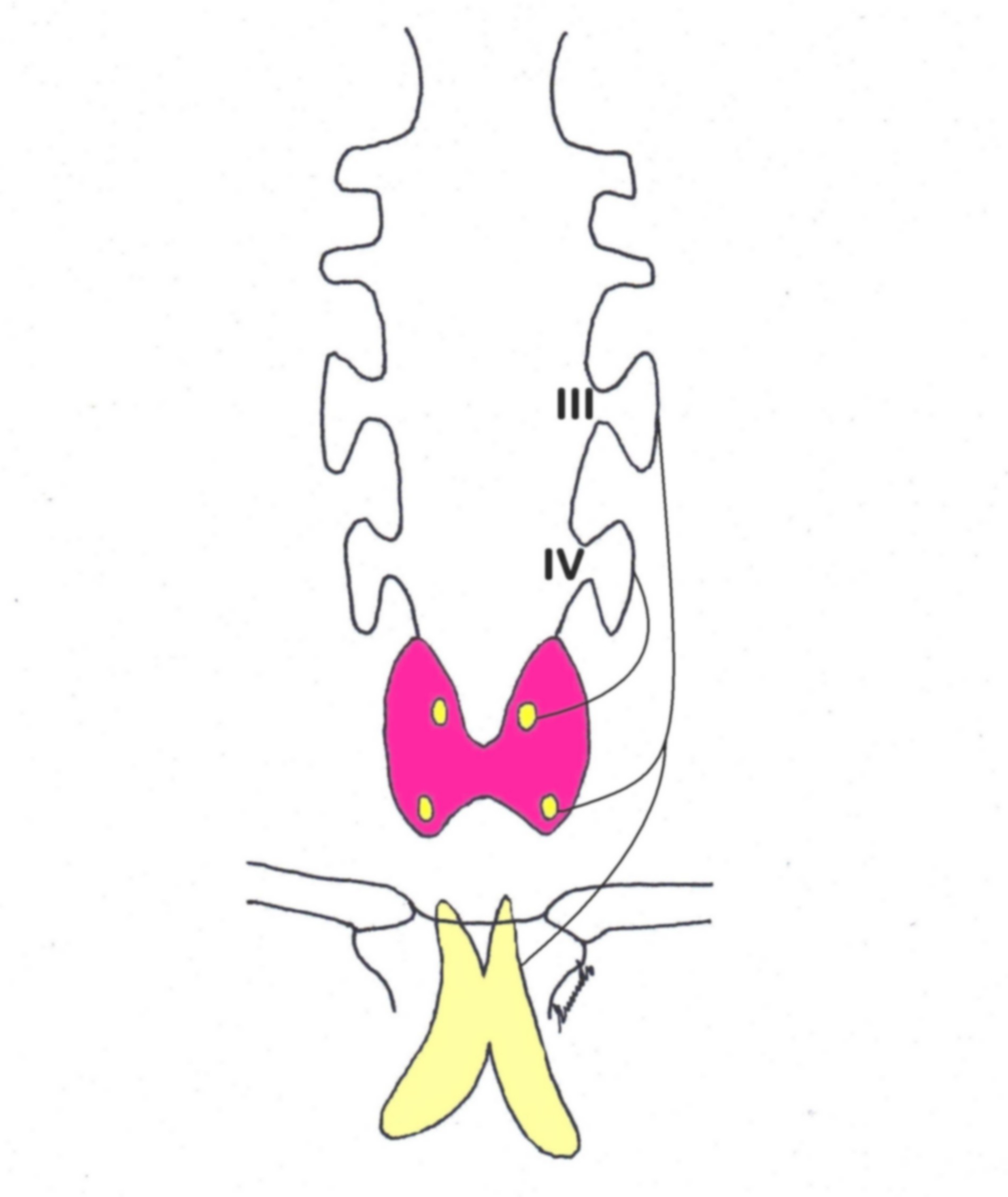
Figura E. Embriologia
Il percorso di migrazione più lungo delle paratiroidi inferiori rende conto della loro sede d'impianto più variabile.
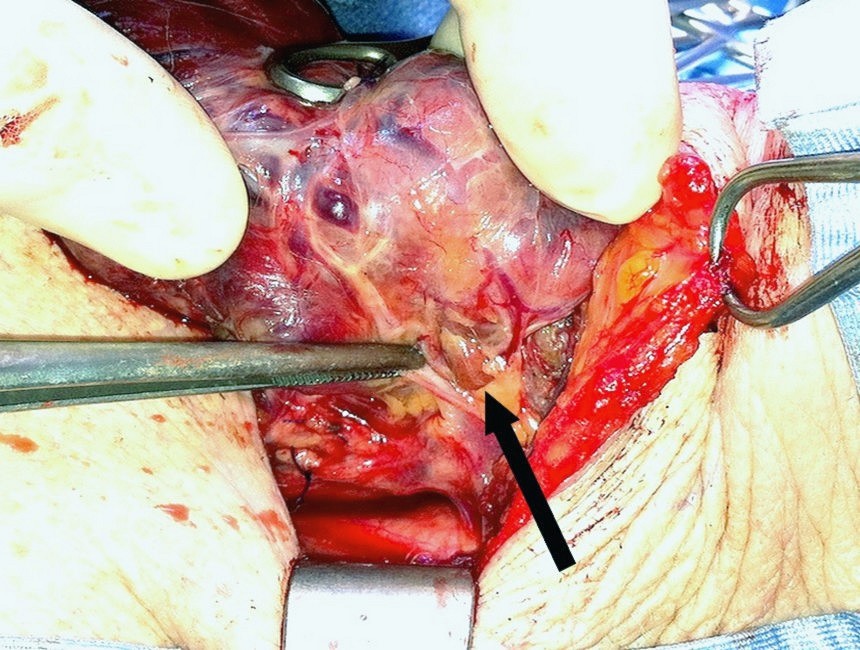
Figura F. Sede della paratiroide superiore
La paratiroide superiore sinistra normale nella sua sede tipica
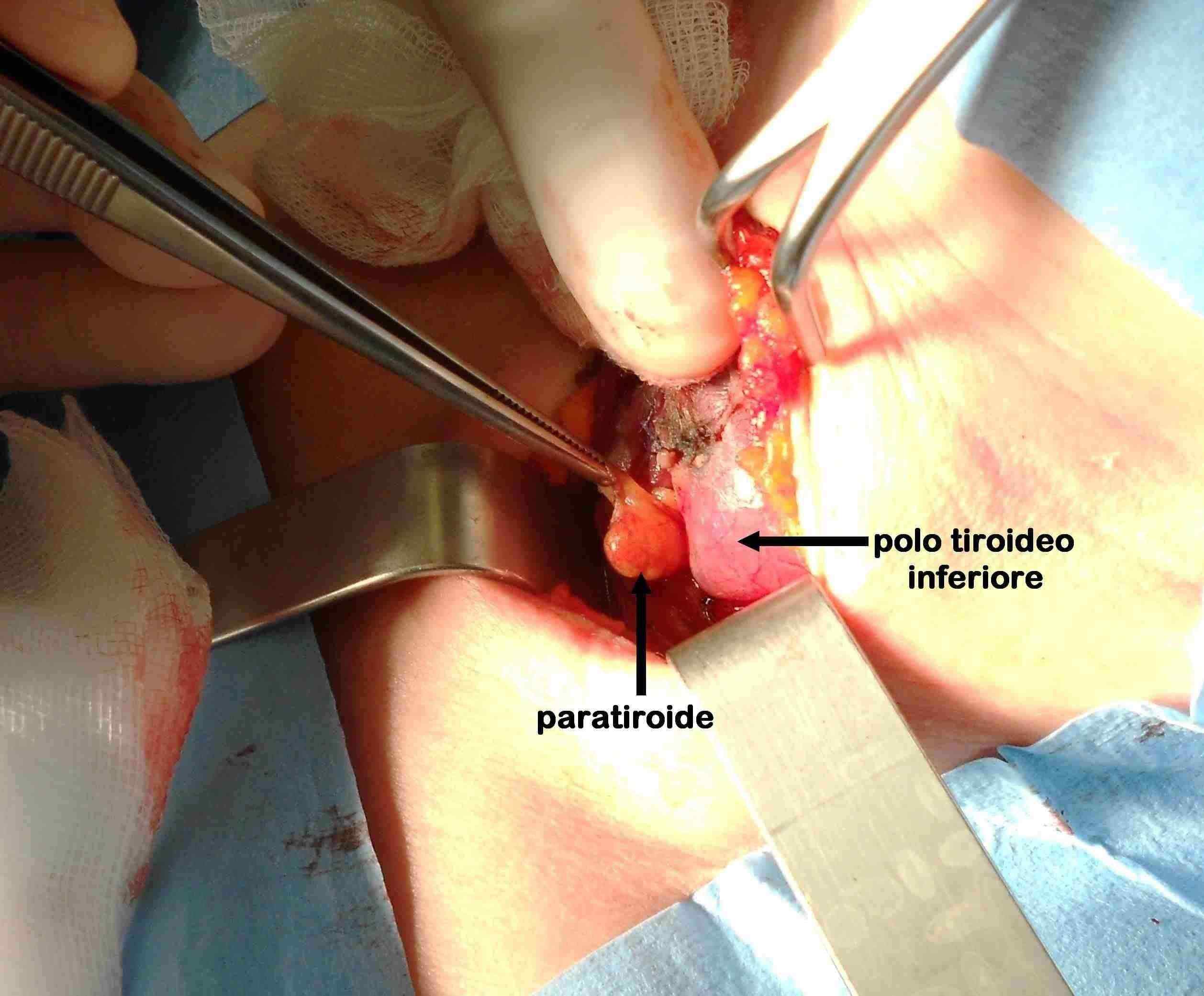
Figura G. Sede della paratiroide inferiore
La paratiroide inferiore sinistra normale subito al di sotto del polo tiroideo inferiore.
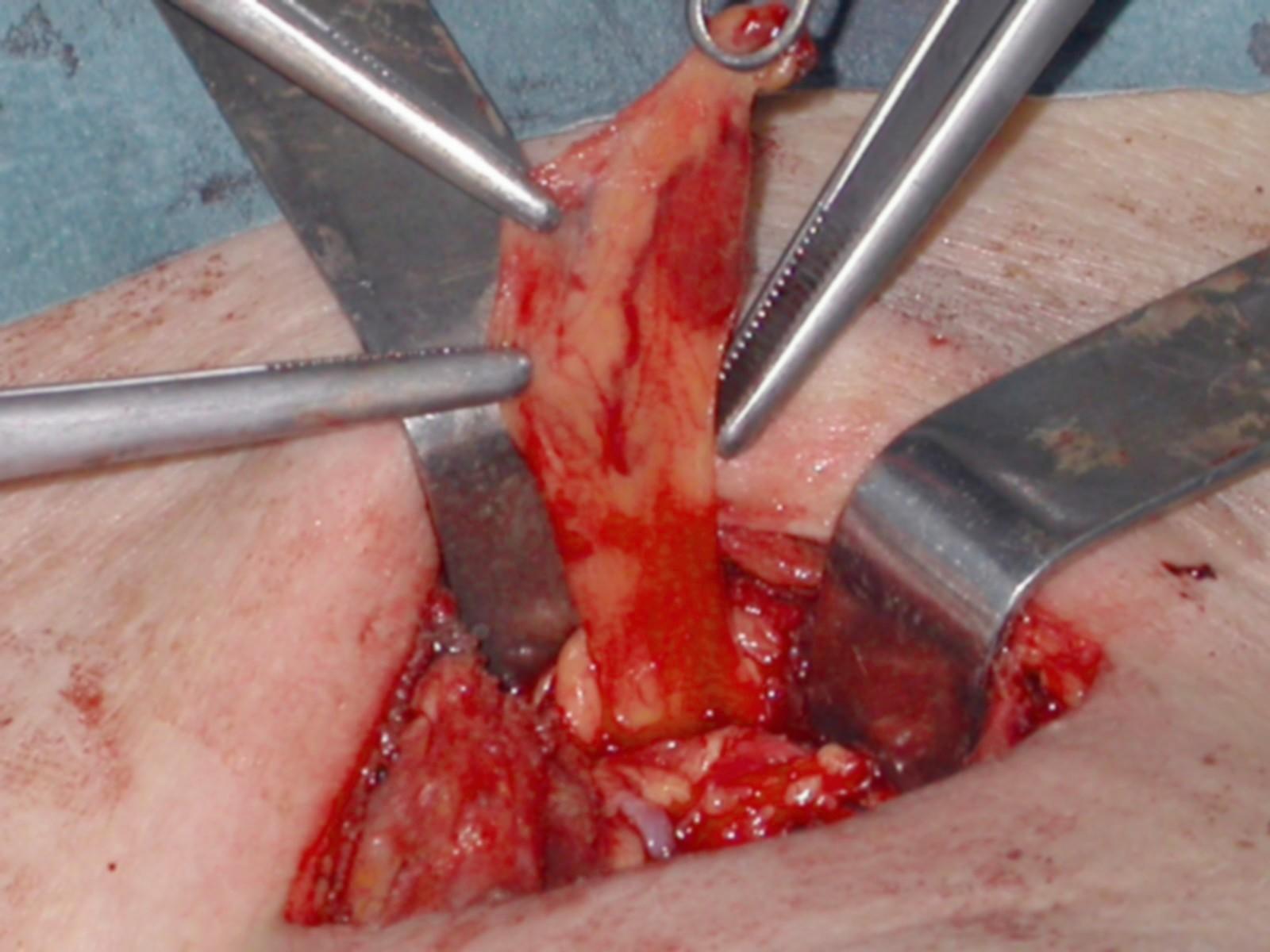
Figura H. Piccolo adenoma paratiroideo ectopico intra-timico
Il corno timico superiore è stato mobilizzato ed attratto fuori dal mediastino. Al suo interno traspare, per il colore più scuro, un piccolo adenoma accompagnato dal vaso nutritizio.
Le paratiroidi sono costituite da due tipi di cellule parenchimali[5][foto I]:
- cellule principali, di piccole dimensioni, sono in numero predominante e secernono il PTH,
- cellule ossifile, di dimensioni maggiori, sono ricche di mitocondri e hanno significato biologico incerto.
Le cellule chiare, considerate una variante delle principali, sono presenti normalmente nell’infanzia.
All’interno delle paratiroidi sono contenute anche cellule adipose in quantità inversamente proporzionale all’attività secretoria ghiandolare.
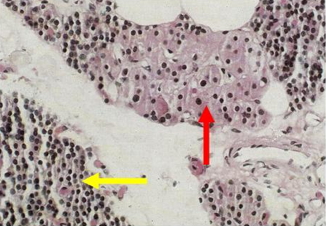
Figura I. Istologia della paratiroide normale
La freccia gialla indica le cellule principali e la freccia rossa quelle ossifile. Queste ultime sono più grandi per il loro abbondante citoplasma ricco di mitocondri.
Anatomia patologica
L’iperparatiroidismo primitivo può essere dovuto a
- adenoma (circa 85% dei casi, fra i quali multiplo nel 2-5%),
- iperplasia (circa 15% dei casi),
- carcinoma (< 1% dei casi).
Negli ultimi anni alcuni autori hanno riportato una maggiore incidenza dell’adenoma singolo (90%) e minore dell’iperplasia (6%) [6].
L’iperparatiroidismo secondario è invece sostenuto sempre dall’iperplasia.
L’adenoma è in genere di forma nodulare, capsulato, di dimensioni variabili [foto L, foto M]]. Il colore è più scuro rispetto alla ghiandola normale, di solito compreso tra il bruno-rossastro ed il rosso-vinoso. Esso è riccamente costituito da cellule principali, più raramente ossifile o chiare, con scarsa o minima presenza di cellule adipose. Talvolta in periferia è presente un orletto più chiaro costituito da tessuto paratiroideo normale compresso dalla neoplasia. Esso risulta determinante per porre la diagnosi differenziale con l’iperplasia, specialmente all’esame istologico estemporaneo. Quest’ultimo può incontrare notevole difficoltà nel distinguere tra natura paratiroidea e tiroidea di un nodo con estesa proliferazione di cellule ossifile.
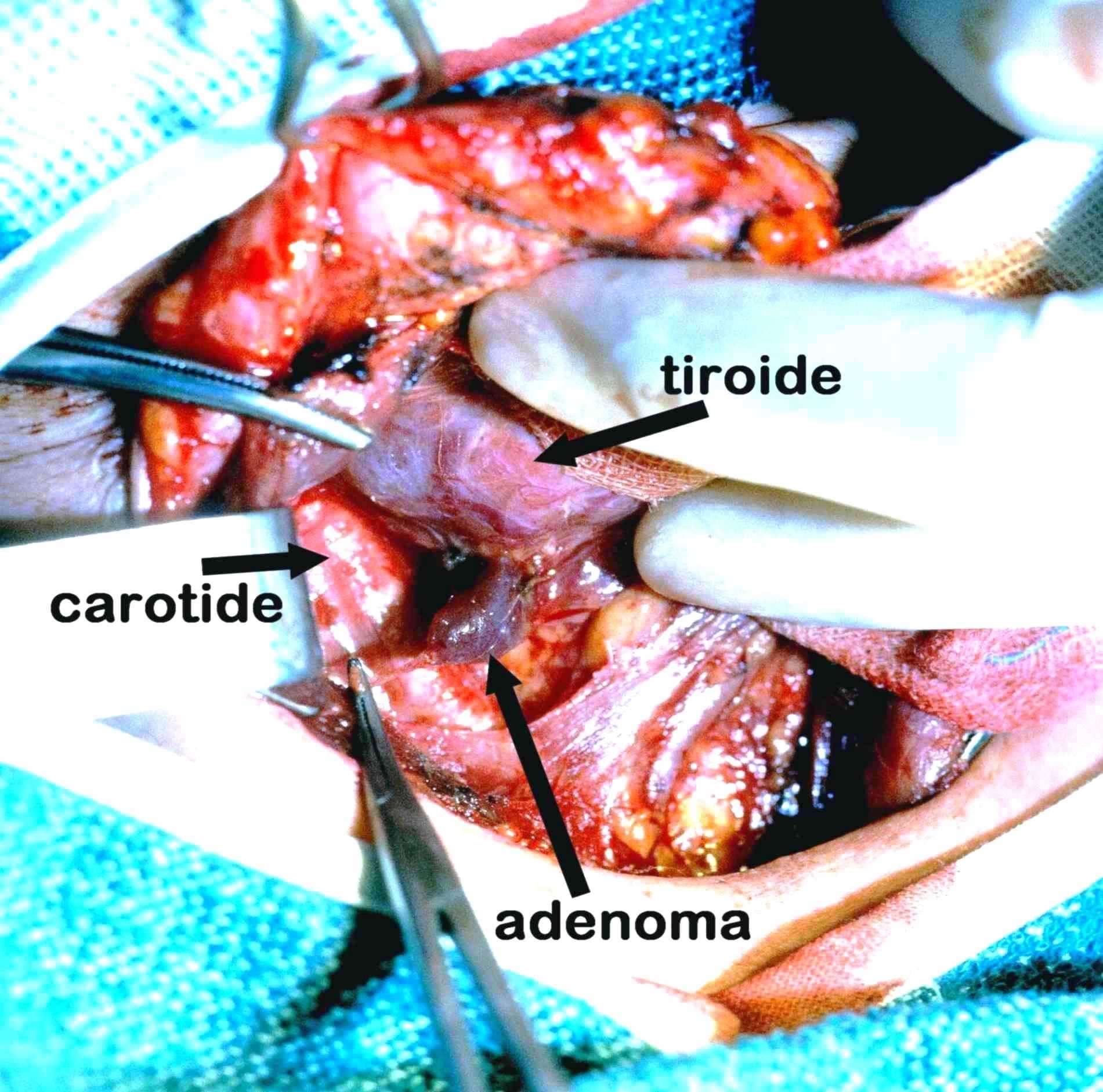
Foto L. Piccolo adenoma paratiroideo
L'adenoma di 12 mm, di colore rosso scuro, è adeso al lobo tiroideo.
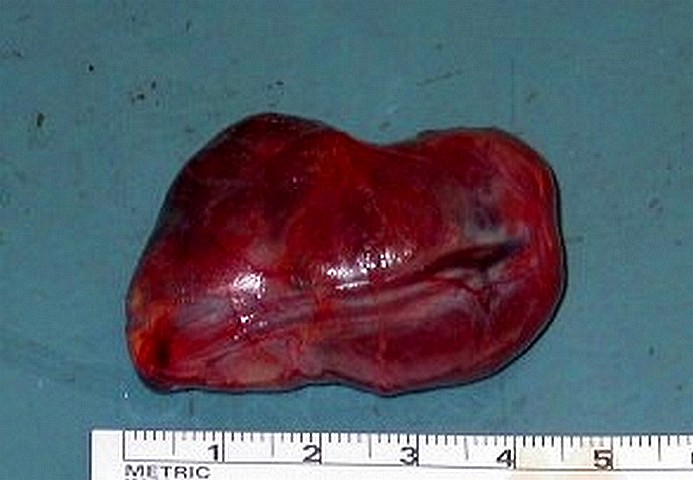
Foto M. Grosso adenoma paratiroideo
Nonostante le cospicue dimensioni la neoplasia ha caratteristiche macroscopiche di benignità, confermata dall'esame istologico.
L’iperplasia interessa tutte le ghiandole che, per il differente grado di coinvolgimento, raramente hanno la stessa dimensione, potendo una apparire di volume anche molto superiore alle altre. La proliferazione cellulare può essere di tipo diffuso o nodulare. Non è possibile distinguere istologicamente tra iperplasia primitiva e secondaria. La diagnosi differenziale intra-operatoria (macroscopica ed istologica estemporanea) tra iperplasia ed adenoma è in genere poco affidabile con l’esame di una sola ghiandola, a meno del riscontro dell’orletto di tessuto normale (vedi sopra). Tuttavia l’esame di un’altra paratiroide permette di differenziare la malattia multi-ghiandolare da quella uni-ghiandolare.
Il carcinoma ha il più delle volte grosse dimensioni, consistenza dura, ed è aderente alle strutture contigue. Le caratteristiche macroscopiche, la presenza di atipie cellulari, l’elevata attività mitotica non costituiscono criteri di certezza per la diagnosi differenziale tra carcinoma e adenoma. Sono invece criteri di certezza l’invasione dei vasi, della capsula, dei tessuti circostanti e la presenza di metastasi a distanza, in assenza dei quali si preferisce porre diagnosi di adenoma atipico[7].
Bibliografia
- Wang C. The anatomic basis of parathyroid surgery. Ann Surg 1976, 183: 271-5.
- Akerström G, Malmaeus J, Bergström R. Surgical anatomy of human parathyroid glands. Surgery 1984, 95: 14-21.
- Testut L, Jacob O. Trattato di anatomia topografica. Unione Tipografico-Editrice Torinese 1974, vol II: 84-7.
- Yeo H, Uranga P, Roman S. Conventional surgical management of primary hyperparathyroidism. In Oertli D, Udelsman R. Surgery of the thyroid and parathyroid glands. Berlin: Springer-Verlag, 2007: 261-7.
- Lewis PD. Surgical Pathology of the parathyroids in primary and secondary hyperparathyroidism. In Lynn J, Bloom SR. Surgical Endocrinology. Butterworth-Heinemann Ltd, Oxford, 1993: 370-9.
- Ruda Jm, Hollenbeak CS, Stack BC. A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003. Otolaryngol Head Neck Surg 2005, 132: 359-72.
- Adam MA, Untch BR, Olson JA. Parathyroid carcinoma: current understanding and new insights into gene expression and intraoperative parathyroid hormone kinetics. The Oncologist 2010, 15: 61-72.